Introducción
Los arrecifes de coral constituyen uno de los ecosistemas de mayor diversidad biológica y económicamente más valiosos en el planeta y, si bien son de importancia crítica para las sociedades humanas, se encuentran entre los más amenazados (Chen et al., 2015; Hoegh-Guldberg, 2010). Estos ecosistemas se ven afectados por múltiples agentes como el aumento de nutrientes, incluso eutrofización, y de sedimentos hacia la zona costera (que causan la disminución de la calidad del agua), el desarrollo humano no planificado (construcción de marinas y puertos comerciales), la sobreexplotación de recursos marinos y la pesca destructiva (Ban et al., 2014). La degradación de los arrecifes de coral es tal que se estima que un tercio de los corales escleractinios que en ellos habitan, están en riesgo de extinción (Carpenter et al., 2008).
A nivel global, estos delicados sistemas también enfrentan los efectos del cambio climático (Pandolfi, 2015). El aumento de la temperatura del océano es una de las principales causas de eventos masivos de blanqueamiento que se manifiestan mediante la expulsión de las zooxantelas simbiontes y la eventual muerte del hospedero (Hughes et al., 2018). Además, el exceso de dióxido de carbono en la atmósfera y su incorporación al océano ha disminuido el pH del agua y el valor de omega de aragonita, que es un indicador de capacidad de calcificación en organismos carbonatados (Jokiel, 2015), lo cual a su vez afecta el crecimiento de los corales, al disminuir su capacidad de depositar los esqueletos de carbonato de calcio (Comeau et al., 2014). Estos fenómenos pueden originar graves consecuencias ecológicas, incluyendo pérdida de biodiversidad y cambios en la composición de las comunidades asociadas (Baker et al., 2008), además de causar pérdidas económicas al dañar la provisión de servicios ecosistémicos que abarcan la producción de materias primas, la protección costera, el mantenimiento de la pesca, turismo, recreación, educación e investigación (Chen et al., 2015).
Los arrecifes coralinos en el Pacífico oriental tropical (POT) son reconocidos como los más periféricos y aislados a escala global debido a que están separados por más de 6,000 km de las comunidades geográficamente más cercanas, situadas en las islas del Pacífico central (Baums et al., 2012; Combosch y Vollmer, 2011). En el POT las condiciones para el desarrollo arrecifal son muy limitantes debido a las amplias fluctuaciones estacionales de temperatura, altas concentraciones naturales de nutrientes y valores de pH naturalmente bajos (Fiedler y Lavín, 2017; Manzello et al., 2008); como resultado, los arrecifes son pequeños, estructuralmente simples y constituidos por pocas especies. Dichos sistemas están dominados por corales del género Pocillopora (Pinzón et al., 2012), del cual existen 9 especies en el POT: P. capitata, P. damicornis, P. effusus, P. elegans, P. eydouxi, P. inflata, P. meandrina, P. verrucosa y P. woodjonesi. La distribución del género Pocillopora abarca desde el centro del golfo de California, México hasta la costa de Ecuador, incluyendo todas las islas oceánicas adyacentes (LaJeunesse et al., 2008). Dos de estas especies, P. effusus y P. inflata son endémicas del POT, mientras que el resto son taxones provenientes del Indo-Pacífico (Glynn, Alvarado et al., 2017).
Los pocilopóridos representan un componente clave de las comunidades coralinas en la costa occidental de las Américas; suministran hábitat, refugio y son fuentes de nutrición para múltiples invertebrados y peces (Cortés et al., 2017), además de que aportan gran cantidad de carbonato de calcio que constituye el grueso de la estructura física arrecifal en la región (Carballo et al., 2008). Estos corales son ramificados, lo que lleva a que tengan una tasa de recuperación relativamente rápida en relación con otros géneros de la costa occidental del continente americano (Comeau et al., 2014; Darling et al., 2012), y que en el caso de estar sujetos a perturbaciones fuertes o frecuentes como huracanes y eventos de oscilación sureña de El Niño, son capaces de recuperar su función ecosistémica en relativamente corto plazo (Glynn, Alvarado et al., 2017; Glynn, Mones et al., 2017).
Dada la relevancia ecosistémica de los corales del género Pocillopora en el POT, es importante incrementar nuestra capacidad predictiva acerca de las consecuencias potenciales del cambio climático en la región. Una forma de lograr esto, es mediante la aplicación de modelos de nicho ecológico (MNE) y distribución potencial (MDP) (Gormley et al., 2015). Estas herramientas han sido ampliamente utilizadas para precisar las áreas de presencia actual de especies marinas (Freeman et al., 2013; Mikkelsen et al., 2016; Reyes-Bonilla, Martínez-Torres et al., 2013) y para plantear de forma hipotética cuáles zonas podrían ser ocupadas o donde podría haber extinciones locales, si las condiciones ambientales cambian en el futuro (Freeman, 2015; Freeman et al., 2013).
El propósito de este estudio fue evaluar los cambios potenciales en la distribución geográfica de los corales del género Pocillopora dentro del POT como consecuencia del cambio climático global. Para ello se modeló la distribución actual de las 9 especies de coral pertenecientes al género Pocillopora en la región y se evaluaron los posibles cambios en la distribución de estos taxones bajo 3 escenarios RCP de cambio climático y elevación de temperatura para el año 2050. Estos escenarios representan diferentes trayectorias de concentración de gases de efecto invernadero presentadas en el 5° Informe de Evaluación del Panel Intergubernamental sobre Cambio Climático (IPCC, por sus siglas en inglés) en 2013 (Church et al., 2013) y constituyen las mejores predicciones de los cambios futuros en las características físicas y biogeoquímicas del océano (Bopp et al., 2013). Se buscó determinar cuáles pueden ser las especies más vulnerables a las nuevas condiciones con base en el grado de modificación de su distribución geográfica y de cambios potenciales en la riqueza a nivel de género.
Materiales y métodos
Los datos georeferenciados de presencia de las 9 especies de Pocillopora presentes en el POT fueron tomados de las bases de datos OBIS (Ocean Biogeographic Information System, http://www.iobis.org) y GBIF (Global Biodiversity Information Facility, http://www.gbif.org), y complementados con registros disponibles en la literatura científica (Glynn y Ault, 2000; LaJeunesse et al., 2007; López-Pérez et al., 2012; Reyes-Bonilla et al., 2005, 2013). Para evitar la autocorrelación espacial, los puntos de presencias repetidas fueron eliminados antes del procesamiento (Veloz, 2009) y se determinó una distancia mínima de 9 km entre presencias para evitar aglomeramiento de datos y sesgo en los modelos (Shcheglovitova y Anderson, 2013).
Las variables ambientales utilizadas en nuestro análisis se enumeran en la tabla 1, las cuales incluyen aquellas consideradas importantes en la determinación de la distribución de los corales arrecifales (Kleypas et al., 1999). Para la totalidad del POT (coordenadas extremas: 35.3° N, 4.3° S, 116.6° O, 77.6° E), se obtuvieron los valores mínimos, máximos y promedio mensual en superficie de la temperatura (TSM; C°), salinidad, (UPS) y concentración de fosfatos (μmol/l) y silicatos (μmol/l), del Atlas Mundial de los Océanos (World Ocean Atlas 2013, WOA 13; https://www.nodc.noaa.gov/OC5/woa13/), mientras que los de radiación fotosintéticamente activa (Einstein/m2/día) y del coeficiente de atenuación de la luz (1/m) se tomaron de NASA-Giovanni (https://giovanni.gsfc.nasa.gov/giovanni/). Estos fueron complementados con información sobre la profundidad (m) proveniente de la Carta Batimétrica General de los Océanos (General Bathymetric Chart of the Oceans; GEBCO, https://www.gebco.net/) y de los tipos de sustrato costero (rocoso o arenoso), tomados de una base de datos del Laboratorio de Sistemas Arrecifales de la Universidad Autónoma de Baja California Sur. Los datos satelitales y de tipo de fondo se tomaron en su escala original (pixeles de 9 km por lado) y las demás variables se interpolaron a la misma resolución utilizando el método de la distancia inversa ponderada en el programa ArGIS 10.3 (ESRI, Redmond, CA). Adicionalmente, la alcalinidad se estimó para cada pixel como una función de la salinidad y la TSM con las ecuaciones de Lee et al. (2006), y el pH y el valor de Ω aragonita se calcularon utilizando el programa CO2SYS (Lewis y Wallace, 1998) a partir de los datos de salinidad, silicatos, fosfatos, TSM, y promedio de la concentración de CO2 atmosférico de los años 2013 a 2017 (403.63 ppm), según los datos de la Red Mundial de Referencia de Gases de Efecto Invernadero (http://www.esrl.noaa.gov/gmd/ccgg/trends).
Tabla 1 Variables utilizadas para realizar los modelos de distribución potencial y para la caracterización de la distribución geográfica.
| Variable oceanográfica | Unidad de medida | Fuente | ||
| Modelación de distribución potencial | Temperatura superficial del mar | °C | WOA 13 | |
| Alcalinidad | μmol/kg | Lee et al., 2006 | ||
| pH | adimensional | CO2SyS | ||
| Ω aragonita | adimensional | CO2SyS | ||
| Caracterización de la distribución geográfica | Salinidad | UPS | WOA 13 | |
| Fosfatos | μmol/l | WOA 13 | ||
| Silicatos | μmol/l | WOA 13 | ||
| Radiación fotosintéticamente activa | Einstein/m2/día | Giovanni-NASA | ||
| Atenuación de la luz | 1/m | Giovanni-NASA | ||
| Batimetría | m | GEBCO | ||
| Tipologia de fondo marino | adimensional | Laboratorio de Sistemas Arrecifales (Universidad Autónoma de Baja California Sur) |
Para evitar la sobreparametrización de los modelos, se eliminó la información climática redundante realizando una prueba de correlación de Pearson usando el lenguaje estadístico R (R Development Core Team, 2018). Con base en las consideraciones de Carlos-Junior et al. (2015) se utilizó como umbral el valor de r > 0.85. Luego de esta depuración, se tomaron en cuenta para la modelación solamente los valores mínimos y máximos de alcalinidad, pH y Ω aragonita, y los valores mínimos, máximos y promedio de TSM.
Variables ambientales para modelar la distribución potencial futura de las especies. Las 3 trayectorias RCP que se utilizaron, se identifican por su forzamiento radiativo (calentamiento de la atmósfera) y consideran los efectos de las políticas orientadas a mitigar el cambio climático y las emisiones de contaminantes del aire y de gases de invernadero en el siglo XXI (van Vuuren et al., 2011). Éstas comprenden un escenario con fuertes reducciones en las emisiones de gases de efecto invernadero (RCP 2.6), un escenario de estabilización (RCP 4.5) y un escenario con un crecimiento agresivo de las emisiones y sin estabilización (RCP 8.5).
Para generar los modelos de distribución potencial futura de las especies del género Pocillopora para el año 2050, se utilizaron las proyecciones regionalizadas de TSM, bajo los escenarios RCP 2.6, 4.5 y 8.5 generadas originalmente por Morzaria-Luna (2016). Las proyecciones regionalizadas fueron estimadas por escalamiento empírico de la TSM proyectada por los modelos globales de circulación en alta resolución que son representaciones a gran escala de los procesos terrestres, oceánicos y atmosféricos (Wilby y Dessai, 2010). Estas proyecciones globales necesitan ser regionalizadas porque son demasiado gruesas para capturar procesos regionales y locales e incluyen un sesgo relativo al clima observado (Ekström et al., 2015). Este método, basado en el aplicado por Mora et al. (2013) involucra agregar la anomalía, la diferencia entre un promedio a largo plazo histórico (1976-2005) y futuro (2020-2050) a partir de simulaciones de modelos globales bajo escenarios RCP al promedio observado derivado de datos observados de la TSM (AVHRR, Advanced Very High Resolution Radiometer; Pathfinder Version 5.2). Las proyecciones futuras se tomaron de 6 modelos globales de circulación en alta resolución (CNRM-CM5, MPI-ESM-MR, HadGEM2-ES, EC-EARTH, MRI-CGCM3, NorESM1-M) que forman parte del 5° reporte del Proyecto de Comparación de Modelos Acoplados Fase 5 (CMIP5).
Con base en la TSM esperada y en la concentración de CO2 atmosférico estimada para el año 2050 (421, 538 y 936 ppm, respectivamente para los RCP 2.6, 4.5 y 8.5; Hoegh-Guldberg et al., 2014), se generaron los valores a futuro de las variables pH, alcalinidad y Ω aragonita con el programa CO2SYS, bajo la hipótesis que la concentración de nutrientes y salinidad serán estables para el año 2050. Esta suposición fue necesaria ya que los valores de nutrientes no pueden ser modelados con un nivel de precisión confiable en el futuro, ya que se carece de información a pequeña escala sobre los niveles de aporte y reciclamiento en condiciones de elevación térmica y cambios en patrones de viento (Freeman, 2013).
Para la elaboración de los modelos de distribución potencial actual y futura de las especies pertenecientes al género Pocillopora del POT, se utilizó el programa Maxent versión 3.3.3k (http://www.cs.princeton.edu/~schapire/ Maxent/; Phillips et al., 2004) que ha sido aplicado con éxito en múltiples estudios sobre corales de aguas someras (Couce et al., 2012; Freeman, 2015; Freeman et al., 2013). Maxent es un algoritmo probabilístico que utiliza un conjunto de variables ambientales y datos de presencia de las especies de interés, para estimar la probabilidad de presencia de un taxón en una región no muestreada basándose en el principio de la máxima entropía (Phillips et al., 2004). La probabilidad es interpretada como un valor de idoneidad que representa las condiciones ambientales que potencialmente favorecen la presencia de las especies (Merow et al., 2013).
Para mejorar el rendimiento de los modelos de distribución de cada especie se hicieron ajustes particulares dependiendo del número de registros georeferenciados disponibles. Para ésto se utilizó el paquete ENMeval (versión 3.2.1; Muscarella et al., 2014) en el programa estadístico R (R Development Core Team, 2018). Este paquete tiene como objetivo encontrar los parámetros que generen los modelos con mejor rendimiento con la menor complejidad posible, lo cual ha demostrado ser útil para realizar proyecciones en el tiempo (Merow et al., 2013). Durante el proceso de selección se utilizaron 2 métodos de partición de datos de presencia: el método de división al azar de k grupos, para las especies que presentaban más de 20 registros y el “n-1 jackknife” para aquellas con menos de 20 registros (Pearson et al., 2007; Radosavljevic y Anderson, 2014). En todos los casos se usó una configuración con una combinación de 8 parámetros de regularización (“regularization multipliers”: RM 0.5, 1, 1.5, 2, 2.5, 3, 3.5, 4) y con 5 clases características (“feature classes”: FC lineal, cuadrático, producto, umbral y bisagra). Por cada especie fue seleccionada la combinación de parámetros y clases que resultaban en el menor valor de tasa de omisión, y la diferencia del criterio de información de Akaike (ΔAICc) más cercano a cero (Warren y Seifert, 2011).
Tomando en cuenta la combinación de parámetros RM y FC, para cada una de las especies con más de 20 registros se realizó una validación cruzada, en donde se generaron 10 réplicas de los modelos. Esto consiste en dividir el número total de presencias de una especie, en 10 subconjuntos (k). Los modelos son calibrados con k-1 de los subconjuntos y validados con el subconjunto que no fue utilizado en la calibración, este procedimiento se repite 10 veces (Gormley et al., 2015; Warren y Seifert, 2011). Las validaciones cruzadas permiten detectar la variación resultante de la partición de los datos (Elith et al., 2011). En el caso de las especies con menos de 20 registros se generaron modelos con tantas réplicas como el número de datos de presencia de la especie (Rengstorf et al., 2013). A través de la validación cruzada, Maxent registra la curva de respuesta y las predicciones ajustadas para cada uno de los subconjuntos de calibración utilizados y los usa para dar una indicación de la variabilidad en los resultados (Merow et al., 2013).
El rendimiento de los modelos fue medido a través del área bajo la curva ROC (Receiver Operating Characteristic). El área bajo la curva (AUC, por sus siglas en inglés) ROC es un estadístico de prueba ampliamente utilizado que mide la capacidad que tiene el modelo de discriminar las presencias del resto del entorno disponible para la especie (Gormley et al., 2013). Un AUC de 0.5 indica que el rendimiento del modelo es igual a la de una predicción aleatoria (Elith, 2000). Modelos con AUC por encima de 0.75 se consideran potencialmente útiles, 0.80-0.90 buenos y 0.90-1.0 excelentes (Elith, 2000). Solo los modelos con AUC > 0.75 fueron transferidos a los escenarios futuros RCP 2.6, 4.5 y 8.5 para el año 2050. El valor de AUC se reporta como el valor promedio de las réplicas de cada especie (Merow et al., 2013; Phillips et al., 2006). El formato de salida de los modelos fue el logístico (Phillips y Dudík, 2008) y la importancia de las variables ambientales predictoras fue evaluada a partir del promedio del porcentaje de contribución al modelo final de cada una para todas las especies (Kalle et al., 2013; Lecours et al., 2016).
Para cada especie, las réplicas de los modelos con buen rendimiento fueron promediadas para obtener un solo mapa de probabilidad por especie. Ésto se realizó a través de calculadora de raster en ArcMap versión 10.3. La probabilidad de presencia se reclasificó utilizando como valor de corte del umbral de presencia del décimo percentil para producir un mapa binario con áreas de presencia y ausencia para el tiempo presente y bajo los diferentes escenarios al futuro (Radosavljevic y Anderson, 2014). Este nivel de corte supone que 10% de los datos de presencia pueden ocurrir en áreas donde la especie está ausente debido a errores de posicionamiento o falta de resolución en los datos ambientales y, como tal, clasifica como 0 (ausente) los valores de idoneidad por debajo de 10% de los registros. Esto es pertinente con los puntos de presencia de las especies de corales presentados en este estudio ya que se tomaron de bases de datos que pueden contener diferentes grados de precisión espacial (Davies y Guinotte, 2011; Pearson et al., 2007).
Para depurar el posicionamiento espacial del modelo para cada especie, fueron evidenciados, desde las capas de salinidad, fosfatos, nitratos, radiación fotosintéticamente activa y atenuación de la luz, los pixeles con valores máximos y mínimos asociados a los puntos de presencia, para obtener el rango de valores de estas variables ambientales asociados con los pocilopóridos presentes. Además, se utilizó la capa de batimetría para tomar como válidos solo los pixeles con un valor comprendido entre 0 m y -40 m, que corresponde a la profundidad máxima para el desarrollo de arrecifes coralinos de aguas someras (Kleypas et al., 1999). Finalmente, desde la capa de tipología de fondo marino se seleccionaron solo los pixeles correspondientes a la presencia de sustrato rocoso adecuado para el asentamiento de las especies de Pocillopora (Dambach y Rödder, 2011).
Para estimar la vulnerabilidad de las especies, se calculó la diferencia entre el número de pixeles ocupados en la distribución actual y futura en cada escenario utilizando el paquete “caja de herramienta de los modelos de distribución de especies” (SDM toolbox; Brown, 2014) de ArcGIS. Además, se identificaron todos los pixeles donde potencialmente se encuentra la especie en la actualidad y los que mantendrá en el futuro (área conservada), y también aquellas donde no se encontró en la actualidad pero sí en el futuro (área ganada) y donde la especie estaba presente en la actualidad pero ausente en el futuro (área perdida).
Finalmente, se elaboraron mapas de riqueza total para la actualidad y en la condiciones futuras a partir de la sumatoria de los rasters de presencia y ausencia de cada especie, y se cuantificaron y mapearon los cambios en la cifra de riqueza con la finalidad de evaluar la pérdida y ganancia de especies en la región de estudio.
Resultados
La distribución potencial actual de las especies mostró congruencia con la distribución conocida (fig. 1). Los modelos predictivos tuvieron un buen ajuste tanto para los datos de calibración como para los de validación, de acuerdo con los valores de AUC que oscilaron entre 0.800 y 0.995 (tabla 2), no obstante presentaron pequeños problemas, por ejemplo en el caso de Pocillopora damicornis al predecir altas probabilidades de presencia en la porción norte del Golfo de California (donde no se distribuye; fig. 1B), y ausencia en zonas que cuentan con registros de campo como el archipiélago de Revillagigedo (18°49’ N, 112°45’ O; fig. 1B) y las islas Galápagos (0°40’ S; 90°33’ O, fig. 1B).
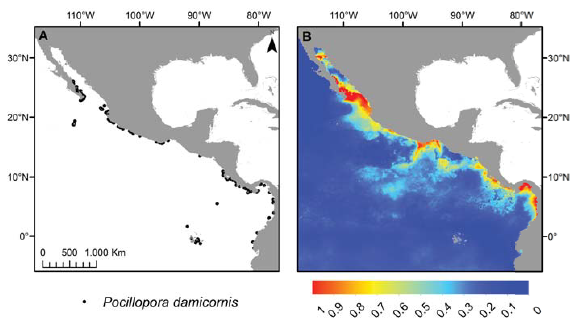
Figura 1 Comparación entre la distribución de P. damicornis de acuerdo con los registros georeferenciados (A) y la distribución potencial predicha por Maxent (B).
Tabla 2 Valores de AUC de los puntos de calibración y validación.
| Especies | Calibración | Validación |
| P. capitata | 0.911 | 0.896 |
| P. damicornis | 0.952 | 0.932 |
| P. effusus | 0.995 | 0.985 |
| P. elegans | 0.845 | 0.835 |
| P. eydouxi | 0.814 | 0.800 |
| P. inflata | 0.917 | 0.904 |
| P. meandrina | 0.887 | 0.873 |
| P. verrucosa | 0.941 | 0.922 |
| P. woodjonesi | 0.923 | 0.907 |
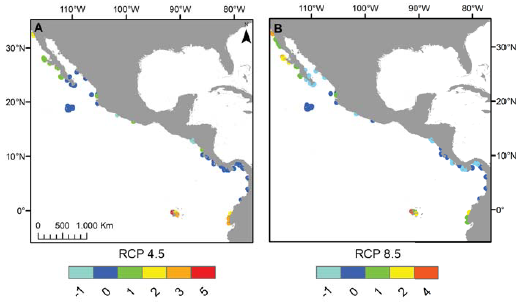
Al evaluar el promedio de contribución individual de las variables ambientales en los modelos para las 9 especies de Pocillopora del POT (fig. 2), la TSM máxima fue la que apareció con mayor frecuencia (porcentaje de contribución del 29%, seguida por la Ω aragonita máxima (14%) y el pH mínimo (13%).
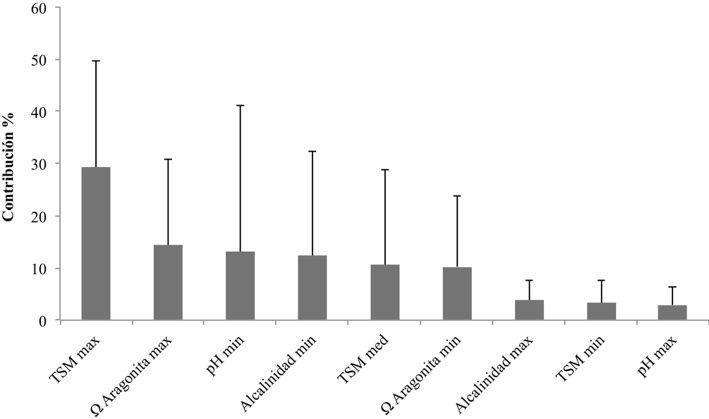
Figura 2 Promedio y desviación típica del porcentaje de contribución de las variables predictoras en los modelos de distribución potencial de las 9 especies de Pocillopora del POT.
En relación con la distribución potencial para el año 2050 en los distintos escenarios RCP, la tendencia de las especies de Pocillopora en el POT mostró diferencias. En el caso del escenario RCP 2.6, se observó que las especies mantendrían su área de distribución sin variación. Por el contrario, la tendencia de las especies en los escenarios RCP 4.5 y 8.5 fue hacia el aumento en el área favorable para el desarrollo de 6 especies, mientras que sólo para 2 de ellas los modelos mostraron una reducción de su área de distribución inicial (tabla 3). La especie que mostró el mayor incremento en el área con las condiciones óptimas fue Pocillopora meandrina en los escenarios RCP 4.5 y 8.5 (respectivamente 27.6% y 34.7% de pixeles de área ganada, fig. 3A-C) seguida por P. eydouxi en el escenario RCP 8.5 (19.6%) y P. elegans en los escenarios RCP 4.5 y 8.5 (16%) (tabla 3). Por el contrario, la especie que perdió área en el horizonte 2050 fue Pocillopora verrucosa en los escenarios RCP 4.5 y 8.5 (pérdida de pixeles del 8.2% y 55.1%, respectivamente; fig. 3B-D). Solamente 1 especie sufrió extinción local según las proyecciones y fue Pocillopora effusus en los escenarios RCP 4.5 y 8.5 (tabla 3).
Tabla 3 Numero de píxeles ocupados por cada especie según los mapas de distribución actual y futura, y el respectivo porcentaje de pérdida o ganancia de área según el escenario.
| Especies | Número de pixeles en la distribución actual |
Número de pixeles en la distribución futura (RCP4.5) |
Porcentaje de pérdida o ganancia (RCP4.5) |
Número de pixeles en la distribución futura (RCP8.5) |
Porcentaje de pérdida o ganancia (RCP8.5) |
| P. capitata | 57 | 65 | 12.3 | 58 | 1.7 |
| P. damicornis | 61 | 71 | 14.0 | 67 | 8.9 |
| P. effusus | 1 | 0 | -100 | 0 | -100 |
| P. elegans | 63 | 75 | 16.0 | 75 | 16.0 |
| P. eydouxi | 53 | 54 | 1.8 | 66 | 19.6 |
| P. inflata | 27 | 31 | 12.9 | 31 | 12.9 |
| P. meandrina | 47 | 65 | 27.6 | 74 | 34.7 |
| P. verrucosa | 49 | 45 | -8.2 | 22 | 55.1 |
| P. woodjonesi | 32 | 32 | 0.0 | 32 | 0.0 |
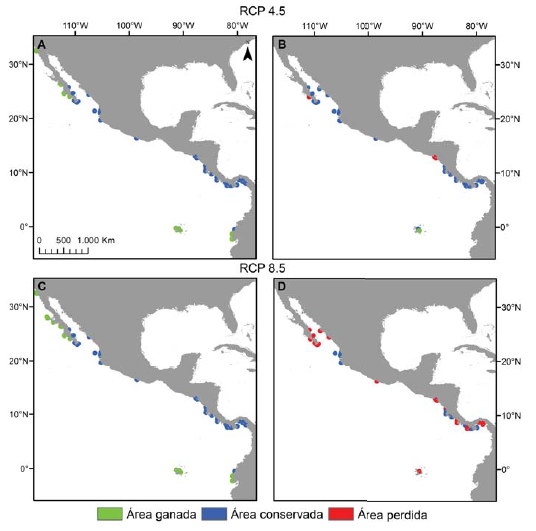
Figura 3 Pérdida y ganancia de área en el escenario RCP 4.5 y 8.5 para P. meandrina (A y C) y P. verrucosa (B y D). Las celdas en azul representan el área conservada por la especie, las celdas en rojo el área perdida y las celdas en verde, el área ganada en relación a la distribución potencial actual.
Los modelos de distribución potencial futura muestran que 3 especies extenderían sus áreas de distribución a latitudes más altas, trasladándose hacia la parte sur del golfo de California (P. inflata) y la costa occidental de la península de Baja California (P. elegans y P. meandrina, fig. 3A-C), mientras que 5 extenderían sus áreas de distribución hacia las costas de Ecuador y el archipiélago de Galápagos (P. capitata, P. damicornis, P. elegans, P. eydouxi, P. meandrina; fig. 3A-C). La proyección de pérdida de sitios con las condiciones favorables es en las costas de Nicaragua, Costa Rica y Panamá, por la desaparición de P. verrucosa (fig. 3B-D) y en el sur de México por P. effusus.
Los mapas elaborados sobre riqueza potencial de especies permiten apreciar que en el POT, la riqueza por sitio en los escenarios RCP 4.5 y 8.5 puede aumentar en comparación con la actual en la costa del Pacífico de la península de Baja California, en la costa de Ecuador y en el archipiélago de Galápagos (fig. 4C, D), mientras que las localidades en donde se aprecia una disminución de la riqueza de especies son el sur del golfo de California (México) y algunas zonas de Costa Rica y Panamá en el escenario RCP 8.5 (fig. 4D) y la costa de El Salvador en ambos escenarios (fig. 4C, D). Finalmente, algunas regiones destacan por su retención de hábitat arrecifal adecuado. Estos incluyen la parte sur del golfo de California, el archipiélago de Revillagigedo y las costas de Costa Rica y Panamá en el escenario RCP 4.5 (figs. 4C, 5A) y las costas de Colombia en ambos escenarios (figs. 4C, D, 5A, B).
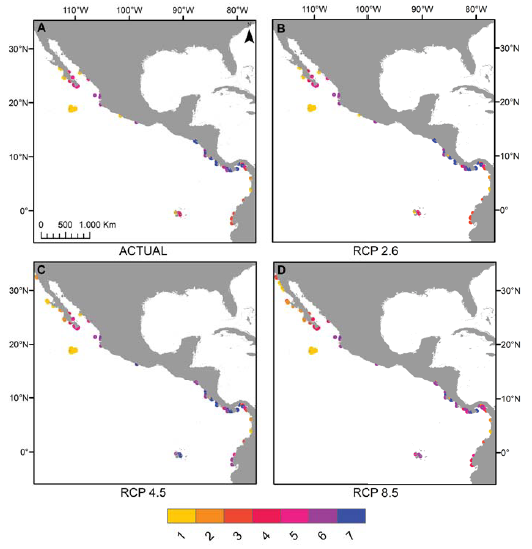
Figura 4 Cambios en la riqueza total de especies en respecto a la actualidad (A) en los escenarios 2.6 (B), 4.5 (C) y 8.5 (D) en su horizonte 2050.
Discusión
El objetivo de este estudio fue modelar la distribución presente y bajo escenarios climáticos futuros de 9 especies de corales del género Pocillopora en el POT. En general, podemos observar un aumento del área de distribución en los escenarios futuros de cambio climático, lo que sugiere que estos organismos presentan atributos de su nicho ecológico que se ven beneficiados por posibles aumentos en la temperatura y acidificación. Se tienen datos de la alta tolerancia térmica de los pocilopóridos debido a su asociación con dinoflagelados simbiontes pertenecientes al clado D, el cual es más resistente al estrés por aguas cálidas (Baker et al., 2017) y, al comparar las costas de Panamá y de las islas Galápagos, se vio que aunque los esqueletos se hacen más frágiles, la mayor acidez del agua en las islas no afecta su presencia en el sitio (Manzello et al., 2008, 2014). Finalmente, dado que en la actualidad las especies de Pocillopora en el POT se desarrollan en condiciones ambientales no óptimas (Kleypas et al., 1999), es posible que la elevación de temperatura se traduzca en la aparición de condiciones más adecuadas para su desarrollo en el futuro. Estos resultados sugieren que a escala regional es posible que la elevación de la temperatura favorezca el desarrollo de los arrecifes de coral, pero que debido a la fragilidad de sus esqueletos, al menos el servicio ambiental de protección costera no sea tan eficiente como en la actualidad (Guinotte et al., 2003; Manzello et al., 2017). En el contexto de la conservación de estos ecosistemas, la identificación de zonas que podrían ser favorables para la presencia de arrecifes a futuro, podría ser útil para considerarlas para la implementación de nuevas áreas marinas protegidas, como la costa occidental de la península de Baja California.
Los resultados indican que los modelos actuales son eficientes ya que el AUC tendió a ser superior a 0.8 (Costa et al., 2015); sin embargo, se pueden observar algunas inconsistencias, por ejemplo, según los modelos la isla Clipperton y los archipiélagos de Revillagigedo y de Galápagos, fueron identificados como sitios actualmente no idóneos para la presencia coralina. Ésto se debe a la poca información de presencias registradas en las zonas, ya que a pesar de que la presencia de varias especies en cada una de esas localidades es bien conocida (Glynn, Alvarado et al., 2017; Ketchum y Reyes-Bonilla, 2001; Reyes-Bonilla, 1999), las zonas cuentan con relativamente pocos registros de presencia georreferenciados (Calderón-Aguilera, 2006). Por otra parte, la temperatura y la Ω aragonita son notablemente más bajas en Galápagos y Revillagigedo respecto a los sitios con mayor concentración de registros, todos colocados en el margen continental, lo que genera un efecto en que los valores de idoneidad son más altos en zonas en que las especies han sido mejor muestreadas. Dado que el algoritmo calcula un valor empírico promedio para cada variable tomando en cuenta únicamente los puntos de ocurrencia y calcula la probabilidad de distribución con base en las restricciones impuestas por dichos promedios, es de esperarse que aquellos sitios con bajos valores de temperatura y Ω aragonita que son representados por un número bajo de puntos se encuentran lejanos a dicho promedio, y por lo tanto el programa tiende a subestimar los valores de la probabilidad de presencia (Shcheglovitova y Anderson, 2013).
El análisis (fig. 2) indica que la distribución actual de las especies del género Pocillopora en el POT está relacionada en gran medida con la temperatura superficial del mar y la Ω aragonita, lo que coincide con las conclusiones de múltiples trabajos sobre biogeografía de corales arrecifales (Couce et al., 2012, 2013; Freeman et al., 2013). La temperatura tiene efectos fisiológicos positivos sobre las tasas de crecimiento, la calcificación (Carricart-Ganivet et al., 2012; Langdon y Atkinson, 2005) y sobre el aumento de la viabilidad reproductiva (Couce et al., 2012; Santiago-Valentín et al., 2015). Por su parte, los altos valores de saturación de aragonita también favorecen la calcificación (Fabricius et al., 2011; Kleypas et al., 2006; Manzello, 2010), aumentan la cementación de la estructura arrecifal y se relacionan con menores tasas de bioerosión (Couce et al., 2012; Manzello et al., 2008; Wild et al., 2011).
Los mapas (figs. 3-4) muestran que el efecto de cambio en la temperatura y la acidificación sobre la distribución de los pocilopóridos en el POT sería mayor bajo los escenarios RCP 4.5 y 8.5, y mínimo para el RCP 2.6. Este último se basa en la suposición de un uso más racional de los recursos y muchas menos emisiones de gases de efecto invernadero, condiciones que para el año 2100 permitirían limitar el aumento de la temperatura media global a 2 °C (van Vuuren et al., 2011), y controlarían la baja del pH (Mei-Di y Long, 2015). Para los escenarios RCP 4.5 y 8.5, la proyección de Maxent refleja un desplazamiento del hábitat adecuado hacia regiones que actualmente se consideran marginales para el desarrollo coralino como el Pacífico de la península de Baja California, la costa de Ecuador e islas Galápagos (Couce et al., 2013; Freeman et al., 2015), posiblemente debido al aumento esperado de temperatura según los modelos de cambio climático (Freeman, 2015; Howes et al., 2015; Kleypas et al., 2006; Precht y Aronson, 2004) y la posible mejora concomitante en el valor de Ω aragonita (Freeman et al., 2013; Pörtner et al., 2014). Estas expansiones pueden tener efectos importantes ya que los corales podrían afectar otras especies bentónicas al aumentar los niveles de competencia por el sustrato, pero en paralelo, aumentarían la heterogeneidad del fondo, el nivel de reciclamiento de nutrientes y la biodiversidad local (Fabricius, 2005; Graham, 2014). La mejora en la probabilidad de presencia no es garantía de colonización exitosa pues la expansión del área de distribución depende en gran parte de las interacciones bióticas (de Araújo et al., 2014); sin embargo, los corales del género Pocillopora son bien conocidos por su alto potencial de dispersión que puede facilitar su traslado a mayores latitudes, fenómeno que ya ocurre en Japón y Florida (Vargas-Ángel et al., 2003; Yamano et al., 2011).
Así como hay algunos aumentos en los rangos de distribución geográfica en el POT, las proyecciones de los 3 escenarios denotan regiones que destacan por su retención de hábitat arrecifal adecuado, que incluyen la parte sur del golfo de California en el escenario 4.5, el archipiélago de Revillagigedo, las costas de Colombia y algunas zonas de costas de Costa Rica y Panamá en ambos escenarios (figs. 4, 5); ello se debe a que en los pixeles se aprecian cambios mínimos de temperatura (entre -0.73 y +1.23 °C) y de Ω aragonita (entre -1.3 y +0.13 unidades) para el año 2050. En particular, en lo que concierne a la parte sur del golfo de California, el panorama presentado en este estudio está en línea con estudios anteriores que apoyan la idea de que esta zona estará en relativamente bajo estrés térmico porque está más influenciada por la corriente de California en invierno y primavera (Kessler, 2006; López-Pérez et al., 2014).
Algunos arrecifes de Costa Rica y Panamá se desarrollan en aguas con concentraciones altas de nutrientes y relativamente frías a causa de fenómenos de surgencia en los golfos de Chiriquí y Papagayo (Couce et al., 2012), y se ha sugerido que en el futuro pueden funcionar como refugios para especies de coral, en especial durante años en que se presente el fenómeno de oscilación sureña de El Niño (Podestá y Glynn, 2001; Smith et al., 2017). Aunque algunos autores no apoyan esta hipótesis (Chollett et al., 2010), los resultados del presente estudio apoyan la idea de que esas zonas seguirán siendo relativamente hospitalarias para los corales, al menos en el futuro cercano.
Según los resultados, la tendencia general de los pocilopóridos será hacia la conservación o ganancia de hábitat en el POT, pero existe una especie que potencialmente puede sufrir extinción local (P. effusus) y otra que perdería buena parte de su área de distribución en los escenarios 4.5 y 8.5 (P. verrucosa). La primera es la única endémica del POT y sobre ella se cuenta con muy poca información sobre la distribución, su biología y susceptibilidad a las amenazas (Hoeksema et al., 2008).
Por el contrario, P. verrucosa es una de las especies dominantes en la costa americana occidental y uno de los principales constructores de arrecifes (Veron, 2000). Estos corales tienen morfología ramificada y proveen un hábitat estructuralmente complejo para gran diversidad de organismos asociados (Lenihan et al., 2011). Por este motivo, su pérdida potencial podría disminuir la complejidad estructural local y como resultado, acarrear cambios relevantes en la composición bentónica y los ensamblajes locales, como ha sucedido en el caso de la desaparición de las especies de Acropora en el mar Caribe (Alvarez-Filip et al., 2009).
Finalmente, los resultados del análisis de riqueza de especies identificaron lugares clave para la diversidad del género Pocillopora en las Américas (“hotspots”; Beger et al., 2002) tanto en el presente como en el futuro, y serían las costas de Costa Rica y Panamá. Los arrecifes de esos países ya son reconocidos como sitios de gran biodiversidad en el POT, particularmente para cnidarios y peces (Glynn, Alvarado et al., 2017; Guzmán et al., 2004, 2008). Además de estas regiones, los modelos predicen nuevos puntos de alta diversidad de corales arrecifales en regiones ricas en nutrientes, con alta productividad y aguas relativamente frías como el archipiélago de Galápagos y también con baja salinidad como la costa de Ecuador (Glynn, 2003). Por lo anterior, los resultados de la presente investigación tienen implicaciones importantes para el manejo futuro y conservación de áreas de interés que podrían ser incorporadas a planes de manejo ecológico cuyo objetivo sería maximizar la conservación de la biodiversidad de los arrecifes coralinos ante un panorama de cambio climático.
En conclusión, este estudio sugiere que en los escenarios de cambio climático RCP 4.5 y 8.5, los corales del género Pocillopora podrían experimentar a mediano plazo (para 2050) una expansión de su distribución espacial hacia la costa del Pacífico de la península de Baja California, la costa de Ecuador y las islas Galápagos, las cuales actualmente se consideran marginales para el desarrollo arrecifal; no obstante, un control de emisiones de gases de efecto invernadero que diera lugar a condiciones como las esperadas en el escenario RCP 2.6, resultaría en virtual estabilidad de la distribución de este género coralino. El aumento en la probabilidad de presencia de los corales del POT en las zonas antes mencionadas podría deberse al hecho de que éstos se desarrollan dentro de condiciones ambientales subóptimas y altamente variables, lo cual podría precondicionar su resistencia al estrés y a los disturbios futuros antes descritos, explicando su potencial para colonizar nuevas zonas alteradas por el cambio climático.











 nova página do texto(beta)
nova página do texto(beta)