Introducción
Algunas especies de parásitos, en particular los que requieren el paso por las cadenas tróficas, han sido mencionadas como bioingenieros o constructores de las relaciones tróficas; sus ciclos de vida complejos poseen un gran valor ecológico para comprender el funcionamiento de un ecosistema (Goater et al., 2013; Marcogliese y Cone, 1997). En México, el conocimiento acerca de la helmintofauna de peces dulceacuícolas es amplio, se ha incluido en temas de conservación (Falcón-Ordaz et al., 2015; Monks et al., 2013; Pulido-Flores et al., 2005), biogeografía (Aguilar-Aguilar et al., 2005, 2008; Salgado-Maldonado y Quiroz-Martínez, 2013), y un gran número de listados de especies (Aguilar-Aguilar et al., 2004, 2014; Aguilar-Aguilar y Salgado-Maldonado, 2006; Caspeta-Mandujano, 2005, 2010; Pérez-Ponce de León et al., 2009, 2010; Salgado-Maldonado, 2006; Salgado-Maldonado, Cabañas-Carranza, Caspeta-Mandujano Salgado-Maldonado et al., 2001; Cabañas-Carranza, Soto-Galera et al., 2001; Salgado-Maldonado, Cabañas-Carranza et al., 2004; Salgado-Maldonado, Mercado-Silva et al., 2004; Salgado-Maldonado et al., 2005, 2011, 2016; Scholz et al., 1996; Vidal-Martínez et al., 2001). A pesar del considerable esfuerzo de muestreo en estudios taxonómicos sobre helmintos de peces dulceacuícolas en el país, a la fecha, los peces anuales no han sido estudiados. En Latinoamérica, pocos son los estudios sobre helmintos en peces anuales, con registros en Uruguay (Delgado, 2014; Delgado y García, 2015), Venezuela (Nico y Thomerson, 1989) y México (Mosqueda-Cabrera y Ocampo-Jaimes, 2009). Los peces anuales habitan cuerpos de agua temporales que se inundan por semanas o meses durante la estación de lluvias, siguiendo los ciclos estacionales y transitando obligadamente por una fase seca (Myers, 1952; Wourms, 1972a, b). Durante el hidroperíodo (tiempo en que el hábitat presenta agua) los peces tienen un acelerado crecimiento y reproducción, y toda la población muere al secarse el estanque. En la siguiente estación de lluvias una nueva población tiene lugar a partir de los huevos que resisten la sequía mediante la detención del desarrollo conocido como diapausas embrionarias (Dolfi et al., 2014; Furness, 2016; Podrabsky et al., 2010). En México el conocimiento de peces con historia de vida anual es reciente (Domínguez-Castañedo et al., 2013). Millerichthys robustus es una especie endémica de las cuencas de los ríos Coatzacoalcos y Papaloapan, este último catalogado como uno de los ríos con mayor riqueza y endemismos de helmintos en el país (Salgado-Maldonado et al., 2005). La información sobre los helmintos ha permitido conocer la manera en que la asociación parásito-hospedero se establece en cuerpos de agua permanentes (Pérez-Ponce de León et al., 2010); no obstante, a pesar de que en cuerpos de agua temporales los procesos de especiación y coevolución entre las especies y su fauna parasitaria se potencializan (Delgado y García, 2015), existe poca información acerca de las relaciones parásito-hospedero en estos hábitats. Esta investigación presenta la helmintofauna de la única especie de pez anual distribuida en México (M. robustus) y discute brevemente el riesgo que representa sobre sus poblaciones en cuerpos de agua temporales de la parte baja de la cuenca del río Papaloapan.
Materiales y métodos
La recolecta de peces se realizó durante 2 momentos de un hidroperíodo (al inicio, en octubre de 2015 y al final, en febrero de 2016) en 2 cuerpos de agua temporales asociados a la cuenca del río Papaloapan, en las inmediaciones de Playa Salinas (PS-1) y Tlacotalpan (TL-1). Los peces fueron capturados durante la fase de reproducción utilizando redes de cuchara con luz de malla de 1/8”. Al finalizar la recolecta, inmediatamente fueron sacrificados, fijados en formaldehído al 10% durante 10 días y posteriormente conservados en alcohol etílico al 70% hasta su estudio. Cuando fue posible, la búsqueda de helmintos se realizó en peces recién sacrificados y disectados bajo un microscopio estereoscópico. Los helmintos fueron mantenidos en solución salina al 0.65% hasta que fueron fijados de acuerdo a cada grupo taxonómico: metacercarias y metacéstodos con formaldehído al 4% caliente; para la observación de los ganchos de estos últimos, se utilizó solución GAP (glicerina y ácido pícrico). Las metacercarias y cistacantos fueron teñidos con paracarmín de Mayer y montadas en resina sintética; larvas de nemátodos con alcohol etílico al 70% caliente y transparentados con lactofenol de Amman. La recolecta de peces fue amparada bajo los permisos de colecta científica (SPGA/DGVS/04147/15, 05529/16) y se identificaron de acuerdo con Costa (1995) y Miller y Hubbs (1974).
Los descriptores cuantitativos de la infección fueron calculados de acuerdo con Bush et al. (1997) y el intervalo de confianza (95%), de acuerdo con el método exacto de Fisher. Los parásitos fueron identificados de acuerdo con Caffara et al. (2011), García-Prieto et al. (2010), Gaspar-Navarro et al. (2013), Moravec (1998), Scholz y Salgado-Maldonado (2001). Los ejemplares fueron primeramente observados con un microscopio estereoscópico y fotografiados con una cámara digital adaptada a un microscopio compuesto. Algunos peces fueron depositados en la Colección Nacional de Peces, Instituto de Biología, Universidad Nacional Autónoma de México (22560, 22561, 22562 y 22563) y los helmintos de referencia, en la Colección Nacional de Helmintos (CNHE) del Instituto de Biología, UNAM.
Resultados
La disección de 48 peces procedentes de 2 hábitats (tabla 1) resultó en el hallazgo de 8 especies de helmintos; 7 en peces de PS-1 y 4 de TL-1. Al inicio del hidroperíodo, solo 3 especies de helmintos se encontraron en ambos hábitats: Valipora minuta, Clinostomum marginatum y Serpinema trispinosum; mientras que al final, a las especies anteriores, se sumaron Eustrongylides sp., Gnathostoma lamothei, Contracaecum sp., Valipora campylancristrota y Polymorphus sp. El sitio de infección de todas las especies fue el mismo a lo largo del hidroperíodo, excepto para las larvas de S. trispinosum; al inicio del hidroperíodo se encontraron libres a lo largo del intestino mientras que al final se localizaron enquistados sobre la serosa externa del recto. Por otra parte, las metacercarias de C. marginatum, además de encontrarse en el celoma, también infectaron las gónadas (fig. 1) con una prevalencia de 20.8% (16.7% en testículo y 4.1% en ovario) al final del hidroperíodo, únicamente en peces de PS-1 (tabla 2).
Tabla 1 Total de peces recolectados en 2 cuerpos de agua temporales durante 2 momentos del hidroperíodo. He = Hospederos examinados, M = macho, H = hembra, n = total de peces examinados.
| Hábitat | Hidroperíodo | n | |
| Inicio He (M, H) |
Final He (M, H) |
||
| PS-1 (18°54’48” N, 95°56’56” O) | 9 (9, 0) | 15 (4, 11) | 24 |
| TL-1 (18°37’06” N, 95°38’08” O) | 10 (10, 0) | 14 (0, 14) | 24 |
| Total | 19 (19, 0) | 29 (4, 25) | 48 |
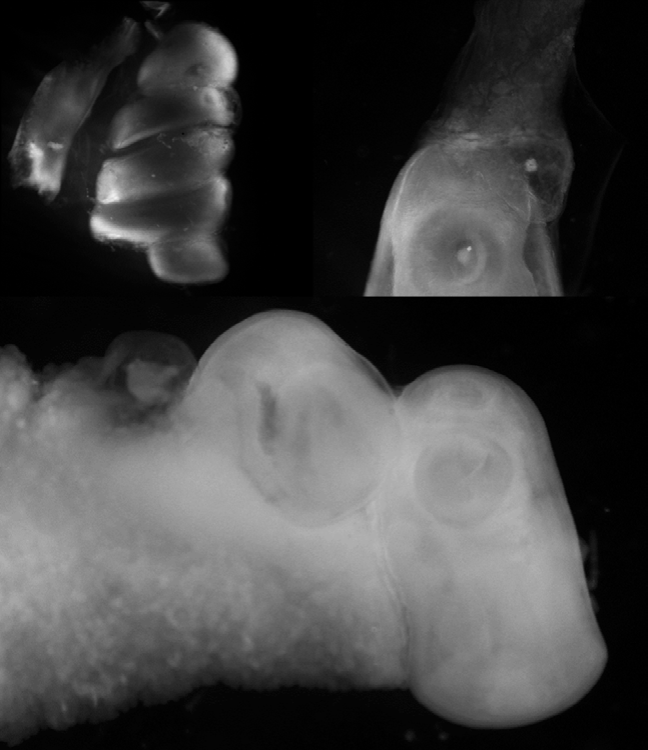
Figura 1 Metacercarias de Clinostomum marginatum infectando las gónadas de Millerichthys robustus. Ovarios (arriba), testículo (abajo).
Tabla 2 Parámetros cuantitativos de la infección de 8 especies de helmintos aislados de Millerichthys robustus recolectado en 2 cuerpos de agua temporales. S = Sitio de infección, Vb = vesícula biliar, Ce = celoma, G = gónadas, H = hígado, I = intestino, M = musculatura, P = prevalencia, i = inicio del hidroperíodo, f = final del hidroperíodo, IC = intervalo de confianza, I = intensidad promedio, A = abundancia promedio
| Especie de helminto | S | Hábitat (Fase del hidroperíodo) |
P (IC) 95% | I | A |
| Metacestodos | |||||
| Gryporhynchidae | |||||
| Valipora minuta | Vb Vb Vb Vb |
PS-1(i) PS-1(f) TL-1(i) TL-1(f) |
44.44 (13.70-78.80) 20.00 (04.33-48.09) 60.00 (26.24-87.84) 92.85 (66.13-99.82) |
1.0 1.0 1.8 2.7 |
0.4 0.2 1.1 2.5 |
| V. campylancristrota | Vb | PS-1(f) | 26.67 (07.79-55.10) | 1.5 | 0.4 |
| Metacercaria Clinostomidae |
|||||
| Clinostomum marginatum | Ce Ce, G Ce |
PS-1(i) PS-1(f) TL-1(i) |
33.33 (07.48-70.07) 33.33 (11.82-61.62) 20.00 (02.52-55.61) |
3.3 1.4 1.5 |
1.1 0.5 0.3 |
| Larvas de nemátodos | |||||
| Anisakidae | |||||
| Contracaecum sp. | H, Ce | PS-1(f) | 40.00 (16.34-67.71) | 1.7 | 0.7 |
| Camallanidae | |||||
| Serpinema trispinosum | I I Ce |
PS-1(i) TL-1(i) TL-1(f) | 33.33 (7.49-70.07) 10.00 (0.25-44.50) 28.57 (08.40-58.10) |
1.0 2.0 1.0 |
0.3 0.2 0.3 |
| Dioctophymatidae | |||||
| Eustrongylides sp. | Ce | PS-1(f) | 6.67 (0.17-31.95) | 6.0 | 0.4 |
| Gnathostomatidae Gnathostoma lamothei |
M | TL-1(f) | 26.67 (7.79-55.10) | 0.8 | 0.2 |
| Cistacanto | |||||
| Polymorphidae | |||||
| Polymorphus sp. | Ce | PS-1(f) | 6.67 (0.17-31.95) | 1.0 | 0.07 |
Todas las especies de helmintos fueron encontradas en sus fases larvarias; los nemátodos conformaron el grupo mejor representado, con 4 especies Contracaecum sp., G. lamothei, S. trispinosum (fig. 2) y Eustrongylides sp.; excepto para Eustrongylides sp. y Polymorphus sp., todas las especies de helmintos presentaron prevalencias mayores de 20%. El metacéstodo V. campylancristrota fue registrado solo al final del hidroperíodo en PS-1 (fig. 3) y 3 peces presentaron infección mixta con V. minuta. Esta última especie presentó las prevalencias más altas y junto con S. trispinosum, sus valores se incrementaron al final del hidroperíodo en peces de TL-1 (tabla 2).

Figura 2 Extremos anterior y posterior de larvas de nemátodos aislados de Millerichthys robustus. a-b, Contracaecum sp.; c-d, Gnathostoma lamothei; e-f, Serpinema trispinosum. Escala de la barra = 20 micras.
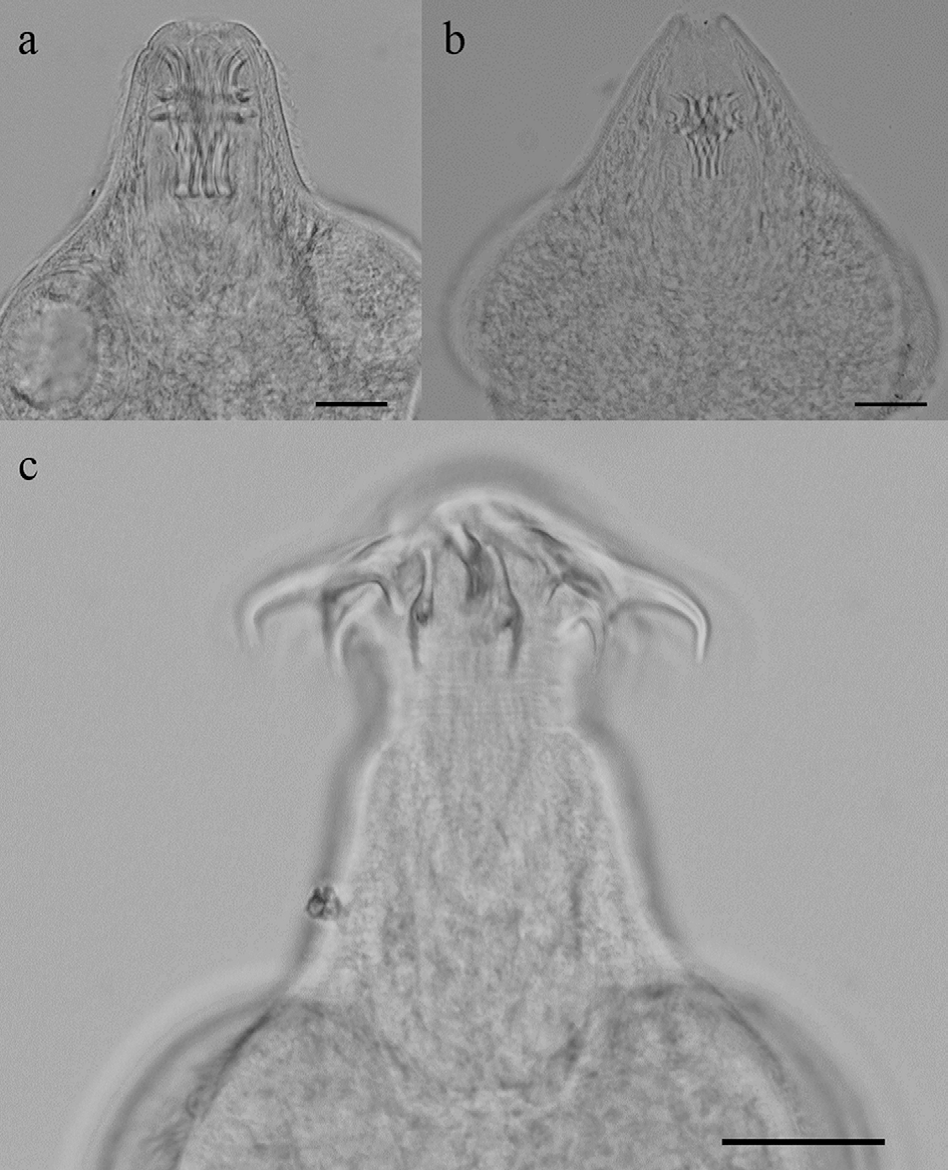
Figura 3 Metacéstodos de Valipora de la vesicular biliar de Millerichthys robustus. Comparación del escólex invaginado: a, V. minuta; b, V. campylancristrota. c, Escólex evaginado de V. minuta. Escala de la barra = 20 micras (a-b), 5 micras (c).
Todas las especies de helmintos presentan ciclos de vida heteroxénicos y utilizan a M. robustus como hospedero intermediario. El hecho de haber encontrado los ovarios infectados con metacercarias de C. marginatum, en algunos casos ocupando la totalidad del órgano, sin la observación de ovocitos maduros, supone un efecto negativo sobre su reproducción y/o sobrevivencia (fig. 1). En el caso de los machos, el impacto puede estar reflejado al final del hidroperíodo, en el que la cantidad de machos fue menor con relación a las hembras (tabla 1).
Discusión
México es uno de los países con mayor número de estudios dirigidos al conocimiento de la helmintofauna de peces dulceacuícolas en Latinoamérica (Luque y Poulin, 2007). Este grupo de hospederos presenta una capacidad limitada en su distribución, resultado de la historia geológica de sus hábitats; no obstante, muchas especies de helmintos cumplen sus ciclos de vida en peces (Salgado-Maldonado y Quiroz-Martínez, 2013). En contraste, todas las especies de helmintos aquí documentadas constituyen especies alogénicas (Esch et al., 1988), es decir, durante su transmisión, M. robustus funge como hospedero intermediario hacia reptiles (S. trispinosum), aves (V. campylancristrota, V. minuta, C. marginatum, Eustrongylides sp., Contracaecum sp.) y mamíferos (G. lamothei), sus hospederos definitivos.
La ausencia de helmintos adultos en M. robustus está asociada principalmente a la efimeridad del hábitat. En términos generales, los peces anuales presentan una esperanza de vida corta (Blažek et al., 2013; Furness, 2016) e inevitablemente la muerte de todas las formas de vida acuática ocurre durante la sequía. En este escenario, los ciclos de vida de las especies de helmintos solo pueden ser completados en hospederos externos al cuerpo de agua, ya que una hipotética población de formas adultas de helmintos infectando a M. robustus, las cuales liberarían huevos y larvas que parasitarían a microcrustáceos y caracoles (primeros hospederos intermediarios) también moriría al final del hidroperíodo. No obstante, la presencia de helmintos en su fase adulta en M. robustus podría ocurrir bajo el siguiente supuesto. Durante las lluvias torrenciales, es posible que peces de cuerpos de agua permanentes infectados por un parásito adulto (p. ej. Bothriocephalus) lleguen a cuerpos de agua temporales a través de las escorrentías. De esta manera, M. robustus podría adquirir la infección al alimentarse de copépodos infectados y actuar como hospedero definitivo. No obstante esta situación dependería exclusivamente de este escenario.
En comparación con los cuerpos de aguas permanentes (p. ej. ríos, lagos y lagunas), los cuerpos de agua temporales, hábitat típico de peces anuales, presentan una fase seca obligatoria en un ciclo anual (Furness, 2016). Durante el hidroperíodo, los cuerpos de agua temporales son el hábitat común de crustáceos, insectos, moluscos y peces, entre otros; también de anfibios, reptiles y aves que llegan por razones de alimentación y reproducción. Sin embargo, solo las especies que presentan formas de resistencia a la sequía del hábitat darán lugar a nuevas poblaciones en el siguiente hidroperíodo (Williams, 2006). Las poblaciones de M. robustus mueren al final del hidroperíodo, cuando sus estanques se secan por completo; una población nueva tiene lugar en el siguiente hidroperíodo, al inicio de la estación de lluvias con la eclosión de huevos fertilizados por la generación anterior, que resistieron la temporada seca mediante diapausas embrionarias. De tal manera que cuando los comparamos con sus contrapartes - peces de ríos, lagos y lagunas-, los peces de cuerpos de agua temporales se encuentran aislados y presentan una vagilidad muy reducida. En este contexto, al inicio del hidroperíodo, el proceso de infección entre parásitos y los hospederos intermediarios depende de la visita recurrente de hospederos definitivos infectados (reptiles, aves y mamíferos) en busca de alimento, momento en que liberan los huevos junto con las heces. Estos hábitats proporcionan una abundante fuente de alimento durante el hidroperíodo, lo que atrae a muchas aves residentes y migratorias y a medida que el nivel del agua desciende se presenta una fuerte depredación (Bonetto, 1975; Williams, 2006).
En algunas especies anuales del género Nothobranchius, el tamaño de sus poblaciones llega a ser de 1,750-1,956 individuos en un estanque de 875 m2 (2 peces/m2) (Berois et al., 2016). Los hábitats aquí estudiados presentan un área reducida y poca profundidad (180 m2 × 80 cm), aun cuando en algunos casos observamos poblaciones grandes (110 peces) en hábitats con dimensiones de 60 m2 × 7 cm (1.8 peces/m2). Esta condición del hábitat podría incrementar la frecuencia de encuentro parásito-hospedero y por tanto, las tasas de infección se incrementan de un hospedero a otro durante su ciclo de vida. En relación con lo anterior, los valores de los parámetros de la infección que presentan la mayoría de las especies de helmintos encontrados en M. robustus son mayores a los registrados en peces de cuerpos de agua permanentes asociados a la cuenca del río Papaloapan y otros sistemas hidrológicos (tabla 3).
Tabla 3 Comparación de los parámetros cuantitativos de la infección de helmintos de peces de la cuenca del río Papaloapan con relación a los registrados en M. robustus de cuerpos de agua temporales. N = Número de hospederos examinados, P/I = prevalencia e intensidad promedio, (*) = datos de la infección en otros sistemas hidrológicos, - sin datos.
| Especie de helminto | Hospedero | Localidad | N | P/I | Estudio |
| Valipora campylancristrota | Rhamdia guatemalensis | Ixin-há cenote | 131 | 1.5/- | Scholz et al. (1996)* |
| Millerichthys robustus | Playa Salinas | 15 | 26.7/1.5 | Presente estudio | |
| V. minuta | R. guatemalensis | Ixin-há cenote | 131 | 3.05/- | Scholz et al. (1996) * |
| Poecilia sphenops | Presa Tepecoacuilco | 6 | 33.3/6.0 | Scholz y Salgado-Maldonado (2001)* | |
| M. robustus | Tlacotalpan Playa Salinas |
14 9 |
92.9/2.7 44.4/1.0 |
Presente estudio | |
| Clinostomum complanatum | Dormitator maculatus | Tlacotalpan | 184 | 82.3/49.7 | Montoya-Mendoza et al. (2004) |
| 36 | 86.1/39.6 | Salgado-Maldonado et al. (2005) | |||
| Cichlasoma urophthalmus | Tlacotalpan | 10 | 20.0/2.0 | Salgado-Maldonado et al. (2005) | |
| Xipophorus helleri | Arrollo Balzapote | 8 | 12.5/1.0 | ||
| C. marginatum | M. robustus | Playa Salinas | 15 | 33.3/1.4 | Presente estudio |
| Contracaecum sp. | C. urophthalmus D. maculatus | Tlacotalpan | 10 11 | 100/1.8 18.2/2.0 |
Salgado-Maldonado et al. (2005) |
| Ophisternon aenigmaticum | Lago de Catemaco Tlacotalpan |
27 10 |
11.1/1.0 80.0/3.6 |
||
| M. robustus | Playa Salinas | 15 | 40.0/1.7 | Presente estudio | |
| Serpinema trispinosum | D. maculatus O. aenigmaticum | Tlacotalpan | 47 10 |
2.0/1.0 10.0/1.0 |
Salgado-Maldonado et al. (2005) |
| M. robustus | Tlacotalpan Playa Salinas | 24 9 |
21.0/1.2 33.3/1.0 |
Presente estudio | |
| Eustrongylides sp. | D. maculatus | Tlacotalpan | 47 | 2.0/1.0 | Salgado-Maldonado et al. (2005) |
| M. robustus | Playa Salinas | 15 | 6.7/6.0 | Presente estudio | |
| Gnathostoma binucleatum | Gobiomorus dormitor | Tlacotalpan | 14 | 36.0/2.6 | Mosqueda y Ocampo (2009) |
| G. lamothei | M. robustus | 15 | 26.7/0.8 | Presente estudio | |
| Polymorphus sp. | R. guatemalensis | Lago de Catemaco | 4 | 25.0/1.0 | Salgado-Maldonado et al. (2005) |
| M. robustus | Playa Salinas | 15 | 6.7/1.0 | Presente estudio |
Por otra parte, las especies del género Clinostomum utilizan caracoles de la familia Planorbidae como hospederos intermediarios (Choudhury et al., 2016; Lane y Morris, 2010; Rosser et al., 2017). Se conoce que los esporocistos de varias especies de tremátodos no esquistosómicos causan muerte prematura, alteraciones del crecimiento y castración en los caracoles y bivalvos (Bohes et al., 2010; Esteban et al., 2011); sin embargo, nada se ha documentado sobre estas afectaciones por C. marginatum en sus primeros y segundos hospederos intermediarios. En M. robustus, una cantidad considerable de metacercarias de C. marginatum se encontraron en los testículos y ovarios, un caso extremo con 5 metacercarias ocupando por completo el ovario (fig. 2). Por lo tanto, un efecto negativo sobre la capacidad reproductiva de M. robustus por C. marginatum es posible. En otras especies de peces anuales como Rachovia maculpinnis y R. transilis, se ha documentado la presencia de parásitos en gónadas causando la castración total o parcial de los organismos (Nico y Thomerson, 1989), un factor que podría ser determinante en la tasa de fecundidad y supervivencia de los peces. A menudo, la proporción de sexos en peces anuales está dominada por las hembras (Passos et al., 2014; Reichard et al., 2014). Algunos factores que actúan sobre los machos llegan a representar presiones importantes en sus poblaciones, p. ej., la depredación por aves que se intensifica en especies que presentan coloraciones más llamativas (Reichard et al., 2009) y las altas temperaturas que afectan la esperanza de vida de los machos de algunas especies (Berois et al., 2016). A este escenario se suma el posible efecto negativo de las metacercarias de C. marginatum; por lo tanto, el conocimiento sobre la interacción de M. robustus y su helmintofauna en términos de su reproducción y supervivencia, es pertinente, y comprobar dicho efecto podría dar la pauta para trabajar en potenciales programas de conservación de la especie.
Esta investigación da cuenta del primer estudio sobre la helmintofauna de M. robustus; todas las especies alojadas por este pez anual constituyen nuevos registros. El número relativamente alto de especies de helmintos encontrados en el hospedero y los valores altos en los parámetros de infección, junto con las características físicas del hábitat (área reducida, poca profundidad y permanencia), juegan un rol importante que asegura la transmisión de la infección desde M. robustus hacia los hospederos definitivos.
Finalmente, los cuerpos de agua temporales constituyen hábitats que transitan una fase seca y un hidroperíodo con base en un ciclo anual. El inicio de la estación de lluvias en México está bien definido y consecuentemente el inicio del hidroperíodo y de las poblaciones de M. robustus; por lo tanto, en estos hábitats es posible conocer con exactitud el periodo de desarrollo larvario de las especies de helmintos en sus hospederos intermediarios, aspecto que se complica en cuerpos de agua permanentes. Los estudios sobre patrones de colonización de las especies de helmintos a lo largo del hidroperíodo, podrían dar cuenta de la sincronización de los ciclos de vida de las especies parásitas con el ambiente y con sus hospederos intermediarios y definitivos.











 nova página do texto(beta)
nova página do texto(beta)


