Introducción
A pesar de la extensión del litoral michoacano, resalta lo reducido de las investigaciones sobre las algas marinas bentónicas de éste (Pedroche et al., 2005). Los primeros registros de algas marinas de la costa de Michoacán corresponden con 3 especies de Padina Adanson registradas para Las Peñas y Caleta de Campos, en el trabajo de Chávez-Barrera (1980). Posteriormente, el listado florístico se enriqueció con el registro de 14 especies pertenecientes a la familia Rhodomelaceae (Sentíes et al., 1990). La primera lista florística de las algas marinas bentónicas de la costa norte de Michoacán fue realizada por Dreckmann et al. (1990), quienes registraron 68 especies, 15 de las cuales pertenecen a Chlorophyta. Más adelante, Stout y Dreckmann (1993), identificaron 68 especies de macroalgas en el faro de Bucerías: de las cuales 12 fueron Chlorophyta, 15 Phaeophyceae y 41 Rhodophyta, con 23 nuevos registros para la zona y 15 para el Pacifico Tropical mexicano. Posteriormente, León-Álvarez y González-González (1993) registraron a Pseudendoclonium marinum (Reinke) Aleem y Shulz en Lázaro Cárdenas; por otro lado, León-Tejera et al. (1993) ubicaron 23 Phaeophyceae, 34 Rhodophyta y 25 Chlorophyta, 8 de las cuales fueron registros para Caleta de Campos. Finalmente, Bucio-Pacheco y Dreckmann (1997) hallaron 26 especies de Chlorophyta en 12 localidades del litoral de Michoacán, éste es el único trabajo enfocado exclusivamente a las algas verdes.
Las algas verdes (Chlorophyta) son un importante componente en los ecosistemas costeros (Mateo-Cid et al., 2013). Estas se encargan de la producción primaria, consolidan y fijan el sustrato por medio de sus rizoides disminuyendo la erosión (Sentíes y Dreckmann, 2011). En los trabajos mencionados anteriormente se encuentran registrados solo 32 taxones de Chlorophyta para la costa de Michoacán (Bucio-Pacheco y Dreckmann, 1997; Pedroche et al., 2005), por lo que el objetivo de este trabajo fue ampliar el conocimiento de las algas verdes que habitan el litoral de Michoacán. El presente estudio incorpora una lista florística de 6 localidades poco estudiadas de esta región, además de Las Peñas, La Saladita, Caleta de Campos y Maruata, aportando nuevos registros de Chlorophyta para la zona de estudio, así como datos acerca de su distribución, variación estacional, hábitat y reproducción durante las estaciones climáticas de lluvias y secas.
Materiales y métodos
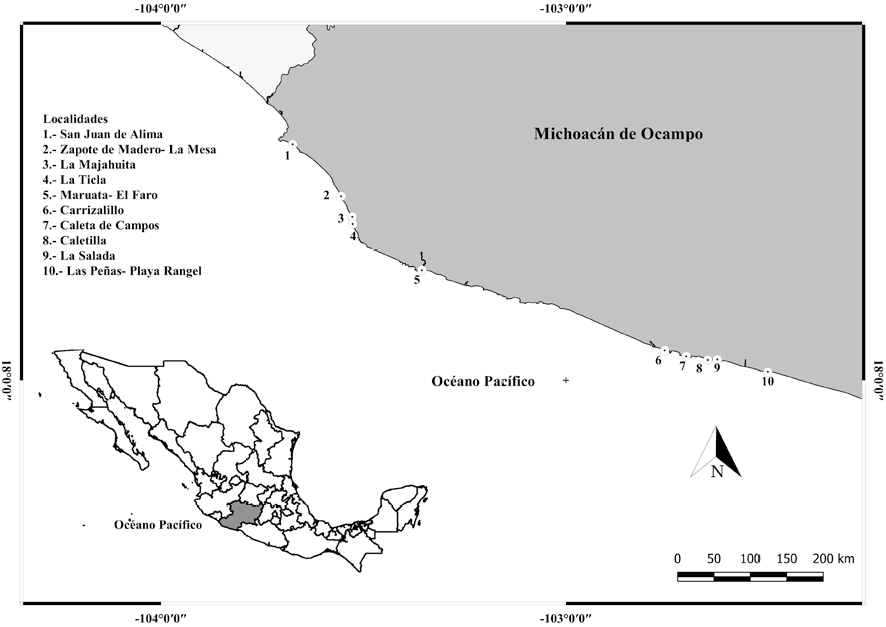
El material ficológico se obtuvo a partir de 18 muestreos, 7 en la estación climática de lluvias y 11 en la de secas en 10 localidades del litoral de Michoacán, 6 de ellas poco estudiadas: San Juan de Alima, El Zapote de Madero-La Mesa, La Majahuita, La Ticla, Carrizalillo y Caletilla; que abarcaron desde mayo de 2006 hasta mayo de 2014. En el Tabla 1 se indican los sitios de muestreo con coordenadas geográficas (GPS), fisiografía, exposición al oleaje, sustrato, profundidad y fecha de recolecta. Las algas se recolectaron a mano en el nivel intermareal con ayuda de espátulas y navajas de campo, y se fijaron en formaldehido a 4% en agua de mar. Las recolectas se realizaron en segmentos de playa de aproximadamente 500-2,000 m de extensión. El material fue procesado y depositado en el herbario ENCB (Thiers, 2017). Para la observación de las algas se utilizó un microscopio binocular Olympus CX31RBSF, realizándose cortes de los talos con navajas de doble filo para distinguir estructuras reproductivas y vegetativas. Para la descalcificación de los taxones de la familia Halimedaceae, se utilizó HNO3 0.6 M. La determinación de las Chlorophyta se llevó a cabo empleando los trabajos de Setchell y Gardner (1924); Taylor (1945); Abbott y Hollenberg (1976); Burrows (1991); Schneider y Searles (1991) y Norris (2010). La secuencia de la lista florística sigue el orden propuesto por Pedroche et al. (2005) y Wynne (2017). La actualización nomenclatural se basó en Wynne (2017) y Guiry y Guiry (2018). Cada especie se acompañó con datos sobre distribución en el área de estudio, estacionalidad, estado reproductivo, hábitat, epifitismo y número de herbario o de recolección. Las fotomicrografías se tomaron con una cámara Canon D30 (Tokio, Japón) acoplada a un microscopio Olympus CX31 (Manila, Filipinas). Las imágenes de las muestras se tomaron con una cámara digital Canon (SX710HS). Las imágenes digitales fueron editadas y ensambladas en láminas con Adobe Photoshop 7.0 (San José, CA, EUA).
Tabla 1 Caracterización de las localidades de muestreo.
| Localidades | Coordenadas GPS |
Fisiografía | Exposición al oleaje |
Sustrato | Profundidad (m) |
Fecha de recolecta |
| 1. San Juan de Alima |
18°34’59” N, 103°40’28” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso | 0-1 | 03/ 2010; 12/ 2012; 08/ 2013 |
| 2. El Zapote de Madero- La Mesa |
18°23’10” N, 103°31’35” O |
Arenosa con plataformas rocosas y agregados de rocas |
Expuesto y protegido |
Rocoso con pozas intermareales |
0-2 | 05/2006; 03/ 2007; 03, 09, 12/ 2008; 04, 12/ 2009; 03/2010; 12/ 2012; 08/2013 |
| 3. La Majahuita | 18°24’13” N, 103°31’39” O |
Rocosa con plataforma de marea |
Expuesto y protegido |
Rocoso con pozas intermareales con canales de corriente |
0-2 | 05/ 2006; 03/ 2007; 03, 09, 12/2008; 04, 12/2009; 03/2010; 12/2012; 08/2013 |
| 4. La Ticla | 18°27’16” N, 103°33’19” O |
Arenosa con cantos rodados |
Expuesto | Cantos rodados | 0-2 | 12/2012; 08/2013 |
| 5. Maruata- El Faro |
18°16’18” N, 103°21’20” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso | 0-3 | 12/2012; 08/2013 |
| 6. Carrizalillo | 18°03’33” N, 102.42’11” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso con pozas |
0-1 | 12/2008; 04, 12/2009 |
| 7. Caleta de Campos |
18°04’26” N, 102°45’23” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso, acantilados |
0-1 | 05/2008; 04/2009; 12/2012 |
| 8. Caletilla | 18°03’01” N, 102°38’58” O |
Arenosa con plataformas rocosas y agregados de rocas |
Expuesto y protegido |
Rocoso con pozas intermareales |
0-2 | 05, 12/2006; 03/2007; 03, 05, 12/ 2008; 04/2009 |
| 9. La Saladita | 18°03’06” N, 102°37’35” O |
Arenosa con agregados rocosos |
Expuesto | Rocoso con pozas intermareales |
0-1 | 05, 12/2006; 03/ 2008 |
| 10. Las Peñas- Playa Rangel |
18°01’14” N, 102°30’06” O |
Arenosa con acantilados, agregados rocosos |
Expuesto | Rocoso con pozas intermareales |
0-1 | 03/2009; 03/2010; 05/2014 |
El estado de Michoacán forma parte del litoral de la República Mexicana en el Pacífico tropical mexicano (PTM) tiene una longitud de 247 km, lo que representa el 2.9% de línea costera total del país. Su litoral abarca desde la “Boca de Apiza” del río Coahuayana hasta la “Boca de San Francisco” al este del delta del río Balsas (Correa, 1974), entre los 20°23’27” y 17°53’57” N, 100°03’32” y 103°44’49” O (Fig. 1). Pertenece a la región costa suroccidental del Pacífico mexicano, limita al noroeste con la bahía de Banderas, Jalisco, hasta Mazunte, cerca de Puerto Ángel en Oaxaca. Son costas tectónicas de colisión con gran abundancia de cantiles y de puntas rocosas y pequeñas bahías. Hay algunos ríos que llegan a la costa y casi una total ausencia de cuerpos de agua costeros (Ortiz-Pérez y de la Lanza-Espino, 2006). Michoacán posee 3 regiones hidrológicas: Balsas, Lerma-Santiago y Costas de Michoacán El clima del área corresponde al subtipo Aw 1 (W), es decir, cálido subhúmedo con 2 periodos de lluvia separados por sequías intraestivales; las lluvias de verano son abundantes, las invernales escasas (menos del 5% del total anual). La temperatura es relativamente alta (mínima invernal de 18° C). La precipitación pluvial anual es de 600 a 800 mm (García, 1983). La estación de lluvias se presenta de mayo a octubre y la de secas de noviembre a abril. El régimen de mareas es micromareal mixto, presentándose generalmente 2 pleamares y 2 bajamares, con una amplitud de alrededor de 0.27 metros (Grivel, 1983).
Resultados
En el litoral de Michoacán, que es predominantemente rocoso, un total de 56 especies de algas verdes que habitaban en plataformas rocosas, pozas de marea, sobre guijarros, cantos rodados, zonas de acantilados y canales de corriente, fueron determinadas. Estas especies estuvieron distribuidas en 5 órdenes, 13 familias y 19 géneros (Tabla 2). Los géneros con mayor riqueza específica fueron Ulva Linnaeus (10), Cladophora Kützing (8) y Bryopsis J.V. Lamouroux (6), entre los géneros monoespecíficos se encontraron: Boodlea G. Murray y De Toni, Chlorodesmis Harvey y Bailey, Phaeophila Hauck, Phyllodictyon J.E. Gray, Ulothrix Kützing y Willeella Børgesen.
Tabla 2 Algas verdes (Chlorophyta) del litoral de Michoacán. La explicación de los símbolos al final de la tabla.
| Especies | Localidades | Est. | Fenología | Habitat | Obs. | Referencias | Número Herbario ENCB |
| Ulvophyceae Phaeophilales Phaeophilaceae 1. Phaeophila dendroides (P. Crouan y H. Crouan) Batters |
2, 6, 9 | Ll, S | Ve | Epi | NRM | A | 23860 23872 23949 |
| Ulotrichales Ulotrichaceae 2. Ulothrix flacca (Dillwyn) Thuret |
2 | S | Ve | Epi | A | 23874 | |
| Ulvales | 1, 2, 3, 5 | Ll, S | Esp | R, Pm | NRM | A | 23972 23973 |
| Kornmanniaceae 3. Blidingia minima (Nägeli ex Kützing) Kylin |
23974 23975 | ||||||
| 4. B. minima var. vexata (Setchell y N.L. Gardner) J.N. Norris | 3 | Ll | Esp | R, Pm | NRP | A | 23978 |
| 5. Pseudendoclonium marinum (Reinke) Aleem y E. Schulz | F | ||||||
| Ulvaceae 6. Ulva californica Wille |
3 | Ll | Ve | R | A | 24003 | |
| 7. U. chaetomorphoides (Børgesen) Hayden, Blomster, Maggs, P.C. Silva, M.J. Stanhope y J.R. Waaland | 1 | Ll | Ve | Epi | NRP | A | 23975 |
| 8. U. compressa Linnaeus | 1, 2, 3, 5, | Ll, S | Ve | R, Pm | A | 23893 23894 23985 | |
| 7, 8, 9, 10 | 23986 23927 23997 | ||||||
| 23998 24146 | |||||||
| 9. U. fasciata Delile | 2, 3, 6, 7, | Ll, S | Ve | R, Pm | NRM | A | 22630 23927 23962 |
| 8, 9, 10 | 23963 24147 | ||||||
| 24148 24150 | |||||||
| 10. U. flexuosa Wulfen | 1, 2, 3, 7, 10 | Ll, S | Ve | R, Pm | A | 23905 23900 23964 | |
| 23965 24158 24159 | |||||||
| 11. U. flexuosa subsp. paradoxa (C. Agardh) M.J. Wynne | 2 | Ll, S | Ve | R, Pm | A | 23930 23995 | |
| 12. U. intestinalis Linnaeus | 2, 4, 5, 8, 10 | Ll, S | Ve | R, Pm | A | 15591 23902 23966 | |
| 23967 24160 | |||||||
| 13. U. lactuca Linnaeus | D,E,F | ||||||
| 14. U. linza Linnaeus | 3, 5 | Ll, S | Ve | R | NRM | A | 15519 |
| 15. U. nematoidea Bory | 2, 5 | Ll, S | Ve | R | NRM | A | 17017 23909 |
| 16. U. rigida C. Agardh | 1, 2, 3, 4, 5, | Ll, S | Ve | R, Epi | NRM | A | 19578 23905 23968 |
| 6, 7, 8, 9, 10 | 23969 23960 | ||||||
| 24166 24167 24168 | |||||||
| 24169 24170 | |||||||
| Ulvellaceae | 1, 2, 4, 5, | Ll, S | Ve | Epi | NRM | A | 23853 23860 23922 |
| 17. Ulvella lens P. Crouan y H. Crouan. | 7, 8, 9 | 23953 24045 24088 | |||||
| 18. U. setchellii P. Dangeard | 10 | S | Ve | Epi | NRM | A | 24000 |
| 19. U. viridis (Reinke) R. Nielsen, C.J. O'Kelly y B. Wysor | 8 | Ll | Ve | Epi | NRM | A | 23870 23942 |
| Cladophorales Boodleaceae 20. Boodlea composita (Harvey) F. Brand |
2, 3, 7 | Ll, S | Sv | R, Pm | NRM | A | 23846 23847 23908 |
| 21. Cladophoropsis gracillima E.Y. Dawson | 1, 2, 3, 8 | Ll, S | Sv | R, Pm | NRM | A | 23909 23939 23940 |
| 24010 24011 | |||||||
| 22. C. sundanensis Reinbold | 2 | Ll | Ve | R | NRM | A | 23848 |
| 23. Phyllodictyon robustum (Setchell y N.L. Gardner) Leliaert y Wysor | 2, 3 | Ll, S | Sv | R, Pm | 23910 23941 23942 | ||
| Cladophoraceae | 2, 3, 7, 9 | Ll, S | Ve | R | NRM | A | 23862 23863 |
| 24. Chaetomorpha aerea (Dillwyn) Kützing | 23949 24035 | ||||||
| 25. C. antennina (Bory) Kützing | 1, 2, 3, 4, 5, | Ll, S | Ve | R | A | 19358 23853 23854 | |
| 6, 7, 8, 9, 10 | 23950 23951 23952 | ||||||
| 23953 24036 24037 | |||||||
| 24038 24039 24040 | |||||||
| 26. C. californica Collins | B, E | ||||||
| 27. C. gracilis Kützing | 1, 2, 10 | Ll, S | Ve | R | NRM | 23864 23915 23930 | |
| 28. C. ligustica (Kützing) Kützing | E | ||||||
| 29. C. linum (O.F. Müller) Kützing | 1, 2, 3 | Ll, S | Ve | R | NRM | A | 23865 24005 24115 |
| 30. Cladophora albida (Nees) Kützing | 1, 7, 10 | Ll, S | Ve | R | NRM | A | 23888 23991 24079 |
| 31. C. crispula Vickers | 2 | Ll | Ve | R | NRP | A | 23867 |
| 32. C. flexuosa (O.F. Müller) Kützing | E, F | ||||||
| 33. C. liniformis Kützing | 1, 2, 5 | Ll, S | Gm | R | A | 23868 23955 24046 | |
| 34. C. microcladioides Collins | 4 | S | Gm | R | A | 23992 | |
| 35. C. prolifera (Roth) Kützing | 2, 3, 10 | Ll, S | Ve | R, Pm | A | 19088 23869 23916 | |
| 36. C. sericea (Hudson) Kützing | 2, 3 | S | Ve | R | A | 23866 23916 | |
| 37. C. tiburonensis E.Y. Dawson | 3 | S | Ve | Epi | NRM | A | 23994 |
| 38. C. vagabunda (Linnaeus) Hoek | 5 | S | Ve | R | NRM | A | 24001 |
| 39. Rhizoclonium riparium (Roth) Harvey | 10 | S | Ve | Epi | A | 23888 | |
| 40. R. tortuosum (Dillwyn) Kützing | 2 | S | Ve | Epi | A | 23942 | |
| 41. Willeella brachyclados (Montagne) M.J. Wynne | 2, 3 | Ll, S | Ve | R. Pm | A | 23870 23956 | |
| Bryopsidales Bryopsidaceae 42. Bryopsis galapagensis W.R. Taylor |
C, F | ||||||
| 43. B. hypnoides J.V. Lamouroux | 2, 5, 6, 8 | Ll, S | Ve | R | 15516 23980 | ||
| 23981 24014 | |||||||
| 44. B. muscosa J.V. Lamouroux | 5, 10 | Ll, S | Sv | R | NRM | A | 23912 23913 |
| 23914 23938 | |||||||
| 45. B. pennata J.V. Lamouroux | 1, 2, 3, | Ll, S | Ve | R | NRM | A | 15600 23843 23982 |
| 5, 7, 8 | 24013 24062 24189 | ||||||
| 46. B. pennata var. minor J. Agardh | 1, 2, 3, 6, 8 | Ll, S | Sv | R, Pm | A | 23844 23983 | |
| 24015 24016 MICH-07-10/02 | |||||||
| 47. B. pennata var. secunda (Harvey) Collins y Hervey | 6, 10 | S | Ve | R | NRP | A | 23845 MICH-12-09/01 |
| 48. B. plumosa (Hudson) C. Agardh. | 2, 3 | S | Ve | R | NRM | A | 23984 23985 |
| Caulerpaceae 49. Caulerpa ambigua Okamura |
6 | S | Ve | R, Epi | NRM | A | 23986 |
| 50. C. chemnitzia (Esper) J.V. Lamouroux | 1, 2, 3, 6, | Ll, S | Ve | R, Pm, | A | 19097 23849 23943 | |
| 7, 8, 9, 10 | Epi | 23944 23945 | |||||
| 23946 24018 24019 | |||||||
| 24020 24021 | |||||||
| 51. C. racemosa (Forsskål) J. Agardh | C, D, E, F | ||||||
| Codiaceae 52. Codium brandegeei Setchell y N.L. Gardner |
3 | S | Gm | R | NRM | A | 23917 |
| 53. C. giraffa P.C. Silva | 1, 2, 3, 4, 5, | Ll, S | Gm | R | A | 22633 23871 23872 | |
| 6, 8, 9, 10 | 23873 23918 23919 | ||||||
| 23920 23921 24062 | |||||||
| 54. C. isabelae W.R. Taylor | 1, 2, 3, 6, | Ll, S | Gm | R, Pm | A | 19166 22631 22922 | |
| 7, 8, 10 | 22923 23957 24058 | ||||||
| 24059 24060 | |||||||
| 55. C. picturatum Pedroche y P.C. Silva | 2, 6, 7, 8 | S | Gm | Epi, R, | A | 23878 23879 24063 | |
| Pm | 24064 24065 | ||||||
| 56. C. simulans Setchell y N.L. Gardner | 2, 5, 6 | Ll, S | Gm | R, Pm | NRM | A | 11021 24066 MICH-09-25/01 |
| Derbesiaceae 57. Derbesia hollenbergii W.R. Taylor |
2, 6, 8, 9 | Ll, S | Esp | R, Epi | NRM | A | 23880 23883 |
| MICH-07-10/03 MICH-13-30/01 | |||||||
| 58. D. marina (Lyngbye) Solier | 1, 2, 6, 8, | Ll, S | Esp | R | A | 23881 23882 24048 | |
| 9, 10 | 24070 24079 MICH-09-194/01 | ||||||
| Udoteaceae 59. Boodleopsis pusilla (Collins) W.R. Taylor, A.B. Joly y Bernatowicz |
2, 10 | S | Ve | R, Pm | NRM | A | 23971 23979 |
| 60. B. verticillata E.Y. Dawson | 3, 6 | S | Ve | R, Pm, Epi | NRM | A | 23892 23893 23926 |
| 61. Chlorodesmis caespitosa J. Agardh | D, E, F | ||||||
| 62. C. hildebrandtii A. Gepp y E.S. Gepp | 2, 3, 6, 8 | S | Ve | R, Pm | NRM | A | 22628 23961 |
| 24179 24180 | |||||||
| 63. Penicillus sibogae A. Gepp y E.S. Gepp | E, F | ||||||
| Halimedaceae 64. Halimeda discoidea Decaisne |
2, 5 | Ll, S | Ve | R, Pm | A | 15543 MICH-06-58/01 | |
| 65. H. tuna (J. Ellis y Solander) J.V. Lamouroux | 2, 3 | Ll, S | Ve | R, Pm | NRM | A | 23999 MICH-08-107/06 |
Localidades: 1, San Juan de Alima. 2, El Zapote de Madero-La Mesa. 3, La Majahuita. 4, La Ticla. 5, Maruata-El Faro. 6, Carrizalillo. 7, Caleta de Campos. 8, Caletilla. 9, La Saladita. 10, Las Peñas-Playa Rangel. Est. (Estacionalidad): Ll = lluvias (mayo de 2006, 2008, 2014; agosto 2013; septiembre 2009), S = secas (marzo de 2007, 2008, 2010; abril 2009; noviembre 2010; diciembre de 2006, 2008, 2009; diciembre 2012). Fenología: Gm = gametangios; Esp = esporangios; Sv = segregación vegetativa; Ve = vegetativo. Hábitat: R = rocoso; Pm = pozas intermareales; Epi = epífito. Obs. (Observaciones): NRM = nuevo registro para Michoacán; NRP = nuevo registro para la costa del Pacífico de México. Referencias: A) este estudio, B) Dreckmann et al. (1990); C) León-Tejera et al. (1993); D) Stout y Dreckmann (1993): E) Bucio-Pacheco y Dreckmann (1997); F) Pedroche et al. (2005).
En el Tabla 2 se indican las especies ubicadas en este estudio según la clasificación de Wynne (2017) y Guiry y Guiry (2018), con su distribución en las 10 localidades exploradas, así como la estacionalidad, reproducción, hábitat y número de colección del herbario ENCB. Las familias mejor representadas de acuerdo al número de taxa fueron Cladophoraceae (15) y Ulvaceae (10). Siguen en importancia Bryopsidaceae (6), Codiaceae (5) y Boodleaceae (4). También se ubicaron especies de Chaetophoraceae, Halimedaceae, Phaeophilaceae, Udoteaceae y Ulvellaceae representadas por 1 o 3 especies (Tabla 2).
La integración del listado florístico permitió reconocer 33 nuevos registros infragenéricos para el litoral de Michoacán, 4 de los cuales fueron nuevos registros para el Pacífico de México.
De los 32 registros previos, 23 taxones fueron encontrados en este estudio y 9 no se ubicaron en las muestras recolectadas (Tabla 2). En virtud de lo anterior, el número de especies registradas para la costa de Michoacán, se amplió a 65 taxones infragenéricos de algas verdes marinas bentónicas, lo que representa un incremento del 49.23% del total de las Chlorophyta del área de estudio. La mayoría de los registros nuevos para Michoacán pertenecen a los géneros Blidingia Kylin, Boodlea, Bryopsis, Chaetomorpha Kützing, Cladophora, Cladophoropsis Børgesen, Codium Stackhouse, Phaeophila, Ulva y Ulvella P. Crouan y H. Crouan.
También se cita por primera vez a Blidingia minima var. vexata (Setchell y N.L. Gardner) J.N. Norris, Bryopsis pennata var. secunda (Harvey) Collins y Hervey, Cladophora crispula Vickers y Ulva chaetomorphoides (Børgesen) Hayden, Blomster, Maggs, P.C. Silva, M.J. Stanhope y J.R. Waaland, para la costa del Pacifico de México (Tabla 2). A continuación se hace una breve descripción de los nuevos registros de Chlorophyta para el Pacífico tropical de México, con comentarios y distribución de las especies.
Blidingia minima var. vexata (Setchell y N.L. Gardner) J.N. Norris (Figs. 2-5)

Figuras 2-9. 2-5 Blidingia minima var. vexata: 2, detalle de la porción basal del talo con ramificaciones. Escala 160 μm; 3, detalle de estructuras de reproducción en desarrollo (flecha) y porciones vegetativas (cabeza de flecha). Escala 210 μm; 4, porción ensanchada del talo con peritecios (flecha). Escala 1 mm; 5, detalle de los paquetes de esporangios (flechas) en la superficie del talo. Escala 75 μm. 6-8. Ulva chaetomorphoides: 6, aspecto general del talo. Escala 250 μm. 7, detalle de un talo joven (flecha) fijo a su hospedero (cabeza de flecha). Escala 210 μm; 8, detalle de la porción apical del talo, se observan las proliferaciones uniseriadas. Escala 120 μm. 9. Cladophora crispula: aspecto general del talo filamentoso, ramificado. Escala 190 μm.
Talo tubular y ramificado en la base, porciones erguidas aplanados, láminas lineares a espatuladas, de color verde claro simples y 1 o 2 veces ramificadas y 1.5- 3 cm de longitud. Porción basal de 150-160 µm diámetro, cuando en los talos forman los peritecios estos se ensanchan y toman la superficie se observan corrugadas, rugosas y con numerosos peritecios en forma de verrugas de color verde brillante, que tienen de diámetro de 1 a 1.2 mm.
Reproducción: los esporangios se disponen en paquetes de diversa forma en la superficie del talo, en general de 60-70 µm diámetro.
Comentarios: las características de nuestros ejemplares concuerdan en general con la descripción de Abbott y Hollenberg (1976) para especímenes de California, USA. Su presencia en el área de estudio puede deberse a la corriente de California de aguas frías y cuya manifestación se presenta hacia el invierno y principios de primavera (SEMAR, 2002)
Distribución: Pacífico de América: USA: Alaska, British Columbia, California, Oregon, Washington. México: La Majahuita, Michoacán.
Ulva chaetomorphoides (Børgesen) Hayden, Blomster, Maggs, P.C. Silva, M.J. Stanhope y J.R. Waaland (Figs. 6-8).
Talo de color verde brillante, erecto, tubular, conformado por filamentos cilíndricos, huecos en sección transversal, en la porción basal de 40 a 50 µm de diámetro, con arreglos de 3 filas de células alineadas longitudinalmente en vista superficial, con proliferaciones uniseriadas cerca de los ápices. Células cuadradas-rectangulares, de 10-15 μm de diámetro, cada célula tiene de 2-3 pirenoides. Talo fértil no observado.
Comentarios: nuestros especímenes concuerdan con los descritos por Taylor (1960) como Enteromorpha chaetomorphoides Børgesen. U. chaetomorphoides se distingue de otras especies de Ulva por su hábito tubular y filiforme. U. chaetomorphoides ha sido registrada en Filipinas y Vietnam (Guiry y Guiry, 2018) y quizá pase desapercibida por ser epífita y de talla pequeña.
Distribución: USA: Florida. América Central: Belice, Caribe: Cuba, Martinica, Trinidad y Tobago, Curazao, Barbados, islas Bermudas, Jamaica, Trinidad, islas Vírgenes. América del Sur: Brazil, Colombia, Venezuela. Filipinas, Vietnam. Europa: Francia. Asia: China.
Cladophora crispula Vickers (Figs. 9-11)

Figuras 10-13 10. Cladophora crispula: detalle de la ramificación unilateral en las porciones apicales del talo. Escala 460 μm; 11, detalle de la porción apical fuertemente curvada (flecha). Escala 130 μm; 12-13. Bryopsis pennata var. secunda: 12, aspecto general del talo. Escala 300 μm; 13, porción erguida donde se detalla el patrón unilateral de ramificación de las pínulas (cabeza de flecha). Escala 2 mm.
Talos uniseriados y ramificados de color verde claro, delicado, formando mechones enredados, a veces en espiral, hasta 1 cm de altura, fijo al sustrato por rizoides de la célula basal. Ramificación pseudodicotómica, unilateral, con el eje principal con ramillas fuertemente curvadas. Células apicales con puntas redondas, que miden 80-100 μm de longitud y 30-40 μm en diámetro; células del eje principal 200-350 μm de longitud y 35-50 μm de diámetro. Talo fértil no observado.
Comentarios: los especímenes asignados a C. crispula concuerdan perfectamente con lo descrito por Alves et al. (2012) para Bahia, Brazil. De acuerdo con van den Hoek (1982), las células en C. crispula son uniformes en diámetro a lo largo del talo, una característica observada tanto en material mexicano como en el de Brazil. Cladophora crispula comparte características con C. laetevirens (Dillwyn) Kützing con respecto a la arquitectura del talo, dimensiones de las células y la forma de las células apicales, pero difiere por su talo enmarañado con filamentos apicales fuertemente curvados.
Distribución: México: Tabasco. Caribe: islas Bermudas, Bahamas, Barbados, Hispaniola, islas Vírgenes. América del Sur: Brazil. Bangladesh, China, Filipinas, Singapore, Vietnam.
Bryopsis pennata var. secunda (Harvey) Collins y Hervey (Figs. 12-13).
Talo color verde olivo, cenocítico, erguido, hasta 2.5 cm de alto, diferenciado en una porción postrada de la cual se origina una porción erguida. Porción erguida organizada en un eje principal cilíndrico de 240 a 300 μm de diámetro, con pínulas (a excepción de la poción basal que es desnuda). Porciones erectas lineares a lanceoladas, compuestas por pínulas con organización principalmente unilateral con ápices redondeados y marcadamente constreñidas en la base.
Comentarios: los ejemplares asignados a B. pennata var. secunda en general concuerdan con la descripción de Taylor (1960), excepto en la talla de los talos que en nuestro caso son más pequeños. B. pennata var. secunda difiere de B. pennata J.V. Lamouroux y B. pennata var. minor, por su ramificación claramente unilateral (secunda). Esta especie ha sido registrada en varias islas del Pacifico, Australia y América por lo que puede considerarse que tiene amplía distribución.
Distribución: México: Tabasco, Quintana Roo. Atlántico: islas Bermudas. Caribe: Cuba, Martinica. América del Sur: Brazil, Venezuela. Africa: Mauritius, Guinea Ecuatorial, Ghana, Tanzania. Asia: China, Japón, Taiwan, Vietnam, India, Irán, Yemen, Filipinas, Singapore, Tailandia. Australia, Nueva Zelanda: Papua, Queensland. Islas del Pacífico: Micronesia, Nueva Caledonia, Hawái, Islas Marshall.
La riqueza específica total entre los sitios de muestreo fue diferente, los valores oscilaron desde un máximo de 41 especies, en El Zapote de Madero-La Mesa, hasta un mínimo de 6 en La Ticla. El mayor número de especies se registró en localidades con plataformas rocosas y zonas rocosas expuestas en donde se forman pozas y canales de corriente como La Majahuita (29), Caletilla (19) y Carrizalillo (17). Por lo que respecta a las zonas con áreas rocosas expuestas, destaca Las Peñas-Playa Rangel donde se ubicaron 19 taxones, en San Juan de Alima se hallaron 18, Maruata-El Faro 16, Caleta de Campos 14 y finalmente, La Saladita 12. En estos sitios se ubicaron especies de las familias Cladophoraceae, Ulvaceae, Codiaceae, Boodleaceae y Bryopsidaceae.
Las especies con la distribución más amplia en el área de estudio fueron Ulva rigida C. Agardh y Chaetomorpha antennina (Bory) Kützing, que se encontraron en las 10 localidades de muestreo, Codium giraffa P.C. Silva en 9, Ulva compressa Linnaeus y Caulerpa chemnitzia (Esper) J.V. Lamouroux en 8 y finalmente Ulvella lens P. Crouan y H. Crouan y Codium isabelae W.R. Taylor en 7.
Variación estacional. Del total de las especies determinadas, 50 se ubicaron en la estación climática de secas, incremento atribuido a los representantes del orden Cladophorales, seguido de la época de secas con 40.
Fenología. Del total de taxones ubicados en este estudio, solo se encontraron a 7 (12.5%) en estado reproductivo sexual, presentando gametangios. Los talos fértiles pertenecieron a Codium y Cladophora (Tabla 2). En el caso de Blidingia minima (Nägeli ex Kützing) Kylin, B. minima var. vexata (Setchell y N.L. Gardner) J.N. Norris, Derbesia hollenbergii W.R. Taylor y D. marina (Lyngbye) Solier, estas se encontraron con esporangios; mientras que Boodlea composita (Harvey) F. Brand, Cladophoropsis gracillima E.Y. Dawson, C. sundanensis Reinbold y Bryopsis muscosa J.V. Lamouroux presentaron segregación vegetativa. El resto de los taxones (71.43%) se halló en estado vegetativo.
Discusión
Las Chlorophyta determinadas en este trabajo, han sido registradas en las zonas tropicales rocosas del mundo, incluida la costa del Pacífico de América, el Océano Indico, o bien en el Atlántico Tropical de América (Mateo-Cid et al., 2013; Pedroche et al., 2005). El número total de taxones encontrados en este estudio es similar con lo registrado por Bastida-Zavala et al. (2013) para el litoral de Oaxaca, quienes mencionan 54 taxones infragenéricos de algas verdes para esa región. En contraste, la riqueza específica de algas verdes de Michoacán es por mucho más alta que en la costa sur de Nayarit donde Mateo-Cid y Mendoza-González (1992) citaron 29 taxones de Chlorophyta; en 1991, las mismas autoras registraron 27 Chlorophyta en el litoral de Colima; en Chiapas, Mendoza-González y Mateo-Cid (1996) citan 12 taxones de Chlorophyta para ese estado. Por otro lado, Mendoza-González et al. (2011) documentaron 28 taxones de Chlorophyta para el litoral sur de Jalisco, mismo número de especies registradas por Mateo-Cid y Mendoza-González (2012) para la costa noroccidental de Guerrero. Lo anterior evidencia que el litoral de Michoacán posee la mayor riqueza específica de algas verdes del litoral del Pacífico tropical mexicano, con numerosos taxones representativos de la región.
Asimismo, los resultados obtenidos sugieren que el litoral de Michoacán es un área con alta diversidad florística, si se tiene en cuenta que en su línea costa se puede encontrar el 37.2 % de las Chlorophyta conocidas para la costa del Pacífico de México que es de 178 (Pedroche et al. 2005). Es importante resaltar que más de la mitad (53.9%) de las especies de Chlorophyta de la costa atlántica y del Pacífico tropical de México han sido recolectadas en sustrato rocoso. Garduño-Solórzano et al. (2005), Mateo-Cid y Mendoza-González (1991, 2001, 2012) y Mendoza-González et al. (2011) señalan que este sustrato expuesto al oleaje es el lugar donde se localiza una gran diversidad de algas marinas. La textura, el grado de dureza y el color de las rocas influyen sobre las comunidades algales. Por ejemplo, Boodlea composita, Bryopsis pennata y Derbesia hollenbergii, pueden albergarse entre los intersticios de las rocas y con ello protegerse del oleaje; en el caso de Chaetomorpha antennina y C. gracilis Kützing habitan en sustrato rocoso liso y muy expuesto al oleaje, en ambos casos las estructuras de adhesión tienen modificaciones relacionadas con la superficie utilizada. La presencia de acantilados, plataformas rocosas, canales de corriente y agregados rocosos, combinado con características oceanográficas particulares, actúan en conjunto en el área de estudio y proveen las condiciones para el desarrollo de un elevado número de algas verdes (Bucio-Pacheco y Dreckmann, 1997; Mateo-Cid y Mendoza-González, 1991, 2001, 2012; Mendoza-González et al. 2011).
De los 32 registros previos, 9 no fueron ubicados en el presente trabajo. Esta situación puede deberse a varios factores: 1) a la aplicación de nombres incorrectos derivado de la falta de certeza de los caracteres taxonómicos actualmente en uso para la determinación de las especies; por ejemplo, Fama et al. (2002) mencionan que existe un complejo de especies del género Caulerpa J. V. Lamouroux que requiere de revisión taxonómica; 2) período de recolecta, tipo de muestreo y localidades exploradas; 3) sucesos climatológicos, como presencia de mar de fondo, lluvias atípicas y huracanes, los cuales pueden inducir cambios en los ecosistemas marinos (Lugo, 2000).
De los 32 taxones citados previamente para el litoral de Michoacán (Bucio-Pacheco y Dreckmann, 1997; Pedroche et al., 2005), se ubicaron 23, mientras que 33 son nuevos registros para el área de estudio. El alto número de nuevos registros hallados en el área de estudio puede deberse a: 1) las localidades de muestreo que no habían sido previamente estudiadas, 2) la revisión meticulosa del material, que permitió ubicar a especies epífitas y 3) el número de recolectas llevadas a cabo.
Entre los nuevos registros destacan Phaeophila dendroides (P. Crouan y H. Crouan) Batters, Ulvella lens, U. setchelli P. Dangeard y U. viridis (Reinke) R. Nielsen, C.J. O'Kelly y B. Wysor, todas de hábitos epífitos. En general, es reducido el número de especies y estudios florísticos en que se cita a los representantes de la familia Ulvellaceae (Barata y Toyota-Fujii, 2006), debido quizás a su hábito de vida epífito. Asimismo, Boodleaceae es una familia que únicamente incluye 5 géneros y 34 especies en el Atlántico, Índico y Pacífico (Guiry y Guiry, 2018). En contraste, dentro del género Ulva se encontró el mayor número de registros nuevos (5), sobresaliendo U. chaetomorphoides y U. nematoidea Bory, en el caso de Cladophora y Bryopsis se ubicaron 4 registros nuevos de cada uno (Tabla 2): Cladophora crispula, C. tiburonensis E.Y. Dawson, Bryopsis muscosa y B. plumosa (Hudson) C. Agardh.
Se observaron variaciones de la riqueza específica a lo largo del ciclo estacional. La mayor riqueza se presentó en secas (50), lo cual puede estar relacionado con la disponibilidad de luz. Lalli y Parson (1997) mencionan que en latitudes tropicales la superficie del agua de mar recibe más energía del sol durante verano, en comparación a invierno y los días de verano son 4 o 5 horas más largos, lo que se traduce en una mayor energía disponible para la fotosíntesis de las algas. En contraparte, el menor número de especies se registró en la temporada de lluvias (40); durante este periodo la precipitación pluvial acarrea terrígenos al mar disminuyendo de este modo la energía proveniente del sol (Lalli y Parson, 1997). Lo anterior concuerda con otros estudios realizados en otros estados del Pacífico sur de México, por ejemplo, Mateo-Cid y Mendoza-González (2001) en su estudio del litoral de Oaxaca, ubicaron un mayor número de especies de Chlorophyta en la época de secas, hecho atribuible a las algas anuales que dominan en secas y disminuyen en lluvias. En 2012, las mismas autoras en su trabajo de algas marinas bentónicas de la costa noroccidental de Guerrero, también encontraron un mayor número de especies en la temporada de secas y lo atribuyeron a las especies anuales, las que dominan en época de secas y disminuyen en la época de lluvias. El efecto de la luz y la temperatura sobre las variaciones temporales de la composición y riqueza de las algas marinas bentónicas está ampliamente documentado (Santelices, 1977), otros factores como la precipitación, nutrientes, cambios en la dinámica del agua producto de los huracanes y tormentas, también inciden en el desarrollo de la flora marina (Santelices, 1977).
Las diferencias en la riqueza específica entre las localidades de muestreo pueden ser explicadas por el tipo de sustrato dominante en los sitios de muestreo, por ejemplo en El Zapote de Madero-La Mesa y La Majahuita, que son lugares con sustrato rocoso y grandes plataformas rocosas donde se forman pozas, lagunetas y canales, se ubicaron 41 y 30 taxones, respectivamente, lo que concuerda con Mendoza-González et al. (2011) y Mateo-Cid y Mendoza-González (1992, 2001, 2012), quienes encontraron que las algas verdes que habitan en las costas mexicanas del golfo de México y del mar Caribe se desarrollan principalmente sobre sustratos duros; Santelices (1977) indica que los sustratos duros y estables permiten la fijación y desarrollo de un mayor número de algas marinas bentónicas.
Por lo que respecta a La Ticla, Caleta de Campos y La Saladita, la riqueza específica fue baja (6, 14 y 13 taxones, respectivamente), comparada con las otras localidades, esto puede atribuirse a que las playas son mayormente arenosas y con formaciones rocosas expuestas a intenso oleaje. En el caso de San Juan de Alima, Maruata-El Faro y Las Peñas-Playa Rangel se ubicaron 18, 15 y 19 taxones, respectivamente, a pesar de que en las 3 localidades se encuentran formaciones rocosas, éstas se muestran como una zona de mar abierto fuertemente expuesta al oleaje durante la resaca de las olas, en las bajamares y pleamares.
En este estudio se ubicó un bajo número de especies de Chlorophyta en estado reproductivo, hecho que coincide con lo registrado en diversos estudios florísticos realizados en las costas mexicanas (Mateo-Cid y Mendoza-González, 1991, 1992, 2001, 2012; Mendoza-González et al. 2011). Esta situación puede deberse a que las especies se encontraban en estadios juveniles y a que las fases sexuales de estos organismos tienen un periodo corto de vida (Mendoza-González et al. 2011; Santelices, 1977), asimismo los mecanismos de reproducción de este grupo de algas implican la rápida formación de estructuras de reproducción y liberación de gametos móviles (Acosta-Calderón et al., 2016). Además, la temperatura, la luz, el fotoperiodo y los nutrientes, intervienen en la reproducción de las algas; por ejemplo, Coppejans et al. (2001) mencionan que la aparición de estructuras de reproducción en Ulvophyceae es estacional. Las algas en estado fértil que se ubicaron en este trabajo pertenecen a los géneros Codium, Cladophora, Derbesia, Boodlea y Cladophoropsis.
El análisis y la integración de los estudios previos y los resultados obtenidos en el presente estudio indican la importancia de realizar inventarios ficoflorísticos en regiones del litoral mexicano poco trabajadas y actualizaciones de la flora en intervalos de tiempo regulares. Además, estos resultados son la base para futuros estudios de tipo ecológico y de conservación, por lo que se recomienda continuar con los muestreos en las localidades visitadas para recabar datos de los cambios espaciales y temporales de la flora que permitan monitorear e identificar posibles alteraciones en las condiciones ambientales del litoral michoacano.











 text new page (beta)
text new page (beta)