Introducción
En México se localizan 193 cuencas hidrológicas, las más importantes son las de los ríos Bravo y el Balsas, la cuenca Lerma-Chapala, la del río Santiago, el río Pánuco y las cuencas de los ríos Grijalva y Usumacinta (Cotler et al., 2010). La cuenca del río Usumacinta es la más grande de Mesoamérica, el 48% de su superficie se encuentra en México y el 52% en Guatemala, nace en los Altos de Chiapas, en México y en las partes altas de Guatemala en la sierra de los Cuchumatanes, específicamente en el departamento de Totonicapan, en Guatemala y desemboca en el golfo de México. La longitud del río Usumacinta es de aproximadamente 1,000 km y es el río más caudaloso de México y Centroamérica (Amezcua et al., 2007). En la planicie costera de Tabasco, el río Usumacinta se junta con el Grijalva, formando un extenso delta denominado pantanos de Centla, el cual mide alrededor de 50 km de ancho por 70 km de largo y corresponde al 12.27% de la superficie total del estado de Tabasco (Semarnat, 2000a). La cuenca del Usumacinta se divide en alta, media y baja. La parte alta va desde los 2,700 a los 900 m de altitud, comprendiendo los departamentos de Huehuetenango, Quinché y Totonicapa en Guatemala y los municipios de Chanal, Huixtán, Oxchuc y Las Margaritas en Chiapas. La parte media se presenta en altitudes de los 800 a los 100 m, se encuentra al noreste de las montañas mayas en Guatemala y en los municipios de Ocosingo y Maravilla Tenejapa en Chiapas. La parte baja inicia en Boca del Cerro, en el municipio de Tenosique, Tabasco y termina en la barra de Frontera, en el municipio de Centla, Tabasco (Cabrera y Cuc, 2002; Cruz, 2017).
La cuenca del Usumacinta se localiza en la región tropical del sureste de México, la cual es considerada una de las regiones con mayor biodiversidad y alta heterogeneidad ambiental (Kolb, 2013). En esta región se encuentra la mayor riqueza de anfibios y reptiles (Johnson et al., 2010) y presenta un gran número de endemismos en relación con otras regiones y áreas del mundo (Casas-Andreu et al., 1996).
Ochenta y cinco trabajos documentan la riqueza y diversidad de los diferentes grupos herpetofaunísticos que se distribuyen en la cuenca del Usumacinta y zonas aledañas. Históricamente, se han registrado 146 especies de herpetozoos (gamma acumulada) que corresponden a 38 especies de anfibios y 108 especies de reptiles, por lo que se tenía reportado hasta antes de este trabajo el 9.97% de los anfibios mexicanos y el 12.5% de los reptiles (Flores-Villela y García-Vázquez, 2014; Parra-Olea et al., 2014). Destacan los trabajos de Campbell (1999), Köhler (2008, 2011) y Lee (1996, 2000), cuyas revisiones a nivel regional (península de Yucatán y Mesoamérica) compilan información sobre distribución, taxonomía y ecología de la herpetofauna de la zona. Otros trabajos analizan algunos grupos taxonómicos en particular. Duellman (1970, 2001) realiza una descripción de las ranas arborícolas (familia Hylidae) de Mesoamérica, registrando 10 especies para las distintas regiones de la cuenca, especialmente para la parte baja. Por su parte, Campbell et al. (2004) en su trabajo sobre los reptiles venenosos de América, reportan 7 especies (3 de la familia Elaphidae y 4 de la Viperidae). Legler y Vogt (2013) registran 9 especies de tortugas, todas ampliamente distribuidas a lo largo de la cuenca, 8 de ellas dulceacuícolas: Dermatemys mawii, Claudius angustatus, Staurotypus triporcatus, Kinosternon scorpioides, Kinosternon acutum, Kinosternon leucostomum, Trachemys venusta y Chelydra rosiignonii y una especie terrestre, Rhinoclemmys areolata.
Un bajo porcentaje de los trabajos realizados dentro de la región son estudios herpetofaunísticos locales (10%). Barragán-Vázquez (2007) realiza un análisis ecológico de la comunidad herpetofaunística de la sierra de Boca del Cerro, cerca de Tenosique, Tabasco. Este trabajo registra, entre septiembre de 2001 a agosto de 2002, un total de 414 individuos pertenecientes a 38 especies (12 anfibios y 26 reptiles), indicando que la riqueza (27 especies), la abundancia específica (307 individuos) y la diversidad (H' = 2.28) fueron mayores en los hábitats conformados por acahuales. Otro estudio describe y analiza la diversidad alfa del Monumento Natural de Yaxchilán (Ferreira-García y Canseco-Márquez, 2006), reportando 55 especies (14 anfibios y 41 reptiles); los autores reportan que la mayoría de los anfibios y reptiles de la zona ocuparon el microhábitat terrestre (35 especies), mientras que 18 especies prefirieron el microhábitat arborícola, 8 son saxícolas (de hábitos enterradores), 6 dulceacuícolas y 4 riparias.
Hernández-Ordoñez et al. (2014, 2015) sistematizaron la información sobre los anfibios y reptiles de la región Lacandona, ubicada en la parte media de la cuenca, registrando 125 especies (90 reptiles y 35 anfibios), especificando que 9 anfibios (25.7%) y 3 reptiles (2.2%) son endémicos a la selva Lacandona y que hasta la fecha, 4 anfibios y 3 reptiles están restringidos al área de Montes Azules. Asimismo, González-Hernández et al. (2014) amplían la distribución de Gymnopis syntrema y Hernández-Ordóñez et al. (2017) de Craugastor psephosypharu para la cuenca y para México. Otros trabajos se enfocan a la descripción taxonómica o sitios de registro de algún grupo o especie en particular (Bezy, 1984; Duellman y Trub, 1966; Kofron, 1990; Myers, 1974).
Al comparar la cantidad de estudios que se han realizado en la cuenca del Usumacinta, encontramos que existe un mayor número de trabajos en la parte media de la misma (Lacandona, Yaxchilán y Márquez de Comillas), ya que en esta zona se ha realizado aproximadamente el 80% de los estudios, destacando las investigaciones dentro de la región Lacandona y la Reserva de la Biosfera Montes Azules (Hernández-Ordoñez et al., 2014, 2015, 2017; Lazcano-Barrero et al., 1992; Ochoa-Ochoa y Whittaker, 2014; Shreve, 1957). Otro aspecto importante es que el 90% de los trabajos se enfoca a los anfibios y reptiles terrestres, es decir, a aquellos que habitan en las zonas de bosque dentro de la cuenca del Usumacinta, pero pocos estudios se han encaminado a estudiar grupos que habitan en zonas riparias o inundables, como son las tortugas dulceacuícolas, los cocodrilianos y el grupo de los anuros, cuya función es esencial en la dinámica hidrológica de la cuenca y en las redes tróficas de estos ecosistemas en particular.
Tomando en cuenta la riqueza de especies reportada, el conocimiento generado dentro de la zona de estudio y las particularidades ecológicas de ciertos grupos de especies importantes en el ecosistema, en este trabajo se planteó ampliar el conocimiento de la herpetofauna dentro del área de influencia del río Usumacinta, estudiando la zonas donde existen vacíos de información y comparando la diversidad y composición de anfibios y reptiles en 3 zonas de la cuenca (costa, lagunas y selva), con el fin de establecer si existen diferencias en la composición y en la diversidad a lo largo de la misma.
Materiales y métodos
El estudio se realizó a lo largo del área de influencia del río Usumacinta, desde los Pantanos de Centla, Tabasco hasta la comunidad de Benemérito de las Américas, Chiapas, y del río Lacantún, desde su unión con el río Usumacinta al ejido de Chajul, Chiapas. El área de influencia se definió desde los márgenes de ambos ríos hasta 30 km tierra adentro y cuando el río Usumacinta hace frontera con Guatemala, se consideró exclusivamente el lado mexicano (Fig. 1). Las coordenadas extremas de la zona de estudio son: 18º31’58” N, 92º39’01” O - 16º15’15” N, 90º51’35” O. Se dividió en 3 zonas: 1) costa, abarca el delta del Usumacinta, desde la localidad de Frontera, Tabasco, hasta la comunidad de Carrizal, Tabasco (18º31’58” N, 92º39’01” O - 17º56’08” N, 91º47’39” O); 2) lagunas, zona ubicada desde Emiliano Zapata, Tabasco, a los límites con Guatemala (17º 49’42” N, 91º47’23” O - 17º15’52” N, 91º 5’49” O) y 3) selva, desde el Omega de Yaxchilán a Chajul, Chiapas, al sur y sureste de la Reserva de la Biosfera de Montes Azules (16º52’17” N, 90º59’38” O - 16º15’15” N, 90º51’35” O).

Figura 1 Localización de la zona de estudio indicando los registros históricos y actuales, así como las zonas de muestreo.
Las 3 zonas presentan características ambientales distintas. La zona costa presenta una altitud promedio de 10 m snm (0-20 m snm), predominando los climas cálidos subhúmedos con lluvias en verano (Aw) y cálidos húmedos con lluvias en verano (Amw y Am(f)), con temperaturas medias anuales de 25.4-26.5 ºC y precipitaciones medias anuales desde 1,422 a 1,800 mm (Semarnat, 2000a). Fisiográficamente, las topoformas dominantes son las llanuras fluvio palustres (71% del área) y las llanuras fluviales (18%). Los tipos de vegetación mejor representados son las comunidades hidrófitas (asociaciones hidrófitas emergentes, vegetación hidrófita flotante y vegetación sumergida), ocupando casi el 70% del área, le siguen los cultivos y potreros con el 16%, la selva mediana subperenifolia (7%) y los manglares ocupando el 2% del territorio (Semarnat, 2000a).
La zona lagunas se encuentra en altitudes que oscilan entre los 20 y 350 m snm y se divide en 2 áreas ambientalmente distintas. En la zona norte existen numerosas lagunas, áreas sujetas a inundaciones temporales y llanuras fluviales a lo largo del río San Pedro, así como topoformas del tipo lomeríos, cubiertas con grandes extensiones de pastizales (Estrada-Loreto et al., 2013; Inegi, 2017); en la parte sur, se presenta una sierra llamada Boca del Cerro que pertenece a la provincia fisiográfica de las Sierras Bajas del Petén (Barragán-Vázquez, 2007). El clima es de tipo Am(f) y Af, que corresponde a los cálidos húmedos con abundantes lluvias en verano y cálido húmedo con lluvias todo el año, la temperatura media anual es de 24-26.8 ºC y la precipitación media anual es de 2,376 mm (Inegi, 2017).
La zona selva presenta variaciones altitudinales que van desde los 150 a los 650 m snm, fisiográficamente imperan las sierras altas plegadas y la llanura aluviales. En esta zona, las precipitaciones pueden llegar a los 3,500 mm al año en algunos sitios (Semarnat, 2000b); sin embargo, la precipitación media anual varía: en Yaxchilán es de 1,950 mm (Meave et al., 2008) y en Montes Azules de 2,226 mm (Semarnat, 2000b). El clima predominante es cálido húmedo del tipo Am y Af(m), con una temperatura promedio anual entre 24 a 26 ºC (Meave et al., 2008; Semarnat, 2000b). La mayoría del área está cubierta por selva alta perennifolia y selva mediana subperennifolia, y a los lados de los ríos Usumacinta y Lacantún existe una franja de vegetación riparia con numerosos jimbales intercalados. Al este del río Lacantún se presentan grandes extensiones de pastizales inducidos y zonas de cultivo, con algunos manchones de selva mediana (Semarnat, 2000b).
Se evaluó el grado de conocimiento de los anfibios y reptiles de la cuenca del río Usumacinta a través de la búsqueda de los registros de distribución disponibles en la base de datos del Sistema de Nacional Información sobre Biodiversidad (SNIB) de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio). Adicionalmente, se incluyeron los registros provenientes de la repatriación de información de colecciones científicas nacionales e internacionales (March y Muñoz, 1998; Muñoz, 2006), así como los registros de la Colección de Anfibios y Reptiles de la Universidad Juárez Autónoma de Tabasco y los registros provenientes de la revisión de literatura científica que incluía información sobre estos taxones para la zona de estudio (Barragán-Vázquez, 2007; Campbell y Lamar, 2004; Ferreira-García y Canseco-Márquez, 2006; González-Hernández et al., 2014; Hernández-Ordoñez et al., 2014, 2015, 2017; Köhler, 2008, 2011; Lee, 1996, 2000; Legler y Vogt, 2013; Ochoa-Ochoa y Whittaker, 2014). Todos los registros fueron actualizados a los nombres taxonómicos válidos para evitar la duplicación de registros y con ello evitar que datos de riqueza y frecuencia fueran sobreestimados debido a las sinonimias. Para la actualización taxonómica, se utilizó la clasificación de Amphibian Species of the World de Frost (2016), para el grupo de los anfibios y la clasificación de The Reptiles Database de Uetz et al. (2016), para los reptiles. Después de los procesos de depuración y actualización de la base de datos, ésta quedo constituida por 3,275 registros, correspondientes a 1,520 ejemplares para anfibios y 1,755 para reptiles.
La revisión geográfica de los registros de anfibios y reptiles de la base de datos del SNIB y de la revisión de la literatura especializada reveló 3 zonas con vacíos de información. La primera de ellas se ubica en la parte baja de la cuenca, en la zona conocida como Pantanos de Centla, la cual se caracteriza por ser un delta conformado por lagunas, pantanos y zonas inundables perennes e intermitentes, donde la vegetación predominante pertenece a las comunidades vegetales del tipo hidrófilas ocupando casi el 70% de los pantanos (Semarnat, 2000a). La segunda zona se localiza en Tenosique y Emiliano Zapata, al sureste de Tabasco y está conformada por un sistema de lagunas permanente, las cuales se interconectan durante la época de lluvias por el crecimiento y desborde de ríos. Los tipos de vegetación predominantes son la vegetación hidrófila combinada con selvas medianas y altas perennifolias; asimismo, es una región extremadamente fragmentada, con abundantes potreros y pastizales (Barragán-Vázquez, 2007). La tercera zona se ubica en la selva Lacandona a pesar de ser la región más estudiada desde el punto de vista faunístico; es muy extensa, presentando vacíos de información en algunas regiones, como el sitio donde confluyen los ríos Lacantún y Usumacinta, así como la parte sur de la reserva de Montes Azules, donde predominan las selvas altas perennifolias en buen estado de conservación (Hernández-Ordoñez et al., 2014). Estas zonas con vacíos de información fueron las que se visitaron durante el trabajo de campo para ampliar el conocimiento de la herpetofauna del área de estudio.
Se realizaron muestreos periódicos durante 15 meses, de agosto del 2014 a octubre del 2015, en las áreas donde se detectaron vacíos de información. En total, se ejecutaron 11 campañas de muestreo (Tabla 1): 4 en la zona costa, 4 en la zona lagunas y 3 en la zona selva. En cada zona se establecieron 3 transectos de muestreo tratando de abarcar los hábitats, tipos de vegetación y usos del suelo más representativos de cada zona de estudio. Cada uno de los transectos fue muestreado durante 2 días en la misma salida de campo. Se aplicó, en promedio, un esfuerzo de muestreo de 8 días por transecto, 24 días por zona y 72 días para toda la región de estudio. Para la captura y registro de anuros, lagartijas y serpientes se utilizó la técnica de transectos de registro de encuentros visuales (REV) recomendada por Lips et al. (2001) y Foster (2012); adicionalmente, para los anuros se realizaron inventarios en sitios de apareamiento (ISA) de acuerdo con Zimmerman (1994). En los sitios en donde el número de ranas llegó a cientos o miles de individuos, la estimación de la abundancia se realizó a través de la extrapolación: contabilizando el número promedio de individuos dentro de 1 m2 (con 5 repeticiones) y después multiplicándolo por los metros totales del área de apareamiento.
Tabla 1 Listado de las campañas de muestreo, indicando zonas, mes y épocas del año.
| Zona | Estado | Localidad | Mes | Año | Época |
|---|---|---|---|---|---|
| Lagunas | Tabasco | Emiliano Zapata | Agosto | 2014 | Lluvias |
| Costa | Centla y Jonuta | Octubre | Secas | ||
| Lagunas | Tabasco y Chiapas | Tenosique y Palenque | Noviembre | ||
| Selva | Chiapas | Marqués de Comillas y Frontera Corozal | Febrero | 2015 | |
| Lagunas | Tabasco y Chiapas | Tenosique y Palenque | Abril | ||
| Costa | Tabasco | Centla | Mayo | ||
| Selva | Chiapas | Marqués de Comillas | Junio | Lluvias | |
| Costa | Tabasco | Macuspana | Julio | ||
| Centla y Jonuta | |||||
| Lagunas | Chiapas | Tenosique y Palenque | Agosto | ||
| Costa | Campeche | Palizada | |||
| Selva | Chiapas | Marqués de Comillas | Octubre |
En el caso de las tortugas, en cada transecto se estableció una estación de muestreo consistente en 2 trampas de desvío y 10 trampas tipo nasa, adicionalmente se aplicó la técnica de trampeo llamada mallador (Gibbons y Semlitsch, 1981; Vogt y Hine, 1982). Las trampas se instalaron en los ríos Usumacinta y Lacantún, así como en lagunas y zonas inundadas; se mantuvieron en el agua (activas) un promedio de 4 días de muestreo por salida, sumando un total de 2,738 horas/trampa para toda la región.
Para el muestreo de cocodrilos utilizamos el método de detección visual nocturna (DVN) recomendado por Sánchez et al. (2011); la técnica consistió en el encuentro directo de ejemplares, a través de la búsqueda nocturna del reflejo del “tapetum lucidum” de los ojos por un haz de luz (Cupul-Magaña, 2009; Sigler et al., 2002). El registro de cocodrilos se realizó sobre los ríos Usumacinta y Lacantún, en lagunas y pozas, a través de transectos con una extensión promedio de 4 km de longitud. En total el esfuerzo de muestreo fue de 39 km para toda la región.
Para la estimación de la diversidad alfa y beta utilizamos exclusivamente los registros obtenidos durante el trabajo de campo. La diversidad alfa se define como el número de especies (totales, comunes o dominantes) dentro de una muestra territorial o comunidad (Whittaker, 1960, 1972), pero en la práctica es difícil delimitar el territorio mínimo o máximo para evaluar la diversidad alfa, ya que depende del grupo taxonómico a estudiar (Arita y Rodríguez, 2002; Koleff et al., 2008; Rodríguez y Vázquez-Domínguez, 2003; Schmida y Wilson, 1985). Halffter y Moreno (2005) proponen que en hábitats homogéneos se podría medir la diversidad alfa puntual (DAP), que sería el número de especies que tiene una comunidad en un punto determinado, y en paisajes o regiones (zonas heterogénas) se podría cuantificar la diversidad alfa promedio (DAPO), definida como un promedio de valores puntuales correspondiente a diferentes sitios o lugares dentro de un paisaje ocupado por una misma comunidad.
En este trabajo cualculamos la DAPO de cada zona de estudio a través del DAP de cada sitio (transecto), estimando el número efectivo de especies (qD), conocido también como medidas de diversidad verdadera (Jost, 2006). Utilizamos valores de q = 1 (exponencial del índice de entropía de Shannon) que analiza a todas las especies con un peso exactamente proporcional a su abundancia dentro de una comunidad (Moreno et al., 2011). Para corregir el error de un posible submuestreo de las comunidades, los valores de 1D se compararon con base en la diversidad esperada bajo el modelo de Chao-Jost (Chao y Jost, 2015) con un intervalo de confianza al 95%. Los cálculos y estimaciones del número efectivo de especies se realizaron con el programa SpadeR (Chao et al., 2015). Para comparar la estructura de las comunidades de anuros y tortugas entre las diferentes zonas, se elaboraron curvas de rango-abundancia (Feinsinger, 2004). Para lo anterior, se transformaron los valores de la abundancia proporcional de cada especie (ni/N, donde ni es el número de individuos de una especie en particular y N es el número total de individuos dentro de toda la comunidad) a logaritmo base 10 y se graficaron de mayor a menor abundancia para cada zona de estudio (Cruz-Elizalde y Ramírez-Bautista, 2012; Magurran, 2004).
Con el fin de detectar los cambios en la composición de especies entre las diferentes zonas, se calculó la diversidad beta (expresada en grados de similitud faunística). Para ello, se empleó el coeficiente de similitud de Jaccard (Moreno, 2001; Sánchez y López, 1988); con base en la composición de especies se aplicaron técnicas de conglomerados que posteriormente se representaron mediante un dendrograma, utilizando el método de la media aritmética UPGMA como medida de distancia entre zonas. Los cálculos y el dendrograma se realizaron a través de Statistica versión 8 (Statsoft, 2007).
Resultados
En total se analizaron 8,808 registros (3,275 provenientes del SNIB y la revisión de la literatura y 5,533 del trabajo de campo), de los cuales 5,660 corresponden al grupo de los anfibios y 3,148 al de reptiles. Como resultado de la revisión de registros históricos y del muestreo de campo, en este trabajo se reportan 42 especies de anfibios y 110 de reptiles para la zona de influencia los ríos Usumacinta y Lacantún (Fig. 1; Tablas 2, 3).
Tabla 2 Composición y riqueza taxonómica de anfibios y reptiles del área de estudio. Entre paréntesis, nombres comunes de los grupos.
| Orden | Familias | Géneros | Especies |
|---|---|---|---|
| Gymnophiona (cecilias) | 1 | 2 | 2 |
| Urodela (salamandras) | 1 | 2 | 4 |
| Anura (ranas y sapos) | 10 | 20 | 36 |
| Subtotal de Amphibia | 12 | 24 | 42 |
| Crocodylia (cocodrilos y caimanes) | 1 | 1 | 1 |
| Sauria (lagartijas) | 12 | 20 | 41 |
| Serpentes (culebras y serpientes) | 7 | 42 | 59 |
| Testudines (tortugas) | 5 | 7 | 9 |
| Subtotal de Reptilia | 25 | 70 | 110 |
| Total | 37 | 94 | 152 |
Tabla 3 Lista de especies de anfibios y reptiles registradas en la cuenca del Usumacinta. DD = datos deficientes; LC = preocupación menor; NT = casi en peligro; VU = vulnerable; CR = peligro crítico; Pr = protección especial; A = amenazada; P = en peligro.
| Grupo | Muestreo de campo | Histórico | Costa | Lagunas | Selva | IUCN | NOM-059 |
|---|---|---|---|---|---|---|---|
| Amphibia | |||||||
| Anura | |||||||
| Bufonidae | |||||||
| Incilius campbelli (Mendelson, 1994) | X | X | NT | ||||
| Incilius macrocristatus (Firschein y Smith, 1957) | X | X | X | VU | |||
| Incilius valliceps (Wiegmann, 1833) | X | X | X | X | X | LC | |
| Rhinella marina (Linnaeus, 1758) | X | X | X | X | X | LC | |
| Centrolenidae | |||||||
| Hyalinobatrachium fleischmanni (Boettger, 1893) | X | X | X | X | X | LC | |
| Craugastoridae | |||||||
| Craugastor alfredi (Boulenger, 1898) | X | X | X | X | VU | ||
| Craugastor campbelli (Smith, 2005) | X | X | DD | ||||
| Craugastor laticeps (Duméril, 1853) | X | X | X | NT | Pr | ||
| Craugastor loki (Shannon y Werler, 1955) | X | X | X | X | LC | ||
| Craugastor palenque (Campbell y Savage, 2000) | X | X | X | DD | |||
| Craugastor psephosypharus (Campbell, Savage y Meyer, 1994) | X | X | VU | ||||
| Craugastor sp. | X | X | |||||
| Eleutherodactylidae | |||||||
| Eleutherodactylus leprus (Cope, 1879) | X | X | VU | ||||
| Hylidae | |||||||
| Bromeliohyla bromeliacia (Schmidt. 1933) | X | X | LC | ||||
| Dendropsophus ebraccatus (Cope, 1874) | X | X | X | X | LC | ||
| Dendropsophus microcephalus (Cope, 1886) | X | X | X | X | X | LC | |
| Ptychohyla macrotympanum (Tanner, 1957) | X | X | CR | ||||
| Ptychohyla sp | X | X | |||||
| Scinax staufferi (Cope, 1865) | X | X | X | X | X | LC | |
| Smilisca baudinii (Duméril y Bibron, 1841) | X | X | X | X | X | LC | |
| Smilisca cyanosticta (Smith, 1953) | X | X | NT | ||||
| Tlalocohyla loquax (Gaige y Stuart, 1934) | X | X | X | X | X | LC | |
| Tlalocohyla picta (Günther, 1901) | X | X | X | X | X | LC | |
| Trachycephalus typhonius (Linnaeus, 1758) | X | X | X | X | X | LC | |
| Triprion petasatus (Cope, 1865) | X | X | X | X | LC | Pr | |
| Leptodactylidae | |||||||
| Engystomops pustulosus (Cope, 1864) | X | X | X | X | LC | ||
| Leptodactylus fragilis (Brocchi, 1877) | X | X | X | X | X | LC | |
| Leptodactylus melanonotus (Hallowell, 1861) | X | X | X | X | X | LC | |
| Microhylidae | |||||||
| Gastrophryne elegans (Boulenger, 1882) | X | X | X | LC | Pr | ||
| Hypopachus variolosus (Cope, 1866) | X | X | X | X | X | LC | |
| Phyllomedusidae | |||||||
| Agalychnis callidryas (Cope, 1862) | X | X | X | X | X | LC | |
| Agalychnis moreletii (Duméril, 1853) | X | X | LC | ||||
| Ranidae | |||||||
| Lithobates brownorum (Sanders, 1973) | X | X | X | X | X | LC | Pr |
| Lithobates maculatus (Brocchi, 1877) | X | X | X | X | LC | ||
| Lithobates vaillanti (Brocchi, 1877) | X | X | X | X | X | LC | |
| Rhinophrynidae | |||||||
| Rhinophrynus dorsalis Duméril y Bibron, 1841 | X | X | X | X | LC | Pr | |
| Caudata | |||||||
| Plethodontidae | |||||||
| Bolitoglossa mexicana Duméril, Bibron y Duméril, 1854 | X | X | X | X | LC | Pr | |
| Bolitoglossa mulleri (Brocchi, 1883) | X | X | VU | ||||
| Bolitoglossa rufescens (Cope, 1869) | X | X | X | LC | Pr | ||
| Oedipina elongata (Schmidt, 1936) | X | X | LC | Pr | |||
| Gymnophiona | |||||||
| Dermophiidae | |||||||
| Dermophis mexicanus (Duméril y Bibron, 1841) | X | X | X | VU | Pr | ||
| Gymnopis syntrema (Cope, 1866) | X | X | DD | ||||
| Reptilia | |||||||
| Crocodylia | |||||||
| Crocodylidae | |||||||
| Crocodylus moreletii (Duméril y Bibron, 1851) | X | X | X | X | X | LC | Pr |
| Sauria | |||||||
| Anguidae | |||||||
| Celestus rozellae (Smith, 1942) | X | X | X | X | LC | Pr | |
| Corytophanidae | |||||||
| Basiliscus vittatus Wiegmann, 1828 | X | X | X | X | X | LC | |
| Corytophanes cristatus (Merrem, 1820) | X | X | X | X | LC | Pr | |
| Corytophanes hernandesii (Wiegmann, 1831) | X | X | X | LC | Pr | ||
| Laemanctus longipes Wiegmann, 1834 | X | X | X | X | LC | Pr | |
| Dactyloidae | |||||||
| Anolis biporcatus (Wiegmann, 1834) | X | X | X | X | X | Pr | |
| Anolis capito Peters, 1863 | X | X | X | X | |||
| Anolis dollfusianus Bocourt, 1873 | X | X | |||||
| Anolis laeviventris (Wiegmann, 1834) | X | X | |||||
| Anolis lemurinus Cope, 1861 | X | X | X | X | X | ||
| Anolis pentaprion Cope 1863 | X | X | X | Pr | |||
| Anolis petersii Bocourt, 1873 | X | X | |||||
| Anolis rodriguezii Bocourt, 1873 | X | X | X | X | X | ||
| Anolis sagrei Duméril y Bibron, 1873 | X | X | X | ||||
| Anolis sp. | X | X | X | ||||
| Anolis tropidonotus Peters, 1863 | X | X | X | X | |||
| Anolis unilobatus Hallowell, 1856 | X | X | X | X | X | ||
| Anolis uniformis Cope, 1885 | X | X | X | X | |||
| Eublepharidae | |||||||
| Coleonyx elegans Gray, 1845 | X | X | X | X | LC | A | |
| Gekkonidae | |||||||
| Gehyra mutilata (Wiegmann, 1834) | X | X | |||||
| Hemidactylus frenatus Duméril y Bibron, 1836 | X | X | X | X | X | ||
| Hemidactylus turcicus (Linnaeus, 1758) | X | X | |||||
| Iguanidae | |||||||
| Ctenosaura similis (Gray, 1831) | X | X | X | X | X | LC | A |
| Iguana iguana (Linnaeus, 1758) | X | X | X | X | X | LC | Pr |
| Phrynosomatidae | |||||||
| Sceloporus chrysostictus Cope, 1866 | X | X | X | X | LC | ||
| Sceloporus serrifer Cope, 1866 | X | X | X | X | LC | ||
| Sceloporus siniferus Cope, 1870 | X | X | LC | ||||
| Sceloporus teapensis Günther, 1890 | X | X | X | X | LC | ||
| Sceloporus variabilis Wiegmann, 1834 | X | X | X | X | LC | ||
| Phyllodactylidae | |||||||
| Thecadactylus rapicauda (Houttuyn, 1782) | X | X | X | Pr | |||
| Scincidae | |||||||
| Marisora brachypoda (Cope, 1862) | X | X | X | X | X | LC | |
| Mesoscincus schwartzei (Fischer, 1884) | X | X | X | X | LC | ||
| Plestiodon sumichrasti Cope, 1867 | X | X | X | X | LC | ||
| Sphenomorphus assatus (Cope, 1864) | X | X | X | LC | |||
| Sphenomorphus cherriei (Cope, 1893) | X | X | X | X | LC | ||
| Sphaerodactylidae | |||||||
| Sphaerodactylus glaucus Cope, 1866 | X | X | X | X | X | LC | Pr |
| Sphaerodactylus millepunctatus Hallowell, 1861 | X | X | X | X | X | LC | |
| Teiidae | |||||||
| Aspidoscelis deppii (Wiengmann, 1834) | X | X | X | X | LC | ||
| Holcosus festivus (Lichtenstein, 1856) | X | X | X | X | X | LC | |
| Holcosus undulatus (Wiegmann, 1834) | X | X | X | X | X | LC | |
| Xantusiidae | |||||||
| Lepidophyma flavimaculatum Dúmeril, 1851 | X | X | X | X | LC | Pr | |
| Serpentes | |||||||
| Boidae | |||||||
| Boa constrictor Linnaeus, 1758 | X | X | X | X | X | A | |
| Colubridae | |||||||
| Amastridium sapperi (Werner, 1903) | X | X | LC | ||||
| Coluber mentovarius (Duméril, Bibron y Duméril, 1854) | X | X | X | X | X | LC | |
| Drymarchon melanurus (Duméril, Bibron y Duméril, 1854) | X | X | X | X | X | LC | |
| Drymobius margaritiferus (Schlegel, 1837) | X | X | X | X | X | LC | |
| Ficimia publia Cope, 1866 | X | X | X | LC | |||
| Lampropeltis triangulum (Lacépède, 1789) | X | X | X | A | |||
| Leptophis ahaetulla (Linnaeus, 1758) | X | X | X | X | A | ||
| Leptophis diplotropis (Günther, 1872) | X | X | X | LC | A | ||
| Leptophis mexicanus Duméril, Bibron y Duméril, 1854 | X | X | X | X | X | LC | A |
| Mastigodryas melanolomus (Cope, 1868) | X | X | LC | ||||
| Oxybelis aeneus (Wagler, 1824) | X | X | X | ||||
| Oxybelis fulgidus (Duadin, 1803) | X | X | X | ||||
| Phrynonax poecilonotus (Günther, 1858) | X | X | X | X | X | LC | |
| Pseudelaphe flavirufa (Cope, 1866) | X | X | LC | ||||
| Senticolis triaspis (Cope, 1866) | X | X | LC | ||||
| Spilotes pullatus Linnaeus, 1758 | X | X | X | X | X | ||
| Stenorrhina degenhardtii (Berthold, 1846) | X | X | LC | ||||
| Stenorrhina freminvillei (Duméril, Bribon,y Duméril, 1854) | X | X | LC | ||||
| Tantilla schistosa Bocourt, 1883) | X | X | |||||
| Tantilla rubra Cope, 1875 | X | X | LC | Pr | |||
| Tantillita lintoni (Smith, 1940) | X | X | LC | Pr | |||
| Dipsadidae | |||||||
| Adelphicos quadrivirgatum Jan, 1862 | X | X | X | LC | Pr | ||
| Clelia clelia (Duadin, 1803) | X | X | X | LC | |||
| Coniophanes bipunctatus (Günther, 1858) | X | X | X | X | X | LC | |
| Coniophanes fissidens (Günther, 1858) | X | X | X | X | LC | ||
| Coniophanes imperialis (Baird y Girard, 1859) | X | X | X | X | X | LC | |
| Coniophanes quinquevittatus (Duméril, Bibron y Duméril, 1854) | X | X | X | X | LC | ||
| Coniophanes schmidti Bailey, 1937 | X | X | X | X | LC | ||
| Conophis lineatus (Duméril, Bibron y Duméril, 1854) | X | X | X | LC | |||
| Geophis carinosus Stuart, 1941 | X | X | X | X | LC | ||
| Imantodes cenchoa Linnaeus, 1758 | X | X | X | Pr | |||
| Imantodes gemmistratus (Cope, 1861) | X | X | X | LC | Pr | ||
| Leptodeira frenata (Cope, 1866) | X | X | X | X | LC | ||
| Leptodeira septentrionalis (Kennicott, 1859) | X | X | LC | ||||
| Leptodeira splendida Günther, 1895 | X | X | LC | ||||
| Ninia diademata Baird y Girard, 1853 | X | X | LC | ||||
| Ninia sebae (Duméril, Bibron y Duméril, 1854) | X | X | X | X | X | LC | |
| Oxyrhopus petolarius (Linneaus, 1758) | X | X | |||||
| Pliocercus elapoides Cope, 1860 | X | X | X | LC | |||
| Rhadinaea decorata (Günther, 1858) | X | X | X | LC | |||
| Sibon dimidiatus (Günther, 1872) | X | X | LC | ||||
| Sibon nebulatus (Linnaeus, 1758) | X | X | X | ||||
| Tretanorhinus nigroluteus Cope, 1861 | X | X | LC | ||||
| Tropidodipsas sartorii Cope, 1863 | X | X | X | LC | |||
| Xenodon rabdocephalus (Wied-Neuwied, 1824) | X | X | |||||
| Elapidae | |||||||
| Micrurus diastema (Duméril, Bibron y Duméril, 1854) | X | X | X | LC | Pr | ||
| Micrurus elegans Jan, 1858 | X | X | LC | ||||
| Natricidae | |||||||
| Nerodia rhombifer (Hallowell, 1852) | X | X | X | X | LC | ||
| Thamnophis cyrtopsis (Jan, 1863) | X | X | LC | A | |||
| Thamnophis marcianus (Baird y Girad, 1853) | X | X | X | X | X | LC | A |
| Thamnophis proximus (Say, 1823) | X | X | X | X | LC | A | |
| Thamnophis sumichrasti (Cope, 1866) | X | X | LC | A | |||
| Sibynophiidae | |||||||
| Scaphiodontophis annulatus (Duméril, Bibron y Duméril, 1854) | X | X | X | LC | |||
| Viperidae | |||||||
| Atropoides mexicanus (Duméril, Bibron y Duméril, 1854) | X | X | LC | A | |||
| Bothriechis schlegelii (Berthold, 1846) | X | X | |||||
| Bothrops asper (German, 1883) | X | X | X | X | X | ||
| Crotalus simus Latreille, 1801 | X | X | X | LC | Pr | ||
| Porthidium nasutum (Bocourt, 1868) | X | X | LC | Pr | |||
| Testudines | |||||||
| Chelydridae | |||||||
| Chelydra rossignonii (Bocourt, 1868) | X | X | X | X | VU | Pr | |
| Dermatemydidae | |||||||
| Dermatemys mawii Gray, 1847 | X | X | X | X | X | CR | P |
| Emydidae | |||||||
| Trachemys venusta (Gray, 1855) | X | X | X | X | X | Pr | |
| Geoemydidae | |||||||
| Rhinoclemmys areolata (Duméril, Bibron y Duméril, 1851) | X | X | X | X | X | NT | A |
| Kinosternidae | |||||||
| Claudius angustatus Cope, 1856 | X | X | X | X | NT | P | |
| Kinosternon acutum Gray, 1831 | X | X | X | X | X | NT | Pr |
| Kinosternon leucostomum (Duméril, Bibron y Duméril, 1851) | X | X | X | X | X | Pr | |
| Kinosternon scorpioides (Linnaeus, 1766) | X | X | Pr | ||||
| Staurotypus triporcatus (Wiegmann, 1828) | X | X | X | X | X | NT | A |
| Número total de Anfibios | 25 | 38 | 20 | 29 | 29 | 40 | 9 |
| Número total de Reptiles | 61 | 108 | 46 | 79 | 97 | 77 | 40 |
| Número total de especies | 86 | 146 | 66 | 108 | 136 | 117 | 49 |
El grupo más diverso fue el orden Serpentes con 59 especies, conformando el 38.3% del total de la herpetofauna; dentro de este orden, las familias Dipsadidae y Colubridae (serpientes no venenosas) fueron las mayormente representadas con el 15.6 y 13.6% (24 y 21 especies). Las lagartijas conforman el segundo grupo con 41 especies (26.6%), siendo el género Anolis (familia Dactyloidae) el más diverso con 13 especies (8.4%). En tercer lugar está el orden Anura (ranas y sapos) con una representatividad del 23.4% (36 especies), sobresaliendo la familia Hylidae dentro de la región de estudio con el 7.8% (12 especies). Las tortugas representan el 5.8% de la herpetofauna, con 9 especies (Tabla 4).
Tabla 4 Diversidad taxonómica de la herpetofauna de la zona de estudio.
| Grupo taxonómico | Núm. de especies | % respecto a la clase | % respecto a la herpetofauna |
|---|---|---|---|
| Amphibia | 42 | 27.3 | |
| Anura | 36 | 85.7 | 23.4 |
| Bufonidae | 4 | 9.5 | 2.6 |
| Centrolenidae | 1 | 2.4 | 0.6 |
| Craugastoridae | 7 | 16.7 | 4.5 |
| Eleutherodactylidae | 1 | 2.4 | 0.6 |
| Hylidae | 12 | 28.6 | 7.8 |
| Leptodactylidae | 3 | 7.1 | 1.9 |
| Microhylidae | 2 | 4.8 | 1.3 |
| Phyllomedusidae | 2 | 4.8 | 1.3 |
| Ranidae | 3 | 7.1 | 1.9 |
| Rhinophrynidae | 1 | 2.4 | 0.6 |
| Caudata | 4 | 9.5 | 2.6 |
| Plethodontidae | 4 | 9.5 | 2.6 |
| Gymnophiona | 2 | 4.8 | 1.3 |
| Dermophidae | 2 | 4.8 | 1.3 |
| Reptilia | 110 | 71.4 | |
| Crocodylia | 1 | 0.9 | 0.6 |
| Crocodylidae | 1 | 0.9 | 0.6 |
| Sauria | 41 | 36.6 | 26.6 |
| Anguidae | 1 | 0.9 | 0.6 |
| Corytophanidae | 4 | 3.6 | 2.6 |
| Dactyloidae | 13 | 11.6 | 8.4 |
| Eublepharidae | 1 | 0.9 | 0.6 |
| Gekkonidae | 3 | 2.7 | 1.9 |
| Iguanidae | 2 | 1.8 | 1.3 |
| Phrynosomatidae | 5 | 4.5 | 3.2 |
| Phyllodactylidae | 1 | 0.9 | 0.6 |
| Scincidae | 5 | 4.5 | 3.2 |
| Sphaerodactylidae | 2 | 1.8 | 1.3 |
| Teiidae | 3 | 2.7 | 1.9 |
| Xantusiidae | 1 | 0.9 | 0.6 |
| Serpentes | 59 | 52.7 | 38.3 |
| Boidae | 1 | 0.9 | 0.6 |
| Colubridae | 21 | 18.9 | 13.6 |
| Dipsadidae | 24 | 21.6 | 15.6 |
| Elapidae | 2 | 1.8 | 1.3 |
| Natricidae | 5 | 4.5 | 3.2 |
| Sibynophiidae | 1 | 0.9 | 0.6 |
| Viperidae | 5 | 4.5 | 3.2 |
| Testudines | 9 | 8.0 | 5.8 |
| Chelydridae | 1 | 0.9 | 0.6 |
| Dermatemydidae | 1 | 0.9 | 0.6 |
| Emydidae | 1 | 0.9 | 0.6 |
| Geoemydidae | 1 | 0.9 | 0.6 |
| Kinosternidae | 5 | 4.5 | 3.2 |
De acuerdo a la lista roja de especies amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2012, 2018), en el área de estudio se encuentran 9 especies en alguna categoría de amenaza (5.9% de la herpetofauna). D. mawii y Ptychohyla macrotympanum están consideradas como en peligro crítico (CR) e Incilius macrocristatus, Craugastor alfredi, Craugastor psephosypharus, Eleutherodactylus leprus, Bolitoglossa mulleri, Dermophis mexicanus y C. rossignonii, bajo el estatus de vulnerable (VU). Las demás especies no presentan problemas de conservación: 98 especies están consideradas como de preocupación menor (LC) y 7 casi amenazadas (NT). Por su parte, la Semarnat (2010) considera que el 31.5% de las especies (48) se encuentran bajo alguna categoría de protección del gobierno mexicano (Tabla 3), estando 32 especies sujetas a protección especial (Pr), 14 amenazadas (A) y 2 en peligro de extinción (P).
El análisis faunístico por zona indicó que la de selva es la más rica en especies, en ella se han registrado 136 especies: 39 anfibios y 97 reptiles, siguiéndole la zona lagunas con 108 especies (29 anfibios y 79 reptiles) y por último el área menos rica es la zona costa, con 20 anfibios y 46 reptiles registrados (66 en total).
Los resultados de los valores del número efectivo de especies (Fig. 2), indican que existen diferencias significativas (al 95% de confianza) entre las diversidades de la zona selva con un valor de 1D = 11.63 ± 1.64 con las zona lagunas (1D = 20.98 ± 3.35) y costa (1D = 16.01 ± 2.35); sin embargo, no se presentan diferencias significativas entre las diversidades de las zonas lagunas y costa.

Figura 2 Diversidad estimada (1D) de la herpetofauna en las distintas zonas estudiadas dentro de la cuenca de Usumacinta. Las barras de error son intervalos de confianza al 95%.
El análisis de similitud entre las zonas focales nos indicó que las 3 zonas son diferentes en su composición herpetofaunística. Las menores similitudes se presentan entre costa y selva (38.0% de similitud), mientras que costa y lagunas comparten menos de la mitad de las especies (47.8% de similitud), la composición de anfibios y reptiles entre selva y lagunas son las más similares con un 62.4% de similitud (Fig. 3).
En la zona de estudio se registraron 5,544 individuos de anuros pertenecientes a 36 especies. El grupo más diverso fue el de las ranas arborícolas (familia Hylidae) con 12 especies, mientras que el segundo gremio mejor representado correspondió a las ranas de hojarasca (familia Craugastoridae) con 7 especies, seguido por los sapos de la familia Bufonidae con 4 taxones. Los otros grupos contienen de 1 a 3 anuros diferentes (Tabla 4).
Por otra parte, 10 especies dominan la comunidad de anfibios del Usumacinta, debido a que sus abundancias relativas suman el 81.1% del total (Fig. 4). Las especies más abundantes fueron: S. baudinii (3,067 individuos), Dendropsophus microcephalus (444 individuos), Leptodactylus fragilis (249 individuos), Incilius valliceps (226 individuos) y Rhinella marina (190 individuos). Las zonas selva y lagunas presentan la mayor riqueza con 33 y 26 especies respectivamente, mientras que la zona costa presentó 20 anuros. Las especies dominantes cambian en cada zona de estudio: D. microcephalus, Lithobates brownorum, L. fragilis, Leptodactylus melanonotus y R. marina abundaron en costa, R. marina, D. microcephalus, I. valliceps, Tlalocohyla loquax y S. baudinii en la zona lagunas, y en selva predominaron: S. baudinii, D. microcephalus, I. valliceps, L. fragilis y Scinax staufferi (Fig. 5).

Figura 4 Distribución de las abundancias de los anuros en la cuenca del Usumacinta. X = abundancia promedio. Sb = Smilisca baudinii; Dm = Dendropsophus microcephalus; Lf = Leptodactylus fragilis; Iv = Incilius valliceps; Rm = Rhinella marina; Lm = Leptodactylus melanonotus; Ss = Scinax staufferi; Lb = Lithobates brownorum; Tl = Tlalocohyla loquax; Lv = Lithobates vaillanti; Ac = Agalychnis callidryas; Tt = Trachycephalus typhonius; Ca = Craugastor alfredi; Tp = Tlalocohyla picta; Cl = Craugastor loki; Rd = Rhinophrynus dorsalis; Hf = Hyalinobatrachium fleischmanni; De = Dendropsophus ebraccatus; Im = Incilius macrocristatus; Cp = Craugastor palenque; Ge = Gastrophryne elegans; Ep = Engystomops pustulosus; Csp = Craugastor sp.; Lm = Lithobates maculatus; Hv = Hypopachus variolosus; Sc = Smilisca cyanosticta; Am = Agalychnis moreletii; Cc = Craugastor campbelli; Cl = Craugastor laticeps; Ic = Incilius campbelli; Pm = Ptychohyla macrotympanum; Tp = Triprion petasatus; Psp = Ptychohyla sp.; Cc = Craugastor campbelli; Bb = Bromeliohyla bromeliacia; Cps = Craugastor psephosypharus.

Figura 5 Curvas de rango-abundancia de la anurofauna en las zonas estudiadas dentro la cuenca del Usumacinta. Las claves de las especies se encuentran en la Figura 4.
Durante el estudio se registró un total de 9 especies de tortugas, pertenecientes a 4 familias y 6 géneros. Obteniendo con ello el 100% de la riqueza de tortugas reportadas para la cuenca del río Usumacinta. Las tortugas más abundantes fueron K. leucostomum (tortuga casquito) con 117 individuos y D. mawii (tortuga blanca) con 103 registros, mientras que C. rossignonii (tortuga lagarto), C. angustatus (chopontil), K. acutum (casquito) y K. scorpioides (pochitoque) fueron las especies menos abundantes, contribuyendo con tan solo el 5.5% a la abundancia total. La abundancia relativa de cada una de las especies cambia entre las zonas estudiadas; en la selva se registró la mayor cantidad de individuos totales y D. mawii fue la dominante, mientras que en costa y lagunas, K. leucostomum y T. venusta presentan las mayores abundancias relativas. En cuanto a riqueza de especies, las regiones costa y lagunas presentaron 8 de las 9 tortugas registradas, en cambio la riqueza de la selva se restringe a 6 especies (Fig. 6).
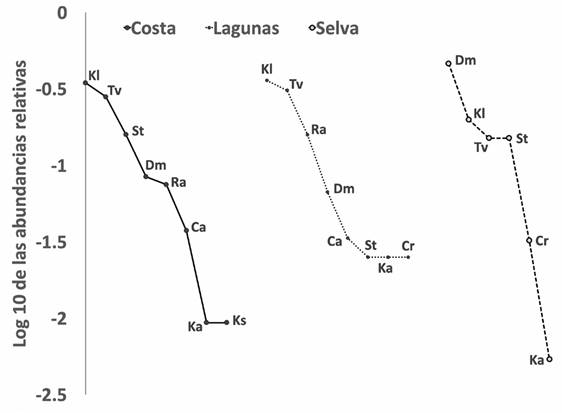
Figura 6 Curvas de rango-abundancia donde se compara la composición, riqueza y abundancia de las tortugas dulceacuícolas en las distintas zonas de la cuenca del Usumacinta. Kl = Kinosternon leucostomum; Dm = Dermatemys mawii; Tv = Trachemys venusta; St = Staurotypus triporcatus; Ra = Rhinoclemmys areolata; Cr = Chelydra rossignonii; Ca = Claudius angustatus; Ka = Kinosternon acutum; Ks = Kinosternon scorpioides.
Se registró una especie de cocodriliano, Crocodylus moreletii y en total se contabilizaron 359 individuos durante el estudio. En la zona costa se registraron 154 cocodrilos, en la selva 108 y en la zona lagunas 97 ejemplares.
Discusión
En México se han registrado 381 especies de anfibios (Canseco-Márquez, Aguilar-López et al., 2017; Canseco-Márquez, Ramírez-González et al., 2017; González-Hernández et al., 2014; Hernández-Ordóñez et al., 2017; Parra-Olea et al., 2014; Sandoval-Comte et al., 2017) y 864 especies de reptiles (Flores-Villela y García-Vázquez, 2014). Si comparamos la riqueza total de la herpetofauna de México, con el número de especies registradas en la zona de estudio (152 especies), encontramos que en la zona de influencia de los ríos Usumacinta y Lacantún está representado el 11.2% de los anfibios mexicanos y el 12.7% de los reptiles (12.2% de la herpetofauna). Sin embargo, si comparamos la riqueza herpetofaunística registrada con aquella que solo se distribuye en el sureste de México (definida como la región al este del istmo de Tehuantepec; según Johnson et al., 2010), se ha documentado una diversidad regional del 34.9% de los anfibios y el 40.6% de los reptiles del sureste de México, implicando que la cuenca del Usumacinta contiene más de la tercera parte de la herpetofauna del sureste mexicano. Al comparar con otras regiones de igual importancia por la alta biodiversidad que contienen, resulta que presenta 10 especies más que la región de los Chimalapas (Canseco-Márquez y Pérez-Ramos, 1996; Navarro et al., 2008; Pineda, 2015), 15 especies menos que la herpetofauna de Belice (Stanfford et al., 2010) y representa el 80.7% de la riqueza herpetofaunística de toda la península de Yucatán (Lee, 2000).
Durante el trabajo de campo se encontró el 58.9% de las especies de herpetofauna registradas con anterioridad y se agregaron 5 a la lista de especies previamente documentadas; de éstas, 2 especies de anfibios de los géneros Ptychohyla y Craugastor probablemente pertenecen a especies no descritas, ya que no corresponden morfológicamente a ninguna de las registradas.
Por otra parte, no encontramos 16 especies de anfibios que anteriormente fueron registradas para la región (Tabla 3), destacando las del género Craugastor (ranas de hojarasca), las del género Bolitoglossa (salamandras) y 3 especies de la familia Hylidae (ranas arborícolas). Las especies no registradas corresponden a anfibios distribuidos en las áreas de Bonampak (300 m snm), Nahá (> 600 m snm) y Palenque (70 m snm), localidades ubicadas en los extremos de la región de estudio (Hernández et al., 2015; Hernández-Ordóñez et al., 2014; Ochoa-Ochoa y Whittaker, 2014). Para el caso de los reptiles, no fueron documentadas 50 especies de las previamente registradas en la literatura o en las bases de datos del SNIB. Las especies no registradas corresponden principalmente al grupo de las serpientes (36 especies) y las causas por las cuales no fueron registradas durante el trabajo de campo podrían ser: 1) que este grupo se caracteriza por ser demográficamente raro (Vitt y Caldwell, 2009) por lo que es necesario realizar mayor esfuerzo de muestreo para obtener una lista de especies relativamente completa y 2) porque tienen hábitos muy especializados (hipogeos, arborícolas, etc.), por consiguiente, son especies que necesitan técnicas de muestreo especializadas para ser registradas (Cruz-Elizalde y Ramírez-Bautista, 2012) y no fueron aplicadas en este estudio.
El análisis de la riqueza de anfibios y reptiles en la cuenca del Usumacinta indica que la diversidad se concentra en las zonas selva y lagunas y, por lo tanto, son las zonas más importantes desde el punto de vista faunístico dentro de la cuenca. La zona selva es más rica en especies (136 especies) pero la menos diversas (1D =11.63 ± 1.64), en cambio la zona lagunas presenta una riqueza intermedia (108 especies), pero es la zona con la mayor diversidad alfa (1D = 20.98 ± 3.35). Adicionalmente, las zonas selva y lagunas presentan una similitud herpetofaunística del 62.4%, que de acuerdo con Sánchez y López (1988) está muy cerca del punto de inflexión para considerarse faunas similares. La alta riqueza en selva se puede explicar porque es una zona con un mayor porcentaje de hábitats conservados. Según Hernández-Ordóñez et al. (2014), en México se presentan grandes extensiones de selva alta perennifolia, que están protegidas bajo diferentes esquemas de manejo por la Comisión Nacional de Áreas Naturales Protegidas (Conanp) y en Guatemala, la selva alta está protegida a través de la Reserva de la Biosfera de la Sierra del Lacandón. Otro aspecto que hay que considerar es que dentro de la zona selva se han realizado diversos estudios herpetofaunísticos (Ferreira-García y Canseco-Márquez, 2006; Hernández-Ordóñez et al., 2014; Lazcano-Barrero et al., 1992), por lo tanto, su diversidad está mejor documentada en relación con las otras zonas (el 94.6% de la riqueza de la zona selva fue reportada históricamente). Adicionalmente, nuestro estudio agregó 12 especies más al conocimiento faunístico de selva y de lagunas.
Desde el punto de vista de las poblaciones o comunidades del gremio de los anuros, sobresalen de nuevo las zonas selva y lagunas, debido a que presentan alta diversidad y abundancia de grupos (Fig. 5), predominando especies de las familias Hylidae (ranas arborícolas) y Craugastoridae (ranas de hojarasca) (Tabla 3), que son los grupos de anuros más diversos del mundo (Duellman, 1970; 2001; Faivovich et al., 2005; Frost, 2016). Una particularidad de las especies de hílidos que se distribuyen en la cuenca del Usumacinta es que son demográficamente abundantes y tienen amplia distribución en las tierras bajas del sureste de México (Duellman, 2001).
En el caso particular de S. baudinii (la especie más abundante), ésta conforma grandes grupos reproductivos, sumando miles de individuos en pequeñas charcas de menos de 1,500 m2. En la localidad de Reforma Agraria, Chiapas (zona selva), se registró una población reproductiva de aproximadamente 3,000 individuos en 2 noches de actividad. Asimismo, Muñoz (comunicación personal) registró una población de esta especie (de varios miles de individuos) cerca de Chajul, al sur de la Reserva de la Biosfera de Montes Azules. Lazcano-Barrero et al. (1992) también reportó a S. baudinii como una especie muy abundante en las localidades de Chajul, Ixcán y Lacanjá-Chansayab, sitios localizados dentro del área de estudio.
Si coincidimos con Sala et al. (1996), quienes afirman que las abundancias de las especies son un indicador de la importancia ecológica y funcional de los ecosistemas, entonces los gremios de los anuros son valiosos indicadores de calidad ambiental y de la salud del medio porque juegan múltiples papeles funcionales dentro de los ecosistemas acuáticos y terrestres. Desde el punto de vista ecológico, los anfibios desempeñan un papel importante, ya que prestan servicios en el ciclo de nutrientes y mantienen las cadenas tróficas en los ecosistemas (Wake y Blaustein, 1990, Young et al., 2004). La importancia en las redes tróficas de los anuros se ejemplifica en el trabajo de Poulin et al. (2001), donde encontraron que 45 especies de aves en un bosque húmedo se alimentan principalmente de ranas del género Craugastor. Asimismo, observaciones de campo indican que las serpientes del género Thamnophis y Leptodeira se alimentan exclusivamente de hílidos y ránidos durante la época lluviosa (Nieblas, 2017).
En el Usumacinta se distribuyen 9 de las 26 especies de tortugas dulceacuícolas que existen en México, lo que representa el 34.6% de la riqueza (Legler y Vogt, 2013), indicando la importancia de la cuenca para este grupo de reptiles. Además, conforme a Legler y Vogt (2013) las tortugas dulceacuícolas son el grupo de reptiles menos estudiados en México, tan solo existen 1,200 ejemplares en colecciones científicas.
Existen mínimas diferencias en la riqueza de especies entre las 3 zonas estudiadas; sin embargo, se encontró que 3 especies dominan la comunidad: K. leucostomum, T. venusta y D. mawii, presentando abundancias relativas similares de las 3 especies en las zonas costa y lagunas, pero en la zona selva la abundancia de D. mawii aumenta significativamente, indicando la importancia de la zona para esta última especie (Fig. 6).
Dermatemys mawii o tortuga blanca es la tortuga dulceacuícola más grande de México y se distribuye en la parte norte de Mesoamérica (sureste de México, Guatemala y Belice); sin embargo, es una de las 25 especies en mayor riesgo de desaparecer en el mundo (Rhodin et al., 2011; Zenteno-Ruiz et al., 2010), debido a que sus abundancias en la actualidad han decrecido dramáticamente. Juárez et al. (2009) registraron 271 ejemplares en 6 cuencas hidrológicas en Guatemala, encontrando la mayor abundancia en la cuenca alta del Usumacinta (133 individuos). Zenteno-Ruiz et al. (2010) únicamente obtuvieron 17 registros en la zona de Pantanos de Centla y Oliva (2012) registró 53 ejemplares en la cuenca del río Sarstún en Guatemala. A diferencia de los resultados obtenidos en los trabajos anteriormente mencionados, nuestro estudio reporta la mayor población de Dermatemys en los últimos 25 años para la cuenca del Usumacinta (86 individuos); además, encontramos una población de D. mawii dentro de la reserva de Montes Azules (zona selva) que corresponde a un linaje genéticamente diferente a las poblaciones de la parte baja de la cuenca (González-Porter et al., 2011; Martínez, 2017).
En general, no existen estudios sobre la estructura poblacional de D. mawii dentro de la zona de estudio, lo cual nos permitiría hacer comparaciones sobre las tendencias poblacionales a lo largo de las últimas décadas. Solamente Vogt y Flores-Villela (1992) trabajaron en el río Lacantún, donde reportaron 102 individuos, 15 machos, 47 hembras y 40 juveniles, destacando el alto porcentaje de juveniles. Vogt y Flores-Villela argumentan que la desproporción de juveniles fue resultado de la fuerte explotación a la que fue sometida en la década de los 80. Asimismo, Guichard-Romero (2006) realizó varios muestreos entre el 2002 y 2006, con la finalidad de estimar la situación de las poblaciones de tortuga blanca en el sureste de México, indicando que durante esos años solo pudo reportar una captura de Dermatemys para el río Tzendales y ningún registro para Tabasco.
Con respecto a los cocodrilianos, hay que destacar 2 aspectos importantes: primero, en la parte baja de la cuenca es donde se ha realizado la mayor cantidad de estudios poblacionales de Crocodylus moreletii, principalmente en los Pantanos de Centla (García-Grajales y López-Luna, 2010); segundo, son abundantes en toda la zona de estudio, y según King (1988), todos los cocodrilianos constituyen especies clave o funcionales en los ambientes acuáticos tropicales. Como depredadores tope son muy selectivos, controlan las poblaciones de especies abundantes y de esta manera aumentan los recursos para las especies menos abundantes (Botha, 2010; Mazotti et al, 2009). También intervienen en el ciclo de nutrientes de las redes tróficas en sistemas acuáticos; algunos estudios previos han demostrado que la presencia de cocodrilos en arroyos y lagos está relacionada con el aumento las concentraciones de calcio, fósforo, magnesio, potasio y sodio, en comparación con sitios donde han sido extirpados (Alcalá y Dy-Liacco, 1989; Botha, 2010; Vitt y Caldwell, 2009). Además, actúan como puente entre 2 ecosistemas, introduciendo nutrientes al medio acuático desde el terrestre o viceversa (Fittkau, 1970) y mantienen la biodiversidad de los humedales mediante la apertura de caminos y el mantenimiento de pozas profundas, las cuales son utilizadas por peces, otros reptiles, anfibios, aves e incluso algunos mamíferos; durante la sequía, estos refugios húmedos proporcionan microhábitats para organismos acuáticos pequeños (Alcalá y Dy-Liacco, 1989; Botha, 2010; García et al., 2010).
La cuenca del Usumacinta es una región importante por su riqueza y diversidad herpetofaunística; sin embargo, varias especies presentan problemas de conservación sobre todo los gremios de las tortugas dulceacuícolas y cocodrilianos. Sumado a lo anterior, la región presenta altas tasas de deforestación generando, a lo largo de los años, la disminución o modificación de los hábitats y microhábitats de estos vertebrados (Urbina-Cardona et al., 2006). Dentro del área de estudio, la deforestación está concentrada en la zona selva, que se caracteriza por ser la región más conservada de la cuenca del Usumacinta. Díaz-Gallego et al. (2008) mencionan que en México se pierden aproximadamente 500,000 hectáreas por año de selvas y bosques, y que la tasa de deforestación en el Corredor Mesoamericano (que incluye la parte media y alta de la cuenca del Usumacinta) fue de 0.8% anual entre 1980 y 2000. Al utilizar esta tasa de deforestación para la cuenca del Usumacinta en México, en los últimos 30 años se ha modificado el 28% de la cobertura vegetal de la región; por lo tanto, consideramos que probablemente algunas de las especies han desaparecido de la región o sus poblaciones se han modificado de manera relevante.
Aunque algunas especies de anuros todavía son abundantes en la zona de estudio, en el futuro podrían declinar debido a 3 grandes causas. La primera es el drenado y azolve de humedales, principalmente de los humedales de Pantanos de Centla (zona costa) y del área de Tenosique (zona lagunas). La segunda es que debido a que la mayoría de los anuros distribuidos en la cuenca del Usumacinta requieren de aguas someras con abundante vegetación para reproducirse, estos hábitats están disminuyendo debido a la conversión a zonas de cultivo y pastizal. El tercer factor es que los hábitats esenciales para la reproducción de los anuros podrían disminuir por cambios pequeños en los flujos de agua de los grandes ríos (Usumacinta y Lacantún) o cambios en los flujos de inundación de los humedales costeros; si los flujos disminuyen, las partes más bajas dejarían de inundarse, generando un cambio en la dinámica, calidad y cantidad de charcas pequeñas y someras (Smith y Sutherland, 2014).
En cuanto a las tortugas dulceacuícolas, tenemos documentados diversos problemas de conservación. Primero, que son aprovechadas por las comunidades locales para su autoconsumo, y segundo, que son sobreexplotadas para la venta, lo cual ha generado una rápida declinación en las poblaciones. Nosotros documentamos a lo largo del muestreo que los pescadores las cazan para consumirlas y forman parte común de su dieta de proteínas (trabajo no publicado). Además, son altamente sensibles al cambio en la estructura del paisaje, ya que tienen altos requerimientos de diferentes unidades del paisaje (acuático, terrestre y una combinación de ambas) y la falta o deterioro de alguna unidad, podría provocar cambios en sus poblaciones (Zenteno-Ruiz et al., 2010).











 nueva página del texto (beta)
nueva página del texto (beta)



