Introducción
Los ecosistemas dulceacuícolas concentran una elevada diversidad de especies, dado que cerca del 9.5% del total de las especies de animales descritas hasta ahora se encuentran en un 0.8% de la superficie que ocupan estos ecosistemas a escala global (Strayer y Dudgeon, 2010). Sin embargo, la elevada demanda por el uso del agua, los impactos de cambios en el uso del suelo sobre los ecosistemas acuáticos, la sobreexplotación de especies acuáticas y la introducción de especies exóticas, entre otras amenazas, han llevado a colocar a la biodiversidad dulceacuícola en un alto riesgo de extinción, que supera el de los organismos terrestres (Collen et al., 2014; Dudgeon et al., 2006). De las 126,000 especies de agua dulce que se conocen, un 60.4% son insectos, variando mucho el grado de conocimiento entre los diferentes órdenes, siendo para algunos, como los Diptera, muy escasa la información actualmente existente (Balian et al., 2008).
Además de ser un grupo diverso, los insectos acuáticos son un componente importante de las comunidades de invertebrados en ecosistemas dulceacuícolas, pudiendo dominar la abundancia en arroyos y lagunas tropicales (Jacobsen et al., 2008; Kouamé et al., 2010). Estos organismos se caracterizan por presentar al menos una fase del desarrollo dentro del agua, así como diversas adaptaciones al intercambio gaseoso y a la osmorregulación, que les permite ocupar una variedad considerable de microhábitats en los ambientes acuáticos (Cummins et al., 2008). Los insectos acuáticos juegan un papel importante en el procesamiento de la materia orgánica tanto de origen acuático como terrestre, representando un enlace importante entre las fuentes basales de energía y niveles tróficos superiores como anfibios y peces (Hershey et al., 2010 ). Además de este servicio ecosistémico de soporte, este grupo representa una fuente de alimento para diversos grupos indígenas en Asia, África y América (incluyendo México) y suministra diversos servicios culturales por su papel en la pesca deportiva, el biomonitoreo de ecosistemas acuáticos y la medicina tradicional, entre otros (Macadam y Stockan, 2015; Ramos-Elorduy y Pino-Moreno, 2001, 2004).
Diversos factores afectan la composición, la diversidad y la abundancia de los insectos acuáticos. Aspectos físicoquímicos del agua como la concentración de oxígeno, la temperatura y la salinidad, así como elementos del hábitat físico como el sustrato y la corriente pueden influir sobre estos organismos (Allan y Castillo, 2007; Hershey et al., 2010). La disponibilidad de alimento es otro factor que puede influir sobre la abundancia y composición del ensamble de insectos, ya que influye sobre los grupos tróficos presentes y la producción secundaria (Allan y Castillo, 2007). Estos factores pueden variar a lo largo de una red fluvial, desde los arroyos de cabecera hasta los ríos en las tierras bajas y lateralmente desde el cauce principal del río al plano de inundación, influyendo sobre la composición y abundancia de los ensambles de insectos (Junk et al., 1989; Vannote et al., 1980). También estos ensambles pueden presentar variaciones estacionales debido a cambios en las condiciones de flujo que pueden influir sobre la calidad del agua, el hábitat físico y las fuentes de alimento afectando las tasas de crecimiento y mortalidad (Jacobsen et al., 2008).
La región Neotropical es la segunda más diversa en insectos acuáticos después de la zona Paleártica, aunque dado que la zona Holoártica ha sido más estudiada, los patrones globales de diversidad en insectos acuáticos pueden presentar cierto sesgo (Balian et al., 2008). De allí, la necesidad de estudiar la composición y distribución de insectos acuáticos en ecosistemas tropicales para identificar zonas de alta riqueza de especies que ayuden a definir áreas prioritarias para la conservación enfocadas hacia los ambientes dulceacuícolas, dado que la tendencia mundial se ha orientado hacia la protección de los ecosistemas terrestres (Abell et al., 2007; Herbert et al., 2010; Howard et al., 2015). Esto es particularmente relevante para las especies de insectos acuáticos debido a que muestran un alto endemismo dentro de la ecorregiones globales, por lo que la desaparición de una especie en una región puede llevar a su extinción (Dudgeon et al., 2006).
En el sur de México, son escasos los estudios sobre insectos acuáticos (Bond et al., 2014; Bueno-Soria y Barba-Álvarez, 2011; Bueno-Soria et al., 2005; Estrada-Loreto, 2011). En particular, se conoce poco sobre la distribución y ecología de este grupo en los ambientes acuáticos de la cuenca del Usumacinta, a pesar de ser el río más grande de Mesoamérica, con una elevada biodiversidad y numerosas áreas protegidas (March-Mifsut y Castro, 2010). La mayoría de los trabajos encontrados que hacen referencia a insectos acuáticos en la cuenca son estudios taxonómicos, que describen alguna nueva especie o bien mencionan nuevos registros (Flint, 1970, 1972, 1974; González-Soriano y Paulson, 2011; Lugo-Ortiz y McCafferty, 1994, 1998; McCafferty, 1968). Pocos estudios se han orientado a la caracterización de los ensambles de insectos acuáticos y su función como indicadores biológicos tanto en las subcuencas ubicadas en México como en Guatemala (Bestelmeyer y Leeanne, 2000; Estrada-Loreto, 2011; Reyes-Morales, 2014). Aunado a ésto, las presiones por la transformación del uso del suelo y la alteración hidrológica en la cuenca (March-Mifsut y Castro, 2010), hacen imperante conocer la distribución de los insectos acuáticos como insumo para la identificación de zonas prioritarias de conservación de la biota acuática. Por lo tanto, dada la importancia de los insectos acuáticos en los ecosistemas y la escasa información existente para la cuenca del río Usumacinta, en este trabajo se propone analizar la composición del ensamble de insectos acuáticos en hábitats lénticos y lóticos en la cuenca del Usumacinta en México para identificar áreas y condiciones que estén asociadas con mayor riqueza y diversidad. Nuestro enfoque fue estudiar el ensamble de insectos acuáticos en arroyos, ríos y lagunas en 3 zonas a lo largo de la cuenca del río Usumacinta durante 3 temporadas del año.
Materiales y métodos
La revisión de insectos acuáticos registrados en la cuenca del río Usumacinta se realizó considerando los 5 órdenes de insectos: Ephemeroptera, Plecoptera, Trichoptera, Odonata y Megaloptera, cuyos miembros son estrictamente acuáticos, es decir, que alguna fase del ciclo de vida se desarrolla en estos ambientes. La búsqueda también se orientó hacia familias que presentan especies con algún estadio acuático en los órdenes: Coleoptera, Lepidoptera, Hemiptera, Orthoptera, Hymenoptera y Diptera. Se le solicitó a la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio) información sobre insectos incluida en el Sistema Nacional de Información sobre Biodiversidad (SNIB) (proyectos de origen de registros: Casas-Martínez et al., 2012; Casas-Martínez y Orozco Bonilla, 2004; Contreras-Ramos, 2000; Díaz-Batres, 2004; Gómez y Gómez 2004; Huerta-Jiménez, 2015; Ponce-García, 2012). También se consultaron diversas colecciones entomológicas (Colección Nacional de Insectos [CNIN], Instituto de Biología, Universidad Nacional Autónoma de México, Smithsonian National Museum of Natural History, Essig Museum of Entomology Collections en la University de California, Berkeley) así como el compendio en el portal SCAN (Symbiota Collections of Arthropods Network, http://symbiota4.acis.ufl.edu/scan/portal/index.php) que integra los catálogos de diversas colecciones de Norte América, incluyendo México. Además se revisó literatura que contiene registros para la región para determinar si incluía reportes de especies acuáticas para la cuenca.
La cuenca del río Usumacinta tiene una extensión de 73,195.22 km2 y es compartida principalmente por Guatemala (57.9%) y México (47.1%), aunque una pequeña proporción se encuentra en Belice (0.001%). En México, sus principales tributarios son los ríos Lacantún, Chancalá, Chacamax y San Pedro. La cuenca presenta un plano de inundación con numerosas lagunas y pantanos aguas abajo de Tenosique en Tabasco. A pesar que un 32% de la cuenca se encuentra bajo algún régimen de protección, incluyendo 8 reservas de biósfera y numerosos parques nacionales y estatales, el 36% de la cuenca ha experimentado conversión de la vegetación nativa a otros usos (March-Mifsut y Castro, 2010).
Los muestreos se realizaron en 3 zonas en la cuenca del río Usumacinta en México ubicadas en Centla, Tenosique-Palizada y Lacantún-Yaxchilán en un gradiente altitudinal (0-160 m snm) (Fig. 1). El muestreo incluyó lagunas de inundación, canales, arroyos y ríos, abarcando así diversos tipos de ambientes acuáticos.
En la zona Centla perteneciente al delta del Usumacinta se muestrearon las lagunas San Pedrito (3 sitios), La Puerta Pajaral (2 sitios) y San Isidro (3 sitios), así como los canales de conexión de las lagunas San Pedrito y San Isidro con el río Usumacinta (canales San Pedrito y Salsipuedes, respectivamente). Todos los sitios muestreados en esta zona se encuentran dentro del perímetro de la Reserva de Biosfera Pantanos de Centla (Guerra-Martínez y Ochoa-Gaona, 2008). Las lagunas de San Pedrito y La Puerta Pajaral presentan escasa vegetación acuática flotante o sumergida y se encuentran bajo la influencia de la intrusión salina, presentando elevada conductividad en algunas temporadas del año (2,800-6,500 μS cm-1, M. Castillo, datos no publicados). En San Isidro, la vegetación acuática flotante y sumergida fue más abundante observándose: Eichhornia sp., Pistia sp., Salvinia auriculata, Nympha sp., Cabomba palaeformis, Oxycarium cubense y Najas sp., entre otras. Los muestreos se realizaron en octubre de 2014, en marzo, junio y septiembre de 2015, abarcando los periodos de secas, inicio de lluvias y lluvias.
En la zona Tenosique-Palizada de la planicie de inundación se recolectaron muestras en las lagunas de Nueva Esperanza (3 sitios), Canitzán (3 sitios) y en los ríos San Pedro (2 sitios), Chacamax (2 sitios) y Palizada (2 sitios). Esta zona está más impactada por actividades humanas como ganadería, agricultura y centros urbanos. La vegetación en las márgenes de la laguna de Nueva Esperanza está dominada por zarzales (Mimosa pigra) mientras que en Canitzán hay una mezcla de Phragmites sp., Typha sp. y Thalia pontederia. Plantas flotantes como Eichhornia sp. y Salvinia auriculata estuvieron presentes en ambas lagunas pero en baja abundancia. Los muestreos se realizaron en abril, junio y agosto de 2015. También se recolectaron muestras en el arroyo Canitzán y en la laguna El Mangal (3 sitios) en octubre de 2014.
La zona Lacantún-Yaxchilán se encuentra a una altitud de 160 m snm y comprende la parte baja de la subcuenca del río Lacantún así como el cauce principal del río Usumacinta y algunos arroyos que drenan hacia los ríos. Se realizaron 3 campañas de muestreo en 2015 en los meses de marzo, junio y septiembre. Los puntos en el río Lacantún fueron: el cauce principal a la altura del ejido Reforma Agraria, el arroyo Remolino y el río Tzendales. El arroyo Remolino atraviesa la Reserva Ejidal Reforma Agraria mientras que el río Tzendales se encuentra dentro de la Reserva de Biosfera de Montes Azules. También se trabajó sobre el cauce principal del río Usumacinta a la altura de Frontera Corozal (playón Macachi) y los arroyos Agua Azul y Guatemala, que desembocan al río Usumacinta entre Frontera Corozal y Yaxchilán.
Se utilizó una red tipo “D” (500 µm) para recolectar insectos acuáticos asociados a la vegetación acuática (macrofitas flotantes, sumergidas, emergentes) en las orillas de los ríos y lagunas. Para el muestreo de arroyos y ríos vadeables se empleó una malla de pateo (500 µm), ya que permite remover el sustrato. Los muestreos se realizaron empleando un enfoque multihábitat cubriendo la zona litoral, la vegetación acuática y los sedimentos del fondo, de ser esto factible, aplicándose tiempos similares de esfuerzo en todos los sitios. En cada sitio de estudio se recolectaron 3 réplicas y se tomaron las coordenadas geográficas. Las muestras fueron preservadas en etanol al 70%, etiquetadas y transportadas al laboratorio para su separación, identificación y conteo. Para la identificación se emplearon principalmente los trabajos de Berner y Pescador (1988), Blackwelder (1944,1945), Bueno-Soria (1984, 2010), Bueno-Soria y Flint (1978), Chacón y Segnini (1996), Cranston y Daly (2008), Edmunds et al. (1976), Flint et al. (1999), McCafferty (1983), McCafferty et al. (1997), Morse (1999, 2009), Needham et al. (2000), Novelo (1996, 1997a, 1997b), Pescador y Richard (2004), Stewart y Stark (1993), Usinger (1956), Westfall y May (1996) y Wiggins (1996).
Para comparar la composición y estructura del ensamble de insectos acuáticos entre sitios y zonas se emplearon solo los resultados de los muestreos llevados a cabo en 2015, dado que se disponía de muestras de los mismos sitios en las 3 temporadas, haciendo comparativos los resultados. Se calcularon los índices de diversidad de Shannon-Wiener (H’) y dominancia de Simpson (D) para cada zona y localidades empleando el nivel de género (Mueller et al. 2013). Para comparar la composición entre sitios de cada zona y entre zonas, se utilizó una ordenación de escalamiento multidimensional no métrico (nMDS) empleando la abundancia de organismos por género. Para someter a prueba la hipótesis nula de que no existen diferencias en el ensamble de insectos entre sitios y temporadas de muestreo se realizó un análisis de varianza multivariado con base en permutaciones (Permanova) basándose en matrices de similitud de Bray-Curtis construidas a partir de la abundancia de cada género. Al encontrarse diferencias significativas se aplicaron comparaciones múltiples y el análisis Simper para identificar los taxones que más contribuyeron a estas diferencias (Anderson, 2001; Clarke, 1993; Clarke y Warwick, 2001). Todos los análisis fueron realizados usando PRIMER & PERMANOVA 6 y el nivel de significancia empleado fue de 5%.
Resultados
El número de registros de insectos acuáticos para la cuenca del río Usumacinta en la base de datos de Conabio (SNIB) fue de 782 e incluyó los órdenes: Odonata, Hemiptera, Megaloptera, Hymenoptera, Orthoptera, Trichoptera, Coleoptera y Diptera. En esta base de datos no aparecen registros para los órdenes estrictamente acuáticos: Ephemeroptera y Plecoptera, ni para Lepidoptera. El total de los registros incluye 8 órdenes, 16 familias, 36 géneros y 118 especies para la cuenca del Usumacinta en territorio mexicano. Diptera presentó el mayor número de géneros (20) y especies registradas (94), además de concentrar el 58% del total de los registros. Al analizar la distribución por municipios, se observa que el 60% de los registros se ubican en el municipio de Ocosingo y el 71% en la subcuenca del río Lacantún, mientras que los registros son escasos en los municipios de la parte norte de la cuenca (Centla, Jonuta). Al combinar todas las fuentes de registros consultadas (Conabio, literatura y colecciones), se obtuvieron 225 especies y 109 géneros que abarcan 10 órdenes y 45 familias, siendo Odonata y Diptera los mejor representados con 35 y 28 géneros respectivamente (Tabla 1; Apéndice 1).
Tabla 1 Familias y géneros por orden reportados previamente para la cuenca y los obtenidos en este estudio. El número total para la cuenca incluye los reportes previos y los resultados del presente trabajo (ni, no identificado)
| Orden | Literatura y colecciones | Muestreos | Total | |||
|---|---|---|---|---|---|---|
| Familias | Géneros | Familias | Géneros | Familias | Géneros | |
| Ephemeroptera | 3 | 3 | 8 | 18 | 9 | 19 |
| Orthoptera | 1 | 1 | 1 | ni | 1 | 1 |
| Plecoptera | 1 | 1 | 1 | 1 | 1 | 1 |
| Hemiptera | 5 | 8 | 12 | 26 | 12 | 28 |
| Odonata | 10 | 35 | 8 | 21 | 10 | 42 |
| Megaloptera | 2 | 3 | 1 | 2 | 2 | 4 |
| Trichoptera | 7 | 12 | 8 | 12 | 9 | 17 |
| Lepidoptera | 0 | 0 | 2 | 2 | 2 | 2 |
| Coleoptera | 8 | 16 | 11 | 26 | 14 | 34 |
| Hymenoptera | 2 | 2 | 0 | 0 | 2 | 2 |
| Diptera | 6 | 28 | 9 | 19 | 10 | 42 |
| Total | 45 | 109 | 61 | 127 | 72 | 192 |
Con el trabajo de campo realizado, se recolectaron 10 órdenes de insectos acuáticos (Ephemeroptera, Odonata, Orthoptera, Plecoptera, Hemiptera, Megaloptera, Trichoptera, Lepidoptera, Coleoptera, y Diptera), 61 familias y 127 géneros. La identificación a nivel de especie no fue posible debido a la falta de claves especializadas para la región. Al comparar con los reportes previos, el número de familias se incrementó en 27, ascendiendo de 45 reportadas a 72. Es importante resaltar que únicamente 44 géneros de los recolectados coinciden con los reportados previamente, con lo cual, este estudio contribuyó con 83 nuevos registros de géneros para la cuenca (Apéndice 2), haciendo un gran total actualizado de 192 géneros de insectos acuáticos registrados para la cuenca del río Usumacinta. El mayor número de registros nuevos de familias para la cuenca fue en los órdenes Hemiptera y Ephemeroptera, mientras que los nuevos registros de géneros fueron más numerosos en Coleoptera, Hemiptera y Ephemeroptera (Tabla 1).
En este estudio, Diptera fue el orden de insectos acuáticos más abundante con 1,415 ejemplares, representando el 41.09%, seguido por Hemiptera y Ephemeroptera con 653 (19%) y 556 (16%) ejemplares respectivamente. Chironomidae (Diptera) fue la familia más abundante y a la vez dominante, constituyendo el 35.9% del total. Coleoptera, Hemiptera y Odonata fueron los órdenes con mayor riqueza con 26, 26 y 21 géneros respectivamente, seguidos por Diptera con 19.
Zona Centla. En esta zona del delta se recolectaron 69 géneros pertenecientes a 40 familias (Apéndice 2) y dominaron en abundancia los órdenes: Odonata, Diptera, Hemiptera y Ephemeroptera (Fig. 2). Los órdenes con mayor riqueza de géneros fueron: Odonata, Hemiptera, Coleoptera y Diptera. Entre los Odonata, dominó la familia Libellulidae, específicamente Miathyria marcella y en los Hemiptera, el género Rhagovelia de la familia Veliidae. Tropisternus sp., de la familia Hydrophilidae, fue el coleóptero más abundante. Los Diptera más abundantes fueron los Chironomidae y dentro de los Ephemeroptera, el género dominante fue Caenis (Caenidae), seguido de Baetis (Baetidae). La laguna San Isidro fue el sitio con mayor número de géneros (45) seguido del canal Salsipuedes y las lagunas de San Pedrito y La Puerta Pajaral (Tabla 2). Igualmente la diversidad (índice de Shannon) fue más alta en la laguna de San Isidro y en el canal Salsipuedes que en las lagunas San Pedrito y la Puerta Pajaral. La laguna de San Isidro y el canal Salsipuedes presentaron mayor abundancia que San Pedrito y La Puerta Pajaral, donde la abundancia disminuyó en el muestreo de junio. Entre las fechas de muestreo se observaron cambios en la abundancia, presentando una tendencia a disminuir en la temporada de lluvias (septiembre) en casi todos los grupos (Fig. 3A), mientras que riqueza pasó de 25 géneros en la temporada de secas a 58 en lluvias.

Figura 2 Número de individuos recolectados (A) y riqueza de géneros (B) por orden para cada zona estudiada.
Tabla 2 Riqueza (S) de géneros, número de individuos (N) e índices de diversidad de Shannon (H’) y dominancia de Simpson (D) para cada sitio de muestreo.
| Zonas | S | N | Hˈ | D |
|---|---|---|---|---|
| Centla | 69 | 544 | 3.17 | 0.07 |
| L. San Pedrito | 18 | 73 | 1.73 | 0.31 |
| L. Puerta Pajaral | 11 | 46 | 2.06 | 0.19 |
| L. San Isidro | 45 | 266 | 2.88 | 0.08 |
| C. Salsipuedes | 28 | 159 | 2.64 | 0.10 |
| Tenosique-Palizada | 62 | 1,713 | 1.66 | 0.43 |
| L. Canitzán | 29 | 485 | 1.78 | 0.33 |
| L. Nueva Esperanza | 18 | 1,039 | 0.91 | 0.65 |
| R. San Pedro | 21 | 105 | 2.42 | 0.12 |
| R. Chacamax | 5 | 24 | 0.98 | 0.53 |
| R. Palizada | 8 | 60 | 1.13 | 0.51 |
| Lacantún-Yaxchilán | 70 | 1,178 | 3.58 | 0.04 |
| R. Lacantún | 31 | 291 | 2.86 | 0.08 |
| R. Tzendales | 45 | 305 | 3.16 | 0.07 |
| A. Remolino | 43 | 326 | 3.11 | 0.07 |
| A. Guatemala | 24 | 86 | 2.85 | 0.07 |
| R. Usumacinta | 3 | 4 | 1.04 | 0.38 |
| A. Agua Azul | 28 | 166 | 2.64 | 0.12 |

Figura 3 Abundancia de los órdenes de insectos acuáticos en cada temporada de muestreo y para cada zona estudiada (A) Centla, (B) Tenosique-Palizada y (C) Lacantún-Yaxchilán. Se presentan promedio y desviación estándar entre los sitios de muestreo para cada temporada.
Los resultados del escalamiento multidimensional (Fig. 4A), así como los resultados de Permanova indican diferencias significativas en la estructura de los ensambles entre sitios (F3,54 = 3,8663, p = 0.004) y temporadas de muestreo (F2,54 = 2.25, p = 0.007). A pesar de existir una gran variación entre los puntos de muestreo, como se evidencia en los factores de interacción que incluyen los puntos (F10,54 = 2.58, p = 0.0001), la interacción entre temporadas y sitios fue significativa (F6,54 = 1.60, p = 0.0124) indicando que el efecto de la época de muestreo es diferente entre los sitios. Esto se evidencia al realizar las comparaciones múltiples para el factor temporada, las cuales indican que solo el canal Salsipuedes presentó diferencias entre temporadas (p < 0.048). Por otra parte, al realizar las comparaciones entre sitios, se detectaron diferencias significativas entre la laguna de San Isidro y las lagunas San Pedrito (p = 0.015) y La Puerta Pajaral (p = 0.028) en la temporada de secas, siendo las disimilitudes entre sitios mayores al 91%. Las diferencias entre las lagunas San Isidro y San Pedrito estuvieron dadas principalmente por la mayor abundancia de Chironomidae en San Pedrito y de Libellula sp., Caenis sp., Abedus sp., Argia sp. y Tauriphila sp. en la laguna de San Isidro explicando estos géneros un 69% de las diferencias. Un patrón similar se observó entre San Isidro y La Puerta Pajaral. En la temporada de inicio de lluvias, se encontraron diferencias entre San Isidro y el Canal Salsipuedes (p = 0.019) así con la laguna de San Pedrito (p = 0.003), con disimilitudes mayores al 81% entre sitios. La mayor abundancia de Chironomidae, Eristalis sp., Tropisternus sp., Berosus sp. y Belostoma sp. en Salsipuedes y de Caenis sp. en San Isidro definieron las diferencias entre estos sitios en un 70%. En San Isidro la mayor abundancia de los géneros Miathyria, Caenis y Baetis y la menor abundancia de Chironomidae en San Pedrito, explicaron el 70% de las diferencias. En la temporada de lluvias, no se detectaron diferencias entre los ensambles de insectos acuáticos de los cuerpos de agua de esta zona (p > 0.153).
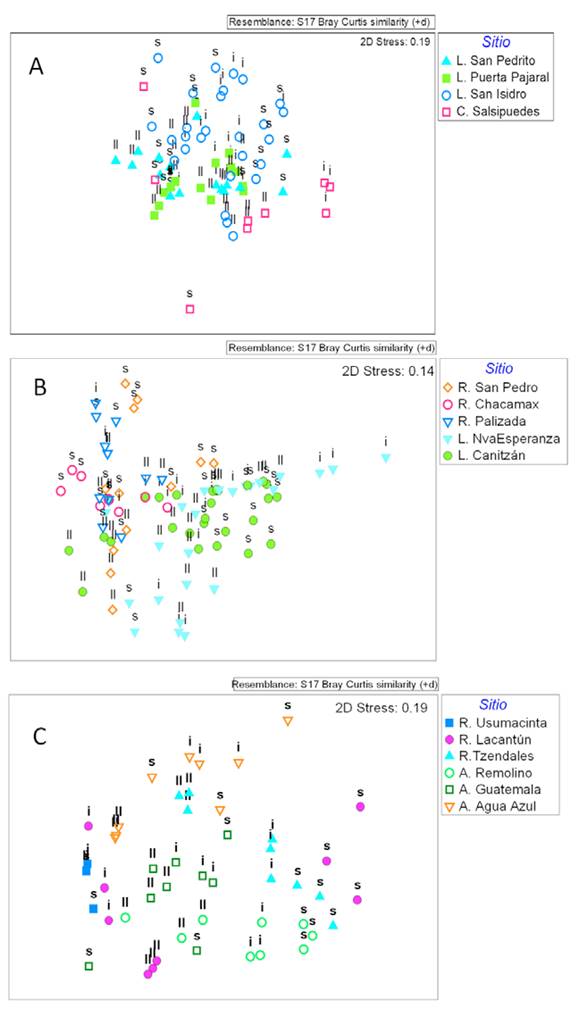
Figura 4 Escalamiento multidimensional no métrico (nMDS) de las muestras recolectadas en los sitios de cada zona estudiada (A) Centla, (B) Tenosique-Palizada y (C) Lacantún-Yaxchilán. Se muestran las fechas de recolecta de cada muestra en la temporada de secas (s), inicio de lluvias (i) y lluvias (ll).
Zona Tenosique-Palizada. En esta zona de la planicie de inundación se recolectó un total de 62 géneros pertenecientes a 33 familias (Apéndice 2), dominando los insectos de los órdenes Diptera, principalmente Chironomidae, y Hemiptera de la familia Notonectidae, siendo Martarega el género más abundante. Los órdenes con mayor riqueza de géneros fueron: Coleoptera, Hemiptera, Diptera y Odonata (Fig. 2). La laguna de Canitzán presentó el mayor número de géneros, seguida por el río San Pedro, la laguna de Nueva Esperanza, mientras que los ríos Palizada y Chacamax fueron los más pobres en número de géneros (Tabla 2). En las lagunas dominaron los Chironomidae llegándose a registrar en la laguna de Nueva Esperanza la mayor abundancia en este estudio con 632 ejemplares recolectados en un solo punto. Los Hemiptera, específicamente del género Martarega, fue el segundo grupo más abundante en este sitio. En el río San Pedro dominaron Rheumatobates sp. (Gerridae) y Smicridea sp. (Hydropsychidae) y en el Palizada dominó Rhagovelia sp. (Veliidae). El río Chacamax presentó además de baja riqueza, poca abundancia (24 ejemplares), siendo Trichocorixa sp. (Corixidae) el taxón más abundante. Aunque la laguna el Mangal solo se muestreó en octubre de 2014, se recolectaron 25 géneros en una sola oportunidad, dominando Scirtes sp. (Scirtidae) y Protoneura sp. (Protoneuridae). En el arroyo Canitzán, destacó la abundancia de Ephemeroptera (Camelobaetidius sp.) y Coleoptera de la familia Heteroceridae. Los índices de diversidad fueron más altos para el río San Pedro, seguido de la laguna Canitzán y los valores más bajos para la laguna de Nueva Esperanza y el río Chacamax (Tabla 2).
En la gráfica de nMDS para esta zona se visualiza la separación de las lagunas de los ríos muestreados (Fig. 4B). Los resultados de la Permanova indican que las diferencias entre fechas de muestreo no son significativas (F2,78 = 0.89, p = 0.555), así como la interacción entre sitios y fechas de muestreo (F8,78 = 0.80, p = 0.84). Aunque hay un efecto significativo de los sitios de muestreo, las interacciones significativas que incluyen los puntos de muestreo indican una alta variabilidad espacial (F8,78 = 8.23, p = 0.001). El análisis Simper indica que las disimilitudes entre los sitios fueron mayores al 91%. Diferencias entre la laguna de Canitzán y los ríos San Pedro y Chacamax vienen dadas por la mayor abundancia de Chironomidae, Martarega sp. y Anopheles sp. en la laguna de Canitzán. Igualmente, la mayor abundancia de Chironomidae, Martarega sp. y Belostoma sp. en la laguna de Nueva Esperanza la diferencian de los ríos Chacamax y San Pedro. El río San Pedro se diferenció del Chacamax por la mayor abundancia de Rheumatobates sp., Chironomidae y Smicridea sp. En el río Palizada, la mayor abundancia de Rhagovelia sp. marcó la diferencia con los otros sitios. A pesar que el factor temporal no fue significativo, la riqueza en la zona varió de 35 géneros en marzo, a 15 en junio y 14 en septiembre, mientras que la abundancia tuvo su valor más alto en esta zona focal en el mes de junio (Fig. 3B).
Zona Lacantún-Yaxchilán. Aquí se presentó la mayor riqueza con 43 familias y 70 géneros (Apéndice 2). Los órdenes Ephemeroptera, Trichoptera y Hemiptera dominaron en abundancia (Fig. 2), mientras que la mayor riqueza de géneros la presentaron los órdenes Ephemeroptera, Hemiptera, Coleoptera y Trichoptera. Entre los Ephemeroptera dominó Traverella sp. (Leptophlebiidae), Chimarra sp. (Philopotamidae) en los Trichoptera, y Ambrysus sp. (Naucoridae) entre los Hemiptera. La mayor riqueza se encontró en el río Tzendales y en el arroyo Remolino con 45 y 43 géneros respectivamente, mientras que el sitio sobre el río Usumacinta presentó baja riqueza y abundancia (Tabla 2). El índice de Shannon igualmente fue mayor en el río Tzendales seguido del arroyo Remolino, siendo estos valores los más altos reportados para este estudio. Los sitios con mayor abundancia de insectos fueron el río Lacantún y el arroyo Remolino. En cuanto a la temporada de muestreo, secas (marzo) e inicio de lluvias (junio), fueron los meses en los que se obtuvo la mayor riqueza con 55 y 54 géneros, respectivamente. En temporada de lluvias (septiembre), el número de géneros disminuyó a 27, así como la abundancia de individuos recolectados (Fig. 3C). Sin embargo, algunos géneros como Baetis y Hetaerina en el río Tzendales y Rhagovelia en el río Lacantún aumentaron sus densidades durante la temporada de lluvias.
En el nMDS se observó que los sitios de estas zona están separados entre sí (Fig. 4C). Las muestras del río Lacantún, aparecen separadas en 2 grupos, pareciéndose más al río Usumacinta en la temporada de lluvias. Los resultados de la Permanova indican efectos significativos de la temporada (F2,36 = 6.50, p = 0.001) y el sitio de muestreo (F5,36 = 8.15, p = 0.001) así como una interacción significativa entre temporada y sitios (F10,36 = 3.85, p = 0.001). Las comparaciones múltiples para el factor temporada indican diferencias significativas entre las temporadas para casi todo los sitios (p < 0.035), excepto para el río Tzendales y los arroyos Guatemala y Agua Azul entre secas e inicio de lluvias (p > 0.1). En la temporada de secas, las comparaciones entre sitios indican que la baja abundancia en el río Usumacinta marca las diferencias con los ríos Tzendales, Agua Azul y Remolino, siendo las disimilitudes mayores a 68%. En la temporada de inicio de lluvias (junio), se obtuvieron diferencias significativas entre todos los sitios de muestreo (p < 0.023). De acuerdo a los resultados de SIMPER las disimilitudes fueron mayores a 77% entre sitios y la baja abundancia en el Lacantún en esta época define las diferencias entre este río y los demás sitios de muestreo. La mayor abundancia de Traverella sp., Smicridea sp., Anacroneuria sp. y Baetis sp. en el río Tzendales contribuye en un 40% a las disimilitudes con los arroyos Agua Azul y Guatemala, en los cuales destaca la mayor abundancia de Atopsyche sp. y Serromya sp. en el primero y de Rhagovelia sp. en el segundo. En el arroyo Remolino, la mayor abundancia de Chimarra sp. y Anacroneuria sp. marca las diferencias con otros arroyos. En la temporada de lluvias, también se observaron diferencias significativas entre los sitios de muestreo (p < 0.014), siendo las disimilitudes entre sitios mayores al 75%. Las diferencias entre el río Lacantún y los demás sitios vienen dadas por la mayor abundancia de Rhagovelia sp. y Ambrysus sp. en este río. En el río Tzendales, la abundancia más elevada de Baetis sp., Hetaerina sp. y Lachlania sp. contribuyó a las diferencias con los demás arroyos y ríos, mientras que en el arroyo Remolino destaca la mayor abundancia de Thraulodes sp., Corydalus sp. y Limnophila sp. En el arroyo Guatemala, la mayor abundancia de Trepobates sp. y Leptohyphes sp. contribuyó a las diferencias con otros sitios, mientras que en el arroyo Agua Azul es Hetaerina sp. el género más abundante.
Al comparar las 3 áreas se evidencia una mayor riqueza y diversidad en Lacantún-Yaxchilán, seguida de Centla (Tabla 2). El nMDS aplicado a las 3 zonas (Fig. 5) agrupa las muestras de la zona Lacantún Yaxchilán, separadas de las zonas Centla y Tenosique-Palizada, las cuales presentan una mayor similitud entre ellas. Los resultados de la Permanova indican diferencias significativas entre las 3 zonas (F2,243 = 9.12, p = 0.001) y las 3 temporadas (F2,243 = 3.58, p = 0.001), así como una interacción significativa entre estos 2 factores, indicando que el efecto de la temporalidad varía por zona (F4,243 = 2.18, p = 0.001). Al realizar las comparaciones múltiples se evidencian diferencias significativas entre las temporadas de secas y lluvias para las 3 áreas de muestreo (p < 0.025). Los resultados de Simper indican que los géneros que contribuyen a las diferencias entre zonas varían entre temporadas. Así, al comparar entre las zonas en la temporada de secas, la abundancia de Chironomidae, Caenis sp., Libellula sp. y Abedus sp. en Centla, Chironomidae, Caenis sp., Trichocorixa sp., Martarega sp. y Belostoma sp. en Tenosique-Palizada y Chimarra sp., Smicridea sp., Traverella sp., Baetis sp., Baetodes sp. y Simulium sp. en la zona Lacantún-Yaxchilán contribuyeron a explicar entre 50-60% de las diferencias entre zonas como lo indican los resultados de Simper. Al inicio de lluvias la abundancia de Chironomidae, Caenis sp. y Miathyria sp. en Centla, Chironomidae y Martarega sp. en Tenosique-Palizada y de Simulium sp., Chimarra sp., Smicridea sp., Limnocoris sp. y Anacroneuria sp. en Lacantún-Yaxchilán, explicaron alrededor del 60% de las diferencias entre zonas. En la temporada de lluvias, la mayor abundancia de Chironomidae y Tauriphila en Centla, Chironomidae, Rheumatobates sp., Martarega sp. y Tenagobia sp. en Tenosique-Palizada y Rhagovelia sp., Hetaerina sp., Baetis sp., Trepobates sp. y Leptohyphe sp. en Lacantún-Yaxchilán explicaron cerca del 60% de las diferencias entre las zonas.
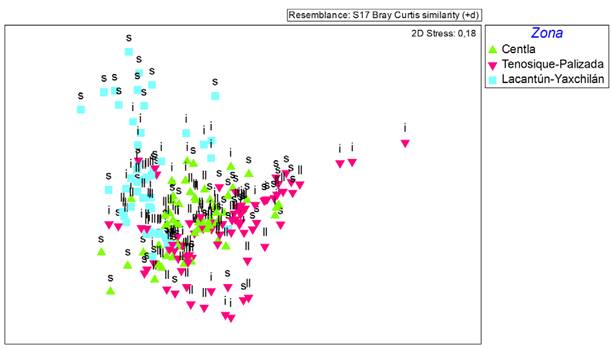
Figura 5 Escalamiento multidimensional no métrico (nMDS) de las muestras recolectadas en las 3 zonas estudiadas. Se muestran las fechas de recolecta de cada muestra en la temporada de secas (s), inicio de lluvias (i) y lluvias (ll).
Entre los ambientes muestreados, la riqueza y diversidad fue más alta en arroyos y ríos que en las lagunas (Tabla 2). Los ríos y arroyos de la zona Lacantún-Yaxchilán presentaron mayor riqueza, diversidad y abundancia que los de las otras zonas. Por otra parte, las lagunas en la zona Centla presentaron mayor riqueza y diversidad que las de la zona Tenosique-Palizada, mientras que estas últimas presentaron la mayor abundancia.
Discusión
Los resultados de este estudio indican que la riqueza de insectos acuáticos en la cuenca del río Usumacinta es mucho mayor de la previamente conocida (Tabla 1) y que la distribución de este grupo de organismos varía a lo largo de la cuenca y entre los tipos de ambientes. Los muestreos realizados permitieron incrementar en 76% el número de géneros previamente reportados para la cuenca y en un 64% el número de familias. Llama la atención la escasez de registros para esta zona de estudio de algunos grupos que permanecen una buena parte del ciclo de vida en ambientes acuáticos como Ephemeroptera y Trichoptera y que pueden encontrarse comúnmente en arroyos, ríos y lagunas. La mayoría de los géneros obtenidos en los muestreos han sido reportados para el resto del país, aunque muchos de ellos en estadios adultos. En el caso de los Ephemeroptera, los géneros Cercobrachys y Terpides, que ya han sido reportados para Centroamérica, podrían ser nuevos reportes para México (Flowers, 1992; McCafferty, 1985), mientras que Asioplax ha sido registrado tanto localidades del centro y norte de México (Querétaro y Tamaulipas) como en Centroamérica (McCafferty, 2011). La familia Lutrochidae (Coleoptera) no ha sido reportada para México, aunque Lutrochus vestitus está reportado para Guatemala (Spangler et al., 2001).
Al comparar con la riqueza de algunos grupos a escala regional y continental, se puede apreciar la diversidad en la cuenca. Para Odonata, hay reportadas 14 familias para México y en la cuenca se reportan 10 (González-Soriano y Paulson, 2011). De las 18 familias de coleópteros acuáticos reportadas para México (Arce-Pérez, 1995), en la cuenca del Usumacinta se encuentran 12, además de Staphylinidae y Lutrochidae, indicando la riqueza de familias en la zona. Con relación a los géneros, se han reportado 120 géneros para México (Arce-Pérez, 1995) mientras que en este estudio se encontraron 36. Esta discrepancia puede deberse en parte a que para algunos especímenes de Coleoptera no pudo realizarse la identificación a nivel de género. Para Ephemeroptera hay 12 familias reportadas para México (McCafferty, 2011) y 16 para el Neotrópico (Barber-James et al., 2008), reportándose 9 para la cuenca del río Usumacinta. De Trichoptera se consiguieron en la cuenca del Usumacinta 9 familias de las 17 reportadas para México (Bueno-Soria, 2010) y de las 22 reportadas para el Neotrópico (De Moor e Ivanov, 2008). La mayor riqueza de estos 2 últimos grupos se observó en los arroyos de la zona Lacantún-Yaxchilán, por lo que muestreos más intensivos en este tipo de ambiente, así como en las partes altas de la cuenca podrían aumentar el número de familias y géneros para la cuenca. Probablemente de haber obtenido una mayor resolución taxonómica, se podría haber alcanzado una mejor comprensión de los patrones biogeográficos y temporales para los organismos colectados. Sin embargo, claves específicas al nivel de especie para los estadios inmaduros, que son los que están presentes en los ambientes acuáticos, son escasas lo que dificulta su identificación. En muchos casos se requiere del organismo adulto para identificar la especie; la colecta simultánea de adultos y larvas puede apoyar en la identificación en algunos casos, mientras que en otros, la cría de adultos en el laboratorio a partir de huevos o estadios inmaduros obtenidos en campo puede ser otra forma de mejorar la resolución taxonómica (Merrit et al., 2008).
Las diferencias entre los sitios estudiados pueden estar relacionadas con el tipo de ambiente, ya que aspectos como el flujo de agua y el sustrato varían entre lagunas, ríos y arroyos lo cual puede generar diferencias en los ensambles (Hershey et al., 2010; Vinson y Hawkins, 1998). Los ambientes lénticos estuvieron dominados por los órdenes Diptera, Hemiptera y Odonata, aunque Ephemeroptera (Caenidae) también fue abundante en la laguna de San Isidro en Centla, mientras que en Lacantún-Yaxchilán donde predominaban condiciones lóticas, Ephemeroptera y Trichoptera fueron los órdenes dominantes. Al analizar la riqueza por ambiente, se encontró que ríos y arroyos mostraron mayor riqueza y diversidad que las lagunas, mientras que éstas presentaron mayor abundancia (Tabla 2). Aunque los ríos y arroyos con mayor riqueza están en la zona Lacantún-Yaxchilán y posiblemente bajo la influencia de zonas en mejor estado de conservación (Reserva de Biosfera de Montes Azules), también es probable que las condiciones de flujo y sustrato favorezcan la presencia de ciertos grupos como Ephemeroptera y Trichoptera, cuya riqueza de géneros destacó en esta zona (Fig. 2). Muchos géneros de Ephemeroptera se encuentran principalmente en hábitat lóticos y la mayor diversidad ha sido encontrada en arroyos pequeños con sustrato rocoso (Waltz y Burian, 2008), como la mayoría de los ríos y arroyos de la zona Lacantún-Yaxchilán. Algunos géneros como Caenis y Baetis pueden encontrarse en ambientes lénticos (Waltz y Burian, 2008), lo cual coincide con su abundancia en las lagunas de Centla y Tenosique-Palizada. Al igual que Ephemeroptera, Trichoptera fue mucho más abundante en la zona Lacantún-Yaxchilán, lo cual también indica que las condiciones de los arroyos favorecen a este grupo. Varios de los géneros dominantes de tricópteros en esta zona corresponden a organismos filtradores típicos de ambientes lóticos como Chimarra, Smicridea y Leptonema, aunque también fueron abundantes los depredadores como Atopsyche. En contraste, este grupo fue menos abundante en las zonas Centla y Tenosique-Palizada y en particular en las lagunas, donde dominó Cyrnellus (Polycentropodidae) que puede habitar ambientes lénticos (Wiggins y Currie, 2008). Por otra parte, la mayor riqueza de los Odonata en Centla, sugiere que ambientes lénticos están asociados a una mayor riqueza y abundancia en este grupo, en especial para Coenagrionidae y Libellulidae, encontrándose esta última familia generalmente en ambientes lénticos (Tennesen, 2008). La elevada abundancia de Chironomidae en las lagunas de Nueva Esperanza y Canitzán, podría estar reflejando las mayores concentraciones de clorofila y fósforo (M. Castillo, datos no publicados), que sugieren una tendencia a la eutrofización, condición que es tolerada por esta familia de Diptera (Hershey et al., 2010).
Dentro de cada ambiente, también se encontraron variaciones lo que sugiere que otros factores pueden estar influyendo sobre la diversidad y riqueza. La laguna de San Isidro en Centla fue uno de los sitios que reportó mayor diversidad de géneros, lo cual podría estar relacionado, en parte, con la mayor abundancia de plantas acuáticas flotantes y sumergidas en comparación con las lagunas San Pedrito y La Puerta Pajaral; igualmente, la laguna El Mangal donde abundaban las macrofitas flotantes registró 24 géneros en una sola fecha de recolecta, lo cual contrasta con las lagunas de San Pedrito, La Puerta Pajaral, Canitzán y Nueva Esperanza donde se encontraron un menor número de géneros en las 3 temporadas de muestreo. Se conoce que las raíces de las macrofitas pueden representar un hábitat importante para los insectos acuáticos en sistemas inundables (Lewis et al., 2001; Pettit et al., 2011; Poi de Neiff y Neiff, 2006) y que pueden influir sobre la complejidad del hábitat, lo cual guarda relación con el número de especies y abundancia de macroinvertebrados (St. Pierre y Kovalenko, 2014; Thomaz et al., 2008). Eichhornia sp. fue una de las macrofitas más abundantes en las lagunas de San Isidro y El Mangal. Esta planta puede alojar en sus raíces una mayor riqueza de especies que otras plantas acuáticas, probablemente por las condiciones que ofrece como sustrato y la retención de materia orgánica por las raíces, como se ha demostrado en lagunas de inundación de América del Sur, de donde esta planta es nativa (Poi de Neiff y Neiff, 2006). En zonas donde Eichhornia ha sido introducida, se han producido cambios en las comunidades acuáticas, aunque también puede alojar una diversidad alta de invertebrados (Higuti y Martens, 2016; Kouamé et al., 2010; Rocha-Ramírez et al., 2007). La menor diversidad y riqueza en lagunas de San Pedrito y La Puerta Pajaral podría estar relacionada con la ausencia de la vegetación acuática sumergida y flotante y con las entradas de agua de mayor salinidad (3.5 ppm en junio 2006, M. Castillo datos no publicados) por efecto de las mareas (Cañedo-Argüelles et al., 2013; Hart et al., 1991; Piscart et al., 2005). Aunque la presencia de aguas más salinas solo se registró en junio de 2015, esta influencia probablemente explica la dominancia de Chironomidae en San Pedrito, ya que son insectos más tolerantes al incremento en salinidad, mientras que los Ephemeroptera son los más sensibles (Hart et al., 1991; Hassell et al., 2006).
Los sitios con mayor riqueza y diversidad en este estudio fueron el río Tzendales, la laguna de San Isidro y el arroyo Remolino, que se ubican dentro de áreas protegidas que incluyen tanto reservas de biósfera (Montes Azules y Pantanos de Centla) como reservas ejidales (ejido Reforma Agraria, Marqués de Comillas, Chiapas). Esto indica que algunas áreas protegidas en la cuenca del río Usumacinta cubren zonas que presentaron la mayor biodiversidad de insectos acuáticos en este estudio, lo cual es relevante dado que muchas áreas protegidas se han designado para proteger los ambientes terrestres, sin considerar la biodiversidad acuática o las amenazas que afectan a los ecosistemas acuáticos (Herbert et al., 2010; Juffe-Bignoli et al., 2014).
Las variaciones temporales observadas en este estudio pueden deberse principalmente a cambios en el hábitat relacionados con la estacionalidad hidrológica. Tanto en las zonas de Centla como en Lacantún-Yaxchilán, se observó una disminución en la abundancia de organismos entre las temporadas de secas y lluvias. En los ambientes lóticos tropicales, es común observar una mayor abundancia en secas y una disminución marcada en la temporada de lluvias, como se observó en este estudio, lo cual puede estar relacionado con mayor mortalidad y alteraciones del hábitat debido a las crecidas que ocurren durante el periodo de lluvias (Jacobsen et al., 2008); sin embargo, también se pueden encontrar que algunos taxones aumentan su abundancia durante la época de lluvias, como se registró en algunos sitios de la zona Lacantún-Yaxchilán. Mayor variación temporal fue observada en los sitios en Centla que en Tenosique-Palizada, lo cual podría estar relacionado con la mayor conectividad existente entre las lagunas de Centla y el cauce principal del río Usumacinta, dada la influencia que tiene la conectividad hidrológica sobre la composición y diversidad de los ensambles de macroinvertebrados acuáticos (Leigh y Sheldon, 2009). En el caso de San Isidro que presenta abundante vegetación flotante y sumergida, se esperaba un incremento en la abundancia en la temporada de lluvias o inundación como se ha reportado en otros sistemas inundables tropicales (Blanco et al. 1998; Poi de Neiff y Carignan, 1997); sin embargo, más bien se observó una disminución en la abundancia acompañado de un aumento en la riqueza de géneros, lo cual podría sugerir diferencias entre la dinámica que experimentan las lagunas de Centla y las observadas en otros sistemas de inundación.
Este estudio fue una primera aproximación a la diversidad de insectos de la cuenca del río Usumacinta en México, considerando un enfoque de cuenca e incluyendo diversos tipos de ambientes acuáticos. Al comparar las zonas, se encontró la mayor riqueza y diversidad tanto en ambientes lóticos de la zona Lacantún-Yaxchilán como en ambientes lénticos del plano de inundación en Centla, lo cual puede contribuir a identificar zonas de elevada biodiversidad acuática para su conservación. En las 3 zonas se observó una disminución en la abundancia entre la temporada de secas y lluvias, así como diferencias en la composición de los ensambles lo cual requiere mayor investigación para conocer qué factores operan en los diferentes ambientes que generan estos cambios. Una de las contribuciones de este trabajo es la recopilación de registros para la cuenca, así como el aumento en el número de registros por las recolectas tanto para estadios inmaduros como adultos. Sin embargo, la extensión de la cuenca del río Usumacinta requiere mayor esfuerzo de muestreo, en especial en zonas lénticas con vegetación acuática flotante y en arroyos, que demostraron ser áreas de mayor diversidad, así como en las partes altas de la cuenca, las cuales no fueron incluidas en este estudio.











 nova página do texto(beta)
nova página do texto(beta)