Introducción
La bahía de La Paz (BLP) es considerada el ecosistema costero más grande de la porción occidental del golfo de California, cuya superficie es cercana a los 1,200 km2 (Lewis y Ebeling, 1971; Roberts, 1989). Esta bahía representa un ecosistema de gran importancia ecológica, debido a que alberga una gran biodiversidad marina y abundantes recursos pesqueros. Razón por la cual, en este lugar se llevan a cabo diversas actividades de pesca artesanal (e.g., pesca con anzuelo, redes de enmalle, trampas de fondo), deportiva e industrial, así como la pesca de arrastre de camarón (Arreguín-Sánchez et al., 2004).
Por su cercanía con la ciudad de La Paz, capital del estado de Baja California Sur, la BLP y sus áreas adyacentes, son por mucho, los ecosistemas marinos más estudiados del noroeste de México (Contreras-Espinosa, 2010). Lo que sin duda, es debido a la presencia de diversas instituciones de educación superior, cuya investigación se centra en el estudio de los procesos oceanográficos y biológicos que tienen lugar en este ecosistema, con la finalidad de contribuir a un mejor conocimiento y aprovechamiento de sus recursos naturales.
Con relación al conocimiento de la ictiofauna de BLP, se cuenta con una cantidad importante de estudios que han hecho posible conocer aspectos ecológicos (Balart et al., 1997; Chávez, 1985; Galván-Piña et al., 2003; González-Acosta et al., 2005; López-Rasgado et al., 2012; Pérez-España et al., 1996; Ramos-Lozano et al., 2015; Rodríguez-Romero et al., 2005) y pesqueros de diferentes especies de telósteos y peces cartilaginosos (Díaz-Uribe et al., 2004; Ramírez-Rodríguez, 1997; Ramírez-Rodríguez y Rodríguez, 1990; Vázquez-Hurtado et al., 2010; Villavicencio-Garayzar et al., 1997). Además, se cuenta con estudios que abordan la riqueza y distribución de la ictiofauna presente en los diferentes ambientes que se pueden encontrar en este ecosistema (Abitia-Cárdenas et al., 1994; Balart et al., 1995; Castro-Aguirre y Balart, 1997; Chávez, 1985; González-Acosta et al., 1999, 2001; González-Acosta, Ruiz-Campos et al., 2015; Sánchez-Ortiz et al., 1997; Trujillo-Millán et al., 2006).
En la última actualización del conjunto íctico de BLP, se incluyó un total de 520 especies (Balart et al., 1995) y aunque dicho número parece no haberse incrementado de modo importante con el tiempo, cambios notables en la identidad y nomenclatura de las especies que lo integran, han modificado su composición y estructura taxonómica (Castro-Aguirre y Balart, 1997; González-Acosta, Rabadán-Sotelo et al., 2015; González-Acosta, Ruiz-Campos et al., 2015; González y Saldierna, 1997; Trujillo-Millán et al., 2006). No obstante, la falta de una evaluación crítica de la literatura, relacionada con el registro de la presencia de ciertas especies y de su actualización taxonómica, hacen posible encontrar aún confusiones en la nomenclatura y distribución de algunos taxones que se consideran de interés para su conservación ecológica y principalmente comercial (Vázquez-Hurtado et al., 2010). De este modo, se evaluó la composición y estado de conservación de la ictiofauna de la BLP, a través de la actualización de la lista taxonómica, complementada con información sobre su taxonomía alfa, zoogeografía e importancia económica. Ésto permitirá establecer las bases de estrategias de manejo y aprovechamiento de los recursos ícticos pesqueros y, de aquellos, sujetos a conservación ecológica en la región.
Materiales y métodos
La bahía de La Paz es el ecosistema marino estuarino más grande de la parte sur de la península de Baja California, el cual se localiza entre las coordenadas 24°07’ y 24°21’ N, 110°17’ y 110°40’ O (Fig. 1), justo por encima del Trópico de Cáncer. Cuenta con una superficie cercana a los 1,200 km2, su longitud es de 80 km y su amplitud de 35 km, la parte norte es la más estrecha de la bahía. Se conecta al sur con la laguna o ensenada de La Paz (24°10’ y 24°06’ N, 110°19’ y 110°26’ O), un cuerpo lagunar costero y somero de 1 km de extensión que está separado de la bahía por El Mogote, una barrera formada por sedimentos de tipo arenoso derivados del transporte litoral. En el interior de la bahía se presentan 3 esteros: Balandra, Enfermería y Zacatecas, con presencia de vegetación de manglar (Contreras-Espinosa, 2010; González-Acosta, 1998; Lewis y Ebeling, 1971; Obeso-Nieblas et al., 2008; Roberts, 1989). La importancia de las áreas de manglar radica en su contribución en el reclutamiento de especies y su aporte a las cadenas tróficas entre los ecosistemas costeros y la bahía (González-Acosta, 1998; González-Acosta et al., 2005; González-Acosta, Ruiz-Campos et al., 2015; López-Rasgado et al. 2012). La bahía se conecta con el golfo de California, a través de la Boca Grande que se localiza al norte (punta Cabeza de Mechudo) y en el sur por el canal de San Lorenzo (Obeso-Nieblas et al., 2008); al suroeste está delimitada por El Mogote y al sureste por la isla Espíritu Santo, el canal de San Lorenzo y punta Pichilingue. El clima de este ecosistema es de tipo árido o desértico (BW (h’) hw (e’)) (García, 2004), con escasa precipitación pluvial (media anual de 185 mm), una temperatura promedio de 23.5 °C y una tasa de evaporación anual de 2,387.2 mm (González-Acosta, 1998). La batimetría de la bahía es somera, excepto en las zonas de canales, cuyo gradiente batimétrico varía desde los 10 m de profundidad en la porción sur hasta 450 m en el norte (Obeso-Nieblas et al., 2008); en la parte central los sedimentos son de tipo arenoso y de carbonato de calcio, mientras que en los márgenes de las zonas intermareales son de tipo limoso y fango-arenoso, con barreras arenosas formadas por escurrimientos ausentes o muy localizados (Contreras-Espinosa, 2010). De igual manera se pueden encontrar sustratos duros en las áreas insulares y, de forma discontinua, en el margen peninsular de la bahía.
El listado sistemático de la ictiofauna que caracteriza a la bahía de La Paz, se compiló por medio de la revisión crítica de registros documentados en la literatura (Abitia-Cárdenas et al., 1994; Balart et al., 1995, 1997; Castro-Aguirre y Balart, 1997; Castro-Aguirre y Espinosa-Pérez, 1996; Espinosa-Pérez et al., 2004), de bases de datos y por medio de la verificación taxonómica de ejemplares contenidos en colecciones ictiológicas de referencia nacional y regional (CNPE-IBUNAM, CI-CIBNOR y CI-UABC). La identificación de los taxones se confimó mediante la consulta de catálogos (Allen y Robertson, 1994) y claves especializadas (Castro-Aguirre et al., 1999; Fischer et al., 1995), así como de fuentes de información electrónica como el Catálogo de Peces de Eschmeyer et al. (2017) y FishBase (Froese y Pauly, 2017).
El arreglo taxonómico (nomenclatura y clasificación) sigue en lo general a Last et al. (2016) y Page et al. (2013). La información sobre el estado de conservación e importancia comercial de las especies se obtuvo de la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2017) y la Norma Oficial Mexicana NOM-059-Semarnat-2010 (Semarnat, 2010), así como de fuentes de información local (Ramírez- Rodríguez,1997;Ramírez-Rodríguez y Rodríguez,1990; Vázquez-Hurtado et al., 2010; Villavicencio-Garayzar, 1996; Villavicencio-Garayzar et al., 1997) y observaciones de campo. Las afinidades zoogeográficas y los patrones de distribución, fueron determinados con base en los criterios de Briggs (1974) y Castro-Aguirre et al. (2005, 2006), respectivamente. La información de los hábitats en donde concurren las especies, se obtuvo de los datos de recolecta de los ejemplares, observaciones en campo y de la literatura pertinente.
Resultados
Se integró un listado íctico actualizado para BLP que consiste en 533 especies, 314 géneros, 123 familias, 34 órdenes y 2 clases (Tabla 1). La clase Chondrichthyes se compone de 2 subclases, 9 órdenes, 22 familias, 35 géneros y 66 especies, que representan 12.4% de la ictiofauna total en la bahía; dentro de este grupo de peces cartilaginosos, los Carcharhiniformes son el orden más diverso (4 familias, 11 géneros y 24 especies; Fig. 2) y la familia Carcharhinidae es la mejor representada con 6 géneros y 12 especies, 7 de las cuales pertenecen al género Carcharhinus Blainville, 1816. En orden de importancia le siguen los Myliobatiformes (6 familias, 9 géneros y 19 especies), con mayor representación de la familia Mobulidae (3 géneros y 8 especies).
Tabla 1 Elenco íctico actualizado de la bahía de La Paz, Baja California Sur, México. El arreglo taxonómico sigue a Page et al. (2013). Tipo de hábitat (H): AI (insular), BAP (batipelágico), BP (bentopelágico), C (costero), D (demersal), EM (biotopo de manglar), F (dulceacuícola), FB (fondos blandos), FB (fondos duros: arrecifes), IM (intermareal), MP (mesopelágico), PO (pelágico-oceánico). Zoogeografía (Z, sensu Briggs, 1974): provincias Oregoniana (PO), de San Diego (PS), de Cortés (PC), Mexicana (PM), Panámica (PP) y Galápagos (PG); distribución geográfica (sensu Castro-Aguirre et al. 2005, 2006): AA (anfiamericana), AP (anfipacífica), AAT (anfiatlántica), E (endémica), Ex (exótica) y CT (circuntropical). Categoría en la Lista Roja de Especies Amenzadas de la UICN: Amenazada (EN), críticamente amenazada (CR), casi amenazada (NT), datos deficientes (DD), No evaluado (NE), preocupación menor (LC), Vulnerable (V). Categorías en la NOM-059-SEMARNAT-2010 (N): Amenazada (A) y Protección especial (Pr). Importancia económica sensu UICN (IU). Importancia económica sensu información local (IL). * Especies de interés comercial que se encuentran bajo alguna categoría de riesgo o conservación.
| Taxón | H | Z | UICN | N | IU | IL |
| Clase Chondrichthyes | ||||||
| Subclase Holocephali | ||||||
| Orden Chimaeriformes | ||||||
| Familia Chimaeridae | ||||||
| Hydrolagus colliei (Lay y Bennett, 1839) | D | PO,PS,PC | LC | |||
| Subclase Elasmobranchii | ||||||
| Orden Heterodontiformes | ||||||
| Familia Heterodontidae | ||||||
| Heterodontus francisci (Girard, 1855) | FB | PS,PC,PM,PP | DD | X | ||
| Heterodontus mexicanus Taylor y Castro-Aguirre, 1972 | FB | PC,PM,PP | DD | X | ||
| Orden Orectolobiformes | ||||||
| Familia Ginglymostomatidae | ||||||
| Ginglymostoma unami Del Moral-Flores, Ramírez-Antonio, Angulo y | AI,C,FD | PS,PC,PM,PP | DD | X | X | |
| Pérez-Ponce de León, 2015* | ||||||
| Familia Rhincodontidae | ||||||
| Rhincodon typus Smith, 1828* | PO | CT | EN | A | X | X |
| Orden Lamniformes | ||||||
| Familia Odontaspididae | ||||||
| Odontaspis ferox (Riso, 1810)* | BP | CT | V | X | X | |
| Familia Alopiidae | ||||||
| Alopias pelagicus Nakamura, 1935* | PO | AP | V | X | X | |
| Alopias superciliosus (Lowe, 1841)* | PO | CT | V | X | X | |
| Alopias vulpinus (Bonnaterre, 1788)* | C,PO | CT | V | X | X | |
| Familia Lamnidae | ||||||
| Carcharodon carcharias (Linnaeus, 1758)* | PO | CT | V | A | X | X |
| Isurus oxyrinchus Rafinesque, 1810* | C,PO | CT | V | X | X | |
| Orden Carcharhiniformes | ||||||
| Familia Scyliorhinidae | ||||||
| Cephaloscyllium ventriosum (Garman, 1880)* | D,FD | PS,PC | LC | X | X | |
| Parmaturus xaniurus (Gilbert, 1892) | D,FD | PO,PS,PC | DD | |||
| Familia Triakidae | ||||||
| Mustelus californicus Gill, 1864* | C,EM | PS,PC | LC | X | X | |
| Mustelus henlei (Gill, 1863)* | D,EM | PO,PS,PC,PM,PP | LC | X | X | |
| Mustelus lunulatus Jordan y Gilbert, 1882* | C,EM | PS,PC,PM,PP | LC | X | X | |
| Triakis semifasciata Girard, 1855 | D | PO,PS,PC | LC | X | ||
| Familia Carcharhinidae | ||||||
| Carcharhinus brachyurus (Günther, 1870)* | C | CT | NT | X | X | |
| Carcharhinus cerdale Gilbert, 1898 | PO | PC,PM,PP | NE | |||
| Carcharhinus falciformis (Müller y Henle, 1839)* | PO | CT | NT | X | X | |
| Carcharhinus leucas (Müller y Henle, 1839)* | C,D | CT | NT | X | X | |
| Carcharhinus limbatus (Müller y Henle, 1839)* | C,FB,FD | CT | NT | X | X | |
| Carcharhinus longimanus (Poey, 1861) | PO | CT | V | |||
| Carcharhinus obscurus (Lesueur, 1818)* | PO | CT | V | X | X | |
| Galeocerdo cuvier (Péron y Lesueur, 1822)* | AI,C | CT | NT | X | X | |
| Nasolamia velox (Gilbert, 1898)* | C | PS,PC,PM,PP | DD | X | X | |
| Negaprion brevirostris (Poey, 1868)* | EM,FB | AA, AAT | NT | X | X | |
| Prionace glauca (Linnaeus, 1758)* | PO | CT | NT | X | X | |
| Rhizoprionodon longurio (Jordan y Gilbert, 1882)* | C | PS,PC,PM,PP | DD | X | X | |
| Familia Sphyrnidae | ||||||
| Sphyrna corona Springer, 1940* | D | PC,PM,PP | NT | X | X | |
| Sphyrna lewini (Griffith y Smith, 1834)* | AI,C,D,PO | CT | EN | X | X | |
| Sphyrna media Springer, 1940 | D | AA | DD | X | ||
| Sphyna mokarran (Rüpell, 1837)* | AI,C,PO | AP | EN | X | X | |
| Sphyrna tiburo (Linnaeus, 1758) | AI,C,FB | AA | DD | X | ||
| Sphyna zygaena (Linnaeus, 1758)* | AI,C | AP | V | X | X | |
| Orden Squatiniformes | ||||||
| Familia Squatinidae | ||||||
| Squatina californica Ayres, 1859* | C,D | PS,PC,PM,PP | NT | X | X | |
| Orden Torpediniformes | ||||||
| Familia Narcinidae | ||||||
| Diplobatis ommata (Jordan y Gilbert, 1890) | C,D,FB | PC,PM,PP | V | X | ||
| Narcine entemedor Jordan y Starks, 1895 | C,D,FB | PC,PM,PP | DD | X | ||
| Narcine vermiculatus Breder, 1928 | C,D,FB | PC,PM,PP | NT | X | ||
| Orden Rajiformes | ||||||
| Familia Rhinobatidae | ||||||
| Pseudobatos glaucostigma Jordan y Gilbert, 1883 | C,D,FB | PS,PC,PM,PP | DD | X | ||
| Pseudobatos leucorrhynchus Günther, 1867 | C,D,FB | PC,PM,PP | NT | X | ||
| Pseudobatos productus (Ayres, 1854)* | C,FB | PS,PC | NT | X | X | |
| Familia Trygonorrhinidae | ||||||
| Zapteryx exasperata (Jordan y Gilbert, 1880) | C,D,FB,FD | PS,PC,PM,PP | DD | X | ||
| Familia Rajidae | ||||||
| Beringraja cortezensis (McEachran y Miyake, 1988) | D | PC,E | DD | |||
| Beringraja inornata (Jordan y Gilbert, 1881) | C,D | PS,PC,PM,PP | DD | |||
| Rostroraja equatorialis (Jordan y Bollman, 1890) | C,D | PS,PC | DD | X | ||
| Rostroraja velezi (Chirichigno, 1973) | D | PC,PM,PP | DD | X | ||
| Orden Myliobatiformes | ||||||
| Familia Platyrhynidae | ||||||
| Plathyrinoidis triseriata (Jordan y Gilbert, 1880) | C,D,FB | PS,PC | LC | |||
| Familia Urotrygonidae | ||||||
| Urobatis concentricus Osburn y Nichols, 1916 | AI,C,D,FB,FD | PC,PM | DD | X | ||
| Urobatis halleri (Cooper, 1863) | C,D,EM,FB | PS,PC,PM,PP | DD | X | ||
| Urobatis maculatus Garman, 1913 | AI,C,D,EM,FB | PC,PM | DD | |||
| Urotrygon chilensis (Günther,1872) | EM | PS,PC,PM,PP | DD | |||
| Urotrygon rogersi (Jordan y Starks, 1895) | C,D,FB | PC,PM,PP | DD | |||
| Familia Dasyatidae | ||||||
| Hyphanus dipterurus (Jordan y Gilbert, 1880) | FB | PO,PS,PC,PM,PP,PG | DD | |||
| Hyphanus longus (Garman, 1880) | D,FB | PC,PM,PP,PG | DD | |||
| Familia Gymnuridae | ||||||
| Gymnura crebipunctata (Peters, 1869) | FB | PS,PC | NE | |||
| Gymnura marmorata (Cooper, 1864)* | EM,FB | PS,PC,PM,PP | LC | X | X | |
| Familia Aetobatidae | ||||||
| Aetobatos laticeps Gill, 1865* | C,D,FB | PS,PM,PP,PG | NE | X | X | |
| Mobula birostris (Walbaum, 1792)* | C,PO | CT | V | X | X | |
| Mobula japanica (Müller y Henle, 1841)* | PO | CT | NT | X | X | |
| Mobula munkiana Notarbartolo-di-Sciara, 1987* | PO | PC,PM,PP,PG | NT | X | X | |
| Mobula tarapacana (Philippi, 1893)* | PO | CT | V | X | X | |
| Mobula thursoni (Lloyd, 1908)* | C,PO | CT | NT | X | X | |
| Myliobatis californica Gill, 1865* | AI,C,FB | PO,PS,PC,PM,PP | LC | X | X | |
| Myliobatis longirostris Applegate y Fitch, 1964 | D,FB | PS,PC,PM,PP | NT | X | ||
| Rhinoptera steindachneri Evermann y Jenkins, 1891 | C,D | PC,PM,PP | NT | X | ||
| Clase Actinoperygii | ||||||
| Orden Elopiformes | ||||||
| Familia Elopidae | ||||||
| Elops affinis Regan, 1909 | AI,EM,FB | PS,PC,PM,PP | DD | |||
| Orden Albuliformes | ||||||
| Familia Albulidae | ||||||
| Albula esuncula (Garman, 1899) | AI,EM,FB | PS,PC,PM,PP | LC | X | ||
| Orden Angulliformes | ||||||
| Familia Muraenidae | ||||||
| Anarchias galapagensis (Seale, 1940) | FB,FD | PC,PM,PP,PG | LC | |||
| Gymnomuraena zebra (Shaw, 1797) | FB,FD | CT | NE | |||
| Gymnothorax castaneus (Jordan y Gilbert, 1883) | AI,D,FD | PS, PC,PM,PP | LC | |||
| Gymnothorax dovii (Günther, 1870) | D,FB,FD | PC,PM,PP,PG | LC | |||
| Gymnoyhorax equatorialis (Hildebrand, 1946) | D,FB | PC,PM,PP,PG | LC | |||
| Gymnothorax panamensis (Steindachner, 1876) | C,FB | PS,PC,PM,PP,PG | LC | |||
| Muraena argus (Steindachner, 1870) | D,FB,FD | PS,PC.PM,PP,PG | LC | |||
| Muraena lentiginosa Jenyns, 1842 | C,FD | PC,PM,PP,PG | LC | |||
| Familia Ophichthidae | ||||||
| Callechelys eristigma McCosker y Rosenblatt, 1972 | D,FB,FD | PS,PC,PM,PP,PG | LC | |||
| Myrichthys tigrinus Girard, 1859 | D,EM | PC,PM,PP | LC | |||
| Myrophis vafer Jordan y Gilbert, 1883 | D,EM,FB | PC,PM,PP | LC | |||
| Ophichthus triserialis (Kaup, 1856) | D,FB | PO,PS,PC,PM,PP,PG | LC | |||
| Ophichthus zophochir Jordan y Gilbert, 1882 | FB | PC,PM,PP,PG | LC | X | ||
| Uropterygius macrocephalus (Bleeker, 1864) | FD | CT | NE | |||
| Familia Congridae | ||||||
| Bathycongrus varidens (Garman, 1899) | BP | PO,PS,PC,PM,PP | NE | X | ||
| Heteroconger canabus (Cowan y Rosenblatt, 1974) | D | PC,PM,PP | DD | |||
| Heteroconger digueti (Pellegrin, 1923) | EM | PC,PM | LC | |||
| Paraconger californiensis Kanazawa, 1961 | AI,D,FB | PC,PM,PP,PG | LC | |||
| Familia Nettastomatidae | ||||||
| Hoplunnis pacifica Lane y Stewart, 1968 | D | PS,PC,PM,PP | NE | |||
| Orden Clupeiformes | ||||||
| Familia Engraulidae | ||||||
| Anchoa argentivittata (Regan, 1904) | C,EM,FB,PO | PC,PM,PP | LC | |||
| Anchoa curta (Jordan y Gilbert, 1882) | FB,PO | PC,PM,PP | LC | |||
| Anchoa exigua (Jordan y Gilbert, 1882) | PO | PC,PM,PP | LC | |||
| Anchoa helleri (Hubbs, 1921) | C,FB | PC,E | LC | |||
| Anchoa lucida (Jordan y Gilbert, 1882) | C,EM,FB | PS,PC,PM | LC | |||
| Anchoa ischana (Jordan y Gilbert, 1882) | C,EM,FB | PC,PM,PP | LC | |||
| Anchoa mundeola (Gilbert y Pierson, 1898) | EM,FB | PC,PM,PP | LC | |||
| Anchoa mundeoloides (Breder, 1928) | EM,FB | PC,PM,PP | LC | |||
| Anchoa nasus (Kner y Steindachner, 1867) | C,EM | PS,PC,PM,PP | LC | X | ||
| Anchoa walkeri Baldwin y Chang, 1970 | C,EM | PC,PM,PP | LC | X | ||
| Anchovia macrolepidota (Kner, 1863) | C,FB | PS,PC,PM,PP | LC | X | ||
| Cetengraulis mysticetus (Günther, 1867) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Engraulis mordax Girard, 1854 | EM,PO | PS,PC,PM,PP | LC | X | ||
| Familia Clupeidae | ||||||
| Etrumeus teres (De Kay, 1842) | C,EM,PO | PS,PC,PM,PP | NE | |||
| Harengula thrissina (Jordan y Gilbert, 1882) | C,EM,FB | PS,PC,PM,PP | LC | X | ||
| Lile nigrofasciata Castro-Aguirre, Ruiz-Campos y Balart, 2002 | C,EM,FB | PC,PM,PP | LC | |||
| Lile stolifera Jordan y Gilbert, 1884) | C,EM,FB | PC,PM,PP | LC | X | ||
| Opisthonema libertate (Günther, 1867) | AI,C,EM,FB | PS,PC,PM,PP | LC | X | ||
| Opisthonema medirrastre Berry y Barret, 1963 | EM | PS,PC,PM,PP | LC | X | ||
| Sardinops sagax (Jenyns, 1842) | EM,FB,PO | CT | LC | X | ||
| Orden Gonorynchiformes | ||||||
| Familia Chanidae | ||||||
| Chanos chanos (Forsskål, 1775) | AI,EM,PO | CT | NE | X | ||
| Orden Siluriformes | ||||||
| Familia Ariidae | ||||||
| Ariopsis seemanni (Günther, 1864) | C,EM,FB | PC,PM,PP | LC | X | ||
| Bagre panamensis (Gill, 1863) | C,EM,FB | PS,PC,PM,PP | LC | X | ||
| Bagre pinnimaculatus (Steindachner, 1877) | C,EM,FB | PC,PM,PP | LC | X | ||
| Notarius planiceps (Steindachner,1877) | C,EM,FB | PS,PC,MP,PP | LC | X | ||
| Occidentarius platypogon (Günther, 1864) | AI,C | PS,PC,PM,PP | LC | X | ||
| Orden Argentiniformes | ||||||
| Familia Argentinidae | ||||||
| Argentina sialis Gilbert, 1890 | MP,PO | PO,PS,PC | LC | |||
| Orden Osmeriformes | ||||||
| Familia Bathylagidae | ||||||
| Leuroglossus stilbius Gilbert, 1890 | BP | PO,PS,PC | NE | |||
| Orden Stomiiformes | ||||||
| Familia Phosichthyidae | ||||||
| Vinciguerria lucetia (Garman, 1899) | BAP | AP | NE | |||
| Orden Aulopiformes | ||||||
| Familia Aulopidae | ||||||
| Aulopus bajacali Parin y Kotylar, 1984 | D,FB | PS,PC | NE | |||
| Familia Synodontidae | ||||||
| Synodus evermanni Jordan y Bollman, 1890 | D,FB | PS,PC,PM,PP | LC | |||
| Synodus lucioceps (Ayres, 1855) | FB,FD | PS,PC,PM | LC | X | ||
| Synodus scituliceps Jordan y Gilbert, 1882 | D,EM,FB | PS,PC,PM,PP | LC | X | ||
| Synodus sechurae Hildebrand, 1946 | D | PC,PM,PP | LC | |||
| Familia Chlorophthalmidae | ||||||
| Chlorophthalmus agassizii Bonaparte, 1840 | BP | CT | NE | |||
| Familia Paralepididae | ||||||
| Lestidiops jayakari (Boulenger, 1889) | BP | CT | NE | |||
| Orden Myctophiformes | ||||||
| Familia Myctophidae | ||||||
| Benthosema panamense (Tåning, 1932) | MP | PS,PC,PM,PP | NE | |||
| Diogenichthys laternatus (Garman, 1899) | MP | CT | NE | |||
| Triphoturus mexicanus (Gilbert, 1890) | MP | PO,PS,PC,PM,PP | NE | |||
| Orden Lampriformes | ||||||
| Familia Lampridae | ||||||
| Lampris guttatus (Brünnich, 1788) | MP | CT | NE | |||
| Familia Regalecidae | ||||||
| Regalecus ruselli (Cuvier, 1816) | EM,PO | AP | NE | |||
| Orden Gadiformes | ||||||
| Familia Bregmacerotidae | ||||||
| Bregmaceros bathymaster Jordan y Bollman, 1890 | MP | PS,PC,PM,PP | LC | |||
| Familia Moridae | ||||||
| Physiculus nematopus Gilbert, 1890 | D, MP | PS,PC,PM,PP,PG | LC | |||
| Physiculus rastrelliger Gilbert, 1890 | D | PO,PS,PC,PM,PP | LC | |||
| Familia Merlucciidae | ||||||
| Merluccius productus (Ayres, 1855) | MP | PO,PS,PC | LC | X | ||
| Orden Ophidiiformes | ||||||
| Familia Carapidae | ||||||
| Carapus dubius (Putnam, 1847) | D | PS,PC,PM,PP | DD | |||
| Encheliophis vermicularis Müller, 1842 | D,FD | CT | NE | |||
| Familia Ophidiidae | ||||||
| Brotula clarkae Hubbs, 1944 | BP,FB | PC,PM,PP | DD | X | ||
| Chilara taylori (Girard, 1858) | D | PS,PC,PM,PP | LC | |||
| Cherublemma emmelas (Gilbert, 1890) | D,FB | PC,PM,PP | NE | |||
| Lepophidium microlepis (Gilbert, 1890) | D | PS,PC | LC | |||
| Lepophidium pardale (Gilbert, 1890) | D,FB | PC,E | LC | |||
| Lepophidium prorates (Jordan y Bollman, 1890) | D,FB | PC,PM.PP | LC | |||
| Lepophidium stigmatistium (Gilbert, 1890) | D,FB | PS,PC | LC | |||
| Neobythites stelliferoides Gilbert, 1890 | D | PC,PM,PP | LC | X | ||
| Ophidion galeoides (Gilbert, 1890) | D,FB | PS,PC,PM,PP | LC | |||
| Ophidion scrippsae (Hubbs, 1916) | D | PS,PC | LC | |||
| Ophidion iris Breder, 1936 | D,FD | PS,PC,PM | LC | |||
| Familia Bithytidae | ||||||
| Grammonus diagrammus (Heller y Snodgrass, 1903) | C,FD | PO,PS,PC,PM,PP,PG | NE | |||
| Ogilbia ventralis (Gill, 1863) | C,FD | PS,PC | LC | |||
| Orden Batrachoidiformes | ||||||
| Familia Batrachoididae | ||||||
| Porichthys analis Hubbs y Schultz, 1939 | C,D | PS,PC,PM | LC | |||
| Porichthys margaritatus (Richardson, 1844) | D,FB | PS,PC,PM,PP | LC | |||
| Porichthys myriaster Hubbs y Schultz, 1939 | C,D,FB | PS,PC | LC | |||
| Porichthys notatus Girard, 1854 | C,D | PO,PS,PC | LC | |||
| Orden Lophiformes | ||||||
| Familia Lophiidae | ||||||
| Lophioides caulinaris (Garman, 1899) | D | PS,PC,PM,PP | LC | |||
| Lophioides spilurus (Garman, 1899) | D | PS,PC,PM,PP | LC | |||
| Lophius setigerus (Vahl, 1797) | AI,D,FB | AP | NE | |||
| Familia Antennariidae | ||||||
| Antennarius striatus (Gill, 1863) | FD | CT | LC | |||
| Fowlerichthys avalonis (Jordan y Starks, 1907) | D,FB,FD | PS,PC,PM,PP,PG | LC | |||
| Familia Ogcocephalidae | ||||||
| Dibranchus nudivomer (Garman, 1899) | D | PC,PM,PP | NE | |||
| Zalieutes elater (Jordan y Gilbert, 1882) | D,FB | PS,PC,PM,PP,PG | LC | |||
| Orden Mugiliformes | ||||||
| Familia Mugilidae | ||||||
| Chaenomugil proboscideus (Günther, 1861) | FD,IM | PS,PC,PM,PP | LC | |||
| Mugil cephalus Linnaeus, 1758 | AI,EM,FB | CT | LC | X | X | |
| Mugil curema Valenciennes, 1836 | AI,EM,FB | CT | NE | |||
| Mugil hospes Jordan y Culver, 1895 | C,D,FB,FD | AA | LC | |||
| Orden Atheriniformes | ||||||
| Familia Atherinopsidae | ||||||
| Atherinella eriarcha Jordan y Gilbert, 1882 | EM,FB | PS,PM,PP | LC | |||
| Orden Beloniformes | ||||||
| Familia Exocoetidae | ||||||
| Fodiator acutus (Valenciennes, 1847) | PO | PS,PC,PM,PP | NE | |||
| Familia Hemiramphidae | ||||||
| Hemiramphus saltator Gilbert y Starks, 1904 | PO | PO,PS,PC,PM,PP | NE | |||
| Hyporamphus naos Banford y Collette, 2001 | AI,C,EM | PS,PC,PM,PP | LC | |||
| Hyporamphus rosae (Jordan y Gilbert, 1880) | C,FB | PS,PC,PM,PP | DD | |||
| Familia Belonidae | ||||||
| Ablennes hians (Valenciennes, 1846) | AI,C,PO | CT | NE | |||
| Platybelone argalus (Lesueur, 1821) | AI | CT | LC | |||
| Strongylura exilis (Girard, 1854) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Tylosurus pacificus (Steindachner, 1876) | AI | CT | LC | X | ||
| Orden Cyprinodontiformes | ||||||
| Familia Poeciliidae | ||||||
| Poecilia butleri Jordan, 1889 | EM,F | Ex | NE | Pr | ||
| Orden Beryciformes | ||||||
| Familia Holocentridae | ||||||
| Myripristis leiognathus Valenciennes, 1846 | FD,IM | PS,PC,PM,PP,PG | LC | |||
| Sargocentron suborbitale (Gill, 1863) | AI,FD | PS,PC,PM,PP | LC | |||
| Orden Gasterosteiformes | ||||||
| Familia Syngnathidae | ||||||
| Cosmocampus arctus (Jenkins y Evermann, 1889) | FD,PO | PS,PC | LC | |||
| Doryrhamphus excisus Kaup, 1856 | FD | CT | LC | |||
| Hippocampus ingens Girard, 1858 | FD | PS,PC,PM,PP | V | X | ||
| Pseudophallus starksii (Jordan y Culver, 1895) | EM,FB | PC,PM,PP | NE | |||
| Syngnathus auliscus (Swain, 1882) | EM,FB | PS,PC,PM,PP | LC | |||
| Familia Aulostomidae | ||||||
| Aulostomus chinensis (Linnaeus, 1766) | BP | CT | NE | |||
| Familia Fistulariidae | ||||||
| Fistularia commersonii Rüpell, 1838 | AI,EM,FD | AP | NE | |||
| Fistularia corneta Gilbert y Starks, 1904 | AI,EM | PC,PM,PP | LC | |||
| Orden Scorpaeniformes | ||||||
| Familia Scorpaenidae | ||||||
| Pontinus sierra (Gilbert, 1890) | D | PC,PM,PP | LC | |||
| Scorpaena guttata Girard, 1854 | D,FD | PS,PC | DD | X | ||
| Scorpaena mystes Jordan y Starks, 1895 | AI,FD | PC,PM,PM,PG | LC | |||
| Scorpaena russula Jordan y Bollman, 1890 | C | PC,PM,PP | LC | |||
| Scorpaena sonorae Jenkins y Evermann, 1889 | D | PS,PC | LC | |||
| Scorpaenodes xyris (Jordan y Gilbert, 1882) | C,FD | PO,PS,PC,PP,PG | LC | |||
| Familia Triglidae | ||||||
| Bellator gymnostethus (Gilbert, 1892) | D | PS,PC,PM,PP | LC | X | ||
| Bellator loxias (Jordan, 1897) | D | PC,PM,PP,PG | LC | |||
| Bellator xenisma (Jordan y Bollman, 1890) | D | PO,PS,PC,PM,PP | LC | |||
| Prionotus albirostris Jordan y Bollman, 1890 | D | PC,PM,PP | LC | |||
| Prionotus birostratus Richardson, 1844 | D | PC,PM,PP | LC | |||
| Prionotus horrens Richardson, 1844 | D,FB | PC,PM,PP | LC | |||
| Prionotus ruscarius Gilbert y Starks, 1904 | D | PS,PC,PM,PP | LC | |||
| Prionotus stephanophrys Lockington, 1881 | D | PS,PC,PM,PP | LC | |||
| Familia Peristediidae | ||||||
| Peristedion paucibarbiger Castro-Aguirre y García-Domínguez, 1984 | D | PC,PM | NE | |||
| Familia Hexagrammidae | ||||||
| Zaniolepis frenata Eigenmann y Eigenmann, 1889 | D,FB | PO,PS,PC | NE | |||
| Orden Perciformes | ||||||
| Familia Centropomidae | ||||||
| Centropomus armatus Gill, 1863 | EM | PC,PM,PP | LC | |||
| Centropomus nigrescens Günther, 1864 | EM | PC,PM,PP | LC | |||
| Centropomus robalito Jordan y Gilbert, 1882 | FB | PC,PM,PP | LC | |||
| Centropomus unionensis Bocourt, 1868 | C,D | PC,PM,PP | LC | |||
| Centropomus viridis Lockington, 1877 | EM | PS,PC,PM,PP | LC | |||
| Familia Polyprionidae | ||||||
| Stereolepis gigas Ayres, 1859 | D,FB | CT | NT | |||
| Familia Epinephelidae | ||||||
| Alphestes immaculatus Breder, 1936 | AI,D,FD | PC,PM,PP | LC | X | ||
| Alphestes multiguttatus (Günther, 1867) | C,D | PC,PM,PP | LC | X | ||
| Cephalopholis panamensis (Steindachner, 1877) | AI,FD | PC,PM,PP,PG | LC | X | ||
| Epinephelus analogus Gill, 1863 | FB | PS,PC,PM,PP,PG | LC | X | X | |
| Epinephelus labriformis (Jenyns, 1840) | AI,FD | PC,PM,PP,PG | LC | X | X | |
| Epinephelus quinquefasciatus (Bocourt, 1868)* | AI,FD,EM | PC,PM,PP | DD | X | X | |
| Hyporthodus acanthistius (Gilbert,1892) | D,FB,FD | PS,PC,PM,PP | LC | |||
| Hyporthodus niphobles (Gilbert y Starks, 1897) | EM | PS,PC,PM,PP | LC | X | X | |
| Mycteroperca jordani (Jenkins y Evermann, 1889) | FD | PC,PM | EN | X | ||
| Mycteroperca prionura Rosenblatt y Zahuranec, 1967 | FD | PC,PM | NT | X | ||
| Mycteroperca rosacea (Streets, 1877)* | FD | PS,PC,PM | V | X | X | |
| Mycteroperca xenarca Jordan, 1888 | EM | PS,PC,PM,PP | LC | X | ||
| Paranthias colonus (Valencienne, 1846) | AI, FD | PS,PC,PM,PP | LC | X | X | |
| Familia Serranidae | ||||||
| Diplectrum euryplectrum Jordan yBollman, 1890 | EM,FB | PS,PC,PM,PP | LC | |||
| Diplectrum labarum Rosenblatt y Johnson, 1974 | EM | PC,MP,PP | LC | |||
| Diplectrum macropoma (Günther, 1864) | D | PS,PC,PM,PP,PG | LC | |||
| Diplectrum pacificum Meek y Hildebrand, 1925 | EM | PS,PC,PM,PP | LC | |||
| Diplectrum rostrum Bortone, 1974 | D | PC,PM,PP | LC | |||
| Diplectrum sciurus Gilbert, 1892 | D,FB | PS,PC | LC | |||
| Hemanthias peruanus (Steindachner, 1875) | D,FB | PS,PC,PM,PP | LC | X | X | |
| Liopropoma longilepis Garman, 1899 | FD | PC,PM,PP | DD | X | ||
| Paralabrax auroguttatus Walford, 1936* | FB | PS,PC | DD | X | X | |
| Paralabrax loro Waldford, 1936 | FD | PC,PM,PP | DD | X | ||
| Paralabrax maculatofasciatus (Steindachner, 1868) | EM,FB | PS,PC,PM,PP | LC | X | X | |
| Paralabrax nebulifer (Girard, 1854) | FB | PS,PC,PM | LC | X | X | |
| Pronotogrammus eos Gilbert, 1890 | D,FB | PC,PM,PP | NE | |||
| Pronotogrammus multifasciatus Gill, 1863 | D | PS,PC,PM,PP | LC | |||
| Pseudogramma thaumasia (Gilbert, 1900) | FD | PC,PM,PP,PG | LC | |||
| Rypticus bicolor Valenciennes, 1846 | FB | PS,PC,PM,PP,PG | LC | |||
| Serranus aequidens Gilbert, 1890 | D | PS,PC,PM,PP | LC | |||
| Serranus psittacinus Valencienne, 1846 | FB | PC,PM,PP,PG | LC | |||
| Familia Opistognathidae | ||||||
| Lonchopisthus sinuscalifornicus Castro-Aguirre y Villavicencio- | D,FB | PC,PM,PP | LC | |||
| Garayzar, 1988 | ||||||
| Opistognathus punctatus Peters, 1869 | FB,FD | PS,PC,PM,PP,PG | LC | |||
| Opistognathus rosenblatti Allen y Robertson, 1991 | FD | PC,E | LC | Pr | ||
| Familia Priacanthidae | ||||||
| Pristigenys serrula (Gilbert, 1891) | D,FD | PS,PC,PM,PP | LC | X | X | |
| Famila Apogonidae | ||||||
| Apogon atricaudus Jordan y McGregor, 1898 | AI,FD | PO,PS,PC | LC | |||
| Apogon pacificus (Herre, 1935) | FD | PS,PC,PM,PP | LC | |||
| Apogon retrosella (Gill, 1862) | FD | PC,PM,PP | LC | |||
| Familia Malacanthidae | ||||||
| Caulolatilus affinis Gill, 1865 | D,FB,FD | PC,PM,PP | LC | X | X | |
| Caulolatilus princeps (Jenyns, 1840) | D,FD | PC,PM,PP,PG | LC | X | X | |
| Familia Nematistiidae | ||||||
| Nematistius pectoralis Gill, 1862 | AI | PS,PC,PM,PP | NE | X | X | |
| Familia Carangidae | ||||||
| Alectis ciliaris (Bloch, 1787) | C,D | CT | LC | X | ||
| Caranx caballus Günther, 1868 | AI | PS,PC,PM,PP | LC | X | X | |
| Caranx caninus Günther, 1867 | EM,FB | PS,PC,PM,PP | LC | X | ||
| Caranx lugubris Poey, 1860 | AI,PO | PS,PC,PM,PP | NE | |||
| Caranx melampygus Cuvier,1833 | EM | CT | NE | |||
| Caranx otrynter Jordan y Gilbert, 1833 | D,PO | PS,PC,PM,PP,PG | LC | X | ||
| Caranx sexfasciatus Quoy y Gaimard, 1825 | AI,EM | PC,PM,PP | LC | X | ||
| Caranx vinctus Jordan y Gilbert, 1882 | EM,FB | PS,PC,PM,PP | LC | X | ||
| Chloroscombus orqueta Jordan y Gilbert, 1883 | EM,FB | PS,PC,PM,PP | LC | X | ||
| Decapterus macarellus (Cuvier, 1833) | PO | CT | NE | |||
| Elagatis bipinnulata (Quoy y Gaimard, 1825) | PO,FD | CT | NE | |||
| Gnathanodon speciosus (Forsskål, 1775) | EM,FD | PC,PM,PP | NE | X | X | |
| Hemicaranx leucurus (Günther, 1864) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Hemicaranx zelotes Gilbert, 1898 | C,D,PO | PO,PS,PC,PM,PP | LC | X | ||
| Naucrates ductor (Linnaeus, 1758) | PO | CT | NE | |||
| Oligoplites altus (Güntherm 1868) | EM,FB | PC,PM,PP | LC | X | ||
| Oligoplites refulgens Gilbert y Starks, 1904 | EM | PS,PC,PM,PP | LC | X | ||
| Oligoplites saurus (Bloch y Schneider, 1801) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Selar crumenophthalmus (Bloch, 1793) | FB | CT | NE | |||
| Selene brevoortii (Gill, 1863) | C,D,FB | PS,PC,PM,PP | LC | X | ||
| Selene peruviana (Guichenot, 1866) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Seriola lalandi Valenciennes, 1833 | C,FD,BP | CT | NE | X | ||
| Seriola peruana Steindachner, 1881 | C,D,PO | PC,PM,PP | LC | |||
| Seriola rivoliana Valenciennes, 1833 | D,PO | CT | NE | |||
| Trachinotus kennedyi Steindachner, 1876 | C,EM | PS,PC,PM,PP | LC | X | ||
| Trachinotus paitensis Cuvier, 1832 | FB | PS,PC,PM,PP | LC | X | ||
| Trachinotus rodophus Gill, 1863 | AI | PS,PC,PM,PP | LC | |||
| Trachurus symmetricus (Ayres, 1855) | EM,PO | PS,PC,PM,PP | LC | |||
| Familia Coryphaenidae | ||||||
| Coryphaena hippurus Linnaeus, 1758 | C,PO | CT | LC | X | X | |
| Familia Echeneidae | ||||||
| Remora albescens (Temminck y Schlegel, 1850) | PO | CT | LC | X | ||
| Remora brachyptera (Lowe, 1839) | PO | CT | LC | |||
| Familia Bramidae | ||||||
| Taratichthys steindachneri (Döderlein, 1884) | PO | CT | NE | |||
| Familia Lutjanidae | ||||||
| Hoplopagrus guentherii Gill, 1862 | AI,EM,FB | PS,PC,PM,PP | LC | X | X | |
| Lutjanus aratus (Günther, 1869) | AI,EM | PS,PC,PM,PP | LC | X | X | |
| Lutjanus argentiventris (Peters, 1869) | AI,EM,FB | PS,PC,PM,PP | LC | X | X | |
| Lutjanus colorado Jordan y Gilbert, 1882 | AI,EM,FB | PS,PC,PM,PP | LC | X | X | |
| Lutjanus guttatus (Steindachner, 1869) | FB | PS,PC,PM,PP | LC | X | X | |
| Lutjanus inermis (Peters, 1869) | AI,FB,FD | PS,PC,PM,PP,PG | LC | |||
| Lutjanus novemfasciatus Gill, 1862 | AI,EM,FB | PS,PC,PM,PP | LC | X | X | |
| Lutjanus peru (Nichols y Murphy, 1922) | FD | PS,PC,PM,PP | LC | X | X | |
| Lutjanus viridis (Valenciennes, 1846) | FD | PS,PC,PM,PP,PG | LC | X | X | |
| Familia Gerreidae | ||||||
| Deckertichthys aureolus (Jordan y Gilbert,1882) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Diapterus brevirostris (Sauvage, 1879) | EM,FB | PS,PC,PM,PP | NE | X | ||
| Eucinostomus currani Zahuranec, 1980 | AI,EM,FB | PS,PC,PM,PP | LC | |||
| Eucinostomus dowii (Gill, 1863) | AI,EM,FB | PS,PC,PM,PP | LC | |||
| Eucinostomus entomelas Zahuranec, 1980 | AI,EM,FB | PS,PC,PM,PP | LC | |||
| Eucinostomus gracilis (Gill, 1862) | EM,FB | PS,PC,PM,PP | LC | |||
| Eugerres axillaris (Günther, 1864) | EM | PC,PM,PP | LC | |||
| Eugerres lineatus (Humboldt, 1821) | EM,FB | PC,PM,PP | LC | |||
| Gerres cinereus (Walbaum, 1792) | AI,EM,FB | AA | NE | X | ||
| Familia Haemulidae | ||||||
| Anisotremus davidsonii (Steindachner, 1876) | C,FB,FD | PS,PC | LC | X | ||
| Anisotremus interruptus (Gill, 1862) | AI | PC,PM,PP | LC | X | X | |
| Anisotremus taeniatus Gill, 1861 | C,FD | PS,PC,PM,PP | LC | |||
| Conodon serrifer Jordany Gilbert, 1882 | EM,FB | PC,PM,PP | NE | |||
| Haemulon californiensis (Steindachner, 1876) | C,FD | PS,PC | NE | |||
| Hemulon flaviguttatum Gill, 1862 | EM,FB | PS,PC,PM,PP | LC | |||
| Haemulon maculicauda (Gill, 1862) | EM,FB | PC,PM,PP | LC | |||
| Haemulon scudderi Gill, 1862 | AI,EM,FB | PC,PM,PP | LC | |||
| Haemulon sexfasciatum Gill, 1862 | AI,EM | PS,PC,PM,PP | LC | X | ||
| Haemulon steindachneri (Jordan y Gilbert, 1882) | AI,EM,FB | PC,PM,PP | LC | |||
| Haemulopsis axillaris (Steindachner, 1869) | EM,FB | PC,PM,PP | LC | X | ||
| Haemulopsis elongatus (Steindachner,1879) | EM | PS,PC,PM,PP | LC | X | ||
| Haemulopsis leuciscus (Günther, 1864) | EM,FB | PC,PM,PP | LC | X | ||
| Haemulopsis nitidus (Steindachner, 1869) | AI,EM | PC,PM,PP | LC | |||
| Microlepidotus inornatus Gill, 1862 | EM | PC,PM,PP | LC | |||
| Orthopristis chalceus (Günther, 1864) | EM | PC,PM,PP | LC | X | ||
| Orthopristis reddingi Jordan y Richardson, 1895 | EM | PC,PM,PP | LC | |||
| Pomadasys bayanus Jordan y Evermann,1898 | AI,EM | PC,PM,PP | NE | |||
| Pomadasys branickii (Steindachner, 1879) | AI,EM | PC,PM,PP | LC | X | ||
| Pomadasys macracanthus (Günther, 1864) | AI,EM | PC,PM,PP | LC | |||
| Pomadasys panamensis (Steindachner, 1876) | EM,FB | PC,PM,PP | LC | X | ||
| Xenichthys xanti Gill, 1863 | EM | PS,PC,PM,PP | LC | X | ||
| Familia Sparidae | ||||||
| Calamus brachysomus (Lockington, 1880) | AI | PS,PC,PM,PP | LC | X | X | |
| Sparus aurata Linnaeus, 1758 | FB | Ex | LC | X | ||
| Familia Polynemidae | ||||||
| Polydactylus approximans (Lay y Bennett, 1839) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Polydactylus opercularis (Gill, 1863) | D,FB | PC,PM,PP | LC | X | ||
| Familia Sciaenidae | ||||||
| Bairdiella armata Gill, 1863 | C,FB | PC,PM,PP | LC | X | ||
| Bairdiella icistia (Jordan y Gilbert, 1882) | EM,FB | PC,PM,PP | LC | |||
| Cynoscion nannus Castro-Aguirre y Arvizu-Martínez, 1976 | D | PC,PM,PP | LC | |||
| Cynoscion parvipinnis Ayres, 1861 | EM | PS,PC | DD | |||
| Cynoscion phoxocephalus Jordan y Gilbert, 1882 | EM | PS,PC,PM,PP | LC | X | ||
| Cynoscion reticulatus (Günther, 1864) | FB | PC, PM, PP | LC | X | ||
| Cynoscion xanthulus Jordan y Gilbert, 1882 | EM,FB | PC,PM,PP | DD | X | ||
| Elattarchus archidium (Jordan y Gilbert, 1882) | FB,D,EM | PC,PM,PP | LC | |||
| Larimus acclivis Jordan y Bristol, 1898 | FB | PS,PC,PM.PP | LC | X | ||
| Larimus effulgens Gilbert, 1898 | C | PS,PC,PM,PP | LC | X | ||
| Menticirrhus undulatus (Girard, 1854) | FB | PS,PC,PM,PP | DD | X | ||
| Micropogonias altipinnis (Güntther; 1864) | EM,FB | PS,PC,PM,PP | LC | X | ||
| Micropogonias ectenes (Jordan y Gilbert, 1882) | EM,FB,D | PC,PM,PP | LC | X | ||
| Ophioscion strabo Gilbert, 1897 | EM,FB | PC,PM,PP | LC | X | ||
| Pareques viola (Gilbert, 1898) | FD | PC,PM,PP | LC | |||
| Umbrina roncador Jordan y Gilbert, 1882 | EM | PC,PM | LC | X | ||
| Umbrina wintersteeni Walker y Radford, 1992 | EM | PC,PM,PP | DD | |||
| Umbrina xanti Gill, 1862 | FB | PS,PC,PM,PP | LC | X | ||
| Familia Mullidae | ||||||
| Mulloidichthys dentatus (Gill, 1862) | AI | PS,PC,PM,PP | LC | |||
| Pseudopeneus grandisquamis (Gill, 1863) | AI,EM | PC,PM,PP | LC | X | ||
| Familia Kyphosidae | ||||||
| Girella simplicidens Osburn y Nichols, 1916 | FD | PC,E | LC | |||
| Kyphosus azureus (Jenkins y Evermann, 1889) | C,FD | PC,PM | LC | |||
| Kyphosus elegans (Peters, 1869) | AI,FB | PC,PM,PP | LC | X | ||
| Kyphosus vaigiensis (Quoy y Gaimard, 1825) | AI,EM | PS,PC,PM,PP | LC | |||
| Familia Scorpididae | ||||||
| Medialuna californiensis (Steindachner, 1876) | FB | PO,PS,PC | LC | |||
| Familia Chaetodontidae | ||||||
| Chaetodon humeralis Günther, 1860 | AI,D,FD | PS,PC,PM,PP | LC | |||
| Forcipiger flavissimus Jordan y McGregor, 1898 | AI,FD | PS,PC | LC | |||
| Johnrandallia nigrirostris (Gill, 1862) | AI,FD | PC,PM,PP,PG | LC | |||
| Familia Pomacanthidae | ||||||
| Holacanthus clarionensis Gilbert, 1891 | AI,FD | PC,PM | V | Pr | X | |
| Holacanthus passer Valenciennes, 1846 | AI | PC,PM,PP | LC | Pr | ||
| Pomacanthus zonipectus (Gill, 1862) | EM | PS,PC,PM,PP | LC | Pr | X | X |
| Familia Cirrhitidae | ||||||
| Cirrhitichthys oxycephalus (Bleeker, 1855) | FD | PC,PM,PP,PG | NE | |||
| Cirrhitus rivulatus Valenciennes, 1846 | FD | PC,PM,PP,PG | LC | X | X | |
| Oxycirrhites typus Bleeker, 1857 | FD | CT | NE | |||
| Familia Pomacentridae | ||||||
| Abudefduf declivifrons (Gill, 1862) | AI,FD | PS,PC,PM,PP,PG | LC | |||
| Abudefduf troschelii (Gill,1862) | AI,EM,FB | PS,PC,PM,PP | LC | X | ||
| Chromis alta Greenfield y Woods, 1980 | AI,FD | PS,PC,PM,PP | LC | |||
| Chromis atrilobata Gill, 1862 | AI, FD | PC,PM,PP,PG | LC | |||
| Chromis limbaughi Greenfield y Woods, 1980 | AI,FD | PS,PC | LC | Pr | ||
| Hypsypops rubicundus (Girard, 1854) | FD | PS,PC | LC | |||
| Microspathodon bairdii (Gill, 1862) | FD | PC,PM,PP,PG | LC | |||
| Microspathodon dorsalis (Gill, 1862) | AI,FD | PC,PM,PP,PG | LC | |||
| Stegastes acapulcoensis (Fowler, 1944) | AI,FD,IM | PC,PM,PP,PG | LC | |||
| Stegastes flavilatus (Gill, 1862) | AI,FD | PC,PM,PP,PG | LC | |||
| Stegastes leucorus (Gilbert, 1892) | AI,FD | PS,PC,PM | V | |||
| Stegastes rectifraenum (Gill, 1862) | AI | PC,PM,PP | LC | |||
| Familia Labridae | ||||||
| Bodianus diplotaenia (Gill, 1862) | AI,FB,FD | PS,PC,PM,PP,PG | LC | X | ||
| Decodon melasma Gomon, 1974 | AI,FB,FD | PS,PC,PM,PP,PG | LC | |||
| Halichoeres chierchiae di Caporiacco, 1947 | AI,FB,FD | PS,PC,PM,PP | LC | X | ||
| Halichoeres dispilus (Günther, 1864) | AI,FD | PS,PC,PM,PP | LC | |||
| Halichoeres melanotis (Gilbert, 1890) | FD | PC,PM,PP | LC | |||
| Halichoeres nicholsi (Jordan y Gilbert, 1882) | AI,FB,FD | PS,PC,PM,PP,PG | LC | X | ||
| Halichoeres semicinctus (Ayres, 1859) | AI,FD,IM | PS,PC | LC | |||
| Iniistius pavo (Valenciennes, 1840) | FD | CT | LC | |||
| Nicholsina denticulata (Evermann y Radcliffe, 1917) | AI,FD,EM | PC,PM,PP,PG | LC | |||
| Novaculichthys taeniorus (Lacepède, 1801) | FB,FD | CT | LC | X | ||
| Scarus compressus (Osburn, y Nichols, 1916) | AI,FD | PS,PC,PM,PP,PG | LC | X | ||
| Scarus ghobban Forskål, 1775 | AI,EM | CT | LC | X | X | |
| Scarus perrico Jordan y Gilbert, 1882 | AI,FD | PC,PM.PP.PG | LC | X | X | |
| Scarus rubroviolaceus Bleeker, 1847 | AI,FD | CT | LC | X | X | |
| Semicossiphus pulcher (Ayres, 1854)* | FD | PS,PC | V | X | X | |
| Stethojulis bandanensis (Bleeker, 1851) | AI,FD,FB | CT | LC | |||
| Thalassoma lucasanum (Gill, 1862) | AI | PC,PM,PP | LC | |||
| Thalassoma grammaticum Gilbert, 1890 | AI,FD | PS,PC,PM,PP | LC | X | ||
| Familia Tripterygiidae | ||||||
| Axoclinus lucillae Fowler, 1944 | D,FD | PC,PM,PP | LC | |||
| Axoclinus multicinctus Allen y Robertson, 1992 | D,FD | PC,PM | V | |||
| Crocodilichthys gracilis Allen y Robertson, 1991 | FD | PC,E | LC | |||
| Enneanectes carminalis (Jordan y Gilbert, 1882) | FD,IM | PS,PC,PM,PP | LC | |||
| Familia Dactyloscopidae | ||||||
| Dactylagnus mundus Gill, 1862 | FB,EM | PS,PC,PM,PP,PG | LC | |||
| Dactyloscopus lunaticus Gilbert, 1890 | FB,IM | PS,PC,PM,PP | LC | |||
| Dactyloscopus pectoralis Gill, 1861 | FB,IM | PS,PC,PM,PP | LC | |||
| Gillellus ornatus Gilbert, 1892 | FB,IM | PC,E | LC | |||
| Gillellus semicinctus Gilbert, 1890 | FB | PC,PM,PP,PG | LC | |||
| Myxodagnus opercularis Gill, 1861 | C,FB | PS,PC,PM,PP,PG | LC | |||
| Familia Bleniidae | ||||||
| Entomacrodus chiostictus (Jordan y Gilbert, 1882) | FD,IM | PC,PM,PP | LC | |||
| Hypsoblennius brevipinnis (Günther, 1861) | FD | PS,PC,PM,PP,PG | LC | |||
| Hypsoblennius gentilis (Girard, 1854) | EM,FB | PS,PC | LC | |||
| Hypsoblennius jenkinsi (Jordan y Evermann, 1896) | D,FD | PS,PC | LC | |||
| Ophioblennius steindachneri Jordan y Evermann, 1898 | FD | PS,PC,PM,PP,PG | LC | |||
| Plagiotremus azaleus (Jordan y Bollman, 1890) | FD | PC,PM,PP | LC | |||
| Famila Labrisomidae | ||||||
| Exerpes asper (Jenkins y Evermann, 1889) | EM | PS,PC | LC | |||
| Labrisomus xanti Gill, 1860 | AI,FD,IM | PS,PC,PM | LC | |||
| Malacoctenus gigas Springer, 1959 | FD | PC,E | LC | |||
| Malacoctenus hubbsi Springer, 1959 | FD | PS,PC,PM | LC | |||
| Malacoctenus zacae Springer, 1959 | FD | PS,PC,PM | LC | |||
| Malacoctenus zonifer (Jordan y Gilbert, 1882) | FD | PS,PC,PM,PP | LC | |||
| Paraclinus beebei Hubs, 1952 | D, FD | PS,PC,PM,PP | LC | |||
| Paraclinus mexicanus (Gilbert, 1904) | EM | PS,PC,PM,PP | LC | |||
| Paraclinus sini Hubbs, 1952 | EM | PS,PC | LC | |||
| Starksia cremnobates (Gilbert, 1890) | FD,IM | PC,E | LC | |||
| Starksia spinipenis (Al-Uthman, 1960) | FD | PC,PM | LC | |||
| Xenomedea rhodopyga Rosenbatt y Taylor, 1971 | FD | PC,E | LC | |||
| Familia Chaenopsidae | ||||||
| Acanthemblemaria crockeri Beebe y Tee-Van, 1938 | FD | PC,E | LC | |||
| Acanthemblemaria macrospilus Brock, 1940 | FD | PS,PC,PM,PP | LC | |||
| Chaenopsis alepidota (Gilbert, 1890) | D,FD | PS,PC | LC | |||
| Chaenopsis coheni Böhlke, 1957 | FD | PS,PC,PM | DD | |||
| Cirriemblemaria lucasana (Stephens, 1963) | FD | PS,PC,PM | LC | |||
| Coralliozetus angelicus (Böhlke y Mead, 1957) | FD | PS,PC,PM | LC | |||
| Coralliozetus boehlkei Stephens, 1963 | FD | PC,PM,PP | LC | |||
| Coralliozetus micropes (Beebe y Tee-Van, 1938) | FD | PS,PC | LC | |||
| Emblemaria hypacanthus (Jenkins y Evermann, 1889) | D,FD | PC,E | LC | |||
| Protemblemaria bicirrus (Hildebrand, 1946) | FD | PS,PC,PM,PP | LC | |||
| Stathmonotus sinuscalifornici (Chabanaud, 1942) | D,FD,IM | PS,PC | LC | |||
| Familia Gobiesocidae | ||||||
| Gobiesox pinniger Gilbert, 1890 | FD,IM | PC,E | LC | |||
| Gobiesox schultzi Brigg, 1951 | FD,IM | PC,E | LC | |||
| Pherallodiscus funebris (Gilbert, 1890) | FD,IM | PC,E | LC | |||
| Tomicodon boehlkei Brigss, 1955 | FD,IM | PC,E | LC | |||
| Tomicodon humeralis (Gilbert, 1890) | FD,IM | PC,E | LC | |||
| Tomicodon zebra (Jordan y Gilbert, 1882) | FD,IM | PS,PC | LC | |||
| Familia Callionymidae | ||||||
| Synchiropus atrilabiatus (Garman, 1899) | D,FB,FD | PS,PC,PM,PP,PG | LC | |||
| Familia Eleotridae | ||||||
| Dormitator latifrons (Richardson,1844) | EM,FB | PC,PM,PP | LC | |||
| Eleotris picta Kner,1863 | EM | PS,PC,PM,PP | LC | |||
| Erotelis armiger (Jordan y Richardson, 1895) | EM | PC,PM,PP | DD | |||
| Gobiomorus maculatus (Günther, 1859) | EM,FB | PS,PC,PM,PP | LC | |||
| Familia Gobiidae | ||||||
| Aruma histrio (Jordan, 1884) | EM | PC,E | LC | |||
| Barbulifer pantherinus (Pellegrin, 1901) | EM | PC,E | DD | |||
| Bathygobius ramosus Ginsburg, 1947 | EM,FB | PS,PC,PM,PP | LC | |||
| Bollmania ocellata Gilbert, 1892 | AI,D,FB | PC,PM,PP | DD | |||
| Chriolepis minutillus Gilbert, 1892 | FB,FD | PC,E | DD | |||
| Chriolepis zebra Ginsburg, 1938 | FB,FD | PC,E | LC | |||
| Coryphoterus urospilus Ginsburg, 1938 | FD | PS,PC,PM,PP,PG | LC | |||
| Ctenogobius manglicola (Jordan y Starks, 1895) | EM | PC,PM,PP | LC | |||
| Ctenogobius sagittula (Günther, 1861) | EM,FB | PS,PC,PM,PP | LC | |||
| Elacatinus digueti (Pellegrin, 1901) | FD | PC,PM | LC | |||
| Elacatinus puncticulatus (Ginsburg, 1938) | FD | PC,PM,PP | LC | |||
| Evermannia zosterura (Jordan y Gilbert, 1882) | FB,IM | PS,PC,PM,PP | LC | |||
| Evorthodus minutus Meek y Hildebrand, 1928 | EM | PC,PM,PP | LC | |||
| Gillichthys mirabilis Cooper, 1864 | EM,FB | PS,PC | LC | |||
| Gobionellus microdon (Gilbert, 1892) | EM | PS,PC,PM,PP | LC | |||
| Gobiosoma chiquita (Jenkins y Evermann, 1889) | EM | PC,E | LC | |||
| Gobiosoma paradoxum (Günther, 1861) | FD | PC,PM,PP | LC | |||
| Gobulus crescentalis (Gilbert, 1892) | FB,FD | PS,PC,PM,PP | LC | |||
| Gobulus hancocki Ginsburg, 1938 | FB,FD | PC,PM,PP | LC | |||
| Gymneleotris seminuda (Günther, 1864) | FD | PC,PM,PP | LC | |||
| Ilypnus gilberti (Eigenmann y Eigenmann, 1889) | C,FB | PS,PC | LC | |||
| Lythrypnus dalli (Gilbert, 1890) | FD | PS,PC,PM,PP,PG | LC | |||
| Lythrypnus pulchellus Ginsburg, 1938 | FD | PS,PC,PM,PP,PG | LC | |||
| Microgobius emblematicus (Jordan y Gilbert, 1882) | D,FB | PC,PM,PP | LC | |||
| Microgobius tabogensis Meek y Hildebrand, 1928 | D,EM,FB | PS,PC,PM,PP | LC | |||
| Parrella maxillaris Ginsburg, 1938 | EM | PS,PC,PM,PP | LC | |||
| Pycnomma semisquamatum Rutter, 1904 | FD | PC,E | DD | |||
| Quietula y-cauda (Jenkins y Evermann, 1889) | EM,FB | PS,PC | LC | |||
| Familia Microdesmidae | ||||||
| Microdesmus affinis Meek y Hildebrand, 1928 | C,FB,FD | PC,PM,PP | LC | |||
| Microdesmus dipus Günther, 1864 | FD,IM | PC,PM,PP | LC | |||
| Familia Ephippidae | ||||||
| Chaetodipterus zonatus (Girard, 1858) | AI,EM,FB | PS,PC,PM,PP | LC | |||
| Parapsettus panamensis Steindachner, 1876 | FD | PC,PM,PP | LC | X | ||
| Familia Luvaridae | ||||||
| Luvarus imperialis Rafinesque, 1810 | PO | CT | NE | |||
| Familia Zanclidae | ||||||
| Zanclus cornutus (Linnaeus, 1758) | AI,FD | AP | NE | |||
| Familia Acanthuridae | ||||||
| Acanthurus achiles Shaw, 1803 | AI,FD | PS,PC | LC | X | ||
| Acanthurus nigricans (Linnaeus, 1758) | AI,FD | AP | LC | |||
| Acanthurus triostegus (Linnaeus, 1758) | AI,FD | CT | LC | X | ||
| Acanthurus xanthopterus Valenciennes, 1835 | AI | AP | LC | |||
| Prionurus laticlavius (Valenciennes, 1846) | AI,FD | PC,PM,PP | LC | |||
| Prionurus punctatus Gill, 1862 | AI | PC,PM,PP | LC | X | ||
| Familia Sphyraenidae | ||||||
| Sphyraena argentea Girard, 1854 | PO | PS,PC | LC | X | ||
| Sphyraena ensis Jordan y Gilbert, 1882 | PO | PC,PM,PP | LC | X | ||
| Sphyraena lucasana Gill, 1863 | PO | PS,PC,PM,PP | DD | X | ||
| Familia Trichiuridae | ||||||
| Trichiurus nitens Garman, 1899 | C | PS,PC,PM,PP | NE | |||
| Familia Scombridae | ||||||
| Acanthocybium solandri (Cuvier, 1832) | PO | CT | LC | X | ||
| Auxis rochei (Riso, 1810) | AI,PO | CT | LC | X | ||
| Auxis thazard (Lacepède, 1800) | EM,PO | CT | LC | X | ||
| Euthynnus lineatus KIshinouye, 1920 | PO | PS,PC,PM,PP | LC | X | ||
| Katsuwonus pelamis (Linnaeus, 1758) | PO | CT | LC | X | ||
| Scomber japonicus Houttuyn, 1782 | MP,PO | CT | LC | X | ||
| Scomberomorus concolor (Lockington, 1879) | PO | CT | V | X | ||
| Scomberomorus sierra (Jordan y Starks, 1895) | PO | PS,PC,PM,PP | LC | X | X | |
| Thunnus albacares (Bonnaterre, 1788) | PO | CT | LC | X | X | |
| Thunnus orientalis (Temminck y Schlegel, 1844) | PO | CT | LC | X | ||
| Familia Istiophoridae | ||||||
| Istiompax indica (Cuvier, 1832) | PO | CT | DD | X | ||
| Istiophorus platypterus (Shaw, 1792) | PO | CT | LC | X | ||
| Kajikia audax (Philippi, 1887) | PO | CT | NT | X | ||
| Makaira nigricans Lacepède, 1802 | PO | CT | V | X | ||
| Familia Stromateidae | ||||||
| Peprilus medius (Peters, 1869) | D,FB | PS,PC,PM,PP | LC | |||
| Peprilus simillimus (Ayres,1860) | BP | PO, PS,PC | LC | X | ||
| Peprilus snyderi Gilbert y Starks,1904 | D,FB | PS,PC,PM,PP | LC | |||
| Orden Pleuronectiformes | ||||||
| Familia Paralichthydae | ||||||
| Ancyclopsetta dendritica Gilbert, 1890 | D,FB | PC,PM,PP | LC | |||
| Citharichthys gilberti Jenkins y Evermann, 1889 | EM,FB | PS,PC,PM,PP | LC | X | ||
| Citharichthys xanthostigma Gilbert, 1890 | D,FB | PO,PS,PC,PM,PP | NE | |||
| Cyclopsetta panamensis (Steindachner, 1876) | EM,FB | PC,PM,PP | LC | X | ||
| Cyclopsetta querna (Jordan y Bollman, 1890) | EM,FB | PS,PC,PM,PP | LC | |||
| Etropus crossotus Jordan y Gilbert, 1882 | EM,FB | PS,PC,PC,PP | NE | |||
| Hippoglossina tetrophthalma (Gilbert, 1890) | C,D,FB | PS,PC,PM,PP | LC | |||
| Paralichthys aestuarius Gilbert y Scofield, 1898 | C,D,FB | PS,PC | DD | |||
| Paralichthys californicus (Ayres, 1859) | FB | PS,PC | LC | X | ||
| Paralichthys woolmani Jordan y Williams, 1897* | D,FB | PS,PC,PM,PP | DD | XX | ||
| Syacium ovale (Günther, 1864) | FB | PS,PC,PM,PP | LC | |||
| Xystreurys liolepis Jordan y Gilbert, 1880 | D,FB | PS,PC | LC | |||
| Familia Pleuronectidae | ||||||
| Pleuronichthys guttulatus Girard, 1856 | C,D,FB | PS,PC | LC | |||
| Familia Bothidae | ||||||
| Bothus constellatus (Jordan, 1889) | D,FB | AP | NE | |||
| Bothus leopardinus (Günther, 1862) | D,FD | PS,PC,PM,PP | LC | |||
| Familia Achiridae | ||||||
| Achirus mazatlanus (Steindachner, 1869) | EM,FB | PS,PC,PM,PP | LC | |||
| Trinectes fonsecensis (Günther, 1862) | EM,FB | PC,PM,PP | LC | |||
| Familia Cynoglossidae | ||||||
| Symphurus atramentatus Jordan y Bollman, 1890 | C,D,FB | PS,PC,PM,PP | LC | |||
| Symphurus atricaudus (Jordan y Gilbert, 1880) | FB | PS,PC | LC | |||
| Symphurus fasciolaris Gilbert, 1892 | FB | PS,PC,PM,PP | LC | |||
| Symphurus melanurus Clark, 1936 | FB | PS,PC,PM,PP | LC | |||
| Orden Tetraodontiformes | ||||||
| Familia Balistidae | ||||||
| Balistes polylepis Steindacher, 1876 | FB | PS,PC,PM,PP | LC | X | ||
| Suflamen verres (Gilbert y Starks, 1904) | FD | PS,PC,PM,PP,PG | LC | X | ||
| Pseudobalistes naufragium (Jordan y Starks, 1895) | FD | PS,PC,PM,PP | LC | |||
| Familia Monacanthidae | ||||||
| Aluterus scriptus (Osbeck, 1765) | FD | PC,PM,PP | NE | |||
| Cantherhines dumerilii (Hollard, 1854) | AI,FD | PS,PC,PP,PG | NE | |||
| Familia Ostraciidae | ||||||
| Ostracion meleagris Shaw, 1976 | FD | CT | NE | |||
| Familia Tetraodontidae | ||||||
| Arothron meleagris (Lacèpede, 1798) | AI | CT | LC | |||
| Canthigaster punctatissima (Günther, 1870) | AI | PC,PM,PP | LC | |||
| Sphoeroides annulatus (Jenyns, 1842) | EM,FB | PS,PC,PM,PP | LC | |||
| Sphoeroides lispus Walker, 1996 | EM | PS,PC | LC | |||
| Sphoeroides lobatus (Steindachner, 1870) | AI, EM | PC,PM,PP | LC | |||
| Familia Diodontidae | ||||||
| Chilomycterus reticulatus (Linnaeus, 1758) | FD | CT | NE | |||
| Diodon holocanthus Linnaeus, 1758 | AI,EM | CT | NE | |||
| Diodon hystrix Linnaeus, 1758 | AI,EM,FB | CT | NE | |||
| Familia Molidae | ||||||
| Mola lanceolata (Liénard, 1840) | BP | CT | NE | |||
| Ranzania laevis (Pennant, 1776) | PO | CT | NE |
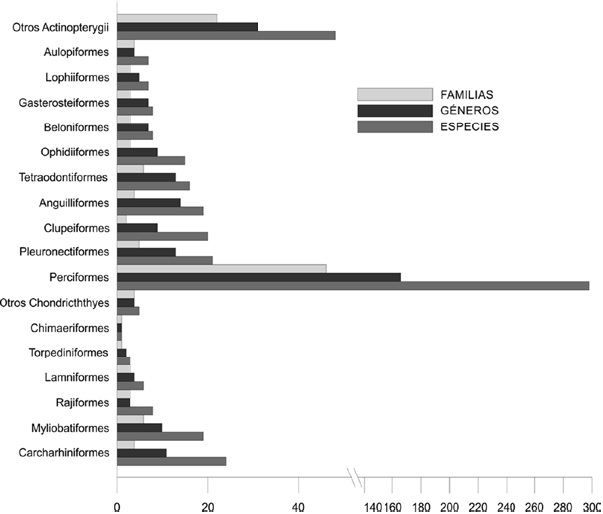
Figura 2 Composición taxonómica de la ictiofauna que caracteriza al ecosistema de la bahía de La Paz, Baja California Sur, México.
Por su parte, la clase Actinopterygii está integrada por 467 especies (87.6% de la riqueza total en BLP), agrupadas en 278 géneros, 101 familias y 25 órdenes (Fig. 2). El orden Perciformes es el de mayor riqueza con 298 especies, 166 géneros y 46 familias (Fig. 3), que representan el 64% de la clase y 56% del elenco total aquí reportado; 10 familias: Carangidae (13 géneros y 28 especies), Gobiidae (21 géneros, 28 spp.), Haemulidae (8 géneros, 22 spp.), Sciaenidae (9 géneros, 18 spp.), Labridae (8 géneros, 18 spp.), Serranidae (8 géneros, 18 spp.), Epinephelidae (6 géneros, 13 spp.), Labrisomidae (6 géneros, 12 spp.), Pomacentridae (5 géneros, 12 spp.) y Chaenopsidae (7 géneros, 11 spp.), representan el 60.4% del orden, 38.5% de la clase y 33.8% de la riqueza total en BLP. En orden de importancia le siguen los órdenes Pleuronectiformes (5 familias, 13 géneros y 21 spp.), Clupeiformes (2 familias, 9 géneros y 20 spp.), Anguilliformes (4 familias, 14 géneros y 19 spp.), Scorpaeniformes (4 familias, 7 géneros y 16 spp.), Tetraodontiformes (6 familias, 13 géneros y 16 spp.) y Ophidiiformes (3 familias, 19 géneros y 15 spp.), los cuales representan el 23% de la clase Actinopterygii y 20% del elenco total de la bahía.
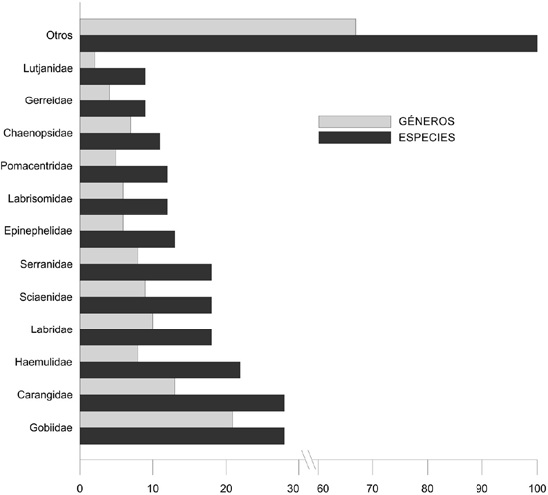
Figura 3 Familias, géneros y especies representativas del orden Perciformes en la bahía de la Paz, Baja California Sur, México.
Desde el punto de vista zoogeográfico (sensu Briggs, 1974), la ictiofauna de BLP mostró mayor afinidad con la provincia de Cortés (82.4%) de la región de California (RC), seguida por la provincia Mexicana (68.3%) de la región del Pacífico oriental tropical (POT); asimismo, fue notable su afinidad con las provincias Panámica (PP = 63%) del POT y de San Diego (PSD = 49%) de la RC, las cuales a su vez contrastan con la menor afinidad observada para las provincias Oregoniana (4.5%) de la región Boreal e Islas Galápagos (10.7%) del POT (Tabla 1). En relación con sus patrones de distribución geográfica (sensu Castro- Aguirre et al., 2005, 2006), la mayoría de las especies muestran afinidad con el POT (> 78%). Asimismo, destaca la presencia de 24 (4.5%) especies con distribución exclusiva en el golfo de California (1 condrictio [la raya de Cortés Beringraja cortezensis (McEachran y Miyake, 1988)] y 23 teleósteos), además de 2 especies exóticas: el topote del Pacífico Poecilia butleri Jordan, 1889 y la dorada Sparus aurata Linnaeus, 1758. Adicionalmente, 76 especies (14.2%) son de distribución circumtropical (18 condrictios y 57 teleósteos), 11 (2%) anfipacíficas (3 condrictios y 8 teleósteos), 4 (0.7%) anfiamericanas (2 condrictios [la cornuda cuchara Sphyrna media Springer, 1940 y la cornuda gigante Sphyna mokarran (Rüpell, 1837)] y 2 teleósteos [la mojarra trompetera Gerres cinereus (Walbaum, 1792) y la lisa hospe Mugil hospes Jordan y Culver, 1895]) y 1 (0.2%) anfiatlántica: el tiburón limón Negaprion brevirostris (Poey, 1868).
El análisis por hábitat (y/o tipo de sustrato), permitió determinar que las especies de peces en BLP, habitan de modo preferente sobre fondos blandos con sustratos de arena y fango (38%); así también, 30% habitan sobre fondos duros con sustratos rocosos. Por otra parte, se observó un porcentaje importante (29%) de la ictiofauna que habita en biotopos de manglar, además de aquellas que manifiestan hábitos demersales (25%), costeros (16%) y pelágico-oceánicos (12%). También se presentan en la bahía conjuntos de especies asociados a ecosistemas insulares (20.3%); en menor proporción están las que viven en el intermareal rocoso (4%), o son de hábitos mesopelágicos (1.7%), bentopelágicos (1.9%) y batipelágicos (0.2%).
Con base en la información obtenida de la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2017), se determinó que 380 (71.3%) especies de BLP, están en la categoría de “preocupación menor” (9 condrictios y 371 teleósteos), 68 (12.8%) son “no evaluadas” (4 condrictios [el tiburón poroso del Pacífico Carcharhinus cerdale Gilbert, 1898, el tiburón gata del Pacífico Ginglymostoma unami Del Moral- Flores, Ramírez-Antonio, Angulo y Pérez-Ponce de León, 2015, la raya mariposa picuda Gymnura crebipunctata (Peters, 1869)] y la raya águila del Pacífico Aetobatus laticeps Gill, 1865 y 64 teleósteos), 1 (0.2%) “críticamente amenazada” [el pescara Stereolepis gigas Ayres, 1859], 6 (1.1%) “amenazadas” (5 condrictios y 1 teleósteo [la baya Mycteroperca jordani (Jenkins y Evermann, 1889)]), 18 (3.4%) “casi amenazadas” (16 condrictios y 2 teleósteos [el marlín rayado Kajikia audax (Philippi, 1887) y la cabrilla chiruda Mycteroperca prionura Rosenblatt y Zahuranec, 1967]), y 20 (3.7%) “vulnerables” (12 condrichios y 8 teleósteos) (Tabla 1).
Según la norma mexicana NOM-059-Semarnat-2010 (Semarnat, 2010; Tabla 1), 6 especies se encuentran bajo “protección especial” (Pr): la castañeta mexicana Chromis limbaughi Greenfield y Woods, 1980, el ángel de Clarión Holacanthus clarionensis Gilbert, 1891, el ángel real H. passer Valenciennes, 1846, el bocón manchas azules Opistognathus rosemblatti Allen y Robertson, 1991, P. butleri y el ángel de Cortés Pomacanthus zonipectus (Gill, 1862). Adicionalmente, 2 condrictios: el tiburón ballena Rhincodon typus Smith, 1828 y el tiburón blanco Carcharodon carcharias (Linnaeus, 1758), se encuentran en la categoría de “amenazadas” (A).
La Lista Roja de Especies Amenazadas (UICN, 2017) incluye 188 (35.3%) especies con valor comercial que se presentan en la BLP (47 condrictios y 141 teleósteos), de las cuales solo 82 (50% de condrictios y teleósteos, respectivamente) se explotan localmente. Un total de 72 especies coinciden entre ambas fuentes de información (36 condrictios y 36 teleósteos), de éstas, 4 están como “no evaluadas” (2 condrictios y 2 teleósteos), 5 “datos deficientes” (2 condrictios y 3 teleósteos), 31 en “preocupación menor” (6 condrictios y 25 teleósteos), 5 “amenazadas” (5 condrictios), 11 “casi amenazadas” (11 condrictios) y 12 “vulnerables” (10 condrictios y 2 teleósteos); ninguna especie de este conjunto se encuentra en la categoría de “críticamente amenazadas”. Del total de especies de interés comercial aquí reportadas, 3 se encuentran protegidas por la NOM-059-Semarnat-2010 (Semarnat, 2010): R. typus, C. carcharias y P. zonipectus.
Discusión
El conjunto ictiofaunístico de BLP, de acuerdo con su última actualización, estuvo conformado por un total de 520 especies (Balart et al., 1995); por tanto, si se considera la riqueza específica aquí reportada (533 spp.), se puede establecer que el número de taxones ha tenido un incremento moderado en los últimos años. Ésto sin duda destaca la gran diversidad íctica de especies de peces que habitan en este ecosistema, cuya riqueza representa cerca del 58.3% de la ictiodiversidad del golfo de California (73.3% condrictios y 56.7% teleósteos, respectivamente) y, de modo particular, el 64.7% de la riqueza reportada para la porción sur del golfo (80.5% condrictios y 62.8% teleósteos), que corresponde al área en donde se localiza la bahía (Hastings et al., 2010). Por otra parte, la riqueza íctica de BLP representa el 19.3% de la ictiofauna mexicana y 24% de aquellas del componente marino estuarino; sobre esta base, los condrictios conjuntan el 35% de las 188 especies reportadas para este grupo y el 18% de las 2,599 especies de teleósteos reportados en ambientes marinos mexicanos (Espinosa-Pérez, 2014).
De este modo, el número de especies reportadas en el presente listado permite la actualización de la taxonomía alfa (nomenclatura) y la correcta delimitación de sus áreas de distribución. Como ejemplos están: el gobio lento Aruma histrio (Jordan, 1884), mencionado por Balart et al. (1995) como A. occidentalis (Ginsburg, 1933) y cuyo sinónimo fue aclarado por González y Saldierna (1997). Otros ejemplos son aquellos de 3 especies cuya distribución actual corresponde al Atlántico occidental: la raya manchada A. narinari (Eufrasen, 1790), cuyo nombre válido corresponde a la raya águila Aetobatus laticeps Gill, 1865 (Last et al., 2016); el mero gigante Epinephelus itajara (Lichtenstein, 1822), cuyo nombre válido para el POT corresponde a E. quinquefasciatus (Bocourt, 1868) (Craig et al., 2009) y el sable del Pacífico Trichiurus lepturus Linnaeus, 1758, cuyo nombre válido para esta vertiente corresponde a T. nitens Garman, 1899 (Burhanuddin y Parin, 2008). De la misma forma destacan la petaca mexicana Abudefduf declivifrons (Gill, 1862), antes reconocida como A. concolor (Lessios et al., 1995) y el pez erizo enano Chilomycterus reticulatus (Linnaeus, 1758) antes C. affinis Günther, 1870 (Allen y Robertson, 1994). Asimismo, existen otros casos de actualización taxonómica como la inclusión de las especies del género Scarus Forsskål, 1775, como una subfamilia de Labridae (Page et al., 2013; Wesneat y Alfaro, 2005).
Algunas especies de listados previos, fueron eliminadas tomando como base su correcta identidad y distribución actual: la cherna pintada “Epinephelus” [sic] niveatus Poey, 1860 [= Hyporthodus niveatus (Valenciennes, 1828)] y el jurel común Caranx hippos Linnaeus, 1766 (Abitia-Cárdenas et al., 1994), cuya área de distribución corresponde a la vertiente costera del Atlántico occidental (McEachran y Fechelm, 2005; Page et al., 2013). También, hubo casos de adición como el cochinito barbero Prionurus laticlavius (Valenciennes, 1846) (Trujillo-Millán et al., 2006).
Se establecieron diferentes categorías que se incluyen en el listado taxonómico (Tabla 1), las cuales podrían tener cambios en la medida que se incremente el número de estudios que evalúen la taxonomía de sus especies y la descripción de nuevos taxones, además de la documentación de nuevos registros que amplíen o corroboren su ámbito de distribución; todo lo anterior será posible a través de la realización de exploraciones en diferentes áreas de la bahía, tal como se ha llevado a cabo en diversos ecosistemas del golfo de California (González-Acosta, Ruiz-Campos et al., 2015; Hastings et al., 2010). En particular, si dichas actividades de exploración se centran en la evaluación de ambientes de aguas profundas de la bahía, utilizando para este fin nuevas tecnologías (e.g., código de barras, técnicas acústicas), se podrá adicionar un mayor número de especies a las ya conocidas, así como lograr un mejor conocimiento de los recursos ícticos potenciales de la bahía de La Paz (Balart et al., 1995; Castro-Aguirre, 1991).
La heterogeneidad de hábitats -biotopos de manglar y zonas de arrecife- y fondos con sustratos diversos -fango-arenosos, rocosos y parches coralinos- que se pueden encontrar en BLP (Galván-Piña et al., 2003; González-Acosta, Rabadán-Sotelo et al., 2015; Pérez-España et al., 1996; Sánchez-Ortiz et al., 1997), favorecen la presencia y predominio en la riqueza específica de la clase Actinopterygii sobre los Chondrichthyes. Sin embargo, en BLP también existen áreas costeras que dan protección y favorecen la presencia de peces cartilaginosos, así como el desarrollo de sus actividades de reproducción, crianza y alimentación (Villavicencio-Garayzar, 1996; Villavicencio-Garayzar et al., 1997). Por consiguiente, es posible que el menor número de registros de condrictios (vs. teleósteos) en la bahía, sea consecuencia del descarte de especies carentes de valor comercial durante las actividades de pesca artesanal y debido a la falta de un mayor esfuerzo dirigido a la captura y registro de las rayas y tiburones en este ecosistema.
Dentro de los Chondrichthyes, el predominio en el número de especies del género Carcharhinus (Carcharhiniformes: Carcharhinidae) en la BLP, alude a su importancia como grupo ampliamente representado en el océano mundial (Lea y Rosenblatt, 2000), pero poco estudiado en la bahía (Balart et al., 1995). Con respecto al grupo de las mantarrayas del género Mobula Rafinesque, 1810 (Myliobatiformes: Mobulidae), su presencia diversa en la bahía podría estar relacionada con su preferencia por biotopos someros de fondos arenosos y/o de roca con vegetación abundante (Castro-Aguirre y Espinosa Pérez, 1996). En cuanto a los Actinopterygii y, en particular a los Perciformes, el predominio en la riqueza que denotan familias como Carangidae, Epinephelidae, Gobiidae, Haemulidae, Labridae, Sciaenidae, Serranidae y Pomacentridae, resulta ser un patrón común en la región noroeste de México debido a la disponibilidad de hábitats favorables que pueden encontrar sus especies, en relación con las condiciones topográficas y oceanográficas que caracterizan a la BLP y que favorecen su presencia (Galván-Piña et al., 2003; González-Acosta, Ruiz-Campos et al., 2015).
De modo particular, la existencia de ambientes estuarino lagunares con amplia cobertura de manglar en BLP, favorece el reclutamiento de especies sujetas a conservación ecológica y de aquellas de interés comercial como el jurel dorado Gnathanodon speciosus (Forsskål, 1775), cuya presencia ha sido reportada en estos biotopos (González-Acosta et al., 2001); ya que estos sitios, tanto para el jurel como para muchas otras especies, representan zonas de protección, alimentación y reproducción, por lo que su presencia contribuye de modo importante a la conexión de las tramas tróficas de la bahía y áreas adyacentes (González-Acosta et al., 2005; González-Acosta, Ruiz-Campos et al., 2015; Ramos-Lozano et al., 2015). Por otra parte, existen áreas insulares en la bahía que se caracterizan por albergar una importante ictiodiversidad, representada por especies de hábitos pelágico-oceánicos (e.g., el pez vela Istiophorus platypterus (Shaw, 1792) y el dorado Coryphaena hippurus Linnaeus, 1758) y bento demersales (e.g., la cornuda común S. lewini y el angelote del Pacífico Squatina californica Ayres, 1859), que concurren en estas áreas con fines de alimentación o refugio (Galván-Piña et al., 2003; Pérez-España et al., 1996; Rodríguez-Romero et al., 2005; Sánchez-Ortiz et al., 1997).
Las afinidades zoogeográficas que presenta la ictiofauna de BLP, indican la existencia de una zona de transición para conjuntos ícticos de derivación boreal y templado-fría (e.g., el sargo Anisotremus davidsonii (Steindachner, 1776), el pejegato lima Parmaturus xaniurus (Gilbert, 1892), la raya de California Beringraja inornata (Jordan y Gilbert, 1881), el escorpión californiano Scorpaena guttata Girard, 1854, el tiburón leopardo Triakis semifasciata Girard, 1855y el lenguado cola de abánico Xystreurys leolepis Jordan y Gilbert, 1880), así como de aquellos de derivación subtropical-tropical (e.g., Lutjanidae, Gerreidae, Haemulidae). Situación que se refleja en la alta proporción de especies afines a las provincias de Cortés o Sinuscaliforniana y Mexicana, así como en la similitud en la composición específica de los conjuntos de las provincias Mexicana-Panámica (región del POT) y la de Cortés (región de California).
Patrones similares de distribución de las especies han sido reportados en ecosistemas de manglar del noroeste de México, donde se establece que la notable afinidad entre los conjuntos ícticos de dichas provincias son resultado de la antigua conexión entre las regiones templada y tropical del Pacífico oriental que determina una condición subtropical para el golfo de California (González-Acosta, Rabadán-Sotelo et al., 2015; González-Acosta, Ruiz-Campos et al., 2015) y, en consecuencia, da lugar al predominio de especies de derivación tropical con presencia en las provincias Mexicana y Panámica, sobre aquellas que proceden de zonas templadas de la provincia de Cortés (Brusca et al., 2005; Hastings et al., 2010). También sobresale el hecho de que cerca del 50% de las especies presentes en BLP, sean afines a la provincia de San Diego (región de California), lo que corrobora la conexión de esta provincia con aquellas del POT y la existencia de una zona de transición entre dichas regiones biogeográficas (Briggs, 1974; Castro-Aguirre et al., 1993; González-Acosta, Ruiz-Campos et al., 2015; Hastings et al., 2010; Ruiz-Campos et al., 2010).
La BLP se caracteriza por la presencia de una menor proporción de especies con distribución en diferentes áreas geográficas del océano mundial (con excepción del POT), debido quizá a que éstas manifiestan hábitos de amplia distribución, ya sea circumtropical (e.g., el tiburón toro Carcharhinus leucas (Müller y Henle, 1839), el sabalote Chanos chanos (Forsskål, 1775), la lisa rayada Mugil cephalus Linnaeus, 1758 y el loro barbazul Scarus gobbhan Forsskål, 1775), anfipacífica (e.g., la corneta pintada Fistularia commersonii Rüpell, 1838, el rape boca blanca Lophiomus setigerus (Vahl, 1797) y el cirujano aleta amarilla Acanthurus xanthopterus Valenciennes, 1835), anfiamericana (G. cinereus y M. hospes) y anfiatlántica (N. brevirostris). Del mismo modo, estos patrones denotan una antigua conexión entre el Pacífico nororiental (incluyendo el golfo de California) con otras regiones biogeográficas, acontecida durante los episodios glaciales y evolución geotectónica que dieron origen a la península de Baja California (Castro-Aguirre y Balart, 1997; Castro-Aguirre et al., 1993; González-Acosta, Ruiz-Campos et al., 2015).
Algunas de las adiciones a la ictiofauna de la bahía son resultado del nuevo registro y/o la ampliación de ámbito de especies como P. laticlavius (Trujillo-Millán et al., 2006) y el tres aletas Axoclinus multicinctus Allen y Robertson, 1992, solo reportado para el archipiélago Revillagigedo (Eschmeyer et al., 2017; Froese y Pauly, 2017) y cuyo registro se adiciona al listado de este ecosistema. Ejemplos como estos sugieren la falta de estudios exploratorios y de revisión taxonómica más extensivos, que permitan explicar la presencia novedosa de algunas especies en este ecosistema y su posible relación con anomalías en la temperatura del océano (Lea y Rosenblatt, 2000); o bien, como resultado de la introducción de especies exóticas invasivas o translocadas, resultado de actividades relacionadas con acuarismo (cultivo de peces de ornato), así como por “accidentes” o escape de ejemplares de cultivos comerciales que se han llevado a cabo sin ningún éxito en la bahía, tal es el caso de P. butleri (Palacios-Salgado et al., 2011) y S. aurata (Balart et al., 2009). Debido al reciente registro de estas especies exóticas invasivas, todavía no es posible determinar el impacto de su presencia sobre las poblaciones de peces nativos de la bahía, aunque ya se han tenido noticias de su presencia en áreas distintas a las de su primer registro (e.g., la ensenada de La Paz).
El registro dudoso de algunas especies en BLP, también pudo ser clarificado a partir de la revisión crítica de su taxonomía, este es el caso del gobio cola de palma Gobionellus microdon Gilbert, 1892 (Abitia-Cárdenas et al., 1994), que se considera ausente en la bahía (González y Saldierna, 1997); sin embargo, debido a que su distribución se reporta desde la costa suroccidental de Baja California Sur (incluyendo el golfo de California) hasta Perú (Allen y Robertson, 1994) y con base en 2 registros de su presencia en costas de Sonora (Castro-Aguirre et al., 1999; Froese y Pauly, 2017), se le incluyó aquí como parte del conjunto íctico de BLP. Por otra parte, destaca la presencia de 24 especies con distribución exclusiva en el golfo de California (Tabla 1), donde las familias: Gobiidae (6 especies), Gobioesocidae (5) y Chaenopsidae (2) conjuntan el 14.3% del total de especies endémicas reconocidas para golfo de California por Hastings et al. (2010); de acuerdo con estos autores, dichas especies se distribuyen en ambientes costeros, asociados a hábitats bénticos y demersales sobre fondos de arena y fango, así como en zonas arrecifales. Sobre este particular, Hastings (2000) menciona que al menos 14 de las especies endémicas presentes en el golfo de California se han originado por procesos de especiación alopátrica a partir de grupos procedentes de otras regiones del Pacífico han dado origen a la fauna endémica de este mar interior aún representan una interrogante (Hastings et al., 2010).
En el análisis de distribución por hábitat se determinó que existe una alta proporción de especies que habitan en áreas con sustratos blandos y duros que son predominantes en la bahía, lo que podría explicar la aparente preferencia de la ictiofauna por este tipo de hábitats (Galván-Piña et al., 2003; González-Acosta, 1998; González-Acosta et al., 1999, 2005: Pérez-España et al., 1996; Sánchez-Ortiz et al., 1997). De igual manera, sobresale el porcentaje de especies que utilizan los biotopos de manglar de la bahía, como hábitats primarios de crianza, zonas de refugio, reclutamiento y alimentación (González-Acosta, 1998; González-Acosta et al., 2005; González-Acosta, Rabadán-Sotelo et al., 2015; González-Acosta, Ruiz-Campos et al., 2015; López-Rasgado et al., 2012; Ramos-Lozano et al., 2015); en particular para aquellas especies de interés comercial (e.g., la mojarra de aletas amarillas Diapterus brevirostris (Sauvage, 1879) y los pargos del género Lutjanus Bloch, 1790), que penetran en estas áreas en etapas juveniles para completar su desarrollo y antes de migrar hacía la bahía donde son capturadas por las pesquerías artesanales (González-Acosta et al., 1999, 2001, 2005; González-Acosta, Ruiz-Campos et al., 2015).
De acuerdo con la información sobre el estado de conservación y/o riesgo (UICN, 2017) de las especies que habitan en BLP, fue posible determinar la falta de información que prevalece sobre la mayoría de los taxones del elenco que se reporta, lo cual se refleja en el alto porcentaje obtenido para la categoría de “preocupación menor” (71.3%), además de las “no evaluadas” (12.8%) y de “datos deficientes” (8.4%), correspondientes a un total de 493 especies. Asimismo, sobresale la categoría de especie “críticamente amenazada” del pescara S. gigas, el cual tiene amplia distribución en el Pacífico oriental y no representa ningún interés ecológico o comercial en la zona (Cornish, 2004). Como “amenazadas” se presentan 5 especies de condrictios (N. brevirostris, el tiburón azul Prionace glauca (Linnaeus, 1758), R. typus, S. lewini y S. mokarran) y la cabrilla sardinera Mycteroperca rosacea (Streets, 1877), las cuales se encuentran entre las especies que más se capturan por la pesca artesanal en la bahía (Villavicencio-Garayzar, 1996; Villavicencio-Garayzar et al., 1997; Vázquez-Hurtado et al., 2010); sin embargo, no existe información detallada en la zona, sobre los niveles de explotación de dichas especies que permitan corroborar su ubicación dentro de la categoría de amenazadas. En la categoría de “casi amenazadas”, 11 de las 17 especies aquí mencionadas (Tabla 1), se capturan comercialmente en la bahía (e.g., la manta chica Mobula munkiana Notarbartolo di Sciara, 1987, el atún aleta amarilla Thunnus albacares (Bonnaterre, 1788)) y 20 “vulnerables”, de las que 12 se explotan en la zona (e.g., Alopias spp., el mako Isurus oxyrinchus Rafinesque, 1810) (Ramírez-Rodríguez, 1997; Villavicencio-Garayzar, 1996).
Del mismo modo, se observó la falta de información referente a diferentes especies mexicanas de ambientes marinos, algunas de las cuales según la NOM-059- Semarnat-2010 (Semarnat, 2010), se consideran como sujetas a “protección especial” y de las que se cuenta con poca o casi nula información sobre su biología y ecología; por lo tanto, en muchos de los casos se carece de sustento para su inclusión en esta categoría. Ejemplo de lo anterior es el exótico P. butleri, una especie que se encuentra bajo protección especial por las leyes mexicanas, en lo que corresponde a su área de distribución natural en aguas continentales (dulceacuícolas) y costeras (salobres y marinas) de la vertiente del Pacífico, desde el río Fuerte en Sonora (México) hasta La Libertad en El Salvador, CA (Miller et al., 2006); la presencia del topote del Pacífico en BLP, corresponde a una especie introducida, no nativa, cuyo nivel de afectación sobre las poblaciones de peces nativos aún no ha sido evaluado. Algunas excepciones del caso, son el ángel real H. passer y el ángel de Cortés P. zonipectus, especies marinas cuya biología reproductiva (Arellano-Martínez y Ceballos-Vázquez, 2001; Arellano-Martínez et al., 1999, 2006) y alimentaria (Pérez-España y Abitia-Cárdenas, 1996) ya han sido estudiadas; a partir de lo cual se ha demostrado que son peces altamente fecundos y cuyas poblaciones podrían ser sujetas de sobrexplotación debido a su alto valor comercial y pesca excesiva, principalmente en etapas juveniles que son las de mayor atracción por su gran colorido. Sin embargo, es necesario llevar a cabo los estudios que permitan confirmar estos supuestos y el eventual impacto negativo de la pesca sobre sus poblaciones.
Las diferencias observadas entre el número de especies de interés comercial reportadas en la Lista Roja de Especies Amenazadas (UICN, 2017) y las fuentes de información disponibles para BLP (Ramírez-Rodríguez, 1997; Ramírez-Rodríguez y Rodríguez, 1990; Vázquez- Hurtado et al., 2010; Villavicencio-Garayzar et al., 1997), indican que existen otras 113 especies con potencial económico, que no son explotadas o bien que no cuentan con registros formales de su captura y aprovechamiento comercial. Un asunto de gran relevancia cuando se toma en cuenta información como la señalada por Vázquez-Hurtado et al. (2010), quienes estimaron una producción anual potencial de 3,200 toneladas para la bahía, sustentada en información de solo 18 especies de interés comercial.
Las proporciones de condrictios y teleósteos que se pescan en la bahía son similares y cercanas al 50% en ambos casos, lo que indica que estos 2 grupos parecen tener igual importancia pesquera en la zona. Sobre este particular, Arreguín-Sánchez et al. (2004) establecen que en la BLP se captura alrededor del 40% de la pesca nacional, con mayor abundancia de especies pelágico costeras y migratorias, entre las cuales están los lutjánidos (e.g., el huachinango del Pacífico Lutjanus peru (Nichols y Murphy, 1922), el pargo flamenco L. guttatus (Steindachner, 1869)), serránidos (e.g., la cabrilla de roca Paralabrax maculatofasciatus (Steindachner, 1868)), meros o cabrillas (e.g., la cabrilla pinta Epinephelus analogus Gill, 1863, la cabrilla piedrera E. labriformis (Jenyns, 1840), M. rosacea) y los jureles (e.g., el jurel bonito Caranx caballus Günther, 1868, el medregal rabo amarillo Seriola lalandi Valenciennes, 1833). Especies que son preferentemente capturadas por las pesquerías artesanales de la región, en particular el caso de los serránidos y lutjánidos, sobre los cuales se ejerce un esfuerzo de pesca del 70% (Díaz-Uribe et al., 2004; Ramírez-Rodríguez, 1997; Vázquez-Hurtado et al., 2010).
En suma, la correcta identificación de las especies que sustentan los recursos pesqueros de BLP, permitirá entre otras cosas, evitar confusiones en la identidad de las especies que conduzcan a la elaboración de propuestas de manejo (e.g., vedas, establecimiento de áreas protegidas) y asignación de cuotas de captura erróneas, sobre todo cuando en los listados se incluyen especies cuya distribución no corresponde a la bahía y al POT en general. Dicha información se integra en páginas electrónicas (e.g., FishBase), que sirven como fuentes de información en estudios de tipo pesquero, pero que como se establece, no son aplicables a las especies de la BLP y golfo de California. Ejemplo de ésto es la inclusión de especies con distribución en la vertiente del Atlántico occidental: la cherna gigante E. itajara sinónimo del mero gigante E. quinquefasciatus; el jurel común C. hippos (posiblemente C. caninus Günther, 1867) y la mojarra plateada Eucinostomus argenteus Baird y Girard, 1855; especies que se señalan de forma incorrecta, como de interés pesquero y como potenciales para maricultivos en la bahía (Vázquez-Hurtado et al., 2010).











 nova página do texto(beta)
nova página do texto(beta)



