Introducción
Las Cassidinae son una de las subfamilias más diversas de Chrysomelidae (Chaboo, 2007). En México se registran más de 300 especies de casidinos sensu lato (Ordóñez-Reséndiz, 2014), poco más del 5% de las especies a nivel mundial (Borowiec y Świętojańska, 2014), cifra cercana a las 402 especies reportadas para Brasil, considerado como el país con la mayor riqueza de casidinos (Sekerka y Borowiec, 2015). El estudio bionómico y sistemático de los casidinos mexicanos ha sido poco abordado, la información taxonómica del grupo se concentra principalmente en las descripciones originales, donde la mayoría son sintéticas y no permiten una determinación adecuada de los taxones. Existen contribuciones recientes que han generado información nueva que permite comprender la taxonomía y ecología del grupo (Córdova-Ballona y Sánchez-Soto, 2008; García-Robledo et al., 2014; López-Pérez, 2016, 2017; López-Pérez et al., 2015; Martínez-Sánchez, 2010; Rodríguez-Mirón y López-Pérez, 2017; Sánchez-Soto, 2016; Sandoval-Becerra et al., 2015, 2016; Staines, 2006; Tejas et al., 2011). A pesar de la diversidad de los casidinos, aún falta recabar información sobre la historia natural, morfología de estados inmaduros y ecología de las distintas tribus de Cassidinae presentes en México.
De las 37 tribus registradas a nivel mundial (Borowiec y Świętojańska 2014), en México se han registrado 12 (Ordóñez-Reséndiz, 2014). Sin embargo, de acuerdo con un análisis filogenético basado en caracteres morfológicos, las tribus Aspidimorphini e Ischyrosonychini se incluyen dentro de la tribu Cassidini formando Cassidini s. l. (López-Pérez et al., 2018). Cassidini s. l. es la tribu con mayor número de especies registradas a nivel mundial, caso similar para México donde se registran 120 especies dentro de 20 géneros (Ordóñez-Reséndiz, 2014). Del total de las tribus presentes en México, Cassidini s. l. representa más del 30% de la diversidad de las especies de casidinos mexicanos.
Las larvas y adultos de Cassidini s. l. al igual que el resto de los casidinos son exclusivamente fitófagos y se relacionan con diversas familias de plantas (Borowiec y Świętojańska, 2014; Chaboo, 2007). Debido a su condición de fitófagos, algunas especies se han catalogado como especies de importancia económica en países como la India y China, donde Aspidimorpha miliaris, A. indica, Glyphocassis trilineata Hope, Cassida circumdata y C. indicola se han reportado como plaga de la papa dulce o camote, y C. exilis Boheman se ha catalogado como posible plaga de la mandarina (Singh y Sharma, 2014; Sultan et al., 2008). En México se ha reportado a Helocassis clavata (Fabricius) en chile silvestre Capsicum annuum L. en Baja California Sur (Tejas et al., 2011). Por otro lado, especies como Charidotis pigmaea (Klug) se ha sugerido como especie biocontroladora de Lantana camara L. y L. montevidensis (Sprengel) Briquet (Verbenaceae) (Day et al., 1999). Asimismo Ch. auroguttata Boheman se ha considerado como agente biocontrolador para Dolichandra unguis-cati (L.) L. G. Lohmann (Bignoniaceae) (Dhileepan et al., 2005; Williams, 2002). Casos similares se han reportado para las especies Metriona elatior (Klug) para Solanum sisymbriifolium Lam. (Solanaceae) (Hill y Hulley, 1996), Physonota alutacea (Boheman) para Cordia curassavica (Jacquin) Roem. y Schult. (Fowler et al., 2000) y P. maculiventris (Boheman) para Tithonia diversifolia (Hemsl.) A. Gray (Compositae) (Mphephu, 2015).
Los trabajos que permiten un pronto reconocimiento de las especies de casidinos son una herramienta para estudios integrativos de los cassidinos mexicanos. En este trabajo se presenta una diagnosis de los géneros mexicanos de Cassidini s. l., una lista de las especies registradas en México junto con su distribución geográfica conocida y nuevos registros, así como una clave dicotómica ilustrada para el reconocimiento de los géneros de Cassidini s. l. mexicanos. Se incorpora el nombre actualizado de las plantas en las que se haya confirmado la presencia de la larva y el adulto (planta huésped) y de las plantas en las que se han recolectado sólo adultos (planta asociada). Además, se presentan fotografías de algunas especies de cada género.
Materiales y métodos
Los 422 ejemplares revisados se obtuvieron de colecciones nacionales, como la Colección Nacional de Insectos (CNIN), la Colección Coleopterológica de la Facultad de Estudios Superiores Zaragoza (CCFES-Z, M. Ordóñez) y la Colección Nacional de Insectos Dr. Alfredo Barrera Marín del Museo de Historia Natural de la Ciudad de México (CNIABM, Ma. Eugenia Díaz), así como de colecciones internacionales: Museo Americano de Historia Natural (AMNH, Lee Herman, Jr.), Museo de Entomología de la Universidad de California (EMEC, P. Oboyski), Museo Nacional de Historia Natural, Smithsonian Institute (NMNH-A. Konstantinov), Museo de Zoología Comparada de la Universidad de Harvard (MCZ, P. Perkins), Museo de Historia Natural de la Universidad de Manchester (MMUE, D. Logunov) y Museo de Historia Natural de Londres (BMNH, M. Geiser).
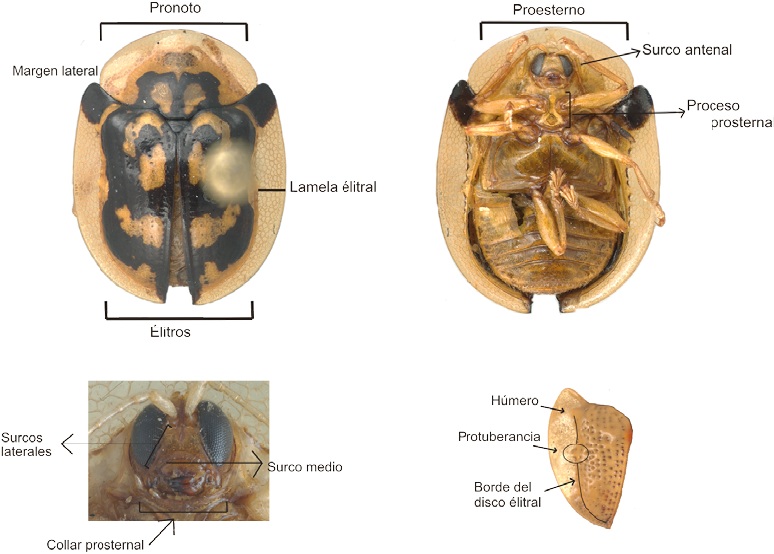
Las diagnosis de los géneros se construyeron con base en descripciones originales, cuando fue posible obtenerlas, de literatura referente a los géneros (Borowiec, 2005, 2007a, b; Sekerka, 2009, 2011; Sekerka y Borowiec, 2015) y de la revisión de ejemplares de distintas especies; el estudio morfológico se realizó con la ayuda de un microscopio esteroscopio Zeiss Discovery V8. La terminología de las estructuras morfológicas está basada en Chaboo (2007), Riley (1986) y Shin (2015); en la Figura 1 se ilustran algunos de los caracteres utilizados en las diagnosis. Cuando fue posible revisar el material tipo del género, se señaló con un “!” al final de las siglas del museo donde está depositado. Los géneros están ordenados alfabéticamente y cada diagnosis se acompaña de una lista de las especies registradas en México de acuerdo con Borowiec y Świętojańska (2017), Niño-Maldonado, Sánchez-Reyes et al. (2016) y Ordóñez-Reséndiz (2014). Para cada especie se proporciona la ubicación del ejemplar tipo, los nombres de las plantas huéspedes y asociadas, su distribución geográfica conocida y nuevos registros. En la Tabla 1 se muestran los acrónimos de los museos referidos en este trabajo de acuerdo con The Insect and Spider Collections of the World Webside (Evenhuis, 2017).
Tabla 1 Acrónimos de los museos referidos.
| Acrónimo | Museo |
| AMNH | Museo Americano de Historia Natural. Nueva York, EUA. |
| BMNH | Museo de Historia Natural, Londres, Reino Unido. |
| CCFES-Z | Colección Coleopterológica de la Facultad de Estudios Superiores Zaragoza, UNAM. Ciudad de México, México. |
| CNIABM | Colección Nacional de Insectos Dr. Alfredo Barrera Marín. Ciudad de México, México. |
| CNIN | Colección Nacional de Insectos del Instituto de Biología, UNAM. Ciudad de México, México. |
| EGRC | Colección de Edwar G. Riley. |
| EMEC | ESSIG, Museo de Entomología. Universidad de California, Berkeley, EUA. |
| HNHM | Museo de Historia Natural de Hungría. Hungría, Budapest. |
| LM | Museo de Luxemburgo. Luxemburgo. |
| MCZ | Museo de Zoología Comparada, Universidad de Harvard. Cambridge, Massachusetts, EUA. |
| MMUE | Museo de Historia Natural de la Universidad de Manchester. Manchester, Reino Unido. |
| MNHN | Museo de Historia Natural de París. París, Francia. |
| MZPW | Academia de Ciencias de Polonia, Museo e Instituto de Zoología. Varsovia, Polonia. |
| NHMA | Museo de Historia Natural. E. Jutland, Dinamarca. |
| NHRS | Museo Sueco de Historia Natural. Suecia. |
| NMPC | Museo Nacional de Praga. República Checa. |
| OUMNH | Museo de Historia Natural de la Universidad de Oxford. Oxford, Reino Unido. |
| RSME | Museo Nacional de Escocia. Edimburgo, Reino Unido. |
| SDEI | Instituto Entomológico Alemán Senckenberg. Müncheberg, Alemania. |
| SEMC | Museo Entomológico, Universidad de Kansas. Lawrence, Kansas, EUA. |
| USNM | Museo Nacional de Historia Natural. Washington D.C., EUA. |
| ZMHB | Museo de Historia Natural de Berlín. Alemania. |
Borowiec y Świętojańska (2017) han compilado información de las plantas en donde se ha corroborado la presencia tanto de la larva como del adulto (planta huésped). En este trabajo, los nombres de las plantas huéspedes se toman de dicho catálogo y de los trabajos de Helson (2005), Rodríguez-Mirón y López-Pérez (2017) y Tejas et al. (2011). Los nombres de las plantas asociadas se tomaron de las etiquetas de los ejemplares y de Hernández-Sosa (2014). Cada nombre de las plantas fue verificado y actualizado de acuerdo con la base de datos Tropicos.org (http://www.tropicos.org/). Los datos geográficos se recopilaron de Andrews y Gilbert (2005), Borowiec (2009), Borowiec y Świętojańska (2017), Chaboo (2003), Correa-San Agustín (2008), Hernández-Sosa (2014), Niño-Maldonado, Jones et al. (2016), Niño-Maldonado, Sánchez-Reyes et al. (2016), Martínez-Sánchez et al. (2010), Sánchez-Reyes et al. (2014, 2015,2016), Sandoval-Becerra et al. (2016), Serrano-Reséndiz (2014), de la base digital del Museo de Entomología de Berkeley, Universidad de California y de las etiquetas de los ejemplares revisados. La información del material examinado se tomó de las etiquetas de los distintos ejemplares y se organizó iniciando de la primera línea de la etiqueta y se corrigió de acuerdo al formato de la Revista Mexicana de Biodiversidad. Para separar información de distintas etiquetas se utilizó “|”, entre paréntesis se muestra el acrónimo del museo al que pertenecen y el número de ejemplares revisados de esa localidad. Las fotografías digitales se tomaron con un estereoscopio Axio Zoom V16 y las micrografías se tomaron con el microscopio electrónico de barrido Hitachi S-2460 N (15KV).
Resultados
Se presentan 122 especies para México dentro de 20 géneros para Cassidini s. l. Dos especies más se reportan como registros dudosos para el país. Se proporcionan 114 registros estatales nuevos para México y otros más para 13 países. Los géneros de Cassidini s. l. se distribuyen en los 32 estados del país (Figs. 2-4). Veracruz cuenta con la mayor diversidad de especies, seguido de Guerrero y Oaxaca (59, 52 y 50 especies) (Tabla 2). Aguascalientes (2), Baja California (1), Coahuila (3), Nuevo León (3), Tlaxcala (2), Quintana Roo (4) y Zacatecas (1) son estados en donde se registran menos de 5 especies (Tabla 2).
Tabla 2 Número de especies de Cassidini s. l. presentes en cada estado.
| Estado | Número de especies | Estado | Número de especies |
| Baja California | 1 | Nayarit | 11 |
| Aguascalientes | 2 | Nuevo León | 3 |
| Baja California Sur | 12 | Oaxaca | 50 |
| Campeche | 6 | Puebla | 20 |
| Chiapas | 41 | Querétaro | 16 |
| Chihuahua | 11 | Quintana Roo | 4 |
| Ciudad de México | 7 | San Luis Potosí | 11 |
| Coahuila | 3 | Sinaloa | 15 |
| Colima | 10 | Sonora | 7 |
| Durango | 19 | Tabasco | 27 |
| Estado de México | 24 | Tamaulipas | 24 |
| Guanajuato | 8 | Tlaxcala | 2 |
| Guerrero | 52 | Veracruz | 59 |
| Hidalgo | 24 | Yucatán | 21 |
| Jalisco | 45 | Zacatecas | 1 |
| Michoacán | 15 | ||
| Morelos | 46 |
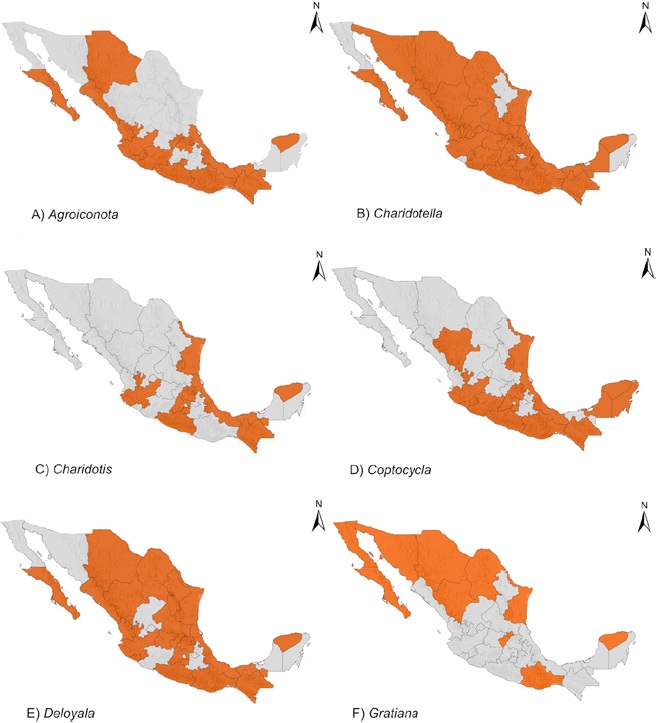
Figura 2 Distribución en México de géneros de Cassidini s. l. A) Agroiconota Spaeth, B) Charidotella Weise, C) Charidotis Boheman, D) Coptocycla Chevrolat, E) Deloyala Chevrolat, F) Gratiana Spaeth.
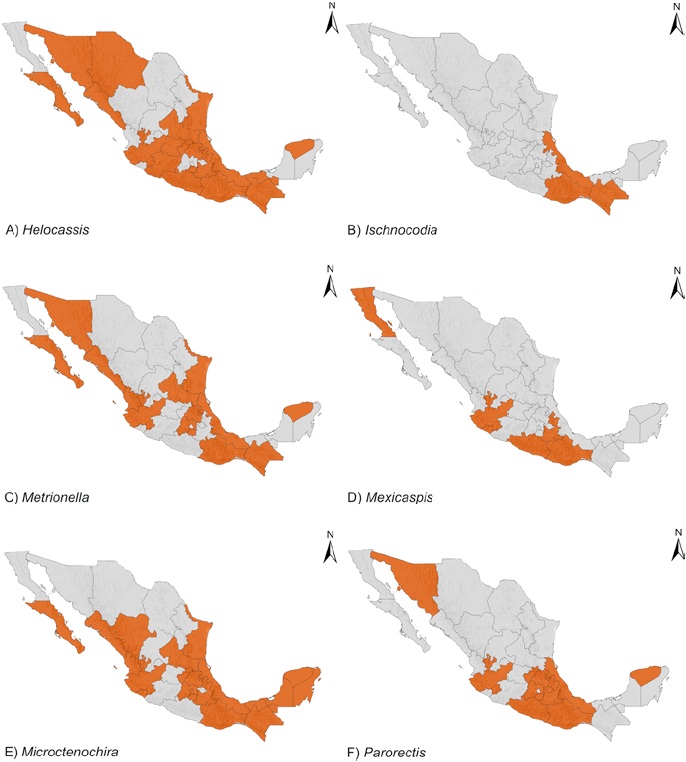
Figura 3 Distribución en México de géneros de Cassidini s. l. A) Helocassis Spaeth, B) Ischnocodia Spaeth, C) Metrionella Spaeth, D) Mexicaspis Spaeth, E) Microctenochira Spaeth, F) Parorectis Spaeth.
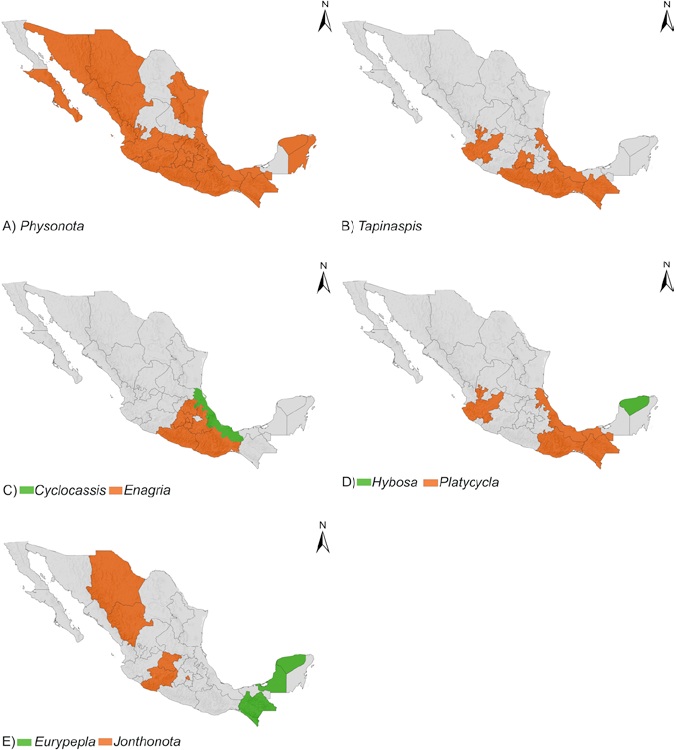
Figura 4 Distribución en México de géneros de Cassidini s. l. A) Physonota Boheman, B) Tapinaspis Spaeth, C) Cyclocassis Spaeth y Enagria Spaeth, D) Hybosa Duponchel y Platycycla Boheman, E) Eurypela Boheman y Jonthonota Spaeth.
Diagnosis de la tribu Cassidini s. l.
Cuerpo generalmente ovalado, en ocasiones paralelo. Cabeza circular o transversal, líneas estridulatorias generalmente presentes en la parte posterior. Antenas regularmente rebasando la base del pronoto. Pronoto de formas variadas, cubriendo la cabeza en vista dorsal, margen anterior frecuentemente redondo (Dorynotini, Eugenysini y la mayoría de los Mesomphaliini presentan margen anterior transverso o cóncavo que expone a los ojos). Prosterno en ocasiones con un surco antenal. Collar prosternal cubriendo o no las partes bucales. Clípeo horizontal. Élitros generalmente con protuberancia en la parte media del borde del disco, lamela elitral casi siempre translúcida. Peines generalmente presentes en alguna de las caras de las uñas de los tarsos.
Comentarios. Las uñas de los mesotarsos y en ocasiones de los metatarsos varían en su simetría dependiendo de la especie y del sexo; Dorynotini y Hemisphaerotini son otras tribus en América que presentan uñas asimétricas (Riley 1986). Los peines son de tamaño y número variable en las distintas especies. En ocasiones se deben obtener micrografías.
Clave para la identificación de los géneros mexicanos de Cassidini s. l., modificada de Riley (1986) y Sekerka (2016).
1. Uñas tarsales sin peines...................................................................................................2
1.1 Uñas tarsales con peines (Fig. 5A, B)..........................................................…...............7
2. Clípeo sin surco frontoclípeal profundo................................................................…........3
2.2 Clípeo con un distintivo surco frontoclípeal profundo (Fig. 5C).........….........Agroiconota
3. Clípeo convexo o levemente convexo..........................................................….................4
3.1 Clípeo plano (Fig. 5D), elevado a los lados…………………………………….Hybosa
4. Uñas simples..................................................................................................................5
4.1 Uñas con un diente basal (Fig. 5E)………………………………….….….………….Enagria
5. Antenómero III mucho más largo que el II……………………………….….….….…………….6
5.1 Antenómero II y III casi de la misma longitud………………………....….…..……..Eurypepla
6. Cuerpo ovalado raramente redondo o triangular....................................….….….........Physonota
6.1 Cuerpo marcadamente ovalado, casi redondo……………………….....….…....………Platycycla
7. Margen basal de los élitros crenado (Fig. 5F)................................................…..................8
7.1 Margen basal de los élitros no crenado...................................................…...................14
8. Prosterno con un surco antenal……………………………………………….….….….………....9
8.1 Prosterno sin surco antenal........................................................................…................10
9. Cuerpo ovalado; clípeo plano; élitros sin elevación por detrás del escutelo, con puntuación superficial…………….….….….………………..Deloyala
9.1 Cuerpo paralelo a los lados; clípeo usualmente con una superficial depresión en el ápice, ligeramente elevado; élitros con o sin una elevación por detrás del escutelo, con puntuación profunda……………………………..Parorectis
10. Élitros con una elevación por detrás del escutelo (Fig. 5G)……………………….….…..…...….11
10.1 Élitros sin una elevación por detrás del escutelo………………………………….….….….…....…12
11. Collar prosternal sin cubrir las partes bucales; clípeo plano, con la superficie apical elevada…………………….….….….….….….….….….….….….………..Coptocycla
11.1 Collar prosternal cubriendo parcialmente las partes bucales (Fig. 5H); clípeo usualmente con una superficial depresión en el ápice y elevado en el margen anterior……….….….….….….…..…..Helocassis
12. Cuerpo redondo o semicircular. Élitros con puntuación superficial……………….….….…..…..13
12.1 Cuerpo ovalado. Élitros con puntuación profunda…………………….….…....………Gratiana
13. Cuerpo redondo. Antenómeros I-IV glabros; pronoto con márgenes laterales agudos…………………………Cyclocassis
13.1 Cuerpo semicircular. Antenómeros I-III glabros; pronoto con márgenes laterales redondos…………………Ischnocodia
14. Parte posterior de la cabeza con líneas estridulatorias (Fig. 5I)…………….….….….….………15
14.1 Parte posterior de la cabeza sin líneas estridulatorias………………….….….….…..….Charidotis
15. Uñas de los meso y metatarsos con peines distintivos (Fig. 5B)……….….….....Microctenochira
15.1 Uñas de los meso y metatarsos con peines pequeños (Fig. 5A)……………….….….….……….16
16. Tarsos con uñas simples.....................................................................................Jonthonota
16.1 Protarsos con uñas distintas a los meso y metatarsos……………………….….….….………….17
17. Protarsos con uñas apendiculadas, meso y metatarsos con uñas simples o apendiculadas................….….….….….….….….….….….................................18
17.1 Protarsos con uñas simples, mesotarsos y metatarsos con uñas apendiculadas.........................….….….….….….….….….….…...........Tapinaspis
18. Meso y metatarsos con uñas apendiculadas....................................................................19
18.1 Meso y metatarsos con uñas simples.....................................................….…..........Mexicaspis
19. Clípeo plano sin surco medio; surcos laterales presentes pero no distintivos………………………….Charidotella
19.1 Clípeo con un surco medio y laterales distintivos………………………….….….….….......Metrionella
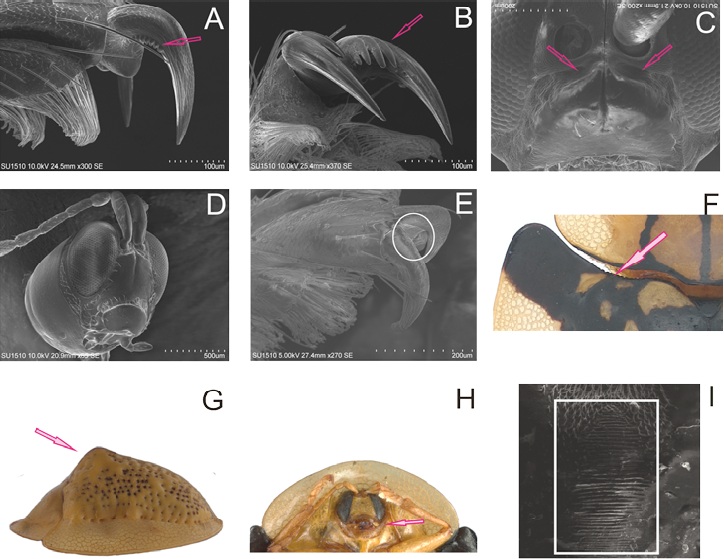
Figura 5 Estructuras morfológicas utilizadas en la clave taxonómica: A) peines presentes en la cara externa de las uñas, B) peines presentes en la cara interna de las uñas, C) surco frontoclípeal profundo, D) clípeo plano, E) uña con un diente basal, F) margen basal de los élitros crenado, G) élitros con una elevación por detrás del escutelo, H) collar prosternal cubriendo parcialmente las partes bucales, I) líneas estridulatorias en la parte posterior de la cabeza.
Diagnosis de los géneros registrados en México
Agroiconota Spaeth
Agroiconota Spaeth, 1913: 142. Especie tipo: Cassida tristriata Fabricius, 1792. Holotipo en la colección de J. Ch. Fabricius en NHMA.
Cuerpo ovalado. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros distales cortos más anchos que largos, antenómeros I-V glabros y brillantes, VII-XI pubescentes, antenómero VI con características intermedias. Pronoto ovalado, márgenes laterales redondos, ocasionalmente subangulados. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo de moderado a fuertemente convexo, al centro con un orificio o surco, surco frontoclípeal profundo. Labro emarginado. Élitros regularmente convexos, nunca elevados por detrás del escutelo, base poco más ancha que la base del pronoto, superficie de los élitros con puntuación superficial, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal no crenado, húmeros no prominentes. Proceso prosternal no expandido hacia el ápice. Uñas apendiculadas sin peines en la cara interna y externa.
Comentarios. De acuerdo con Borowiec (2005) la estructura del clípeo en el género es única, sólo Bradycassis Spaeth, 1952 tiene características similares, pero difiere en que el clípeo es plano sin formar una elevación triangular o trapezoidal.
Especies registradas en México
Agroiconota bivittata (Say, 1826) (Fig. 6A)
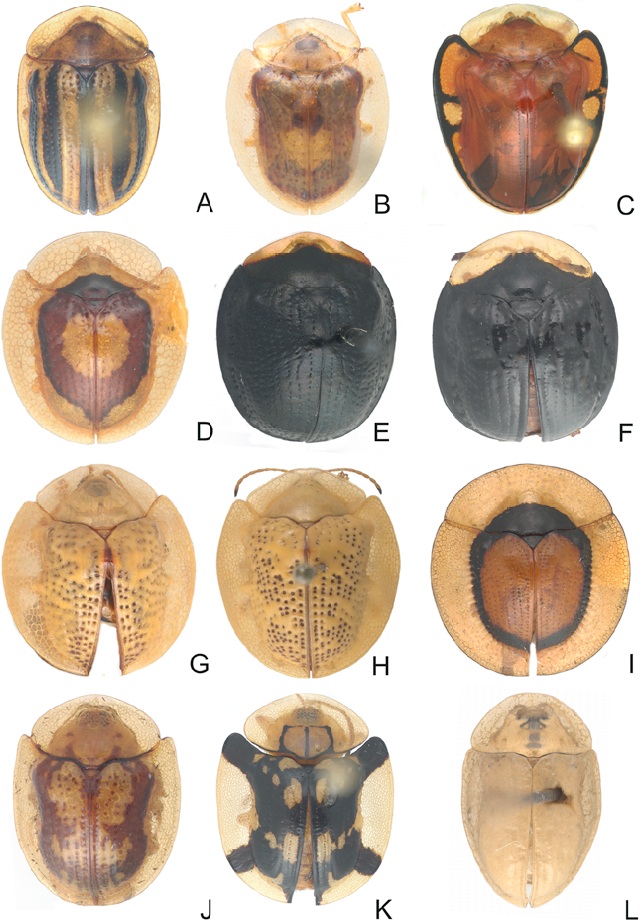
Figura 6 Especies de Cassidini s. l. A) Agroiconota bivittata, B) A. vilis, C) Charidotella egregia, D) C. puella, E) Charidotis curtula, F) C. frontalis, G) Coptocycla texana, H) C. leprosa, I) Cyclocassis circulata, J) Deloyala fuliginosa, K) D. zetterstedti, L) Enagria angulifera.
Material tipo: ubicación desconocida. Sintipo de Cassida striolata Boheman, 1854 y C. vittula Boheman, 1854 en NHRS.
Planta huésped: Convolvulaceae: Ipomoea batatas (L.) Lam., I. pandurata (L.) G. Mey, Calystegia sepium (L.) R. Br. (Borowiec y Świętojańska, 2017).
Distribución: México: Baja California Sur, Chihuahua, Colima, Guerrero, Jalisco, Morelos, Querétaro, Sinaloa. Guatemala. EUA: Arizona, Maryland, Ohio.
Nuevos registros: México: Chiapas, Michoacán, Nayarit, Oaxaca. EUA: Carolina del Sur, Iowa, Georgia, Nueva Jersey, Louisiana, Texas.
Material examinado: México: Chiapas: Tonalá, 8469-09 | 03651 (AMNH, 1). Guerreo: Xalitla, 2 km S, 25.VII.83, J. Chemsak, A. y M. Miclelbacher (EMEC, 1). Jalisco: La Resolana, 2 mi SO, 20.XI.50 | Ray F. Smith (EMEC, 1). Michoacán: Zihuatanejo, L. Cárdenas, km 95, 27.VII.85, E. Arias (CNIN, 1). Morelos: Alpuyeca, 27.VI.1951 | P. D. Hurd | Det. E. G. Riley (EMEC, 1). Nayarit: Tepec, 2-24.IX.1947, B. Malkin (AMNH, 2); E. Santiago Ixcuintla, 10.VII.1950, Ray F. Smith (MCZ, 1). Oaxaca: Pochutla, 30.XI.82, M. García (CNIN, 1). EUA: Carolina del Sur: Florence, 25.I.38, S. C. | C. A. Frost collection, 1962 (MCZ, 1). Georgia: Tifton | Liebeck collection (MCZ, 1). Iowa: Iowa City, Wickman | F. C. Bowditch collection (MCZ, 1). Louisiana: Tallulah, 8.VII.30, PA Glick | C. A. Frost collection 1962 (MCZ, 1). Nueva Jersey: Woodbury, 18.VII | Liebeck collection (MCZ, 1). Ohio: Columbus, 23.V.99 | H. H. P. Severin (EMEC, 1). Texas: Brazos, Co. 12.IV. 36 | Det. J. H. Robinson (MCZ, 1).
Agroiconota vilis (Boheman, 1855)
Material tipo: ubicación desconocida.
Planta huésped: desconocida.
Planta asociada: Araceae: Xanthosoma sp. Euphorbiaceae: Ricinus communis L. (Hernández-Sosa, 2014)
Distribución: México: Chiapas, Guerrero, Hidalgo, Jalisco, Morelos, Oaxaca, Tabasco, Veracruz, Yucatán. Belice. Costa Rica: Bebedero, Puntarenas. Guatemala: El Naranjo, Vera Paz. Honduras. Nicaragua: Chontales.
Material examinado: México: Guerrero: PAPIT1011, La Mina, R. V. Chilpancingo, SMC, 17°16’31.3” N, 99°28’26.28” O, 749 m, 19.IV.2013, 16:40, árbol | Det. M. Ordóñez, 17.V.2013 (CCFES-Z, 1); SCH1371, Buenavista de Cuellar, 18°27’55.3” N, 99°24’8.5” O, selva baja caducifolia, 8.III.2008, 11:57, hoja matata, M. Ordóñez | Det. M. Ordóñez, 16.III.2011 (CCFES-Z, 1). Morelos: SHLC0919-20, El Limón, Tepalcingo, selva baja caducifolia, 18°32’33.5” N, 98°56’18.19” O, 1,282 m, 15.IV.2011, 13:12, sobre riachuelo, M. Ordóñez | Det. M. Ordóñez, 18.XII.2011 (CCFES-Z, 2); SHLC0792, El Limón, Tepalcingo, selva baja caducifolia, 18°32’33.5” N, 98°56’18.19” O, 1,282 m, 17.III.2011, 13:12, sobre riachuelo, M. Ordóñez | Det. M. Ordóñez, 18.XII.2011 (CCFES-Z, 1).
Charidotella Weise
Charidotella Weise, 1896:13. Especie tipo: Cassida zona Fabricius, 1801. Sintipo en la colección de J. Ch. Fabricius en NHMA.
Cuerpo marcadamente ovalado o raramente paralelo. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas moderadamente largas rebasando la base del pronoto, antenómero III ligeramente o no más largo que el II, antenómeros distales cortos no más largos que anchos, antenómeros I-VI glabros y brillantes, VII-XI pubescentes. Pronoto semicircular, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano o ligeramente convexo, usualmente con una superficial depresión en el ápice, ligeramente elevado en el margen anterior; surcos laterales obsoletos o finos, distintivamente al menos en un tercio de la porción basal. Labro ligeramente o no emarginado. Élitros regularmente convexos a angulados, nunca con una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación superficial, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal no crenado, húmeros redondos o agudos, epipleura con margen ventral agudo. Proceso prosternal ancho, poco expandido hacia el ápice. Uñas apendiculadas en todos los tarsos, en ocasiones las uñas de los protarsos son asimétricas con al menos una uña simple. Protarsos sin peines en la cara interna y externa de las uñas, meso y metatarsos generalmente con peines en la cara interna y externa.
Comentarios.Borowiec (2007) proporciona la diagnosis y una clave dicotómica para el grupo de especies cercanas a C. sexpunctata (Fabricius, 1781). Sekerka y Borowiec (2015) realizaron un trabajo taxonómico donde proporcionan un panorama de los subgéneros de Charidotella, así como también presentaron un cuadro comparativo y una clave dicotómica para el reconocimiento de ellos.
Especies registradas en México
Charidotella (s. str.) Weise, 1896
Charidotella bifossulata (Boheman, 1855)
Material tipo: sintipo en NHRS.
Planta huésped: Convolvulaceae: Ipomoea murucoides Roem. y Schult, I. wolcottiana Rose (Borowiec y Świętojańska, 2017).
Distribución: México: Baja California Sur, Chiapas, Durango, Guanajuato, Guerrero, Jalisco, Morelos, Oaxaca, Sinaloa, Tamaulipas, Veracruz y Yucatán. Guatemala. EUA: Arizona.
Nuevos registros: México: Ciudad de México, Estado de México, Michoacán, Puebla, Zacatecas.
Material examinado: México: Ciudad de México: Tacubaya, 29.VI.1946, J. Hendrichs | Ex. Colección Jorge Hendrichs S. (CNIN, 1). Estado de México: Malinalco, 26.VI.80, H. Brailovsky (CNIN, 1). Michoacán: Zitácuaro, Presa El Bosque, 23.VI.86, E. Mariño (CNIN, 1). Puebla: km 4 Pahuatlan La Cruz, 5.VIII.1995, H. Brailovsky (CNIN, 1). Zacatecas: Fresnillo, 7,000 pies, VIII.15.1947 | D. Rockefeller Exp. Schramel | Metriona bifossulata, Det. J. C. Pallister (AMNH, 1).
Charidotella duplex (Champion, 1894)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Chiapas. Guatemala: Las Mercedes.
Charidotella egregia (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Planta asociada: Fagaceae: Quercus sp. (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Morelos, Oaxaca. Belice: Cayo. Costa Rica. Nicaragua: Chontales. Panamá: David, Volcán de Chiriquí.
Nuevos registros: México: Michoacán, Veracruz.
Material examinado: México: Michoacán: Dos Aguas, 50 mi O de Apatzingán. Daff in Pine-oak forest, 6.III.65 (AMNH, 1). Veracruz: Jalapa, W. Schaus | Det. E. G. Riley, 2016 (AMNH, 1).
Charidotella hoegbergi (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Jalisco, Tabasco, Veracruz. Argentina. Brasil. Costa Rica: Limón, Guanacaste, Puntarenas. Guatemala. Guayana Francesa. Honduras. Panamá. Paraguay.
Material examinado: México: Tabasco: Teapa, Jan H. H. S. | Ex Godman y Salvini (MCZ, 1). Honduras: Honduras: Comayagua, 5 km, 17.VI.1979, W. Taulabe | J. A. Chemsak y M. Michelbacher y W. W. Midolekauff | Det. E. G. Riley (EMEC, 1).
Charidotella proxima (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Chihuahua, Guerrero, Jalisco, Morelos. Guatemala.
Charidotella semiatrata (Boheman, 1862)
Material tipo: lectotipo en NHRS.
Planta huésped: Convolvulaceae: Ipomoea sp. (Borowiec y Świętojańska, 2017).
Planta asociada: Polypodiaceae: Polypodium sp. (AMNH).
Distribución: México: Guerrero, Hidalgo, San Luis Potosí, Tabasco, Tamaulipas, Veracruz. Costa Rica. Guatemala
Nuevo registro: México: Coahuila, Oaxaca.
Material examinado: México: Guerrero: JFTH4655, San J. Tenería, Taxco de A. bosque de pino, 18°34’53.4” N, 99°42’7.3” O, 2,622 m, 22.III.2013, 17:34, sobre árbol, T. Bautista | Det. M. Ordóñez, 12.XI.2013 (CCFES-Z, 1). Oaxaca: 80 mi S of Oaxaca City, Polypodium sp., 10.II.65 | W. R. Anderson (AMNH, 1).
Charidotella sexpunctata (Fabricius, 1781)
Material tipo: holotipo en la colección de J. Ch. Fabricius en NHMA.
Planta huésped: Convolvulaceae: Calystegia sepium (L.) R. Br., Ipomoea arborescens (Humb. y Bonpl. ex Willd.) G. Don., I. batatas (L.) Lam., I. cairica (L.) Sweet, I. crassicaulis (Benth.) B. L. Rob., I. hederifolia L., I. indica (Burm.) Merr., I. lacunosa L., I. leptophylla Torr., I. pandurata (L.) G. Mey, I. pes-caprae (L.) R. Br., I. purpurea (L.) Roth, I. trifida (Kunth) G. Don, Merremia aegyptia (L.) Urb. y M. quinquefolia (L.) Hallier F. (Borowiec y Świętojańska, 2017).
Planta asociada: Phytolaccaceae: Phytolacca rugosa A. Braun y C.D. Bouché. Apocynaceae: Stemmadenia pubescens Benth (Hernández-Sosa, 2014).
Distribución: desde Canadá hasta el norte de Argentina. México: Baja California Sur, Chiapas, Chihuahua, Coahuila, Durango, Estado de México, Guanajuato, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Oaxaca, Querétaro, Sonora, Tabasco, Tamaulipas, Veracruz, Yucatán.
Material examinado: México: Ciudad de México: San Fco. Tlaltenco Tlahuac, 28.VII.84, P. Guzmán (CNIN, 1). Colima: 6.9 km SE Jiliotupa, Arroyo El Salado, 165m, 19°01’32.4” N, 103°42’49” O, 23.XI.2006 | S. Zaragoza, F. A. Noguera, E. Ramírez, E. Gonzáles y V. Jiménez (CNIN, 1). Estado de México: Tecpan, Avándaro, 9.VII.71, H. Brailovsky | CNIABM 39660 | 308-36 (CNIABM, 1); Valle de Bravo, Loc. 80.0, 13.VII.69 (CNIN, 1). Nayarit: Río Santiago, Las Adjuntas II, 13-17.IX.91, R. Barba y E. Barrera (CNIN, 1). Puebla: Dos Caminos, El Pozo, La Unión, 20°13’526” N, 97°55’768” O, C. Mayorga y E. Barrera (CNIN, 1).
Charidotella succinea (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Chihuahua, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Oaxaca, Veracruz. Costa Rica: San José. Guatemala. El Salvador. Panamá. EUA: Arizona, Nuevo México.
Material examinado: México: Guerrero: 6 km O Taxco, 21-24.VII.83, J. Chemsak, A. y M. Michelbacher | Det. E. G. Riley (EMEC, 1). Jalisco: La Floresta, lago de Chapala, 1,510 m, 4-5.IX.1977, E. I. Schlinger (EMEC, 1). Oaxaca: 12 km NE Oaxaca City, 1,930 m, 16.VIII.1988, J. T. Doyen (EMEC, 1). Veracruz: Huatusco, 17.VII.1967, R. F. Smith (EMEC, 1). EUA: Arizona: Huachuca Mts. 11.IX.28 1| 2 F. W. Nunenmachei (EMEC 1).
Charidotella tuberculata (Fabricius, 1775)
Material tipo: holotipo en la colección de J. Ch. Fabricius en NHMA.
Planta huésped: Compositae: Chromolaena odorata (L.) R.M. King y H. Rob. (Borowiec y Świętojańska, 2017).
Planta asociada: Anacardiaceae: Mangifera indica L. Asteraceae (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Durango, Estado de México, Guerrero, Hidalgo, Jalisco, Morelos, Oaxaca, Tamaulipas, Veracruz. Cosa Rica: Cartago, Piedras Negras, San José. El Salvador: Guazapa. Guatemala: El Naranjo, Quetzaltenango. Honduras: Comayagua, Cortes. Nicaragua. Venezuela: Carabobo, Distrito Federal, Miranda.
Nuevos registros: México: Michoacán, Nayarit, Puebla, San Luis Potosí, Yucatán. Belice. Panamá.
Material examinado: México: Michoacán: El Limón, 24.II.86, E. Barrera (CNIN, 1). Nayarit: Jalcocotán, 30.VII.84, A. Ibarra (CNIN, 1). Puebla: Yohualichan, 7.II.86, E. Barrera (CNIN, 1); Cuetzalan, 940 m, 29.IV.1994, G. Ortega y E. Barrera (CNIN, 1). San Luis Potosí: Tamasopo, 21°55’45” N, 99°24’56” O, 1,315 m, 25.VIII.2006, E. Barrera y H. Brailovsky (CNIN, 1); Tamazunchale, 4.V.76, C. Barrera (CNIN, 1).Yucatán: Sin localidad específica | F. C. Bowditch collection (MCZ, 1). Belice: M-tee, Dist. Brit. Hondu. 3-15.06 (AMNH, 1). Panamá: km 8-13 El Llano-Carti Rd., 10-13.V.1996, Wappes Huether y Morris | Det. J. E. Wappes (EMEC 1); Sin localiad específica | F. C. Bowditch collection (AMNH, 1).
Charidotella ventricosa (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: Convolvulaceae: Merremia umbellata (L.) Hallier f. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Tabasco, Veracruz, Yucatán. Belice: Cayo. Colombia. Costa Rica: Puntarenas. Guatemala. Panamá. Venezuela: Miranda.
Nuevo registro: México: Campeche.
Material examinado: México: Campeche: Candelaria, XII.1944 (AMNH, 1). Chiapas: Palenque, 15.VII.1981, C. Gold collection | Det. E. G. Riley (EMEC, 1); Simojovel, 1-16.VII.58 | J. A. Chemsak | Det. E. G. Riley (EMEC, 4). Veracruz: Lake Catemaco, 5 mi S, 6.VII.61 | D. H. Janzen | Det. E. G. Riley (EMEC, 2); río Metlac. Nr. Fortín de las Flores, 20.VIII.1977, E. I. Schlinger | Det. E. G. Riley (EMEC, 2).
Charidotella vinula (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: Convolvulaceae: Ipomoea purpurea (L.) Roth (Borowiec y Świętojańska, 2017).
Distribución: México. Argentina. Bolivia: Guayaramerin. Brasil: Pará, Pernambuco, Rio Grande do Sul, Santa Catarina. Ecuador: Los Ríos. Guyana: Essequibo. Guyana Francesa: Kourou. Paraguay: Asunción, Presidente Hayes. Surinam: Paramaribo. Venezuela: Anzoategui, Bolivar, Distr. Federal, Miranda, Tachira.
Charidotella virgulata (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: Convolvulaceae: Ipomoea batatas (L.) Lam. (Borowiec y Świętojańska, 2017).
Planta asociada: Bromeliaceae. Euphorbiaceae: Ricinus communis L. (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Guerrero, Morelos. El Salvador. Guatemala: San Gerónimo.
Charidotella (Chaerocassis) Spaeth en Hincks, 1952
Charidotella (Chaerocassis) annexa (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Hidalgo, Querétaro, San Luis Potosí, Tamaulipas, Veracruz. Belice. Costa Rica: Heredia, Limón. Guatemala. Panamá.
Nuevo registro. México: Tabasco.
Material examinado: México: Tabasco: sin localidad específica, Palm | Det. E.G. Riley, 1982 (AMNH, 1).
Charidotella (Chaerocassis) atromarginataBorowiec, 2009
Material tipo: holotipo y paratipo en la colección de L. Borowiec, Universidad de Wroclaw, Polonia.
Planta huésped: desconocida.
Distribución: México: Veracruz.
Charidotella (Chaerocassis) emarginata (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Planta asociada: Phytolaccaceae: Phytolacca rugosa A. Braun y C. D. Bouché (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Durango, Estado de México, Guanajuato, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Querétaro, Tamaulipas, Veracruz. Costa Rica: Guanacaste, Heredia, Puntarenas, San José, Turrialba. Guatemala: El Naranjo.
Nuevos registros: México: Aguascalientes, Ciudad de México, Coahuila, Oaxaca, Puebla, Sonora. EUA: Arizona.
Material examinado: México: Aguascalientes: Sierra Fría, S. José García, 27.III.72, 2,900 m, J. Hendrichs S. | Ex Colección Jorge Hendrichs S. (CNIN, 1). Ciudad de México: Tacubaya, 29.VI.1946, Malven, J. Hendrichs | Ex Colección Jorge Hendrichs S. (CNIN, 4). Estado de México: Valle de Bravo, 1,700 m, 2.X.1969, H. Brailovsky | CNIABM 39659 (CNIABM, 1). Puebla: Xicotepec Juárez, 11.VII.1970, A. Barrera | CNIABM 41655 | 308-31 (CNIABM, 1). Oaxaca: sin localidad específica, Hoege | Ex Godman y Salvini (AMNH, 1). Sonora: Nacozari de García, Rancho el Tigre, N of Mina el Tigre, 29 km WNW Bavispe | 30.58944° N, 109.21833° O, 2,297 m, 25.IV.2015, T. R. Van Devender y A. L. Reina-G. | Det. S. M. Clark, 2016 (CNIN, 1). EUA: Arizona: Huach Mt, VI.19 | Liebeck collection (MCZ, 1).
Charidotella (Chaerocassis) marculenta (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Tuxtla. Nicaragua: Managua.
Charidotella (Chaerocassis) purpurata (Boheman, 1855)
Material tipo: ejemplar tipo en NHRS.
Planta huésped: Convolvulaceae: Ipomoea pandurata (L.) G. Mey, Calystegia sepium (L.) R. Br. (Borowiec y Świętojańska, 2017).
Distribución: México. EUA: Colorado, Iowa, Minnesota, Pennsylvania.
Material examinado: EUA: Iowa: Osage, 14-12.VII, D. Stoner (EMEC, 1). Minnesota: Lk. Lac Qui Parle, 3.5 ml, SW Appleton, Swift Co. 4.VII. 1974, Blair Tollefson | Det. E. G. Riley (EMEC, 1). Pensilvania: Crawford Co. Hatch Hill Road, 7 mi E Meadville, 17.VII.1080 | Ex: Convolvulus sepium | G. A. Marsh (EMEC, 2).
Charidotella (Xenocassis) Spaeth en Hincks, 1952
Charidotella (Xenocassis) amoena (Boheman, 1855)
Material tipo: sintipos en NHRS y MZPW.
Planta huésped: desconocida.
Planta asociada: Asteraceae: Podachaenium sp. (AMNH). Hamamelidaceae: Matudaea trinervia Lundell (CNIABM).
Distribución: México: Chiapas, Chihuahua, Durango, Estado de México, Guerrero, Jalisco, Morelos, Oaxaca, Sinaloa, Veracruz. Belice: Río Hondo. Costa Rica: San José. Guatemala: cerro Zunil, Capetillo, El Naranjo, Ciudad de Guatemala, Sacatepéquez, San Gerónimo. Panamá: Volcán de Chiriquí.
Nuevos registros: México: Michoacán. Nicaragua: Matagalpa.
Material examinado: México: Estado de México: Tejupilco, Sierra Nanchititla, Cañada Bosque Encantado, 18. XII.73, R. M. López F. | Cañada Bosque Encantado, bosque mesófilo, 1,750 m, sobre Matudaea trinervia, 1 310-12 | CNIABM 41720 (CNIABM, 1). Michoacán: 15 mi WSW of Dos Aguas 50 mi O of Apatzingán, on Podochaenium sp., 6.II.65 | Det. E.G. Riley, 2016 (AMNH, 1). Nicaragua: Matagalpa, 10 km NW Matagalpa, Selva Negra, 1,280 m, 16-22.IV.2002, 12°59’ N, 85°54’ O, Weston Opitz (AMNH, 1).
Charidotella (Xenocassis) atalanta (Boheman, 1862)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Guerrero, Tabasco, Veracruz. Belice. Guatemala.
Material examinado: México: Guerrero: JFH4738, Parque El Huixteco, Tetipac, BE 18°35’15.1” N, 99°36’48.3” O, 2,280 m, 21.III.2013, 16:23, sobre árbol, L. Hernández | Det. M. Ordóñez, 12.XI.2013 (CCFES-Z, 1); JFTH7687, Hiuxtac, Taxco de A. BTC-MA, 18°26’50.3” N, 99°39’9.8” O, 1,370 m, 2.VIII.2013, 16:53, herbácea, M. Ordóñez (CNIN, 1).
Charidotella (Xenocassis) cingulata (Boheman, 1862)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Veracruz.
Charidotella (Xenocassis) opulenta (Boheman, 1855)
Material tipo: ubicación desconocida.
Planta huésped: Convolvulaceae: Ipomoea murucoides Roem. y Schult. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Veracruz. Guatemala: cerro Zunil.
Charidotella (Xenocassis) puella (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: Convulvolaceae: Merremia umbellata (L.) Hallier f. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Durango, Tabasco, Veracruz. Belice. Colombia: Cauca, Cesar, El regidor, Maripi, Santa Cruz de Mompox, Muzo. Costa Rica: Guanacaste, Heredia, Puntarenas, Sirena. Ecuador. Guayana Francesa. Honduras. Nicaragua. Panamá. Perú: Omaguas. Trinidad y Tobago: Guaico. Venezuela: Bolívar, Falcón. Miranda, Táchira.
Material examinado: México: Tabasco: Cárdenas, 6-14.VII. 1981, C. Gold | Det. E. G. Riley (EMEC, 4). Costa Rica: Heredia, Prov. La Selva Res. Sta. 17.VII.1973, J. Doyen y P. A. Opler (EMEC, 1).
Charidotella (Philaspis) Spaeth en Hincks, 1952
Charidotella (Philaspis) bivulnerata (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Durango, Guanajuato, Veracruz.
Nuevo registro: México: Estado de México.
Material examinado: México: Estado de México: Valle de Bravo, El Manguito, 13-18.VII.84, colecta directa, J. Blackaller | 310-37 | CNIABM 45252 (CNIABM, 1).
Charidotis Boheman
Charidotis Boheman, 1854:152. Especie tipo: Charidotis miniata Boheman, 1855. Holotipo en NHRS.
Cuerpo semicircular, ocasionalmente oval. Cabeza circular sin líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más corto que el II, antenómeros III-XI cuadrados, antenómeros I-VI glabros, VII-XI pubescentes. Pronoto semicircular, márgenes laterales poco angulados, casi redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano, surcos laterales ausentes o finos. Labro no emarginado. Élitros regularmente convexos, base poco más ancha que la base del pronoto, superficie con puntuación profunda, algunos con intervalos de estrías, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal no crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas simples en todos los tarsos, cara interna y externa de las uñas de los meso y metatarsos con micropeines.
Especies registradas en México
Charidotis aurofasciata (Erichson, 1847)
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México: Tabasco. Bolivia: Santa Cruz. Brasil: Amazonas, Pará, Sao Paulo. Colombia. Guatemala: Vera Paz. Guayana. Guayana Francesa: Cayena. Honduras. Nicaragua: Chontales. Panamá: Bugaba. Perú: Callanga, Marcapata, Río Toro, Satipo, Ucayali.
Material examinado: Perú: Tingo María, Huan, XII.28.1946, 2,200 pies | J. C. Pallister, Donor Frank Johnson (AMNH, 4).
Charidotis auroguttata Boheman, 1855
Material tipo: sintipo en MNHN y NHRS.
Planta huésped: Bignoniaceae: Dolichandra unguis-cati (L.) L.G.Lohmann. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Tamaulipas. Argentina: Salta. Belice. Bolivia: Santa Cruz. Brasil: Amazonas, Goiás, Mato Grosso, Pará, Paraná, Rio de Janeiro, Rio Grande do Sul, Santa Catarina. Ecuador: Napo, Sucumbíos. Guatemala: Vera Paz. Paraguay: Asunción, Dto. Central, Presidente Hayes, San Lorenzo, Santa Trinidad. Venezuela: Bolívar, Caracas, Miranda.
Material examinado: Brasil: Lanca, St. Cath. X.1944 | A. Maller, Donor Frank Johnson (AMNH, 4).
Charidotis benedicta Boheman, 1862
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Jalisco.
Charidotis curtula Boheman, 1862
Material tipo: ubicación desconocida.
Planta huésped: desconocida.
Planta asociada: Fagaceae: Quercus sp. Moraceae: Ficus sp. (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Morelos.
Material examinado: México: Guerrero: JFTH5876, Huixtac, Taxco de A., Cultivos, 18°26’50.3” N, 99°39’98.8” O, 2,406 m, 26.IV.2013, 17:23, sobre hoja, M. Ordóñez | Det. M. Ordóñez, 27.VIII.2013 (CCFES-Z, 1). Morelos: SHLC0899, El Limón, Tepalcingo, selva baja caducifolia, 18°32’33.5” N, 98°56’18.9” O, 1,282 m, 14.IV.2011, 17:20, sobre Ficus, P. Romero | Det. M. Ordóñez, 27.VIII.2013 (CCFES-Z, 1); SHLC0374, El Limón, Tepalcingo, selva baja caducifolia, 18°32’33.5” N, 98°56’18.9” O, 1,282 m, 4.IX.2010, 08:46, sobre árbol con fruto, M. Ordóñez | Det. M. Ordóñez, 27.VIII.2013 (CCFES-Z, 1); RTPC0272, Los Sauces, Tepalcingo, selva baja caducifolia, 18°35’16.3” N, 98°56’42” O, 1,298 m, 31.III.2012, 10:10, herbácea, T. Escalante | Det. M. Ordóñez VIII.2012 (CCFES-Z, 1).
Charidotis erythrostigma Champion, 1894
Material tipo: holotipo en BMNH.
Planta huésped: desconocida.
Planta asociada: Oleaceae: Fraxinus sp. (CNIABM).
Distribución: México: Estado de México, Guerrero, Morelos, Tamaulipas, Veracruz.
Material examinado: México: Estado de México: Tejupilco, Sierra Nanchititla, XII.73, R. M. López F. | Cañada Bosque Encantados, bosque mesófilo, sobre Fraxinus, 1,750 m | 310-2 | CNIABM 41692 (CNIABM, 1). Guerrero: SCH0885, Coxcatlán, Buenavista de Cuellar, 18°29’37.1” N, 99°26’53.8” O, selva baja caducifolia, 25.VII.2007, 10:25, árbol, M. Ordóñez | Det. M. Ordóñez, 15.IV.2008 (CCFES-Z, 1); JFTH4666, San J. Tenería, Taxco de Alarcon, bosque de pino, 18°34’54.4” N, 99°42’7.3” O, 2,620 m, 22.III.2013, 11:10, árbol, I. Pérez | Det. M. Ordóñez, VI.2013 (CCFES-Z, 1).
Charidotis frontalis Champion, 1894
Material tipo: holotipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Yucatán.
Nuevo registro. México: Guerrero.
Material examinado: México: Guerrero: SCH0365, Cascada de las Granadas, 18°34’30.4” N, 99°30’36.8” O, selva baja caducifolia, 22.III.2007, 16:05, mangal, M. Ordóñez | Det. M. Ordóñez, 27.VIII.2013 (CCFES-Z, 1); SCH0393, 395, 396, Santa Teresa, Cacahuamilpa, 18°41’13.2’ N, 99°29’18.6” O, selva baja caducifolia, 24.III.2007, 11:04, árbol, M. Ordóñez | Det. M. Ordóñez, 27.VIII.2013 (CCFES-Z, 3).
Charidotis seminulum Boheman, 1855
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México. Costa Rica. Guatemala: Vera Paz, San Gerónimo.
Charidotis sphaerica Spaeth, 1936
Material tipo: holotipo en MMUE.
Planta huésped: desconocida.
Distribución: México.
Charidotis vitreata (Perty, 1830)
Material tipo: holotipo de Charidotis herminae Spaeth, 1898 y de C. vicina Spaeth, 1899 en MMUE!
Planta huésped: desconocida.
Distribución: México: Tabasco. Argentina: Misiones. Colombia: Bogotá, Muzo. Brasil: Amazonas, Minas Gerais, Santa Catarina. Guatemala: Vera Paz. Nicaragua: Chontales. Panamá: Bugaba, Darién. Perú.
Nuevos registros. Brasil: Natal, Nueva Friburgo. Paraguay: San Salvador. El Salvador: Sonsonate.
Material examinado: Brasil: Minas Geraës, 1897, excoll. Fruhstofer | herminae Spaeth det. | vitreata Spaeth det. | syntype (MMUE, 1); Rio Natal, S. Cath. XI.1945 | A. Maller, Donor Frank Johnson (AMNH, 1); Novo Friburgo | F. C. Bowditch collection (MCZ, 1). Colombia: Bogotá | heydeni B. Spaeth det. | vicina Spaeth det. | Holotype (MMUE, 1). El Salvador: Sonsonate, 20.VIII.05 | Fredk Knab (NMNH, 1). Panamá: Canal Zone, 22.IV.11, E. A. S. Chwarz (NMNH, 1). Paraguay: S. Salvador, Dr. Bohls | F. C. Bowditch collection (MCZ, 1).
Charidotis yucatanensis Champion, 1894
Material tipo: holotipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Yucatán.
Coptocycla Chevrolat
Coptocycla Chevrolat, 1836:372. Especie tipo: Cassida undecimpuctata Fabricius, 1781. Holotipo en Glasgow.
Cuerpo ovalado. Cabeza transversal con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III usualmente más largo que el II, III-X generalmente filiformes, antenómeros I-VI glabros, VIII-XI pubescentes, VII con características intermedias. Pronoto pentagonal, márgenes laterales rectos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo plano, margen anterior elevado. Labro emarginado. Élitros convexos a angulados, generalmente con una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación superficial y profunda, en ocasiones con una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal distintivamente crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas simples en todos los tarsos, cara interna y externa de las uñas en todos los tarsos generalmente con peines.
Comentarios. Siete de las 9 especies de Coptocycla registradas para México se colocan dentro del subgénero Psalidonota, caracterizado por tener los élitros tuberculados, el disco elitral fuertemente punteado, intercalado con áreas impuntuadas, margen basal distintivamente crenado y peines en las uñas de los tarsos distintivos (Riley, 1986). Además, López-Pérez (2016) describió la genitalia de Coptocycla (Psalidonota) leprosa, la cual presenta una un ápice ensanchado, carácter que lo diferencia del resto de los casidinos. Coptocycla dorsoplagiata y C. texana presentan un edeago similar.
Especies registradas en México
Coptocycla (s. str.)
Coptocycla decussata Boheman, 1855
Material tipo: ejemplar tipo en MNHN.
Planta huésped: desconocida.
Distribución: México.
Coptocycla sordida Boheman, 1855
Material tipo: holotipo en NHRS.
Planta huésped: Bignoniaceae: Bignonia diversifolia Kunth, Handroanthus impetiginosus (Mart. ex DC.) Mattos. Rubiaceae: Alibertia edulis (Rich.) A. Rich. ex DC. (Borowiec y Świętojańska, 2017).
Distribución: México: Jalisco, Yucatán. Belice: Río Hondo. Costa Rica: Guanacaste; Guatemala: Panzós, Telemán, Alta Verapaz.
Nuevos registros. México: Quintana Roo, Veracruz. Honduras.
Material examinado: México: Quintana Roo: Xcan Nuevo, VI.6-7.1959, P. y C. Vaurie (AMNH, 1). Veracruz: Jalapa, Me., W. Sohaus (AMNH, 1). Yucatán: Colonia Yucatán, 14.VIII.1952, J. y D. Pallister (AMNH, 1). Honduras: C. A. 8.IV.1923, S. C. Bruner | Det. E. G. Riley, 1982 (AMNH, 1).
Coptocycla (Psalidonota)
Coptocycla (Psalidonota) dorsoplagiata Champion, 1894
Material tipo: sintipos en BMNH. Paralectotipo en MMUE.
Planta huésped: Boraginaceae: Cordia sp. (Borowiec y Świętojańska, 2017).
Planta asociada: Boraginaceae: Cordia guanacastensis Standl. (EMEC).
Distribución: México: Jalisco. Belice. Costa Rica: Guanacaste. Guatemala. Nicaragua
Nuevos registros. México: Guerrero, Veracruz, Yucatán. Brasil. Guayana. Jamaica, Panamá. Perú.
Material examinado: México: Guerrero: río Balsas, Wickham | F. C. Bowditch collection (MCZ, 1). Jalisco: Est. Biol. Chamela, 28.VII.84, J. A. Chemsak (EMEC, 2). Veracruz: La Playa Escondida 16 km N Sontecomapan, 2-9.VIII.1980 | Det. E. G. Riley (EMEC, 1); Sn. Rafael Jicaltepec, 5.III.96 | F. C. Bowditch collection (MCZ, 1). Yucatán: Sin localidad específica | F. C. Bowditch collection (MCZ, 1). Brasil: Rolandia Parana, XI.1942 | A. Maller, Donor Frank Johnson (AMNH, 1). Costa Rica: Guanacaste, Sta. Rosa N. P. HQ area, 280 m, 16-18.VI.1988, Brown, Powel | On: Cordia guanacastense (EMEC, 1). Guyana: sin localidad específica | F. C. Bowditch collection (MCZ, 1). Jamaica: Kingston | F. C. Bowditch collection (MCZ, 1). Nicaragua: Chontales, T. Belt. | Paralectotypus L. Sekerka des. (MMUE, 1). Panamá: Barro Colorado, Canal Zone. V.1929, Darlington (AMNH, 1). Perú: Satipo, Jauja Prov. III.1945 | P. Paprzycki, Donor FrankJohnson (AMNH, 1).
Coptocycla (Psalidonota) dorsopunctata (Klug, 1829)
Material tipo: lectotipo y paralectotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México: Campeche, Guerrero. Quintana Roo, Yucatán. Cuba: Matanzas.
Coptocycla (Psalidonota) febricitans Spaeth, 1936
Material tipo: holotipo en MMUE. Paratipos en coll. E. Reitter en HNHM, USNM, MMUE.
Planta huésped: desconocida.
Distribución: México: Oaxaca.
Coptocycla (Psalidonota) leprosa (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: Boraginaceae: Cordia alliodora (Ruiz y Pav.) Oken, C. elaeagnoides A. D.C. (Borowiec y Świętojańska, 2017).
Planta asociada: Fagaceae: Quercus sp. Myrtaceae: Psidium guajava L. (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Durango, Estado de México, Guerrero, Hidalgo, Jalisco, Morelos, Michoacán, Veracruz. Belice. Costa Rica. Guatemala: Vera Paz, Capetillo, cerro Zunil. Nicaragua: Chontales. Panamá: Chiriquí, Bugaba, David, Taboga I. Panamá capital.
Nuevos registros. México: Colima. Costa Rica. Honduras. EUA: Texas.
Material examinado: México: Colima: Tecolapa, VII.21.1953 | D. Rockefeller, Mex. Exp. 1953, C. y P. Vaurie (AMNH, 1). Estado de México: San Martín Otzoloapan, 27.XI.93, H. Brailovsky y E. Barrera (CNIN, 1). Morelos: Cañón de Lobos, 18.IV.86, F. (CNIN, 1). Oaxaca: km 15 carr. Tehuantepec, El Carmen Sta. Alicia, 100 m, 14.VII.2000, E. Barrera, C. Mayorga y A. Ibarra (CNIN, 1). Costa Rica: Guanacaste, Santa Rosa, 11.II.85, E. Barrera y H. Brailovsky (CNIN, 1). Honduras: Honduras, C.A. IV.3.1923, S. C. Bruner (AMNH, 1). EUA: Texas: Brownsvlle, Wickham | 171 | Frederick Blanchard collection (MCZ, 1).
Coptocycla (Psalidonota) marmorata Champion, 1894
Material tipo: sintipos en BMNH y MMUE.
Planta huésped: desconocida.
Distribución: México: Guerrero, Jalisco, Morelos.
Material examinado: México: Guerrero: Mexcala, VI.3.1946, J. y D. Pallister (AMNH, 1).
Coptocycla (Psalidonota) rufonotata Champion, 1894
Material tipo: holotipo en BMNH.
Planta huésped: Boraginaceae: Cordia alliodora (Ruiz y Pav.) Oken. (Borowiec y Świętojańska, 2017).
Distribución: México: sur de México. Costa Rica: Zona del Canal. Venezuela: Itaituba. Registro de Venezuela probablemente erróneo. Itaituba es un municipio de Brasil localizado en el estado de Pará.
Coptocycla (Psalidonota) texana (Schaeffer, 1933)
Material tipo: sintipo en MMUE.
Planta huésped: Boraginaceae: Ehretia anacua (Terán y Berland.) I.M.Johnst (Borowiec y Świętojańska, 2017).
Distribución: México: Tamaulipas. EUA: Texas.
Material examinado: EUA: Texas: Brownsville, No. 23478, 26.IV.38 (NMNH, 1).
Cyclocassis Spaeth
Cyclocassis Spaeth, 1913:143. Especie tipo: Coptocycla circulata Boheman, 1855. Holotipo en NHRS.
Cuerpo redondo. Cabeza circular o transversal con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III levemente más largo que el II, antenómeros I-VI glabros, VII con características intermedias, VIII-XI pubescentes. Pronoto semicircular, márgenes laterales agudos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo plano. Labro poco o no emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base con el mismo ancho que la base del pronoto, superficie con puntuación superficial, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros prominentes. Proceso prosternal ancho y expandido hacia el ápice. Uñas simples en todos los tarsos, cara interna y externa de las uñas de los meso y metatarsos con peines.
Especies registradas en México
Cyclocassis circulata (Boheman, 1854)
Material tipo: holotipo en NHRS.
Planta huésped: Bignoniaceae: Bignonia corymbosa (Vent.) L. G. Lohmann (Borowiec y Świętojańska, 2017).
Planta asociada: Bignoniaceae: Bignonia aequinoctialis L. (BMNH).
Distribución: México: Veracruz. Guyana Francesa: Cayena, Kourou. Panamá.
Nuevos registros. Brasil. Perú.
Material examinado: Brasil: Basilia | 6756 (BMNH, 1). Panamá: Panamá City, Parque Nacional Metropolitano, 8º59’40.36” N, 79º32’34.65” O, 29.IX.2007, BIG: Cydista aequinoctialis, L. Sekerka lgt. | Det. L. Sekerka (BMNH, 1). Perú: San Tipo, X-1942 | A Maller, Donor Frank Johnson Donor (AMNH, 1); San Tipo, Jauja Prov. IX-45 | A Maller, Donor Frank Johnson (AMNH, 2).
Deloyala Chevrolat
Deloyala Chevrolat, 1836:371. Especie tipo: Cassida cruciata Linnaeus, 1758. Holotipo de C. crux Fabricius, 1781 en NHMA.
Cuerpo ovalado. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros I-VII glabros, VIII-XI pubescentes, IX-X más largos que anchos. Pronoto ovalado, márgenes laterales redondos. Prosterno con un surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano. Labro emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie con puntuación superficial, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas apendiculadas, generalmente con peines en la cara interna y externa de las uñas de los meso y metatarsos.
Especies registradas en México
Deloyala fuliginosa (Olivier, 1790)
Material tipo: ubicación desconocida. Holotipo de Coptocycla hamulata Boheman, 1855 y de C. glabricula Boheman, 1855 en NHRS, de C. lugubrina Boheman, 1855 en la colección de J. Weise en ZMHB. Sintipo de C. extensa Boheman, 1855 en NMPC y MMUE!, de C. trabeata Boheman, 1855 en NHRS. Ejemplar tipo de C. immunda Boheman, 1855 en NHRS, de Chririda guttata columbica Spaeth, 1936 en MMUE y BMNH.
Planta huésped: Convolvulaceae: Merremia aegyptia (L.) Urb. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Estado de México, Hidalgo, Morelos, Nayarit, Nuevo León, San Luis Potosí, Sinaloa, Veracruz, Yucatán. Belice: Cayo. Brasil. Colombia: Buenaventura. Costa Rica. Cuba. El Salvador: Guazapa. Guatemala. Martinica. Nicaragua. Panamá. República Dominicana. EUA: Texas. Venezuela.
Nuevos registros. México: Tabasco. EUA: Arizona.
Material examinado: México: Tabasco: Teapa, March, H. H. S. | Godman-Salvini, Biol. Centr. Amer. (BMNH, 1). Yucatán: Temax, N. Yucatán, Gaumer | Godman-Salvini, Biol. Centr. Amer. (BMNH, 2). Costa Rica: Van Patten | Godman-Salvini, Biol. Centr. Amer. (BMNH, 1). EUA: Arizona: S. W. R. S. 5 mi W Portal, 5,400 ft, Cochise Co. 20.VIII.1956 (AMNH, 1).
Deloyala guttata (Olivier, 1790)
Material tipo: sintipo en RSME.
Planta huésped: Convolvulaceae: Calystegia sepium (L.) R. Br., Ipomoea pandurata (L.) G. Mey, I. purpurea (L.) Roth. (Borowiec y Świętojańska, 2017).
Distribución: México: Baja California Sur, Guerrero, Hidalgo, Jalisco, Morelos, Querétaro, Tamaulipas. Brasil. Canadá. Cuba. Colombia. Haití. Jamaica. Panamá: Chiriquí. Puerto Rico: Mayagüez. República Dominicana. EUA: Illinois, Iowa, Nueva York, Kentucky. Venezuela.
Nuevos registros. México: Chiapas, Chihuahua, Colima, Nayarit, San Luis Potosí, Veracruz, Yucatán. Costa Rica. Honduras: Tegucigalpa. EUA: Arizona, Carolina del Sur.
Material examinado: México: Chiapas: Ruins at Palenque, June 26-30.1959, P. y C. Vaurie (AMNH, 1). Chihuahua: Catarinas, 5,800 pies, VII.26.47 (AMNH, 1). Colima: Tecolapa, 21.VII.1953 | Mex. Exp. 1953 P. y C. Vaurie (AMNH, 1). Hidalgo: Chapulhuacan, 20.V.1952 | M. Cazier, W. Gertsch, R. Schrammel (AMNH, 1). Nayarit: Acaponeta, VIII.4.53 | D. Rockefeller, Mex. Exp. 1953, P. y C. Vaurie (AMNH, 1). San Luis Potosí: Tamazunchale, 20.V.1952 | M. Cazier, W. Gertsch y R. Schrammel (AMNH, 1). Veracruz: Estación de Biología, Los Tuxtlas, 2.VII.1988, J. D. McCarty | Det. E. G. Riley (EMEC, 1). Yucatán: Temax, N. Yucatán, Gaumer | Am. Mus. Nat. Hist. Dept. Invert. Zool. No. 18148 | Donated by F. Du C. Godman, 1907 (AMNH, 1). Costa Rica: Van Patten | Donated by Du C. Godman, 1907 (AMNH, 1). Honduras: Tegucigalpa, 3.IV.17 (AMNH, 1). Panamá: Chiriqui Prv. 8 km N Cont’l Divide, 15.V.1996, Wappes, Huelher y Morris (EMEC, 1). EUA: Arizona: Pima Co., Madera Cyn. Bogg Spgs. Cmpds. R. Coville, 30.VII.73, 4,500 m | Det. E. G. Riley (EMEC, 1). Carolina del Sur: McClellanville, 2.VIII1945, P. Vaurie (AMNH, 1). Nueva York: Pelham Bay Park, 7.VI.1959, T. Gidaspow (AMNH, 1).
Deloyala lecontei (Crotch, 1873)
Material tipo: holotipo en MCZ.
Planta huésped: desconocida.
Distribución: México: Baja California Sur, Coahuila, Durango, Guanajuato, Guerrero, Jalisco, Morelos, Tamaulipas, Veracruz. Panamá. EUA: Arizona, California.
Deloyala zetterstedti (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipo en BMNH!
Planta huésped: desconocida.
Planta asociada: Apocynaceae: Stemmadenia pubescens Benth. (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Colima, Estado de México, Guerrero, Hidalgo, Jalisco, Morelos, Oaxaca, Veracruz. El Salvador: Guazapa. Guatemala: Suchitepéquez.
Material examinado: México: Oaxaca: Temascal, 10.VII.1966 | J. S. Buckett, M. R. y R. C. Gardner | Det. E. G. Riley (EMEC, 1). Veracruz: Fortín de las Flores, 7-12.VII.74, 1, 010 m. | J. A. Chemsak, E., J. Linsley y J. Powell | Det. E. G. Riley (EMEC, 2).
Enagria Spaeth
Enagria Spaeth, 1936: 139. Especie tipo Physonota ovata Boheman, 1854. Lectotipo en NHRS. Paralectotipo en NHRS y en la Colección Entomológica de Hope OUMNH.
Cuerpo ovalado. Cabeza transversa con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros distales cortos no más largos que anchos, antenómeros I-IV glabros, VI-XI pubescentes, V con características intermedias. Pronoto semicircular, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo convexo. Labro emarginado. Élitros ligeramente convexos, nunca con una elevación por detrás del escutelo, base generalmente del mismo ancho que la base del pronoto, con una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros no prominentes. Proceso prosternal expandido hacia el ápice. Uñas de todos los tarsos apendiculadas sin peines en la cara interna y externa.
Especies registradas en México
Enagria angulifera Spaeth, 1913
Material tipo: holotipo en MMUE.
Planta huésped: desconocida.
Distribución: México.
Nuevo registro. México: Estado de México.
Material examinado: México: Estado de México: Temascaltepec,1931 | Det. Shin, C. 2013 (CNIN, 1).
Enagria ovata (Boheman, 1854)
Material tipo: lectotipo en NHRS. Paralectotipos en NHRS y en la Colección Entomológica de Hope OUMNH.
Planta huésped: Compositae: Montanoa tomentosa Cervant (Rodríguez-Mirón y López-Pérez, 2017).
Distribución: México: Ciudad de México, Estado de México, Hidalgo, Guerrero, Morelos, Oaxaca, Puebla.
Material examinado: México: Ciudad de México: Pedregal de San Ángel, Loc. 28, 14.VI.59 | Det. Shin, C. 2013 (CNIN, 1); Pedregal de San Ángel, 27.VIII.76 (CNIN, 1).
Eurypepla Boheman, 1854
Eurypepla Boheman, 1854:236. Especie tipo Cassida jamaicensis Linnaeus, 1758. Ejemplar tipo con ubicación desconocida.
Cuerpo ovalado. Cabeza transversal con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III casi de la misma longitud que el II, antenómeros distales más largos que anchos, antenómeros I-III glabros, IV-XI pubescentes. Pronoto ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo poco convexo, con un somero surco medio. Labro emarginado. Élitros convexos, nunca con una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie de los élitros con puntuación superficial, con una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros no prominentes. Proceso prosternal expandido hacia el ápice. Uñas de todos los tarsos simples sin peines en la cara interna y externa.
Especies registradas en México
Eurypepla brevilineata Boheman, 1854
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Campeche, Yucatán.
Nuevos registros. México: Chiapas.
Material examinado: México: Chipas: Tuxtla, Gutiérrez, X.1954 | Det. S. Zaragoza (CNIN, 1). Eurypepla calochroma: EUA: FL. Davis, Target parking, 26°2’50.96” N, 80°15’0.72” W, 26.IV.2013; sobre Cordia sebestena, Shin, SCW-FL-2013-07 (CNIN, 12).
Gratiana Spaeth
Gratiana Spaeth, 1913:142. Especie tipo: Cassida spadicea. Holotipo con ubicación desconocida.
Cuerpo ovalado o en ocasiones paralelo a los lados. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómeros III más largo que el II, antenómeros I-VII glabros, VIII-XI pubescentes. Pronoto semicircular, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano. Labro emarginado. Élitros paralelos a los lados, sin una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación generalmente profunda y con estrías, sin una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas apendiculadas en todos los tarsos, protarsos sin peines en la cara interna y externa de las uñas, meso y metatarsos con peines en la cara interna y generalmente en la externa.
Comentarios. Los peines de las uñas de los meso y metatarsos no son visibles bajo los lentes del estereoscopio, es necesario tomar micrografías.
Especies registradas en México
Gratiana insculpta (Boheman, 1855)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Yucatán. Panamá.
Gratiana pallidula (Boheman, 1854)
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: Solanaceae: Solanum elaeagnifolium Cav., S. carolinense L., S. xanti A. Gray, S. rostratum Dunal (Borowiec y Świętojańska, 2017).
Distribución: México: Baja California, Baja California Sur, Chihuahua, Durango, Oaxaca, Querétaro, Sonora, Tamaulipas. EUA: California, Texas.
Nuevos registros. México: Coahuila. EUA: Arizona, Nuevo México, Oklahoma, Washington DC.
Material examinado: México: Coahuila: 25 mi. S. E. San Pedro de Colonias, 3,700 pies, 21.VII.1947 | Det. J. C. Pallister (AMNH, 1); Guadalupe, VIII.23.47 | D. Rockefeller, Exp. Michener (AMNH, 1). Durango: San Juan del Río 5,200 pies, 30.VII.47 | Exp. Cazier (AMNH, 1). EUA: Arizona: sin localidad específica | Liebeck Collection (MCZ, 1). Nuevo México: Malaga, Eddy Co. 19.VI.1947 | A. T. McClay | Det. M. Viana (EMEC, 1). Oklahoma: So. McAlester Ind. 11.VI, Wickham | Det. E. G. Riley (EMEC, 1). Washington D.C.: sin localidad específica | sobre Solanum carolinense, F. Knap (NMNH, 1). Gratiana spadicea: Brasil: San José dos Campos, Sao Paulo, 14-17.X.1990; D. L. Tiemann | Det. E. G. Riley (EMEC, 2). Gratiana gramínea: Brasil: Parobe, 20.XII.2006, J. Medal (NMNH, 2).
Helocassis Spaeth
Helocassis Spaeth, 1952:349. Especie tipo: Coptocycla flexuosa Boheman, 1855. Holotipo en NHRS.
Cuerpo ovalado, en ocasiones paralelo a los lados. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros IV-VI más largos que los anteriores, I-VII glabros, VIII-XI pubescentes. Pronoto ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo usualmente con una superficial depresión en la superficie del ápice y elevado en el margen anterior. Labro emarginado. Élitros paralelos generalmente con una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación profunda, con una protuberancia en la parte media del borde del disco, lamela translúcida, margen basal crenado, húmeros prominentes. Proceso prosternal ancho hacia el ápice. Protarsos sin peines en la cara interna y externa de las uñas, meso y metatarsos con peines en la cara interna y externa.
Especies registradas en México
Helocassis clavata (Fabricius, 1798)
Material tipo: holotipo en la colección de J. Ch. Fabricius en NHMA.
Planta huésped: Solanaceae: Datura stramonium L., Solanum americanum Mill., S. carolinense L., S dulcamara L., S. chenopodioides Lam., S. americanum Mill., S. tuberosum L., Physalis heterophylla Nees, P. longifolia Nutt. (Borowiec y Świętojańska, 2017). Solanaceae: Capsicum annuum L. (Tejas et al., 2011).
Distribución: México: Baja California Sur, Chihuahua, Guanajuato, Guerrero, Hidalgo, Jalisco, Morelos, Puebla, Querétaro, San Luis Potosí, Tamaulipas. Costa Rica: Cartago. EUA: California, Kansas, Kentucky, Louisiana, Maryland, Massachusetts, Michigan, Missouri, Nebraska, New Jersey, New Mexico, Tenessee, Texas.
Material examinado: México: Chihuahua: Santa Bárbara, 6,300 pies, 17.VII.1947 | D. Rockefeller, Exp. Cazier | Det. J. C. Pallister (AMNH, 1). EUA: Massachuset: Cambridge (MCZ, 1). Texas: Belfrage | F. C. Bowditch (MCZ, 1); Dallas (MCZ, 1).
Helocassis crucipennis (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: Asteraceae (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Guerrero, Morelos, Hidalgo, Oaxaca, Puebla, Querétaro, San Luis Potosí, Tabasco, Tamaulipas, Veracruz. Belice. Colombia. Costa Rica. Guatemala: El Naranjo. Honduras. Nicaragua: Granada. Panamá. Venezuela: Falcón.
Nuevos registros. Brasil: Salvador de Bahía.
Material examinado: México: Chiapas: Tapachula, Höege | Am. Mus. Nat. Hist. Dept. Invert. Zool. No. 18267 | Donated by F. Du C. Godman, 1907 (AMNH, 1). Hidalgo: Chapulhuacan, 20.V.1952 | M. Cazier, W. Gertzch y R. Schrammel (AMNH, 1). Oaxaca: sin localidad específica, 2.VIII.03 | W. L. Tower collection (AMNH, 1). Puebla: Huachinango | F. C. Bowditch collection (MCZ, 1); Acatlán, 25.IX.1946, H. Wagner (AMNH, 1). San Luis Potosí: Huichihuyan, 20 min N Tamazunchale, 19.V.1952 | M. Cazier, W. Gertzch y R. Schrammel (AMNH, 1). Veracruz: Córdoba, 14.V.1946, J. y D. Pallister | Det. J. C. Pallister (AMNH, 1); Jalapa, 22.V.1946, J. y D. Pallister | Det. J. C. Pallister, 1951 (AMNH, 1). Brasil: Salvador de Bahía: Rio Vermelho, S. Cath. I.1945 | A. Maller, Donor Frank Johnson (AMNH, 1).
Helocassis distorta (Boheman, 1855)
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México: Hidalgo, Oaxaca.
Helocassis maculicollis (Champion, 1894)
Material tipo: holotipo de BMNH.
Planta huésped: desconocida.
Distribución: México: Jalisco, Oaxaca, Querétaro.
Helocassis testudinaria (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipos en NHRS y MZPW.
Planta huésped: Solanaceae: Solanum hazenii Britton, S. seaforthianum Andrews, Physalis cordata Houst. ex Mill., Lycopersicon esculentum Mill. (Borowiec y Świętojańska, 2017).
Distribución: México: Baja California Sur, Chiapas, Guerrero, Jalisco, Michoacán, Morelos, Oaxaca, Querétaro, Sinaloa, Sonora, Tabasco, Tamaulipas, Veracruz, Yucatán. Belice. Colombia. Costa Rica. El Salvador. Guatemala. Honduras. Panamá. EUA: Arizona, Florida. Venezuela: Maracay, Mérida.
Nuevos registros. México: Ciudad de México. Trinidad y Tobago.
Material examinado: México: Ciudad de México: San Gregorio, 17.VI.1950, tomate verde, J, Hendrichs (CNIN, 3); Colima: sin localidad específica, L. Conrad (AMNH, 2); 4 km SE Jiliotupa, Arroyo El Salado, 163 m, 24.VIII.2006, 19°03’11.4” N, 103°43’26.1” O, S. Zaragoza (CNIN, 3). Guanajuato: Jaral del Progreso, cerro Culiacán, 2,697 m, 20°20’12” N, 100°58’33” O, 26.X.2007, Encinar, H. Brailovsky y L. Cervantes (CNIN, 2). Guerrero: río Balsas, Wickham (MCZ, 1); Apipihulco, Wickham (MCZ, 1). Jalisco: Loc. 4, Amacahuatitlan, 6.VI.1997, S. Zaragoza (CNIN, 5). Tabasco: Teapa, Abril, H. H. S. | Ex Godman y Savini (MCZ, 1). Veracruz: Zongolica, 25.V.63, S. Zaragoza (CNIN, 1). Trinidad y Tobago: St. Agustine, IV.1929, Darlington (MCZ, 1).
Hybosa Duponchel
Hybosa Duponchel, 1842:256. Especie tipo: Hibosa gibbera Boheman, 1855. Holotipo en NHRS.
Cuerpo ovalado, en ocasiones paralelo a los lados. Cabeza sin líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III moderadamente más largo que el II, antenómeros I-VI glabros, VII-XI pubescentes. Pronoto ovalado, márgenes laterales redondos, en las hembras los márgenes forman un lóbulo que se extienden hacia los lados (Fig. 7E-F). Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo plano, elevado a los lados. Labro emarginado. Élitros convexos, con una elevación por detrás del escutelo, en ocasiones la base es poco más ancha que la base del pronoto, superficie con puntuación profunda, protuberancia en la parte media del borde del disco, lamela opaca, margen basal crenado, húmeros prominentes. Proceso prosternal ancho hacia el ápice. Uñas simples y sin peines en la cara interna y externa de todas las uñas de los tarsos.

Figura 7 Especies de Cassidini s. l. A) Enagria ovata, B) Eurypepla brevilineata, C) Gratiana pallidula, D) Helocassis testudinaria, E) Hybosa mellicula (♀), F) H. mellicula (♂), G) Ischnocodia annulus, H) Jonthonota mexicana, I) Metrionella bilimeki, J) Mexicaspis azteca, K) Microctenochira bilobata, L) M. dissimilis.
Especies registradas en México
Hybosa mellicula Boheman, 1862
Material tipo: ejemplar tipo en BMNH.
Planta huésped: Bignoniaceae: Bignonia corymbosa (Vent.) L. G. Lohmann (Borowiec y Świętojańska, 2017).
Distribución: México: Yucatán. Brasil: Pará. Colombia: Minca. Costa Rica: Guanacaste. Guatemala: Vera Paz. Nicaragua: Chontales. Panamá: Zona del Canal. Perú: Loreto, San Martín. Venezuela.
Nuevos registros. Brasil: Sao Paulo. Perú: Jauja.
Material examinado: Brasil: Sao Paulo, I.41 | A. Maller, Donor Frank Johnson (AMNH, 1). Panamá: Barro Colorado, Canal Zone, 29.VII. 1928 | C. H. Curran (AMNH, 1); Perú: Santipo, Jauja Prov., XI.1944 | P. Paprzycki, Donor Frank Johnson (AMNH, 1).
Ischnocodia Spaeth
Ischnocodia Spaeth, 1942: 34. Especie tipo Cassida annulus Fabricius, 1781. Holotipo en la colección de J. Ch. Fabricius en NHMA.
Cuerpo semicircular. Cabeza con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros I-III glabros, IV con características intermedias, V-XI pubescentes, IX-X por lo menos dos veces tan largo como ancho. Pronoto ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo plano, surcos laterales ausentes o finos, surco medio usualmente presente. Labro emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie con puntuación superficial, sin una protuberancia en la parte media del borde del disco, lamela translúcida, margen basal crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas simples, cara interna y externa de todos los tarsos con peines.
Especies registradas en México
Ischnocodia annulus (Fabricius, 1781)
Material tipo: sintipo en la colección de J. Ch. Fabricius en NHMA.
Planta huésped: Boraginaceae: Cordia alliodora (Ruiz y Pav.) Oken, C. panamensis L. Riley, C. ecalyculata Vell., C. trichotoma Arráb. ex Steud. Lauraceae: Ocotea veraguensis (Meisn.) Mez. (Borowiec y Świętojańska, 2017).
Distribución: México: Tabasco, Veracruz. Argentina: Misiones. Belice. Bolivia: Chapare, Las Juntas, Santa Cruz. Brasil: Amazonas, Goiás, Mato Grosso, Pará, Paraná. Colombia. Costa Rica: Guanacaste, Heredia, Puntarenas, San José, Talamanca, Turrialba. Ecuador: Cotopaxi, Napo, Palora, Pastaza, Pichincha, Sucumbios. El Salvador. Guayana Francesa. Guatemala: Vera Paz. Honduras. Nicaragua: Chontales. Panamá: Zona del Canal, Colón. Paraguay: Caazapá. Perú: Cuzco, Loreto, Madre de Dios. Venezuela: Portuguesa.
Nuevos registros. México: Chiapas, Oaxaca. Belice.
Material examinado: México: Chiapas: El Salvador Urbina, Angel A. Corzo, 850 m, 7.VII.1993, S. Zaragoza, E. Gonzales y C. Mayorga (CNIN, 1). Oaxaca: Istmo de Tehuantepec | F. Islas det. (CNIN, 1). Veracruz: Los Tuxtlas, Est. de Biología 2-10.VII.85, C. Mayorga (CNIN, 2). Belice: M-tee Dist. Brit. Hond. 6-12.2006, Peck (MCZ, 1). Costa Rica: Guanacaste, volcán Miravalles, Goothermal Area, 3.VIII.91, Forest Edge Assoc. J. T. Doyen (EMEC, 1); río Aquiare, nr Santa Cruz, Cartago Prov, 1,500 m, 9 km NW Turrialba, 16.V.85 | P. A. Opler (EMEC, 1); Turrialba, 6.VI.1986, Chemsak, Katsura y M. Michelbacher (EMEC, 1); Cartago Turrialba-grounds of IICA, 1.VI1.976, M. Wasbauer (EMEC, 1). Honduras: Honduras: Cortes Peña Blanca, lago Yojoa, 22.VI.1979 | J. A. Chemsak, M. Michelbacher y W. W. Middlekauff | Det. E. G. Riley (EMEC, 3).
Jonthonota Spaeth
Jonthonota Spaeth, 1913:141. Especie tipo Cassida nigripes Olivier, 1790. Holotipo Ubicación desconocida. Sintipo de Cassida novemmaculata en MZPW, holotipos de C. atripes y C. ellipsis en MCZ.
Cuerpo paralelo. Cabeza con líneas estridulatorias en la parte posterior. Antenas cortas sin rebasar la base del pronoto, antenómeros III ligeramente más largo que el II, antenómeros I-VII glabros, VIII-XI pubescentes. Pronoto ovalado, márgenes laterales poco angulados, casi redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano elevado en el ápice, surco fontoclípeal presente. Labro emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie con puntuación superficial, lamela elitral translúcida, margen basal no crenado, húmeros no prominentes. Proceso prosternal ancho, expandido hacia el ápice. Uñas simples, generalmente con peines en la cara interna y externa de las uñas del meso y metatarso. Cara interna y externa de las uñas de los protarsos sin peines.
Especies registradas en México
Jonthonota mexicana (Champion, 1894)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Chihuahua, Ciudad de México, Durango. EUA: Arizona, Colorado.
Nuevos registros. México: Guanajuato, Michoacán.
Material examinado: México: Chihuahua: San José Babicora, 7,100 pies 5.VI.1947 | D. Rockefeller Exp. Gertsch (AMNH, 1). Durango: Tepehuanes, Wickham | Det. L. Sekerka (BMNH, 1). Guanajuato: Abasolo El Encinal, matorral espinoso, 20º24’31” N, 101º33’11” O, 1,760 m, 2.X.2008, H. Brailovsky, L. Cervantes y E. Barrera (CNIN, 1); sin localidad específica | F. C. Bowditch collection | Det. E. G. Riley 1982 (MCZ, 1). Michoacán: 3 m west Quiroga, 9.V.1963 | W. J. Gertsch y W. Ivie (AMNH, 2). EUA: Arizona: Santa Rita 5 to 8,000 ft, July, F. H. Snow. | H. C. Fall collection (MCZ, 1); Palmerlee | By Hakaeber (NMNH, 1).
Metrionella Spaeth
Metrionella Spaeth, 1932:263. Especie tipo Coptocycla erratica Boheman, 1855. Sintipos en BMNH, MZPW, NHRS, MNHN.
Cuerpo ovalado. Cabeza con líneas estridulatorias en la parte posterior presentes sólo en M. bilimeki. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros I-VI glabros, VII-XI pubescentes. Pronoto semicircular, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo levemente convexo, surcos laterales evidentes e impresos en la base formando un tríangulo, surco medio presente. Labro emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie con puntuación superficial, con una protuberancia en la parte media del borde del disco, lamela translúcida, margen basal no crenado, húmeros prominentes. Proceso prosternal ancho sin expandirse al ápice. Uñas apendiculadas en todos los tarsos, cara interna de las uñas en todos los tarsos con peines, cara externa en todos los tarsos sin peines.
Especies registradas en México
Metrionella bilimeki Spaeth, 1932
Material tipo: lectotipo y paralectotipo en MMUE!
Planta huésped: desconocida.
Distribución: México: Baja California Sur, Chiapas, Estado de México, Jalisco, Morelos, Nayarit, Oaxaca, Sonora, Tamaulipas. El Salvador: Guazapa. Costa Rica: Turrialba. Guatemala. Honduras. Nicaragua: Managua. EUA: Arizona.
Nuevos registros. México: Hidalgo, San Luis Potosí, Sinaloa, Veracruz, Yucatán.
Material examinado: México: Hidalgo: Chapulhuacan, 20.V.1952 | M. Cazier, W. Gertsch y R. Schrammel | Det. E. G. Riley 1982 (AMNH, 1). San Luis Potosí: Picolo, 21.V.1952 | M. Cazier, W. Gertsch y R. Schrammel | Det. E. G. Riley 1982 (AMNH, 1); Huichihuyan, 20 min N Tamazunchale, 19.V.1952 | M. Cazier, W. Gertsch y R. Schrammel | Det. E. G. Riley 1982 (AMNH, 1). Sinaloa: 40 mi S Culiacan, 22.VII.1954 | M. Cazier, W. Gertsch y R. Schrammel | Det. E. G. Riley 1982 (AMNH, 1). Sonora: Lower Sonora, Álamos, 1.VII.1971, G. Kageyama | Det. E. G. Riley (EMEC, 1); Veracruz: La Buena Ventura, 09.II.74.| a3651 | Det. E. G. Riley 1982 (AMNH, 1). Yucatán: Dolores Otero, 10.VI.1952, J. y D. Pallister | C. R. Vose Fund, Explorers Club, A. M. N. H. Exped. Det. E. G. Riley 1982 (AMNH, 1). Costa Rica: Turrialba | bilimeki, Det. Spaeth | Paralectotype E. Riley des. (MMUE, 1). Guatemala: Guatemala | bilimeki, Det. Spaeth | Lectotype E. Riley des. (MMUE, 1).
Metrionella erratica (Boheman, 1855)
Material tipo: sintipos en NHRS, BMNH, MNHN y MZPW.
Planta huésped: desconocida.
Distribución: México: Nayarit, Oaxaca, Tamaulipas. Belice. Colombia. Costa Rica. El Salvador: Guazapa. Guatemala: El Naranjo, Suchitepéquez. Nicaragua. Panamá.
Nuevos registros. México: Puebla, San Luis Potosí, Tabasco, Veracruz, Yucatán.
Material examinado: México: Puebla: Xochitepec de Juárez, 11.VII.70, Díaz Batres | CNIABM 39675 (CNIABM, 1). San Luis Potosí: Tamazunchale, 19.VII.1946, J. y D. Pallister | Det. E. G. Riley 1982 (AMNH, 1). Tabasco: Teapa, Feb. H. H. S. | Donated by F. Du C. Godman, 1907. Am. Mus. Nat. Hist. Dept. Invert. Zool. No. 18263 | Det. E. G. Riley 1982 (AMNH, 1). Veracruz: Jalapa, W. Schaus | Det. E. G. Riley 1982 (AMNH, 1); Tabasco, Palm Coli | Det. E. G. Riley 1982 (AMNH, 1). Yucatán: Chichen Itza, 11.IX.1952, J. y D. Pallister | C. R. Vose Fund, Explorers Club, A.M.N.H. Exped. Det. E. G. Riley 1982 (AMNH, 1).
Mexicaspis Spaeth
Mexicaspis Spaeth, 1936:259. Especie tipo Coptocycla azteca Champion, 1894. Sintipo en BMNH.
Cuerpo con lados paralelos. Cabeza con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros I-IV glabros, V-XI pubescentes. Pronoto pentagonal, márgenes laterales rectos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo plano, elevado en el margen anterior formando un surco frontoclípeal. Labro emarginado. Élitros convexos, sin una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación superficial, protuberancia en la parte media del borde del disco, lamela translúcida, margen basal no crenado, húmeros prominentes. Proceso prosternal ancho, sin expandirse al ápice. Uñas de los protarsos apendiculadas sin peines. Uñas en los meso y metatarsos simples con peines en la cara interna y externa.
Especies registradas en México
Mexicaspis azteca (Champion, 1894)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Baja California, Guerrero, Jalisco, Oaxaca, Puebla.
Nuevos registros. México: Colima.
Material examinado: México: sin localidad específica, F. C. Bowditch collection | Det. E. G. Riley (MZC, 1). Colima: Tecolapa, 31.VII.1954 | M. Casier, W. Gertzch y Bradts (AMNH, 1). Guerrero: río Balsas, Wickham | Det. E. G. Riley (MZC, 6). Jalisco: South side lake, Chapala, 29/VII/1954 | M. Cazier, W. Gertsch y Bradts | Det. E. G. Riley (AMNH, 2).
Microctenochira Spaeth, 1926
Microctenochira Spaeth, 1926: 36. Especie tipo Coptocycla jousselini Boheman, 1855. Holotipo en NHRS.
Cuerpo ovalado. Cabeza circular con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero II poco más grande que el III, antenómeros I-VII pubescentes, VII-XI glabros. Pronoto ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo con una superficial depresión en el ápice y ligeramente elevado en el margen anterior; surcos laterales ausentes o finos, visibles al menos en la tercera parte de la porción basal. Labro emarginado. Élitros poco convexos, sin una elevación por detrás del escutelo, base poco más ancha que la base del pronoto, superficie con puntuación superficial, sin una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal no crenado, húmeros no prominentes. Proceso prosternal expandido hacia el ápice. Uñas apendiculadas, peines en la cara interna y externa de las uñas de los meso y metatarsos.
Especies registradas en México
Microctenochira aspersa (Champion, 1894)
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Morelos, Oaxaca. Colombia. Costa Rica: Turrialba, Tucurrique. Guatemala: Quiriguá. Panamá: Bugaba, Coclé.
Microctenochira bilobata (Boheman, 1855)
Material tipo: sintipos en la colección de J. Weise en ZMHB y NHRS.
Planta huésped: desconocida.
Distribución: México: Guerrero.
Nuevos registros. México: Ciudad de México, Estado de México.
Material examinado: México: Ciudad de México: Tacubaya, 28.VI. 1946, J. Hendrichs | Ex colección Jorge Hendrichs S. (CNIN, 1). Estado de México: Tejupilco, Sierra Nanchititla, 9.XII.73, A. Barrera | Los Llanitos, bosque pino-encino, 1,850 m. | 310-34 | CNIABM 41770 (CNIABM, 1).
Microctenochira bonvouloiri (Boheman, 1862)
Material tipo: holotipo en NHRS.
Planta huésped: Convolvulaceae: Merremia dissecta (Jacq.) Hallier F., Ipomoea wolcottiana Rose (Borowiec y Świętojańska, 2017).
Planta asociada: Cleomaceae: Polanisia uniglandulosa (Cav.) DC. Euphobiaceae: Ricinus communis L. (Hernández-Sosa, 2014).
Distribución: México: Baja California Sur, Colima, Durango, Guerrero, Jalisco, Morelos, Nayarit, Puebla, Sinaloa, Tabasco, Veracruz, Yucatán. Belice. Costa Rica: Guanacaste, Puntarenas. Guatemala. EUA: Texas.
Material examinado: México: Jalisco: Est. de Biología Chamela, 16.X.1981, G. Ortega y C. Mayorga (CNIN, 1); Est. de Biología Chamela, 26.VIII.1996, C. Mayorga, A. Cadena y J. Martínez (CNIN, 4). Oaxaca: km 21, desviación San Miguel, 210 m, 22.III.1990, E. Barrera y A. Cadena (CNIN, 1). Veracruz: Los Tuxtlas camino a Lag. Escondida, 5.II.1990, G. Ortega y C. Mayorga (CNIN, 1).
Microctenochira coronata (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipos en MZPW y NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Guerrero, Jalisco, Morelos, Oaxaca, Veracruz. Belice. Guatemala: El Naranjo, Zapote. Honduras: Yoro.
Nuevos registros. México: Estado de México, Tamaulipas.
Material examinado: México: Estado de México: Tejupilco, Sierra Nanchititla, 9.XII.73, A. Barrera | Los Llanitos, bosque pino-encino, 1,850 m. | 310-16 | CNIABM 41731 (CNIABM, 1). Tamaulipas: Tampico, 19.III.1972, E. Auer (CNIABM, 1).
Microctenochira cumulata (Boheman, 1855)
Material tipo: lectotipo en la colección de J. Weise en ZMHB. Paralectotipo en NHRS.
Planta huésped: Asteraceae: Chromolaena odorata (L.) R. M. King y H. Rob. Convolvulaceae: Odonellia hirtiflora (M. Martens y Galeotti) K. R. Robertson (Borowiec y Świętojańska, 2017).
Planta asociada: Bromeliaceae: Tillandsia sp. (CCFES-Z).
Distribución: México: Chiapas, Guerrero, Veracruz. Costa Rica: Caché, Heredia, Puntarenas, San José, San Mateo, Limón. Ecuador: Pichincha, Río Palenque. Guatemala: El Naranjo, Ciudad de Guatemala, San Isidoro, Suchitepéquez, Zapote. Nicaragua: Chontales. Panamá. Venezuela: Miranda, Puerto Caballo, Valencia.
Nuevos registros. México: Ciudad de México, Puebla.
Material examinado: México: Ciudad de México: Tacubaya, 29.VI. 46, J. Hendrichs (CNIN, 1). Chiapas: Ixhuatan, km 3 Carr. Pozo Rosarito, 12.XII.85, F. Arias, R. Barba y L. Cervantes (CNIN, 1); Ocosingo Chajul, Reserva Montes Azules, 10-16.VII.87, F. Arias, R. Barba y L. Cervantes. Guerrero: Taxco de Alarcón, bosque de pino, 18°34’53.4” N, 99°42’7.3” O, 2,620 m, 22.III.2013, 18:20, sobre Tillandsia sp., I. Pérez| Det. M. Ordóñez, 06.VI.2014 (CCFES-Z, 1). Morelos: RTPC0353, Las Huertas, Tlaquiltenango, selva baja caducifolia, 18°28’56.8” N, 99°09’11.3” O, 775 m, 04.V.2012, 19:18, árbol, M. Ordóñez | Det. M. Ordóñez, 06.VI.2014 (CCFES-Z, 1). Puebla: km 3 Carr. Xicotepec Barranca de Patla, 20°13’529” N, 97°57’042” O, 4,400 pies, 12.VII.1994, E. Barrera y C. Mayorga (CNIN, 1).
Microctenochira diophthalma (Champion, 1894)
Material tipo: holotipo en BMNH.
Planta huésped: desconocida.
Planta asociada: Ericaceae: Arbutus unedo L. (Hernández-Sosa, 2014).
Distribución: México: Estado de México, Guerrero, Morelos.
Microctenochira dissimilis (Boheman, 1855)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Planta asociada: Bromeliaceae (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Morelos, Tabasco. Belice.
Material examinado: México: Guerrero: JFTH4900, San J. Tenería (CCFES-Z, 1).
Microctenochira ferranti (Spaeth, 1926)
Material tipo: sintipos en MMUE y LM.
Planta huésped: Convolvulaceae: Ipomoea sp. (Borowiec y Świętojańska, 2017).
Distribución: México: Chiapas, Guerrero, Jalisco, Morelos, Nayarit, Sinaloa. Costa Rica: Piedras Negras, Surrubres, Turrialba. El Salvador: Guazapa. Guatemala: Zacapa. Nicaragua: Managua.
Microctenochira hectica (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipo en la colección de J. Weise en ZMHB.
Plantas huésped: desconocida.
Planta asociada: Apocynaceae: Stemmadenia pubescens Benth. Verbenaceae: Lantana hirta Graham (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Guerrero, Morelos, Oaxaca, Puebla, Sinaloa, Tabasco, Veracruz. Costa Rica: Puntarenas, San José. El Salvador: Guazapa. Guatemala: El Naranjo, San Gerónimo, Zapote. Venezuela: Maracay, Miranda.
Nuevos registros. México: Nayarit, Quintana Roo.
Material examinado: México: Nayarit: Compostela, 27.VII.1954 | M. Cazier y W. Gertsch | Det. E. G. Riley 1982 (AMNH, 1). Tabasco: Teapa, March, H. H. S. | Ex Godman y Salvin (AMNH, 1). Quintana Roo: Xean Nuevo, 6-7.VI.1959, P.C. Vaurie (AMNH, 1).
Microctenochira hieroglyphica (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipo en MZPW.
Plantas huésped: desconocida.
Planta asociada: Cleomaceae: Polanisia uniglandulosa (Cav.) D. C. Apocynaceae: Stemmadenia pubescens Benth. Araceae: Xanthosoma sp. Bromeliaceae. Fagaceae: Quercus sp. (Hernández-Sosa, 2014).
Distribución: México: Chiapas, Guerrero, Estado de México, Morelos, San Luis Potosí, Tabasco, Tamaulipas, Veracruz. Belice. Costa Rica: Cartago, San Carlos, San José, Turrialba. Guatemala. Honduras: Yoro. Nicaragua: río San Juan. Panamá: Veragua.
Nuevos registros. México: Puebla.
Material examinado: México: Chiapas: finca Prusia, Jaltenango, 10-12.V.85, F. Arias, H. Velasco y M. Vertiz (CNIN, 1). Oaxaca: presa Cerro de Oro, 23.V.1990, E. Barrera y A. Cadena (CNIN, 1); Portillo del Rayo, 24.XI.85, E. Mariño (CNIN, 1). Puebla: Cuetzalán, 9.III.87, M. García y M. Meléndez (CNIN, 1). Tabasco: Teapa, H. H. S. | Ex Godman y Salvini (AMNH, 1).
Microctenochira infantula (Boheman, 1862)
Material tipo: ejemplar tipo en BMNH.
Plantas huésped: desconocida.
Planta asociada: Euphobiaceae: Ricinus communis L. (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Morelos. Guatemala: Izabal. Costa Rica. Panamá.
Nuevo registro. México: Veracruz.
Material examinado: México: Veracruz: Coatepec | Det. S. Zaragoza (CNIN, 1).
Microctenochira melanota (Boheman, 1855)
Material tipo: sintipos en BMNH y MNHN.
Planta huésped: desconocida.
Distribución: México: Tabasco, Veracruz. Costa Rica: San Mateo. Guatemala.
Nuevo registro. México: Puebla.
Material examinado: México: Puebla: Xicotepec de Juárez, 11.VII.1970, A. Barrera | CNIABM 39657 (CNIABM, 1). Tabasco: Teapa, H. H. S. Ex Godman y Salvin (AMNH, 1).
Microctenochira palmata (Boheman, 1855)
Material tipo: ubicación desconocida.
Planta huésped: desconocida.
Distribución: México: Oaxaca, Veracruz. Guatemala: Las Mercedes, Capetillo.
Nuevo registro. México: Puebla.
Material examinado: México: Puebla: Ahuatamimilol, 8.VII.1989. Citlalli G. G. | 356-51 | CNIABM 42896 (CNIABM, 1).
Microctenochira plagifera (Spaeth, 1926)
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México.
Microctenochira plebeja (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipos en MZPW y NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Jalisco, Morelos, Tabasco, Veracruz. Guatemala. Nicaragua: Chontales.
Material examinado: México: Guadalajara: sin localidad espcecifica, F. C. Bowditch collection (MCZ, 1). Tabasco: Teapa, March. H. H. S. | Ex Godman y Salvin (MCZ, 1).
Microctenochira plicata (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Tabasco, Veracruz. Costa Rica: Puntarenas, San Mateo. Panamá: Bugaba, Volcán de Chiriquí.
Nuevos registros. México: Chiapas, Puebla.
Material examinado: México: Chiapas: Ocosingo, Chajul, Reserva Montes Azules, 28.IV al 5-V.86, F. Arias, R. Barba y L. Cervantes (CNIN, 1). Puebla: Cuetzalan, 19.III.89, M. García (CNIN, 1); Teziutlán, 15.VIII.74 (CNIN, 1). Tabasco: Teapa Puyacatengo, 9.XII.85, R. Barba (CNIN, 2). Veracruz: Los Tuxtlas, Est. de Biología, 2-10.VII.85, C. Mayorga (CNIN, 1).
Microctenochira punicea (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Guerrero, Hidalgo, Puebla, Querétaro, Tabasco, Tamaulipas, Veracruz, Yucatán. Belice. Costa Rica. Guatemala: Alta Verapaz, El Naranjo. Honduras. Nicaragua.
Nuevos registros. México: Campeche, Morelos, Oaxaca.
Material examinado: México: Campeche: El Tormento, 13.VI.85, V. Arias, H. Velasco y M. Vértiz (CNIN, 1). Chiapas: finca, Prusia, Jaltenango, 10-12.V.85, F. Arias, H. Velasco y M. Vértiz, (CNIN, 1). Morelos: Jaltipán (CNIN, 1); Oaxaca: Tuxtepec, 14.VIII.1934 (CNIN, 1); Tabasco: Teapa, March, H. H. S. Donated by F. Du C. Godman, 1907 | Am. Mus. Nat. Hist. Dept. Invert. Zool. No. 18216 (AMNH, 1). Veracruz: Martínez de la Torre, 5.VII.46 (CNIN, 1).
Microctenochira rubrocincta (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México: Puebla, San Luis Potosí, Veracruz. Brasil. Colombia. Costa Rica: San Mateo. Guatemala. Nicaragua: Chontales. Panamá: Colon, Volcán de Chiriquí. Venezuela: Caracas, Maracay.
Material examinado: México: Veracruz: Volcán San Martín, 29.V.51, MacGregor | Det. S. Zaragoza (CNIN, 1).
Microctenochira stali (Boheman, 1862)
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México. Guatemala. Nicaragua: Chontales.
Nuevos registros. México: Tabasco, Veracruz.
Material examinado: México: Tabasco: Teapa, March, H. H. S. | Donated by F. Du Co. Godman, 1907 | Am. Mus. Nat. Hist. Dept. Invert. Zool. No. 18218 (AMNH, 1). Veracruz: Orizaba, 1-10.IV | F. C. Bowditch collection (MCZ, 1).
Microctenochira tabida (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Tabasco, Veracruz. Costa Rica: Puntarenas, San Mateo. Panamá: Bugaba, Zona del Canal, Colón, Volcán de Chiriquí.
Nuevos registros. México: Campeche, Hidalgo, Puebla, Oaxaca.
Material examinado: México: Campeche: El Tormento, 13.VI.85, V. Arias, H. Velasco y M. Vertiz (CNIN, 1). Hidalgo: San Bartolo, Tutotepec, 3.II.1991, H. Brailovsky y E. Barrera (CNIN, 1). Puebla: Cuetzalan, San Andrés Tzicuilan, Cascada, 27-30.IV.1994, G. Ortega y E. Barrera (CNIN, 1); Teziutlán, 15.VIII.84 (CNIN, 1). Oaxaca: km 58, Tuxtepec-Oaxaca, 28.VII.87, L. Cervantes (CNIN, 1).
Microctenochira vivida (Boheman, 1855)
Material tipo: lectotipo en NHRS. Paralectotipos en MZPW y NHRS.
Planta huésped: Convolvulaceae: Ipomoea phillomega (Vell) House (Borowiec y Świętojańska, 2017).
Distribución: México: Guerrero, Hidalgo, Querétaro, San Luis Potosí, Tabasco, Tamaulipas, Veracruz. Costa Rica: San Mateo. Honduras. Panamá: Bugaba, Chiriquí, Panamá.
Nuevos registros. México: Campeche, Oaxaca, Puebla. Perú: Iquitos.
Material examinado: México: Campeche: Champotón, 14.VI.85, F. Arias (CNIN, 1). Chiapas: Ixhuatán, 19.VII.87, R. Bertha, F. Arias y C. Cervantes (CNIN, 1). Puebla: Cuetzalán, 19.III.87, V. Melendez (CNIN, 1); km 4 Xicotepec-MA. Andrea El Zoquital, 1,190 m, 13.VII.1994, E. Barrera y C. Mayorga (CNIN, 1). Oaxaca: Istmo de Tehuantepec | Ctenochira vivida v. tabida, Det. F. Islas | Microctenochira vivida v. tabida, Det. S. Zaragoza (CNIN, 1). Perú: Iquitos F 6062 | Acc. 33591 (AMNH, 1).
Parorectis Spaeth
Parorectis Spaeth, 1901: 346. Especie tipo Cassida callosa Boheman, 1854. Holotipo en NHRS.
Cuerpo paralelo. Cabeza con líneas estridulatorias en la parte posterior. Antenas cortas sin rebasar la base del pronoto, antenómero III más largo que el II, antenómeros I-VI glabros, VII con características intermedias, VIII-XI pubescentes. Pronoto ovalado, márgenes laterales redondos. Prosterno con surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo usualmente con una superficial depresión en el ápice y ligeramente elevado en el margen anterior, surcos laterales ausentes o finos. Labro emarginado. Élitros convexos con o sin protuberancias, base más ancha que la base del pronoto, superficie con puntuación profunda, sin protuberancia en la parte media del borde del disco, lamela elitral opaca, margen basal crenado, húmeros prominentes. Proceso prosternal expandido hacia el ápice. Uñas simples, con peines en la cara interna y externa de las uñas de los tarsos.
Especies registradas en México
Parorectis callosa (Boheman, 1854)
Material tipo: holotipo en NHRS.
Planta huésped: Solanaceae: Solanum sp. Physalis sp. (Borowiec y Świętojańska, 2017).
Distribución: México: Morelos. EUA: Carolina del Sur, Florida y Texas.
Parorectis rugosa (Boheman, 1854)
Material tipo: lectotipo en NHRS. Paralectotipos en MZPW, NHRS y en la Colección Entomológica de Hope en OUMNH.
Planta huésped: Solanaceae: Physalis pruinosa L. (Borowiec y Świętojańska, 2017).
Planta asociada: Solanaceae: Physalis sp. (Hernández-Sosa, 2017).
Distribución: México: Estado de México, Guerrero, Hidalgo, Jalisco, Morelos, Oaxaca, Puebla, Tlaxcala, Yucatán. Costa Rica: Guanacaste. El Salvador: San Salvador. Honduras. Guatemala: San Gerónimo. Nicaragua: Chontales.
Nuevos registros: México: Querétaro, Veracruz. Panamá: El Real.
Material examinado: México: Guerrero: río Balsas, Wickham (MCZ, 1). Morelos: Matamoros, VII.10.03 | W. L. Flower collection (AMNH, 1). Querétaro: Jalpan, Jalpan-Xilitla km 15, 21°11’42” N, 99°26’30” O, 802 m, 03.VIII.2006, L. Cervantes y D. Brzoska (CNIN, 3). Veracruz: Sn. Rafael, Jicaltepec, 96 | F. C. Bowditch collection (MCZ, 1); El Castillo, 26.VIII.84, J. Peña M (CNIN, 1). Guatemala: Salama, 3,000 pies VII.30.1947 (AMNH, 1). Panamá: St. María El Real, Panamá | F. C. Bowditch collection (MCZ, 1).
Parorectis sublaevis (Barber, 1946)
Material tipo: holotipo y paratipo en USNM.
Planta huésped: desconocida.
Distribución: México: Sonora. EUA: Texas, Arizona, Nuevo México.
Material examinado: EUA: Arizona: SW research Sta., 5 mi W, Portal, Cochise Co. 5,400 ft, IV.15.55, M. Cazier (AMNH, 1); 8 mi. E. Douglas, Cochise Co., 4,000-4,500 ft, 12.1950 | M. Cazier (AMNH 1).
Physonota Boheman, 1854
Physonota Boheman, 1854:190. Especie tipo Physonota alutacea Boheman, 1854. Lectotipo y paralectotipo en NHRS.
Cuerpo ovalado, raramente redondo o triangular. Cabeza transversa con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más largo que el II, generalmente antenómeros I-V glabros, VI-XI pubescentes. Pronoto semicircular u ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo o no las partes bucales. Clípeo plano o levemente convexo, con o sin surco medio. Labro emarginado. Élitros convexos, nunca con una elevación por detrás del escutelo, base generalmente más ancha que la base del pronoto, superficie de los élitros con puntuación superficial, con una protuberancia en la parte media del borde del disco, lamela elitral translúcida u opaca, margen basal crenado, húmeros no prominentes. Proceso prosternal expandido hacia el ápice. Uñas de todos los tarsos simples sin peines en la cara interna y externa.
Especies registradas en México
Physonota alutacea Boheman, 1854:191
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: Boraginaceae: Cordia alba (Jacq.) Roem. y Schult., C. boissieri A. D. C., C. inermis (Mill.) I.M.Johnst., C. macrostachya (Jacq.) Roem. y Schult (Borowiec y Świętojańska, 2017). Cordia curassavica (Jacq.) Roem. y Schult. (Helson, 2005).
Distribución: México: Baja California, Chiapas, Durango, Guerrero, Jalisco, Estado de México, Morelos, Nuevo León, Oaxaca, Puebla, Sinaloa, Tabasco, Tamaulipas, Tlaxcala, Veracruz, Yucatán. Colombia: Bogotá. Costa Rica: El Coco, Escaz, Piedras negras, Poco Azul, San José. Ecuador: Manabi. Guatemala. Nicaragua. Panamá. Trinidad, Venezuela: Caparo. EUA: Texas.
Nuevos registros. México: Michoacán, Nayarit, Quintana Roo.
Material examinado: México: Baja California Sur: San José del Cabo | H. C. Fall collection | Physonota alutacea v. cyrtodes Boheman (MCZ, 1). Michoacán: 14 km al sur de Uruapan, 29.VII.1988, M. García (CNIN, 1). Nayarit: Mesa del Nayarit, camino al Cangrejo, 19.1.89, A. Cadena (CNIN, 1). Sinaloa: Mazatlán, Concordia km 32, Villa Unión Durango la Guasima, 37 m, 23°19’47” N, 105°58’40” O, 26.09.2010, L. Cervantes y C. Mayorga (CNIN, 1). Quintana Roo: 7 km N de Tulum, 23.VI.84, V. Hernández O. (CNIN, 2).
Physonota arizonae Schaeffer, 1925:234
Material tipo: ubicación desconocida.
Planta huésped: Asteraceae: Ambrosia ambrosioides (Cav.) W.W. Payne (Borowiec y Świętojańska, 2017).
Distribución: México: Jalisco, Sinaloa. EUA: Arizona.
Physonota attenuata Boheman, 1854
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: Boraginaceae: Cordia alba (Jacq.) Roem. y Schult., C. seleriana Fernald (Borowiec y Świętojańska, 2017).
Distribución: México: Colima, Chiapas, Guerrero, Jalisco, Morelos, Oaxaca, Querétaro, Tamaulipas, Veracruz. Guatemala. Nicaragua.
Material examinado: México: Chiapas: Cintalapa, 16.IX.47 | Det. Shin, C. 2013 (CNIN, 1); cerro Hueco, 5 km sur Tuxtla Gutiérrez, 23.VII.1992, B. Gómez | Det. Shin, C. 2013 (CNIN, 1). Tamaulipas: San Isidro, X.85, L. Cervantes | Det. Shin, C. 2013 (CNIN, 1); Llera, VI.14.1961 | Aguacate | E. Elías Calles | Det. Shin, C. 2013 (CNIN, 1). Nicaragua: Granada, Reserva Silvestre, Privada Domitila, 6.VI.2011, Shin, C. | Det. Shin, C. 2013 (CNIN, 2).
Physonota calcarata (Boheman, 1854)
Material tipo: ubicación desconocida.
Planta huésped: desconocida.
Distribución: México: Guerrero, Estado de México, Jalisco, Oaxaca.
Material examinado: México: Oaxaca: Hierve el Agua, 25.VII.2000, H. Brailovsky (CNIN, 2).
Physonota caudata Boheman, 1854
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Veracruz.
Nuevos registros. México: Ciudad de México, Oaxaca.
Material examinado: México: Ciudad de México: sin localidad específica | Det. S. Zaragoza (CNIN, 1). Oaxaca: Tehuantepec | F. C: Bowditch collection (MCZ, 1).
Physonota cerea Boheman, 1854
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México: Oaxaca.
Physonota citrina Boheman, 1854
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Durango, Jalisco, Oaxaca, Sinaloa, Veracruz. El Slavador.
Material examinado: México: Veracruz: Coatepec | Det. Shin, C. 2013 (CNIN, 1).
Physonota citrinella Boheman, 1854
Material tipo: holotipo en la colección de J. Weise en ZMHB.
Planta huésped: desconocida.
Distribución: México.
Physonota convexa Borowiec, 1995
Material tipo: holotipo en EGRC. Paralectotipo en la colección de L. Borowiec, Universidad de Wroclaw, Polonia, SEMC y MMUE.
Planta huésped: desconocida.
Distribución: México: Chiapas, Jalisco, Oaxaca.
Physonota disjuncta (Chevrolat, 1834)
Material tipo: ejemplar tipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Chihuahua, Durango, Estado de México, Guerrero, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Querétaro, Sinaloa, Tamaulipas, Veracruz.
Nuevos registros. México: Aguascalientes, Colima, Hidalgo, Puebla.
Material examinado: México: Aguascalientes: Sierra Fría, 26.III.72, J. Hendrichs S. Colima: sin localidad específica, IX.1916, C. C. Hoffman | Det. C. C. Hoffman, 76 (CNIN, 8). Hidalgo: Parque Nacional El Chico, 3,100 m, 27.VI.1943, Osorio Bonet Peláez | 37 (CNIN, 1); Las Ventanas, 10.VII.60, Pflanze im Bach, J. Hendrichs S. (CNIN, 10). Puebla: La Trinidad, 5 km al SE de Atlalixco, 15.VI.94, 18°50’97” N, 98°25’34” O, E. Barrera y C. Mayorga (CNIN, 2).
Physonota eucalypta Boheman, 1862
Material tipo: holotipo en ZMHB
Planta huésped: desconocida.
Distribución. México. Belice. Costa Rica. Guatemala.
Physonota flavago Boheman, 1854
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Durango, Sinaloa.
Physonota humilis Boheman, 1856
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Guanajuato, Oaxaca.
Physonota incrustata Boheman, 1854
Material tipo: ejemplar tipo en BMNH.
Planta huésped: desconocida.
Distribución: México.
Physonota limoniata Boheman, 1862
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Durango, Guerrero, Oaxaca. El Salvador.
Nuevos registros. México: Chiapas, Colima, Michoacán.
Material examinado: México: Chiapas: finca Prusia, Jaltenango, 10-12.V.85, F. Arias, H. Velasco y M. Vertiz, Det. Shin, C. 2014 (CNIN, 1). Colima: VII, C. C. Holfman | Det. F. Islas (CNIN, 1). Michoacán: Los llanos, 25.VI.86, E. Mariño (CNIN, 1).
Physonota maculiventris Boheman, 1854
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Oaxaca, Veracruz.
Nuevo registro. México: Jalisco.
Material examinado: México: Veracruz: sin localidad específica, colección E. Duges, 1754 | 1073 | 3209 | Det. Shin, C. 2013 (CNIN, 1). Guadalajara: sin localidad específica | F. C. Bowditch collection (MCZ, 1).
Physonota mexicana Boheman, 1854
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Hidalgo, Morelos, Oaxaca, Querétaro.
Physonota nitidicollis Boheman, 1854
Material tipo: lectotipo en NHRS. Paralectotipo en NHRS y en la Colección Entomológica de Hope en OUMNH.
Planta huésped: desconocida.
Planta asociada: Poaceae (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Jalisco, Estado de México, Michoacán, Morelos.
Nuevo registro. México: Colima.
Material examinado: México: Colima: sin localidad específica | Det. Shin, C, 2013 (CNIN, 1). Morelos: Cuernavaca, Mexico (MCZ, 1).
Physonota ovalis Boheman, 1854
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chihuahua, Nuevo León, Veracruz.
Physonota ovipennis Champion, 1894
Material tipo: sintipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Guerrero.
Physonota pacifica Spaeth, 1932
Material tipo: holotipo en MNHN.
Planta huésped: desconocida.
Distribución: México: Baja California Sur, Sonora.
Physonota picticollis Boheman, 1854
Material tipo: lectotipo en NHRS. Paralectotipo en NHRS y en la Colección Entomológica de Hope OUMNH.
Planta huésped: Lesianthaea sp. (Borowiec y Świętojańska, 2017).
Distribución: México: Durango, Jalisco, Oaxaca, Sinaloa, Veracruz. Guatemala.
Physonota puncticollis Borowiec, 1995
Material tipo: holotipo en SEMC. Paralectotipos en SEMC y en la colección de L. Borowiec, Universidad de Wroclaw, Polonia.
Planta huésped: desconocida.
Distribución: México: Oaxaca.
Physonota separata Boheman, 1854
Material tipo: ejemplar tipo en BMNH.
Planta huésped: desconocida.
Distribución: México: Durango, Hidalgo, Jalisco, Morelos, Oaxaca, Veracruz.
Physonota stigmatilis Boheman, 1854
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Chiapas, Guerrero, Tabasco, Veracruz.
Nuevos registros. México: Jalisco, Oaxaca.
Material examinado: México: Jalisco: Guadalajara | F. C. Bowditch collection (MCZ, 1). Oaxaca: San Juan Lachao, 704 m, 16°09’59.7” N, 97°07’051” O, 13.VII.2004, L. Cervantes, A. Delgado y C. Mayorga | Det. Shin, C. 2013 (CNIN, 1); Tuxtepec, Arr. Choapan, 29.V.97, F. Arias | Det. Shin, C. 2013 (CNIN, 1). Veracruz: colección E. Duges, 1759, D-1035 | Det. F. Islas (CNIN, 1).
Physonota sublaevigata Spaeth, 1915
Material tipo: sintipos en MMUE y SDEI.
Planta huésped: desconocida.
Distribución: México: Jalisco.
Physonota translucida Boheman, 1854
Material tipo: lectotipo y paralectotipo en NHRS.
Planta huésped: desconocida.
Planta asociada: Araceae: Xanthosoma sp. Bromeliaceae: Tillandsia sp. (Hernández-Sosa, 2014).
Distribución: México: Guerrero, Jalisco, Estado de México, Morelos.
Physonota turgida Boheman, 1854
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Planta asociada: Tillandsia caput-medusae E. Morren (CNIN).
Distribución: México: Oaxaca.
Nuevos registros. México: Guerrero, Michoacán, Morelos.
Material examinado: México: Guerrero: camino a las Granadas, on Tillandsia caput-medusae, 4.IV.1971, C. Beutelspacher B. | Det. Shin, C. 2014 (CNIN, 1); 15 km al N de Iguala (Est. de Microondas, Tuxpan), 24.V.66, H. Brailovsky, E. Barrera y E. Mariño | Det. Shin, C. 2014 (CNIN, 1). Michoacán: Zirahuén, 26.V.1988, 2,100 m, A. Cadena y L. Cervantes | Det. Shin, C. 2014 (CNIN, 1). Morelos: km 79, carr. Cuautla-Oaxaca, 28.I.88, A. Cadena, E. Barrera y E. Ramírez | Det. Shin, C. 2014 (CNIN, 1).
Physonota vitticollis Boheman, 1854
Material tipo: holotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Estado de México, Oaxaca.
Platycycla Boheman, 1854
Platycycla Boheman, 1854:240. Especie tipo Platycycla deruta Boheman, 1854. Lectotipo y paralectotipo en NHRS.
Cuerpo marcadamente oval, casi redondo. Cabeza transversa con líneas estridulatorias en la parte posterior. Antenas moderadamente largas apenas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros distales más largos que anchos, antenómeros I-III glabros, IV-XI pubescentes. Pronoto pentagonal, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal sin cubrir las partes bucales. Clípeo poco convexo, más ancho que largo. Labro emarginado. Élitros convexos, nunca con una elevación por detrás del escutelo, base más ancha que la base del pronoto, superficie de los élitros con puntuación superficial, con una protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal crenado, húmeros no prominentes. Proceso prosternal expandido hacia el ápice. Uñas de todos los tarsos simples sin peines en la cara interna y externa.
Especies registradas en México
Platycycla deruta Boheman, 1854:241
Material tipo: lectotipo en NHRS.
Planta huésped: desconocida.
Distribución: México: Oaxaca, Tabasco, Veracruz.
Nuevos registros. México: Chiapas, Jalisco.
Material examinado: México: Chiapas: XI.1907 | Det. Shin, C. 2013(CNIN, 1). Jalisco: Guadalajara, km 159, carr. Puerto Vallarta-Manzanillo, 25.XI.1990, G. Ortega y C. Mayorga | Det. Shin, C. 2013 (CNIN, 2).
Tapinaspis Spaeth
Tapinaspis Spaeth, 1936: 260. Especie tipo Coptocycla wesmaeli Boheman, 1855. Lectotipo en NHRS.
Cuerpo ovalado. Cabeza con líneas estridulatorias en la parte posterior. Antenas largas rebasando la base del pronoto, antenómero III más largo que el II, antenómeros I-VI glabros, VII-XI pubescentes. Pronoto ovalado, márgenes laterales redondos. Prosterno sin surco antenal. Collar prosternal cubriendo parcialmente las partes bucales. Clípeo plano con un somero surco medio. Labro emarginado. Élitros convexos, sin una elevación por detrás del escutelo, base usualmente del mismo ancho que la base del pronoto, superficie con puntuación superficial, sin protuberancia en la parte media del borde del disco, lamela elitral translúcida, margen basal liso, húmeros prominentes. Proceso prosternal y expandido hacia el ápice. Uñas de los protarsos simples, sin peines; meso y metatarsos con uñas apendiculadas y con peines en la cara interna de las uñas.
Especies registradas en México
Tapinaspis wesmaeli (Boheman, 1855)
Material tipo: lectotipo en NHRS.
Planta huésped: Compositae: Sinclairia caducifolia (B. L. Rob. y Bartlett) Rydb. (Borowiec y Świętojańska, 2017)
Planta asociada: Euphobiaceae: Ricinus communis L. Fagaceae: Quercus sp. Moraceae: Ficus sp. (Hernández-Sosa, 2014). Hamamelidaceae: Matudaea trinervia Lundell (CNIABM).
Distribución: México: Chiapas, Guerrero, Jalisco, Morelos, Oaxaca, Veracruz. Costa Rica: Guanacaste, Cartago. El Salvador: lago de Coatepeque. Guatemala: El Naranjo. Nicaragua: Matagalpa.
Nuevo registro. México: Estado de México. Belice.
Material examinado: México: Chiapas: Ixhuatan, 19.VII.1987, R. Bertha y L. Cervantes (CNIN, 1). Estado de México: Tejupilco, Sierra Nanchititla, Cañada Bosque Encantado, 18.XII.73, R. M. L. Franco | Cañada Bosque Encantado, bosque mesófilo, sobre Matudaea trinervia | 310-7 | CNIABM 41710 (CNIABM, 1). Guerrero: SCH1374, 77, Buenavista de Cuellar, B. C., 18º27’56.3” N, 99º24’8.5” O, selva baja caducifolia, 8.III.2006, 12:40, hojas matata, S. López (CCFES-Z, 2). Oaxaca: km 30 Tuxtepec, 20.XI.1990, E. Barrera y A. Cadena (CNIN, 1); Veracruz: Atoyac, 14.IV.2000, H. Brailovsky y E. Barrera (CNIN, 1). Belice: Toledo, Distr, Brit. Hond. 1-15.IX.06, Peck (MCZ, 1).
Comentarios finales
Agroiconota propinqua (Boheman, 1855) se cita en el catálogo de Ordóñez-Reséndiz (2014), sin embargo, su registro para México es erróneo. Durante la visita al MCZ, se encontraron ejemplares identificados por Ordóñez-Reséndiz como A. propinqua procedentes de México; al revisar dichos ejemplares, la primera autora de este trabajo determinó que en realidad corresponden a A.bivittata, ya que las líneas negras de los élitros son más delgadas y los élitros son menos convexos a diferencia de A. propinqua. Por otra parte, Sánchez-Reyes et al. (2014) y Sánchez-Reyes et al. (2015) listan a Gratiana lutescens (Boheman, 1854) y a Microctenochira varicornis (Spaeth, 1926), respectivamente, para el estado de Tamaulipas. Estas dos especies no se habían registrado para México antes de estos dos trabajos. Es necesario corroborar la determinación de estos ejemplares para establecer si es correcta la ampliación de su distribución. Asimismo para la especie Charidotis flavomarginata mencionada en Ordóñez-Reséndiz (2014).
A continuación se listan las especies con distribución dudosa para México.
Charidotis flavomarginata Champion, 1894
Material tipo: sintipo en BMNH y MMUE.
Planta huésped: desconocida.
Distribución: México? Guatemala: Vera Paz.
Gratiana lutescens (Boheman, 1854)
Material tipo: sintipo en BMNH y NHRS.
Planta huésped: Solanaceae: Solanum elaeagnifolium Cav., S. melongena L., S. linnaeanum Hepper y P.-M.L.Jaeger (Borowiec y Świętojańska, 2017).
Distribución: México? Argentina: Buenos Aires. Brasil. Chile? Paraguay.
Microctenochira varicornis (Spaeth, 1926)
Material tipo: holotipo en MMUE.
Planta huésped: desconocida.
Distribución: México? Belice.











 nueva página del texto (beta)
nueva página del texto (beta)