Introducción
Los ambientes subaéreos son aquellos que cuentan con una cantidad de agua intermitente, ya sea por la lluvia, goteo, niebla o por un flujo de agua corriente (Komárek y Anagnostidis, 1998). Dependiendo del sustrato (rocas, suelos, cortezas de árboles, plantas) en estos hábitats se desarrollan principalmente cianoprocariontes, clorofitas, diatomeas, rodofitas, que forman crecimientos de muchos tipos (biopelículas, tapetes, fieltros, etcétera).
Los objetos del patrimonio cultural también son colonizados por microorganismos, lo que impacta sobre su aspecto estético y su estado de conservación para las futuras generaciones (Allsopp et al., 2004). Como consecuencia, existe un interés por conocer las especies que integran los crecimientos de microorganismos que habitan sobre los bienes culturales, así como sus ciclos de vida y su fisiología, de modo que se puedan planificar estrategias que ayuden a conservar los objetos de valor artístico o histórico.
En México, el interés por la conservación del patrimonio cultural material y por el conocimiento de la ficoflora, originó que se realizaran estudios en las zonas arqueológicas de la cultura maya de Palenque, Yaxchilán y Bonampak, Chiapas (Herbert-Pesquera, 2008; Loyo, 2009, 2015; Mireles, 2012; Pedraza, 2014; Ramírez, 2006, 2012; Ramírez et al., 2009, 2010, 2011; Torres, 1993), registrando 159 especies para estos sitios, de las cuales el 63.2% corresponde a Chroococcales, 29.2% a Nostocales, 5.6% a Oscillatoriales, 0.9% a Trentepohliales y 0.9% a Fragilariales.
El objetivo de este trabajo fue documentar la riqueza de especies de algas y cianoprocariontes que conforman los crecimientos epilíticos que se desarrollan sobre los monumentos de la Zona Arqueológica (ZA) de Yaxchilán, Chiapas, México.
Materiales y métodos
La ZA de Yaxchilán se localiza en el municipio de Ocosingo, Chiapas, flanqueada por un meandro del río Usumacinta (Fig. 1). El área tratada en este estudio se restringe a la zona con los principales monumentos arqueológicos, localizados entre las coordenadas 16°54’7.2”- 16°53’43.2” N, 90°59’35.7”-90°58’45.3” O, la altitud varía entre 80 y 260 m snm, el clima es de tipo tropical monzónico con invierno seco (Amw), el periodo con la mayor precipitación ocurre entre mayo y octubre, mientras que la menor acontece entre febrero y abril, la precipitación pluvial media anual es de 2,000 a 2,300 mm, la temperatura media anual es de 25.5 °C, la vegetación corresponde a bosque tropical lluvioso y bosque mesófilo de montaña (Meave et al., 2008). En el sitio se encuentran alrededor de 40 edificios y estelas construidos con la roca calcárea de la región entre los años 238 a 849 d.C. (García, 2003).
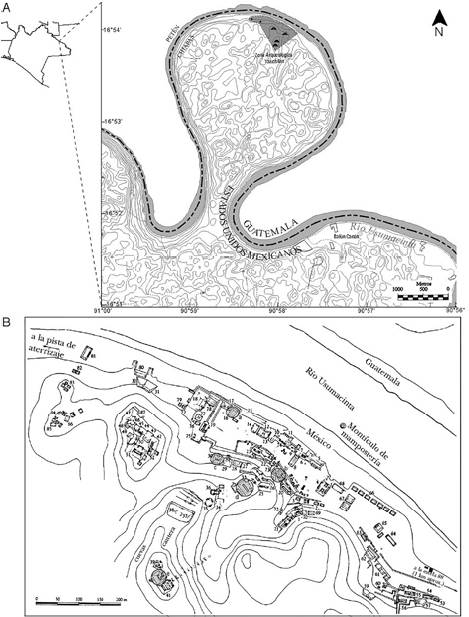
Figura 1 A) Localización del Monumento Natural Yaxchilán en Chiapas, México; la Zona Arqueológica de Yaxchilán se indica con sombreado (modificado de Inegi, 2006); B) los edificios donde se recolectó son señalados mediante círculos sombreados, a) edificio 16, b) edificio 21, c) edificio 30, d) edificio 33, e) edificio 40 (modificado de Herbert-Pesquera, 2008).
En visitas a la zona realizadas en agosto de 2006, enero y agosto de 2007, enero y agosto de 2008, se recolectaron 135 muestras de los crecimientos epilíticos de los edificios 16, 21, 30, 33 y 40 (Fig. 1B). También se obtuvieron los siguientes datos ambientales: temperatura ambiental, humedad relativa ambiental, radiación luminosa (como radiación fotosintéticamente activa o PAR) y dirección y velocidad del viento con una estación meteorológica Hobo Micro Station (Onset Computer Co.) y en algunas recolectas se tomaron datos puntuales de humedad relativa del muro con un protrímetro (GE Protrimeter Surveymaster). Los crecimientos epilíticos a muestrear se seleccionaron con base en los distintos aspectos macroscópicos, para posibilitar la recolecta del mayor número posible de especies. Las muestras consistieron en fragmentos de 1 cm2 removidos de los muros empleando un bisturí estéril, éstas se dividieron en 2 partes, una que se fijó in situ con formol al 3% y otra que se guardó en sobres de papel para deshidratarse posteriormente. En el laboratorio, una parte de cada una de las muestras en formol se utilizó para elaborar preparaciones semipermanentes con gelatina glicerinada, las muestras conservadas en formol y las herborizadas se depositaron en la colección de Biodeterioro Algal (BA) del Herbario de la Facultad de Ciencias (FCME) de la Universidad Nacional Autónoma de México.
Las preparaciones semipermanentes se observaron con microscopios Nikon Eclipse 80i y Nikon Optiphot, se tomaron fotografías digitales con una cámara ProgRes CT3, (Jenoptik), con el software ProgRes Capture Pro 2.8.8 (Jenoptik), y con una cámara fotográfica Nikon Coolpix S10. La identificación de las especies se basó principalmente en los trabajos de Komárek (2013), Komárek y Anagnostidis (1998, 2005) y Printz (1921) para Cyanoprokaryota; Komárek y Fott (1983), Starmach (1972) y Thompson y Wujek (1992) para Chlorophyta, y Novelo (2012) para Bacillariophyta, también se usó literatura especializada sobre cada género que sirvió para corroborar o modificar la identificación.
Resultados
Los datos de las variables ambientales registradas durante las recolectas aparecen en la Tabla 1.
Tabla 1 Condiciones ambientales mínimas y máximas durante los periodos de muestreo. T = temperatura ambiental; HR = humedad relativa ambiental (en %); PAR = radiación fotosintéticamente activa (μmol m2 s-1); VV = velocidad del viento (m s-1); HRm = humedad relativa del muro (en %).
| Fecha | T | HR | PAR | VV | HRm |
| Agosto 2006 | 26.7-35.2 | 54.2-87.7 | 63.7-2153.7 | 0-0.5 | 2.5-94.5 |
| Enero 2007 | 25.5-33.6 | 9.8-99.0 | 118.7-1683.7 | 0-0.74 | 13.0-99.9 |
| Agosto 2007 | 27.5-35.7 | 50.7-87.2 | 81.2-2161.2 | 0-1.11 | 56.2-87.2 |
| Enero 2008 | 23.0-31-0 | 14.5-99.0 | 21.2-1663.7 | 0-1.3 | 15.3-99.9 |
| Agosto 2008 | 29.1-34.0 | 49.2-78-2 | 1.2-1586.2 | 0-1.48 | 6.9-99.9 |
Se determinaron 49 especies (Tabla 2), de las cuales 25 pertenecen al orden Chroococcales (51%), 12 al orden Nostocales (24.5%) y 3 al orden Oscillatoriales (6.1%) de Cyanoprokaryota; 3 al orden Chlorellales (6.1%) y 4 al orden Trentepohliales (8.2%) de Chlorophyta y 2 al orden Naviculales (4.1%) de Bacillariophyta. Todas las especies se ilustran en las Figuras 2-7.
Tabla 2 Especies de algas y cianoprocariontes que componen los crecimientos epilíticos de los monumentos arqueológicos de Yaxchilán, Chiapas, México. * = Nuevo registro para México; E1 = eurioica; E2 = estenoica.
| Taxón | E1 | E2 |
| Cyanoprokaryota Komárek, 1996 | ||
| Cyanophyceae Schaffner, 1909 | ||
| Chroococcales Schaffner, 1922 | ||
| Chroococcaceae Nägeli, 1849 | ||
| Asterocapsa divina Komárek, 1993 (Fig. 2A) | x | |
| Chroococcus cohaerens (Brébisson) Nägeli, 1849 (Fig. 2B) | x | |
| * Chroococcus ercegovicii Komárek et Anagnostidis, 1994 (Fig. 2C) | x | |
| Chroococcus helveticus Nägeli, 1849 (Fig. 2D) | x | |
| Chroococcus varius A. Braun in Rabenhorst, 1861 (Fig. 2E) | x | |
| Gloeocapsopsis cyanea (Krieger) Komárek et Anagnostidis, 1994 (Fig. 2F) | x | |
| Pseudocapsa dubia Ercegović, 1925 (Fig. 2G) | x | |
| Entophysalidaceae Geitler, 1925 | ||
| Chlorogloea novacekii Komárek et Montejano, 1994 (Fig. 2H) | x | |
| Hyellaceae Borzì, 1914 | ||
| * Pleurocapsa fusca Godward, 1937 (Fig. 2I) | x | |
| Merismopediaceae Elenkin, 1933 | ||
| Aphanocapsa fuscolutea Hansgirg, 1892 (Fig. 3A) | x | |
| Aphanocapsa muscicola (Meneghini) Wille, 1919 (Fig. 3B) | x | |
| Microcystaceae Elenkin, 1933 | ||
| Gloeocapsa acervata Gardner, 1927 (Fig. 3C) | x | |
| Gloeocapsa aeruginosa Kützing, 1843 (Fig. 3D) | x | |
| Gloeocapsa atrata Kützing, 1845 (Fig. 3E) | x | |
| Gloeocapsa biformis Ercegović, 1925 (Fig. 3F) | x | |
| Gloeocapsa caldariorum Rabenhorst, 1865 (Fig. 3G) | x | |
| Gloeocapsa compacta Kützing, 1845 (Fig. 3H) | x | |
| Gloeocapsa punctata Nägeli, 1849 (Fig. 3I) | x | |
| Synechococcaceae Komárek et Anagnostidis, 1995 | ||
| Aphanothece castagnei (Kützing) Rabenhorst, 1865 (Fig. 4A) | x | |
| Gloeothece confluens Nägeli, 1849 (Fig. 4B) | x | |
| Gloeothece palea (Kützing) Nägeli, 1865 (Fig. 4C) | x | |
| Gloeothece rupestris (Lyngbye) Bornet in Wittrock et Nordstedt, 1880 (Fig. 4D) | x | |
| Gloeothece tepidariorum (A. Braun) Lagerheim, 1883 (Fig. 4E) | x | |
| Synechococcus elongatus (Nägeli) Nägeli, 1849 (Fig. 4F) | x | |
| Xenococcaceae Ercegović, 1932 | ||
| * Myxosarcina concinnaPrintz, 1921 (Fig. 4G) | x | |
| Nostocales Borzì, 1914 | ||
| Fischerellaceae Anagnostidis et Komárek, 1990 | ||
| * Fischerella tiserantiiFrémy, 1930 (Fig. 4H) | x | |
| Nostocaceae Agardh ex Kirchner, 1898 | ||
| * Nostoc carneum Agardh ex Bornet et Flahault, 1888 (Fig. 4I) | x | |
| Nostoc commune Vaucher ex Bornet et Flahault, 1888 (Fig. 5A) | x | |
| Nostoc microscopicum Carmichael ex Bornet et Flahault, 1888 (Fig. 5B) | x | |
| Scytonemataceae Rabenhorst ex Bornet et Flahault, 1886 | ||
| Petalonema crassum (Nägeli ex Kützing) Migula, 1907 (Fig. 5C) | x | |
| Petalonema densum (Bornet ex Bornet et Flahault) Migula, 1907 (Fig. 5D) | x | |
| Scytonema drilosiphon Elenkin et Polyanskiĭ, 1922 (Fig. 5E) | x | |
| Scytonema evanescens Gardner, 1927 (Fig. 5F) | x | |
| Scytonema hofmannii Agardh ex Bornet et Flahault, 1887 (Fig. 5G) | x | |
| Scytonema javanicum (Kützing) Bornet et Flahault, 1887 (Fig. 5H) | x | |
| Scytonema ocellatum Lyngbye ex Bornet et Flahault, 1887 (Fig. 5I) | x | |
| Stigonemataceae Borzì, 1892 | ||
| * Stigonema hormoides (Kützing) Bornet ex Flahault, 1886 (Fig. 6A) | x | |
| Oscillatoriales Elenkin, 1934 | ||
| Pseudanabenaceae Anagnostidis et Komárek, 1988 | ||
| Leptolyngbya cebenensis (Gomont) Umezaki et Watanabe, 1994 (Fig. 6B) | x | |
| Leptolyngbya compacta (Hansgirg) Komárek in Anagnostidis, 2001 (Fig. 6C) | x | |
| Leptolyngbya laminosa (Gomont) Anagnostidis et Komárek, 1988 (Fig. 6D) | x | |
| Chlorophyta Reichenbach, 1834 | ||
| Chlorophyceae Wille, 1884 | ||
| Chlorellales Bold et Wynne, 1985 | ||
| Scenedesmaceae Oltmanns, 1904 | ||
| Scenedesmus bijugus (Turpin) Lagerheim, 1893 (Fig. 6E) | x | |
| Scenedesmus obtusus Meyen, 1829 (Fig. 6F) | x | |
| Tetradesmus obliquus (Turpin) Wynne, 2015 (Fig. 6G) | x | |
| Ulvophyceae Mattox et Stewart, 1984 | ||
| Trentepohliales Chadefaud ex R.H. Thompson et Wujek, 1997 | ||
| Trentepohliaceae Hansgirg, 1886 | ||
| * Printzina ampla R.H. Thompson et Wujek, 1992 (Fig. 6H) | x | |
| * Printzina bosseae (De Wildeman) R.H. Thompson et Wujek, 1992 (Fig. 6I) | x | |
| * Printzina effusa (Krempelhuber) R.H. Thompson et Wujek, 1992 (Fig. 7A) | x | |
| Trentepohlia aurea (Linnaeus) C.F.P. Martius, 1817 (Fig. 7B) | x | |
| Bacillariophyta L.S. Dillon, 1963 | ||
| Bacillariophyceae Haeckel emend. Medlin et Kaczmarska, 2004 | ||
| Naviculales Bessey, 1907 | ||
| Naviculaceae Kützing, 1844 | ||
| Navicula orangiana Patrick, 1959 (Fig. 7C) | x | |
| Pinnulariaceae D.G. Mann, 1990 | ||
| Pinnularia borealis Ehrenberg, 1841 (Fig. 7D) | x |
Entre las temporadas del año hay variaciones en el tamaño de las poblaciones y en el número de especies presentes en el sitio. Se recolectaron 36 especies tanto en la temporada lluviosa como en la seca, 9 solo estuvieron presentes en el periodo de lluvias: Asterocapsa divina, Chrococcus ercegovicii, Pseudocapsa dubia, Chlorogloea novacekii, Myxosarcina concinna, Nostoc microscopicum, Scenedesmus bijugus, Tetradesmus obliquus y Pinnularia borealis, y 4 fueron exclusivas de la estación seca: Fischerella tiserantii, Stigonema hormoides, Scenedesmus obtusus y Trentepohlia aurea.
Los nuevos registros para México son: Chroococcus ercegovicii, Pleurocapsa fusca, Myxosarcina concinna, Fischerella tiserantii, Nostoc carneum, Stigonema hormoides, Printzina ampla, Printzina bosseae y Printzina effusa. Estas especies se describen a continuación:
Chroococcus ercegovicii Komárek et Anagnostidis, 1994 (Fig. 2C)
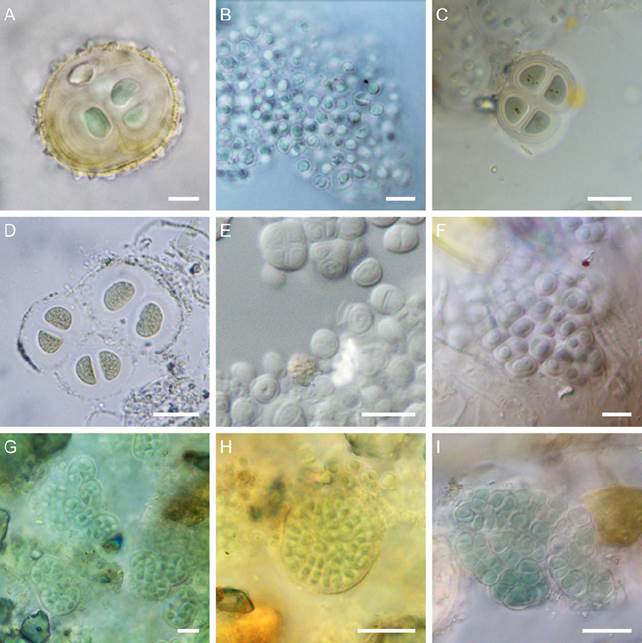
Figura 2 A) Asterocapsa divina; B) Chroococcus cohaerens; C) Ch. ercegovicii; D) Ch. helveticus; E) Ch. varius; F) Gloeocapsopsis cyanea; G) Pseudocapsa dubia; H) Chlorogloea novacekii; I) Pleurocapsa fusca. Barra: 10 μm.
Colonias dentro de crecimientos de otros cianoprocariontes. Agrupaciones microscópicas, formadas por grupos de 2 o 4 células, dentro de una vaina, hialina a ligeramente amarilla, estratificada. Células hemisféricas o con aspecto de triángulo con vértices redondeados, de 4.5- 5.1 μm por 6.2-6.9 μm, con vaina individual, contenido celular homogéneo, de color verde azul a verde olivo, en ocasiones con gránulos pardos en forma de puntos en el centro de la célula.
Comentarios taxonómicos
Herbario: BA196; BA418; BA516. Especie registrada en Croacia en ambientes subaéreos y epilíticos.
Pleurocapsa fusca Godward, 1937 (Fig. 2I)
Crecimientos macroscópicos con aspecto de películas pulverulentas, de color verde oscuro a negruzcas, firmemente adheridos a los muros. Colonias pseudofilamentosas, constituyen pseudoparénquimas de formas irregulares. Pseudofilamentos compuestos por 1 o 2 filas de células, rodeadas por vainas sin lamelaciones, hialinas, con un grosor menor a 0.5 μm entre las células. Células esféricas, hemisféricas o poliédricas, con diámetros de 2.6-3.6 μm por 3.6-4.8 μm, contenido celular homogéneo, de color verde azul.
Comentarios taxonómicos
Herbario: BA397; BA517. Registrada en Inglaterra y Polonia epilítica en litorales de lagos.
Myxosarcina concinna Printz, 1921 (Fig. 4G)
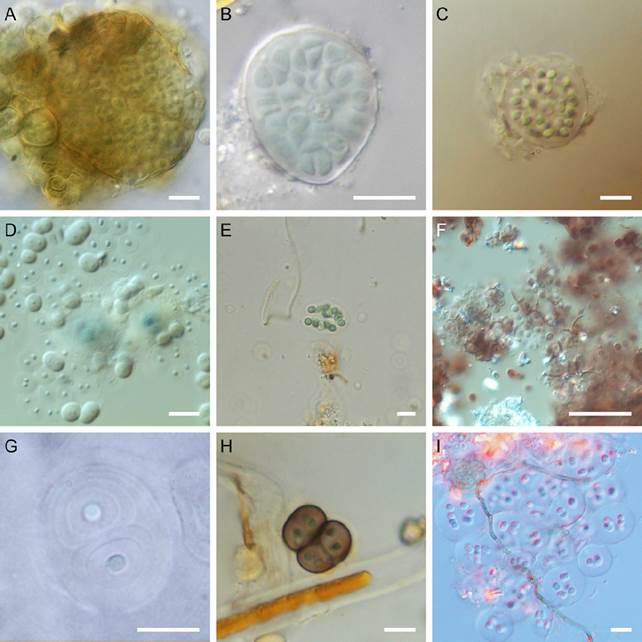
Figura 3 A) Aphanocapsa fuscolutea; B) A. muscicola; C) Gloeocapsa acervata; D) G. aeruginosa; E) G. atrata; F) G. biformis; G) G. caldariorum; H) G. compacta; I) G. punctata. Barra: 10 μm.
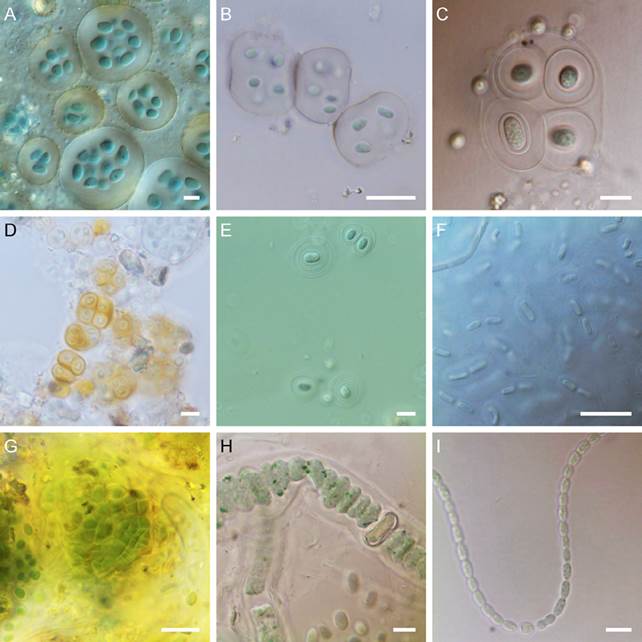
Figura 4 A) Aphanothece castagnei; B) Gloeothece confluens; C) G. palea; D) G. rupestris; E) G. tepidariorum; F) Synechococcus elongatus; G) Myxosarcina concinna; H) Fischerella tiserantii; I) Nostoc carneum. Barra: 10 μm.
Colonias dentro de crecimientos de otros cianoprocariontes. Agrupaciones microscópicas, formadas por subcolonias en forma de paquetes cúbicos o redondeados, con 2 a 64 células, rodeadas por vainas hialinas. Células esféricas o poliédricas irregulares, de 1.3- 2.9 μm de diámetro, contenido celular homogéneo, de color verde amarillento.
Comentarios taxonómicos
Herbario: BA214; BA402; BA613. Especie conocida en Sudáfrica, Centro y Sudamérica sobre cortezas de árboles.
Fischerella tiserantii Frémy, 1930 (Fig. 4H)
Colonias dentro de crecimientos de otros cianoprocariontes. Talo microscópico, filamentoso, con haces poco enredados entre sí, diferenciado en un filamento principal postrado y ramificaciones erectas, generalmente más delgadas. Filamentos multiseriados de 14.6-19.8μm de diámetro, ramas uniseriadas. Vaina amarillenta, a veces hialina, de 2.0-7.0μm de grosor. Células cuadradas o con forma de barril, de 7.7-14.3 μm de ancho por 4.8-10.7 μm de longitud, contenido celular con granulaciones finas, de color verde azul a verde olivo. Heterocitos cuadrados o con forma de barril, de 10.7-11.2 μm de diámetro por 12.6-14.6 μm de largo, de color amarillo pálido.
Comentarios taxonómicos
Herbario: BA510. Especie conocida en África ecuatorial, Centroamérica y Sudamérica en ambientes subaéreos sobre cortezas de árboles y en manglares. En Yaxchilán aparece como colonias microscópicas, no forma talos macroscópicos como los descritos en la literatura (Frémy, 1930; Komárek, 2013). Nostoc carneum Agardh ex Bornet et Flahault, 1888 (Fig. 4I)
Crecimientos macroscópicos en forma de películas grumosas, mucilaginosas, de color verde oscuro, poco adheridas a los muros. Subcolonias microscópicas de formas esféricas o globosas, con una vaina hialina o ligeramente amarilla, sin peridermo. Filamentos curvados, arreglados laxamente, sin orientación definida en la subcolonia, vainas individuales de los filamentos poco evidentes. Tricomas con 20-30 células dispuestas longitudinalmente. Células ovaladas, en forma de barril o, rara vez, esféricas, de 3.5- 4.8 μm de diámetro por 6.0-7.5 μm de largo, contenido celular homogéneo, de color verde azul; células apicales redondeadas. Heterocitos ovales o algunas veces esféricos, de 5.0-6.0 μm de diámetro por 8.0 μm de largo, de color verde azul, intercalares. Acinetos no observados.
Comentarios taxonómicos
Herbario: BA510; BA614. Especie registrada en Estados Unidos, Argentina y Brasil en ríos, estanques y epífita de macroalgas. Uno de sus sinónimos (Nostoc spongiaeforme Agardh ex Bornet et Flahault 1888) fue descrito como subaéreo. Se distinguió esta especie de otras similares, como N. commune, por la forma y tamaño de las células, y la ausencia de un peridermo bien delimitado.
Stigonema hormoides (Kützing) Bornet ex Flahault, 1886 (Fig. 6A)

Figura 5 A) Nostoc commune; B) N. microscopicum; C) Petalonema crassum; D) P. densum; E) Scytonema drilosiphon; F) Sc. evanescens; G) Sc. hofmannii; H) Sc. javanicum; I) Sc. ocellatum. Barra: 5 μm para Figura 5A; 10 μm para Figura 5B-F, H, I; 20 μm para Figura 5G.
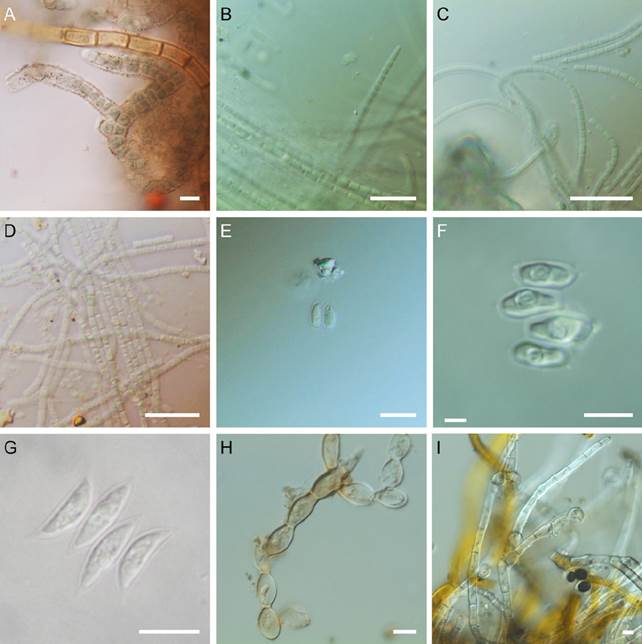
Figura 6 A) Stigonema hormoides; B) Leptolyngbya cebenensis; C) L. compacta; D) L. laminosa; E) Scenedesmus bijugus; F) Sc. obtusus; G) Tetradesmus obliquus; H) Printzina ampla; I) P. bosseae. Barra: 10 μm.
Colonias dentro de crecimientos de otros cianoprocariontes. Talo microscópico, formado por filamentos postrados, solo algunas ramificaciones se desarrollan erectas, sin diferencias en la morfología de los filamentos principales y las ramificaciones. Vainas de color amarillo ocre o parduzcas. Tricomas uni- o biseriados, de 11.6-15.2 μm de diámetro. Células poliédricas o de formas irregulares redondeadas, de 5.7-7.3 μm de diámetro, contenido celular homogéneo, de color verde azul, células separadas entre sí por aproximadamente 1 μm de distancia. Heterocitos de forma poliédrica redondeada, de 4.0-9.0 μm de diámetro, de color amarillo ocre, en posiciones laterales de filamentos principales y ramificaciones.
Comentarios taxonómicos
Herbario: BA519. Registrada en Estados Unidos, Argentina, Brasil e India como edáfica y epilítica en ambientes subaéreos, planctónica en ríos y presas y epífita sobre macroalgas.
Printzina ampla R.H. Thompson et Wujek, 1992 (Fig. 6H)
Crecimientos macroscópicos de aspecto de fieltro, de color verde olivo o anaranjado a rojizo, adherido firmemente al sustrato. Filamentos erectos y postrados, moniliformes, muy ramificados. Células ovoides, de 8.6- 12.3 μm de diámetro por 8.6-11.0 μm de largo, de color anaranjado a pardo pálido; células apicales de forma ovoide o elipsoide. Estructuras reproductoras de aspecto globoso o con forma de frasco, de 10.1 μm de diámetro por 13.6 μm de largo, en posición terminal.
Comentarios taxonómicos
Herbario: BA205, BA313, BA322, BA329, BA330, BA331, BA410, BA411, BA412, BA413, BA521, BA596. Especie registrada en Colombia y Costa Rica, como epífita sobre hojas de árboles.
Printzina bosseae (De Wildeman) R. H. Thompson et Wujek, 1992 (Fig. 6I)
Crecimientos macroscópicos de aspecto de fieltro, de color verde amarillento a anaranjado, poco adheridos al sustrato. Filamentos sin clara diferenciación entre los caracteres postrado o erecto, de forma cilíndrica, sin constricciones entre las células, ligeramente curvos. Células cilíndricas, de 7.0-12.0 μm de diámetro por 15.0-24.0 μm de largo, de color amarillo a anaranjado pálido; células apicales ligeramente cónicas. Esporangióforo en forma de cilindro curvo, de 16 μm de diámetro. Esporangios globosos de 20 μm de diámetro, con una estructura en forma de anillo en la base que se une al filamento.
Comentarios taxonómicos
Herbario: BA196, BA213, BA316, BA323. Registrada en Indonesia como corticícola.
Printzina effusa (Krempelhuber) R.H. Thompson et Wujek, 1992 (Fig. 7A)

Figura 7 A) Printzina effusa; B) Trentepohlia aurea; C) Navicula orangiana; D) Pinnularia borealis. Barra: 10 μm.
Crecimientos macroscópicos con apariencia de fieltro, de color verde amarillento a anaranjado, firmemente adheridos al sustrato. Filamentos postrados, cilíndricos a ligeramente moniliformes. Células cilíndricas alargadas, de 5.0-12.0 μm de diámetro por 15.0-26.0 μm de largo, algunas veces se desarrollan células globosas de 4.0-6.0 μm de diámetro por 5.0-6.0 μm de largo, de color verde pálido o pardo; células apicales redondeadas. Gametangios y esporangios globosos, de 20.0 μm de diámetro, en posición lateral en el talo.
Discusión
En conjunto, la flora epilítica subaérea de las zonas arqueológicas de Palenque, Bonampak y Yaxchilán es rica ya que reúne 168 especies de las cuales, cerca del 30 % se encuentra en la ZA de Yaxchilán y con 14 nuevos registros para estas zonas. Un elemento que hace diversa la flora de Yaxchilán son los componentes nuevos para los ambientes estudiados y para México. Aún con las diferencias en la cantidad de muestreos entre la ZA de Palenque (211 muestras) y la ZA de Yaxchilán (135 muestras y en un periodo más corto), en esta última zona aparecieron especies no registradas previamente en México, en las zonas arqueológicas y en las condiciones subaéreas (Ibarra-Gallardo, 2017; Loyo, 2009, 2015; Mireles, 2012; Ramírez, 2006). De las 14 especies no registradas previamente en zonas arqueológicas de Chiapas, 9 son también registros nuevos para México. Para tener una dimensión de la importancia de éstos pueden compararse las 81 especies reportadas en todo el estado de Chiapas hasta 2012 (Novelo, 2013) y las 167 actuales (Novelo y Tavera, 2018 [bdLACET]). El incremento se ha dado principalmente por las algas epilíticas subaéreas que hemos trabajado en las zonas arqueológicas (http://lacet.meridion.mx/proyectos.html).
La otra característica de la diversidad de las algas de la ZA de Yaxchilán es la valencia ecológica de sus componentes (Tabla 2). Al comparar los ambientes y formas de vida registrados en la bibliografía para esas especies se tiene un panorama de las capacidades de resistencia a la desecación y a la temperatura que explican parcialmente su presencia tan conspicua en los muros de esta zona arqueológica. Existen 27 especies eurioicas pues son capaces de vivir en condiciones acuáticas, subaéreas o ambas, y 22 son estenoicas pues sólo se han registrado en condiciones subaéreas o acuáticas, como es el caso de 4 especies: Nostoc carneum, Scenedesmus bijugus, S. obtusus y Navicula orangiana que son típicamente acuáticas. Veintiuna especies están presentes en condiciones acuáticas y en condiciones subaéreas: Asterocapsa divina, Chroococcus varius, Gloeocapsopsis cyanea, Pleurocapsa fusca, Aphanocapsa fuscolutea, Gloeocapsa aeruginosa, G. atrata, G. compacta, G. punctata, Aphanothece castagnei, Gloeothece confluens, G. palea, G. rupestris, Synechococcus elongatus, Nostoc commune, N. microscopicum, Petalonema densum, Scytonema hofmannii, S. hormoides, Tetradesmus obliquus, y Pinnularia borealis). Las 22 especies restantes son subaéreas, epilíticas o corticícolas (Ibarra, 2017; Novelo y Tavera, 2018 [bdLACET] ).
Las condiciones tropicales húmedas generales y en particular las de los días de recolecta, confirman dos aspectos importantes: una variabilidad ambiental diaria muy acentuada, protegida del viento, soleada y con una humedad relativa ambiental y de los muros muy dinámica (muy variable durante el curso del día, Tabla 1). Con una humedad relativa de 99.9 % en los muros podemos suponer casi una condición acuática, que se mantiene por más tiempo por la constitución mucilaginosa de los talos. Este mucílago funciona también como protección contra la desecación (por temperatura y por viento), la radiación UV (Hill, 1996; Sinha, 2003) y fija los crecimientos al sustrato. Estas condiciones permiten que especies que se dispersan desde cuerpos de agua puedan desarrollarse de forma limitada, pero constante.
De las 43 especies que habitan en condiciones subaéreas en la ZA de Yaxchilán, si 22 son exclusivas de esas condiciones (50%), esa proporción es señal de su afinidad a un sustrato que favorece el pH básico, condiciones de iluminación, humedad y temperatura fluctuantes. Y al mismo tiempo, el 50% restante, es de valencias ecológicas muy amplias. Komárek (2013) y Komárek y Anagnostidis (1998, 2005) cuestionan la validez de los registros multivalentes, principalmente en el caso de los cianoprocariontes, pues en general, las especies son fundamentalmente estenoicas y de distribución restringida. En el caso de la ZA de Yaxchilán, cerca del 80% de las especies son características de los ambientes subaéreos calcáreos, pero de distribuciones tanto amplias como restringidas, lo que obliga a seguir estudiando estas especies para certificar y complementar su identificación.
De las 9 especies descritas en este trabajo, 5 son acuáticas e incluso planctónicas. Su presencia en condiciones subaéreas sugiere que la influencia de las condiciones microambientales tiene un peso mayor que las condiciones climáticas generales. Por ello su desarrollo poblacional es limitado en tiempo y espacio.
No todas las especies presentes en Yaxchilán están en Palenque (que es la zona arqueológica más estudiada en su composición ficoflorística) ni en Bonampak (la zona menos estudiada de las 3): hay 14 especies no registradas previamente en otras zonas arqueológicas de Chiapas (Herbert-Pesquera, 2008; Loyo, 2009, 2015; Mireles, 2012; Pedraza, 2014; Ramírez, 2006, 2012; Ramírez et al., 2009, 2010, 2011; Torres, 1993), es decir, casi un 30% de la flora de Yaxchilán es diferente. Pero esta evaluación deberá matizarse pues no existen registros de otros hábitats subaéreos como cortezas, muros no calcáreos, orillas de cuerpos de agua, etc., para ninguna de las 3 zonas arqueológicas. En cuanto a las especies registradas (Tabla 2) en este trabajo, se trata de especies principalmente estenoicas, en sentido amplio (acuáticas o subaéreas) pues las Scenedesmaceae están presentes en condiciones diversas (plancton, metafiton y bentos de ambientes lóticos y lénticos). Por su parte, las especies del género Printzina son subaéreas, especialmente corticícolas. Es necesario mencionar que todas las identificaciones previas de estos organismos en otras zonas arqueológicas fueron atribuidas a Trentepohlia aurea (Ramírez, 2006, 2012; Ramírez et al., 2010; Torres, 1993) y ahora será necesario revisar ese material para conocer mejor la distribución y condiciones ambientales donde se desarrollan las especies de Printzina.
Conocer la flora epilítica de los monumentos arqueológicos mayas de la zona tropical será un punto de partida para diseñar las estrategias necesarias para su conservación. El crecimiento de algas y cianoprocariontes produce afectaciones que se consideran antiestéticas y aunque la mayoría de las publicaciones sobre el tema afirman que dichos organismos deterioran la roca, especialmente la calcárea, en ninguno de ellos se demuestra ese hecho de manera efectiva. Se afirma, por ejemplo, que hay producción de ácidos orgánicos, pero hasta ahora esos compuestos no se han identificado y por tanto no hay ninguna evidencia directa de ese deterioro (Crispim et al., 2004; Gaylarde et al., 2001; Videla et al., 2003).
Como el acceso al agua por las algas está influido por la hidratación del mucílago, los ciclos de vida se ven afectados por las condiciones microambientales; de tal manera que, si conociéramos el ciclo de vida de cada especie y en cada situación, podríamos diseñar estrategias de conservación tanto de las especies como del monumento. Un ejemplo de ésto sería controlar el desarrollo de las poblaciones durante el periodo de crecimiento vegetativo, lo que reduciría la posibilidad de dispersar los propágulos y estructuras de perennación de las algas. Durante la época de lluvias se incrementa la producción de mucílago (y además se hidrata), así que los crecimientos se desprenden fácilmente; mientras que, en época de secas cuando el mucílago se ha desecado, los talos se desprenden con partículas del sustrato. Una estrategia adecuada sería el control de crecimientos en áreas críticas (relieves o muros) durante el periodo lluvioso. Sin embargo, también habrá que estudiar los tiempos de cada fase del ciclo de vida de las algas para afinar las estrategias relacionadas con la reproducción de cada especie con respecto al clima o las condiciones microambientales.
México cuenta con un importante legado cultural de su pasado prehispánico y colonial, en el que vive una amplia diversidad de microorganismos. Sin embargo, el conocimiento de la composición de la ficoflora de ese patrimonio cultural sigue siendo pobre. Es necesario continuar con los estudios de las especies que habitan estos ambientes subaéreos para comprender las dinámicas en las que están involucradas y su relación con la conservación del patrimonio cultural y la biodiversidad de la región.











 nueva página del texto (beta)
nueva página del texto (beta)


