Introducción
A escala global, el pastoreo de ganado doméstico es la actividad humana que ocupa la mayor extensión de área, más de una cuarta parte de la superficie de la tierra emergida (Asner et al., 2004). Esta actividad altera la abundancia y composición de la biota previamente existente, debido a que el ganado compite por el alimento con los herbívoros nativos, compacta el suelo y modifica el contenido de nutrientes de éste (Frank et al., 2013). Los efectos ante las presiones del pastoreo son variables entre los diferentes ambientes o regiones y organismos de estudio, así como de acuerdo al tipo de ganado estudiado (Bueno et al., 2012; Milchunas et al., 1998), por lo que se ha generado un interés por conocer la magnitud de las respuestas que los organismos tienen a esta actividad (Frank et al., 2013), particularmente en el caso de los roedores donde disminuyen en riqueza y abundancia debido al pastoreo (Lightfoot et al., 2012).
El pastoreo es uno de los principales factores que afectan la estructura y función de los pastizales áridos (Bock et al., 2011), modificando atributos de la vegetación como el banco de semillas, cobertura y altura de la vegetación, estos a su vez son factores clave para los roedores en la selección de sus hábitats, lo que afecta directamente la densidad poblacional, es decir el número de individuos por unidad de área, la cual depende en gran medida de la calidad del hábitat y del movimiento de los individuos entre diferentes hábitats (Ricklefs, 1990). De igual forma, la alteración del hábitat por el pastoreo puede retardar la reproducción y desarrollo en los roedores afectando la estructura de edades y la proporción de sexos (Li et al., 2016), lo cual impacta directamente la tasa de crecimiento poblacional (Smith y Smith, 2007).
Las poblaciones de roedores son afectadas negativamente por la compactación del suelo generada por el pisoteo del ganado (Davidson et al., 2010; Heske y Campbell, 1991), al reducir la idoneidad del terreno para la construcción y permanencia de los sistemas de madrigueras (Torre et al., 2007). La compactación del suelo también reduce la microtopografía del suelo, lo que puede retardar la germinación de las semillas y el establecimiento de las plántulas (Valone y Sauter, 2005). Además, el ganado puede reducir la cobertura vegetal al destruir semillas y consumir otras partes de plantas, eliminando de esta forma, importantes fuentes de alimento (Heske y Campbell, 1991). Con la disminución de la cobertura vegetal se reducen los espacios de refugio, lo que resulta en un riesgo de depredación mayor para los roedores incrementando su vulnerabilidad frente a los depredadores, reduciendo sus oportunidades de escape (Bakker et al., 2009; Johnson y Horn, 2008; Orrock et al., 2004; Smith et al., 1996; Vial et al., 2011). Por otro lado, al disminuirse la cobertura vegetal, la termorregulación de los roedores puede verse afectada (McCafferty et al., 2003) al estar expuestos a los cambios drásticos de temperatura, lo que puede disminuir la supervivencia de éstos.
Los pequeños roedores nocturnos son buenos organismos de estudio debido a que sus ciclos reproductivos cortos permiten observar una respuesta relativamente rápida a las perturbaciones del ambiente (Bueno et al., 2012). Las razones para la conservación de los roedores radican en su diversidad taxonómica, ecológica y su biomasa, así como por el hecho de que juegan un papel fundamental en las comunidades ecológicas (Lidicker, 2007). Los roedores son importantes para cualquier ambiente terrestre, particularmente en los ecosistemas áridos y semiáridos, debido a que representan una fuente de biomasa para los consumidores secundarios (Hernández et al., 2011). A su vez, los roedores actúan como dispersores de esporas de hongos micorrízicos (Maser et al., 1978; Stevens y Tello, 2009) y como dispersores o depredadores de semillas (Ceballos, 2005) facilitando la germinación de éstas al transportarlas y enterrarlas (Alderton, 1996). La actividad de construcción de madrigueras influye sobre la vegetación, al modificar el microrrelieve y permitiendo la aireación del suelo, así como la introducción de materia orgánica y agua (Bock et al., 2006) lo que modifica la estructura y función de la vegetación (Davidson y Lightfoot, 2007; Jones et al., 2003). Además, sus madrigueras constituyen un hábitat importante para otros vertebrados como lagartijas (Davidson et al., 2008) e invertebrados (Davidson y Lightfoot, 2007). Por lo anterior, los roedores tienden a incrementar la heterogeneidad del paisaje creando parches únicos de hábitat para plantas y otros animales (Davidson y Lightfoot, 2007), por lo que han sido considerados como especies clave de los ecosistemas de pastizales en Norteamérica (Davidson y Lightfoot, 2008).
En el Valle de Perote, se practica principalmente el pastoreo de ganado caprino y ovino de forma semi extensiva y en menor medida de bovinos (Gerez, 1985). En el municipio de Perote la producción en toneladas de cabezas en pie, así como el número de animales sacrificados anualmente ha crecido considerablemente en la última década. En el caso del ganado caprino con un incremento del 20%, mientras que el ganado bovino en un 70%. Sacrificándose más individuos caprinos que bovinos (SIAP, 2014). Así mismo, en la región del Valle de Perote se encuentran áreas donde se ha dejado de practicar la ganadería por diferentes periodos, de hasta 10 años o más en sitios donde los propietarios no permiten el desarrollo de estas actividades al interior de sus terrenos. Con este trabajo se logró obtener información para conocer el efecto del pastoreo en roedores nocturnos en el valle de Perote, una zona semiárida poco estudiada y altamente transformada en el estado de Veracruz. Para esto se evaluó la estructura y composición de una comunidad de roedores nocturnos a través de características demográficas de las especies y de su hábitat con presencia de ganado así como en sitios con diferente tiempo sin pastoreo.
Materiales y métodos
El valle de Perote se encuentra ubicado entre los estados de Veracruz y Puebla. Se localiza entre 2 grandes macizos montañosos, en dirección este-sureste lo limita una parte de la Faja Volcánica Transmexicana (Ferrusquía-Villafranca, 2007), representado por el Cofre de Perote (4,282 m snm) y en dirección suroeste-noroeste la sierra Norte de Puebla. Entre estas 2 sierras se extiende una amplia llanura de 1,200 km2. La altitud varía entre 2,300 y 2,500 m formando una cuenca endorreica (Arriaga et al., 2000; Gerez, 1985). El clima corresponde al tipo BSk’w de acuerdo a Köeppen, modificado por García (2004), que es el más húmedo entre los semiáridos con veranos cálidos y lluviosos. La temperatura media anual es de 14 °C y la precipitación anual promedio es de 500 mm.
Se seleccionaron 3 sitios de pastizal, ubicados en la localidad de El Limón Totalco (entre las coordenadas 19°30’58” N, 97°19’26” O, zona 14), el cual pertenece al municipio de Perote, Veracruz (Figura 1). Dos de los sitios se ubicaron dentro del predio donde se encuentra la planta de alimento de Granjas Carroll de México, S.A. de C.V. de R.L. Este terreno se encuentra rodeado por un cerco eléctrico, el cual impide el paso a los pastores, su ganado y a sus perros, así como a los perros ferales. Estos sitios presentan 15 y 5 años sin pastoreo, los cuales fueron denominados como Pastizal antiguo (PA) y Pastizal reciente (PR) respectivamente. El tercer sitio, denominado como Pastizal con pastoreo (PP) se encuentra bajo pastoreo cotidiano. La vegetación consiste en pastos amacollados Jarava ichu y Eragrostis mexicana que crecen en toda el área, se encuentran presentes zonas abiertas donde predominan hierbas de la familia Asteraceae y pastos cortos como Bouteloua scorpiodes y Aristida divaricata además de áreas sin vegetación aparente. Se encuentran presentes arbustos Senesio salignus y nopales Opuntia robusta.

Figura 1 Localización de los sitios de pastizal para el trampeo de roedores. Pastizal antiguo PA (15 años sin pastoreo), pastizal reciente PR (5 años sin pastoreo) y pastizal con pastoreo.
El trampeo de roedores se llevó a cabo de manera mensual, abarcando un ciclo completo de un año, de abril de 2015 a marzo de 2016. En cada sitio se establecieron 2 cuadros de una hectárea. En cada cuadro se colocaron 36 trampas Sherman (30 × 10 × 8 cm), dispuestas en 6 líneas, con 6 trampas por línea y una separación de 20 m entre cada trampa, generando una cuadrícula de trampas, las cuales fueron cebadas por las tardes (alrededor de las 17:00 h) con una mezcla de avena y crema de cacahuate y se revisaron por las mañanas (entre 8:00 y 10:00 h) durante 2 noches consecutivas en cada sitio (Bock et al., 2006; González-Romero, 1995). Los individuos capturados fueron identificados a nivel de especie y se registraron datos de peso, sexo, categoría de edad y condición reproductiva (Bock et al., 2006). Se marcaron temporalmente con una línea en la región ventral utilizando un plumón de tinta permanente, para reconocer a los organismos recapturados (Stevens y Tello, 2012) y se liberaron in situ (Luévano et al., 2008). La edad de los roedores se determinó mediante el tamaño y peso del animal, la coloración del pelaje y la condición reproductiva del individuo, con base en lo anterior se clasificaron en 3 categorías; juveniles, subadultos y adultos (Canul-Cruz et al., 2012; Kunz et al., 1996). En cuanto a la condición reproductiva, en hembras se registró si se encontraban preñadas o en periodo de lactancia y en los machos si presentaban testículos abdominales o escrotados (Kunz et al., 1996; Lightfoot et al., 2012).
El muestreo de vegetación para caracterizar el hábitat, se realizó en octubre de 2015, por considerarse la época de mayor productividad vegetal en el área. Para ello, en cada sitio utilizado para muestrear los roedores se marcaron 5 cuadros de 10 × 10 m (100 m2). Cada uno de estos cuadros se dividió en una cuadrícula de 25 cuadros de 2 × 2 m (4 m2), de los cuales 3 de ellos fueron seleccionados al azar, mediante números generados con la función “aleatorio” en una hoja de cálculo del programa Excel. En estos 3 cuadros se tomaron datos como: especies de plantas, número de individuos por especie, la altura y la cobertura. Se realizó además, la colecta de material vegetal de las especies desconocidas, para ser posteriormente identificadas por medio de comparación con material del herbario XAL del Instituto de Ecología, A.C.
Análisis de datos. Para estimar el tamaño de las poblaciones de roedores por sitio, se utilizó el método del número mínimo que se sabe vivo (NMSV) como un índice de abundancia en cada periodo de muestreo (Caughley y Sinclair, 1994; Johnson y Horn, 2008), el cual se realiza mediante el conteo directo de los organismos capturados (Luévano et al., 2008). Para este análisis los individuos recapturados no fueron considerados (Stevens y Tello, 2012). Los animales pudieron ser incluidos más de una vez en el conteo si el marcaje que se les aplicó se perdió entre los diferentes periodos de muestreo, lo cual no ocurrió entre las noches consecutivas de cada muestreo (Bock et al., 2006). La abundancia poblacional de los roedores nocturnos, se obtuvo a partir del número de individuos capturados durante un periodo o sesión de muestreo (Bueno et al., 2012).
Para determinar diferencias en la abundancia entre los sitios, los datos fueron analizados con el software R mediante la paquetería mgcv (Wood, 2009), usando modelos generalizados aditivos de efectos mixtos (GAMM’s), donde la variable dependiente correspondió a la abundancia de cada especie, mientras que las variables independientes fueron el periodo de muestreo como variable continua y el sitio como variable categórica. Para estos modelos se utilizó una distribución gamma, la cual puede ser usada para describir un amplio rango de procesos y generalmente para la descripción de datos de medidas continuas o en poblaciones grandes, con valores de varianza altos (Crawley, 2007).
Para determinar el efecto del pastoreo sobre el peso promedio de los roedores, se realizaron pruebas de Fligner-Killeen para evaluar si las varianzas diferían significativamente entre muestras (Crawley, 2007). Posteriormente, se realizaron pruebas de Kruskal-Wallis para cada especie (Zar, 2010), finalmente en los casos con significancia se aplicaron pruebas de suma de rangos de Wilcoxon post hoc utilizando el software R (Crawley, 2007). En estos análisis exclusivamente se consideraron individuos adultos excluyendo hembras preñadas (Vial et al., 2011). La exclusión de juveniles, subadultos y hembras preñadas garantiza que se avalúe el efecto del pastoreo en el peso de los individuos y no confundirlo con otros efectos tales como la estructura de edades o la fecundidad en la población, los cuales aumentarían la varianza en los pesos registrados, ya que los individuos juveniles y subadultos no alcanzan el peso promedio de los individuos adultos, mientras que las hembras preñadas tienden a incrementar de peso durante los periodos de gestación. Además, el análisis se realizó separando los machos de las hembras para evitar la influencia de posible dimorfismo sexual (Bueno et al., 2012). Por otro lado, para determinar la contribución de biomasa de roedores, se sumó el peso registrado de cada individuo incluyendo juveniles, subadultos y hembras preñadas en cada sitio. La estructura poblacional de los roedores se determinó con base en el número de individuos en cada periodo de captura (Canul-Cruz et al., 2012; Vázquez et al., 2000). Para determinar si existió una independencia entre las categorías de edad y los 3 sitios, se analizaron tablas de contingencia por especie utilizando el estadístico χ 2 en R (Quinn y Keough, 2002). Mientras que para determinar si la proporción de sexos de los roedores fue diferente de 1:1 se realizaron pruebas binomiales en R (Wilson y Hardy, 2002).
Para determinar el efecto del pastoreo sobre la altura de la vegetación, se realizaron análisis de varianza de una vía con las especies compartidas entre los 3 sitios usando como variable de respuesta la altura de las plantas. Posteriormente, de las especies que resultaron con diferencias significativas en la altura, se compararon mediante pruebas de Tukey utilizando R (Crawley, 2007). Para determinar la relación entre la abundancia de roedores y la abundancia de plantas se realizó un análisis de co-inercia con la paquetería ade4 del programa R (Dray y Dufour, 2007). El análisis de co-inercia es un método de acoplamiento simétrico que proporciona la descomposición de 2 conjuntos de datos en un grupo de vectores ortogonales, lo que nos proporciona una visión más precisa de la posible relación de la comunidad de roedores nocturnos con su hábitat, al medir la correspondencia de 2 matrices de datos, generalmente una matriz de la comunidad animal o vegetal y otra matriz de su ambiente (Dray et al., 2003). Finalmente, para determinar la probabilidad del análisis de co-inercia y la fuerza de la relación entre los conjuntos de datos, se realizó una permutación de Monte Carlo con el coeficiente de correlación de los datos de roedores y plantas, basado en 10,000 réplicas. Con este análisis, se estima si los fenómenos observados son consecuencia del azar, es decir el modelo nulo a comprobar es, si la significancia de la prueba de co-inercia es independiente de la abundancia de los roedores y de las plantas, comparándola con una muestra de estadísticos de prueba obtenidas al azar (Manly, 2006).
Resultados
Durante el estudio fueron capturados 811 individuos de roedores nocturnos, con un esfuerzo de muestreo de 1,944 noches/trampa, de los cuales 164 correspondieron a recapturas. En el pastizal antiguo (PA) se capturaron 336 individuos, de los cuales 74 fueron recapturas. En el pastizal reciente (PR) 311 individuos, de los cuales 62 correspondieron a recapturas. Mientras que en el pastizal con pastoreo (PP) solo se capturaron 164 individuos, de los cuales 28 fueron recapturas. La comunidad estuvo compuesta por cuatro especies de roedores nocturnos, la especie más capturada correspondió a Peromyscus maniculatus, seguido de Dipodomys phillipsii y finalmente, con la menor frecuencia de individuos capturados Reitrodonthomys megalotis y Perognathus flavus. Por otro lado, D. phillipsii fue la especie mayormente capturada en el sitio PP. Mientras que P. maniculatus, R. megalotis y P. flavus, se registraron en mayor proporción en los sitios PA y PR.
La abundancia de los roedores nocturnos en el sitio PA y PR presentó una disminución en el periodo de muestreo correspondiente a junio, la cual se mantuvo hasta septiembre. Posterior a éste, se observó un incremento de la abundancia en octubre, tendencia que continuó hacia el final del muestreo. En el sitio PP la abundancia permaneció relativamente constante durante todo el periodo de muestreo siendo D. phillipsii la especie más abundante de este sitio, a excepción de abril y junio, en los cuales la especie con más capturas registradas corresponde a P. maniculatus. La especie dominante en los sitios PA y PR fue Peromyscus maniculatus. Las capturas de R. megalotis y P. flavus en general, fueron escasas en los 3 sitios, siendo más frecuentes en el PA (Fig. 2). De acuerdo a los GAMM’s se observa que la abundancia de D. phillipsii y R. megalotis fue cualitativamente diferente en el sitio PP. Lo anterior debido a que en PA y PR la abundancia de estas 2 especies, se encuentra significativamente relacionada con el mes de muestreo. Para el caso de P. maniculatus y P. flavus no se encontró dicha relación (Tabla 1). En general, la abundancia de los roedores tendió a ser menor en el sitio pastoreado.

Figura 2 Densidad (individuos/ha) por periodo de muestreo (abril de 2015 a marzo de 2016) de los roedores nocturnos, en tres áreas de pastizal: PA = pastizal antiguo, PR = pastizal reciente y PP = pastizal con pastoreo.
Tabla 1 Resultados de los modelos generalizados aditivos de efectos mixtos (GAMM’s). Se denota con * los casos con significancia.
| Especie | Sitio | Abundancia ± DE | F | p |
|---|---|---|---|---|
| D. phillipsii | PA | 56 ± 3.1 | 16.065 | 0.00019* |
| PR | 14 ± 1.2 | 6.846 | 0.0116* | |
| PP | 74 ± 1.9 | 2.388 | 0.12 | |
| P. maniculatus | PA | 169 ± 6.5 | 0.335 | 0.56 |
| PR | 190 ± 5.8 | 0.000 | 0.995 | |
| PP | 39 ± 2.3 | 1.242 | 0.27 | |
| R. megalotis | PA | 16 ± 1.6 | 4.605 | 0.0094* |
| PR | 12 ± 1.1 | 11.804 | 0.00119* | |
| PP | 1 ± 0.2 | 0.215 | 0.645 | |
| P. flavus | PA | 3 ± 0.4 | 2.288 | 0.137 |
| PR | 2 ± 0.3 | 0.091 | 0.764 | |
| PP | 1 ± 0.2 | 0.365 | 0.548 |
La contribución de biomasa total para los sitios fue mayor en PA (5.8 kg), intermedia en PP (4 kg) y menor en PR (3.8 kg). Independientemente del sitio, las hembras de D. phillipsii tienden a ser menos pesadas que los machos (χ 2 = 7.2, g.l = 1, p = 0.007), en R. megalotis las hembras tienden a ser más pesadas (χ 2 = 5.5, g.l. = 1, p = 0.01), mientras que para P. maniculatus no se observaron diferencias (χ 2 = 0.2, g.l. = 1, p = 0.6). En promedio, las hembras de D. phillipsii en el PA y PP, fueron las menos pesadas, mientras que los machos del PP fueron los más pesados (Fig. 3a). De acuerdo a la prueba de Kruskal-Wallis, no existieron diferencias significativas del peso de D. phillipsii hembras entre los sitios (χ 2 = 0.9, g.l. = 2, p = 0.6), ni en el caso de los machos (χ 2 = 1.7, g.l. = 2, p = 0.4). No se detectaron diferencias significativas en hembras de P. maniculatus (χ 2 = 0.9, g.l. = 2, p = 0.6), mientras que la diferencia en el peso de los machos fue marginalmente significativa (χ 2 = 5.8, g.l. = 2, p = 0.052), siendo los de PP los menos pesados y los de PA los más pesados (W = 927, p = 0.01) (Fig. 3b). Para el caso de R. megalotis solo fue analizado el peso de los machos, puesto que en el PP no fueron capturados individuos hembras (Fig. 3c), determinando que no existieron diferencias significativas en el peso entre los sitios (χ 2 = 1.2, g.l. = 2, p = 0.5).
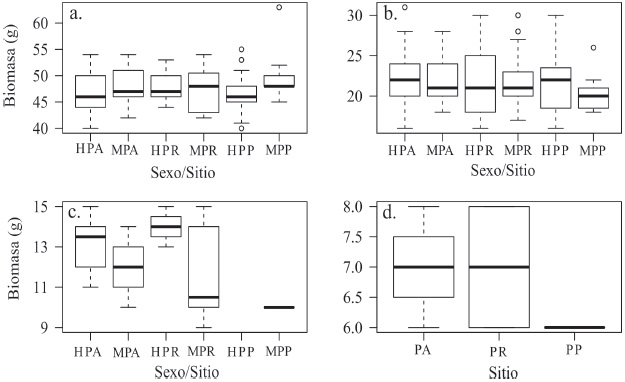
Figura 3 Comparación del peso de a. Dipodomys phillipsii, b. Peromyscus maniculatus, c. Reithrodontomys megalotis y d. Perognathus flavus. Se denota como H a las hembras y como M a los machos, así como las áreas de pastizal muestreadas: PA= pastizal antiguo, PR= pastizal reciente y PP= pastizal con pastoreo. La barra negra representa la mediana, la caja los cuartiles 1 y 3 y los bigotes el valor mínimo y máximo registrados durante los muestreos de abril de 2015 a marzo de 2016.
Debido a que únicamente se capturaron individuos adultos de las especies R. megalotis y P. flavus, en la Figura 4 solo se muestran los individuos bajo alguna categoría de edad de D. phillipsii (Fig. 4a) y de P. maniculatus (Fig. 4b). Para el caso de D. phillipsii en el PR no se registraron individuos subadultos ni juveniles, mientras que en el PA no se registraron juveniles. En general, se cuenta con pocos registros de individuos juveniles y subadultos de esta especie para los 3 sitios (Fig. 4a). Peromyscus maniculatus fue la especie en la que se registraron más individuos subadultos y juveniles. En el PA en los últimos 4 periodos de muestreo, aunque la frecuencia de captura de P. maniculatus es similar, existe un incremento de individuos subadultos y juveniles. En el PR, se observan individuos juveniles o subadultos en todos los periodos de muestreo, a excepción de mayo y marzo. Por otro lado, en el PR se presenta en los últimos periodos de muestreo un mayor número de individuos subadultos y juveniles a excepción de marzo. En el PP solo fueron capturados individuos adultos de esta especie (Fig. 4b). Debido a que los datos de juveniles y subadultos fueron bajos para ambas especies, éstos se trasladaron a una misma categoría de edad para llevar a cabo el análisis de tablas de contingencia. Aun así, no se detectaron diferencias significativas en la proporción de adultos y juveniles entre los sitios (D. phillipsii: χ 2 = 2.16, g.l. = 2, p = 0.33 y P. maniculatus: χ 2 = 2.86, g.l. = 2, p = 0.23). En los sitios protegidos de pastoreo (PA y PR) la tendencia de la proporción de sexos es 1:1 en D. phillipsii y P. maniculatus. En el sitio con pastoreo (PP) la proporción de hembras de D. phillipsii y P. maniculatus es mayor con respecto a los machos (Tabla 2). Para el caso de R. megalotis y P. flavus se observa en general una proporción menos equitativa, además que en algunos casos no es posible establecer adecuadamente una proporción de sexos debido a la baja captura de individuos de estas 2 especies, por lo que no se realizaron inferencias sobre la proporción de sexos de R. megalotis y P. flavus. De acuerdo a las pruebas binomiales solo para el caso de D. phillipsii en el PP la proporción de machos y hembras fue significativamente diferente de 1:1. Durante el muestreo no fueron capturados individuos de R. megalotis y P. flavus bajo algún estadio reproductivo. Se registró un mayor número de individuos de D. phillipsii machos con testículos escrotados en el PP, respecto a los 2 sitios restantes. Sin embargo, proporcionalmente, el PR es el sitio donde se presentaron más machos escrotados con un 50%. No se presentaron machos escrotados entre septiembre y diciembre en todos los sitios (Fig. 5a). Mientras que para el caso de las hembras de la misma especie, se registraron pocas hembras en algún estadio reproductivo, siendo el PP, el sitio donde se presentó un mayor número de hembras lactando (Fig. 5b). Para el caso de P. maniculatus se capturaron pocos machos con testículos escrotados, mientras que las hembras presentaron mayor evidencia reproductiva (Fig. 6). Por otro lado, el PA fue el sitio donde se presentó un mayor porcentaje de machos escrotados con 6.8 % (Fig. 6a). El PP fue el sitio donde se capturó el menor número de hembras en estado reproductivo de esta especie (Figura 6b).
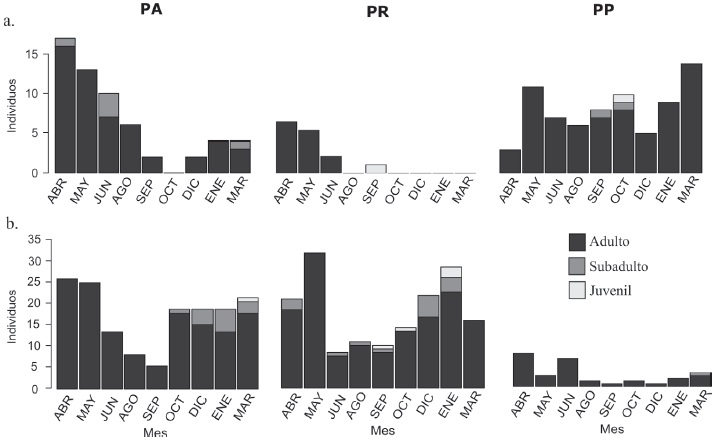
Figura 4 Estructura poblacional por edades (adultos, subadultos y juveniles) de a. Dipodomys phillipsii y b. Peromyscus maniculatus en las tres áreas de pastizal, durante el periodo abril de 2015 a marzo de 2016.
Tabla 2 Número de individuos y proporción de sexos por especie en los tres sitios de pastizal PA (pastizal antiguo), PR (pastizal reciente) y PP (pastizal con pastoreo) en el periodo abril de 2015 a marzo de 2016. Se denota con (*) los casos con significancia.
| PA | PR | PP | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Especie | ♀ | ♂ | Proporción | ♀ | ♂ | Proporción | ♀ | ♂ | Proporción |
| D. phillipsii | 29 | 29 | 1:1 | 6 | 8 | 1:1.33 | 60 | 33 | 1.82:1 * |
| P. maniculatus | 86 | 95 | 1:1.1 | 110 | 101 | 1.08:1 | 24 | 16 | 1.5:1 |
| R. megalotis | 6 | 10 | 1:1.6 | 3 | 10 | 1:3.33 | 0 | 1 | - |
| P. flavus | 2 | 1 | 2:1 | 0 | 3 | - | 1 | 0 | - |

Figura 5 Número de individuos de Dipodomys phillipsii. a, machos con testículos abdominales o escrotados y b, hembras que se encontraron inactivas, preñadas o lactando, en los diferentes sitios de pastizal en el periodo abril de 2015 a marzo de 2016.

Figura 6 Número de individuos de Peromyscus maniculatus a, machos con testículos abdominales o escrotados y b, hembras que se encontraron inactivas, preñadas o lactando, en los diferentes sitios de pastizal en el periodo abril de 2015 a marzo de 2016.
Durante el muestreo de vegetación, fueron registradas un total de 25 especies pertenecientes a 14 familias. De las cuales, la familia Asteraceae fue la mejor representada con 6 especies, seguida de Poaceae con 5 especies. El PA es el sitio donde se presenta la mayor riqueza de especies de plantas (18 especies), seguida por el PR (14 especies) y finalmente el PP con el menor número de especies (10). En el PA se presentaron 9 especies exclusivas, el PR presentó 4 especies exclusivas, mientras que el PP únicamente 3 especies exclusivas. Fueron 7 las especies compartidas entre los 3 sitios. La altura de las plantas fue significativamente diferente entre sitios, con excepción de Heterotheca inuloide, siendo menores en el sitio PP, a excepción de Jarava ichu, donde la altura menor correspondió al sitio PA (Fig. 7). El análisis de co-inercia (Fig. 8) indica que existen 3 tipos de vegetación asociadas a 3 comunidades de roedores distintas, los cuales corresponden a los 3 sitios de pastizal de este estudio. Es decir, cada tipo de vegetación genera una comunidad de roedores diferente. Así mismo la relación hallada entre la abundancia de los roedores y la vegetación es significativa y no es consecuencia del azar (p = 0.0005).
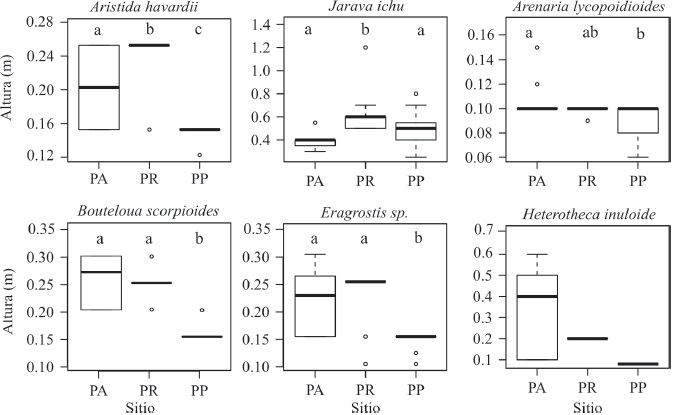
Figura 7 Comparación de la mediana, cuartil 1 y 3 y valor mínimo y máximo de la altura de 6 especies de plantas compartidas entre los 3 sitios de pastizal. Se denota con letras diferentes los casos con diferencia significativa en la altura. Se omite la especie Euphorbia prostrata, así como el análisis estadístico de Heterotheca inuloide debido al bajo número de individuos registrados en PR y PP.
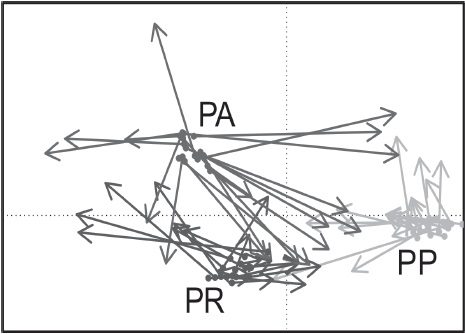
Figura 8 Análisis de co-inercia de la asociación entre roedores y vegetación en los 3 sitios de pastizal del valle de Perote. El origen de los vectores corresponde a la posición del sitio descrito por el grupo de datos de vegetación, mientras que las puntas de los vectores corresponden a la posición del sitio descrito por la abundancia de roedores. La amplitud de los vectores indica que en el PP, la variabilidad en la riqueza y abundancia de roedores y plantas es menor, intermedia en el PR y mayor en el PA.
Discusión
La variación en la abundancia de D. phillipsii y R. megalotis en PA y PR se encontró significativamente relacionada con el periodo de muestreo, es decir con los cambios temporales en el área de estudio. Esta variación en sus poblaciones pudo ser causada por los cambios climáticos del Valle de Perote, tales como la precipitación (Li et al., 2016), debido a que se ha observado como un factor determinante en el cambio de la densidad de los roedores (Hernández et al., 2011; Jones et al., 2003; Lightfoot et al., 2012). Por otro lado, en el PP los valores de abundancia variaron poco y con valores bajos muestreo a muestreo. Esta homogeneidad en la abundancia de roedores en el PP puede deberse a que el pastoreo tiende a disminuir las fluctuaciones periódicas (Evans et al., 2015) así como afectar los picos de la densidad en roedores, principalmente mediante la eliminación de biomasa vegetal (Evans et al., 2015; Schmidt et al., 2005). En general, la abundancia de las especies de roedores fue menor en el sitio con presencia de ganado, a excepción de D. phillipsii, lo que indica que no todas las especies fueron afectadas por el pastoreo en la misma proporción.
En sitios con pastoreo intenso, la composición de especies tiende a estar dominada por generalistas (James, 2003). Contario a lo esperado D. phillipsii, la cual se caracteriza por ser más bien especialista, fue la especie dominante del sitio con presencia de ganado (PP), mientras que la especie dominante en los sitios cercados (PA y PR) correspondió a una especie generalista, P. maniculatus. La población de P. maniculatus pudo disminuir en el sitio pastoreado, debido a que el ganado tiende a afectar negativamente la abundancia y biomasa de artrópodos (Evans et al., 2015), los cuales conforman una parte importante de su dieta (Nowak, 1999; Stevens y Tello, 2012). Así mismo, nuestros resultados contrastan con los de Bich et al. (1995) y Bueno et al. (2012), donde registraron un incremento en la abundancia de P. maniculatus en sitios con mayor intensidad de pastoreo. Por su parte, Bock et al. (2011) mencionan que P. maniculatus fue igualmente abundante tanto en sitios pastoreados como no pastoreados, además las afectaciones más importantes para esta especie fueron referidas a los eventos de fuego y en menor medida a las actividades de pastoreo.
El pastoreo en el sitio PP del valle de Perote pudo ser ligero durante el presente estudio, debido a que favoreció la abundancia de D. phillipsii. Davidson et al. (2010) reportan un efecto positivo del pastoreo moderado sobre los mamíferos pequeños que prefieren los hábitats abiertos, debido a que la eliminación de cantidades de vegetación por el ganado, crea suelos con cobertura baja y sin obstrucciones visuales, lo que permite un mejor desplazamiento para ratas canguro del género Dipodomys (Ostoja y Schupp, 2009; Riojas-López, 2006, 2012; Thibault et al., 2010). Sin embargo, las poblaciones de D. phillipsii podrían declinar a largo plazo, si la intensidad del pastoreo incrementara debido al actual crecimiento poblacional y la consecuente demanda de alimentos, como ha ocurrido en el caso de D. merriami, en algunos sitios del desierto Chihuahuense (Davidson et al., 2010). Los miembros restantes de la comunidad R. megalotis (Cricetiade) y P. flavus (Heteromydae), fueron poco abundantes en todos los sitios. El presente estudio es concordante con el trabajo de Stevens y Tello (2012) quienes reportan a R. magalotis como la especie menos recurrente en su estudio, a través de diferentes tipos de vegetación en el desierto de Mojave. A su vez, diversos autores, registran a P. flavus como una especie rara o poco abundante (Hernández et al., 2005; Luévano et al., 2008; Tapia-Ramírez et al., 2012). En el PP, solo fueron capturados un individuo de R. megalotis y un individuo de P. flavus, lo que sugiere que el carácter de rareza de estas especies puede potenciarse en presencia de pastoreo. Por otro lado, la riqueza de especies de roedores no fue afectada por el pastoreo, debido a que se registró el mismo número de especies en los 3 sitios. De manera similar que otros autores, en el presente estudio se encontraron efectos mínimos del pastoreo sobre la riqueza de especies (Bich et al., 1995; James, 2003; Johnson y Horn, 2008; Schmidt et al., 2005).
Los valores en cuanto al peso de los roedores, aunque no para todas las especies, tendieron a ser menores en el sitio pastoreado. Sin embargo, no se encontraron diferencias significativas en el peso entre los sitios, lo que concuerda con lo reportado por otros autores (Bakker et al., 2009; Bueno et al., 2012; Saetnan y Skarpe, 2006), a su vez lo anterior sugiere nuevamente que el pastoreo en el PP pudo ser ligero durante el muestreo. El peso promedio menor registrado en roedores del sitio PP, pudo estar relacionado con los cambios de las condiciones climáticas, como la variación en la precipitación (Hernández et al., 2005, 2011). Esto debido a que el pastoreo puede exacerbar los efectos negativos de las condiciones climáticas, como la sequía, sobre la biomasa de los roedores (Vial et al., 2011). Sin embargo, durante este estudio no se exploraron las relaciones entre las variables del clima y los roedores.
No se encontraron diferencias significativas en la estructura de edades, los roedores adultos fueron los individuos más capturados en todas las especies, independientemente del sitio. En correspondencia, Bueno et al. (2012) no detectaron efectos del pastoreo sobre la estructura de edades. Por su parte, Smith y Smith (2007) establecen que los organismos de vida corta, como los roedores, generalmente presentan una breve estancia en clases de edad prereproductivas, lo que podría explicar la detección de bajas proporciones de roedores juveniles y subadultos. De la misma forma, otros autores afirman haber encontrado un mayor número de roedores adultos que de juveniles en áreas sin pastoreo (Bueno et al., 2012; Canul-Cruz et al., 2012; González-Christen et al., 2012). Debido a lo anterior, resulta poco preciso el comparar las estructuras de edades, sin un monitoreo de la dinámica de las cohortes, para la determinación de los efectos del pastoreo (Li et al., 2016).
Por otro lado, en cuanto a la proporción de sexos, las hembras de D. phillipsii fueron significativamente más capturadas en el PP, mientras que la proporción de sexos en el PA y el PR tendió a 1:1, al igual que para P. maniculatus. Bueno et al. (2012) registraron una mayor proporción de hembras en general, tendencia que incrementó en el sitio con pastoreo. En contraste, Li et al. (2016) reportan una variación de esta proporción, en donde los machos del roedor asiático Lasiopodomys brandtii fueron los más favorecidos a causa de un pastoreo moderado. Estas variaciones en la proporción de sexos pueden representar una estrategia adaptativa para la regulación de la estructura social o el crecimiento poblacional en respuesta a los cambios en los recursos ocasionados por el pastoreo (Li et al., 2016). En este caso particular, el incremento en la proporción de hembras podría favorecer el crecimiento de las poblaciones de D. phillipsii y P. maniculatus en el PP.
La altura de las plantas fue diferente entre los sitios, siendo significativamente menor en el sitio con presencia de pastoreo, lo que afectó la estructura vertical del mismo, lo cual concuerda con otros estudios (Bakker et al., 2009; Davisdson et al., 2010; Evans et al., 2015; Li et al., 2016). De igual forma, la riqueza de especies vegetales fue mayor en los sitios cercados (19 y 14 especies) y menor en el pastoreado (10 especies), lo cual corresponde con lo reportado por Arévalo et al. (2007), Bermejo et al. (2012) y Mancilla-Leytón et al. (2013). Particularmente, D. phillipsii fue la especie favorecida por el pastoreo debido a que esta especie prefiere hábitats con pastos cortos (Jones y Genoways, 1975, Riojas-López, 2012). Así mismo, los cambios observados en las poblaciones residentes de roedores, como resultado de las actividades del ganado en el PP, pudieron tener un impacto sobre la dispersión y germinación de semillas (Bich et al., 1995). En este sentido, D. phillipsii al ser la especie más recurrente en el sitio pastoreado, pudo mejorar las condiciones de la cobertura vegetal en dicho sitio debido a su importante papel como dispersor de semillas (Oliva, 2005).
Por otra parte, los resultados del análisis de co-inercia sugieren que las combinaciones de especies vegetales y su abundancia en cada sitio, al reflejar una variedad en su estructura, son de importancia para mantener la composición de roedores hallada. Por lo tanto, los efectos que el pastoreo tuvo sobre la vegetación afectaron indirectamente a la comunidad de roedores, a través de su hábitat. Diversos autores mencionan que incluso cambios menores en la composición y la altura de la vegetación pueden modificar la composición de las comunidades de roedores (Heroldová et al., 2007; Holland y Bennett, 2009; Moro y Gadal, 2007).
El PR y el PP presentaron la menor variabilidad en la riqueza y abundancia de roedores y plantas, lo que sugiere una mayor similitud entre estos sitios. Lo anterior probablemente debido al corto periodo sin pastoreo que presenta PR (Evans et al., 2015; Fernández-Lugo et al., 2013; Frank et al., 2013; Johnson y Horn, 2008; Randriamalala et al., 2016; Vial et al., 2011). Valone y Sauter (2005) mencionan que son necesarios más de 20 años para observar un cambio significativo en la cobertura de pastos posterior a la eliminación de pastoreo, dado que es el tiempo requerido para que los suelos pisoteados reestablezcan la estructura microtopográfica que facilite el establecimiento de plántulas, aunque no en todos los ambientes esta recuperación ocurre de la misma manera (Saetnan y Skarpe, 2006). En el caso del presente estudio, en el PA se realizó posterior a 15 años sin prácticas de pastoreo, lo cual pudo representar una ventaja para la detección de estos efectos, a diferencia del PR con solo 5 años de protección al pastoreo, donde los efectos fueron poco notables.
El pastoreo tuvo efectos diferentes a nivel de las especies de roedores, así como de acuerdo al tiempo sin pastoreo en los sitios. La abundancia de D. phillipsii fue favorecida por el pastoreo, sin embargo las fluctuaciones así como los picos de la abundancia de esta especie a lo largo del ciclo de muestreo disminuyeron. El pastoreo no afectó la riqueza de especies, el peso y la estructura de edades de los roedores. Sin embargo, la contribución de biomasa de roedores fue mayor cuando el tiempo sin pastoreo fue más prolongado. En presencia de pastoreo las hembras de D. phillipsii fueron más concurrentes y la composición de la comunidad fue modificada. Por otro lado, la riqueza de especies de plantas así como su altura fueron afectadas negativamente por el pastoreo, mientras que la cobertura vegetal se mantuvo relativamente constante en sitios con y sin pastoreo.
El estudio de otras variables como la intensidad de pastoreo a la que los hábitats están siendo sometidos, ayudaría a determinar de una manera más fiable si una respuesta observada es consecuencia de un pastoreo intenso o ligero. Así mismo, exploraciones hacia las redes tróficas mayores o diferentes grupos a la vez, podrían contribuir a entender los efectos en cascada de esta actividad antropogénica sobre la dinámica de las comunidades, ecosistemas y la biodiversidad. Es recomendable realizar estudios que tomen en cuenta las variables climáticas y el mosaico del paisaje con un grado de heterogeneidad variable, que reflejen escenarios más realistas del mundo real. De igual manera, se recomienda promover el manejo apropiado de los sistemas de pastoreo, incluyendo actividades de rotación del pastoreo, bajas intensidades del mismo, es decir hatos ganaderos con densidades pequeñas, así como el cese radical de las actividades en periodos del crecimiento vegetal, con el objetivo de reducir las presiones sobre la vegetación, incrementar el secuestro de carbono y contribuir a la preservación de roedores y sus depredadores asociados.











 text new page (beta)
text new page (beta)


