Introducción
Las selvas tropicales secas (STS) de México son ecosistemas con dominancia de árboles de baja altura cuyas copas forman un dosel más o menos continuo. Se desarrollan en sitios que experimentan una severa y prolongada sequía estacional que puede durar hasta 8 meses (con precipitación media anual de 800 mm), por lo que lucen verdes y exuberantes durante la época de lluvias y aparentemente muertas durante el estiaje (Challenger y Soberón, 2008; Miranda y Hernández-Xolocotzi, 1963; Rzedowski, 1978; Trejo, 2010). Constituyen ecosistemas muy importantes, no sólo por su alta diversidad específica y el área extensa que cubren -particularmente, en la costa del Pacífico de México las STS ocupan una banda casi continua desde el sur de Sonora hasta Chiapas-, sino también por la gama de adaptaciones fisiológicas y ecológicas que permiten a la flora y fauna persistir en un ambiente con una estacionalidad extrema (Vega-Rivera et al., 2010). Además, poseen un elevado nivel de endemismos con cerca del 60% de las especies de plantas vasculares y alrededor de 30% de los vertebrados que las habitan (Ceballos y García, 1995; Ceballos y Valenzuela, 2010; Challenger, 1998; Lott y Atkinson, 2010).
A pesar de que se reconoce la importancia de las selvas secas, la información disponible sobre la biodiversidad que albergan es todavía limitada, no obstante que son reconocidos como los ecosistemas tropicales menos entendidos y más amenazados (Janzen, 1988; Pennington et al., 2000; Sánchez-Azofeifa et al., 2005). En México, su superficie original se ha reducido en cerca del 70% por las actividades forestales, desarrollo de la agricultura y ganadería, así como por los asentamientos humanos, la minería, la construcción de presas, caminos, líneas eléctricas, etc. que todavía ocasionan una tasa alta de deforestación anual de 2% (Ceballos, Cantú et al., 2010; García, 2006; Maass et al., 2010; Trejo y Dirzo, 2000). Con respecto a las tierras bajas del Pacífico, si bien las selvas secas ahí representan una de las áreas más extensas y mejor conservadas en el país, y quizá en toda Mesoamérica, regional y localmente han experimentado grandes alteraciones en tres cuartas partes de la superficie de su distribución original (Ceballos, García et al., 2010). A pesar de lo anterior, se sabe que de la cobertura total de este tipo de vegetación en dicha franja desde el sur de Sonora hasta Chiapas (12,113,985 ha), solo el 5.7% está incorporado en áreas naturales protegidas (Ceballos, Cantú et al., 2010), y aún en éstas los decretos no siempre están acompañados por un manejo efectivo.
Con respecto a las aves que habitan la STS, la información sobre ellas es todavía insuficiente. Se sabe que el occidente de México (desde Sonora hasta Chiapas), además de poseer una riqueza elevada de especies y una muy alta proporción de especies endémicas respecto a la riqueza total (Navarro-Sigüenza et al., 2014), constituye también una región importante para especies migratorias de larga distancia (Hutto, 1992). De acuerdo con este último autor, aproximadamente 42% de las especies de aves en esta región son residentes de invierno cuyas áreas de reproducción están localizadas exclusivamente en el oeste de Estados Unidos y Canadá. Sin embargo, es difícil estimar el número de especies de aves que habitan en las STS de la franja costera del Pacífico mexicano, ya que esta entra en contacto y se mezcla con otras comunidades vegetales, y en muchas regiones y sitios incluso se carece de inventarios de la avifauna y se conoce muy poco sobre la biología y distribución de la mayoría de las especies (Vega-Rivera et al., 2010). Así, es necesario realizar estudios sobre la avifauna de la STS para entender los patrones locales y regionales de biodiversidad, y con ello implementar programas de manejo y de conservación más apropiados.
En el presente estudio, se documenta la avifauna que habita en la STS de la comunidad rural La Guásima (LG) en el sur de Sinaloa. Esta comunidad ha sufrido un fuerte impacto por las actividades forestales de la industria mueblera regional desarrollada en la década de 1970, la tala de árboles para sostener la actividad minera, la agricultura itinerante de roza-tumba-quema y la ganadería extensiva. Pese a ello, todavía conserva su cobertura de STS en relativo buen estado de conservación y sostiene una diversidad de especies de plantas y vertebrados tan importante (Guido-Sánchez et al., 2005), que la Comisión Nacional de Áreas Naturales Protegidas (Conanp) la declaró a partir del 2005, como Región Prioritaria para la Conservación (RPC).
De esta manera, se ofrece un listado completo de las aves de LG que, además de las especies asociadas a la STS, incluye aquellas avistadas durante numerosos recorridos exploratorios en todos los hábitats entre 2003 y 2015. Además, se detalla información sobre la estacionalidad, tipos de endemismo y estatus de riesgo de las especies de acuerdo a las normas oficiales nacionales e internacionales. Adicionalmente, se amplía la información sobre algunas especies accidentales, amenazadas y en peligro de extinción, con el objetivo de aportar elementos que fortalezcan los programas de manejo y conservación de esta RPC.
Materiales y métodos
La comunidad de LG se localiza en el municipio de Concordia, en el sur del estado de Sinaloa, en la vertiente del Pacífico de la sierra Madre Occidental. Su predio, con una superficie de 7,880 ha, queda comprendido entre las siguientes coordenadas extremas: 23º25’8.07” N, 106º01’1.23” O al norte, 23º18’4.73” N, 105º57’38.86” O al sur, 23º19’54.22” N, 105º55’2.24” O al este y 23º23’45.94” N, 106º01’27.25” O al oeste. La carretera federal MEX 40 y la autopista MEX-40D que conectan a Mazatlán con Durango, atraviesan LG en dirección suroeste-noreste. El gradiente altitudinal del predio abarca desde los 200 m snm , en la zona suroeste (El Zapotillo), hasta los 915 m snm en la zona norte (Guido-Sánchez et al., 2006; Van Devender et al., 2012) (Fig. 1).
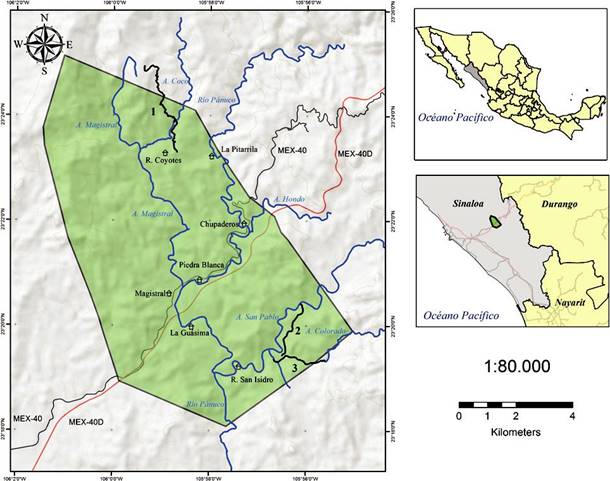
Figure 1 Mapa de la comunidad de La Guásima, Concordia, sur de Sinaloa, México. Poblados y Ranchos: San Isidro y Coyotes ( ); río Pánuco y tributarios más importantes (color azul); carreteras federales Mazatlán-Durango, libre (MEX-40, color café) y autopista (MEX-40D, color rojo); transectos 1-3 (líneas negras).
); río Pánuco y tributarios más importantes (color azul); carreteras federales Mazatlán-Durango, libre (MEX-40, color café) y autopista (MEX-40D, color rojo); transectos 1-3 (líneas negras).
El paisaje consiste en lomeríos y cerros más altos, entre ellos El Pirame, uno de los cerros más representativos de LG, dejando escasas superficies de terreno plano. En todo el predio hay presencia de numerosas quebradas sombreadas que conservan agua en pequeñas pozas de manera permanente pero aislada y permiten el desarrollo de una vegetación densa que mantiene cierto verdor aun en las épocas más secas del año (Guido-Sánchez et al., 2006; Van Devender et al., 2012).
El clima de LG es cálido subhúmedo con temperaturas medias anuales entre 24 °C y 26 °C y precipitaciones medias anuales entre 1,000 mm y 1,200 mm (Inegi, 2016). Las lluvias se presentan principalmente desde finales de junio a principios de octubre (monzón mexicano) alimentando a numerosos arroyos temporales que vierten sus aguas en el río Pánuco que cruza LG de norte a sur (Fig. 1), cuyo caudal se reduce drásticamente hacia el final de la época de estiaje cuando puede llegar a ser nulo (Guido-Sánchez et al., 2006).
La vegetación predominante es la selva tropical seca (STS) de tipo caducifolio y seguida de bosques de Quercus, pastizales naturales, pastizales cultivados y una pequeña área menor a 1 ha de Pinus oocarpa en la Mesa del Cerro El Pirame a los 800 m snm (Guido-Sánchez et al., 2006; Van Devender et al., 2012).
Entre 2003 y 2015 se realizaron numerosos recorridos exploratorios de avistamiento de aves en LG, cubriendo todos los hábitats en las 4 estaciones climáticas del año, tanto de día como de noche. Con el fin de documentar con mayor precisión la presencia, abundancia relativa y residencia de las aves asociadas a la STS, se realizaron conteos mensuales de todas las aves avistadas entre febrero de 2009 y enero de 2010, en 3 transectos diferentes (T1: desde el rancho Coyotes a la falda del cerro El Pirame, 4.9 km, 23°23’17.7” N, 105°58’40.9 ” O, 400-724 m snm; T2: desde el arroyo San Pablo al rancho San Isidro, 2.1 km, 23°20’24.9” N, 105°56’7.8” O, 200-226 m snm; T3: siguiendo el arroyo Colorado, desde el paso de Don Gelo al corral del Tiocintal, 2.1 km, 23°19’23” N, 105°56’40” O, 200-249 m snm) (Fig. 1).
Una primera visita de conteo en enero de 2009 sólo sirvió de ensayo para calcular tiempos de recorrido y afinar aspectos metodológicos y logísticos, por lo que los datos obtenidos fueron excluidos de los análisis cuantitativos. En su conjunto, los 3 transectos estudiados fueron considerados como representativos de la STS en condiciones cercanas a lo natural, pues aunque la vegetación ha sufrido alteraciones por las actividades humanas en décadas pasadas, desde el año 2004 no ha habido tala de árboles, ni nuevos desmontes (Guido-Sánchez et al., 2010). Por otra parte, el tránsito de personas es casi nulo debido a que los transectos se establecieron en caminos rurales secundarios de difícil acceso que se encuentran lejos de los poblados. Los transectos fueron de diferente longitud y gradiente altitudinal (Fig. 1), con la intención de abarcar la mayor variabilidad de condiciones ecológicas así como de estructura de la vegetación y de biodiversidad dentro de la STS. Además de todos los tipos de STS (selva baja a mediana caducifolia y selva mediana subcaducifolia) y las diferentes asociaciones florísticas dentro de la misma, conocidas localmente según la especie dominante como brasilar-ebanal (Haematoxylum brasiletto-Chloroleucon mangense), capomal (Brosimum alicastrum), cardonal (Pachycereus pecten-aboriginum), habal (Hura polyandra), hizal (Sapium sp.), huanacastal (Enterolobium cyclocarpum), mautal (Lysiloma divaricatum, Mariosousa russelliana), etc., en los 3 transectos se presentan parches de bosque de Quercus intercalados entre la STS.
Los recorridos se realizaron a pie a una velocidad promedio de 1.0 km/h, desde las 07:00 hasta las 10:00 h a más tardar. Paulatinamente se fueron registrando mediante una mini grabadora SONY ICD-P520, el número de individuos de cada especie avistada, con el fin de conocer su conducta social predominante (solitaria, por pares o en parvada; no se realizaron registros de las parvadas mixtas), además de la hora de avistamiento.
Los avistamientos se llevaron a cabo con binoculares (10 × 40) y para la identificación de las especies se utilizaron las guías ilustradas de Howell y Webb (1995), Dunn y Alderfer (2006), Clark y Wheeler (2001) y Sibley (2000). Ocasionalmente, algunos cantos de aves se cotejaron con las grabaciones proporcionadas por Boesman (2006). La distancia máxima desde el sendero para lograr observar las aves fue de 35 m al final de la época de estiaje cuando el follaje y el sotobosque estaban en su desarrollo mínimo. En el resto del año, dicha distancia se reducía a 20-25 m. En casos excepcionales se tomaron fotos con una cámara digital NIKON D-300 con lente telefoto SIGMA DG 150-500 mm, para posteriormente realizar la determinación específica de manera confiable. No se realizaron muestreos en días con lluvia.
A las especies avistadas durante los muestreos realizados en la STS en el ciclo anual 2009-2010, se sumaron los avistamientos no sistemáticos realizados durante los numerosos recorridos exploratorios en los años 2003-2015. Aunque no fue registrada por los autores, la especie Megaceryle torquata fue incorporada en la lista debido a que fue observada en LG por Medina-Macías et al. (2010). El listado se organizó taxonómicamente de acuerdo al Checklist of North and Middle American Birds (AOU, 2016), que también sirvió de fuente para los nombres comunes en inglés. Los nombres comunes en español fueron tomados de Berlanga et al. (2015).
La determinación del tipo de endemismo (sensu stricto, cuasi- y semiendémico) de las especies se realizó siguiendo a González-García y Gómez de Silva-Garza (2003), Howell y Webb (1995) y Dunn y Alderfer (2006). Para las categorías de riesgo en las que se ubican las especies a nivel nacional e internacional se consultaron los documentos Semarnat (2010), UICN (2016) y CITES (2016).
Con base en el ciclo anual de muestreo e información disponible en Howell y Webb (1995), se determinó el tipo de residencia de las especies de aves en LG como se describe a continuación. Residentes permanentes (R) son aquellas especies que anidan y permanecen en LG durante todo el año. Algunas especies que a pesar de tener una distribución amplia en el sur de Sinaloa solo se desplazan hacia LG en números pequeños para alimentarse (Ra) o para reproducirse en los meses de abril a agosto (Rr). Los visitantes de invierno que realizan desplazamientos latitudinales considerables desde áreas lejanas no contiguas a la vertiente del Pacífico a la altura del sur de Sinaloa (Vi), o descienden de lugares fríos aledaños y se comportan como migrantes altitudinales o verticales (Vi*). Los visitantes de verano (Vv) se dirigen a LG en los meses de abril a agosto con fines de reproducción. Transitorio (T) son aquellas especies que sólo se presentan en la Comunidad durante sus migraciones de primavera u otoño, y visitantes accidentales (Acc) o vagabundos son aquellas pocas especies para las que LG se encuentra totalmente fuera de su área normal de distribución.
Para el análisis de los datos obtenidos de las aves asociadas a los 3 transectos en STS, sólo se consideraron aquellos individuos que se encontraban dentro de la selva y los pequeños parches intercalados de bosque de Quercus, pero excluyendo a los que sobrevolaban muy alto o dirigían su vuelo hacia otras direcciones o cuyo canto se escuchaba de lejos, fuera del ámbito del transecto. Considerando la gran similitud entre las especies Empidonax difficilis y E. occidentalis, se prefirió seguir el consejo de Kaufman (2011) en no tratar de distinguir entre ellas en campo y anotarlas como “complejo” Empidonax difficilis. Sin embargo, para los aspectos cualitativos de este estudio si fueron consideradas como especies válidas; de acuerdo a aVerAves (2013) y Berlanga et al. (2008), ambas especies se encuentran en Sinaloa y Medina-Macías et al. (2010) las reportaron para LG.
Para conocer la contribución de cada especie a la comunidad de aves en términos de abundancia relativa (número de aves/km recorrido) por estación climática y por año, se siguió a Ferguson (2004). Por ello, se dividió el número total de individuos observados por especie entre la distancia muestreada por estación climática (27.3 km) y por año (109.2 km) [cabe aclarar que se consideró a los meses de enero a marzo como época de invierno, de abril a junio como primavera, de julio a septiembre como verano (coincidiendo con los meses de mayor precipitación) y de octubre a diciembre como otoño]. Se definieron las siguientes categorías en número de aves/km: dominante (D ≥ 2), muy abundante (MA 1-1.99), abundante (A ≥ 0.2-0.99), poco abundante (PA ≥ 0.05-0.19) y rara (R ≥ 0.01-0.049).
Además, a cada especie se le adjudicó una categoría de tamaño de grupo o parvada correspondiente a la conducta social que exhibió con más frecuencia durante el año de muestreo (generalmente en ≥ 50% de los avistamientos): solitaria, en pares, o parvada o sea ≥ 3 individuos. Cabe aclarar que de las 141 especies asociadas a la STS, un total de 28 fueron excluidas de esta categorización debido a que fueron avistadas en una sólo ocasión con un máximo de 4 individuos (Thiollay y Jullien, 1998).
Para evaluar el esfuerzo de observación y registro de especies a lo largo de los 12 meses de estudio y por cada estación climática, se realizaron curvas de acumulación de especies registradas mensualmente. Se utilizó el modelo de Clench (1979) mediante el programa Statistica 7.1 (StatSoft, 2005), considerando un remuestreo con 1,000 repeticiones usando el programa EstimateS Versión 8.0 (Colwell, 2006). La predicción de la riqueza se realizó en función de los parámetros a y b de la ecuación de la curva (Castillo-Guerrero et al., 2009; Jiménez-Valverde y Hortal, 2003).
Resultados
La Guásima alberga un total de 253 especies de aves, pertenecientes a 20 órdenes y 50 familias. De estas familias, 6 contienen más de 10 especies, los Tyrannidae (27), Parulidae (22), Accipitridae (16), Trochilidae (16), Emberizidae (15) y Cardinalidae (14) (Apéndice).
La mayoría de las especies (52.6%) fueron residentes de distribución amplia en el sur de Sinaloa [133 spp.: R (109 spp.), Ra (20 spp.) y Rr (4 spp.)]. Una gran proporción (43.5%) son visitantes de invierno [110 spp.: Vi (60 spp.) y Vi* (50 spp.)], y unas cuantas visitantes de verano (1.6%, 4 spp.), transeúntes (1.6%, 4 spp.), y solo 2 visitantes accidentales o vagabundas (0.8%), el Maullador gris, Dumetella carolinensis y Chipe ala azul, Vermivora cyanoptera (Fig. 2, Apéndice).
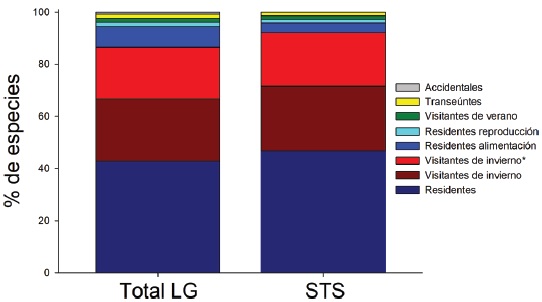
Figure 2 Composición de la avifauna por tipos de residencia en la Comunidad de La Guásima, Concordia, Sinaloa. Se comparan las aves registradas en todo el polígono de la Comunidad entre 2003 y 2015 con las aves registradas en la STS en los 3 transectos, entre febrero de 2009 y enero de 2010.
Del total de las especies registradas, 58 (22.9%) presentan algún tipo de endemismo: 25 especies (9.9%) son endémicas estrictas o sea son exclusivas de México, 9 (3,6%) son cuasiendémicas y 24 (9.5%) son semiendémicas. De acuerdo a la NOM-059-SEMARNAT-2010 (Semarnat, 2010), 34 especies (13.4%) están en riesgo en las siguientes 3 categorías: 5 (2.0%) en peligro de extinción (Buteogallus solitarius, Ara militaris, Amazona finschi, Vireo atricapilla y Cyanocorax beecheii), 5 (2.0%) amenazadas (Penelope purpurascens, Geranospiza caerulescens, Aquila chrysaetos, Tilmatura dupontii y Geothlypis tolmiei) y 24 (9.5%) sujetas a protección especial. De acuerdo a la UICN (2016), todas las especies están ubicadas en la categoría de preocupación menor (LC = Least Concern) con excepción de 6, de las cuales 3 se consideran vulnerables (VU; Ara militaris, Amazona finschi, Vireo atricapilla) y 3 casi amenazadas (NT = Near Threatened; Egretta rufescens, Buteogallus solitarius y Vireo bellii). Un total de 50 especies (19.8%) están incluidas en CITES (2016), 3 (1.2%) en el apéndice I (Falco peregrinus, Ara militaris y Amazona finschi) y 47 (18.6%) en el II (Apéndice).
Solo 141 especies (55.7%) del total registrado en LG se observaron en los 12 meses de muestreo sistemático en la STS, pertenecientes a 17 órdenes y 35 familias. De estas familias, solamente 4 contienen 10 ó más especies, los Tyrannidae (21), Parulidae (16), Trochilidae (10) y Cardinalidae (10) (Apéndice).
El 51.8% de las especies fueron residentes de distribución amplia en la región [73 spp.: R (66 spp.), Ra (5 spp.) y Rr (2 spp., el Cuclillo Manglero, Coccyzus minor y el Tordo Ojos Rojos, Molothrus aeneus)]. El 45.4% fueron visitantes de invierno [64 spp.: Vi (35 spp.) y Vi* (29 spp.)], el 1.4% visitantes de verano (2 spp., el Vireo Verdeamarillo, Vireo flavoviridis y el Papamoscas Rayado Común, Myiodynastes luteiventris) y el 1.4% fueron transitorias (2 spp.)]. No se avistaron especies accidentales durante el año de muestreo de la STS. Cabe resaltar que estas 141 especies tuvieron una composición porcentual similar a la descrita anteriormente para el predio de LG en su totalidad (frecuencias observadas vs. esperadas de acuerdo a la prueba de heterogeneidad chi-cuadrada: 5.986, df = 7, p = 0.54) (Fig. 2, Apéndice).
La riqueza de especies en la STS fue alta entre octubre y marzo, con un mínimo de 71 especies en noviembre, febrero y marzo, y un máximo de 82 especies en diciembre. A partir de marzo la riqueza específica decreció notablemente, hasta un mínimo de 39 en el mes de julio, para posteriormente incrementarse y alcanzar niveles altos a partir de octubre, principalmente debido al arribo de especies migratorias de invierno (Fig. 3A).
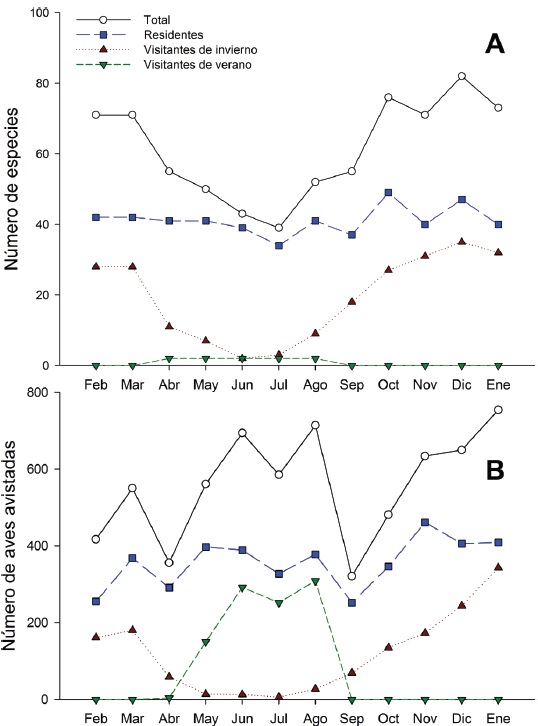
Figure 3 Variación mensual de la riqueza específica (A) y de la abundancia (número de individuos observados) de la avifauna (B), por tipo de residencia en la STS de la Comunidad de La Guásima, Concordia, Sinaloa. Aves residentes (R, incluye Ra y Rr; ■), visitantes de invierno (Vi, incluye Vi*; ▲), visitantes de verano (Vv; ▼), riqueza y abundancia total mensual ○).
El total de aves observadas fue mayor entre junio y agosto -contrariamente a lo que ocurre con la riqueza específica- y de noviembre a enero; en este último se avistó el máximo anual de 755 individuos. El mes de menor abundancia fue septiembre cuando solamente se avistaron 326 individuos (Fig. 3B). Las elevadas abundancias de junio a agosto coinciden con la presencia de los visitantes de verano Myiodynastes luteiventris y en particular de la omnipresente especie Vireo flavoviridis, mientras que de noviembre a enero se deben a la presencia de un gran número de especies migratorias de invierno.
Al agrupar por estación climática, durante otoño hubo el mayor número de especies (104, octubre - diciembre), seguido por invierno (100, enero - marzo) y primavera (76, abril - junio), mientras que la menor riqueza se registró en la época de lluvias o sea en verano (73, julio - septiembre) (Fig. 3). El número de aves observado tuvo el mismo patrón que la riqueza, los valores mayores se observaron durante otoño e invierno, con 1,765 y 1,722 individuos respectivamente, con una abundancia ligeramente menor en primavera y verano, con 1,611 y 1,625 individuos respectivamente.
Al considerar el esfuerzo de muestreo y estimar la riqueza en función de los parámetros de la ecuación de Clench (1979) por estación, se predijo que entre 17 y 19 especies (14.5% y 19.1%) permanecieron sin detección (7.8% del total), sin embargo no se modificó el patrón estacional (Tabla 1).
Tabla1. Parámetros de la estimación de riqueza de especies mediante la curva tipo Clench (Riqueza de especies = (a)*Núm. de transectos/ 1+(b)*Núm. de transectos). Se muestra la predicción de la riqueza de especies y el número de especies observadas en las diferentes estaciones.
| Estación | n | R 2 | a | b | Riqueza predicha | Riqueza observada (% de la predicha) |
|---|---|---|---|---|---|---|
| Primavera | 9 | 0.99 | 38.59 | 0.41 | 94 | 76 (80.9) |
| Verano | 9 | 0.99 | 40.13 | 0.44 | 90 | 73 (81.1) |
| Otoño | 9 | 0.99 | 66.32 | 0.53 | 123 | 104 (84.6) |
| Invierno | 9 | 0.99 | 70.81 | 0.60 | 117 | 100 (85.5) |
| Total | 36 | 0.98 | 35.52 | 0.23 | 153 | 141 (92.2) |
La riqueza y abundancia de especies residentes (34-49 y 255-461, respectivamente) fue relativamente estable a lo largo del año, comparada con la de los visitantes de invierno y de verano (Fig. 3). Entre octubre y marzo, los visitantes de invierno tuvieron una presencia muy importante, con un mínimo de 27 especies en octubre y un máximo de 35 en diciembre; después de marzo el número de especies disminuyó drásticamente hasta un mínimo de 2 en el mes de junio, manteniendo valores bajos que comienzan a incrementarse paulatinamente a partir de agosto (Fig. 3A). La abundancia de los visitantes de invierno mostró un patrón similar: de octubre a marzo la abundancia fue alta con un mínimo de 161 individuos en febrero y un máximo de 343 en enero; después de marzo el número de individuos disminuyó paulatinamente a 13 en el mes de junio y 6 en julio, para luego aumentar gradualmente de nuevo al máximo de individuos de enero. Aunque solo 2 especies migratorias, Myiodynastes luteiventris y Vireo flavoviridis, visitaron LG entre abril y agosto para reproducirse, su presencia influyó notablemente en la abundancia a partir de mayo cuando se registraron 150 individuos, en contraste con el mes anterior cuando sólo se avistaron 4. A finales de junio, al inicio de la época de lluvias, su abundancia aumentó a 292 individuos, mientras que en julio y agosto alcanzaron los 252 y 309 individuos, respectivamente, para después ausentarse del área de estudio (Fig. 3B, Apéndice).
La mayoría de las 141 especies observadas en el año fueron raras (R: 51, 36.2 %), seguido por las abundantes y poco abundantes con casi el mismo porcentaje (A: 38, 27.0 % y PA: 36, 25.5 %). Pocas especies resultaron ser dominantes y muy abundantes (D y MA: 8, 5.7% para ambas categorías) siendo las dominantes en orden de importancia: Vireo flavoviridis (7.85), Cacicus melanicterus (4.94), Turdus rufopalliatus (3.70), Eupsittula canicularis (3.02), Calocitta colliei (2.94), Thryophylus sinaloa (2.72), Polioptila caerulea (2.44), Icterus pustulatus (2.17) (Fig. 4, escenario anual; Apéndice).
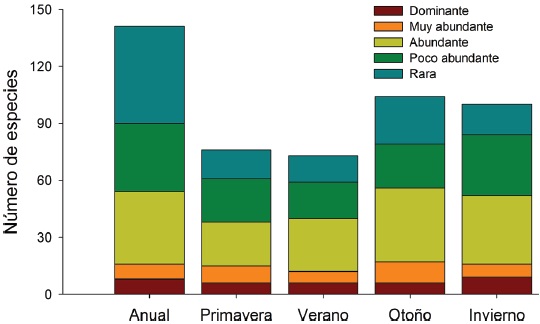
Figure 4 Número de especies anual y estacional por categorías de abundancia relativa, de la avifauna en la STS de La Guásima, Concordia, Sinaloa.
Las especies dominantes fueron residentes permanentes con excepción del visitante de verano Vireo flavoviridis y del visitante de invierno Polioptila caerulea. Solamente 4 de las 8 especies muy abundantes fueron residentes permanentes, 3 visitantes de invierno y una sola especie, Myiodynastes luteiventris visitante de verano (Apéndice).
A lo largo de las 4 estaciones climáticas, la categoría abundante siempre contó con el mayor número de especies (23 a 39) excepto en primavera cuando igualó la categoría poco abundante con 23 especies. Por otro lado, siempre hubo menor número de especies en las categorías dominante y muy abundante (6-11) que en la categoría rara (14-25), mientras que para las categorías abundante y poco abundante fue lo opuesto (19-39), con excepción de otoño cuando hubo mayor número de especies en la categoría rara (25) que en la categoría poco abundante (23) (Fig. 4).
Se obtuvo un total de 3,445 registros de tamaño de grupo para las 113 especies que fueron tomadas en consideración. Un total de 93 especies (82.3%) fueron solitarias a lo largo del año de muestreo, sólo 5 especies (4.4%) se presentaron en pares mientras que 15 especies (13.3%) formaban parvadas de hasta un máximo de 50 individuos (Ptiliogonys cinereus). Entre las especies gregarias sobresalen las siguientes con el tamaño mínimo, máximo y promedio de parvada entre paréntesis: Ptiliogonys cinereus (2-50, 16), Callipepla douglasii (2-14, 8), Cacicus melanicterus (1-40, 7), Vireo flavoviridis (1-25, 6), Calocitta colliei (1-14, 6), Turdus rufopalliatus (1-40, 6), así como las 4 especies de psitácidos avistadas en la STS durante el año de muestreo, Forpus cyanopygius (2-20, 9), Ara militaris (2-18, 7), Eupsittula canicularis (1-25, 6) y Amazona finschi (3-8, 5), y 2 especies de palomas Zenaida asiatica (1-10, 10) y Columbina inca (1-12, 5). Solo para 7 especies fue posible realizar una prueba de comparación de medias para detectar si hubo diferencias significativas en el tamaño de parvada promedio entre la época reproductiva (enero-abril para E. canicularis y abril-agosto para C. colliei, C. melanicterus, C. inca, A. militaris, F. cyanopygius y T. rufopalliatus) y la no reproductiva (el resto del año), mientras que para las demás especies, los datos fueron insuficientes o su presencia ocurrió exclusivamente en la época reproductiva como en el caso de V. flavoviridis. Solo en 2 de las 7 especies, C. colliei y C. melanicterus, hubo diferencias significativas en el tamaño de parvada promedio entre la época reproductiva y el rest o del año (t66 = 3.93, p < 0.001; t113 = 4.58, p < 0.001 respectivamente); en ambos casos el tamaño de parvada disminuyó debido a que en la mayoría de los avistamientos predominaron parejas.
Discusión
La confluencia de las avifaunas neártica y neotropical en la parte media de la costa pacífica mexicana, así como la colindancia con la provincia biótica Sierra Madre Occidental Media (sensuEscalante-Pliego et al., 1998), generan la gran riqueza específica de aves en el estado de Sinaloa, la cual se compone de 487 especies (Berlanga et al., 2008). De estas especies, LG alberga el 51.7% (253 especies) en tan solo 7,880 ha (0.14% de la superficie total del estado), y casi una cuarta parte de todas las especies de aves registradas para el país, que según Berlanga et al. (2015) comprenden 1,108 especies. Por otra parte, si se considera que de las 487 especies presentes en Sinaloa, 200 viven asociadas a la STS de manera permanente o temporal (Guido-Sánchez y van der Heiden, 2009), un muy alto porcentaje de ellas (70.5%, 141 especies) fueron observadas durante los 12 meses de muestreo sistemático de la STS en LG. Considerando lo anterior, el número de especies registradas en LG es alto e indica que el área de estudio es importante para la conservación de la biodiversidad.
A lo largo de la vertiente del Pacífico, la riqueza de especies de la selvas secas tiende a decrecer hacia el sur (Binford, 1989; Vega-Rivera et al., 2010), aunque en áreas puntuales con presencia de STS la riqueza de especies es muy variable, con valores máximos en sitios grandes, bien conservados y colindantes a la costa. Por ejemplo, se han registrado 273 especies en Chamela-Cuixmala, Jalisco (Vega-Rivera, 2012; Vega et al., 2010), 267 en Santa Rosa y 262 en Palo Verde, Costa Rica (Ornelas et al., 1993; Stiles, 1983), y 247 en el oeste de Jalisco (Ramírez-Albores, 2007). Mientras que valores menores han sido registrados en sitios pequeños y/o degradados. Por ejemplo, 113 especies en la cañada del Río Sabino, Oaxaca (Vázquez et al., 2009), 86 en la subcuenca del Río San Juan, Guerrero (Almazán-Núñez y Navarro, 2006) y 71 en una zona fragmentada en Panamá (Lasky y Keitt, 2010). La Guásima, con las 253 especies registradas posee una riqueza alta, comparable con la del primer grupo a pesar de no colindar con el mar, ni poseer hábitats como playas, manglar, esteros, etc. (en Chamela, por ejemplo, el grupo de aves acuáticas incluye 74 especies). En cambio, en LG hay una notable influencia de especies asociadas al sistema montañoso de la sierra Madre Occidental (34, de las cuales 24 son consideradas migrantes altitudinales) que raramente alcanzan la planicie costera (A. M. van der Heiden, datos no publicados).
Quizá el principal condicionante de la presencia de especies a lo largo de la franja de distribución de la STS por el lado del Pacifico, sea el estado de conservación del hábitat (e.g. estructura del paisaje y conectividad, Santamaría-Rivero et al., 2016). En ese sentido, la STS de LG alberga una comunidad de aves con valores de riqueza altos debido a su buen estado de conservación y su colindancia con áreas montañosas de la sierra Madre Occidental.
Se ha indicado que a lo largo de la franja con STS en la vertiente del Pacífico, hay una relativa homogeneidad en la riqueza que se debe en gran parte a que muchas de las especies registradas usan este corredor y tienen distribuciones continuas desde Sonora hasta Panamá (Ornelas et al., 1993). En esta franja la diferencia más notable es que en localidades norteñas, el porcentaje de especies migratorias invernantes es mayor que en localidades sureñas. Por ejemplo, hay 45.4% en LG, en Chamela-Cuixmala 31.1%, mientras que en la depresión central de Chiapas solo el 19.5% de las especies son migratorias y juegan un papel menor en los cambios en la comunidad (Arizmendi et al., 1990; Ramírez-Albores, 2010). La reducción progresiva del porcentaje de aves migratorias a medida que se avanza hacia el sur en el neotrópico, muy probablemente está relacionada con el incremento en la distancia entre los lugares de reproducción y residencia invernal (Hutto, 1992; Terborgh, 1980).
La riqueza y abundancia exhibieron un patrón influenciado notablemente por la presencia de las aves migratorias neotropicales e intertropicales. Las variaciones en la riqueza dependieron principalmente de la llegada de las aves migratorias neotropicales (e.g., Parulidae, Tyrannidae) al occidente de México, donde pueden pasar hasta 9 meses del año (otoño, invierno y primavera) para después migrar a sus sitios de reproducción (Hutto, 1986, 2010). Por otra parte, la mayor cantidad de aves en la STS se observó durante 2 periodos. De diciembre-enero relacionado con la presencia de las especies migratorias neotropicales y durante junio-agosto debido al arribo y estancia de 2 especies de migratorias intratropicales con fines de reproducción (principalmente Vireo flavoviridis), y otras especies que realizan movimientos dentro de la región y solo se encuentran a finales de primavera y durante el verano (e.g. Coccyzus minor). Los patrones de migración de ambos grupos les permiten explotar recursos disponibles estacionalmente para reproducirse durante la época de lluvias (intertropicales) y pasar la época no reproductiva en Centro y Sudamérica (e.g., la cuenca alta del río Amazonas, Morton, 1977). Pero también, para ser usados como sitios de escala y/o invernada posterior a la época de lluvias (migratorias neotropicales; Rohwer et al., 2009; Thompson, 1991). Así, el grupo de migratorias neotropicales tiene gran influencia en el patrón observado de riqueza, mientras que las migratorias intratropicales (con una especie sumamente dominante: Vireo flavoviridis) condicionó el patrón de abundancia durante la época de lluvias a partir de finales de junio.
Dos terceras partes de las especies registradas en nuestro estudio fueron raras y poco abundantes y un porcentaje de aproximadamente 11% fueron dominantes y muy abundantes, coincidiendo con trabajos previos en otras localidades con STS (Ramírez-Albores, 2007, 2010; Ramírez-Albores y Ramírez-Cedillo, 2002; Vázquez et al., 2009). Se ha indicado que este es un patrón generalizado, y en particular en STS se ha recalcado que las especies migratorias neotropicales regularmente se presentan con valores de abundancia de rara a poco común (e.g., Ramírez-Albores 2007, 2010; Ramírez-Albores y Ramírez-Cedillo, 2002; Vázquez et al., 2009). Esto sugiere cierta relación entre los patrones de abundancia y los movimientos estacionales debidos a las fluctuaciones en la disponibilidad de recursos (Arizmendi y Ornelas, 1990).
La formación de grupos o parvadas en especies de aves neotropicales que habitan la STS del noroeste de México ha sido poco estudiada (e.g., la descripción de parvadas mixtas de especies insectívoras, Goodale et al., 2015; Hutto, 1987) y escasamente tratada para algunas especies en guías de campo como Howell y Webb (1995) y Peterson y Chalif (1989). Sin embargo, a partir de investigaciones detalladas del comportamiento social alimenticio de aves en la selva lluviosa de Panamá (Moynihan, 1962) y Guayana Francesa (Jullien y Clobert, 2000; Thiollay, 2003; Thiollay y Jullien, 1998) se desprende que, al igual que en LG, el forrajeo solitario es el comportamiento dominante. Por otra parte, todas las especies de Psittacidae que ocurren tanto en dicha selva lluviosa como en la STS de LG forman parvadas, mientras que todas las especies de Trogonidae, Momotidae, Trochilidae, la mayoría de los Picidae y Tyrannidae tienden a ser solitarias. De esta manera, por primera vez se detalla el tamaño promedio de parvada de las 15 especies que manifiestan este tipo de comportamiento social en la STS de LG.
De acuerdo a Ceballos (1995) y Ceballos y García (1995), las STS del occidente de México no sólo se caracterizan por una diversidad específica alta sino también por su elevado número de endemismos. Para la parte media de la provincia biogeográfica costa del Pacífico subhúmedo, Escalante-Pliego et al. (1998) reportan 20 especies de aves endémicas de México y 33 para la sierra Madre Occidental del Altiplano Mexicano. De todas éstas, LG alberga 25 especies de las cuales 21 se encuentran asociadas a la STS. Por otra parte, las 25 especies endémicas que ocurren en LG representan el 73.8% de la avifauna endémica del estado de Sinaloa (con base en González-García y Gómez de Silva-Garza, 2003) y el 24.5% de las especies endémicas de México (según Berlanga et al., 2015). Estos endemismos, además de las 9 especies cuasi-y 24 semiendémicas y 34 especies que están amparadas por la NOM-059-SEMARNAT-2010, constituyen un reservorio importantísimo para la supervivencia y eventual recuperación de sus poblaciones locales, en particular de las 2 especies de psitácidos que están en peligro de extinción, Ara militaris y Amazona finschi.
En la planicie costera de los estados de Sinaloa y Sonora, ha habido una conversión a gran escala de la STS a agricultura industrial, que se ha indicado como posible causa del decremento poblacional en algunas especies migratorias neotropicales (Carlisle et al., 2009). Aunque se reconoce su importancia, en general, ha habido pocos estudios que describan las comunidades de aves en STS (Ornelas et al., 1993, Santamaría-Rivero et al., 2016) y el conocimiento es aun parcial, esto se ha indicado como una limitante para establecer acciones de conservación efectivas. El presente estudio aporta información básica sobre la comunidad de aves en la STS del sur de Sinaloa y da soporte a la propuesta para incorporar esta área al sistema nacional de áreas naturales protegidas (Semarnat, 2014).
Avistamientos sobresalientes de especies accidentales. El Chipe Alas Azules (Vermivora cyanoptera) fue avistado por George y Winger West y Alwin van der Heiden, el 15 de enero de 2002, en el poblado Piedras Blancas en LG. Se considera una especie vagabunda en la vertiente del Pacífico mexicano, con excepción de los estados de Oaxaca y Chiapas donde es poco común o rara (BirdLife International, 2016; Howell y Webb, 1995). En el noroeste de México solo hay registros previos en Baja California (aVerAves, 2015; Erickson et al., 2001; Howell et al., 2001) y Sinaloa (Berlanga et al., 2008). El presente registro es uno de los pocos para todo el noroeste mexicano y el segundo para el estado de Sinaloa.
El Maullador Gris (Dumetella carolinensis) fue identificado por su característico “canto” y posteriormente avistado en 2 ocasiones por Alwin van der Heiden, el día 28 de diciembre de 2006, en el camino hacia el rancho Coyotes, a aproximadamente 2 km de distancia del entronque con la Carretera Federal MEX 40 Mazatlán-Durango. Es una especie vagabunda para la vertiente del Pacífico mexicano, con excepción de la parte este de Oaxaca y Chiapas donde es poco común (BirdLife International, 2016; Howell y Webb, 1995). En el noroeste de México ha sido reportado en Baja California Norte (Palacios y Alfaro, 1992) y Nayarit (Phillips, 1986). En aVerAves (2015) hay registros para Baja California Norte (Punta Banda y La Salina), Baja California Sur (bahía Asunción, Guerrero Negro y rancho Santa Mónica), Sonora (cerca de la desembocadura del río Colorado y en el río Cuchijaqui), Nayarit (cerro de San Juan, San Blas y los alrededores de Nuevo Vallarta) y Jalisco (Puerto Vallarta). Para Sinaloa solo hubo avistamientos recientes en el Santuario de la Chara Pinta El Palmito y en los alrededores de Mazatlán (aVerAves, 2015).
El Vireo Gorra Negra (Vireo atricapilla) es una especie semiendémica, catalogada como en peligro de extinción (Semarnat, 2010) y vulnerable por la UICN (BirdLife International, 2016) (Apéndice). Durante este estudio, de noviembre a enero, se observaron 10 individuos (incluyendo 3 parejas). Estos avistamientos concuerdan con lo observado por González-Medina et al. (2009) que indican que durante su invernación esta especie se encuentra asociada a la selva tropical caducifolia con una tendencia a preferir las áreas con buena cobertura termal donde se almacena humedad y cercana a fuentes de agua dulce.
El Loro Corona Lila (Amazona finschi) es endémico de la vertiente del Pacífico mexicano, desde el sur de Sonora y suroeste de Chihuahua al sureste de Oaxaca (Howell y Webb, 1995). Está catalogada como en peligro de extinción (Semarnat, 2010) y en peligro por la UICN (BirdLife International, 2016) y además, como todas las especies mexicanas de psitácidos, está protegida por el artículo 60 bis 2 de la Ley General de Vida Silvestre (Semarnat, 2008). Renton e Íñigo-Elías (2003) estimaron que la población mundial solo alcanza los 7,000-10,000 individuos. Además, ya hay poblaciones o grupos ferales en varias ciudades y sus alrededores en México (México, D.F., Monterrey, Torreón, Saltillo, entre otras) así como en el sur de los EUA (desde Los Angeles hasta San Diego en el sur del estado de California y en Brownsville y El Paso, Texas) (Renton e Íñigo-Elías, 2003; aVerAves, 2016). El Loro Corona Lila fue poco común durante primavera y común en otoño pero estuvo ausente de LG durante la época de lluvias y en el invierno (Apéndice). En LG su observación en parvadas de tamaño variable es relativamente común, con avistamientos de números importantes en sitios y fechas específicos. Por ejemplo, Alwin van der Heiden observó a 80 individuos comiendo vainas en un árbol, cerca de RSI, el día 21 de enero de 2013, mientras que el día siguiente, media hora antes de oscurecer, observó a pequeños grupos dispersos por el área acercándose al cerro de la Chilacayota cercano a RSI para dormir, la mayoría provenientes de RSI y el arroyo San Pablo. En esta ocasión se formó una congregación de alrededor de 500 individuos en un solo árbol en el lado oeste de este cerro (Fig. 5; soló en esta fotografía se contaron 206 individuos de esta especie).

Figure 5 Agrupación, poco antes de oscurecer, de aproximadamente 500 individuos de Amazona finschi, en un solo árbol en el Cerro de la Chilacayota, Ejido El Habal, desplazándose desde La Guásima, el 22 de enero de 2013 (en esta fotografía, tomada por A.A.K. van der Heiden, se pueden observar 206 individuos).
La Guacamaya Verde (Ara militaris) a nivel nacional (Semarnat, 2010) e internacional (BirdLife International, 2016) se encuentra en peligro de extinción y vulnerable, respectivamente, mientras que la CITES (2016) la ubica en el apéndice I. La Guacamaya Verde fue abundante en primavera, otoño e invierno pero no fue avistada en los transectos durante la época de lluvias (apéndice). En LG, la especie vive estrechamente asociada a la selva seca y se desplaza en ella conforme maduren y estén disponibles los frutos, semillas y/o vainas de varias especies de árboles como el haba (Hura polyandra), el algodoncillo (Luehea candida) y la chalata (Ficus trigonata) entre otras. Es común observar grupos de varios individuos (máximo observado 60 individuos comiendo semillas de algodoncillo, 16 y 17 de febrero de 2007). En cuanto a su anidación, se constató la presencia de 2 parejas de Guacamayas verde en el peñón del cerro El Pirame en el mes de mayo de 2010, donde posiblemente anidan en la pared vertical sur del mismo. En la parte norte de la comunidad, cada año anida una pareja en un árbol de huanacaxtle (Enterolobium cyclocarpum) de aproximadamente 34 m de alto y un tronco de 5.5 m de perímetro a la altura del pecho (23°23’42”N, 106°00’25”O, 380 m snm). Cabe señalar que la presencia de Ara militaris en LG es notoria si se compara con su situación en la región de Chamela (incluyendo la RBBC) y en la APFF-MC (Arizmendi et al., 1990; Guido-Sánchez et al., 2006; Vega-Rivera, 2012). De acuerdo a Vega Rivera (com. pers., agosto 30, 2015), hay reportes históricos de la presencia de la especie en las selvas medianas de Chamela, sin embargo por lo menos desde 1998 no se han avistado individuos. Por otra parte, González-Bernal afirma (com. pers. sept. 5, 2015) que se han avistado pequeños grupos de hasta 18 guacamayas en el Área de Protección de Flora y Fauna Meseta de Cacaxtla, Sinaloa, que se desplazan desde las zonas boscosas serranas fuera del ANP donde duermen, hacía la meseta para alimentarse.
El Águila Solitaria (Buteogallus solitarius) está catalogada como en peligro de extinción (Semarnat, 2010) y casi amenazada por la UICN (BirdLife International, 2016). De acuerdo con Howell y Webb (1995) es una especie rara y poco conocida que habita áreas de montaña y sus estribaciones. BirdLife International (2016) estima que solamente existen alrededor de 1,000 a 2,500 individuos maduros equivalente a 1,500 a 4,000 individuos en total. Está águila fue observada en solo 2 ocasiones, en el sur de LG, sobrevolando los cerros cercanos al rancho San Isidro (cerro de los Chivos y cerro de la Chilacayota) el 16 de enero de 2008 y 4 de febrero de 2009. Sonoran Joint Venture (2003), Lepage (2016) y Berlanga et al. (2008) la reportan para Sinaloa.
La Chara Sinaloense (Cyanocorax beecheii, Purplish-backed Jay) es una especie endémica de la vertiente del Pacífico mexicano, desde el sur de Sonora a Nayarit (Howell y Webb, 1995) y está catalogada como en peligro de extinción (Semarnat, 2010) y como de preocupación menor por la UICN (BirdLife International, 2016). No fue avistada durante el año de muestreo; sin embargo, Medina-Macías et al. (2010) la reportan para el pueblo El Magistral ubicada en LG.
El Águila Real (Aquila chrysaetos) está catalogada como amenazada (Semarnat, 2010) y como de preocupación menor por la UICN (BirdLife International 2016). Howell y Webb (1995) no mencionan específicamente a la especie para Sinaloa, sin embargo, su mapa de distribución cubre la franja extrema de la sierra Madre Occidental sinaloense. Sonoran Joint Venture (2003) y Lepage (2016) reportan la especie para Sinaloa mientras que Berlanga et al. (2008), en su mapa de distribución, la ubican en el extremo noreste del estado. Igualmente en Sinaloa, la especie fue observada en El Batel, El Palmito y Rancho Mojocoan (entre 900-2,100 m snm; octubre-noviembre, 1998-1999) (Medina-Macías, 2006), mientras que aVerAves (2016) la reporta para la cercanía de Copala y El Palmito. Durante el presente estudio, la especie fue observada en 4 ocasiones, todas en el cerro El Pirame: el 14 de enero 2009 (volando a un costado; Fig. 6), 28 de octubre de 2009 (en la selva mediana subcaducifolia, aproximadamente a mitad del transecto), 19 de noviembre de 2009 (en un árbol en la cima del cerro), y 25 de enero de 2010 (sobrevolando el cerro El Pirame).

Figure 6 Águila real (Aquila chrysaetos) volando a un costado del Cerro del Pirame, el 14 de enero de 2009 (fotografía tomada por A.A.K. van der Heiden).
La Pava Cojolita (Penelope purpurascens), está catalogada como amenazado (Semarnat, 2010) y como de preocupación menor por la UICN (BirdLife International, 2016). Su área de distribución se extiende desde México hasta Ecuador y el norte de Venezuela. Es una especie poco común o rara en ambas vertientes, desde el sur de Sinaloa y sur de Tamaulipas a El Salvador y Honduras. Sus poblaciones fueron y son aún ampliamente diezmadas por la caza, aunque Howell y Webb (1995) consideran a la especie como poco común a común donde está protegida y en áreas remotas. De acuerdo con entrevistas realizadas a habitantes de 27 núcleos agrarios adyacentes a LG, en el año 2010, el ave estuvo todavía presente en 12 de ellos pero se consideró extirpada por la cacería en 15, incluyendo LG, donde era común en las partes altas y aisladas. Sin embargo, gracias a los esfuerzos de conservación y restauración de más de una década en LG, la especie fue vista (agosto 17, 2015) en 2 ocasiones en el sur de la comunidad en los alrededores del rancho San Isidro (23°20’25” N, 105°56’15” O y 23°19’20” N, 105°55’36” O; com. pers. familia Terán-Olivas, agosto 23, 2015; localmente se conoce al ave como faisán) alimentándose de pequeños frutos carnosos (drupas) de color rojo del arbolito conocido localmente como chinito (Erythroxylum havanense).











 text new page (beta)
text new page (beta)


