Introducción
Entre los temas actuales y controversiales abordados por la macroecología, biogeografía y conservación, están los referentes a los patrones de diversidad latitudinal a gran escala y los mecanismos que los determinan (Luo et al., 2011). Para dilucidar estos mecanismos se ha propuesto que la variable de respuesta (usualmente riqueza) se deconstruya o descomponga en subgrupos que compartan algún rasgo en particular. Esta propuesta se basa en el supuesto que, si las especies difieren unas de otras y responden de manera distinta a los cambios ambientales, al analizar el patrón agregado de riqueza se pierde información relevante sobre las causas que subyacen a los patrones de distribución y diversidad de especies (Marquet et al., 2004; Villalobos et al., 2013). En la mayoría de los taxones se ha observado que la diversidad, el tamaño corporal, y la amplitud del área de distribución geográfica de las especies varían latitudinalmente. La diversidad aumenta de los polos hacia el ecuador, lo que se conoce como gradiente de diversidad latitudinal (se han propuesto más de 30 hipótesis para explicar este patrón y continúan apareciendo más, siendo un tema que aún no ha sido agotado según Hawkins et al. [2003] ). El tamaño corporal de los animales y el promedio de la amplitud del área de distribución de las especies aumentan desde el ecuador hacia los polos. El patrón relacionado con el tamaño corporal se conoce como regla de Bergmann, la cual ha sido evaluada en distintos niveles taxonómicos, lo que ha ocasionado debate en torno a la formulación de la regla como sugiere Blackburn et al. (1999). Estos autores definen la regla de Bergmann como la tendencia a una asociación positiva entre la masa corporal de las especies en un taxón superior monofilético y la latitud habitada por esas especies. Esta regla se ha intentado explicar de varias maneras: 1) como un artefacto de las relaciones filogenéticas de las especies (diferentes taxones viven en diferentes latitudes), 2) como consecuencia de la habilidad para migrar, 3) por la resistencia a la inanición, 4) por la habilidad de especies de diferentes tamaños de conservar o disipar el calor (Blackburn et al., 1999; Cushman et al., 1993; Gaston et al., 2000). En relación al último punto, la variación latitudinal del tamaño del cuerpo sería una respuesta al clima extremo, las especies de cuerpos más grandes tendrán mayor capacidad para sobrevivir a largos periodos de escasez de recursos y conservar la temperatura corporal en ambientes fríos, los cuales se encuentran con mayor frecuencia en las latitudes más altas (Blackburn y Ruggiero, 2001; Freckleton et al., 2003). En estas altas latitudes, a su vez, bajo la regla Rapoport (sensu Stevens, 1989), se esperaría encontrar especies con mayor amplitud de área geográfica que en bajas latitudes. Sin embargo, la regla de Rapoport ha sido observada solo a escalas regionales (altas latitudes del hemisferio norte principalmente), por lo que carece de generalidad a escala global. Aunado a esto, el método empleado por Stevens (1989) para mostrar el cumplimiento de la regla de Rapoport en diversos organismos ha sido cuestionado por problemas de autocorrelación (Rohde, 1996). Ruggiero (2001) menciona que existen al menos 6 postulaciones para tratar de explicar patrones latitudinales de distribución de la diversidad: 1) el efecto de la geometría del continente; 2) los accidentes en la dispersión; 3) una mayor tolerancia climática de las especies en altas latitudes; 4) una mayor severidad de las barreras físicas en bajas latitudes que favorecen la especiación alopátrica y el aislamiento; 5) los ciclos climáticos del Pleistoceno y 6) un mayor número de interacciones interespecíficas en latitudes bajas.
Actualmente, la validez de ambas reglas ha suscitado considerable crítica y debate (Arita et al., 2005; Blackburn et al., 1999; Gaston y Chown, 1999). Esto se basa en que, se han encontrado grupos que no siguen estas reglas como en el caso de las tortugas, algunas serpientes, macro algas y crustáceos (Angielczyk et al., 2015). En este trabajo proponemos considerar estas generalizaciones (gradiente de diversidad latitudinal, regla de Rapoport y de Bergman) para un grupo monofilético de mamíferos. Para lo cual se utiliza el análisis de los patrones espaciales de distribución geográfica y diversidad de roedores caviomorfos que se distribuyen a lo largo del continente Americano y en algunas de sus islas. Este grupo de roedores de origen Sudamericano (Honeycutt, 2013), posee una amplia diversidad de formas y tamaños (desde los 12 hasta los 110 cm de longitud del cuerpo (sin cola), de hábitos (nocturnos, diurnos; coloniales, solitarios), de modos de vida (subterráneos o fosoriales, terrestres, arborícolas), entre otros rasgos (Patton et al., 2015). El objetivo de este estudio es identificar patrones en el tamaño corporal, la amplitud del área de distribución geográfica y la distribución latitudinal de la riqueza de los roedores caviomorfos actuales del continente Americano (deconstruidos por modo de vida en fosoriales y no fosoriales). Además, determinar si los patrones encontrados en este estudio para ambos modos de vida, se ajustan al gradiente latitudinal de diversidad y a las reglas de Rapoport y Bergmann. Se espera que las especies fosoriales al pasar gran parte del tiempo bajo tierra (donde la temperatura permanece más constante que en la superficie) se verían menos afectados por condiciones climáticas extremas, que aquellas no fosoriales.
Materiales y métodos
Los roedores caviomorfos comprenden en la actualidad 13 familias, 56 géneros y 246 especies (Ojeda et al., 2015). Sin embargo, en este estudio se excluyeron de la base de datos las especies insulares y aquellas con áreas de distribución fragmentadas para evitar sesgos al identificar y ubicar el punto medio de distribución geográfica de cada especie. La base de datos final se conformó de 126 especies (considerando la clasificación taxonómica de Wilson y Reeder, 2005). Las especies se clasificaron según el modo de vida en fosoriales (n = 62) y no fosoriales (n = 64). Las especies fosoriales son aquellas que construyen y viven en cuevas subterráneas y las no fosoriales corresponden al resto de los caviomorfos. Se consideró como tamaño corporal a la longitud del cuerpo sin cola, desde la punta de la nariz hasta la última vertebra de la columna. Los tamaños corporales y modos de vida se obtuvieron de diversas fuentes bibliográficas (Apéndice).
Partiendo de la línea ecuatorial hacia ambos polos del continente Americano se establecieron 15 franjas latitudinales con un ancho de 5° cada una. La primera franja tuvo como punto intermedio el ecuador y se ubicó entre los 2.5°N y los 2.5°S; la segunda franja abarcó de los 2.5° a los 7.5° de ambos lados del hemisferio y así sucesivamente se ubicaron las demás franjas latitudinales hasta llegar a los polos (Fig. 1). Los datos espaciales de la distribución geográfica de cada especie fueron obtenidos de la página de la UICN (2016). Con ayuda de la plataforma R y las librerías rgdal, raster, rgeos (Bivand et al., 2017; Bivand y Rundel, 2017; Hijmans, 2016) se obtuvieron los límites norte y sur de la distribución latitudinal, la amplitud y extensión del área de distribución geográfica y su punto medio (centroide) para cada especie. El punto medio del área de cada especie fue asociado a una franja latitudinal. Este punto medio se consideró como una medida de distribución latitudinal de las especies en el continente, la cual evita sesgos por falta de independencia estadística (Rohde et al., 1993). El tamaño corporal, la amplitud del área de distribución geográfica y la riqueza de los caviomorfos fosoriales y no fosoriales fueron asociados con la latitud (ya sean franjas o grados latitudinales) para identificar gradientes latitudinales de diversidad y verificar el ajuste de los datos a la regla de Rapoport.
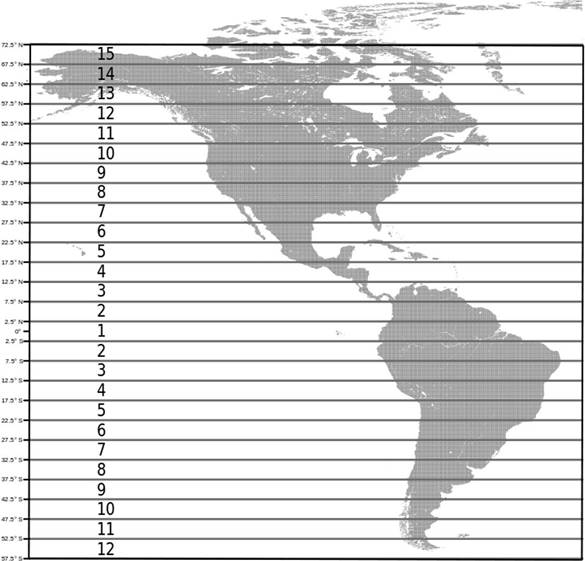
Figura 1 Franjas latitudinales a los largo del Continente Americano partiendo del ecuador hacia los polos. Cada franja tiene una amplitud de 5°. En el lado izquierdo se muestran los grados latitudinales y dentro de la figura se indican las franjas numeradas.
Se realizaron diagnósticos gráficos (histogramas) y estadísticos de las variables tamaño corporal, amplitud del área de distribución geográfica y riqueza de los fosoriales y no fosoriales. Se construyeron modelos lineales generalizados (MLG) para estimar la asociación de las variables anteriores con la latitud y la relación entre el área de distribución geográfica y el tamaño corporal. Para estos modelos se asumió una distribución Poisson y en los casos que se presentó sobre-dispersión, se construyeron los modelos con base en la distribución binomial negativa (Crawley, 2005). Los valores extremos (atípicos) de los datos fueron eliminados de los modelos. Todos los análisis, gráficos y modelos se realizaron en la plataforma R, versión 3.3.1, con ayuda de las librerías ggplot2, extrafont, MASS, rgdal, raster, rgeos y lmtest (Bivand et al., 2017; Bivand y Rundel, 2017; Chang, 2014; Hijmans, 2016; R Core Team, 2016; Venables y Ripley, 2002; Wickham, 2009; Zeileis y Hothorn, 2002).
Resultados
El tamaño corporal de los caviomorfos analizados osciló entre los 12 y 80 cm (fosoriales 12-70 cm, no fosoriales 14-80 cm) siendo el tamaño más frecuente en ambos casos de 21-22 cm. La relación entre la latitud y el tamaño corporal de los caviomorfos fosoriales fue significativo pero negativo (p = 0.0003, Coef = -0.4). Por el contrario, no se encontró una relación significativa entre la latitud y los tamaños corporales de caviomorfos no fosoriales (p = 0.07; Fig. 2), por lo que para ambos grupos se rechaza la regla de Bergmann.
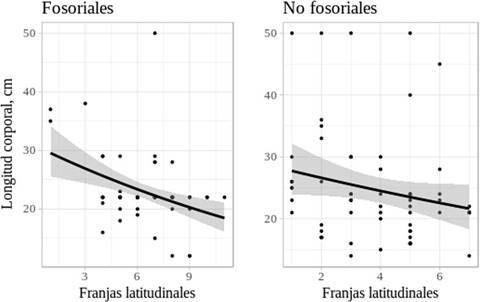
Figura 2 Tamaño corporal de los roedores caviomorfos (fosoriales izquierda, no fosoriales derecha) en función de la latitud en el continente Americano. El tamaño corporal de los fosoriales mostró una asociación negativa con las franjas latitudinales y los no fosoriales no mostraron asociación significativa. Las franjas van aumentando conforme de alejan del ecuador. Se aplicó un modelo lineal generalizado con distribución Poisson para fosoriales, p = 0.0003 y una distribución binomial negativa para los no fosoriales, p = 0.07.
La amplitud latitudinal del área de distribución de las especies fosoriales (medida en grados geográficos) varía entre 0.1 y 55.9° y de las especies no fosoriales entre 0.05 y 43.8°. Para ambos grupos de caviomorfos se encontró un efecto significativo negativo de la latitud sobre la amplitud de sus áreas geográficas (fosoriales: p = 0.001, Coef = - 0.22; no fosoriales: p = 0.004; Coef. = -0.19; Fig. 3), por lo que la regla de Rapoport se rechaza en ambos casos. Por otro lado, la distribución latitudinal de los caviomorfos se extiende desde los 70° N hasta los 50° S en el continente Americano. Los patrones de riqueza latitudinal indican que no es simétrica respecto al ecuador: la mayoría de los caviomorfos se encontraron en latitudes por debajo del ecuador. Las especies fosoriales que presentan menor amplitud latitudinal se encuentran por debajo del ecuador (entre los 16° - 48°S), las especies no fosoriales entre los grados 15°N - 25°S (Fig. 4).
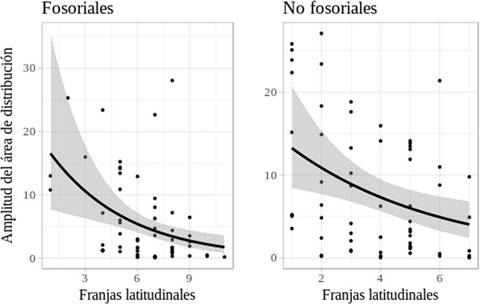
Figura 3 Amplitud del área de distribución geográfica de los roedores caviomorfos (fosoriales izquierda, no fosoriales derecha) en función de la latitud en el continente Americano. La amplitud del área de distribución geográfica de todos los caviomorfos (fosorial y no fosorial) mostró una asociación negativa con las franjas latitudinales. Las franjas van aumentando conforme de alejan del ecuador. Se aplicó un modelo lineal generalizado con distribución binomial negativa en ambos casos: fosoriales, p = 0.001; no fosoriales: p = 0.004.
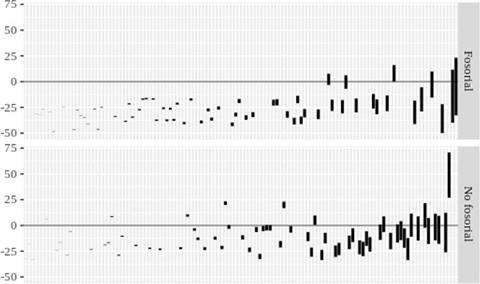
Figura 4 Distribución latitudinal de roedores caviomorfos (fosoriales arriba, no fosoriales abajo) en el Continente Americano. Cada línea representa la amplitud del área de distribución geográfica de cada especie. La gráfica está ordenada de menor a mayor amplitud de distribución geográfica en función de la latitud, representada en grados. El cero es el ecuador, hacia arriba del cero es el hemisferio norte (números positivos) y hacia abajo el hemisferio sur (números negativos).
Discusión
En general, los resultados indican que los caviomorfos no siguen las reglas propuestas, lo mismo se ha registrado para determinados grupos de animales, por ejemplo algunos grupos de tortugas y de anfibios (Adams y Church, 2008; Angielczyk et al., 2015). La regla de Bergmann no se cumple, incluso en el caso de los fosoriales, son más pequeños en altas latitudes. Tampoco se sigue la regla de Rapoport, por lo que no puede generalizarse que las áreas de distribución de estos roedores sean más pequeñas hacia el ecuador. Finalmente, la mayor riqueza de caviomorfos está un poco desplazada hacia el hemisferio sur.
Las asociaciones negativas, tanto del tamaño corporal de fosoriales con la latitud como de la amplitud del área de distribución en ambos grupos, concuerda con los patrones encontrados para los otros roedores (Ashton et al., 2000). Estos patrones negativos no pueden ser explicados por la conservación o pérdida del calor, es decir por la poca o mucha tolerancia a fluctuaciones ambientales como se había propuesto originalmente bajo el marco teórico de ambas reglas (Bergmann y Rapoport). Tampoco el gradiente latitudinal es suficiente para explicar la diversidad específica. Deben existir otros elementos (e.g., ecológicos, evolutivos, biogeográficos) que determinan estas asociaciones negativas y una mayor diversidad en el hemisferio sur.
Los caviomorfos tuvieron una radiación explosiva durante el Oligoceno en Sudamérica (regiones de los Andes, la Amazonia y/o la Patagonia) como consecuencia de la extinción masiva de la fauna arcaica que dejó numerosos nichos vacantes durante el Eoceno (Upham y Patterson, 2012). Además, la ausencia de castores, ardillas arborícolas y de tierra, y ratones de campo en Sudamérica antes del Gran Intercambio Biótico Americano, puede haber contribuido a la rápida diversificación ecológica y morfológica de los caviomorfos (Hinojosa y Villagran, 1997; Molina, 1995). La especialización a nuevos nichos pudiera haber promovido el fenómeno repetido de la aparición de tamaños mayores de caviomorfos a lo largo de su historia evolutiva como se ha planteado anteriormente (Álvarez et al., 2017; Raia et al., 2012). Estas especializaciones, a su vez podrían estar restringiendo su dispersión hacia los extremos del continente. Sumado a esto, el modo de vida fosorial presenta una ventaja sobre los no fosoriales: la protección que les brinda su madriguera, ya sea contra condiciones meteorológicas adversas (como altas o bajas temperaturas) o contra la depredación (Reichman y Smith, 1990). Posiblemente debido a esta ventaja, múltiples linajes de especies fosoriales y roedores del desierto tienen usualmente tasas metabólicas bajas (Contreras y McNab, 1990), lo que se asocia con cuerpos de mayor tamaño y áreas de distribución mayores. Esto podría explicar la falta de relación de este grupo con las leyes propuestas.
Por otro lado, Fergnani y Ruggiero (2015) sugieren que las presiones de selección más fuertes para caviomorfos, podrían haber ocurrido en diferentes zonas de Sudamérica donde, estos autores observaron mayor diversidad ecológica y filogenética de estos roedores: las regiones desérticas extremas tropicales, en hábitats abiertos del sur y en las regiones áridas correspondientes a los desiertos a lo largo de la costa peruana y sabanas de Uruguay y Caatinga, el Cerrado en el noreste y el sureste de Brasil. Junto a lo anterior, algunos autores han encontrado que los roedores, marsupiales y edentados muestran patrones con máximos centrados en latitudes subtropicales o intermedias (15°S - 30°S; Ruggiero, 1994, 1999; Willig y Gannon, 1997). En este trabajo se observó algo similar para los fosoriales quienes se encontraron principalmente entre los 16° - 48°S (Fig. 4), patrón que puede ser explicado por varios factores. Primero, porque Sudamérica es el sitio de florecimiento de este taxón, donde eventos del pasado como las glaciaciones cuaternarias y la formación de las montañas de los Andes, desde el Mioceno y hasta la fecha, han tenido una profunda influencia sobre el clima del continente (Hoorn et al., 2010). Esta fluctuación climática pudiera haber impulsado el modo de vida fosorial como una adaptación a condiciones ambientales drásticas. Segundo, porque dichos eventos del pasado habrían conducido a la formación de barreras fisiográficas a nivel local y regional (e.g., cordilleras, ríos) limitando la dispersión y colonización de nuevas áreas, favoreciendo el aislamiento de poblaciones y posteriormente la especiación alopátrica por parte de estos roedores, contribuyendo a la persistencia de especies endémicas (Badgley, 2010; Upham y Patterson, 2012), lo cual se ha vinculado con el aumento de diversidad de algunos clados en Sudamérica (Goin et al., 2012). Tercero, porque en estas latitudes, Sudamérica presenta mayor área (una gran extensión continental en sentido longitudinal), lo que aunado al relieve fisiográfico complejo (presencia de cordilleras, ríos, cañadas) y alta heterogeneidad ambiental (reflejada en diversidad de hábitats) podría estar asociado a una alta riqueza de mamíferos, como se ha observado en otros estudios (Amori et al., 2013; Badgley, 2010; Melo et al., 2009; Ruggiero y Kitzberger, 2004; Tognelli y Kelt, 2004). Por último, la alta riqueza de especies de caviomorfos en esta región podría estar asociada a procesos de ensamblaje que llevaron a la coexistencia de especies estrechamente relacionadas y que son ecológicamente similares (Fergnani y Ruggiero, 2015).
En conclusión, los patrones latitudinales de los roedores caviomorfos observados en este estudio, podrían ser explicados por una combinación de factores complejos, tales como: factores evolutivos (como la radiación explosiva y la rápida diversificación de estos roedores durante el Oligoceno), biogeográficos (las barreras geográficas originadas en gran parte por procesos históricos como la formación de los Andes y eventos climáticos del Pleistoceno) , factores abióticos (por ejemplo la extensión del espacio disponible a diferentes latitudes en América del Sur), bióticos (alta heterogeneidad ambiental), etc. Por lo que la explicación de la fluctuación ambiental (temperaturas extremas) como mediadora de la diversidad de especies, el tamaño corporal y la amplitud del rango geográfico de los caviomorfos no podría utilizarse como explicación del patrón hallado.











 nova página do texto(beta)
nova página do texto(beta)


