Introducción
Los disturbios antrópicos pueden alterar la diversidad de un determinado ecosistema y con ello, afectar sus procesos, entre los cuales se encuentra el ciclo de nutrientes (León-Gamboa et al., 2010). Uno de los tipos de disturbio más comunes en Sudamérica durante el último siglo ha sido el reemplazo de bosque nativo por la plantación extensiva de especies exóticas, como pino y eucalipto (Granda, 2006; Sedjo, 1999; Toro y Gessel, 1999). Sin importar si estas plantaciones tuvieron un interés estético o maderero, las alteraciones físicas del suelo en plantaciones de pino han sido ampliamente documentadas, e incluyen una baja retención de calor (Porté et al., 2004) y una alta evapotranspiración, lo que afecta la dinámica hídrica a nivel regional (Buytaert et al., 2007; Oyarzún y Huber, 1999). Con frecuencia, el establecimiento de estas plantaciones trae consigo la fragmentación del bosque nativo, de modo que los parches pequeños de vegetación nativa pueden ser influenciados por la matriz de plantaciones de árboles introducidos (León-Gamboa et al., 2010). Diversos trabajos abarcan los efectos de las plantaciones sobre la fauna de artrópodos en general (Brockerhoff et al., 2005; León-Gamboa et al., 2010; Suguituru et al., 2011); sin embargo, los trabajos sobre la araneofauna aún son escasos, pudiéndose citar algunos realizados en Uruguay (Jorge y Simó, 2012; Jorge, 2013).
Las plantaciones afectan la flora y la fauna, principalmente por su carácter uniforme (es decir, una especie dominante crece en extensos rodales homogéneos), lo que conlleva a la ausencia de árboles sobre maduros y muertos que constituyen un hábitat apropiado para muchos artrópodos, por lo que se genera una vegetación más pobre en diversidad y con menor biomasa que la que se desarrolla en el bosque natural (Poore y Fries, 1987). Esta problemática puede atenuarse con planificación y con un manejo adecuado que involucre, por ejemplo, dejar algunos árboles sobre maduros y reductos de vegetación nativa (Poore y Fries, 1987).
Los cambios de paisaje en tierras que antes se destinaban a la ganadería y que ahora se dedican a la forestación, ya ocupan decenas de miles de hectáreas en numerosos lugares de Argentina. Tal es el caso del sistema Iberá, localizado en el centro-norte de la provincia de Corrientes, la cual está sometida a cambios ambientales crecientes a consecuencia de las actividades humanas, tales como el ecoturismo, la forestación y las actividades agrícolas entre otras (Álvarez, 2003). Estos cambios ecológicos conllevan a la necesidad de preservar la biodiversidad de los diferentes ecosistemas en esta zona de Argentina, para lo cual resulta indispensable su conocimiento (Morrone y Coscarón, 1998).
El sistema Iberá constituye una macro unidad de ambientes terrestres, acuáticos y de interfase (Álvarez, 2003), que conserva gran parte del estado natural de los ecosistemas, especies y paisajes de la región y constituyen un importante reservorio de agua dulce de ubicación estratégica a nivel global (Carnevali, 2003). Es el humedal más importante del país y el segundo de Sudamérica por su extensión y sus particularidades biogeográficas. Se extienden sobre 1.3 millones de hectáreas distribuidas en los departamentos de Mercedes, San Roque, San Martín, Santo Tomé, Ituzaingó, San Miguel y Concepción.
Las arañas han ganado una amplia aceptación en los estudios ecológicos como indicadores de calidad ambiental (Clausen, 1986; Maelfait et al., 1990; Pinkus-Rendón et al., 2006; Tsai et al., 2006; Willett, 2001), ya que las comunidades de arañas han mostrado ser fuertemente influenciadas, y de manera predecible, por el tipo de hábitat y el patrón de uso de la tierra (Weeks y Holtzer, 2000).
Por lo mencionado, este trabajo tiene como objetivos conocer la fauna de arañas en bosques de monocultivos de eucaliptos y de pinos del sistema Iberá de la provincia de Corrientes, Argentina; analizando de manera comparativa la diversidad, riqueza específica y abundancia de arañas de la zona.
Materiales y métodos
Las muestras se obtuvieron de los siguientes monocultivos, Eucalyptus grandis W. Hill ex Maiden y Pinus elliottii Engelm, de las localidades de Colonia Montaña, Departamento San Miguel (CM; 28°03’13.2” S, 57°33’00.8” O) y forestación Puerto Valle, Departamento Ituzaingó (PV; 27°37’43.7” S , 56°31’17.8” O). La distancia entre las localidades es de 120 km en línea recta (Fig. 1). En CM tanto las plantaciones de pinos como las de eucaliptos (distanciados por 1 km) tenían 7 años de antigüedad, mientras que en PV ambos monocultivos (separados entre sí por 3 km) tenían 12 años. Estas localidades están comprendidas en las Provincias Fitogeográficas del Chaco Húmedo y Paranaense (Carnevali, 1994).
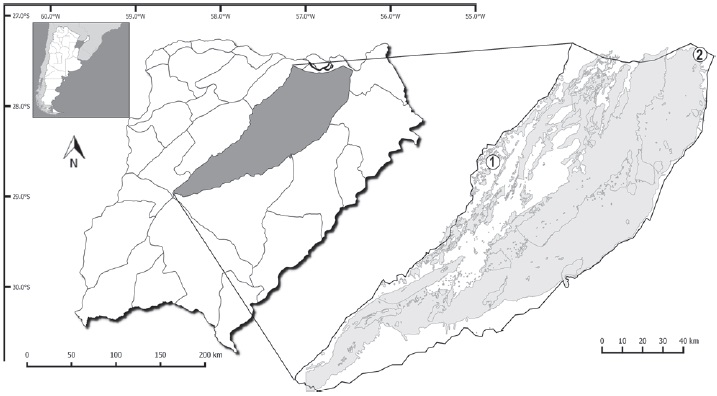
Figura 1 Sistema Iberá, Provincia de Corrientes, Argentina. Sitios de muestreo: 1, Colonia Montaña, Departamento de San Miguel; 2, Establecimiento Puerto Valle, Departamento de Ituzaingó.
Los muestreos se realizaron durante los meses estivales, primavera-verano de 2014 y 2015. En cada unidad ambiental (bosque de pinos y eucaliptos) se trazaron 3 transectos paralelos de 200 m × 2 m separados entre sí por 50 m. En cada uno de ellos se seleccionaron 5 sitios de muestreo de 4 m2 (distanciados por 50 m), haciendo un total de 15 sitios de estudio por cada rodal, donde se aplicaron 3 técnicas diferentes de captura (pit-fall o trampa de caída, tamizado y captura directa), sumando 45 muestras por rodal. De este modo, la unidad de muestreo queda representada por un conjunto complementario de métodos diferentes (Coddington et al., 1996; Jiménez-Valverde y Lobo, 2004; Toti et al., 2000), con la finalidad de obtener una representación óptima de la riqueza de especies de arañas del sitio muestreado.
Las trampas de caída (pit-fall), para la captura de arañas epigeas se instalaron en cada transecto 5 trampas de caída en línea recta, separadas entre sí por 50 m; totalizando 15 trampas por rodal (3 transectos con 5 trampas cada una). Las mismas consistían en un recipiente plástico de 1,000 cm3 de capacidad con solución conservante (etilenglicol: agua en proporción 1:10, con gotas de detergente) y permanecieron activas durante 48 h.
Las arañas del mantillo fueron obtenidas por tamizado de una superficie de 0.50 m2. El tamiz consistió en una malla de 1cm de apertura y se efectuó la técnica sobre un lienzo blanco de 2 × 1.5 m, dentro del rango horario de 15-18 h.
La captura directa nocturna, se efectuó la localización visual nocturna mediante observaciones directas de las arañas ubicadas en el follaje, en sus telarañas o en ramas dentro del bosque. La captura fue durante 10 min y a partir de las 20 h.
Las técnicas mencionadas fueron realizadas por 3 personas. Los ejemplares se conservaron en frascos rotulados y se fijaron en alcohol etílico al 70%.
Para la identificación taxonómica se utilizaron claves específicas disponibles y los individuos no identificados por especies se clasificaron en morfoespecies, en base a caracteres estructurales diferenciables del cuerpo y, en caso de los adultos, en base a las estructuras de los pedipalpos en los machos y epiginios en las hembras. Estos individuos no se determinaron debido al déficit de trabajos taxonómicos actualizados o de descripciones de algunos de los sexos y/o de la especie. Esta determinación es usada por la taxonomía para una determinación rápida, cuando se tiene dificultad en la identificación a nivel específico (Krell, 2004; Oliver y Beattie, 1993).
Las arañas recolectadas se agruparon de acuerdo a su funcionalidad trófica en 7 gremios: cazadoras al acecho (CA), cazadoras por emboscada (CE), constructoras de telas espaciales (CTE), constructoras de telas orbiculares (CTO), constructoras de telas sábanas (CTS), vagabundas de vegetación (VV) y vagabundas de suelo (VS) (Cardoso et al., 2011; Dippenaar-Schoeman et al., 1989; Enders, 1976; Liljesthröm et al., 2002).
El material analizado fue depositado en la colección de la Cátedra de Artrópodos de la Facultad de Ciencias Exactas de la Universidad Nacional del Nordeste, Provincia de Corrientes, Argentina (CARTROUNNE).
Se calcularon los índices de diversidad de Shannon-Wiener, dominancia de Simpson, equidad y la riqueza específica, para cada unidad ambiental. La significación estadística del índice de Shannon-Wiener se probó mediante la prueba “t” de Hutcheson (1970) a un nivel de significación α = 0.05. Previamente, los datos fueron sometidos a las transformaciones Box-Cox (Box y Cox, 1964), que resuelve los problemas de normalidad y se probó la misma mediante la prueba Jarque-Bera (p > 0.05) (Jarque y Bera, 1987). Estos análisis se realizaron con el programa PAST versión 2.17c (Hammer et al., 2001).
Se efectuaron pruebas de bondad de ajuste de ji cuadrada (análisis de tabla de contingencia a 3 vías de clasificación) y el cálculo de residuos estandarizados tanto para las abundancias de familias como las de los gremios, en pinos y eucaliptos, para determinar si las abundancias en la que se registran dependen del rodal (Siegel y Castellan, 1995; Zar, 2010). Para este análisis se utilizó el software estadístico infoStat (Di Rienzo et al., 2008).
Se empleó la prueba no paramétrica de Kruskal-Wallis (Zar, 1996) para verificar si hubo diferencias significativas entre las abundancias de los gremios en los distintos rodales de ambas localidades.
Para determinar la representatividad del muestreo, se elaboraron curvas de acumulación de especies para cada ambiente (Moreno, 2001), para lo cual se utilizaron los estimadores no paramétricos basados en la abundancia Ace y Chao 1(Jiménez-Valverde y Hortal, 2003). Ace se basa en el concepto estadístico de cobertura de muestreo (Colwell et al., 2004) y Chao1 utiliza la relación entre el número de Singletones y Doubleton (Magurran, 2004). También se utilizó el índice no paramétrico basado en la incidencia, Jacknife de primer orden, que no asume la homogeneidad ambiental en la muestra (Magurran, 2004) y tiene en cuenta a las especies que aparecen solo en 1 muestra (uniques), pero pesadas por el número total de muestras (Heltshe y Forrester, 1983a). Los cálculos se realizaron con el programa EstimateS 9.1.0 (Colwell, 2013) y se utilizó como unidad de muestreo el número de la riqueza de especies recolectadas con las técnicas de captura mencionadas.
La diversidad de ambas comunidades se midió mediante el número efectivo de especies o riqueza específica (S), entendido como el número de especies de una comunidad virtual, perfectamente balanceada, en la que todas las especies son igualmente comunes y en la cual se conserva la abundancia relativa promedio de las especies de la comunidad real (Jost, 2006). Los números efectivos de especies permiten comparar de forma clara y directa la magnitud de la diferenciación en la diversidad de 2 o más comunidades (Jost, 2006; Moreno et al., 2011).
En este trabajo consideramos las medidas de diversidad verdadera de orden cero (0D = S), cuyo valor equivale a la riqueza de especies y de orden 1 (1D), en la cual todas las especies son consideradas en el valor de diversidad, ponderadas proporcionalmente según su abundancia en la comunidad (Hill, 1973; Jost, 2006, 2007; Moreno et al., 2011).
Los distintos ambientes se compararon mediante las curvas de rango-abundancia, cuya gráfica permite analizar la riqueza de especies, sus abundancias relativas, la equidad y la secuencia de cada una de las especies que componen la comunidad (Feinsinger, 2004).
Para evaluar las similitudes en cuanto a la riqueza de especies de arañas registradas en los cultivos, se empleó el índice de Bray-Curtis el cual también considera las abundancias de cada especie presente (Brower y Zar, 1984). Con estos datos se construyeron dendrogramas mediante el software PAST versión 2.17c (Hammer et al., 2001).
Resultados
Respecto a la diversidad, se reconocieron 26 familias, 21 en CM (19 en pinos y 18 en eucaliptos) y 22 en PV (16 en pinos y 18 en eucaliptos). De estas familias, Caponidae, Miturgidae, Oonopidae y Philodromidae solo estuvieron presentes en CM, mientras que Mimetidae, Oxyopidae, Palpimanidae, Pholcidae y Uloboridae se hallaron únicamente en PV.
En general las familias con mayor abundancia para las 2 localidades fueron Tetragnathidae, seguida por Araneidae y Lycosidae, mientras que las familias con mayor riqueza de especies fueron Araneidae, Salticidae y Theridiidae (Tabla 1). Solo 13 familias estuvieron representadas con más de 10 individuos (Fig. 2). Respecto a la abundancia, en total se colectaron 1,384 individuos, 805 en CM (388 en pinos y 417 en eucaliptos) y 579 en la forestación PV (275 en pinos y 304 en eucaliptus).
Tabla 1 Familias, abundancia de individuos (N) y especies (S) de arañas de Colonia Montaña y Puerto Valle, Corrientes, Argentina.
| Familia | Colonia | Montaña | Puerto | Valle |
|---|---|---|---|---|
| N | S | N | S | |
| Amaurobiidae | 4 | 1 | 1 | 1 |
| Amphinectidae | 4 | 1 | 0 | 0 |
| Anyphaenidae | 25 | 5 | 4 | 2 |
| Araneidae | 215 | 21 | 93 | 22 |
| Caponidae | 1 | 1 | 0 | 0 |
| Corinnidae | 2 | 2 | 2 | 2 |
| Ctenidae | 23 | 5 | 19 | 3 |
| Gnaphosidae | 2 | 2 | 24 | 3 |
| Linyphiidae | 4 | 2 | 8 | 3 |
| Lycosidae | 87 | 9 | 84 | 4 |
| Mimetidae | 0 | 0 | 23 | 1 |
| Miturgidae | 16 | 1 | 0 | 0 |
| Oonopidae | 2 | 1 | 0 | 0 |
| Oxyopidae | 0 | 0 | 2 | 1 |
| Palpimanidae | 0 | 0 | 1 | 1 |
| Philodromidae | 17 | 4 | 0 | 9 |
| Pholcidae | 0 | 0 | 1 | 1 |
| Phrurolithidae | 17 | 1 | 1 | 1 |
| Salticidae | 27 | 12 | 27 | 6 |
| Scytodidae | 49 | 2 | 2 | 1 |
| Sparassidae | 1 | 1 | 5 | 2 |
| Tetragnathidae | 253 | 4 | 183 | 4 |
| Theridiidae | 27 | 7 | 22 | 12 |
| Thomisidae | 4 | 2 | 17 | 6 |
| Uloboridae | 0 | 0 | 55 | 3 |
| Zodariidae | 25 | 3 | 5 | 3 |

Figura 2 Abundancia de arañas de cada familia en rodales de pinos y eucaliptos (Euca) en Colonia Montaña (CM) y Puerto Valle (PV). Any: Anyphaenidae, Ara: Araneidae, Cte: Ctenidae, Gna: Gnaphosidae, Lyc: Lycosidae, Mim: Mimetidae, Phi: Philodromidae, Sal: Salticidae, Scy: Scytodidae, Tet: Tetragnathidae, Tho: Thomisidae, Zod: Zodariidae.
Se registraron 61 géneros para ambas localidades, en CM 30 géneros en pinos y 27 en plantación de eucaliptos; en la forestación de PV 23 géneros en pinos y 22 en eucaliptos; en la forestación de PV 23 géneros en pinos y 22 en eucaliptos.
Se determinaron 63 especies y 44 morfoespecies para las forestaciones de ambos departamentos, así en los pinos de CM se registraron 54 especies/morfoespecies y en los eucaliptos 61 especies/morfoespecies. En las forestaciones de pinos y eucaliptos de PV se reconocieron 42 y 52 especies/morfoespecies respectivamente (ver Apéndice).
De las especies/morfoespecies que se identificaron en CM el 30% (16) están representadas por un solo individuo (singletons) y un 15% (8) con 2 (doubletons) en la plantación de pinos, y en la plantación de eucaliptos 46% (28) son singletons y el 11% doubletons (7). Asimismo en la forestación de PV se observó un 45% (19) de especies singletons y un 9% (4) de doubletons en pinos y, en eucaliptos 54% (28) de singletons y 19% (10) doubletons (Tabla 3).
Tabla 2 Abundancia de arañas según gremio, familia, localidad y plantación en dos localidades y dos tipos de rodal de Corrientes, Argentina. Los símbolos de los gremios se muestran en materiales y métodos.
| Colonia Montaña | Puerto Valle | |||||
|---|---|---|---|---|---|---|
| Gremio | Familia | Pino | Eucalipto | Pino | Eucalipto | Total |
| CTO | Araneidae | 56 | 159 | 47 | 46 | 308 |
| Tetragnathidae | 138 | 115 | 22 | 161 | 436 | |
| Uloboridae | 0 | 0 | 55 | 0 | 55 | |
| CTS | Linyphiidae | 4 | 0 | 6 | 2 | 12 |
| Amaurobiidae | 3 | 1 | 0 | 1 | 5 | |
| Amphinectidae | 1 | 3 | 0 | 0 | 4 | |
| VV | Anyphaenidae | 24 | 1 | 3 | 1 | 29 |
| Sparassidae | 1 | 0 | 2 | 3 | 6 | |
| Miturgidae | 7 | 9 | 0 | 0 | 16 | |
| VS | Lycosidae | 59 | 28 | 68 | 16 | 171 |
| Gnaphosidae | 1 | 1 | 1 | 23 | 26 | |
| Ctenidae | 14 | 9 | 14 | 5 | 42 | |
| Corinnidae | 0 | 2 | 1 | 1 | 4 | |
| Caponidae | 0 | 1 | 0 | 0 | 1 | |
| Oonopidae | 2 | 0 | 0 | 0 | 2 | |
| Palpimanidae | 0 | 0 | 0 | 1 | 1 | |
| Phrurolithidae | 6 | 11 | 0 | 1 | 18 | |
| Scytodidae | 32 | 17 | 0 | 2 | 51 | |
| Zodariidae | 2 | 23 | 0 | 5 | 30 | |
| CA | Salticidae | 8 | 19 | 8 | 19 | 54 |
| Mimetidae | 0 | 0 | 23 | 0 | 23 | |
| Oxyopidae | 0 | 0 | 1 | 1 | 2 | |
| CE | Thomisidae | 3 | 1 | 9 | 8 | 21 |
| Philodromidae | 15 | 2 | 0 | 0 | 17 | |
| CTE | Theridiidae | 12 | 15 | 14 | 8 | 49 |
| Pholcidae | 0 | 0 | 1 | 0 | 1 | |
Tabla 3 Índices de diversidad de arañas asociadas a rodales de pino y eucaliptos en Colonia Montaña (CM) y Puerto Valle (PV) en Corrientes, Argentina.
| CM | PV | |||
|---|---|---|---|---|
| Variable | Pino | Eucalipto | Pino | Eucalipto |
| SF | 19 | 18 | 16 | 18 |
| SE | 53 | 61 | 42 | 52 |
| EM% | 79.93 | 56.40 | 55.20 | 60.28 |
| Chao-1 | 66.30 (IC:57.07±96.48) | 108.3 (IC:48.11;76.6) | 76.08 (IC:52.78;149.72) | 86.25 (IC:65.35;139.88) |
| Chao-2 | 74.47(IC:60.74;112.54) | 143.13 (IC:92.2;277.19) | 77.93 (IC:54.16;148.16) | 101.28 (IC:72.02;173.33) |
| Jack | 74.47 | 91.8 | 62.53 | 82.8 |
| Singletons | 16 | 28 | 19 | 28 |
| Doubletons | 8 | 7 | 4 | 10 |
| H | 3.03(IC:2.81;3.09) | 3.05 (IC:2.84;3.11) | 2.88 (IC:2.65;2.93) | 2.31 (IC:2.02;2.44) |
| D1 | 20.7 | 21.11 | 17.81 | 10.1 |
| D | 0.1 (IC:0.08; 0.13) | 0.09 (IC:0.07;0.11) | 0.09 (IC:0.07;0.11) | 0.29 (IC:0.23;o.34) |
| J | 0.76(IC:0.73;0.80) | 0.74 (IC:0.73;0.79) | 0.78 (IC:0.76;0.83) | 0.58 (IC:0.55;0.65) |
| d | 0.28(IC:0.23;0.32) | 0.22 (IC:0.17;0.25) | 0.18 (IC:0.16;0.23) | 0.52 (IC:0.46;0.57) |
SF: riqueza de familias; SE: riqueza de especies; EM: eficiencia del muestreo en%, según Chao1; H: índice de Shannon; D1: índice de diversidad verdadera; D: dominancia de Simpson; J: índice de equidad; d: índice de Berger-Parker; IC: intervalos de confianza.
Se pudieron reconocer 7 gremios en ambas localidades, de los cuales el gremio con mayor número de individuos resultó las CTO (Tabla 2) que representa el 57.7% del total de arañas colectadas en ambas forestaciones, seguida por el gremio de las VS con el 25%. Le siguieron, con menor importancia, CA con 5.7%, VV 3.7%, CTE 3.6%, CE 2.7% y CTS con 1.6% (Fig. 3). Según los resultados del test Kruskal-Wallis no hubo diferencias significativas entre las abundancias de los gremios en los rodales de ambas localidades (p > 0.05).
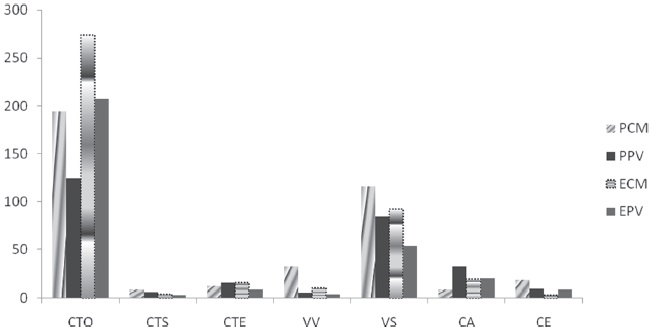
Figura 3 Abundancia de arañas según los gremios en las plantaciones de pino y eucalipto de Colonia Montaña y Puerto Valle, Corrientes, Argentina. PCM: pino, Colonia Montaña; ECM: eucalipto Colonia Montaña; PPV: pino Puerto Valle; EPV: eucalipto Puerto Valle. Los símbolos de los gremios se muestran en Materiales y métodos.
En la forestación de pinos y en la forestación de eucaliptos de las dos localidades sobresalió el gremio de CTO, con la particularidad de que, en la forestación de pinos de PV, aparece la familia Uloboridae que estuvo ausente tanto en eucaliptos como en pinos de CM y en eucaliptos de PV. Asimismo, el gremio de las VS fueron las que le siguieron en abundancia, con mayor predominancia de la Familia Lycosidae (Tabla 2).
Tanto en CM como en PV las frecuencias de las familias que se obtuvieron en los pinos y en los eucaliptos, mostraron dependencia al tipo de rodal (CM: x 2 =160.80, p < 0.0001; PV: x 2 = 290.71, p < 0.0001). Según la tabla de residuos estandarizados, las familias que contribuyeron a las diferencias entre los rodales en CM fueron: Anyphaenidae, Ctenidae, Lycosidae y Philodromidae (hubo más especies en los pinos y menos en los eucaliptos que lo esperado), Araneidae y Salticidae (hubo menos especies en los pinos y más en los eucaliptos que lo esperado); y en PV: Ctenidae, Lycosidae, Mimetidae, Thomisidae y Theridiidae (hubo más especies en los pinos y menos en los eucaliptos que lo esperado) Tetragnathidae, Gnaphosidae y Salticidae (hubo menos especies en los pinos y más en los eucaliptos que lo esperado).
Asimismo las frecuencias de los gremios en los pinos y en los eucaliptos de ambas localidades no fueron independientes (CM: x 2 = 43.84, p < 0.0001; PV: x 2 = 53.10, p < 0.0001).
Los gremios que más contribuyeron a las diferencias entre los rodales fueron VV, CE, CA, VS los cuales presentaron mayor número de especies que las esperadas en los pinos y de manera inversa en los eucaliptos. Las CTO por su parte, presentaron menos especies que las esperadas en los pinos y contrariamente en los eucaliptos.
Los resultados de los índices de Shannon indican mayor diversidad en los pinos y en los eucaliptos de CM respecto a PV, estas diferencias fueron significativas (t = 2.05, gl = 41.12, p = 0.04; t = 2.26, gl = 23.08, p = 0.03). Al comparar la diversidad entre los rodales, no hubo diferencias significativas tanto para CM (t = 0.85, gl = 42.64, p = 0.39) como para PV (t = 1.33, gl = 15.22, p = 0.20).
No obstante, según el índice de diversidad verdadera, los pinos de PV presentan casi el doble de diversidad que el cultivo de eucalipto (Tabla 3).
En general, se observó una menor dominancia en los cultivos de eucaliptos de CM y en los pinos de PV, por lo tanto se observa una mayor equitatividad en ambas plantaciones (Tabla 3).
La estimación de la riqueza de especies, por medio de índices no paramétricos Chao1, Ace y Jacknife, indican que más del 50% de las arañas fueron colectadas en ambas localidades (Fig. 4).
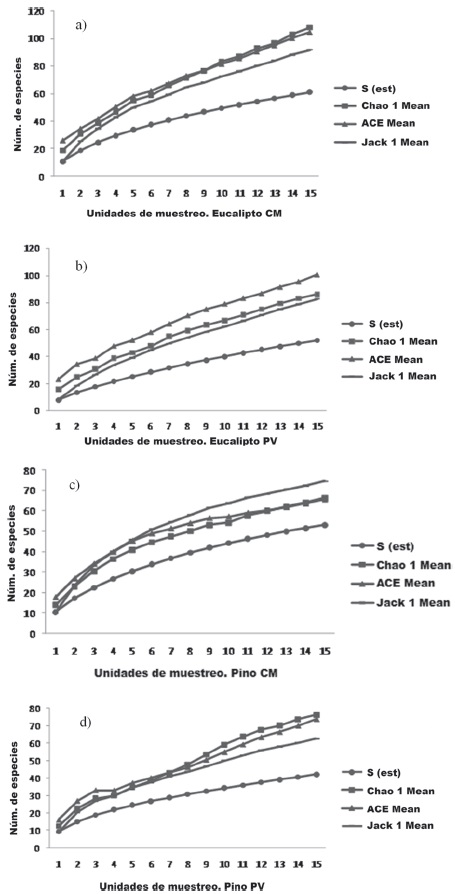
Figura 4 Curvas de acumulación de especies de arañas recolectadas en las plantaciones de pinos y eucaliptos de Colonia Montaña (a, c) y Puerto Valle (b, d). Corrientes, Argentina.
Las curvas de rango-abundancia mostraron que la estructura de las comunidades en los 4 cultivos son similares, con una o pocas especies que dominan y muchas especies raras representadas en las “colas” de la curva. La pendiente fue más pronunciada en los eucaliptos de PV lo que indica que la distribución de las especies fue menos equitativa. En ambos rodales de CM Leucauge argyra fue la especie dominante, seguida por Lobizon corandensis (n = 36), Metazygia gregalis (n = 26) y Scytodes sp. (n = 22) en pino; Metazygia sp. (n = 58), Metazygia gregalis (n = 48) y Cybaeodamus ornatus (n = 20) en eucalipto. Por su parte, los rodales de PV mostraron una composición específica diferente; en pino la especie dominante fue Lycosidae morfoespecie 6 (n = 51), seguida por Miagrammopes guttatus (n = 47), Gelanor sp. (n = 23) y Leucauge venusta (n = 21). Mientras que en eucalipto Leucauge venusta (n = 158) fue la especie dominante seguida de Gnaphosidae morfoespecie 2 (n = 18), Metepeira gressa (n = 17) y Lycosidae morfoespecie 2 (n = 14) (Fig. 5).

Figura 5 Curvas de rango-abundancia en los cuatro cultivos estudiados. Pinos y eucaliptos de Colonia Montaña (CM) y Puerto Valle (PV), Corrientes, Argentina.
El índice de Bray-Curtis presenta valores muy bajos, el dendrograma muestra agrupados a los cultivos de pino y eucalipto de CM con un 52% de similitud. Por otro lado los cultivos de pino y eucalipto de PV también se encuentran agrupados pero con valores de similitud muchos más bajos (15%) (Fig. 6).
Discusión
El total de familias de arañas registradas para Argentina asciende a 72 (CAA, 2015), cifra que representa el 63% de las familias de arañas a nivel mundial (WSC, 2017). Al comparar estos valores con las arañas registradas en las forestaciones investigadas, se constató que el total de familias halladas representan el 36% del país, así como el 55% de las registradas en el Departamento de Corrientes (n = 47 familias) (Avalos et al., 2007, 2009, 2013).
Los resultados obtenidos con los estimadores no paramétricos muestran que las arañas recolectadas representan entre el 52 y el 80% de la riqueza estimada para ambos rodales, de acuerdo a Chao et al. (2009) el esfuerzo de muestreo fue bastante eficiente al superar el 50% de completitud.
Asimismo, al comparar los tipos de forestación, se pudo ver que las familias registradas para la plantación de pinos en CM fue el 40%, en PV el 30% y para las plantaciones de eucaliptus de CM y PV fue el 38% respectivamente, lo que indica una reducción de familias para las zonas del Iberá estudiadas respecto a bosques naturales; en referencia a ello, Avalos et al. (2009) registran 33 familias de Araneomorphae y 2 de Mygalomorphae en bosques y pastizales en dicha reserva.
El número de especies raras registradas en la plantación de eucaliptos es más elevado que en los pinos, hecho observado en los singletons y doubletons de ambas unidades. En general estas especies halladas son miembros de familias megadiversas que se adaptan a diferentes tipos de hábitats, como las Araneidae, Salticidae y Theridiidae (Grismado, 2007); podrían tratarse más bien de especies turistas, cuya presencia se debe a la fragmentación del hábitat natural sin llegar a tener relación con la rareza de especie que indica una baja completitud de muestreo (Rubio et al., 2008).
Cabe destacar la presencia de Phoneutria nigriventer como primera cita en plantaciones de pino. Esta especie constituye un peligro para la salud humana y se oculta durante el día en cortezas de árboles, bajo troncos, en bananeros, palmeras o bromelias e incluso pueden entrar en las viviendas (De Roodt et al., 2011). Además, son más activas durante el período de reproducción (en los meses de marzo y abril, dependiendo de la temperatura), cuando pueden ingresar a viviendas o cruzar caminos o picadas (Lucas, 2003).
Respecto a los gremios de arañas en estos monocultivos, se vio que las cazadoras de telas orbiculares fueron las de mayor abundancia en ambas localidades y sobresale en los cultivos de eucaliptos, condicionado por el elevado número de Araneidae y Tetragnathidae. Inferimos que la estructura morfológica de los eucaliptos, de hojas pecioladas, lanceoladas y dispuestas de manera alterna a lo largo de las ramas, podrían aumentar la disponibilidad de sustrato donde fijar las telas de arañas, de acuerdo con Rypstra (1985) y Samu y Szinetár (2002) quienes sostienen que la complejidad de las estructuras de los árboles ejerce un efecto directo sobre el armado de las telas de manera tal que incrementa la densidad y la riqueza de especies de las arañas CTO. Además, la disponibilidad de presa es también condicionante, porque la síntesis y construcción de la tela implica un costo energético, y esperar la intercepción de la presa, una prolongada inversión de tiempo (Uetz, 1992), por lo que estas arañas deben seleccionar sitios propicios para balancear dichos costos. Los eucaliptos atraen una diversidad de insectos porque sus flores son una fuente rica de néctar; otros artrópodos e invertebrados se refugian en la cáscara desprendida de los troncos y ramas (Schneider, 2003). Esto podría explicar la elevada frecuencia de CTO en estos rodales en comparación con los cultivos de pinos. No obstante, León-Gamboa et al. (2010) aseveran que los cultivos de pino proveen más insectos voladores y arborícolas para las arañas que insectos en el suelo. Dichos resultados podrían deberse a que solo utilizaron técnicas de captura para arañas del suelo y lo compararon con un bosque nativo, de este modo sus resultados, acerca de la araneofauna en el suelo de pino, podrían ser subestimados. A pesar que la hojarasca del pino es pobre en nutrientes y presenta una baja tasa de descomposición (Lemma et al., 2007; Salamanca et al., 1998), en este estudio como los realizados en Uruguay por Jorge (2013), las VS fueron los más frecuentes con predominio de Lycosidae. Algunos investigadores, como Nyffeler y Sunderland (2003), refieren que las arañas vagabundas del suelo generalmente son numerosas debido a su amplia dieta.
Argumentamos, en concordancia con Jorge (2013), que los restos de podas y el mantillo de acículas en las forestaciones investigadas forman complejas tramas que favorecen sitios de refugio y captura para estas arañas. Aunque en otros estudios este mantillo parece ser más propicio para desplegar las telas sábana de las Linyphiidae (León-Gamboa et al., 2010; Jorge, 2013), esta familia no fue importante en este estudio.
En contraposición, las hojas de los eucaliptos con elevadas cantidades de aceites esenciales, no son alimentos para muchos animales (Schneider, 2003) además, según este autor, forman un mantillo de hojas muertas con bajo contenido de humedad y nutrientes. Estas condiciones podrían afectar la fauna de artrópodos del suelo y ocasionar así la disminución de las arañas del suelo, como muestran los resultados de este trabajo.
Es importante resaltar la edad de la plantación de los pinos investigados con relación a la diversidad de arañas encontradas. Elizondo Solís (2002) sostiene que la composición y la complejidad de la comunidad dependen de la edad de los rodales, a mayor edad de los mismos se presentan mayores sitios de refugio, forrajeo y reproducción; así Jorge (2013) obtuvo una elevada riqueza y diversidad de arañas en Pinus taeda de 13 años de edad. La mayor equidad y baja dominancia en las plantaciones de pinos de PV respecto a los pinos más jóvenes de CM, podría evidenciar como las plantaciones más añejas posiblemente favorecen el establecimiento de las arañas. Esto, además, podría estar relacionado a la oferta de micro hábitats y el tipo de manejo que reciben estos cultivos forestales, los cuales generan condiciones micro climáticas favorables para el establecimiento de las arañas (Jorge, 2013).
El género Leucauge en otros estudios realizados en bosques naturales y pastizales muestra valores inferiores de abundancia (Achitte-Schmutzler et al., 2016; Avalos et al., 2007, 2009), principalmente en áreas más conservadas como en las reservas naturales, donde su abundancia no supera a 3 individuos (Escobar et al., 2012; Grismado, 2007). Creemos entonces, que las especies de Leucauge se presentan como pioneras y dominantes en estos cultivos, más bien de tipo de bosques abiertos, adaptándose rápidamente a estas áreas donde los espacios parecieran ser importantes para desplegar sus telas. Asimismo, Avalos et al. (2013) verifican la abundancia de este género en cultivos de Citrus sinensis, junto con especies de Lycosidae. Esta última familia incrementa su abundancia en ambientes modificados por el hombre y, por ello, son considerados buenos indicadores biológicos (Costa et al., 1991). En esta investigación, su abundancia fue notable en los pinos de ambas localidades y en los eucaliptos de PV, cuya curva de rango-abundancia demuestra menor equidad y riqueza específica.
Los valores de similitud indican que la composición y estructura de la comunidad de arañas tienden a ser distintas entre localidades, ya que se puede observar un agrupamiento para las forestaciones de CM y como grupo externo a PV. Por otra parte, los valores de similitud de la abundancia muestran a los cultivos de CM con una similitud más alta que la de PV, lo cual se corresponde con la cercanía de los rodales (1 km) en dicha localidad; así en PV donde las plantaciones de pino y eucalipto están más distanciadas (3 km), presentan menor similitud en la estructura de la araneofauna.











 nueva página del texto (beta)
nueva página del texto (beta)



