Introducción
La pérdida de la diversidad biológica es una de las principales consecuencias del actual cambio climático global que ha vivido la humanidad, transformándose en un tema de interés mundial (Arribas et al., 2012, Ceballos, 2007). Esta crisis modifica el paisaje llevando a la pérdida de especies vegetales y animales, poniendo en riesgo nuestra propia supervivencia (Grismado et al., 2011). En consecuencia, la intensa explotación de los recursos naturales, como la agricultura intensiva, el avance de la frontera agrícola y la urbanización, resultan en una homogeneización del paisaje y son la principal causa de pérdida de biodiversidad en el ambiente.
Las modificaciones antrópicas han dejado pocos remanentes de hábitats naturales al reducir montes y bosques nativos, lo que conlleva a una menor cantidad de estratos vegetales y nichos ecológicos disponibles (Lavilla, 2004). Así como la heterogeneidad ambiental es un elemento determinante para la riqueza de especies, diversidad y composición de la comunidad (Dornelas et al., 2009, Freestone y Inouye, 2006), la homogeneización del ambiente influye tanto en la disminución de la cantidad de especies que pueden coexistir, como en la diversidad de gremios tróficos, lo que genera un déficit de nutrientes en los suelos, intensificando la pérdida de su biodiversidad (Avalos et al., 2008, Tews et al., 2004, Uetz, 1991).
Las arañas son uno de los grupos más abundantes en los agroecosistemas, no obstante son relegadas al momento de realizar acciones de control biológico en insectos (DeBach y Rosen, 1991) y debido a su destacado rol como depredadores en los ecosistemas terrestres, incluyendo los pastizales, pueden alcanzar altos niveles de riqueza de especies y abundancia (Diehl et al., 2013, Gómez et al., 2016).
La composición de arañas se encuentra fuertemente influenciada por el tipo de hábitat y patrones del uso de la tierra (Weeks y Holtzer, 2000), más precisamente, la complejidad de la vegetación ha sido reconocida como un importante factor que influye en la presencia, riqueza y composición de especies (Jiménez-Valverde y Lobo, 2006). Las arañas muestran una fuerte dependencia de la estructura física del ambiente (Halaj, Cady y Uetz, 2000), respondiendo de manera diferencial tanto al hábitat local, como a la conformación del paisaje (Sjödin, Bengtsson y Ekbom, 2008).
Dentro de la comunidad de artrópodos del suelo, las arañas son un componente importante (Clarke y Grant, 1968, Wise, 2002), ya que regulan la actividad de otros organismos más pequeños que habitan en el medio y participan en procesos de fragmentación y reciclado de nutrientes modificando la estructura del suelo (Cardoso et al., 2011, Díaz-Porres et al., 2014).
Debido a la sensibilidad que presentan las arañas a pequeñas diferencias en las condiciones ambientales, los cambios que acontecen en el medio se reflejan en la fauna presente (Rypstra et al., 1999, Uetz, 1991). Este atributo llevó a muchos autores a proponer al orden Araneae como organismos ideales para monitoreos biológicos e indicadores de calidad ambiental (Cardoso et al., 2011, Churchill, 1997, Clausen, 1986, Robertson et al., 2011, Scott et al., 2006, Tsai et al., 2006, Wise, 2002). Desde entonces se han incrementado los estudios encaminados a obtener información sobre las arañas en sistemas agrícolas (Almada et al., 2016, Almada et al., 2012, Armendano y González, 2009, Avalos et al., 2013), bosques neotropicales y áreas naturales protegidas (Avalos et al., 2007, Grismado et al., 2011, Höfer, 1990, Rubio, 2015, Rubio et al., 2008, Silva y Coddington, 1996).
Los inventarios faunísticos son esenciales para evaluar la biodiversidad y sus problemas de conservación a distintas escalas geográficas (Fandiño y Giraudo, 2010). Las áreas naturales protegidas (ANP) cumplen una importante función en la conservación de la biodiversidad regional (Arzamendia y Giraudo, 2004). No obstante, muchas ANP se han establecido sin criterios científicos, existiendo sesgos en la representación de la biodiversidad de especies y ecosistemas, en superficies deficientes como es el caso del noreste de Argentina, principalmente en el Parque General San Martín (Entre Ríos) (Arzamendia y Giraudo, 2004, Arzamendia y Giraudo, 2011). En la actualidad, el parque viene sufriendo un proceso paulatino de invasión de especies vegetales leñosas exóticas que modifican el hábitat natural y la fisonomía de los bosques nativos presentes. Estos cambios tienen una consecuencia directa sobre la composición y diversidad de los ecosistemas y pueden llegar a la extinción de las especies (Avalos et al., 2007, Berduc et al., 2010, Wise, 1993).
En este contexto, teniendo en cuenta los diferentes ambientes presentes en el parque producto de la invasión de especies leñosas y considerando la importancia de las arañas como indicadoras de cambios ambientales, este trabajo tiene como objetivo evaluar la araneofauna asociada al estrato de suelo en diferentes ambientes boscosos (nativos, exóticos) y pajonales, y su relación con la heterogeneidad ambiental del Parque General San Martín, provincia de Entre Ríos, Argentina. Se plantearon las siguientes hipótesis: 1) la diversidad de arañas de suelo es mayor en los sitios más heterogéneos, 2) el número de las especies de arañas compartidas es mayor en aquellos sitios que poseen una mayor similitud entre ambientes, 3) los gremios responden diferencialmente a la heterogeneidad de los ambientes.
Materiales y métodos
El muestreo se realizó en el Parque General San Martín (PGSM) que cuenta con una superficie de 400 ha, comprendida dentro del Área Natural Protegida «Parque Escolar Rural Enrique Berduc» (31°40’ S, 60°20’ O), ubicada en el Departamento Paraná, Provincia de Entre Ríos, Argentina (Fig. 1).
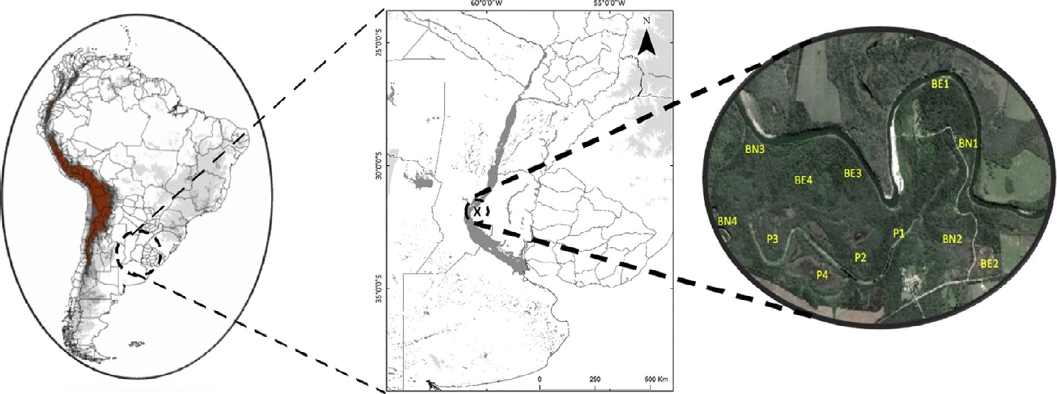
Figura 1 Localización de los sitios de muestreos en el Parque General San Martín, Entre Ríos, Argentina. BE: bosque exótico; BN: bosque nativo; P: pajonales.
Fitogeográficamente, el parque se encuentra dentro de la Provincia del Espinal (Apodaca, Crisci y Katinas, 2015). Presenta temperaturas medias que oscilan entre los 7 y 10 °C en invierno y entre los 19 y 23 °C en verano. Las precipitaciones superan los 1,100-1,200 mm anuales, con valores mayores para los meses de verano (Pereyra, 2003). En el PGSM se observan 3 tipos de ambientes florísticos naturales: bosque nativo con características semixerofíticas, caracterizado por la presencia de especies como Prosopis alba Griseb. y Prosopis nigra Griseb. (algarrobos), Prosopis affinis Spreng. (ñandubay), Celtis tala Gillies (tala), Schinus longifolius Speg. (molle), entre otras; vegetación costera, representada por árboles como Erythrina crista-galli L. (ceibo), Salix humboldtiana Willd. (sauce) y Sapium haematospermum Müll. (curupí) y los pajonales graminiformes, representada principalmente por Panicum prionitis (paja brava) y vegetación acuática anfibia y flotante asociada (Berduc, 2004).
Actualmente, el parque se encuentra en un estado de invasión de especies leñosas exóticas, como Gleditsia triacanthos L. (acacia negra), Morus nigra L. (mora), Ligustrum lucidum Aiton (ligustro) entre otras, generando bosques altos caducifolios y cambios severos en la fisonomía en los últimos 50 años (Berduc et al., 2010).
Para la recolección de las arañas, se seleccionaron 3 ambientes representativos del parque, según la vegetación circundante: 1) bosque nativo (BN), correspondiente a parches de bosques nativos que todavía no presentan leñosas exóticas, presentan una extensión de 1-3 hectáreas, dispersos dentro del PGSM, siendo los últimos remanentes de bosques nativos no invadidos; 2) bosque exótico (BE), con vegetación exótica leñosa, son los más numerosos actualmente, presentan un estado de invasión que han transformado al bosque nativo, y 3) pajonal (P), especies graminiformes, vegetación acuática anfibia y flotante, ambientes de formación típica de bañado y zonas bajas inundables.
Para el muestreo de las arañas de suelo, se utilizaron trampas de caída, que consisten en un recipiente de plástico con una capacidad de 500 cc (11 cm de profundidad y 7 de diámetro superior) y se utilizó como conservador una solución salina (cloruro de sodio [kg]: agua [l] en proporción 1:8, con gotas de detergente para romper la tensión superficial). Las trampas estuvieron activas durante 7 días consecutivos (168 hrs) en cada momento de muestreo. La recolección se realizó durante las estaciones de verano (diciembre 2011 a febrero 2012) e invierno (junio a agosto 2012), realizando un total de 3 muestreos por cada estación. Por ambiente (BN, BE y P) se escogieron 4 sitios (1, 2, 3, 4), con 5 trampas de caída al ras del suelo en cada uno de estos, distribuidas al azar y separadas entre sí por una distancia mínima de 10 m. De esa manera se muestrearon 12 sitios en cada fecha, colocándose en total 180 trampas por estación.
En el laboratorio, se procedió a la separación de arañas del resto de los artrópodos recolectados. Las arañas fueron identificadas hasta género y especie (en los casos posibles) y clasificadas en gremios (Cardoso et al., 2011, Dippenaar-Schoeman y Jocqué, 1997, Ramírez, 1999). Las arañas que no pudieron ser identificadas taxonómicamente, fueron separadas en morfoespecies (msp.) y designadas con el nombre de la familia y un número (n.°) (Oliver y Beattie, 1993). Las especies/morfoespecies fueron preservadas en recipientes de vidrio herméticos, rotulados y en alcohol etílico al 70%. El material recolectado se encuentra depositado en la colección aracnológica del Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» (MACN-Ar, Cristina L. Scioscia).
Para analizar la composición de la comunidad de arañas y su diversidad, se comparó la diversidad de cada ambiente mediante el índice de riqueza de especies (S), la abundancia relativa (n), el índice de diversidad Shannon (H)' y el índice de dominancia de Simpson y Berger-Parker (D) (Krebs, 1999, Magurran, 2004). Se empleó el método de bootstrap para comparar los valores obtenidos de los parámetros estudiados, utilizando el programa PAST versión 2.16 (Krebs, 1999, Hammer et al., 2012). Se compararon los valores de riqueza de especies observadas con respecto a la esperada por medio de estimadores no paramétricos para analizar la completitud del inventario obtenido a través del programa EstimateS 8.0.0 (Colwell, 2006).
Para evaluar y comparar la estructura de dominancia de la comunidad de arañas, se generaron curvas de rango-abundancia (curvas de Whittaker) para cada ambiente utilizando el programa BioDiversity Pro versión 2 (McAleece, 1999).
La densidad de arañas fue analizada considerando el valor promedio por ambiente de la abundancia (valor promedio del número de individuos recolectados entre los sitios en cada ambiente); para probar si existieron diferencias significativas entre las comunidades de arañas entre ambientes, se utilizó la prueba de Kruskall-Wallis. De igual manera se analizó la densidad de arañas por ambiente entre estaciones. Todos los análisis se realizaron con el programa PAST versión 2.16 (Hammer et al., 2012).
El grado de asociación o similitud de la fauna entre los ambientes se realizó mediante el análisis de escalamiento multidimensional no métrico (NMDS, por sus siglas en inglés), utilizando como distancia el índice de Sorensen cuantitativo (Bray-Curtis) usando el programa PC-ORD vers.6 (McCune y Mefford, 2011). Para ello se realizó una matriz primaria con los datos de abundancia de las especies de arañas de los ambientes y se siguió el protocolo propuesto por McCune y Grace (2002). Para evaluar cuándo el NMS extrajo ejes más robustos que lo esperado por azar, se aplicó el test de Montecarlo. Para probar si existieron diferencias significativas entre los agrupamientos obtenidos, se utilizó un procedimiento no paramétrico Multiple Response Permutation Procedure (MRPP), utilizando Bray-Curtis como medida de distancia.
Los gremios fueron clasificados de acuerdo con Cardoso et al. (2011), comparándose cada uno de los ensambles entre los ambientes por medio de un Anosim (análisis de similitud) en una vía, con una permutación de 9,999 y con un nivel de significación de p < 0.05, utilizando el programa PAST versión 2.16 (Hammer et al., 2012).
Para analizar la heterogeneidad horizontal de cada sitio, se tomó el valor de la media de cada variable considerada en cada uno de los ambientes y de esa manera se clasificaron sobre la base de la heterogeneidad ambiental.
En cada uno de los sitios estudiados se consideraron variables de heterogeneidad del hábitat (p. ej., la heterogeneidad del suelo en cada ambiente) y se siguió el método fotográfico Vertical Vegetational Structure Analysis (VESTA) (Zehm, Nobis y Schwabe, 2003). Se tomaron fotografías digitales en 5 sitios por ambiente, en un área de 0.5 × 0.5 m, las cuales fueron examinadas con el programa Photoshop CS5 (Adobe) por medio del análisis de fotos digitales a través del método de los diferentes colores (Gilbert y Butt, 2009). Este método permite asignar un color a una característica en particular, con lo que se obtienen porcentajes. Posteriormente, se obtuvo un promedio del porcentaje de cobertura de la vegetación (% Cobert.), de suelo desnudo (% suelo) y de hojarasca (% Hoj.) por cada área muestreada, que fue utilizado para el análisis porcentual de las variables de heterogeneidad de hábitat (Zehm et al., 2003).
Además en cada sitio se midió: la profundidad de la capa de hojarasca (% Prof.) tomando 5 puntos al azar, el peso de la hojarasca (% peso), medido a partir de 5 muestras aleatorias obtenidas mediante un cuadrante de 0.20 × 0.20 m. Las mismas fueron colocadas en bolsas independientes, secadas a estufas durante 48 h a una temperatura de 60 °C, donde se obtuvo el peso seco. Para cada variable (profundidad y peso de la capa de hojarasca), se calculó el promedio de las muestras por sitio tomando este valor como representativo para el análisis.
Para asignar un ordenamiento de los ambientes en función a la heterogeneidad ambiental, se realizó un análisis de ordenación polar de Bray-Curtis (McCune y Grace, 2002), utilizando las variables que no estuvieron autocorrelacionadas. Este método organiza puntos en referencia a los «polos» o puntos finales (Bray y Curtis, 1957), utilizando como criterio de selección de los mismos el método de varianza-regresión y como distancia Bray-Curtis (Peck, 2010). El análisis se realizó por medio del programa PC-ORD ver.6 (McCune y Mefford, 2011).
Para evaluar si existió autocorrelación entre las variables se procedió a su análisis por medio del programa SPSS Statistics, versión 17.0 (2007), utilizando el coeficiente de correlación de Spearman, que mide la asociación entre órdenes de rangos.
Resultados
Se recolectaron 1,398 arañas y se identificaron 26 familias, correspondientes a 120 especies/morfoespecies. El P registró la mayor abundancia de arañas (678 individuos), seguido del BE (501) y el BN (219). En cambio la mayor riqueza de especies, la presentó el BN con un valor de 67 especies, mientras los ambientes P y BE presentaron 62 especies cada uno (Tabla 1).
Tabla 1 Composición, abundancia y riqueza específica de las familias de arañas de suelo registradas en el Parque General San Martín, agrupadas por gremios (Entre Ríos, Argentina).
| Gremios | Familias | P | BE | BN | Total | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | S | n | S | n | S | n | ||||
| Cazadoras corredoras sobre el suelo | Corinnidae | 13 | 7 | 3 | 1 | 8 | 4 | 24 | ||
| Gnaphosidae | 11 | 3 | 16 | 3 | 7 | 5 | 34 | |||
| Lycosidae | 241 | 9 | 265 | 8 | 68 | 8 | 574 | |||
| Cazadoras deambuladoras Especialistas | Thomisidae | 0 | 0 | 3 | 2 | 8 | 4 | 11 | ||
| Mimetidae | 1 | 1 | 0 | 0 | 0 | 0 | 1 | |||
| Zodariidae | 2 | 1 | 22 | 1 | 11 | 1 | 35 | |||
| Otras cazadoras | Anyphaenidae | 6 | 4 | 5 | 4 | 16 | 8 | 27 | ||
| Clubionidae | 0 | 0 | 3 | 2 | 0 | 0 | 3 | |||
| Ctenidae | 17 | 2 | 32 | 2 | 19 | 2 | 68 | |||
| Miturgidae | 7 | 6 | 4 | 4 | 7 | 4 | 18 | |||
| Oxyopidae | 3 | 1 | 4 | 1 | 0 | 0 | 7 | |||
| Philodromidae | 2 | 1 | 1 | 1 | 0 | 0 | 3 | |||
| Salticidae | 8 | 4 | 13 | 6 | 12 | 10 | 33 | |||
| Scytodidae | 0 | 0 | 10 | 1 | 5 | 1 | 15 | |||
| Sparassidae | 2 | 2 | 0 | 0 | 0 | 0 | 2 | |||
| Tejedoras de telas en sábanas | Amaurobiidae | 0 | 0 | 2 | 2 | 6 | 2 | 8 | ||
| Hahniidae | 95 | 2 | 12 | 1 | 1 | 1 | 108 | |||
| Linyphiidae | 27 | 10 | 79 | 10 | 31 | 5 | 137 | |||
| Pisauridae | 6 | 1 | 2 | 1 | 1 | 1 | 9 | |||
| Tejedoras de telas espaciales | Pholcidae | 2 | 1 | 5 | 1 | 1 | 1 | 8 | ||
| Theridiidae | 8 | 2 | 9 | 4 | 3 | 3 | 20 | |||
| Titanoecidae | 2 | 1 | 3 | 2 | 2 | 1 | 7 | |||
| Tejedoras de telas irregulares | Nemesiidae | 0 | 0 | 0 | 0 | 2 | 1 | 2 | ||
| Tejedoras de telas orbiculares | Araneidae | 4 | 3 | 7 | 4 | 9 | 3 | 20 | ||
| Nephilidae | 0 | 0 | 1 | 1 | 0 | 0 | 1 | |||
| Tetragnathidae | 221 | 1 | 0 | 0 | 2 | 2 | 223 | |||
| Total | 678 | 62 | 501 | 62 | 219 | 67 | 1,398 | |||
BE: bosque exótico; BN: bosque nativo; P: pajonales.
A nivel general, el inventario obtenido fue superior al 85%, mediante el estimador Michelis-Menten que calculó un 15% de especies más que las observadas. Este estimador de riqueza de especies también fue el mejor en las demás comunidades, siendo el inventario del ambiente P el más completo. El número de singletones resultó alto en el BN (40), pero bajo con respecto al número de doubletones (7) (Tabla 2).
Tabla 2 Medidas de diversidad de las comunidades de arañas de suelo registradas en el Parque General San Martín (Entre Ríos, Argentina).
| P | BE | BN | Total | P (bootstrap) | |||
|---|---|---|---|---|---|---|---|
| P-BE | P-BN | BE-BN | |||||
| Abundancia | 678 | 501 | 219 | 1398 | 0.0001 | 0.0001 | 0.0001 |
| Riqueza S (sobs) | 62 | 62 | 67 | 120 | sd | sd | sd |
| Chao 1 | 79.25 | 91.08 | 164.5 | 159.42 | - | - | - |
| ACE | 85.75 | 105.5 | 145.85 | 165.42 | - | - | - |
| ICE | 88.52 | 130.7 | 156.91 | 173.55 | - | - | - |
| MM | 77.34 | 79.74 | 119.51 | 141.77 | - | - | - |
| Singletones | 24 | 28 | 40 | 44 | - | - | - |
| Doubletones | 15 | 12 | 7 | 23 | - | - | - |
| (%) Completitud | 80.16 | 77.75 | 56.06 | 84.64 | - | - | - |
| Dominancia | 0.1698 | 0.1471 | 0.05953 | 0.09475 | 0.04 | 0.001 | 0.001 |
| Ind. Shannon | 2.474 | 2.698 | 3477 | 3125 | 0.024 | 0.001 | 0.001 |
| Ind. Simpson | 0.8302 | 0.8529 | 0.9405 | 0.9052 | 0.04 | 0.001 | 0.001 |
BE: bosque exótico; BN: bosque nativo; P: pajonales; p < 0.05: con diferencias significativas.
Los índices de diversidad de Shannon y de Simpson mostraron diferencias de significación estadística entre los ambientes (p < 0.05), donde el BN presentó el mayor valor, seguido del BE, y por último, el P. Respecto a la dominancia de especies, el ambiente P mostró el mayor valor y el BN el menor, diferenciándose significativamente entre los ambientes analizados (Tabla 2). Esto corresponde con lo observado en las curvas de rango-abundancia donde se registraron pocas especies dominantes en el P y el BE, y donde el BN mostró una comunidad más equitativa, con menor dominancia y mayor diversidad (Fig. 2).
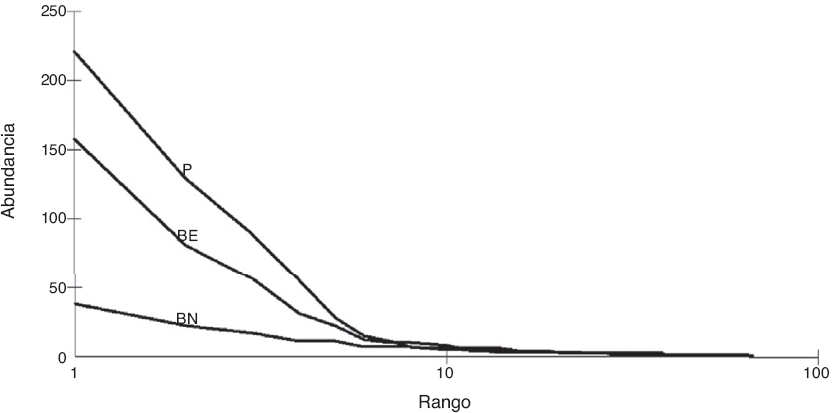
Figura 2 Curva de rango-abundancia de arañas de suelo para cada ambiente estudiado en el Parque General San Martín (Entre Ríos, Argentina). BE: bosque exótico; BN: bosque nativo; P: pajonal.
En cuanto a la densidad de arañas entre los ambientes, no se evidenciaron diferencias significativas (KW: H = 0.077, p = 0.9772). Al considerar las estaciones, se encontró que el verano fue la estación con mayor densidad respecto del invierno y mostró diferencias estadísticamente significativas entre el P y el BE (KW: H = 9.121, p = 0.025). El BN presentó menor densidad de individuos en ambas estaciones con respecto al P y BE, aunque solo se diferenció significativamente con el BE en verano (p = 0.018) (Fig. 3).
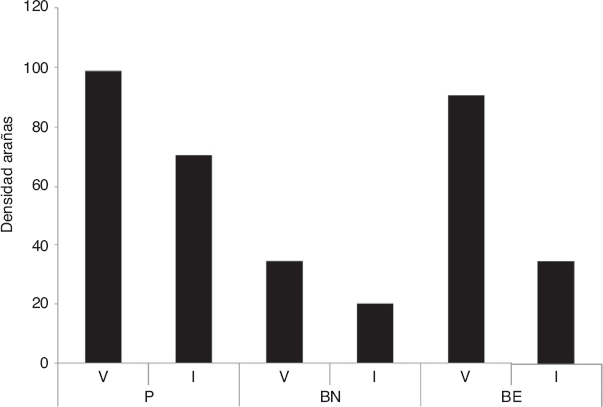
Figura 3 Densidad de arañas de suelo por estación en cada ambiente estudiado en el Parque General San Martín (Entre Ríos, Argentina). BE: bosque exótico; BN: bosque nativo; I: invierno; P: pajonal; V: verano.
El ordenamiento de los sitios en cuanto a las variables ambientales mostró que el BN es el ambiente con mayor heterogeneidad, seguido por los pajonales y BE, el menos heterogéneo. (R2 = 0.748) (Fig. 4).
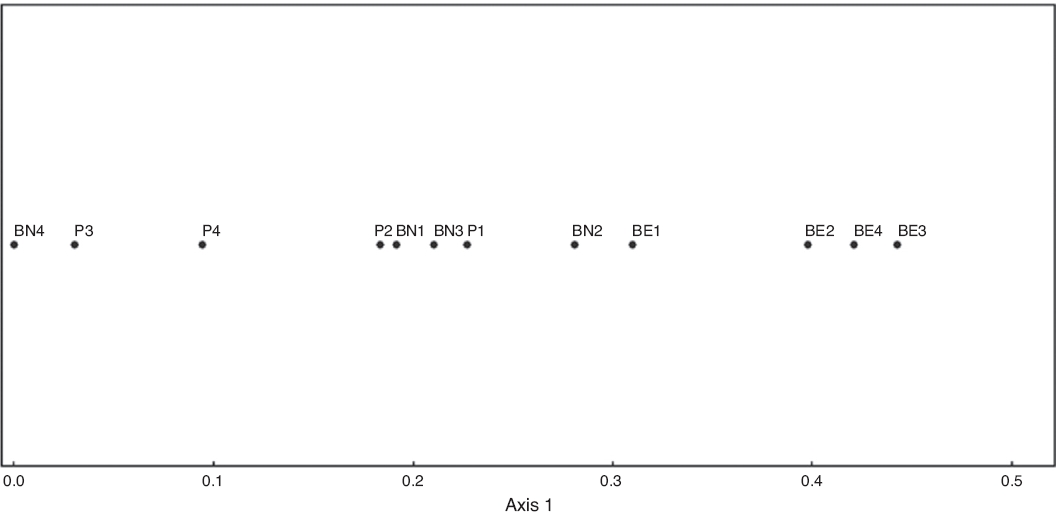
Figura 4 Ordenamiento polar de Bray-Curtis para los ambientes estudiados con respecto a las variables de heterogeneidad de suelo en el Parque General San Martín (Entre Ríos, Argentina). BE: bosque exótico; BN: bosque nativo; P: pajonal;.
En el NMDS se pudieron reconocer 2 grupos correspondientes a los ambientes P y BE del Parque San Martín. El ordenamiento en 2 ejes explicó más del 80% de la varianza (eje 1 = 0.562, eje 2 = 0.242) y con un estrés final de 11.9. El test de Montecarlo demostró que existieron diferencias estadísticamente significativas (p < 0.05) en el ordenamiento en relación con lo esperado por azar (Fig. 5). Los sitios se organizaron de acuerdo con los sistemas estudiados en cuanto a sus ensambles de especies. El porcentaje de profundidad de hojarasca (% Prof.) explicó el ordenamiento de los sitios P, mientras que el agrupamiento de los sitios BE se explica por el porcentaje de suelo sin cobertura (% suelo). El segundo eje del ordenamiento mostró variación en la distribución de los sitios analizados, no representando un patrón claro.
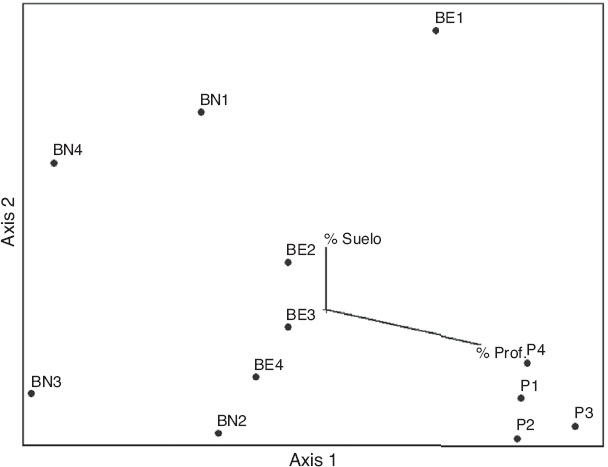
Figura 5 Escalamiento no métrico multidimensional mostrando el ordenamiento de los sitios estudiados teniendo en cuenta la similitud de los ensambles de arañas de suelo por medio de Bray-Curtis en el Parque General San Martín (Entre Ríos, Argentina). BE: bosque exótico; BN: bosque nativo; P: pajonal.
El análisis de MRPP demostró que los agrupamientos arrojados por el NMDS se diferenciaron entre las comunidades de arañas del Pajonal y las de Bosques, mientras que entre las comunidades de ambos tipos de bosques no mostraron diferencias (P vs. BN: A = 0.2407, p = 0.015; P vs. BE: A = 0.4074, p = 0.007; BN vs. BE: A = 0.083, p = 0.507).
Se registraron 8 gremios en el PGSM, donde las «cazadoras corredoras sobre suelo» (n = 632) fueron las más abundantes en todos los ambientes, seguido por las «tejedoras de telas en sábanas» (n = 262) y «tejedoras de telas orbiculares» (n = 223). En el BN se hallaron todos los gremios, mientras que en el BE no se registró a las «tejedoras de telas irregulares», al igual que a las «cazadoras deambuladoras» que no fueron registradas en el P (Tabla 1).
Los resultados del Anosim solo mostraron diferencias de significación estadística en 2 ensambles de arañas de los ambientes analizados, evidenciando cómo la heterogeneidad de cada uno de los ambientes se manifiesta en los gremios presentes. Las tejedoras de telas orbiculares mostraron diferencias significativas entre los ambientes (Anosim: R = 0.3484, p = 0.012) y las tejedoras de telas en sábanas (Anosim: R = 0.6609, p = 0.001). El resto de los gremios (especialistas, cazadoras corredoras sobre el suelo, cazadoras deambuladoras, otras cazadoras, tejedoras de telas irregulares y tejedoras de telas espaciales) no cambiaron sus ensambles de manera significativa entre los ambientes.
Discusión
La hipótesis de heterogeneidad ambiental establece que a mayor heterogeneidad, mayor cantidad de nichos podrán coexistir, traduciéndose en un mayor número de especies (Allouche et al., 2012, Bazzaz, 1975, Jiménez-Valverde y Lobo, 2006). En este contexto, y teniendo en cuenta la diversidad de arañas de suelo presentes en el PGSM se observó que la comunidad estuvo influenciada por los cambios que se generan en el hábitat, mostrando mayor diversidad de arañas donde hay mayor diversidad ambiental. Esto quedó demostrado en el bosque nativo en contraposición al bosque exótico, que es más homogéneo por los cambios que establece la vegetación al invadir y modificar el ambiente.
En Argentina se reconocen 64 familias de arañas correspondientes a 1,109 especies aproximadamente (World Spider Catalog, 2016), de las cuales se reconocieron en el PGSM 26 familias (40%) y 120 especies/morfoespecies. Diversos trabajos realizados en este país, pero con diferentes técnicas de muestreo, hallaron un alto número de familias similares a las registradas en el presente trabajo: 23 familias en la Reserva el Bagual (Formosa) (Corronca y Abdala, 1994), 33 familias y 150 especies/morfoespecies al analizar la araneofauna asociadas a 2 bosques degradados del Chaco Húmedo en Corrientes (Avalos et al., 2007), 28 familias y 104 especies/morfoespecies en el Parque Nacional Mburucuyá (Corrientes) (Rubio et al., 2008), 32 familias y 158 especies/morfoespecies en Reserva Natural Otamendi (Buenos Aires) (Grismado et al., 2011) y 34 familias y 188 especies en las selvas de Yungas (Rubio, 2015).
La familia Lycosidae registró la mayor abundancia en este estudio (41.1%), seguido en orden decreciente por las familias Tetragnathidae (16%), Linyphiidae (9.8%) y Hahniidae (7.7%). Las familias antes mencionadas representan más del 74% de la abundancia total, donde el resto mostró una abundancia inferior al 5%. Estos resultados coinciden con otros estudios en áreas naturales, donde Lycosidae se caracteriza por poseer especies deambuladoras muy activas sobre la superficie terrestre, y por ser la familia de arañas más abundante en los relevamientos de fauna de suelo de todos los ambientes (Rubio, Minoli y Piacentini, 2007). Además, los licósidos son influenciados por la calidad y tipo de hábitat en el que se encuentren, presentando diferentes respuestas de comportamiento en cuanto a sus patrones de abundancia espacial (Buddle y Rypstra, 2003, Martin y Major, 2001).
Linyphiidae constituyó la segunda familia más abundante del suelo en el parque, lo cual se relaciona directamente con la composición y complejidad del paisaje (Schmidt, Roschewitz, Thies y Tscharntke, 2005). Los linífidos son una de las familias que mejor se adapta y resiste a los sistemas con disturbio, lo cual explica la alta abundancia del grupo en el bosque con invasión de exóticas (Samu y Szinetár, 2002, Schmidt y Tscharntke, 2005). Esta familia, junto a Hahniidae forman parte del mismo gremio de las tejedoras de telas en sábanas, construyendo sus telas sobre la superficie del suelo o en el follaje bajo (Grismado et al., 2011). Por otra parte, la familia Tetragnathidae, perteneciente al gremio de las tejedoras de telas orbiculares, presentó la mayor abundancia en los pajonales. Esto se atribuye a la complejidad estructural del hábitat, donde la estructura física establecida por las especies vegetales características permiten que las arañas tejedoras puedan emplazar sus telas y alimentarse (Blanco-Vargas, Amat-García y Flórez-Daza, 2003).
El inventario total obtenido fue óptimo, superior al 80% de las especies estimadas, y similar a los ambientes P y BE; en cambio el inventario del BN fue inferior al resto. La alta heterogeneidad ambiental, junto a las especies raras, especies turistas, fenómenos demográficos y el área que ocupa la comunidad en estudio, son elementos que influyen en la riqueza de especies de un lugar (Halffter y Moreno, 2005). En consecuencia, la alta proporción de especies de arañas que faltaría encontrar en el BN se debería no solo a la complejidad del bosque, sino también, a las especies que son representadas por pocos individuos (singletones) y que suelen ser más difíciles de registrar en bosques, debido a la complejidad estructural que presentan estos ambientes (Rabinowitz, Cairns y Dillon, 1986).
La estimación continua de la riqueza de especies juega un rol fundamental en la conservación y evaluación de los inventarios biológicos en múltiples contextos (Cardoso, 2009, Coddington et al., 2009). Si bien en el presente trabajo, la composición de arañas del PGSM se estimó a partir de una sola técnica de muestreo (trampas de caída); este es un método ampliamente utilizado para el monitoreo de invertebrados de suelo en estudios de diversidad biológica y recomendado en protocolos para estudios de biodiversidad (Brennan et al., 1999, Coddington et al., 1996).
Respecto a la heterogeneidad analizada en el PGSM, el bosque nativo fue el ambiente que presentó altos valores de acuerdo a las variables cuantificadas, lo cual se corresponde con la mayor diversidad, riqueza y equitatividad de arañas, del resto de los ambientes del parque. Esto coincide con otros trabajos que demuestran una correlación entre la diversidad de especies y la complejidad estructural del hábitat, reflejándose en la comunidad de arañas presentes (Avalos et al., 2007, Avalos et al., 2008, Grismado et al., 2011, Uetz, 1991). Así, las arañas del BN del PGSM, encuentran todos los recursos y hábitat necesarios para su supervivencia. En coincidencia con lo postulado por diversos autores, aquellos ambientes que presentan mayor complejidad vegetal se correlacionan con una mayor resistencia a las alteraciones (Cardoso et al., 2011, Voigt et al., 2007).
El pajonal mostró ser un ambiente con una heterogeneidad intermedia, respecto a los ambientes del PGSM. La composición herbácea permite que muchas arañas tejedoras puedan fijar sus telas, y hacer de estas áreas las más propicias para el desarrollo de las especies, debido a la permanente cobertura de estos suelos, al proveer refugio y disponibilidad de presas (Desender et al., 1989, Duffey, 1978, Gravesen y Toft, 1987, Uetz, 1991). Así mismo, la alta abundancia encontrada en estos ambientes a lo largo de las estaciones analizadas, muestran que la estructura de la vegetación es un recurso clave en la determinación de la composición de arañas (Jiménez-Valverde, Ortuño y Lobo, 2007).
La invasión de plantas arbóreas, genera disturbios en el ambiente, cambia la fisonomía del paisaje y amenaza la biodiversidad (Aguirre-Muñoz y Mendoza-Alfaro, 2009). Esto se reflejó en los ordenamientos establecidos, donde el BE mostró ser el ambiente más homogéneo, con predominancia de suelos desnudos y menor cobertura de hojarasca, lo que afectó a la comunidad de arañas epigeas. El reemplazo del bosque nativo por el exótico genera cambios ambientales que fueron percibidos por la comunidad de arañas, por su menor diversidad y especies dominantes. Estudios realizados en otras escalas y con otras comunidades (aves) en el PGSM mostraron el mismo patrón (Fandiño y Giraudo, 2010). La dominancia de unas pocas especies arbóreas y la capacidad de invadir el área, generan un ambiente uniforme sin diversidad florística, lo que se ve reflejado en la comunidad de arañas analizadas.
Numerosos factores afectan la estabilidad ambiental y consecuentemente la diversidad de especies en un hábitat determinado (Whitmore, Slotow, Crouch y Dippenaar- Schoeman, 2002), por tal motivo los análisis de NMDS registraron que los sitios pertenecientes a los pajonales y bosques se ordenan según la heterogeneidad del suelo, principalmente por la profundidad de la hojarasca en los pajonales y por suelo descubierto en los bosques. Esto concuerda con Wise (1993), quien establece que la estructura de la vegetación y las propiedades de la capa de hojarasca afectan a la composición de arañas de la comunidad. Entre los factores que influyen a la comunidad se señalan a las condiciones microclimáticas del suelo, disponibilidad de alimento y de sitios de refugio (Lietti, Gamundi, Montero, Molinari y Bulacio, 2008), lo cual explica el ensamble de arañas del ambiente P y el efecto del suelo sin cobertura vegetal dada en los BE.
Diversos autores establecen que la estructura física del ambiente tiene una importante influencia en la preferencia del hábitat de las arañas, sobre todo para las constructoras de telas que necesitan estructuras más complejas para elaborarlas (Rubio et al., 2008, Uetz, 1991, Whitmore et al., 2002). Esta afirmación se observó en nuestros datos, donde los BN mostraron más gremios que los otros ambientes, como es el caso de las tejedoras de telas irregulares que únicamente se registraron en este ambiente. Los gremios, tejedoras de telas orbiculares y tejedoras de telas en sábana mostraron cambios significativos entre los ambientes analizados. Esto indica la organización que tiene la comunidad en relación con la heterogeneidad ambiental en la que se encuentra, permitiendo ocupar una gran variedad de microhábitats en los diferentes ambientes del parque, debido a la alta capacidad de dispersión, estrategia trófica y nivel de perturbación de los bosques, entre otros factores, que no fueron abordados en el presente trabajo (Cardoso et al., 2011, Jiménez et al., 2015, Uetz, 1991). Por otra parte, para futuros estudios en estos ambientes heterogéneos son necesarios complementar con otras técnicas de recolecta para evitar sesgos en los gremios existentes, evaluando la complejidad vertical y diversidad de las áreas involucradas.
A modo de conclusión, los ambientes del PGSM manifestaron diferentes grados de heterogeneidad horizontal, dando como resultado cambios en la comunidad de arañas del suelo al modificar su diversidad en respuesta a las características ambientales presentes. Esto demuestra que la invasión de especies vegetales exóticas genera pérdida de diversidad de nichos dentro de los bosques nativos, lo que puede llevar a un decremento en la diversidad de arañas en los ambientes nativos del PGSM. Las áreas naturales protegidas de Entre Ríos cumplen una importante función de conservación de la biodiversidad, en una región donde el avance agrícola se intensificó en los últimos 30 años, dejando pocos remanentes de bosques nativos. Es fundamental, el desarrollo de planes estratégicos de conservación en estos sitios para frenar la invasión de especies exóticas y conservar biodiversidad en estas áreas nativas.
En este contexto, sabiendo que el PGSM posee áreas con diferentes grados de heterogeneidad y una diversa comunidad de arañas, se espera que este aporte complemente y ayude al desarrollo de planes de control de exóticas para el fortalecimiento de las ANP, como también considerar nuevas evaluaciones a futuro para revelar nueva información y conservar la biodiversidad en estas áreas.











 nueva página del texto (beta)
nueva página del texto (beta)


