Introducción
Las diversas especies de plantas que habitan en una comunidad a menudo son visitadas por los mismos animales para su proceso de reproducción y presentan eventos fenológicos en tiempos simultáneos, lo que las lleva a recurrir a mecanismos que dividan la oferta del recurso y permitan un aprovechamiento por parte de los polinizadores de manera exitosa, evitando o disminuyendo la competencia (Levin y Anderson, 1970).
En este ámbito, las especies que coexisten se caracterizan porque hay una separación en el nicho, es decir, exhiben patrones y estrategias de explotación de los recursos que les permiten coexistir en una comunidad de manera indefinida (Dudgeon et al., 1999, Leibold y McPeeck, 2006, Silvertown, 2004). Diferencias en la morfología, fisiología, rasgos de historia de vida, y en el comportamiento son algunos mecanismos de coexistencia (Dudgeon et al., 1999).
De acuerdo con lo anterior, muchos aspectos reproductivos de las plantas pueden variar a escalas microespaciales y temporales debido a los cambios en la disponibilidad del recurso, lo que puede influir localmente en la interacción entre plantas y sus polinizadores (Galarda y Sazima, 2012). Existen mecanismos a nivel espacial, tales como la abundancia y distribución de la floración, y a nivel temporal, como la época de floración y horarios de producción de recompensas (néctar, polen), o condiciones ambientales que favorecen o no las visitas de polinizadores (Galarda y Sazima, 2012, Gutiérrez, 2005, Kessler y Krömer, 2000, Pauw, 2013, Sargent y Ackerly, 2008, Stiles, 1975, Tschapka y von Helversen, 2007).
En sitios tropicales con condiciones climáticas extremas como las zonas altoandinas y entre estas, el páramo (Rundel, Smith y Meinzer, 1994), la riqueza de especies y sobre todo de animales puede verse afectada por la elevación y las condiciones ambientales drásticas, lo que genera que a mayor altitud la disponibilidad de polinizadores disminuya y por ende, las plantas comúnmente compartan a sus polinizadores permitiendo la coexistencia (Gutiérrez, 2005, Steinacher y Wagner, 2010).
Puya trianae y Puya nitida son 2 bromelias exclusivas de los páramos andinos, y de las cuales P. nitida es endémica de la cordillera Oriental de los Andes de Colombia (García y Galeano, 2006, Madriñán, 2015). Ambas especies al igual que otras del género Puya, en los Andes se han reportado como fuente de alimento para colibríes, insectos y murciélagos (García-Meneses y Ramsay, 2012, Gutiérrez, 2005, Hornung-Leoni y Sosa, 2006, Hornung-Leoni et al., 2013, Hornung-Leoni et al., 2007, Madriñán, 2015, Salinas et al., 2007). No obstante, la información de la fenología, la biología reproductiva, así como de los visitantes y polinizadores de P. nitida y P. trianae requieren aún de un mayor conocimiento para el entendimiento de las interacciones ecológicas de las comunidades de plantas de alta montaña tropical, de sus aspectos reproductivos, y de sus animales visitantes. Por tal motivo, el objetivo de este estudio fue evaluar los mecanismos de la fenología a nivel de la flor, el individuo y la población, y los visitantes florales de P. nitida y P. trianae, desde una aproximación espacio-temporal en una zona de páramo en Colombia.
Materiales y métodos
El estudio se realizó en el Parque Nacional Natural Chingaza (PNN Chingaza), localizado en la cordillera Oriental, al nororiente de Bogotá, Colombia. El área principal de estudio está ubicada en el municipio de Guasca, vereda de Siecha, entre los 3,300 y 3,700 metros de altitud (4°46′08.53″ N, 73°52′02.07″ O; Figura 1). La mayoría de su territorio corresponde a ecosistemas de subpáramo y páramo (Vargas y Pedraza, 2003). El estudio se realizó durante 16 salidas al campo entre abril de 2013 y febrero de 2014, cuya duración varió entre 7 y 15 días dependiendo de la disponibilidad de flores de las especies estudiadas.
Figura 1 Ubicación geográfica del Parque Nacional Natural Chingaza, Colombia. La estrella en el recuadro de abajo indica la zona de estudio.
P. nitida y P. trianae son 2 bromelias terrestres de la subfamilia Pitcairnioideae exclusivas de las zonas andinas y abundantes en los páramos de la cordillera Oriental en el altiplano Cundiboyacense (Grau et al., 2010, Smith y Downs, 1974). Forman parches con rosetas acaules semélparas (ramets), lo que indica que mueren después de su floración; sin embargo, debido a la capacidad de clonarse, el individuo genético (genet) permanece, por lo que se denominan monocárpicas perennes (Chaparro, 2005).
En diferentes zonas del PNN Chingaza, P. nitida y P. trianae habitan en simpatría principalmente en áreas abiertas con suelos bien drenados en presencia de vegetación arbustiva y pajonales, entre los 3,200 y 3,400 m aproximadamente (Chaparro y Mora, 2003; Franco-Saldarriaga, 2015 com. pers.). En la localidad de Siecha, habitan en zonas contiguas a los 3,500 m aproximadamente (obs. pers.); sin embargo, en el transecto del muestreo las poblaciones de P. nitida y P. trianae se encontraron en hábitats disyuntos, con las poblaciones separadas aproximadamente por 60 m de elevación y 200 m de distancia.
P. nitida Mez, es una bromelia endémica de la cordillera Oriental de Colombia (García y Galeano, 2006, Madriñán, 2015), habita en zonas de subpáramo y páramo entre los 2,700 y 3,700 m en los departamentos de Cundinamarca, Boyacá y Santander, y su inflorescencia mide entre 1 y 2 m de longitud (Smith y Downs, 1974). P. trianae Baker, habita generalmente en zonas de páramo de los Andes de Colombia y Venezuela entre los 3,000 y 4,100 m de altitud y su inflorescencia mide hasta 2 m de longitud (Madriñán, 2015, Smith y Downs, 1974).
Se delimitó un transecto de 1,200 m de longitud a una pendiente de 39° donde se incluyeron 50 m a cada lado, completando para P. nitida un total de 46 rosetas distribuidas en 27 parches y 46 rosetas de P. trianae distribuidas en 45 parches, ya que fueron todas las rosetas en estado reproductivo encontradas en el área. Cada roseta y parche se marcó con etiquetas de aluminio y se georreferenció. Para cada especie se cuantificó el número de rosetas vivas presentes por parche y a poco más de la mitad de ellas (54%), se les midió la longitud de la hoja más larga de la roseta y la longitud de la inflorescencia en estado de antesis.
Variación temporal de la fenología de la floración
Se realizó un seguimiento a las 92 rosetas marcadas de cada especie durante cada salida de campo en la época de floración, registrando a diferentes niveles las siguientes variables: 1) a nivel de la flor: la antesis y longevidad floral medida desde el día de apertura de la flor y número de días en antesis hasta la senescencia; 2) a nivel de la roseta/inflorescencia: longevidad de la inflorescencia, medida por el número de días desde que abre la primera flor hasta que muere la última; pico de floración, medido con el porcentaje del número máximo de rosetas en floración cada mes; 3) a nivel de la población: la estación reproductiva, relacionada con la época de precipitación del año en que cada especie floreció; periodo de floración, relacionado con el número de días entre la apertura de la primera flor y la senescencia de la última; el modo de floración (unimodal, bimodal) y la estación reproductiva (lluvias, sequía).
Morfología floral y visitantes florales
Se recolectaron aleatoriamente flores frescas de diferentes rosetas hasta completar 30 de P. trianae y 43 de P. nitida. A estas flores se les midió la longitud total, longitud de la corola, longitud de los estambres, longitud del estigma y distancia de las anteras al estigma. Para identificar a las aves visitantes, se realizaron jornadas de observaciones focales con ayuda de binoculares a rosetas en estado de floración de ambas especies (una inflorescencia por jornada). Se completaron 64 h de observación en 8 jornadas para P. nitida y 41 h de observación en 5 jornadas para P. trianae. Cada roseta se observó continuamente durante el día entre las 06:30 y 16:30 h. A los visitantes se les registró la especie, frecuencia de la visita (número de veces que la misma especie visitó la inflorescencia), hora de llegada, duración de la visita, legitimidad de la visita (legitimidad definida como la inserción del pico por la parte distal de la flor o si el ave realiza perforaciones en las estructuras florales para consumir el néctar), estrategia de visita (rutero o territorial), forma de la visita (percha, vuelo sostenido) y número de flores probadas por cada visita.
Debido a que los principales visitantes de P. trianae y P. nitida fueron aves, se asistió a la Colección Colombiana de Ornitología en el Instituto de Ciencias Naturales de la Universidad Nacional de Colombia en Bogotá, con el fin de obtener las siguientes medidas morfológicas en diferentes ejemplares curados de las especies observadas en campo: longitud total del cuerpo (medida desde la punta del pico hasta la cola), longitud del culmen total y longitud del ala. Con dichas medidas se analizó el acople morfológico entre las especies de aves y las flores de las 2 especies de plantas, y así analizar relaciones con respecto a las diversas formas de visita y sus efectos sobre la polinización.
Para explorar los datos, se utilizó estadística descriptiva (medidas de tendencia central) y se realizaron pruebas de normalidad y homocedasticidad a cada variable. Las variables que resultaron normales fueron: el tamaño de las rosetas, el tamaño de las inflorescencias, la longitud total de la flor, la longitud de la corola, la longitud del estigma y la antesis floral (Tabla 1). Para establecer si hubo diferencias significativas entre P. nitida y P. trianae en el tamaño de las rosetas y las inflorescencias, se realizó una prueba de t-Student, y para comparar el tamaño de los parches entre las especies se aplicó un contraste de homogeneidad con la prueba no paramétrica de Kolmogorov Smirnov.
Tabla 1 Resultados de análisis de normalidad de las variables morfológicas de P. nitida y P. trianae en el sector de Siecha, PNN Chingaza, Colombia.
| Variable morfológica | |||||||
|---|---|---|---|---|---|---|---|
| Especie | Prueba | Tamaño roseta | Tamaño inflorescencia | Longitud total flor | Longitud corola | Longitud estigma | Antesis floral |
| Puya nitida | Wilcoxon | 0.96 | 0.9276 | 0.98 | 0.97 | 0.97 | 0.96 |
| p = 0.61 | p = 0.07 | p = 0.785 | p = 0.48 | p = 0.46 | p = 0.53 | ||
| Levene | 0.83 | 0.5121 | 3.85 | 0.86 | 0.0004 | 0.0003 | |
| p = 0.36 | p = 0.47 | p = 0.053 | p = 0.35 | p = 0.98 | p = 0.82 | ||
| Puya trianae | Wilcoxon | 0.973 | 0.968 | 0.97 | 0.96 | 0.97 | 0.94 |
| p = 0.72 | p = 0.618 | p = 0.57 | p = 0.44 | p = 0.57 | p = 0.46 | ||
| Levene | 0.63 | 0.2082 | 3.83 | 1.17 | 0.039 | 3.85 | |
| p = 0.42 | p = 0.650 | p = 0.054 | p = 0.28 | p = 0.84 | p = 0.31 | ||
Para analizar la superposición espacial en la distribución de las poblaciones de P. nitida y P. trianae, se realizó una figura de utilización de nicho espacial transformando las coordenadas geográficas de cada individuo marcado a coordenadas polares, las cuales se graficaron por píxeles. El porcentaje de superposición espacial se calculó cuantificando los píxeles solapados de ambas especies. Se realizó una prueba no paramétrica de Kolmogorov Smirnov para analizar diferencias con respecto a la altitud registrada para la población de cada especie y se descartó la altitud como una variable que pudiera generar efectos sobre el tamaño de las rosetas de cada especie de bromelia y el número de flores producidas por estas mediante un análisis de covarianza (Ancova).
Con el fin de analizar la floración de cada especie durante los meses de registro se realizó un contraste de homogeneidad no paramétrico para medidas repetidas o Anova de Friedman y se realizó un contraste de homogeneidad no paramétrico Kolmogorov Smirnov para evaluar diferencias entre el período de floración de ambas especies, así como para analizar diferencias en otras medidas que no resultaron normales, tales como el tamaño de los parches, la longevidad de las inflorescencias, la oferta floral mensual, la longitud de los estambres y la distancia entre anteras y estigma. Se realizó una prueba de t-Student a las variables de morfología floral que resultaron normales, con el fin de analizar diferencias entre las 2 especies de Puya. Para analizar las diferencias entre la morfología y el tamaño de las aves visitantes, la frecuencia de las visitas, los horarios de las visitas, el número de flores probadas y la duración de las visitas, se utilizó la prueba de Kruskal Wallis para los datos obtenidos en P. nitida, mientras que para P. trianae no fue posible realizar ningún análisis con respecto a los visitantes debido a la baja frecuencia de visitas a las flores de esta bromelia. La relación entre la morfología floral y la longitud del pico de las aves polinizadoras se analizó con una correlación de Spearman. Todos los análisis estadísticos se realizaron con el programa R (R Development Core Team, 2013) y en la plataforma R Wizard (Guisande et al., 2014).
Resultados
El tamaño de los parches de P. nitida y P. trianae fue significativamente diferente (Kolmogorov Smirnov = 0.963 p < 0.001). P. nitida se encontró en parches densamente agregados con 60 ± 48 rosetas por parche (min = 5; máx = 200; n = 27), mientras que P. trianae creció en parches con 1.7 ± 1.5 rosetas (min = 1; máx = 7; n = 46). Las rosetas de P. nitida fueron significativamente más grandes que las de P. trianae (t-test = 11.79; df = 44; p < 0.001; n = 25). Igualmente, las inflorescencias de P. nitida fueron significativamente más altas que las de P. trianae (t-test = 14.143; df = 30; p < 0.001; n = 25).
Por otro lado, no se encontró evidencia de superposición (0%) en la distribución espacial de ambas especies. P. nitida fue más abundante entre los 3,450 y 3,540m principalmente en el subpáramo, mientras que P. trianae se encontró principalmente desde los 3,600 m de altitud, en el páramo propiamente dicho (Kolmogorov Smirnov = 1; p < 0.001; Figura 2A).

Figura 2 Análisis espacio-temporal de las poblaciones de Puya nitida y Puya trianae y sus aves visitantes en el sector de Siecha, PNN Chingaza, Colombia. A) Porcentaje de solapamiento espacial entre las poblaciones estudiadas de P. nitida y P. trianae. B) Dinámica temporal de la fenología floral de P. nitida y P. trianae comparado con el patrón de precipitación anual del sector. Las barras indican la precipitación promedio, la línea continua corresponde al número de botones y flores abiertas de P. nitida y la línea discontinua los botones y flores abiertas de P. trianae. C) Frecuencia de visitas por las aves registradas en los diferentes horarios del día a P. nitida y P. trianae.
Variación temporal de la fenología de la floración
El período de floración de la población de P. nitida fue unimodal y prolongado, de aproximadamente 5 meses. El pico de floración se presentó en los meses de junio, julio y principios de agosto, en la época máxima de lluvias, donde el 93% de las rosetas estuvieron florecidas (Friedman Anova = 433.69; df = 14; p < 0.001; Figura 2B). En contraste, P. trianae tuvo un período de floración unimodal y de aproximadamente 3 meses, con un pico de floración al comienzo de la época seca en septiembre, donde el 78.2% de las rosetas estuvieron florecidas (Friedman Anova = 299.54; df = 14; p < 0.001; Figura 2B). Los picos de floración de ambas especies se diferenciaron significativamente (Kolmogorov Smirnov = 0.3851; p < 0.001).
Las flores de P. trianae y P. nitida abrieron gradualmente y al segundo o tercer día estaban totalmente abiertas. Por otro lado, la antesis de las flores de ambas especies duraron entre 3 y 7 días sin mostrar diferencias significativas (t-test = 0.89; df = 32; p = 0.37). El patrón de apertura de las flores fue de tipo acrópeta; es decir, abrieron desde la base de la inflorescencia hacia el ápice y durante los días siguientes abrieron las flores superiores, siendo las flores apicales las últimas en abrir. Las inflorescencias presentaron una longevidad prolongada de 62.8 ± 20 días en P. nitida (min = 12, máx = 107; n = 46) y de 29.6 ± 17 días en P. trianae (min = 0, máx = 62; n = 46) desde que abrió la primera flor hasta que murió la última, con diferencias significativas entre las especies (Kolmogorov Smirnov = 80.43; p < 0.001).
Morfología floral y visitantes florales
Las flores de P. nitida y P. trianae presentaron características acordes principalmente con el síndrome de ornitofilia: flores tubulares, brácteas florales gruesas, producción de néctar y ausencia de fragancias; la coloración de las flores fue característica de cada especie, donde P. nitida presentó una variación de colores verdes, rosas y púrpuras, mientras que las flores de P. trianae fueron de colores amarillos a verde-azules. Se encontraron diferencias significativas en todas las medidas morfométricas de las flores en las 2 especies, ya que P. nitida presentó corolas más largas (58.2 ± 4.9 mm; n = 43) con respecto a P. trianae (36.08 ± 3.8; n = 30; Tabla 2).
Tabla 2 Medidas morfométricas de las flores de P. nitida y P. trianae en el sector de Siecha, PNN Chingaza, Colombia. Se muestran los valores promedio, desviación estándar y entre paréntesis el rango. Todos los valores están en mm y al final de la tabla se presentan los resultados de las pruebas estadísticas realizadas.
| Especie | Longitud total flor |
Longitud corola |
Longitud estambres |
Longitud estigma |
Distancia anteras/estigma |
|---|---|---|---|---|---|
| Puya nitida n = 43 | 71 ± 6.3 (56.3- 84.9) |
58.2 ± 4.9 (40- 69.5) |
49.7 ± 5.1 (37-57.5) |
49.6 ± 3.9 (41.6-58.2) |
0.42 ± 0.24 (0 - 1.26) |
| Puya trianae n = 30 | 42.31 ± 4.19 (33.9–49.3) |
36.08 ± 3.8 (29.2 – 43.8) |
31.39 ± 2.52 (25.6–35.5) |
30.17 ± 2.63 (25 – 37.1) |
1.82 ± 1.62 (0 – 5.8) |
| t-test y Kolmogorov -Smirnov (D) | t-test = 23.276; p < 0.001 |
t-test = 21.4245; p < 0.001 |
D = 1; p < 0.001 |
t-test = 24.806; p < 0.001 |
D = 0.8; p < 0.001 |
Los visitantes florales de P. nitida fueron los colibríes Eriocnemis vestita, Pterophanes cyanopterus, Chalcostigma heteropogon y el pinchaflor Diglossa humeralis. Por otro lado, las aves que visitaron a P. trianae fueron los colibríes Lesbia victoriae, Chalcostigma heteropogon y P. cyanopterus. Se registró un número mayor de visitas en las plantas de P. nitida con un total de 157 registros, mientras que en P. trianae solamente hubo 5 visitas. En P. nitida la frecuencia total de las visitas entre las aves tuvo diferencias significativas (Anova Kruskal-Wallis = 44.63; df = 3; p < 0.001) y correspondieron principalmente a D. humeralis y E. vestita con 43.3 y 35% de visitas respectivamente, mientras que P. cyanopterus la frecuencia de visitas fue 17.8% y C. heteropogon 3.8%.
En la mayoría de las visitas a P. nitida, los colibríes tuvieron contacto con las estructuras reproductivas de la flor en el pico o la frente, a excepción de las visitas de D. humeralis las cuales fueron típicas de ladrones de néctar, perforando la base de la corola para libar el néctar de manera ilegítima y las de E. vestita que regularmente (90% del total de las visitas) robó néctar en las flores con perforaciones realizadas previamente por D. humeralis.
Las especies de aves se diferenciaron significativamente en su tamaño (long. total cuerpo Anova Kruskal-Wallis = 41.35; df = 4; p < 0.0001) y en las demás estructuras del cuerpo como la longitud del culmen total (Anova Kruskal-Wallis = 61.03; df = 4; p < 0.0001) y la longitud del ala (Anova Kruskal-Wallis = 49.84; df = 4; p < 0.0001), siendo E. vestita el colibrí más pequeño —por su longitud total— (112.32 ± 12.36 mm; n = 30) y P. cyanopterus el más grande (171.4 ± 28.38 mm; n = 7).
Los colibríes se caracterizaron por tener 2 estrategias de forrajeo: ruta y territorialismo. E. vestita tuvo comportamientos territoriales en defensa de las flores de P. nitida, ya que tenía una percha fija cercana a las flores y presentaba comportamientos agonísticos con otras especies de aves que se acercaban para libar de estas. Se perchaba y se colgaba de las flores para libar el néctar de manera legítima. C. heteropogon visitó las flores de P. nitida y P. trianae y se caracterizó por ser rutero. Al momento de realizar la visita, se perchaba de la flor para insertar el pico en la corola y alimentarse del néctar.
L. victoriae visitó solo las flores de P. trianae por medio de la estrategia de ruta. Se perchaba en las flores e insertaba todo el pico y la cabeza para libar el néctar ubicado en la base de la corola. Por último, P. cyanopterus visitó tanto las flores de P. nitida como de P. trianae, tuvo un comportamiento principalmente de ruta y su forma de forrajeo fue diferente a las demás especies: con un pico largo y recto visitó las flores rápidamente en vuelo sostenido (hovering) y se perchó ligeramente de las flores inferiores para poder introducir el pico y la cabeza totalmente a las flores de Puya, además se alimentó de todas las flores de la inflorescencia de manera legítima haciendo contacto con las estructuras reproductivas de la flor.
El número de flores probadas por cada especie de ave fue significativamente diferente (Anova Kruskal Wallis = 14.90; df = 3; p < 0.001), así como la duración de cada visita a P. nitida (Anova Kruskal Wallis = 25.44; df = 3; p < 0.001). D. humeralis fue la especie que probó más flores por visita (25 ± 30; n = 68) y la que tardó más tiempo en cada visita (84 ± 69 segundos; n 68), las demás especies tardaron en promedio 60 ± 57 segundos por visita y probaron alrededor de 18 ± 22 flores. Aunque las aves visitaron las flores de P. nitida durante todo el día, hubo diferencias significativas en la frecuencia de visitas durante el día (Anova Kruskal Wallis = 13.11; df = 4; p < 0.05; Figura 2C).
P. nitida y P. trianae compartieron las visitas de 2 especies de colibríes: P. cyanopterus y C. heteropogon, y hubo una relación significativa entre la longitud del pico de dichas especies de colibríes con respecto a la longitud de la corola de ambas especies de bromelias (Spearman Corr = 0.41; p = 0.003).
Discusión
La distribución espacial encontrada en las poblaciones de P. nitida y P. trianae, estudiadas en el sector de Siecha en el PNN Chingaza (Fig. 2A), es el aspecto principal que demuestra una segregación de hábitats a nivel local tanto en la elevación altitudinal como en las coberturas vegetales, siendo P. nitida dominante en el subpáramo entre los 3,450 a 3,540 m, mientras que P. trianae se observó en el páramo propiamente dicho a partir de los 3,600 m de altitud. Esta separación crea un patrón de distribución importante para aprovechar el servicio de polinización en diferentes espacios y de esta manera permitir la coexistencia de ambas plantas a una escala regional.
Se ha reportado una separación espacial a nivel local en otras especies de plantas estrechamente relacionadas que es generada por compromisos entre las habilidades competitivas y la tolerancia al estrés ambiental, aspectos que promueven la coexistencia de dichas plantas en tiempo y espacio (Peterson, Rice y Sexton, 2013). Esta separación espacial de P. nitida y P. trianae favorece tanto al establecimiento de los parches y rosetas, como al uso de los recursos, en este caso el servicio de polinización.
P. nitida, al presentarse de manera dominante en el subpáramo (3,400-3,550 m) está disponible para aprovechar las visitas de diferentes especies de aves que se distribuyen generalmente en este hábitat, tales como E. vestita y P. cyanopterus (Gutiérrez, 2005, Hilty y Brown, 2001) registradas en la zona, mientras que P. trianae al ser dominante en el páramo (mayor a 3,600 m) está disponible para las aves visitantes que se distribuyen regularmente a alturas mayores como C. heteropogon y L. victoriae (Gutiérrez, 2005, Hilty y Brown, 2001).
A su vez, los colibríes realizan migraciones altitudinales y estacionales, por lo tanto, pueden estar presentes en las diferentes coberturas vegetales a lo largo del rango altitudinal (De Queiroz y Galarda, 2007, Gutiérrez, 2005). Las 2 especies de Puya comparten las visitas de las mismas especies de aves que están presentes en toda la zona y en diferentes épocas del año, sin generar una competencia por los posibles polinizadores, ya que las aves visitan las flores con frecuencias distintas en cada hábitat y altitud.
Dinámica temporal de la fenología de la floración
La apertura tipo acrópeta de las flores en la inflorescencia y la longevidad prolongada de las flores, son aspectos característicos de este género de bromelias (Smith y Downs, 1974) que les aportan ventajas para la reproducción sexual y aprovechar el servicio de los visitantes. La asincronía en la apertura floral y la disponibilidad prolongada de cada flor permite que lleguen más visitas y realicen la polinización (Knigth et al., 2005). No obstante lo anterior, hay que tener presente que la longevidad prolongada de las flores favorece las visitas por ladrones de néctar y herbívoros, lo cual influye de manera negativa en la oferta floral para los verdaderos polinizadores de cada especie de planta.
La longevidad floral ha sido reportada como una característica de las plantas de alta montaña polinizadas por animales (García-Camacho y Totland, 2009), donde la actividad de sus visitantes es tan baja, que tener las flores durante varios días compensa la incertidumbre de la llegada de polinizadores potenciales (Ashman y Shoen, 1996; Primack, 1985 en Rathcke, 1988a). Es muy probable que en las zonas de páramo también se presente esta escasez de polinizadores, por lo que P. nitida y P. trianae aseguran su éxito reproductivo con este mecanismo floral, recibiendo la cantidad de polen necesario para fecundar los óvulos durante el tiempo de floración.
En el sector de Piedras Gordas en el PNN Chingaza, Franco-Saldarriaga (2014) estudió la longevidad floral y receptividad estigmática prolongadas (mayor a 5 días) en las flores de una población de P. nitida, y concluyó que a mayor longevidad floral, se incrementa gradualmente la cantidad de polen suficiente para fecundar los óvulos de esta especie de planta. Dicho resultado junto con el presente estudio permiten inferir que este mecanismo floral favorece el exocruzamiento y posiblemente al éxito reproductivo de P. nitida y P. trianae.
Por otro lado, las 2 especies de Puya estudiadas presentaron un pico de floración unimodal pero con diferencias significativas en la duración de la floración y en la época climática (Fig. 2B). Esto indica una clara separación temporal en la floración de P. nitida y P. trianae que permite el uso de los visitantes en diferentes épocas del año, lo que contribuye a la coexistencia de estas especies de plantas en el tiempo. Este patrón fenológico en las comunidades de plantas se ha reportado como usual en especies similares que comparten el polinizador y que posiblemente han competido en el pasado por este recurso, evolucionando en un desplazamiento de caracteres para compartir el uso del polinizador (Chen y Hsu, 2011, Heithaus, 1974, Levin y Anderson, 1970, Rathcke, 1988a, Rathcke, 1988b, Stiles, 1975, Taylor y White, 2007, Waser, 1978).
El patrón fenológico secuencial de P. nitida y P. trianae y la proporción de botones y flores abiertas, evita una superposición en el uso de polinizadores por la separación temporal, y a su vez genera una permanencia del recurso floral (néctar) para las aves visitantes, manteniendo así a las aves en el área y contribuyendo a la eficiencia del sistema de polinización en la comunidad (Machado y Semir, 2006, Stiles, 1975, Taylor y White, 2007). Esta separación temporal de la floración ha sido reportada en otros estudios de comunidades de plantas de zonas tropicales (Marín-Gómez, 2014, Stiles, 1975, Stiles, 1978a), corroborando que dicho mecanismo permite el uso del servicio de polinizadores sin afectar la polinización cruzada y el éxito reproductivo, favoreciendo la coexistencia.
Morfología floral y visitantes florales
La correlación positiva (Spearman Corr = 0.41; p = 0.003) entre las corolas de P. nitida y P. trianae con la longitud de los picos de sus principales visitantes (C. heteropogon y P. cyanopterus), corrobora que diferentes aspectos de la morfología floral de ambas puyas corresponden a las plantas visitadas principalmente por aves. Estas características han sido descritas para diversas especies de la familia Bromeliaceae (Buzato et al., 2000, De Queiroz y Galarda, 2007, Kessler y Krömer, 2000, Machado y Semir, 2006, Varadarajan y Brown, 1988) y para el género Puya (Chaparro, 2005, Franco-Saldarriaga, 2014, Hornung-Leoni et al., 2013, Salinas et al., 2007), y apoya la hipótesis de la existencia de algún grado de correspondencia entre la forma de las flores con la morfología del animal que la visita y poliniza (Cronk y Ojeda, 2008, Faegri y van der Pijl, 1979, Murcia, 2002), en este caso en el síndrome de ornitofilia.
En las condiciones climáticas extremas del páramo, las aves son las principales polinizadoras de las plantas que ven limitada su reproducción sexual por falta de animales polinizadores tales como insectos, los cuales no soportan los fuertes vientos o lluvias de dicho ecosistema y su diversidad se ve disminuida en las alturas (Gutiérrez, 2005). La especialización floral o los polinizadores especialistas pueden aumentar la transferencia de polen coespecífico, pero muchas plantas son visitadas por polinizadores generalistas o comparten morfologías florales entre congéneres, lo que conlleva a una partición del servicio del polinizador (Theiss, Keparth y Ivey, 2007). De acuerdo con esto, P. nitida y P. trianae a pesar de ser similares en su morfología floral, presentan caracteres que contribuyen a partir el servicio de los polinizadores.
El tamaño de las flores incrementa el número de especies visitantes y por ende de polinizadores. Las flores de P. nitida presentaron corolas de mayor longitud que las de P. trianae, lo que podría favorecer a la primera especie para que sean frecuentadas por colibríes de diversos tamaños corporales y longitudes de pico, e incluso por otros animales como murciélagos, como lo reportan Hornung-Leoni y Sosa (2006), en donde explican que las especies de Puya con inflorescencias medianas y flores grandes (como P. nitida) son visitadas por murciélagos; no obstante, se aclara que el acople entre el polinizador y la morfología floral no es muy específico como para excluir a otros animales de visitar las flores y polinizarlas. De acuerdo con esto, se puede inferir en este estudio que aunque se observaron solo aves visitando las flores de P. nitida y P. trianae ya que se realizaron solamente observaciones diurnas, no se excluye la posibilidad de que sean a su vez visitadas y polinizadas por otros animales.
Por el otro lado, las 2 puyas tuvieron diferencias en la longitud y arquitectura de las inflorescencias, caracteres que actúan como mecanismo de atracción de visitantes, ya que influyen en la diversidad de visitantes en las plantas, y en el alcance de atracción de estos (Harder y Barrett, 1996, Harder y Cruzan, 1990). P. nitida al tener inflorescencias más altas que P. trianae, puede tener un mayor alcance para atraer aves a larga distancia en comparación con las plantas de P. trianae, las cuales tienen inflorescencias más cortas; no obstante, el color amarillo-verdoso de las flores de P. trianae puede aumentar la atracción de las aves y aunque las inflorescencias sean menos vistosas en el paisaje, las flores resaltan y aseguran las visitas de sus polinizadores. La coloración de las flores es importante porque las aves perciben las longitudes de onda a largas distancias (cualidad que no presentan los insectos), y asocian estos colores con la recompensa que pueda ofrecer la flor, actuando de esta manera como un mecanismo de atracción de polinizadores (Cronk y Ojeda, 2008).
Se conoce que las plantas del género Puya son visitadas frecuentemente por colibríes de diversos tamaños y morfología de acuerdo con la forma y color de sus flores y la arquitectura de sus inflorescencias (Franco-Saldarriaga, 2014, Gutiérrez, 2005, Hornung-Leoni y Sosa, 2006, Hornung-Leoni et al., 2007, Hornung-Leoni et al., 2013, Salinas et al., 2007). Esta información apoya la evidencia de exocruzamiento. Sin embargo, si una misma ave puede visitar diferentes especies de plantas, también puede ocurrir una pérdida de polen coespecífico por depositarlo en plantas de diferentes especies, de tal modo que es necesario documentar el comportamiento de las aves visitantes y su eficiencia en cada visita.
El comportamiento territorial de E. vestita puede generar efectos negativos a P. nitida ya que impide las visitas de otras especies de aves que pueden transportar el polen y efectuar el proceso de polinización cruzada. Por otro lado, las visitas legítimas de E. vestita aportan al transporte de polen y al exocruzamiento entre las plantas de dicha Puya, pero, al ser un ladrón secundario de néctar (Inouye, 1983 en Arizmendi, 2001) consume el recurso sin contactar las anteras y el estigma de las flores, y al mismo tiempo reduce la recompensa para otros visitantes y polinizadores de esta bromelia. Es probable que el éxito reproductivo de P. nitida en este sector del PNN Chingaza esté afectado por el robo de néctar de este colibrí, no obstante, es necesario realizar estudios que profundicen este tema en particular para definir los efectos de este comportamiento sobre el éxito reproductivo de la planta, así como evaluar posibles visitas nocturnas de murciélagos o roedores pequeños que puedan estar evidenciando un efecto sobre la reproducción de P. nitida.
Las estrategias de forrajeo de ruta empleada por los colibríes C. heteropogon, P. cyanopterus y L. victoriae y la legitimidad de la visita, son aspectos que favorecen la adhesión del polen en el cuerpo del visitante que posteriormente puede ser depositado en otras flores de la especie correspondiente. Según Stiles (1978a), «es la estrategia más efectiva de forrajeo para el exocruzamiento de flores dispersas y a su vez mantiene la cohesión de las poblaciones esparcidas en parches». Simultáneamente, las aves al tener rutas de forrajeo, aprenden dónde está la recompensa para volver a visitarlas sin generar altos costos energéticos por la búsqueda de alimento en otros lados donde no se encuentre (Theiss et al., 2007, Wolf et al., 1976).
Dicha eficiencia y efectividad en la polinización se puede probar parcialmente con el número de flores probadas y la duración de la visita de las aves (Stiles, 1978b, Theiss et al., 2007). Los registros de estos aspectos por C. heteropogon, L. victoriae y P. cyanopterus a las flores de P. nitida y P. trianae son significativos para inferir que estos colibríes actúan como polinizadores de ambas especies y se sugiere que cada ave visitante a las 2 especies de plantas aporta al éxito de la polinización durante cada evento de forrajeo. Las estrategias de forrajeo y las formas de visita de la comunidad de aves visitantes a P. nitida y a P. trianae en la localidad de Siecha del PNN Chingaza, les permite separarse en cuanto a la manera que estas aves explotan el recurso (néctar), permitiendo que sea compartido y posiblemente evitar una disminución en el éxito reproductivo de ambas plantas.
Por otra parte, las especies visitantes C. heteropogon y P. cyanopterus (que comparten P. nitida y P. trianae) son aves que se diferencian significativamente en su morfología y tamaño, y la correlación entre la longitud de sus picos con la longitud de las corolas de cada especie de planta, explica su acople morfológico, así como el comportamiento de forrajeo de los colibríes.
El sitio de deposición del polen de cada bromelia en los cuerpos de las aves visitantes difirió debido al tamaño tanto del pico como de la longitud de la corola. P. cyanopterus al tener mayores proporciones de su pico y cuerpo hizo contacto con el estigma y los estambres en zonas diferentes al momento de realizar la visita, ubicando el polen en la frente y parte superior del pico cuando visitó a P. nitida y en la parte media y baja del pico al visitar a P. trianae. C. heteropogon es más pequeño y presenta un pico de menor longitud, esto junto con la morfología de las flores de ambas puyas permitió que al momento de realizar la visita el polen se dispuso principalmente en la coronilla y frente al visitar a P. nitida y a lo largo del pico al visitar a P. trianae (Fig. 3). Lo anterior favorece la polinización de ambas especies de Puya debido a que separan la ubicación del polen en el cuerpo de las aves, y de esta manera lo transportan adecuadamente a las demás flores de la especie correcta.
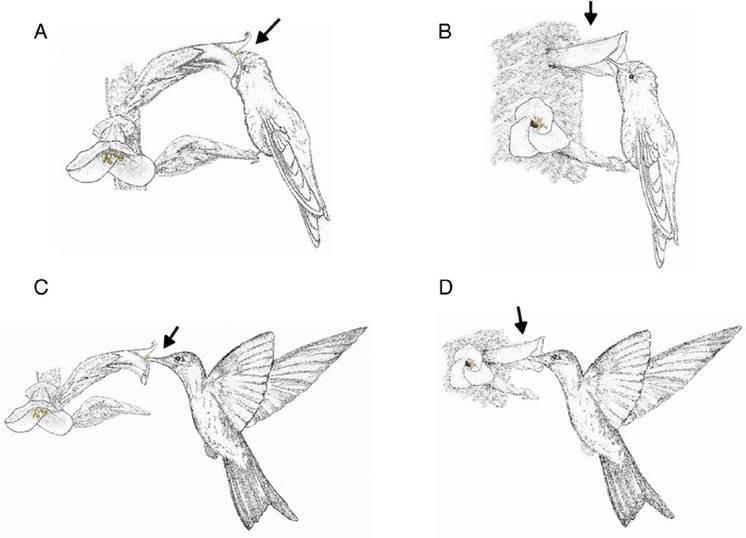
Figura 3 A) Chalcostigma heteropogon visitando las flores de P. nitida y de B) P. trianae. C) Pterophanes cyanopterus visitando las flores de P. nitida y D) P. trianae en el sector de Siecha en el PNN Chingaza, Colombia. Se observa la forma de visita de C. heteropogon a P. nitida, perchado, insertando completamente la cabeza en la corola de la flor y haciendo contacto con los estambres en la frente y coronilla; mientras que al visitar a P. trianae también inserta su cabeza para libar del néctar pero los estambres hacen contacto con el pico del ave. P. cyanopterus realiza su forma de visita en vuelo sostenido, donde hace contacto con los estambres de P. nitida en la base del pico y en la frente del colibrí, mientras que al visitar las flores de P. trianae, los estambres hacen contacto con la parte media y baja del pico del colibrí. Las flechas indican la posible deposición del polen en el cuerpo de cada especie de colibrí. Escala 1:1.
Las visitas de D. humeralis a P. nitida, las cuales predominaron significativamente, podrían generar efectos negativos directos a la planta (Arizmendi, 2001, Rojas-Nossa, 2007), ya que el ave no aporta al transporte de polen, consume la recompensa para los verdaderos polinizadores y probablemente destruye los órganos reproductivos de las flores. Por otra parte, su comportamiento territorial y agonístico contra otras aves como E. vestita y P. cyanopterus (obs. pers.), impidió que dichas especies visitaran las flores de P. nitida en diferentes ocasiones, disminuyendo en consecuencia la probabilidad de que cumplieran su función de polinizadores, lo cual podría afectar el éxito reproductivo de la planta debido a la falta de transporte de polen.
Los resultados de esta investigación mostraron que P. nitida y P. trianae tienen mecanismos florales de la fenología y la distribución espacial que permiten la partición del servicio de polinización. Estos aspectos favorecen las visitas por una amplia gama de especies de colibríes que a su vez, pueden depositar el polen en diferentes partes del cuerpo de acuerdo a su tamaño y estrategia de forrajeo, evitando la mezcla de polen y favoreciendo su transporte y deposición adecuado en flores coespecíficas. La segregación espacial de hábitats y de altitud a nivel local crea un patrón de distribución importante que favorece el uso del servicio de visitantes en diferentes espacios y así mantienen la coexistencia a una escala regional que favorece la polinización. La separación temporal en los picos de floración de P. nitida y P. trianae favorece el aprovechamiento de las visitas por aves durante diferentes épocas del año, aspecto que contribuye a la coexistencia y a la utilización del servicio de polinizadores de estas 2 especies de plantas en el tiempo.











 text new page (beta)
text new page (beta)


