Introducción
Uno de los factores que más influyen en la pérdida de la biodiversidad es la fragmentación de los bosques para el establecimiento de actividades productivas como la agricultura, la minería y la ganadería (Newbold et al., 2015). El reemplazo del bosque por este tipo de actividades modifica la cobertura vegetal, transforma el uso de suelo y altera las variables ambientales, e induce cambios en la composición y estructura de las comunidades biológicas (Harvey y Sáenz, 2008). A pesar de esto, ciertas configuraciones de la matriz del paisaje pueden contribuir a la preservación de la diversidad biológica y al mantenimiento de las funciones y servicios ecosistémicos (Tscharntke et al., 2012). Lo anterior fue demostrado por Gascon et al. (1999) y Mendenhall, Sekercioglu, Brenes, Ehrlich y Daily (2011), quienes encontraron que en matrices de uso agrícola y ganadero en las cuales se preservaron fragmentos de bosque de diferentes tamaños (primarios y secundarios), cercas vivas, matorrales de crecimiento temprano, cultivos de árboles frutales y de madera para corte; son elementos que permiten mantener la riqueza de especies en la matriz.
Este tipo de configuraciones permite que algunas especies del bosque puedan circular por estos hábitats y acceder a la matriz en busca de recursos o para otras actividades como la reproducción (Mendenhall et al., 2011). Sin embargo, la conservación de fragmentos de bosques nativos es vital para mantener las especies que no son capaces de acceder a la matriz, ya que tienen requerimientos de hábitat, recursos y condiciones ambientales que solo se encuentran en los fragmentos de bosques (Fahrig, 2002, 2003; Gascon et al., 1999; Mendenhall et al., 2011).
En el neotrópico, una de las formaciones boscosas que presenta fuertes tasas de transformación para el uso humano es el bosque seco tropical (BST) (Portillo-Quintero y Sánchez-Azofeifa, 2010; Sánchez-Azofeifa et al., 2005). La fertilidad de sus suelos, las condiciones climáticas favorables para la agricultura y la ganadería y áreas relativamente planas son características por las que el BST ha sido fuertemente fragmentado (Becknell, Kissing-Kucek y Powers, 2012; Dirzo, Young, Mooney y Ceballos, 2011). Aunque el BST ha sido sometido a fuertes transformaciones, aún quedan grandes extensiones en Suramérica, siendo Colombia el cuarto país con mayor presencia de esta formación boscosa (Portillo-Quintero y Sánchez-Azofeifa, 2010). No obstante, la situación del BST en Colombia es crítica, ya que de su cobertura original (8,882,854 ha) solo queda el 8%, del cual un gran porcentaje se encuentra en zonas de alto uso ganadero y agrícola, lo que aumenta la posibilidad de pérdida de cobertura (García, Corzo, Isaacs y Etter, 2014). Sin embargo, la preocupación más grande es la falta de conocimiento que se tiene de las comunidades biológicas y su respuesta a la transformación del BST en áreas de uso humano (Janzen, 1988), razón por la cual se hace necesario realizar estudios que contribuyan a ampliar este conocimiento (Derroire et al., 2016).
En el neotrópico, numerosos trabajos se han realizado con el fin de determinar el efecto de la transformación de los boques en áreas de uso humano sobre la diversidad y distribución de la biota (Harvey y Sáenz, 2008). Estos trabajos toman como foco de estudio grupos indicadores, debido a que son capaces de aportar una mayor cantidad de información ecológica sobre el estado actual de los hábitats (Halffter, Moreno y Pineda, 2001). Uno de estos grupos son los coleópteros coprófagos de la subfamilia Scarabaeinae (Spector, 2006); debido a que son especies de fácil captura, se ha avanzado en su taxonomía, por lo que su identificación puede ser sencilla para ciertos grupos, y además son abundantes en la mayor parte del año en ciertos lugares (Scholtz, Davis y Kryger, 2009). El uso de este grupo de insectos también se debe a que han permitido registrar el efecto de las actividades humanas sobre la diversidad, demostrándose que incluso pequeños cambios naturales que modifiquen la estructura vegetal y las condiciones ambientales dentro de sus hábitats causan cambios en su composición y estructura (Bicknell et al., 2014; Scholtz et al., 2009), así como en sus funciones ecosistémicas: remoción de estiércol, reciclaje de la materia orgánica y control de los parásitos que se alojan en el excremento (Favila y Halffter, 1997; Halffter y Favila, 1993; Spector, 2006).
Por otra parte, se ha documentado en diversos estudios que los ensamblajes de coleópteros coprófagos (Scarabaeinae) en bosques maduros sufren modificaciones de su estructura y composición a causa de la transformación de los bosques en áreas de actividades agropecuarias (Scholtz et al., 2009). Estas investigaciones han demostrado una considerable disminución de la riqueza y abundancia de especies desde los bosques hacia los potreros y cultivos, observándose en estos últimos altos valores de abundancia de unas pocas especies y la presencia de especies invasoras, las cuales se ven beneficiadas por las condiciones ambientales, así como también por la poca variedad de recursos que se encuentran en estas coberturas (Arellano, León-Cortés, Halffter y Montero, 2013; Escobar, 2004; Estrada, 2008; Gardner, Hernández, Barlow y Peres, 2008; Klein, 1989; Nichols et al., 2007).
De acuerdo con Noriega et al. (2015), para Colombia investigaciones que tengan en cuenta cómo la modificación del hábitat influye sobre las comunidades de escarabajos coprófagos son escasas y se encuentran centralizadas hacia la región andina y las cordilleras Occidental y Central (Escobar, 2004; Escobar y Chacón-de Ulloa, 2000; Medina, Escobar y Kattan, 2002; Neita y Escobar, 2012; Noriega, Realpe y Fagua-González, 2007; Noriega, Palacio, Monroy y Valencia, 2012; Otavo, Parrado-Rosselli y Noriega, 2013). De esta manera, se han dejado a un lado zonas como la región Caribe, de donde hasta ahora se tienen 6 publicaciones. Lo anterior evidencia una falta de información sobre la dinámica y mantenimiento de la diversidad de los escarabajos en matrices de uso antrópico y hábitats originales, como el BST.
Los pocos trabajos publicados (Barraza, Montes, Martínez y Deloya, 2010; Delgado-Gómez, Lopera y Rangel, 2012; Navarro, Román, Gómez y Pérez, 2011; Rangel-Acosta, Hernández, Gutiérrez-Rapalino, Gutiérrez-Moreno y Borja-Acuña, 2016) demuestran que la riqueza de especies en cultivos, potreros y fragmentos de bosque intervenidos es inferior a la de los bosques nativos no perturbados. Además, se ha observado que las áreas de uso humano presentan una alta dominancia de pocas especies y la temporalidad es un factor que influye en los atributos de los ensamblajes de los escarabajos coprófagos en el BST. Durante la temporada de lluvias la riqueza y abundancia de este grupo de insectos aumenta, y disminuye drásticamente en la temporada seca, por lo que la temporalidad es un factor a tener en cuenta cuando se trabaja con comunidades de escarabajos coprófagos en el BST (Janzen, 1983; Medina y González, 2014).
El objetivo de este trabajo fue analizar la variación espacio-temporal de los ensamblajes de escarabajos copronecrófagos (Scarabaeidae: Scarabaeinae) en fragmentos de bosque seco y la matriz adyacente en el departamento del Atlántico, Colombia, con el fin de generar información sobre cómo inciden los sistemas productivos sobre la fauna de escarabajos coprófagos y cómo estos pueden contribuir en el mantenimiento y conservación de este grupo de insectos.
Materiales y métodos
El trabajo se realizó en 3 localidades en el departamento del Atlántico-Colombia (Reserva Campesina La Montaña [RCM], Corrales de San Luis [CSL] y Reserva Bijibana [RB]). La RCM se localiza en el municipio de Juan de Acosta a (10°46’08.8” N, 75°0’26.0” O) (fig. 1), a una altitud de 245 m. De acuerdo con Martínez et al. (2010a) y García-Atencia y Martínez-Hernández (2015), el área de bosque comprende 47 ha que actualmente se encuentran declaradas como reserva bajo el sistema de áreas protegidas del departamento del Atlántico (Vargas-Zapata, Boom-Urueta, Seña-Ramos, Echeverry-Iglesia y Martínez-Hernández, 2015). CSL está ubicado en el municipio de Tubará (10°53’50.0” N, 075°00’03.6” O) (fig. 1), a una altitud de 68 m. El área de bosque comprende 29 ha y actualmente afronta altos procesos de fragmentación producto de la expansión de las fronteras agrícolas y ganaderas (Prince, Vargas-Zapata, Salazar y Martínez-Hernández, 2011; Simanca-Fontalvo, Fajardo-Herrera y Martínez-Hernández, 2013). RB está localizada en el municipio de Repelón (10°29’18.3” N, 75°11’22.7” O), a una altitud que oscila entre los 100 y los 226 m (fig. 1). El área boscosa comprende una extensión de 113 ha de bosque secundario según lo registrado por Arteaga, de la Parra, Medellín y Martínez-Hernández (2014), el cual se encuentra en estados tempranos de sucesión de un tiempo aproximado de 15 años.

Figura 1. Localización de los sitios de muestreos: Reserva Campesina la Montaña (RCM), Corales de San Luis (CSL) y Reserva Bijibana (RB), Atlántico, Colombia.
Según la clasificación de zonas de vida de Holdridge (1987), las zonas hacen parte de una formación higrotropofítica correspondiente a un BST, y de acuerdo con Berdugo-Latke, Avella y Rangel (2012), estas áreas corresponden a bosques secos dominados por Hura crepitans L. y Terminalia amazonia L. Teniendo en cuenta la clasificación climática propuesta por Rangel y Carvajal-Cogollo (2012) para la región Caribe, las áreas seleccionadas están dentro de la unidad climática A, subunidad climática A1 (DS2A semiárido con marcada deficiencia de agua durante la temporada seca), donde se presentan montos de precipitaciones anuales de 911 mm. La mayor concentración de lluvias se presenta en mayo y octubre y la menor, en enero, febrero y marzo (Rangel y Carvajal-Cogollo, 2012).
En las áreas aledañas a los fragmentos de bosque y el bosque secundario es común encontrar zonas dedicadas a la agricultura donde se llevan a cabo policultivos que incluyen la siembra de maíz (Zea mays L.), yuca (Manihot esculenta C.), patilla (Citrullus lanatus M y N.), auyama (Cucurbita moschata D.), sorgo (Sorghum vulgare M.), habichuela (Phaseolus vulgaris L.) y gandul (Cajanus cajan H.). También se pueden encontrar áreas destinadas al pastoreo de ganado bovino, equino y caprino (García-Atencia y Martínez-Hernández, 2015). Las áreas de cultivos y potreros están delimitadas por la construcción de cercas vivas, en la cuales es común encontrar árboles de interior de bosque como camajón (Sterculia apetala K.) y ceiba de agua (Pseudobombax septenatum D.), ceiba blanca (Hura crepitans L.), yarumo (Cecropia peltata L.) y olivo (Capparis odoratissima J. y C. indica L.).
En cada localidad se realizaron 6 muestreos: 2 en la temporada de primeras lluvias, 2 en fuertes lluvias y los restantes durante la temporada seca. Para la captura de los especímenes se ubicó un transecto lineal en el fragmento de bosque (B), y en cada uno de los hábitats que conforman la matriz: cultivos (C), potreros (P) y cercas vivas (CV), siguiendo la metodología propuesta por Barraza et al. (2010) y Filgueiras, Tabarelli, Leal, Vaz-de Mello y Iannuzzi (2015). Cada transecto tuvo una distancia de 450 m, donde se ubicaron 10 puntos de muestreo distanciados 50 m, instalándose en cada uno una trampa Pitfall (trampa de caída) con modificaciones según lo descrito por Martínez, García, Pulido, Ospino y Narváez (2009). Las trampas fueron cebadas con una mezcla de excremento humano y vísceras de ganado en descomposición y permanecieron en el campo durante 24 h. El tiempo de permanencia de la trampa en el campo obedece a que varias investigaciones realizadas en fragmentos de BST (Barraza et al., 2010; Martínez et al., 2010a; Martínez et al., 2010b; Rangel-Acosta, Blanco-Rodríguez, Gutiérrez-Rapalino y Martínez-Hernández, 2012; Rangel-Acosta, Hernández et al., 2016) han demostrado que este tiempo es suficiente para capturar entre el 95-100% de la riqueza de un sitio de muestreo. Por otra parte, Barraza (2014) demostró que no existe diferencia en la riqueza de especies entre muestreos de duración de 24, 48 y 72 h en fragmentos de BST, sosteniendo que un muestreo de 24 h es suficiente para una buena estimación de la riqueza de especies.
El material recolectado fue lavado, preservado en alcohol al 70% y rotulado teniendo en cuenta las especificaciones realizadas por Villareal et al. (2004) y trasladado al laboratorio de Zoología de la Universidad del Atlántico para su identificación. Los escarabajos se identificaron con las claves taxonómicas propuestas por Medina y Lopera (2000) y Vaz-de Mello, Edmonds, Ocampo y Schoolmeesters (2011) para géneros, y para especies, las propuestas por Delgado y Kohlmann (2007), Edmonds y Zídek (2010, 2012), Génier (2009), González-Alvarado y Vaz-de-Mello (2014), González, Molano y Medina (2009), Kohlmann y Solís-Blanco (1997, 2001), Solís-Blanco y Kohlmann (2002, 2004), Vitólo (2000) y Sarmiento-Garcés y Amat-García (2014).
La medición de las variables ambientales fue realizada en cada uno de los hábitats de las 3 localidades por cada muestreo. Para ello, en cada punto de muestreo con una frecuencia de 30 min se registraron datos de temperatura del suelo (termómetro de suelo) y ambiental, humedad del suelo (higrómetro de suelo) y del ambiente, intensidad lumínica (luxómetro Extech), compactación del suelo (penetrómetro) y cobertura vegetal (densitómetro esférico Forestry). Para el caso de temperatura y humedad ambiente se utilizaron registradores de datos (RHT10: USB Datalogger: Extech). Por otra parte, en cada sitio de trabajo se instaló un pluviómetro (marca Hellman) con el fin de registrar los datos diarios de precipitación.
Análisis de datos
La riqueza se determinó como el número de especies y la abundancia como el número de individuos recolectados por hábitats, localidad y temporada de muestreo. Para establecer si existe un patrón espacio-temporal de la riqueza y diversidad de escarabajos entre los hábitats se utilizó un análisis de interpolación y extrapolación propuesto por Chao et al. (2014), utilizando los números de Hill (Hill, 1973) en unidades del número efectivo de especies siguiendo lo propuesto por Jost (2006). Se calcularon los valores de diversidad verdadera: 0D (riqueza especies), 1D (el exponencial del índice de Shannon) y 2D (el inverso del índice de Simpson) (Jost, 2006). La diversidad calculada fue comparada usando los intervalos de confianza del 95% y realizando una comparación visual basada en la superposición de los intervalos de confianza para establecer si existen diferencias entre los fragmentos de bosque seco y los hábitats de la matriz adyacente durante las temporadas de muestreos. El análisis fue realizado con el script «iNEXT» para R Studios (Chao et al., 2014) y ejecutado en el programa R versión 3.1.1 (R Development Core Team, 2014).
Para evidenciar si la abundancia de especies es afectada por el tipo de hábitat o por la temporada se utilizó un modelo lineal generalizado utilizando como variable dependiente la abundancia y como variables de efectos el tipo de hábitat y la temporalidad. Debido a que los datos provienen del conteo de las abundancias de la especies se utilizó el modelo de distribución de error Poisson. Este análisis fue realizado con el programa R, utilizando el paquete «VEGAN» (Oksanen et al., 2007).
Con el fin de observar la distribución espacial y temporal de la estructura de Scarabaeinae por fragmentos de bosque seco y los hábitats adyacentes, fue realizado un análisis de escalamiento multidimensional no-métrico (nMDS). Para realizar el nMDS se utilizó el índice de disimilitud de Bray-Curtis, debido a que sirve para encontrar relaciones de disimilitud entre sitios y distancias ecológicas entre especies (Faith, Minchin y Belbin, 1987). El rango de este índice está entre cero (0) y uno (1), donde 0 significa que los 2 sitios tienen la misma estructura y 1 significa que los 2 sitios no comparten ninguna especie. Este análisis fue realizado con el programa R, utilizando los paquetes «MASS» (Venables y Ripley, 2002) y «VEGAN» (Oksanen et al., 2007). Para determinar si los agrupamientos observados en el nMDS presentan diferencias, se utilizó un ANOSIM a una vía (análisis de similitud). Esta prueba es utilizada porque tiene en cuenta el aporte que cada especie hace a la composición y estructura a través de su abundancia. Para realizar este análisis se utilizó el programa PRIMER 6.0 (Clarke y Warwick, 2001).
Con el fin de evaluar el potencial de las especies de escarabajos coprófagos como indicadoras de hábitat se utilizó el análisis del valor indicador (IndVal) propuesto por Dufrêne y Legendre (1997). Este estadístico utiliza una matriz de abundancia de especies para evaluar el grado con que una especie exhibe especificidad (presencia única de la especie por un tratamiento) y fidelidad (frecuencia de ocurrencia en un particular tratamiento). Para realizar este análisis se usó el programa R versión 3.1.1 usando el paquete «labdsv».
Por último, para determinar cómo las variables ambientales medidas pueden estar explicando la variación de la composición y estructura de los escarabajos copronecrófagos en los fragmentos de bosque seco y los hábitats de cada matriz adyacente, se realizó un análisis de correspondencia canónica (ACC). Para este análisis fueron excluidas las especies que aportaron poco a la abundancia (< 10 individuos). Por otro lado, con el fin de evitar la colinealidad entre las variables se realizó un análisis de correlación, y las variables que presentaron correlación superior a 0.7 con otras fueron excluidas del análisis. Este análisis se realizó con el programa R y los paquetes «MASS» (Venables y Ripley, 2002) y «VEGAN» (Oksanen et al., 2007).
Resultados
Se capturaron 34,170 individuos agrupados en 15 géneros y 32 especies. Los géneros más diversos fueron Canthon Hoffmansegg (1817), con 7 especies, y Dichotomius Hope (1838) y Onthophagus Latreille (1802), con 4 especies cada uno. La suma de las especies de los 3 géneros representa el 47% del total de la riqueza capturada.
La mayor riqueza fue registrada en RCM, con 28 especies, seguido de CSL y RB, con 25 y 24 especies, respectivamente. Los mayores valores de abundancia fueron registrados para la RCM, con 14,083 individuos, seguido de RB, con 13,619, y por último CSL, con 6,468 individuos. Canthon aff. morsei (Howden, 1966) (6,656 individuos), Uroxys deavilai (Delgado y Kolhmann, 2007) (5,511), Canthon juvencus (Harold, 1868) (1,298) y Onthophagus marginicollis (Harold, 1880) (1,239) fueron las especies más abundantes. La suma de los individuos de estas especies aportan el 63.3% de la abundancia total capturada y sus valores máximos fueron durante las primeras lluvias. Todas las especies mencionadas fueron abundantes en los fragmentos de bosque, a excepción de Onthophagus marginicollis, la cual presentó mayores abundancias en cultivos, potreros y cercas vivas (Material suplementario, tablas A1-A3).
Las especies menos abundantes fueron Dichotomius amicitiae (Kohlmann y Solís, 1997), D. annae (Kohlmann y Solís, 1997), D. costaricensis (Luederwalt, 1935), Eurysternus plebejus (Harold, 1880), Malagoniella astyanax (Olivier, 1789) y Trichillidium pilosum (Robinson, 1948), las cuales suman en conjunto 20 individuos, lo que corresponde al 0.63% de la abundancia total capturada.
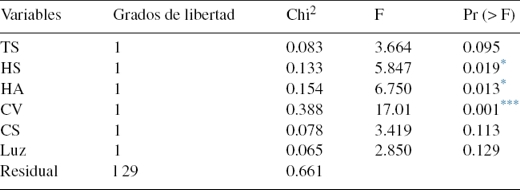
Los mayores valores de riqueza y diversidad se presentaron durante las primeras lluvias, cuando aumentaron la precipitación, cobertura vegetal, humedad del suelo y disminuyeron la temperatura del suelo y ambiente (Material suplementario, tabla A4). La menor riqueza fue observada durante el periodo seco (fig. 2), cuando la precipitación, cobertura vegetal y humedad del suelo disminuyeron y aumentaron la temperatura del suelo, ambiente y luz (Material suplementario, tabla A4).
CSL: Corrales de San Luis; RB: Reserva Bijibana; RCM: Reserva Campesina La Montaña.
B: fragmento de bosque; C: cultivo; CV: cercas vivas; P: potrero.
Figura 2. Análisis de la diversidad 0D (A), 1D (B) y 2D (C) para cada uno de los fragmentos de bosque seco y los hábitats de su matriz adyacentes, durante las temporadas de muestreos.
En términos de 0D, se observó que el mayor número de especies (22) fue capturado durante las primeras lluvias en las cercas vivas de la RCM, mientras que los menores valores fueron registrados en los hábitats de cultivos (2 especies) y potrero (una especie) en CSL durante la temporada seca (fig. 2A). Al realizar las comparaciones se encontraron diferencias significativas con los otros hábitats independientemente de la temporada (fig. 2A). Por otra parte, las cercas vivas y los potreros presentan valores de riqueza iguales o superiores a los fragmentos de bosque, e incluso la riqueza de especies del potrero de la RCM durante las lluvias fue significativamente alta en comparación con otros hábitats para la misma temporada. Por otro lado, durante la temporada de lluvias los 4 hábitats de la RB no presentaron diferencia en cuanto a la riqueza de especies (fig. 2A). Este análisis también mostró que la riqueza de escarabajos disminuye conforme desaparecen las lluvias, observándose que para las temporadas con presencia de lluvias el número de especies osciló entre 13 y 22, mientras que para el periodo seco solo se registraron entre una y 10 especies.
Respecto a la diversidad 1D, los valores altos se presentaron para el fragmento de bosque de CSL durante las primeras lluvias (9.4 especies efectivas), mientras que los menores se registraron durante la temporada seca para todos los hábitats de CSL (2 especies efectivas). Ambos valores descritos presentaron diferencias significativas (IC 95%) con los otros hábitats independientemente de las temporadas (fig. 2B).
Teniendo en cuenta la diversidad 2D, los mayores valores fueron observados durante las primeras lluvias para las cercas vivas y el fragmento de bosque en CSL (6.5 y 6.7 especies efectivas, respectivamente) y los más bajos se registraron para todos los hábitats en CSL durante la temporada seca (1.7 especies efectivas). Al realizar las comparaciones se determinó que los valores difieren a los observados para los otros hábitats analizados independientemente de las temporadas (fig. 2C).
Variación espacial y temporal de la abundancia de escarabajos coprófagos
Con el modelo lineal generalizado se pudo observar que el tipo de hábitat (χ2 = 3221.4, gl = 3, p = 0.000), la temporada de muestreo (χ2 = 5721.1, gl = 2, p = 0.000) y la interacción de ambos (temporada*hábitats) (χ2 = 314.7, gl = 6, p = 0.000) influyen sobre la abundancia de los Scarabaeinae. Se observó que esta disminuyó desde los fragmentos de bosque hacia los hábitats de uso humano, ya que la abundancia de los fragmentos supera por más del 60% a la registrada en los restantes hábitats. Respecto a las temporadas, las mayores abundancias se observaron durante las primeras lluvias, siendo los fragmentos de bosque de RB y RCM los que presentaron mayor número de individuos (4,857 y 4,684, respectivamente) y los más bajos se registraron en la temporada seca en CSL en cultivos y potreros, respectivamente (3 individuos) (Material suplementario, tabla A1-A3).
Similitud entre las comunidades de escarabajos coprófagos
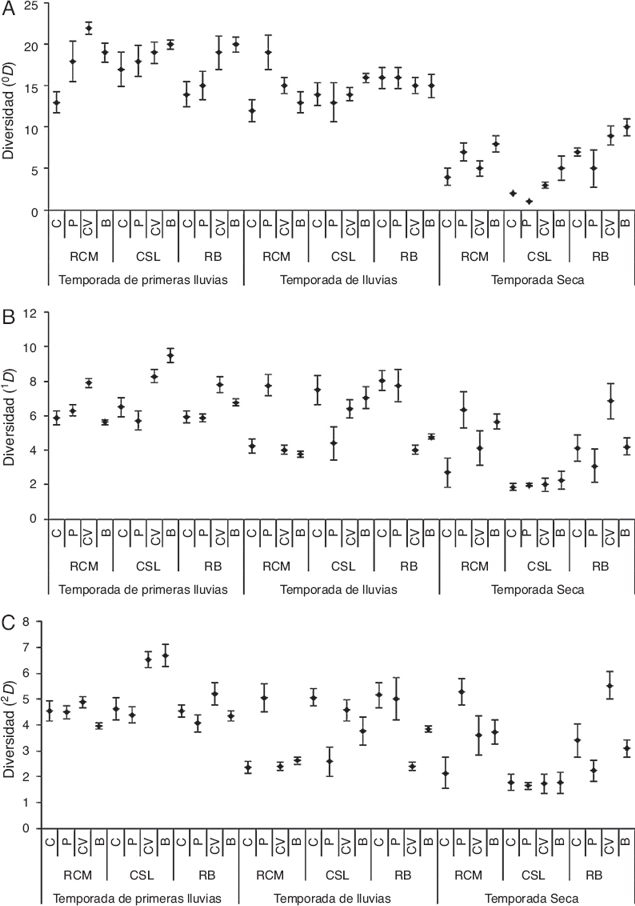
Se observó que los fragmentos de bosques, independientemente de la temporada, presentan diferencias con los hábitats antropizados como cultivos, potreros y cercas vivas (fig. 3A-C). Estos lugares forman grupos que son muy similares entre ellos en cuanto a su composición, sin importar la temporada. Por otra parte, se observó que un grupo de trampas correspondientes al bosque de CSL sin discriminar las temporadas presenta alta similitud con las trampas de las cercas vivas de la RCM, la cual aumenta durante la temporada seca y de lluvias fuertes. En cuanto a los fragmentos de bosque, se observó que presentan diferencias entre ellos en composición durante las primeras lluvias y la temporada seca; sin embargo, durante las lluvias fuertes los fragmentos de CSL y RCM no presentaron diferencias (fig. 3A-C).
CSL: Corrales de San Luis; RB: Reserva Bijibana; RCM: Reserva Campesina La Montaña.
B: fragmento de bosque; C: cultivo; CV: cercas vivas; P: potrero.
Figura 3. Análisis de escalamiento multidimensional no métrico (nMDS) realizado con los fragmentos de bosque seco y los hábitats de su matriz adyacentes para la temporada de primeras lluvias (A), lluvias fuertes (B) y seca (C).
Con el análisis de similitud se determinó que existen diferencias significativas en la estructura de la comunidad entre las temporadas (R = 0.343, p = 0.001). Las primeras lluvias con lluvias fuertes no presentaron diferencias (R = 0.156, p = 0.229), mientras que las primeras lluvias con seca (R = 0.542, p = 0.029) y lluvias fuertes con seca (R = 0.365, p = 0.029) presentaron diferencias. Teniendo en cuenta los hábitats, se determinó que existen diferencias entre ellos (R = 0.14, p = 0.001) en cuanto a la estructura de la comunidad. Los fragmentos de bosques presentan composición y estructura de la comunidad de Scarabaeinae diferente a los cultivos (R = 0.313, p = 0.001), potreros (R = 0.3, p = 0.001) y cercas vivas (R = 0.173, p = 0.001). Los cultivos y potreros no presentan diferencias (R = 0.006, p = 0.06), mientras que las cercas vivas fueron diferentes de cultivos (R = 0.045, p = 0.001) y potreros (R = 0.036, p = 0.001).
Se determinó que, de las 32 especies capturadas, 23 (71.2%) presentan asociación significativa con algunas de las temporadas de muestreos. La temporada de primeras lluvias fue la que presentó mayor número de especies asociadas, con 20 (62.5%), seguida de la temporada de lluvias, con 2 (6.25%), y por último la temporada seca, con 1 (3.1%) (tabla 1). Con este análisis también se observó que 15 especies (Canthon aequinoctialis, C. cyanellus, C. juvencus, C. aff. morsei, Deltochilum guildingii, Eurysternus impresicollis, E. mexicanus, E. plebejus, Onthophagus crinitus, O. landolti, O. lebasi, Phanaeus hermes, P. prasinus, Uroxys boneti y U. deavilai) presentaron asociación significativa a las áreas de bosques, 5 especies (Ateuchus sp. 1, Canthidium sp. 1, Canthon lituratus, Dichotomius aff. agenor y Onthophagus marginicollis) a las cercas vivas, 2 (Diabroctis cadmus y Pseudocanthon perplexus) a los potreros (6.25%) y una (Canthon mutabilis) a los cultivos (tabla 1).
Tabla 1 Análisis del valor indicador (IndVal) para detectar asociación de las especies con las temporadas y los hábitats.

B: fragmento de bosque; C: cultivo; CV: cercas vivas; indcls: valor del indicador para cada especie a su clase máxima; Ll: lluvias; P: potrero; PLl: primeras lluvias; pval: valor p; S: seca.
* Asociación significativa.
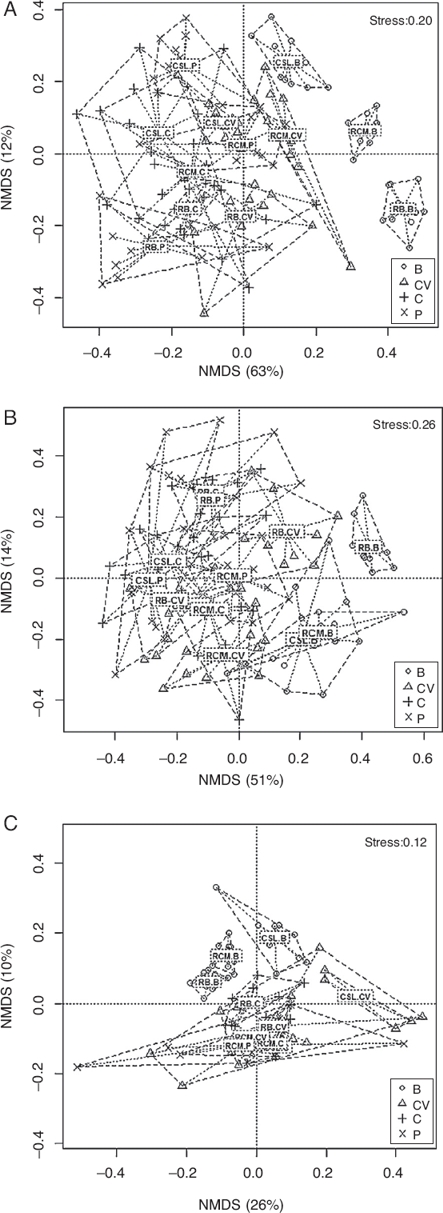
Se determinó que las variables ambientales pueden explicar el 92% de la variación de la comunidad de escarabajos coprófagos en los fragmentos de bosque y sus matrices adyacentes. Lo anterior se encuentra representado en 4 ejes canónicos. El primero explica un 52.3%, el segundo un 19.9%, el tercero un 11.4% y el cuarto un 8.4%. Cada eje de este análisis puede explicar 2 variables (inercia = 2). Las variables que más aportaron a los cambios de la comunidad de escarabajos son cobertura vegetal, intensidad lumínica, compactación del suelo, humedad ambiente y del suelo, observándose que aumentos en la cobertura vegetal y en la humedad del suelo favorecen la riqueza y la abundancia de Scarabaeinae; caso contrario sucede con la intensidad lumínica, la temperatura del suelo y la compactación (fig. 4, tabla 2). Con el análisis de varianza (Anova) realizado al ACC se determinó que la variación observada en este análisis fue significativa (F = 6.590, p = 0.001). También se determinó que la variación observada en los 4 primeros ejes del ACC es significativa (p < 0.05). En cuanto a las variables utilizadas en el ACC, solo cobertura vegetal, humedad ambiente y compactación del suelo resultaron significativas (tabla 3). Por último, las especies que presentaron asociación significativa con hábitats antropizados y el bosque con el índice del valor indicador (IndVal) fueron también discriminadas por el ACC para estos hábitats (tabla 1, fig. 4).
B: fragmento de bosque; C: cultivo; CV: cercas vivas; Ll: lluvias; P: potrero; PLl: primeras lluvias; S: seca.
A. sp.1: Ateuchus sp.1; C. aeq: Canthon aequinoctialis; C. cya: Canthon cyanellus; C. gam: Coprophanaeus jasius; C. juv: Canthon juvencus; C. lit: Canthon lituratus; C. mor: Canthon aff. morsei; C. mut: Canthon mutabilis; C. sep: Canthon septemmaculatus; D. age: Dichotomius aff. agenor; D. cad: Diabroctis cadmus; D. gaz: Digintonthophagus gazella; D. gui: Deltochilum guildingii; E. imp: Eurysternus impresicollis; E. mex: Eurysternus mexicanus; O. cri: Onthophagus crinitus; O. lan: Onthophagus landolti; O. leb: Onthophagus lebasi; O. mar: Onthophagus marginicollis; P. per: Pseudocanthon perplexus; P. pra: Phanaeus prasinus; U. bon: Uroxys boneti; U. dia: Uroxys deavilai.
Figura 4. Análisis de correspondencia canónica (ACC) realizado entre las abundancias de especies de escarabajos coprófagos y las variables ambientales medidas en los fragmentos de bosque seco y los hábitats de su matriz adyacentes.
Tabla 2 Porcentaje de variación explicada, puntajes de las variables y análisis de varianza (Anova) por cada eje en análisis de correspondencia canónica (ACC).
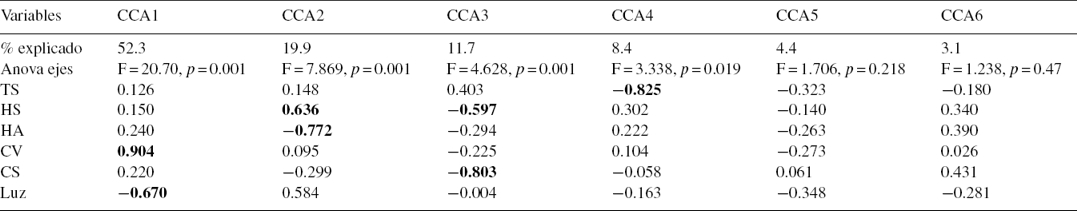
CS: compactación del suelo; CV: cobertura vegetal; HA: humedad ambiental; HS: humedad del suelo; IL: intensidad lumínica; TS: temperatura del suelo.
En negrita las variables que más aportan por cada eje.
Discusión
El número de géneros y especies reportadas en este estudio corresponde al 43 y al 11% de lo registrado por Medina, Lopera, Vítolo y Gill (2001) para Colombia. A escala regional, las especies registradas en esta investigación superan por 2 o más especies a los reportes realizados para otros fragmentos de BST de la región Caribe (tabla 4), mientras que a escala local este trabajo presenta entre 3 y 12 especies más que las registradas para localidades del departamento del Atlántico, aunque es superado en 3 especies por el trabajo realizado por Solís, Noriega y Herrera (2011) (tabla 4). El número de especies registradas en este trabajo con respecto a otros estudios realizados para esta región del país es alto, lo que se debe principalmente a la inclusión de los hábitats adyacentes a los fragmentos de bosque, los cuales contribuyen a mantener una parte de la diversidad de escarabajos. Además, los hábitats que se encuentran alrededor de los fragmentos de bosques presentan especies (Canthon lituratus, C. mutabilis, C. septemmaculatus, Coprophanaeus jasius, Diabroctis cadmus, Dichotomius amicitiae, D. annae, D. costaricensis y Digintonthophagus gazella) que solo son capturadas en este tipo de matrices.
Tabla 4 Estudios realizados con escarabajos coprófagos (Scarabaeinae) en diferentes fragmentos de bosque seco en departamentos del Caribe colombiano.

Los mayores valores de riqueza y abundancia durante los periodos de lluvias y los menores para la temporada seca coinciden con lo descrito para el bosque seco por Barraza (2010, 2014), Busto-Gómez y Lopera (2003), Delgado-Gómez et al. (2012), Medina y González (2014), Navarro, Román, Gómez et al. (2011) y Rangel-Acosta, Blanco-Rodríguez y Martínez-Hernández (2016), los cuales afirman que existe una sincronía de los escarabajos coprófagos con el aumento de las precipitaciones. Otros trabajos, como los realizados por Sowig (1995) y Busto-Gómez y Lopera (2003), demuestran que los Scarabaeinae están más fuertemente influenciados por los cambios que las precipitaciones producen sobre otras variables, como la humedad del suelo, determinándose una relación positiva entre esta última y la eclosión de los escarabajos coprófagos de sus cámara de pupación. Por otro lado, Rangel-Acosta, Hernández et al. (2016) y Rangel-Acosta, Blanco-Rodríguez et al. (2016) determinaron que además de la humedad del suelo, otra variable importante es la temperatura del suelo, ya que su aumento influye negativamente en la riqueza y la abundancia de escarabajos. Además, es la causante de las muertes de las larvas de Scarabaeinae, en especial en las zonas abiertas, donde la temperatura puede alcanzar los 45 °C durante el periodo seco.
Adicional a lo anterior, Noriega, Botero, Viola y Fagua-González (2007) y Wolda (1978) relacionan la estacionalidad de los escarabajos a una mayor oferta de recursos a nivel cuantitativo y cualitativo que se presenta durante las lluvias, debido a que en esta temporada hay una mayor variedad de recursos para los mamíferos, y a su vez estos suministran un recurso de mayor calidad y cantidad para los escarabajos coprófagos.
La mayor riqueza para las cercas vivas en la RCM durante las primeras lluvias puede estar sugiriendo que tanto las especies de Scarabaeinae de bosques como las de áreas abiertas estarían utilizando este lugar para trasladarse dentro de la matriz, lo cual aumenta el número de especies en este hábitat. Los campesinos en el área de estudio construyen y mantienen las cercas vivas con algunas especies vegetales típicas del interior del fragmento de bosque como ceiba (Pseudobombax septenatum D.), ceiba blanca (Hura crepitans L.), camajón (Sterculia apetala K.), yarumo (Cecropia peltata L.) y olivo (Capparis odoratissima J. y C. indica L.), las cuales aportan una alta cobertura vegetal. Resultados similares han sido reportados por Díaz, Galante y Favila (2010), quienes registraron un número alto de especies de escarabajos para las cercas vivas.
Analizando los altos valores de riqueza registrados en las cercas vivas en la RCM y los restantes hábitats antropizados durante las primeras lluvias y las lluvias fuertes surge la siguiente pregunta: ¿cuántas de las especies encontradas en los periodos de lluvias en estos hábitats permanecen activas durante todo el año? Se puede deducir que de las 14 a 22 especies observadas para cultivos, potreros y cercas vivas durante los periodos de lluvias, para la temporada seca solo persisten entre 3 y 9. El caso más severo es el observado para CSL, en el cual la riqueza de especies en la temporada seca para cultivos, potreros y cercas vivas se redujo un 96% y un 85% para el fragmento de bosque, en comparación a la observada en los periodos de lluvias. Esta situación demuestra que muchas especies de escarabajos coprófagos solo colonizan este tipo de matrices cuando las condiciones son favorables y se ven poco afectadas por las variables ambientales. Sin embargo, cuando llega la temporada seca estos insectos buscan refugio en los bosques, donde su integridad física no se ve afectada (Chown y Klok, 2011; Krell-Westerwalbesloh, Krell y Eduard-Linsenmair, 2004; Padilla-Gil y Halffter, 2007). Lo anterior concuerda con lo propuesto por Larsen, Lopera y Forsyth (2008) y Liberal, de Farias, Meiado, Filgueiras y Iannuzzi (2010), quienes explican que las especies típicas de hábitats antropizados son especies oportunistas que aprovechan estos sitios en los momentos favorables para realizar sus procesos de reproducción y alimentación.
En cuanto a la drástica reducción de riqueza, abundancia y diversidad en el fragmento de bosque de CSL, es probable que sea el resultado de los fuertes procesos de alteración a que ha sido sometido. Por ejemplo, el entresacado de madera ocasiona una disminución de gran parte de la cobertura vegetal, en especial durante la temporada seca, cuando no supera el 20%, lo cual deja sin protección a muchas especies de escarabajos que no soportan las altas temperaturas ambientales y del suelo propias de este periodo.
Los análisis de la estructura de la comunidad revelan diferencias entre los hábitats estudiados. También se observó que las abundancias fueron mayores en los bosques que en los sitios antropizados, notándose que esta disminuye en más de un 50% al pasar de los bosques a las zonas abiertas. Se han obtenido resultados similares por Barragán, Moreno, Escobar, Bueno-Villegas y Halffter (2014), Escobar (2004), Gardner et al. (2008), Larsen et al. (2008) y Nichols et al. (2007), quienes resaltan las diferencias entre los hábitats de uso humano y los bosques.
Otra de las razones que limitan la presencia de los Scarabaeinae en las áreas abiertas es la preferencia que algunas especies tienen hacia ciertos recursos como los excrementos de primates, los cuales son más abundantes en los bosques. Gill (1991) propone que, además de los recursos ofertados por los primates, en los bosques es factible encontrar otras fuentes de alimento alternativas como hongos, frutas, carroña e incluso otros tipos de excrementos proporcionados por moluscos terrestres y mamíferos de tamaño pequeño (roedores), los cuales pueden ser utilizados por algunos grupos de escarabajos (Anduaga y Halffter, 1991).
La alta similitud en la comunidad de Scarabaeinae entre los componentes de la matriz (cultivos, potreros y cercas vivas) se debe al alto número de especies compartidas entre estos, los cuales en algunos casos son cercanos a un 95%. Un análisis efectuado a trabajos de este tipo realizados en la costa Caribe colombiana (tabla 4) sugiere que los hábitats antropizados presentan una composición muy similar entre ellos. Resultados similares fueron descritos por Díaz et al. (2010), quienes demostraron que los hábitats de uso humano presentan composición similar y que esta no cambia en relación con la distancia al bosque o entre ellos.
Las especies Canthon lituratus, C. mutabilis, Dichotomius agenor, Onthophagus marginicollis, Pseudocanthon perplexus y Digintonthophagus gazella fueron asociadas a áreas perturbadas, donde se ha demostrado que tienen preferencias por excrementos de mamíferos introducidos como ganado vacuno, cerdo y asno (Busto-Gómez y Lopera, 2003; Martínez, Salcedo, Sierra y Barraza, 2012; Rangel-Acosta et al., 2012). Por otro lado, se observó a individuos de las especies Canthon lituratus y Canthon mutabilis haciendo uso de excrementos de perros en áreas de cultivos, mientras que Pseudocanthon perplexus, Onthophagus marginicollis y Digintonthophagus gazella se avistaron usando excrementos de ganado en los potreros (observación personal). Esta situación estaría dejando en evidencia que su asociación a estos sitios puede estar sujeta a una mayor disponibilidad de recursos aportados por los mamíferos introducidos.
Respecto a las especies indicadoras de bosques, estas han sido reportadas por Barraza (2014), Delgado-Gómez et al. (2012) y Navarro, Roman y Pérez (2011), lo que demuestra que tienen ciertos requerimientos de hábitats y condiciones microclimáticas para establecerse. De acuerdo con Rangel-Acosta, Blanco-Rodríguez et al. (2016), estas especies son sensibles a las altas temperaturas del suelo y ambiente presentes en las áreas de uso humano. Además, Martínez et al. (2012) y Rangel-Acosta et al. (2012) encontraron que especies como Canthon juvencus, Eurysternus mexicanus, E. plebejus, Onthophagu landolti, O. lebasi, Phanaeus hermes y Phanaeus prasinus presentan una clara preferencia por los excrementos de mono aullador rojo (Alouatta seniculus), especie que se encuentra restringida a los bosques. Caso similar fue reportado por Kohlmann y Solís-Blanco (2001) para Onthophagus crinitus, especie restringida al bosque debido a la preferencia por excrementos de mono aullador negro (Alouatta palliata). Estas observaciones estarían soportando la teoría propuesta por Peck y Forsyth (1982), quienes proponen que uno de los factores que limitan la colonización de las áreas abiertas por parte de varias especies de escarabajos coprófagos es la ausencia de excrementos de mamíferos nativos en estos lugares.











 nueva página del texto (beta)
nueva página del texto (beta)