Introducción
En las últimas décadas, los sistemas fluviales han estado sometidos a una fuerte presión antropogénica que ha provocado cambios en la calidad del agua y su biodiversidad. Dentro de las actividades que afectan las cuencas hidrológicas están el ingreso de pesticidas y gran cantidad de material particulado proveniente de actividades agrícolas, la deforestación, la fragmentación del hábitat y el cambio del sustrato por remoción y extracción de materiales, a lo cual se suma el incremento de materia orgánica por ingreso de agua no tratada (Salcedo, Artica y Trama, 2013). Una de las agroindustrias que más contamina el agua en los países en vías de desarrollo es la del café (Woldesenbet, Woldeyes y Chandravanshi, 2014). Tradicionalmente la pulpa del café que resulta del beneficio se deposita en las corrientes de agua, lo que eutrofiza los cuerpos de agua, genera un aumento considerable de la demanda bioquímica de oxígeno, aumenta la carga de sólidos totales, disminuye el pH e incrementa la temperatura del agua (Ferrell y Cockerill, 2012; Haddis y Devi, 2008). Se trata de una forma de contaminación severa que afecta a la flora y fauna acuáticas, que además impide el uso del agua por el hombre para fines domésticos, industriales o recreativos (Álvarez, Hugh, Cuba y Loza-Murguia, 2011; Woldesenbet et al., 2014). Por otro lado, las descargas domésticas afectan las aguas debido a que transportan contaminantes orgánicos, inorgánicos y microorganismos (Daghrir, Drogui y Tshibangu, 2014). El 98% de las aguas residuales domésticas están contaminadas con sólidos suspendidos, compuestos no biodegradables, metales y nutrientes, entre otros (Teixeira-Correia, Sánchez-Ortiz, Gebara, Dall’Aglio-Sobrinho y Matsumoto, 2013). Dentro de las afectaciones más importantes está el enriquecimiento por fosfatos y nitratos, ya que estos favorecen el crecimiento de los microorganismos y plantas que se encuentran en la base de las redes tróficas acuáticas (Rivas et al., 2009). El fósforo en las descargas domésticas proviene principalmente del uso de detergentes y de los excrementos humanos (Teixeira-Correia et al., 2013).
Las actividades humanas son reconocidas como una de las principales amenazas para los ambientes acuáticos (Allan, 2004). Sin embargo, el cómo proteger y remediar la degradación de los cuerpos de agua sigue siendo un tema inconcluso debido a la variedad de factores, escalas y procesos ecológicos involucrados (Wahl, Neils y Hooper, 2013). Por lo tanto, es necesario generar más datos que permitan definir con claridad la naturaleza y magnitud de los cambios ambientales en los cuerpos de agua.
Debido al efecto de los contaminantes sobre los organismos acuáticos, estos son comúnmente usados para obtener información sobre la calidad de los cuerpos de agua, tanto en las zonas donde reciben descargas como aguas abajo. Las técnicas y organismos utilizados para evaluar la calidad del agua son muy variados y pueden ir desde la utilización de tejidos de una determinada especie hasta las métricas de los ensamblajes de un grupo de organismos (Gamboa, Reyes y Arrivillaga, 2008). El uso de organismos para monitorear la calidad del agua brinda información complementaria a los análisis químicos, debido a que su respuesta a la contaminación es producto de las condiciones puntuales más las históricas.
El objetivo del presente estudio fue comparar 2 sitios contrastantes del río Huehueyapan del municipio de Coatepec (Veracruz): La Marina-El Trianón (MT) (poco alterado) y Las Puentes (LP) (impactado por descargas domésticas y un beneficio de café), a través del análisis de varios parámetros fisicoquímicos del agua y usando diferentes métricas de los ensamblajes de larvas de odonatos. Ambos sitios presentan también un grado diferencial de afectación de la vegetación ribereña original. La hipótesis de trabajo es que la diversidad será mayor en MT debido a que es la zona con menos impacto humano.
Materiales y métodos
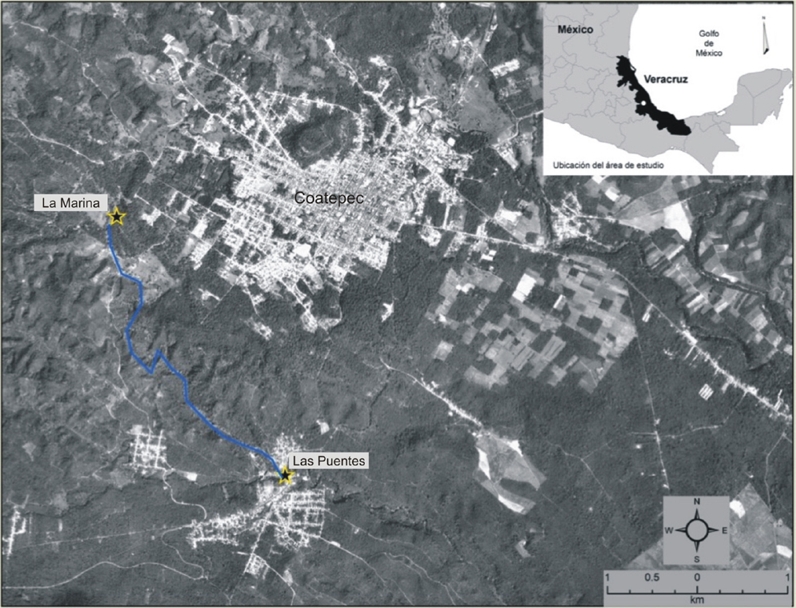
El área de estudio se localiza en el municipio de Coatepec (Veracruz) y pertenece a la subcuenca del río Los Pescados que, a su vez, es parte de la cuenca alta del río La Antigua, que desemboca en el golfo de México (fig. 1; Pérez-Maqueo y Ramos-Escobedo, 2008). La zona presenta una marcada estacionalidad con la época de lluvias entre junio y septiembre, la de nortes entre noviembre y marzo y la de secas entre abril y mayo (Muñoz-Villers y López-Blanco, 2008). El tipo de vegetación presente en la zona es bosque mesófilo de montaña, el cual es la comunidad vegetal más diversa por unidad de área en México (García-Franco, Castillo-Campos, Mehltreter, Martínez y Vázquez, 2008). El bosque mesófilo de montaña en el área de estudio se encuentra en remanentes inmersos en un paisaje compuesto por una matriz de campos agrícolas, potreros, cafetales y asentamientos humanos (Williams-Linera, 2007). Entre 1990 y 2003, el 86.6% del bosque mesófilo de montaña fue transformado en pastizales y cultivos (Pérez-Maqueo y Ramos-Escobedo, 2008). En los ríos de la cuenca alta de La Antigua, la mayor cantidad de descargas contaminantes proviene de la producción de café (beneficios de café), servicios de salud rural y granjas acuícolas (Pérez-Maqueo y Ramos-Escobedo, 2008). Para el muestreo se seleccionaron 2 sitios de aproximadamente 250 m de largo: el menos perturbado se ubica en la zona de MT a las afueras de la ciudad de Coatepec (19°27’09” N, 96°58’53” O; 1,196 m), donde se conservan fragmentos de vegetación ribereña dominada en el estrato arbóreo principalmente por individuos del género Platanus L. (Platanaceae) con presencia de cultivos de café y pequeñas áreas con pastizal; el dosel de la vegetación entre ambas orillas produce un efecto de sombra en alrededor del 50% del tramo estudiado. El sitio impactado está aguas abajo de la zona anterior, a 3.12 km en línea recta, en la comunidad de LP (19°25’36” N, 96°57’52” O; 1,083 m), presenta una fuerte alteración de la vegetación ribereña, la cual consiste principalmente en pastizal, parches de bambú en algunas zonas y algunos individuos de Platanus sp. como remanentes de la vegetación arbórea; en algunas áreas el dosel no se cierra para formar zonas significativas de sombra debido a la construcción de casas, las cuales efectúan descargas domésticas directas al río.
Algunos parámetros fisicoquímicos se midieron in situ mensualmente: oxígeno disuelto (O2, mg/l), pH, conductividad (μS) y temperatura (°C) que se obtuvieron mediante un analizador de agua digital ICM5500; la anchura y profundidad con un flexómetro y la velocidad superficial y bentónica con un flujómetro digital. Otros parámetros fisicoquímicos como amonio (NH4+), nitratos (NO3−), nitritos (NO2−), fósforo total (Ptot), ortofosfatos (PO4-3), sulfatos (SO4-2), turbidez (FTU), iones (K+, Na+, Ca2+, y Mg2+) y alcalinidad (CaCO3) se midieron en laboratorio cada 2 meses a partir de 3 muestras de agua de cada sitio entre febrero y diciembre de 2001. Para la determinación de NH4+, NO3-, No2-, (PT), PO4-3, SO4-2 y la turbidez se utilizaron los métodos de espectrofotometría de HACH. Los valores de K+ y Na+ se obtuvieron mediante flamometría (Corning Mod. 410), Ca2+ y Mg2+ fueron obtenidos mediante espectrofotometría de absorción atómica (Scimadze Mod. AA6501). La alcalinidad se cuantificó mediante colorimetría.
Las larvas de Odonata se recolectaron mensualmente de enero a noviembre de 2001, con excepción de junio debido a la fuerte corriente del río, que impidió la recolecta. Cada mes se tomaron 9 muestras aleatorias de cada sitio (en total 90 para cada sitio). El muestreo se distribuyó sobre las orillas y el centro del cauce, muestreando de manera aleatoria diferentes microhábitats (bancos de arena, limo, hojarasca, vegetación acuática, raíces de vegetación ribereña, cantos rodados). En el centro se utilizó una red de corriente (kick-net) de 1 m de ancho por 80 cm de altura, removiendo frente a ella el sustrato y las rocas contenidas en aproximadamente 1 m2, mientras que en las orillas se usó una red de mano D-net (0.02 mm abertura), barriendo una superficie aproximada de 1 m2 en cada muestra, con el fin de obtener la mayor cantidad de larvas posibles que representaran y permitieran comparar la diversidad entre los 2 sitios. Los ejemplares se fijaron en etanol al 96% para posteriormente separar y cuantificar las especies con la ayuda de un microscopio estereoscópico. Todos los ejemplares fueron determinados por el segundo autor de este trabajo.
Los datos fisicoquímicos mensuales (medidos in situ) fueron analizados con una T de Hotelling, que es una extensión de la prueba t de Student en el plano multivariado (Manly, 1994). Cuando hubo efecto significativo del sitio, se procedió a realizar contrastes pareados para cada variable con la prueba de Bonferroni. De la misma forma se aplicó una T de Hotelling a los datos fisicoquímicos bimestrales registrados en laboratorio a partir de las muestras de agua. Para comparar la abundancia de larvas entre los 2 sitios de estudio se utilizó una prueba no paramétrica de Kolmogorov-Smirnov (Sokal y Rohlf, 1998). La misma prueba fue utilizada para comparar la abundancia de las especies con mayor número de individuos entre los sitios. De manera similar a las proporciones diseñadas con algunos órdenes de insectos acuáticos, Ephemeroptera + Plecoptera + Trichoptera (EPT) y Ephemeroptera + Trichoptera + Odonata (ETO), muy usadas en el biomonitoreo de la calidad del agua (Washington, 1984), creamos con los datos de las especies más abundantes entre los sitios una proporción para obtener un indicador del estado de perturbación de los sitios. En esta proporción, las especies de Odonata que mostraron establecimiento diferencial entre los sitios fueron consideradas como sensibles a los efectos por perturbación de manera similar a como son considerados los órdenes de insectos en las métricas EPT y ETO. Esta proporción es de uso particular para este cuerpo de agua, dadas la riqueza, composición y abundancia de las especies de Odonata. Para saber si la proporción obtenida era significativamente diferente entre los 2 sitios, se aplicó la prueba de Kolmogorov-Smirnov y se calcularon los intervalos de confianza para MT y LP. Todos los análisis fueron realizados con el programa Statistica versión 7.0. (Statsoft, 2006).
Se usaron curvas de dominancia/diversidad (Whittaker plots, Whittaker, 1965), utilizando el logaritmo de la abundancia de las especies para analizar los tipos de distribución de la abundancia en las comunidades. Los vectores de abundancia de ambos sitios se compararon utilizando la prueba de Kolmogorov-Smirnov (Magurran, 2004; Rex, Kelm, Wiesner, Kunz y Voigt, 2008; Sokal y Rohlf, 2012).
Para comparar la diversidad se usaron los perfiles de diversidad de Renyi (Jakab, Muller, Devai y Tothmeresz, 2002; Tothmeresz, 1995, 1998) sobre la riqueza y equidad de los ensamblajes. Las comparaciones de diversidad fueron hechas de acuerdo con lo propuesto por Southwood y Henderson (2009). La función de Renyi depende del parámetro alfa (α) que, al tomar valores bajos, hace que el método sea extremadamente sensible a las especies raras, mientras que, al aumentar, la diversidad se hace menos sensible a las especies raras y, en los valores más altos, el método solo es sensible a las especies comunes. Cuando se tienen los perfiles de diversidad de 2 ensamblajes y sus líneas se intersectan, significa que uno de los ensamblajes es más diverso en especies raras, mientras que el otro lo es en especies comunes. Los perfiles de diversidad fueron realizados con el programa Species Diversity and Richness versión 3.0. (Seaby y Henderson, 2002). Los índices de diversidad de Shannon (H’), Simpson (D) y Berger-Parker (d) (proporcionados por los perfiles de diversidad de Renyi para valores de α 1, 2 y 4, respectivamente) fueron comparados estadísticamente mediante las pruebas de permutación y «boostraping» implementadas en el programa PAleontological STatistics (Hammer, 2014). Se calculó el número efectivo de especies de acuerdo con Jost (2006). Adicionalmente se calculó la diversidad funcional mediante el índice de Shannon (HDF’) usando las proporciones de especies para las siguientes categorías por ocupación de microhábitat: sujetadores (claspers), fondeadores (sprawlers), soterrados (hiders) y cavadores superficiales (shallow burrowers) (Corbet, 1999). Por otro lado, la similitud entre ambos sitios se calculó para datos de presencia/ausencia mediante el índice de Sorensen y para datos de abundancia con el índice de Bray-Curtis, en ambos casos utilizando el programa PC-ORD 4.5 (McCune y Grace, 2002). Finalmente, se realizó un análisis de correspondencia canónico entre el grupo de variables fisicoquímicas y el de las abundancias de las especies utilizando CANOCO 4.5 (Ter Braak y Smilauer, 2002).
Resultados
Los resultados de los análisis fisicoquímicos del agua se muestran en la tabla 1. La T de Hotelling para las variables registradas in situ indicó diferencia fisicoquímica entre ambas zonas (T = 1,768.9, F8,116 = 25,650.4, p < 0.01); las variables responsables de la diferencia fueron el oxígeno, con mayor promedio en MT y la conductividad y la temperatura, que fueron mayores en LP. Por otro lado, la T de Hotelling para las variables obtenidas en laboratorio resultó también significativa (T = 67.9, F12,16 = 90.52, p < 0.01), con mayores cantidades de amonio, nitritos, ortofosfatos, iones Na+, Ca2+, alcalinidad y turbidez en LP.
Tabla 1 Promedios e intervalos de confianza al 95% para las variables fisicoquímicas in situ de los sitios de estudio y para las variables estimadas a partir de diferentes técnicas en laboratorio.
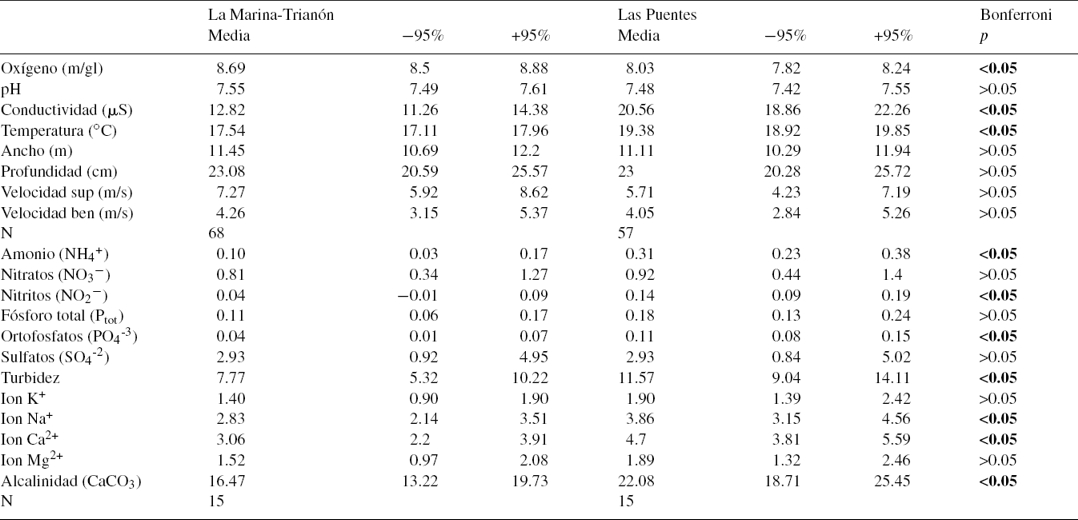
p < 0.05 diferencia significativa entre los sitios, en negrita.
Con relación a la fauna, se recolectó un total de 2,212 larvas de 13 especies incluidas en 4 familias y 7 géneros (tabla 2). Se registraron 11 especies en MT, de las cuales fueron numéricamente dominantes: Hetaerina vulnerata, H. cruentata, Brechmorhoga pertinax y B. tepeaca, mientras que 7 especies (72.73%) conformaron la rareza (especies con abundancia inferior al 1%) de este ensamblaje. En LP se registraron 12 especies, con predominio de H. cruentata, Erpetogomphus viperinus y B. pertinax; las 9 restantes (66.67%) de este ensamblaje se registraron con abundancias inferiores al 1%. Argia anceps y Enallagma sp. se registraron solo en LP, mientras que Argia percellulata solo en MT, con abundancia de un ejemplar en los 3 casos.
Tabla 2 Riqueza, composición, abundancia total y relativa de las especies de larvas de odonatos que conforman los ensamblajes de La Marina-El Trianón (zona limpia) y Las Puentes (zona impactada).
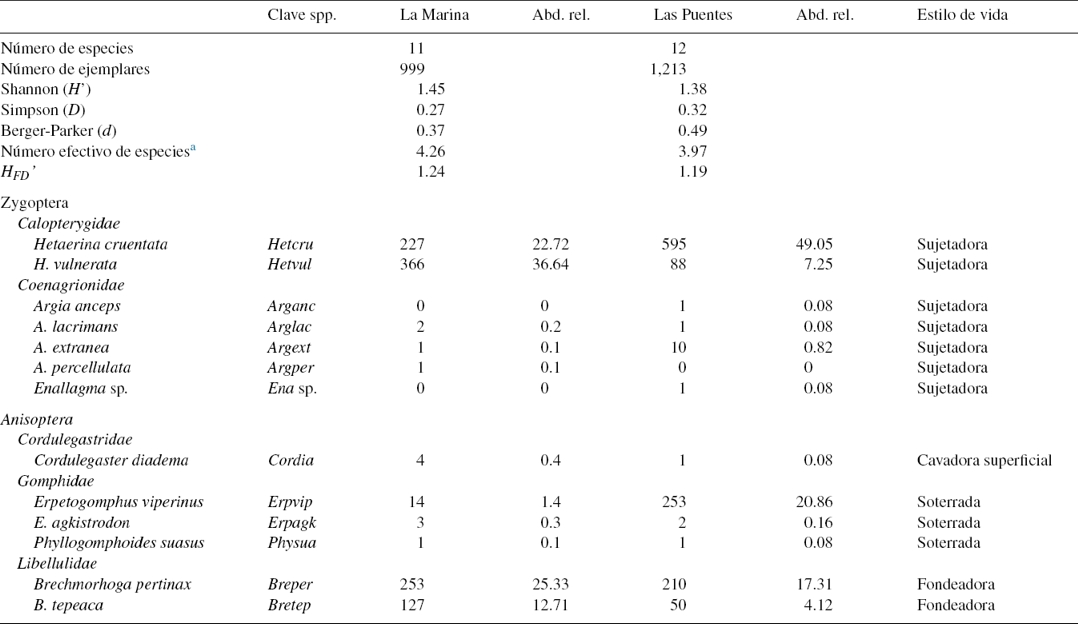
HFD: diversidad funcional.
a Transformación de acuerdo con Jost (2006), para la entropía de Shannon [exp(H)].
No hubo efecto del sitio sobre la abundancia de larvas (K-S test, p > 0.10): los promedios fueron estadísticamente iguales: 11.9 larvas/muestra para MT (DE = 18.24, n = 90) y 18.2 larvas/muestra para LP (DE = 27.96, n = 90). Al analizar la abundancia de H. cruentata, una de las especies más abundantes en ambos sitios, esta resultó estadísticamente diferente (K-S test, p < 0.05) con un promedio de larvas mayor en LP (8.4 larvas/muestra, DE = 21.89, n = 90) que en MT (2.7 larvas/muestra, DE = 9.59, n = 90). H. cruentata conformó casi la mitad de la abundancia de LP (49%), mientras que en MT representó el 22.7%. Otra especie numéricamente importante fue E. viperinus, que tuvo un promedio de larvas significativamente mayor (K-S test, p < 0.001) también en LP (3.9 larvas/muestra, DE = 9.81, n = 90) que en MT (0.17 larvas/muestra, DE = 0.67, n = 90). La proporción de esta especie en relación con el resto de la fauna en LP fue casi del 21% de la abundancia, mientras que en MT fue tan solo del 1.4%. En contraste, la otra especie de Calopterygidae, H. vulnerata, resultó con mayor promedio en MT (4.3 larvas/muestra, DE = 10.16, n = 90) que en LP (1.2 larvas/muestra, DE = 8.31, n = 90) y, finalmente, los libelúlidos Brechmorhoga pertinax y B. tepeaca tuvieron promedios estadísticamente iguales (K-S test, p > 0.05) entre MT (3 larvas/muestra, DE = 10.67, n = 90) y LP (2.8 larvas/muestra, DE = 7.93, n = 90), y MT (1.5 larvas/muestra, DE = 5.24, n = 90) y LP (0.7 larvas/muestra, DE = 2.63, n = 90), respectivamente. Al sumar las proporciones de las 2 especies que mostraron mayores diferencias entre los 2 sitios de muestreo (H. cruentata + E. viperinus), dicha proporción resultó estadísticamente diferente (K-S test, p < 0.001) entre ambos sitios: fue mayor en LP (74%, 12.3 larvas/muestra, DE = 24.80, n = 90) y menor en MT (24%, 2.8 larvas/muestra, 10.03, n = 90). Los intervalos de confianza para estas proporciones indican que en LP se registrarían entre 8 y 16 individuos que pertenecerían a H. cruentata o E. viperinus en un evento de muestreo, mientras que en MT se registrarían entre 0 y 6 individuos de una o ambas especies.
Las curvas de dominancia/diversidad (fig. 2) para los 2 sitios muestreados presentaron una distribución similar de las abundancias de las larvas de odonatos: hubo pocas especies con abundancias de más de 100 individuos y la mayoría de las especies tuvieron abundancias menores a 10 individuos. Sin embargo, las especies numéricamente dominantes fueron distintas entre los sitios. H. vulnerata, la especie más abundante en MT, pasó a ocupar el cuarto lugar en abundancia en LP, mientras que la especie más dominante en LP, H. cruentata, ocupó el tercer lugar en abundancia en MT. De igual forma, la segunda especie con mayor abundancia en LP, E. viperinus, ocupó el quinto lugar en abundancia para MT. Al comparar los vectores de abundancia para los 2 sitios, la prueba de Kolmogorov-Smirnov no evidenció diferencia entre ambos ensamblajes (p > 0.05), lo que indica una distribución similar de la abundancia de las especies.
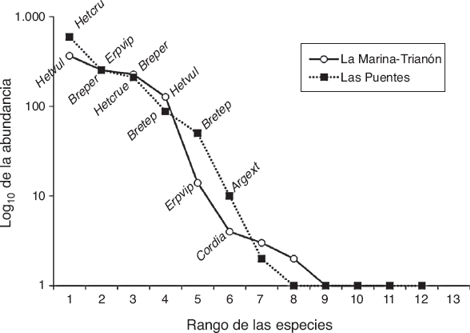
Figura 2. Curvas de dominancia/diversidad para los ensamblajes de larvas de odonatos de La Marina-El Trianón y Las Puentes. Clave de las especies en la tabla 2.
En cuanto a los perfiles de Renyi, MT y LP mostraron curvas similares, las cuales se intersectaron (fig. 3). Sin embargo, LP mostró ser el sitio con mayor diversidad de especies raras, al presentar valores más altos con un bajo, mientras MT mostró tener mayor diversidad de especies comunes, al tener mayor diversidad con los valores altos de α. Al obtener la diversidad relativa de los ensamblajes en los sitios muestreados, el índice de Shannon mostró a MT como el sitio más diverso comparado con LP (permutación p = 0.02, boostraping p = 0.03), mientras que los índices D y d mostraron mayor dominancia en LP (permutación y boostraping p < < 0.01 para ambos índices). El número efectivo de especies (true diversity) fue mayor para MT con 4.26, mientras LP obtuvo 3.97, indicativo de que la odonatofauna de LP es el 93.19% de la fauna de MT. La diversidad funcional (HDF’) de la MT fue 1.24 mientras que la de LP fue de 1.19. Se puede decir que la diversidad funcional de LP esta reducida en un 3.38%. La similitud entre los 2 sitios por datos de presencia-ausencia resultó del 77% (similitud de Sorensen), mientras que, considerando la abundancia, fue de 54% (similitud de Bray-Curtis).

Figura 3. Perfiles de diversidad de Renyi para los sitos de estudio del río Huehueyapan, Las Puentes y La Marina-El Trianón en Coatepec.
En el análisis de correspondencia canónico (fig. 4) el conjunto de ejes extraídos en el análisis resultó significativo (traza = 0.899, F = 2.07, p = 0.036). El primer eje explicó el 49.8% de la variación de los datos y el segundo, el 9.8%. En conjunto, los 2 primeros ejes explicaron el 69.6% de la variación de los datos de las especies. La profundidad parece ser la variable más asociada con el eje 1, mientras que el oxígeno, temperatura y conductividad fueron las variables mejor asociadas con el eje 2.
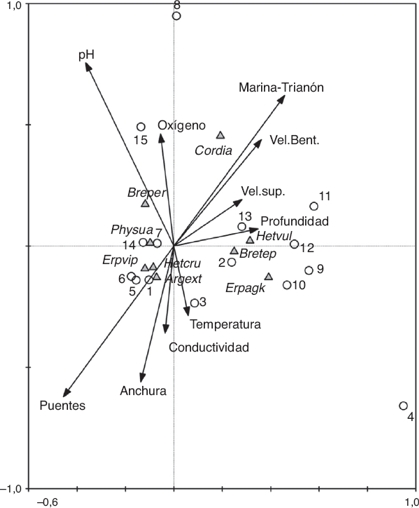
Figura 4. Triplot generado por los 2 primeros ejes del análisis de correspondencia canónico que muestran la proyección de las especies de odonatos, las muestras y variables fisicoquímicas de los 2 sitios de estudio del río Huehueyapan. En el análisis solo se incluyeron las especies con las mayores abundancias. Las variables más importantes son aquellas que presentan flechas más largas. Las muestras 1-7 son de Las Puentes y las 8-15 son de La Marina-Trianón.
Discusión
De los parámetros medidos mensualmente, las características físicas de los sitios (anchura, profundidad y velocidad del cauce) no mostraron diferencias hidrogeomorfológicas, lo que se puede explicar como un resultado de la relativa cercanía entre los sitios. Mientras tanto, la mayoría de los parámetros químicos medidos mensualmente sí las tuvieron. La mayor temperatura y conductividad en el sitio más perturbado (LP) pudo deberse a factores relacionados con la perturbación (Teittinen, Taka, Ruth y Soininen, 2015). Al no haber o estar disminuida la vegetación ribereña, la temperatura de los cuerpos de agua se incrementa debido a la incidencia directa de los rayos solares (Sweeney y Newbold, 2014). De igual forma, la mayor conductividad en sitios perturbados ha sido reportada y se asocia con la mayor entrada de materia orgánica, nutrientes y mayor concentración de iones producto del impacto humano y también con la mayor entrada de sedimentos debido a la falta de vegetación ribereña (Reis-Oliveira, Nogueira y Sartori, 2014; Ternus, Souza-Franco, Anselmini, Mocellin y Dal Magro, 2011). Sin embargo, observamos que la mayor conductividad registrada y relacionada con LP (fig. 4), producto de una mayor cantidad de sales disueltas (aniones de cloruro, nitrato, sulfato y fosfato) (tabla 1), pudo deberse, principalmente, a la entrada de las descargas domésticas, ya que se sabe que la materia orgánica producto del beneficio del café, particularmente los azúcares, lípidos y alcohol, no se disocian fácilmente y son malos conductores (Puerta-Quintero y Ríos-Arias, 2011).
La mayor concentración de oxígeno disuelto en el sitio menos perturbado (MT) también coincide con lo registrado en otros estudios (Salcedo et al., 2013) y se asocia a la mayor cobertura vegetal, que disminuye la temperatura, y a la menor concentración de nutrientes (Felipe-Sotelo, Andrade, Carlosena y Tauler, 2007; Welch, Jacoby y May, 1998). En conjunto, los parámetros fisicoquímicos anteriores confirman a LP como el sitio con mayor perturbación. Aunado a lo anterior, los parámetros fisicoquímicos medidos en el laboratorio también mostraron a LP como el sitio más perturbado, al presentar los mayores valores en nutrientes (amonio, nitratos y ortofosfatos), turbidez, alcalinidad y algunos iones (Na+, Ca2+). Todos los parámetros anteriores han sido asociados con la contaminación del agua debido a las descargas domésticas y las áreas agrícolas (Roy, Rosemond, Paul, Leigh y Wallace, 2003; Wetzel, 2001). Estos resultados coinciden también con lo reportado por Pérez-Maqueo y Ramos-Escobedo (2008) para la zona de muestreo, que señalan la producción de café como uno de los mayores aportes de contaminantes de los cuerpos de agua. Otro estudio realizado en la misma zona encontró efectos similares de los cafetales sobre los arroyos, además de lograr asociar los cambios en las características fisicoquímicas con cambios en los ensamblajes de algas (Vázquez, Aké-Castillo y Favila, 2011).
En relación con la odonatofauna, algunas de las comparaciones hechas entre las larvas señalan que ambos sitios contienen ensamblajes muy parecidos, tanto en número de especies como en composición. Por presencia-ausencia, ambos ensamblajes comparten el 77% de sus especies, mientras que la abundancia resulta un factor causal de diferencia importante entre ambos sitios, como lo indica el índice de Bray-Curtis (54%) al evidenciar el hecho de que aun las especies dominantes en ambos sitios resultaron con establecimiento diferencial, lo que puede estar relacionado con la disponibilidad diferencial de recursos necesarios (por ejemplo, raíces y macrofitos emergentes o sumergidos) para la oviposición de aquellas especies de hábitos endofíticos, particularmente el género Hetaerina. Si bien el número de especies que requieren sustratos vegetales vivos para endovipositar y aquellas que presentan oviposición exofítica fueron similares entre los sitios, las mismas especies mostraron tamaños poblacionales diferentes entre LP y MT. Esto podría estar relacionado con la alteración de la vegetación ribereña, que abre espacios a una mayor insolación, lo que favorece a algunas especies como H. cruentata. En otros estudios con odonatos realizados en la misma microcuenca (García-García, 2013), se vio que H. cruentata es más abundante y común en arroyos dominados por pastizales, mientras que H. vulnerata prefiere sitios con vegetación ribereña mejor conservada donde la sombra es mayor y la temperatura del agua es más fría.
Por otro lado, los ensamblajes de larvas de odonatos de ambos sitios estuvieron dominados numéricamente por representantes de los géneros Hetaerina (Calopterygidae), Erpetogomphus (Gomphidae) y Brechmorhoga (Libellulidae). Si bien las métricas de los ensamblajes indican que no existe un cambio sustancial en la diversidad de las larvas de odonatos, el análisis de la abundancia de las especies numéricamente más importantes evidencia los efectos negativos de la perturbación. H. cruentata y E. viperinus tuvieron un promedio de larvas mayor en LP, mientras H. vulnerata lo tuvo en MT. Las diferencias en abundancia que exhiben las especies dominantes entre ambos sitios permiten seleccionar algunas y establecer una proporción conjunta de estas para la vigilancia, al menos, de una posible disminución en la perturbación de LP, ya que al disminuir la contaminación se esperaría un ensamblaje similar al de MT, debido al cambio en las características fisicoquímicas del agua. Se debe comentar que ambos sitios presentan cierto grado de impacto humano, sin embargo, en MT no existen descargas domésticas ni de beneficios de café, si bien la vegetación ribereña original fue sustituida en su mayor parte por cafetales, mientras que en LP sí existen descargas domésticas y de un beneficio de café y la vegetación ribereña también ha sido severamente sustituida por cultivo de café y urbanismo.
Debido a la respuesta diferencial que presentan las distintas especies a la perturbación, que es la base para el biomonitoreo, se espera que la abundancia de algunas especies se vea afectada por determinado tipo de perturbación, como el enriquecimiento orgánico (Rosenberg y Resh, 2008). En este sentido H. cruentata y E. viperinus, que mostraron mayor abundancia en LP, podrían considerarse para el área de estudio especies tolerantes a la turbidez y el enriquecimiento orgánico. Sin embargo, la mayor abundancia de estas 2 especies en LP no debe verse como resultado exclusivo de su tolerancia a la turbidez y del enriquecimiento orgánico, sino que estos parámetros podrían estar actuando como los detonantes de una serie de cambios que generan condiciones favorables para que estas 2 especies aumenten su abundancia. Dentro de los cambios que pudieran estarse generando, está el incremento de macroinvertebrados recolectores (quironómidos, tricópteros), para los que se ha encontrado una relación entre su abundancia y la entrada de materia orgánica (Compin y Cereghino, 2007) y de los cuales se deben estar alimentando principalmente las larvas de estas especies de odonatos. Por lo general, E. viperinus se asocia bien con el limo acumulado bajo las rocas y entre ellas, mientras que H. vulnerata se asocia con la vegetación creciente en las orillas (fig. 4), particularmente con las raíces abundantes y los sitios con mayor corriente. Tanto la acumulación de limo como el crecimiento de vegetación en las orillas de los arroyos se ven favorecidos por la perturbación antrópica, en general, y por la turbidez y el enriquecimiento orgánico, en particular (Jones et al., 2001; Marzin et al., 2012).
Al comparar la diversidad de odonatos entre MT y LP, las especies abundantes tuvieron mayor importancia en MT, lo que podría estar indicando un ensamblaje más equitativo, con más especies con abundancias similares, mientras en LP las especies raras tuvieron un mayor peso, lo que indica pocas especies dominantes (por ejemplo, H. cruentata) y la mayoría de las especies con abundancias bajas. De acuerdo con el número efectivo de especies, la diversidad de odonatos en LP se encuentra reducida en un 7%.
La diversidad funcional mostró en MT mayor número de especies sujetadoras (Argia, Enallagma), soterradas (Erpetogomphus) y cavadoras superficiales (Cordulegaster); sin embargo, en abundancia dominaron las sujetadoras (principalmente H. vulnerata pero también fue abundante H. cruentata) y 2 fondeadoras (B. pertinax y B. tepeaca), mientras que en LP dominaron también en número las especies sujetadoras y las soterradas, pero en abundancia dominaron en orden una sujetadora (H. cruentata), una soterrada (E. viperinus) y una fondeadora (B. pertinax). No hubo diferencias en número de grupos funcionales entre LP y MT, sin embargo, el dominio y asociación de E. viperinus con LP fue evidente (fig. 4). La acumulación de gran cantidad de materia orgánica en el fondo del lecho del río, producto del beneficio de café y las descargas domésticas, favorecieron el hábitat para esta especie, que suele esconderse en el fondo del lecho. Por otro lado, una especie fondeadora, B. pertinax, fue notablemente más abundante en MT. Esta especie requiere fondos del lecho con una combinación de grava gruesa, grava fina y arena y con nula o poca turbidez para posarse y desplazarse sobre el fondo del arroyo, con buena oxigenación y, quizás, con condiciones de pH neutro o ligeramente básico (fig. 4).
Desde el punto de vista de la diversidad funcional, las especies que conforman los ensamblajes perturbados deben contener pocas especies y más relacionadas, que posean gran similitud funcional, mientras que los ensamblajes que experimentan menos disturbios deben contener mayor diversidad de grupos funcionales (Loreau et al., 2001). Las propiedades de los ensamblajes alterados son informativas desde el punto de vista del desempeño de las especies como grupo dentro de su ambiente. Por esta razón, la diversidad funcional es para muchos una medida mejor de estructura-función que una mera medida de estructura, como el índice de Shannon.
Finalmente, debido a la relativa proximidad de los sitios estudiados y a las diferencias encontradas en las características fisicoquímicas del agua, es posible que las diferencias en la diversidad sean el resultado de la perturbación producida por el beneficio de café y las descargas domésticas. Si bien ambos ensamblajes comparten casi todas sus especies, lo que hace suponer que las condiciones particulares de la vegetación ribereña existentes en cada sitio ofrecen a los odonatos adultos similar protección, sitios de percha y sitios para encuentro de sexos, resulta evidente que existen algunas diferencias en las condiciones intrínsecas del agua y en la disposición de sustratos para la oviposición. También es posible que, ante los cambios producidos en la calidad del agua, no estén presentes depredadores de orden superior y que esto pueda favorecer el establecimiento de grandes poblaciones de H. cruentata y E. viperinus en LP. Particularmente, en el caso de los Calopterygidae (Heterina), que se establecen y sujetan de las raíces donde la corriente puede llegar a ser muy fuerte y, por lo tanto, son sitios difíciles para la depredación por peces y anfibios. Asimismo, los diferentes hábitos en los estilos de vida, como en el caso de Erpetogomphus, que se oculta entre el fango y el detrito, los hace pasar inadvertidos para los depredadores.











 nueva página del texto (beta)
nueva página del texto (beta)