Introducción
El conocimiento de la distribución de especies y la riqueza circunscrita en diversas regiones geográficas facilitan la identificación de centros de biodiversidad (hot spots), así como las áreas prioritarias de conservación (Barthlott, Mutke, Rafiqpoor, Kier y Kreft, 2005: Kress et al., 1998; Williams, Prance, Humphries y Edwards, 1996). En México existe un gran número de especies endémicas (véase por ejemplo, Villaseñor, 2016), lo que ha conducido a considerarlas como prioritarias en las estrategias de conservación biológica (Arriaga et al., 2000).
Los inventarios de biodiversidad en diferentes biomas de México son aún incompletos, lo cual limita el conocimiento biogeográfico de las especies que los componen. Como alternativa a los análisis basados en los inventarios de la riqueza de especies, los patrones de distribución también se pueden evaluar mediante la superposición de mapas de distribución geográfica de las especies (Raedig, Dormann, Hildebrandt y Lautenbach, 2010). Existen diferentes métodos para analizar los patrones de distribución y de estimación de la riqueza de especies (Raedig et al., 2010); algunos, como los estimadores desarrollados por Chao (1984), se basan en la abundancia o en la incidencia de las especies (Chao, 2005; Colwell y Coddington, 1994); otros, como los estimadores de tipo Jacknife y bootstrap (Palmer, 1990), consideran la importancia de las especies endémicas en el reconocimiento de sitios prioritarios de conservación debido a la alta vulnerabilidad que presentan a la extinción (Gentry, 1986; Knapp, 2002). Todos ellos indudablemente facilitan la identificación de áreas prioritarias para la conservación de la biodiversidad.
La distribución de la biodiversidad con frecuencia varía dentro de sitios a escala local, entre lugares de una región (mesoescala) o entre regiones a escala global (Menge y Olson, 1990). Se ha sugerido que la variabilidad climática promueve la diversidad biológica, por lo que los factores climáticos se consideran importantes cuando se intenta explicar la variabilidad de la distribución de la biodiversidad en las escalas mencionadas y en la organización de las comunidades (Bowman, Mueller y McGinnies, 1985; Daubenmire, 1979; González-Medrano, 1996; Miles, 1981; Nix, 1986; Nobel, 1994). En el caso de las plantas, también se ha considerado que los factores edáficos tienen relevancia, debido a que intervienen en su desarrollo y crecimiento (Abd El-Ghani, 2000; Rzedowski, 1965; Sharaf y Shaltout, 1985; Yoder y Nowak, 2000); sin embargo, los datos edafológicos no se encuentran fácilmente disponibles para utilizarlos en análisis biogeográficos, en tanto que los datos climáticos se han empleado con mayor frecuencia debido su disponibilidad (por ejemplo, Worldclim [http://www.worldclim.org/] y Uniatmos [http://atlasclimatico.unam.mx/atlas/Docs/indice.html]). Estos datos se han empleado para formar unidades geográficas con alta similitud climática, definidas como dominios climáticos (Londoño-Murcia, Téllez-Valdés y Sánchez-Cordero, 2010; Mackey, Berry y Brown, 2008; Morgan, 2007; Suárez-Mota, Téllez-Valdés y Martínez-Meyer, 2014).
La Sierra Madre Oriental (SMO) (fig. 1) es una cadena montañosa muy importante, considerada una unidad biótica en diferentes propuestas de regionalización (Arriaga et al., 2000; Rzedowski, 1973, 1978). En ella se distribuyen diferentes biomas, que a su vez albergan una alta diversidad biológica; por ejemplo, su riqueza florística se ha estimado en poco más de 6,600 especies nativas (Villaseñor, 2016). De esta riqueza florística, el 13.5% está representada por miembros de la familia Asteraceae, considerada un buen subrogado de la biodiversidad, debido a su alta y significativa relación positiva entre sus especies y los otros componentes de la flora de diferentes regiones de México. En muchos sitios la familia representa con frecuencia el 10% o más de la riqueza florística (Villaseñor, Maeda, Rosell y Ortiz, 2007).

Figura 1 División de México en provincias geomorfológicas. El polígono gris corresponde a la Sierra Madre Oriental subdividida en celdas de 15 min de latitud y longitud. Los puntos blancos indican los sitios donde se han realizado inventarios florísticos.
Los biomas de la SMO se distribuyen en condiciones climáticas contrastantes (por ejemplo, bosques templados o matorrales xerófilos) y de desigual extensión. El matorral xerófilo es el de mayor amplitud, mientras que el bosque húmedo de montaña registra la menor extensión en la SMO. La distribución y extensión de los biomas se ha delimitado con base en su estructura vegetal y hasta la fecha no se ha documentado cuáles son los factores climáticos que diferencian los biomas distribuidos en la SMO. El clima es considerado como un sustituto de la biodiversidad (Londoño-Murcia et al., 2010; Mackey et al., 2008; Morgan, 2007; Suárez-Mota et al., 2014), por lo que probablemente los biomas de la SMO muestren una alta correlación con los dominios climáticos que la componen. Es decir, si son geográficamente equivalentes, los dominios podrían emplearse para determinar los límites geográficos de los biomas de la SMO. Con base en esta hipótesis, los objetivos del presente trabajo fueron identificar las relaciones entre los biomas y los factores del clima, así como estimar la riqueza de especies en cada uno de ellos (biomas y dominios climáticos).
La estrategia es hacer una evaluación de la variabilidad climática de la SMO, a fin de definir los dominios climáticos que la caracterizan y analizar su relación con la diversidad florística representada por la familia Asteraceae en los biomas que ahí se encuentran. La pregunta a contestar es si la variabilidad climática de la SMO explica los patrones de diversidad y endemismo encontrados a lo largo de su territorio. Para esto se planteó una metodología de análisis basada en una clasificación climática, mediante análisis multivariados, utilizando datos obtenidos de las estimaciones de 19 parámetros climáticos a una resolución de 1 km2. Los dominios climáticos obtenidos se emplearon para explicar sus relaciones con los biomas. Las especies de la familia Asteraceae se emplearon para estimar la riqueza florística total, siguiendo 2 estrategias, la primera con la diversidad total y la segunda con el endemismo.
Materiales y métodos
El polígono de la SMO seleccionado para este estudio corresponde al de las provincias geomorfológicas de México reconocidas por la Conabio (1997). Con un sistema de información geográfica (SIG; ArcGIS 10.0) se estimó la longitud de la SMO (aproximadamente 720 km), con una amplitud de aproximadamente 160 km en su parte más ancha (a los 21° N) y con una altitud promedio de 2,000 m snm. La SMO se ubica entre los 19°44’09” y 25°44’44” de latitud norte y los 97°23’50” y 102°15’15” de longitud oeste (fig. 1) y se dividió en 140 unidades geográficas operativas (UGO’s) de 15 min de latitud y longitud. Tal escala representó el mejor compromiso entre la presencia de localidades de recolecta y los vacíos en dicho esfuerzo. Es decir, a escala más fina el número de celdas sin registros era mayor que el de los que sí los registraban.
La lista de especies de la familia Asteraceae se obtuvo principalmente de la revisión de especímenes depositados en el Herbario Nacional (MEXU) del Instituto de Biología, Universidad Nacional Autónoma de México (UNAM), complementada con el estudio de especímenes adicionales resguardados en otras colecciones biológicas nacionales y del extranjero. La mayoría de los especímenes estudiados están disponibles en línea en las páginas de la REMIB (Conabio) y del Instituto de Biología (UNIBIO, UNAM). A partir de la información contenida en las etiquetas de los ejemplares, se obtuvieron las coordenadas geográficas de los sitios en que fueron recolectados. Esta información permitió la generación de una base de datos que se empleó para analizar su distribución geográfica y su relación con los dominios climáticos y los biomas que se distribuyen en la SMO. Con estos datos se elaboró un mapa que muestra los puntos de ocurrencia de las especies seleccionadas sobre el mapa de la SMO dividido en UGO’s (fig. 2).

Figura 2 Distribución geográfica de las Asteraceae en la Sierra Madre Oriental y los inventarios florísticos (puntos blancos) que allí se han realizado.
La generación de los dominios climáticos en la SMO se realizó siguiendo el proceso de clasificación climática empleado en trabajos previos (Cuervo-Robayo et al., 2013; Leathwick, Overton y Mcleod, 2003; Londoño-Murcia et al., 2010; Morgan, 2007; Suárez-Mota et al., 2014). Se emplearon las capas de los 19 parámetros climáticos propuestos por Cuervo-Robayo et al. (2013) a una resolución de 1 km2. Las coberturas digitales de 3 aspectos de terreno (orientación, pendiente y altitud) considerados entre los principales que propician la variación climática en la SMO fueron también utilizados (tabla 1). La información se analizó en el SIG ArcGIS 10.0 (Esri, 2010).
Tabla 1 Parámetros climáticos usados para generar la clasificación de la Sierra Madre Oriental en dominios y regiones climáticas.

Fuente: Cuervo-Robayo et al., 2013.
Para realizar el proceso de clasificación (regionalización climática), se interpolaron los valores de las 22 capas seleccionadas, utilizando un modelo digital de elevación (Inegi, 1997) y el algoritmo «Thin plate smoothing splines», implementado en el paquete ANUCLIM 6.1 (Houlder et al., 2000; Hutchinson, Nix, McMahon y Ord, 1995; Xu y Hutchinson, 2011, 2013). De esta manera, se obtuvieron los valores promedio mensuales de las 19 variables del clima y las 3 de terreno que se encuentran en cada celda de la SMO a escala de 1 km2 con las altitudes correspondientes al modelo digital de elevación. Con esos valores se llevaron a cabo los análisis multivariados para definir grupos de celdas que por su similitud ambiental permitieran definir una regionalización climática de la SMO. En este trabajo, la clasificación de dichos valores ambientales se definió como la regionalización climática, ya que las variables empleadas (19) en su mayoría corresponden a datos de clima.
Los dominios climáticos en la SMO se definieron a través de una clasificación obtenida de un análisis multivariado derivado del conjunto de datos ambientales considerados. Inicialmente se realizó una clasificación no jerárquica y posteriormente una reclasificación jerárquica; en ambos casos, para la transformación de los datos en las matrices se utilizó la métrica de distancias de Gower (Gower, 1971; Londoño-Murcia et al., 2010; Suárez-Mota et al., 2014). La clasificación final se hizo mediante un agrupamiento promedio no ponderado (UPGMA por sus siglas en inglés).
Los valores en celdas de las 22 coberturas digitales fueron usados para construir una matriz de datos en la que se ordenaron las 76,729 celdas en filas y los valores de los 22 parámetros ambientales en columnas. Debido a que el número de datos de la matriz es muy grande, la clasificación multivariada constó de 2 etapas; la primera consistió en una clasificación no-jerárquica, empleando el algoritmo Allocation Methods for Clustering Large Sets of Data (ALOC), que ha mostrado ser muy eficiente, incluso para análisis de millones de datos, integrado en el programa PATN (Belbin, 1987; Londoño-Murcia et al., 2010; Suárez-Mota et al., 2014). El número de grupos que se forman en esta etapa se definen con otro algoritmo implementado en PATN, determinando el número de grupos como resultado de la raíz cuadrada del número de variables (celdas) que analiza. Debido a que se trata de una clasificación no jerárquica, con un amplio número de datos, no es posible generar un dendrograma de agrupamiento. Como resultado, PATN en esta clasificación no jerárquica produce 2 archivos; el primero (denominado row group composition o rgc), permite distinguir a qué grupo fueron asignadas las celdas y así reconocer el dominio al que pertenecen. Posteriormente, este mismo archivo puede ser convertido en otro archivo tipo raster (ARC/INFO ASCIIGRID) para desplegar en un mapa la distribución geográfica de los dominios formados (Belbin, 1987).
El segundo archivo (denominado row group statistics o rgs), contiene un perfil resumido de las características ambientales de cada dominio (valores mínimos, primer cuartil, mediana, promedio, tercer cuartil y valores máximos). Con este archivo se estructura una nueva matriz con los grupos formados (filas) y sus valores estadísticos resumidos (columnas). Esta nueva matriz permite ahora hacer una clasificación jerárquica que resulta en un dendrograma, el cual muestra los dominios agrupados de acuerdo con su semejanza climática (Belbin, 1989). El número de grupos formados puede ajustarse a diferentes valores de similitud, dependiendo de los objetivos del estudio. En este trabajo se consideró que la clasificación buscara una congruencia con los biomas reconocidos en la SMO. Para lo cual se utilizó la clasificación de los tipos de vegetación concentrada en biomas, propuesta por Suárez-Mota y Villaseñor (2011) y Villaseñor y Ortiz (2014). En dichos trabajos los bosques mesófilos de montaña se incluyen dentro del bioma bosque húmedo de montaña. Los 5 dominios (equivalente a 5 biomas) definidos en el análisis se sobrepusieron con el mapa de biomas, con la finalidad de estimar su correspondencia (sobreposición) geográfica y de esta manera evaluar la posibilidad de emplearlos como substitutos de la biodiversidad.
El mapa que muestra la distribución de las recolectas de especies de Asteraceae en la SMO se sobrepuso a la división en dominios climáticos. Con esta sobreposición de mapas se obtuvieron datos de incidencia de especies por UGO, es decir, número de registros de cada especie en cada UGO. De forma similar se generó otra matriz, en la que se emplearon los dominios climáticos definidos para la SMO.
En diversos estudios se han evaluado los algoritmos empleados para la estimación de riqueza de especies mediante curvas de acumulación (Chazdon, Colwell, Denslow y Guariguata, 1998; Gimaret-Carpentier, Pélissier, Pascal y Houllier, 1998; Longino, Coddington y Colwell, 2002; Skov y Lawesson, 2000). La evaluación del sesgo y la exactitud de los estimadores de riqueza han sido reportadas para datos reales de distintos grupos biológicos (Brose, 2002; Chiarucci, Enright, Perry, Miller y Lamont, 2003; Coddington, Young y Coyle, 1996; Hellmann y Fowler, 1999; Palmer, 1990, 1991; Villaseñor, Maeda, Colín-López y Ortiz, 2005; Walther y Morand, 1998). A partir de tales resultados, se estimó la riqueza y evaluó el sesgo de recolecta utilizando el estimador no paramétrico Jacknife, que toma en cuenta fundamentalmente el número de especies presentes en solo una unidad de muestreo (González-Oreja, de la Fuente-Díaz, Hernández-Santín, Buzo-Franco y Bonache-Regidor, 2010). Para ello se utilizó el paquete «sprich», implementado en R, que se ajusta por el esfuerzo heterogéneo de muestreo (Raedig et al., 2010). El uso de este script deriva en 4 valoraciones: 1) riqueza estimada con respecto al total de especies seleccionadas (áreas de riqueza), 2) misma estimación, pero con las especies endémicas (áreas de endemismo), 3) valores equivalentes, pero usando los dominios climáticos (riqueza climática) y 4) combinando el conjunto de todas las especies y los dominios climáticos. Empleamos el método de interpolación geométrica, aplicando un esquema de suma de distancia ponderada inversa, derivada de los mapas de riqueza de especies y del endemismo presentes en la SMO (Raedig et al., 2010).
Resultados
La revisión de ejemplares de herbario permitió generar una lista de 757 especies pertenecientes a la familia Asteraceae aunque no se contó con registros para unas 150 especies reportadas para la sierra. La cifra de especies evaluadas representa el 11.6% del total de las 6,600 especies registradas en la SMO (Villaseñor, 2016). De esta lista de 757 especies, 427 (56.7%) de ellas son endémicas de México. Utilizando la información reportada en diferentes inventarios florísticos realizados en la SMO, dicha correlación (Asteraceae-total de especies) es positiva y altamente significativa (r = 0.89) (fig. 2). Se encontró que 204 (26.9%) especies restringen su distribución a una sola de las 140 UGO en que se dividió la SMO. La especie con la distribución más amplia es Roldana aschenborniana, registrada en 40 UGO.
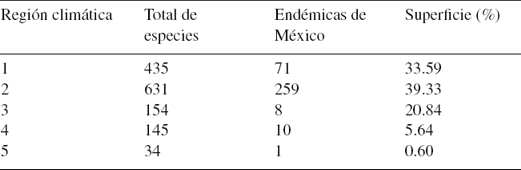
La SMO muestra una alta heterogeneidad climática, definida por 277 dominios climáticos obtenidos en este estudio. Estos dominios representan el número máximo de agrupamientos de celdas que muestran mayor similitud climática en común y reflejan su homogeneidad ambiental con respecto a las demás celdas. Tales dominios se reclasificaron jerárquicamente, empleando la métrica de Gower y el método de UPGMA para definir 5 regiones climáticas, que corresponden al mismo número de biomas, los cuales fueron empleados para generar un mapa al que se sobrepuso el mapa de registros de las especies con el que se obtuvieron sus valores de similitud (figs. 3 y 4). Se encontró que en una sola región (2) se distribuyen 631 (83%) de las especies analizadas; en el extremo opuesto, la región climática menos diversa (región 5) solamente registra 34 especies (tabla 2). La distribución de las especies en las 5 regiones climáticas es variable, seguramente en respuesta a su heterogeneidad ambiental. Sin embargo, las especies compartidas indican que las regiones 1 y 2 muestran la mayor similitud florística, lo que sugiere que comparten también condiciones climáticas similares (fig. 4).

Figura 3 A) Distribución geográfica de las 5 regiones climáticas de la Sierra Madre Oriental; B) distribución de los 5 biomas que la caracterizan. BHM: bosque húmedo de montaña; BTC: bosque tropical estacionalmente seco; BTEM: bosque templado; BTH: bosque tropical húmedo; MXE: matorral xerófilo.
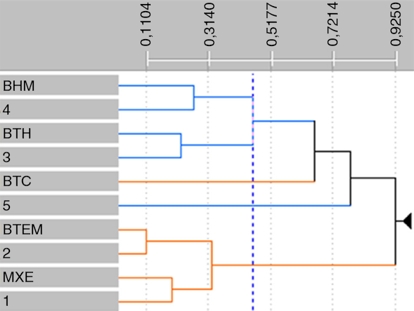
Figura 4 Similitud florística entre las regiones climáticas y los biomas registrados en la Sierra Madre Oriental.
Tabla 2 Riqueza de especies registrada en las regiones climáticas obtenidas a partir de los dominios climáticos de la Sierra Madre Oriental.
Los matorrales xerófilos constituyen el bioma de la SMO con mayor amplitud geográfica (el 41.3% del territorio); allí se registran 531 especies, 111 de ellas solamente conocidas en este bioma (tabla 3). En segundo lugar, se encuentran los bosques templados, que ocupan el 36.1% del territorio de la SMO y que contienen una riqueza de 592 especies, 150 de ellas registradas únicamente en este bioma.
Las áreas ocupadas por los biomas tienen una alta correspondencia geográfica con las regiones climáticas, como lo sugieren los valores de similitud entre ellos (figs. 3 y 4). Dicha similitud permite suponer que los biomas pueden ser circunscritos en las áreas que ocupan las regiones climáticas, donde se encuentran las condiciones ambientales idóneas para las especies analizadas. La correspondencia fue adicionalmente evaluada llevando a cabo un análisis de similitud florística entre los biomas y los dominios, empleando la misma estrategia multivariada, mediante las distancias de la métrica de Gower, reflejándoles con el método UPGMA. El dendrograma obtenido señala los agrupamientos formados por la riqueza florística que existe tanto en los biomas como en los dominios (fig. 4).
La estimación de la riqueza de Asteraceae en la SMO revela que en los bosques templados y la región climática 2 se encuentran los valores más altos, tanto para la riqueza total como para el endemismo (fig. 5A y 5B). El Bosque húmedo de montaña y la región climática 4 también tienen un alto sobrelapamiento, lo cual se refleja en su nivel de similitud florística (figs. 3 y 4). Se observa igualmente un importante sobrelapamiento entre ellos, compartiendo ambos casos sitios con diversidad florística y variabilidad climática equivalente (fig. 5C y 5D). La sobreposición de los mapas obtenidos con las estimaciones de riqueza permiten identificar las celdas que registran la mayor diversidad florística y climática detectada en la SMO (fig. 6).
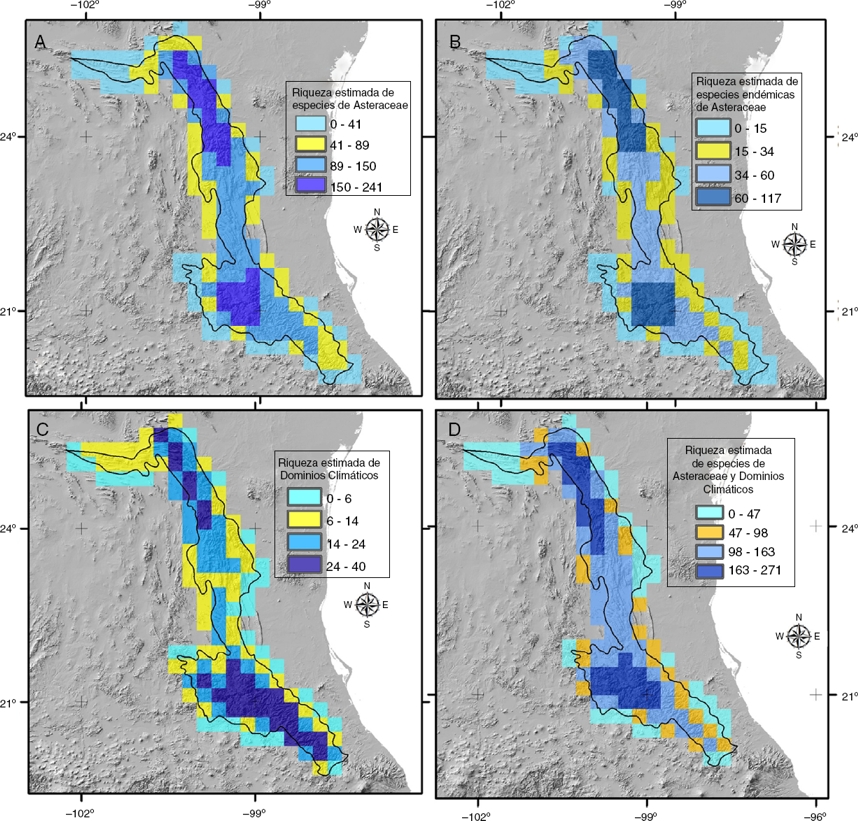
Figura 5 Distribución de la riqueza estimada con total de especies (A), especies endémicas (B), dominios climáticos (C) y riqueza florística y climática (D).
Discusión
La identificación de dominios ambientales ha demostrado ser una herramienta útil para regionalizar diferentes sectores del planeta (Londoño-Murcia et al., 2010; Mackey et al., 2008; Morgan, 2007; Suárez-Mota et al., 2014). A partir de los patrones revelados por una clasificación climática, se han propuesto regionalizaciones biofísicas, utilizando un conjunto de parámetros que caracterizan a los dominios climáticos de un área (Londoño-Murcia et al., 2010; Suárez-Mota et al., 2014). Este estudio muestra la clasificación de los dominios climáticos anidados en 5 regiones, con una contrastante cobertura geográfica que permite su comparación con otras propuestas de regionalización para esta provincia geomorfológica de México (Luna, Morrone y Espinosa, 2004). La variabilidad climática observada en la SMO, reconocida en los 277 dominios identificados en la clasificación no jerárquica, permite evaluar su correspondencia con los tipos de vegetación o los biomas en que se incluyen, como en este estudio. Permite igualmente evaluar su relación con la riqueza y el endemismo de la flora, representada por la familia Asteraceae, catalogada como un buen sustituto de la biodiversidad en México (Villaseñor, Ibarra-Manríquez, Meave y Ortiz, 2005).
La distribución y abundancia de las plantas están estrechamente relacionadas con factores ambientales (McAuliffe, 1994). Por ejemplo, la profundidad del suelo y la inclinación de las laderas influyen en el movimiento y capacidad de retención del agua y, en consecuencia, de su distribución espacial y disponibilidad temporal para las plantas (McAuliffe, 1994). Estos factores pueden verse modificados por otros, como altitud, latitud y longitud, variables directamente relacionadas con el clima; en consecuencia, la existencia de gradientes climáticos en la SMO se ve reflejada en los dominios y regiones climáticas que sintetizan su variabilidad climática (fig. 3). Cada una de las regiones comprende diferentes dominios; la más amplia y heterogénea es la región 2, en la que se distribuyen 97 dominios climáticos, mientras que en la región 5, que es la de menor extensión, se distinguen solamente 10 dominios (tabla 2).
En la SMO se han realizado esfuerzos por conocer mejor su biodiversidad y las condiciones climáticas que la caracterizan (Luna et al., 2004). Aunque actualmente se tienen inventarios florísticos para diferentes localidades (fig. 1), es evidente que la SMO sigue presentando muchos vacíos de información florística. Los resultados de este trabajo muestran las diversas condiciones climáticas a lo largo del área que ocupa la SMO. El agrupamiento de los 277 dominios identificados en 5 regiones climáticas permite a su vez la comparación con la riqueza florística encontrada en los 5 biomas reportados para la cadena montañosa. La congruencia entre ambos conjuntos de datos resalta la relevancia de la información climática como un subrogado de la diversidad florística.
Nix et al. (2000) mencionan que la variación ambiental promueve la variación biológica. En consecuencia, un mejor conocimiento de la variación climática en una región puede apoyar la selección de áreas con distintos atributos ambientales y diferentes patrones de riqueza biológica, algunos de ellos mostrando inclusive elementos biológicos adaptados a ellos, como serían los endemismos (Mackey et al., 2008). En el caso de la SMO, a partir de los resultados obtenidos se apoya esta idea, considerando que la región 2 es la que tiene mayor heterogeneidad climática y en la que se encuentra el mayor número de endemismos y alta riqueza de especies. Algunos autores han sugerido que los dominios climáticos son buenos sustitutos (ambientales) de la biodiversidad, porque incluyen propiedades ecológicamente significativas (Londoño-Murcia et al., 2010; Mackey et al., 2008; Morgan, 2007; Suárez-Mota et al., 2014). Los resultados obtenidos en este trabajo apoyan tales ideas, pues los sitios donde se distribuye la mayor diversidad florística, tanto por su riqueza como por su componente endémico, coinciden de manera importante con los resultados de la división climática de la SMO. Algo importante de destacar, tal y como sugieren Mackey et al. (2008), es la importante relación entre los endemismos y su adaptación a los diferentes climas que se distribuyen en la SMO. Suárez-Mota et al. (2014) encontraron resultados similares, al señalar que los sitios con mayor heterogeneidad ambiental coinciden con sitios de mayor riqueza florística en la Faja Volcánica Transmexicana. Al parecer, al menos para México este patrón de coincidencia geográfica entre climas y diversidad florística está siendo apoyado con los resultados de este estudio (fig. 6) y con los resultados obtenidos por otros autores, como los citados líneas antes.
La SMO es una provincia con una alta diversidad florística, representada por más de 6,600 especies nativas de plantas vasculares (Villaseñor, 2016). Un alto porcentaje de ellas pertenecen a la familia Asteraceae. La preponderancia de miembros de la familia en la flora de la SMO y su correlación altamente significativa con la riqueza representada por las otras familias (tabla 2, fig. 2), apoyan la propuesta de que la familia es un buen subrogado de la riqueza florística (Villaseñor et al., 2005a,b). Del mismo modo, la alta correspondencia geográfica entre las especies de Asteraceae y los dominios climáticos (fig. 4), plasmados en los niveles de similitud encontrados, apoyan dicho argumento de la riqueza florística de esta importante cadena montañosa. En consecuencia, los patrones de distribución de la familia Asteraceae encontrados en este estudio, seguramente son un reflejo de los patrones a observar cuando se evalúe toda su riqueza florística. Ejercicios similares podrían realizarse en otras provincias o regiones del país para determinar, de manera más concluyente, si los patrones entre la riqueza florística y la variabilidad climática constituyen un patrón generalizado a nivel nacional.
La congruencia geográfica observada entre la riqueza florística y la variabilidad climática en la SMO es geográficamente alta (figs. 5 y 6). La región climática 2, que concentra la mayor cantidad de dominios (97), también concentra el mayor porcentaje (83%) de las especies utilizadas para este análisis (tabla 2). Las otras regiones con menor variación climática y menor extensión registran también menor cantidad de especies. Por lo tanto, como lo afirman Nix et al. (2000), es de esperar que a menor variación climática se tenga menor riqueza de especies. Las regiones con mayor heterogeneidad climática muestran una mayor similitud florística (fig. 4). El uso más frecuente de la variabilidad climática, para estimar patrones de diversidad florística, sin lugar a dudas redituará en información interesante para avanzar hacia un mejor conocimiento de nuestra rica biodiversidad nacional.
La distribución de especies en la SMO es heterogénea; la mayor riqueza se concentra en el bosque templado y el matorral xerófilo (tablas 2 y 3). La diferencia florística entre los biomas puede explicarse por su importante correlación con la variabilidad climática, explicada en parte por la correspondencia geográfica encontrada con los dominios climáticos (fig. 4).
La clasificación climática ha permitido reconocer parte de las condiciones ambientales que definen cada bioma. Se considera que las áreas que ocupan los biomas, como ha sido propuesto por Villaseñor y Ortiz (2014) a partir de una agrupación de los tipos de vegetación (por ejemplo, como los definidos por Rzedowski, 1978), tienen una alta correspondencia geográfica con los dominios climáticos. De esta manera, la información perdida por los cambios frecuentes en el uso de suelo que han reducido sustancialmente las áreas con vegetación original, podría ser subsanada utilizando los dominios climáticos como fuente de información de áreas alteradas ecológicamente.
La riqueza observada en cualquier región, obtenida a partir de diversos muestreos, es una subestimación de la riqueza verdadera, debido a que generalmente hay especies que no se incluyen en los inventarios (López-Gómez y Williams-Linera, 2006). Por otra parte, los insuficientes inventarios, como ocurre en la SMO, revelan la urgencia por contar con un mejor conocimiento de su riqueza florística (fig. 1). Por tal motivo, la estimación de su riqueza empleando algoritmos que permitan hacer dichas estimaciones es una alternativa temporal para avanzar hacia un mejor conocimiento de la biodiversidad de regiones tan importantes como lo es la SMO (fig. 6). Los resultados de la riqueza estimada con la diversidad florística tienen una alta correspondencia con la estimación de la riqueza del endemismo en la SMO, lo que sugiere que estos sitios deben ser considerados en futuros planes de conservación de la biodiversidad en esta cadena montañosa. Para poder subsanar vacíos de información de la biodiversidad en futuros planes de conservación, pueden emplearse los dominios climáticos como sustitutos, como lo sugiere su alta correspondencia geográfica con la riqueza florística en la SMO, patrón que podría ocurrir en otras regiones de México.











 nova página do texto(beta)
nova página do texto(beta)




