Introducción
Las alteraciones naturales en los bosques crean y mantienen una estructura heterogénea de la vegetación y son un elemento clave para la promoción de redes de interacción grandes y complejas, por lo que niveles intermedios de alteración suelen estar asociados a incrementos en la riqueza de especies (Pearson, 2010). Uno de los efectos más claros de las perturbaciones es la alteración en la producción de biomasa de un ecosistema en función de la escala espacial y temporal en la que ocurre (Pickett, Kolasa, Armesto y Collins, 1989). Una alteración, de origen natural o humano, contribuye a la conformación de los patrones de distribución de la diversidad biológica (v.gr., Cayuela, Rey, Justel y Salas, 2006). Por ello, la frecuencia y tipo de alteración, así como la historia de uso y manejo de recursos que se le ha dado a diferentes áreas, son factores que deben considerarse en los análisis de los patrones geográficos de la diversidad biológica. Las alteraciones humanas de intensidad moderada pero frecuentes, se consideran importantes en la regeneración de la estructura y composición florística en bosques de montaña neotropicales (Breedlove, 1981; Cayuela, Golicher, Rey-Benayas, González-Espinosa y Ramírez-Marcial, 2006; Ramírez-Marcial, González-Espinosa y Williams-Linera, 2001).
Los bosques de montaña en Los Altos de Chiapas han estado sometidos a un régimen de alteración de baja intensidad, pero con alta frecuencia, lo cual ha configurado a lo largo de varios siglos un paisaje fragmentado con pocos remanentes de bosques primarios rodeados de bosques secundarios en diferentes etapas de sucesión y unidades de producción como campos agrícolas, pastizales y numerosos asentamientos humanos (Figueroa-Jáuregui, Ibáñez-Castillo, Arteaga-Ramírez, Arellano-Monterrosas y Vázquez-Peña, 2011; González-Espinosa, Ramírez-Marcial y Galindo-Jaimes, 2006). En estos escenarios de cambios de la composición y estructura de la vegetación, derivados de la alteración y fragmentación de los bosques, no se conoce bien cómo se estructuran las comunidades de insectos debido a estos cambios. La distribución, abundancia y riqueza de los insectos heterópteros es susceptible a la variación ambiental y a los cambios en la disponibilidad de recursos de un área determinada (Andrew y Hughes, 2005). Hasta el momento se conocen aproximadamente 85,000 especies de heterópteros en el mundo, de las cuales 5,609 se encuentran en México y 219 en Chiapas (Cervantes-Peredo y Brailovsky, 2004; Llorente-Bousquets y Ocegueda, 2008; Mayorga, 2002; Mayorga y Cervantes, 2006; Morrone y Márquez, 2008; Ortega y Thomas, 2004). Los heterópteros herbívoros se alimentan de casi cualquier estructura vegetal (hojas, tallos, flores, semillas, frutos y raíces), ya sea en un hospedero específico (especialistas) o diversos hospederos (generalistas) (Lavelle et al., 1994). Las familias con especies depredadoras como Reduviidae, Phymatidae, Pentatomidae, Miridae y Lygaeidae, se alimentan de la hemolinfa de insectos adultos y larvas. Otras especies de la familia Aradidae se alimentan de hongos y micelio. Sin embargo, independientemente de su tipo de alimentación, la mayor parte de heterópteros generalmente se encuentran estrechamente asociados a las plantas (Schuh y Slater, 1995).
En este estudio se analizó si el régimen de alteración histórica contribuye a la determinación de la comunidad de heterópteros (Hemiptera: Heteroptera), ya que este grupo presenta una amplia gama de usos de recursos de forma generalizada o especializada, son muy abundantes en bosques de montaña y su reconocimiento taxonómico es relativamente preciso (Cavanzón-Medrano, 2011; Zurbrügg y Frank, 2006). También se sabe que tanto las ninfas como los individuos adultos de este grupo viven en el mismo hábitat y son sumamente sensibles a los cambios ambientales (Wheeler, 2001). Adicionalmente, la riqueza de heterópteros se puede correlacionar con la riqueza total de artrópodos en áreas abiertas y el tamaño corporal de cada individuo influye en la competencia intra- e interespecífica y en la depredación (Zurbrügg y Frank, 2006).
El presente estudio busca responder la pregunta: ¿Cómo es la diversidad, la composición de los grupos tróficos y del tamaño corporal de Heteroptera en bosques que difieren en su condición de composición, estructura, cobertura y altitud como resultado de alteraciones antropogénicas? Estos elementos de análisis cubren un vacío de información sobre la ecología de los heterópteros y contribuye al entendimiento de los parámetros ambientales que intervienen en la conformación de la estructura y composición de comunidades de insectos a nivel regional.
Materiales y métodos
El estudio se realizó en 3 bosques secundarios ubicados dentro del municipio de San Cristóbal de Las Casas, en la región central de Chiapas, México. Los 3 bosques secundarios difieren en su origen, historia de uso y en cobertura arbórea pero comparten su distribución dentro de la misma microcuenca del valle de Jovel.
El primer sitio, Cerrito de San Cristóbal (Cerrito) se localiza en el centro de la ciudad de San Cristóbal de Las Casas; comprende una superficie aproximada de 18 ha, con una ligera variación de altitud de 2,128-2,190 m snm. Se localiza entre los 16°43’54.72” y 16°44’08.38” N, 92°38’52.59” y 92°38’24.52” O. El clima es templado y húmedo con abundantes lluvias en verano. La temperatura media anual es de 15.1 °C y la precipitación anual de 1,170 mm. El bosque de Cerrito fue creado a partir de la plantación de especies nativas y exóticas sobre una cantera abandonada desde hace poco más de medio siglo. Las especies dominantes son Pinus pseudostrobus (Lindl.) Shaw, Eucalyptus spp. (especie introducida) y Cupressus lusitanica (Klotzsch ex. Endl) Carriére (Ramírez-Marcial, Luna-Gómez y Guillén-Díaz, 2014). Desde el año 2012, se encuentra en proceso de enriquecimiento florístico con árboles nativos de los bosques de pino-encino de la región (Ruiz-Montoya, Guillén-Díaz, Luna-Gómez y Ramírez-Marcial, 2014). Se trata de un área abierta al público y no dispone de ningún plan de manejo o de conservación.
El segundo sitio, el Parque Ecológico El Encuentro (El Encuentro), comprende un área aproximada de 144 ha, se ubica entre los 16°44’14.99” y 16°43’32.73” N, 92°36’24.87” y 92°36’3.12” O (Ayuntamiento Municipal SCLC y Conagua, 2010). La altitud varía entre 2,180 y 2,420 m snm y la precipitación media anual es de 1,200-1,500 mm, se caracteriza por tener un suelo moderadamente profundo compuesto de rendzinas y luvisoles derivados de rocas calcáreas. La vegetación se compone de bosques secundarios con dominancia de Pinus pseudostrobus (Lindl.) Shaw, Pinus tecunumanii Schwerdtf. ex Eguiluz y J.P. Perry, Quercus segoviensis Liebm., Quercus crispipilis Trel. y Quercus rugosa Née. En este sitio hay señales de alteración reciente por extracción de madera, leña y algunas áreas de extracción de materiales pétreos. Debido a que es un área abierta al público, hay numerosos senderos, áreas abiertas y semiabiertas para realizar actividades recreativas.
El tercer sitio, la Reserva Ecológica Cerro Huitepec (Huitepec), fue creada en 1987 y es administrada como reserva privada por Pronatura, A.C. El área protegida incluye 136 ha ubicadas en las laderas E y NE del Cerro Huitepec, a 6 km del extremo oeste de la ciudad de San Cristóbal de Las Casas, Chiapas. Se localiza entre las coordenadas 16°42’36” y 16°52’12” N, 92°31’48” y 93°47’24” O. La altitud varía entre 2,230 y 2,750 m snm y la precipitación media anual es de 1,300 mm. El sustrato lo compone material ígneo en la zona más elevada, y en las partes bajas predomina material sedimentario. El tipo de vegetación predominante consiste en bosque de encino con dominancia de Quercus rugosa Née., Quercus crassifolia Humb. y Bonpl., Oreopanax xalapensis (Kunth) Decne. y Planch., Mirsyne juerguensenii (Mez) Ricketson. y Pipoly., entre otras (Arriaga et al., 2000; Ramírez-Marcial, Ochoa-Gaona, González-Espinosa y Quintana-Ascencio, 1998). En el área ocurrió extracción de leña y madera, así como pastoreo de ovejas, actividades que se suspendieron definitivamente a partir del año 1985, cuando se decretó la reserva y actualmente hay acceso para el público, pero restringido para algunos sectores de la reserva.
El muestreo en Cerrito, El Encuentro y Huitepec se realizó en un lapso de 9 meses en 4 ocasiones (noviembre de 2013; febrero, mayo y agosto de 2014), lo que incluyó un periodo de secas (noviembre-febrero) y otro de lluvias (mayo-agosto). En cada sitio se trazaron 6 transectos de 400-600 m de longitud, con orientación de este a oeste y a una distancia de 130-200 m entre transecto. Sobre cada transecto se ubicaron 3 parcelas circulares de 15 m de diámetro (707 m2), equidistantes (200 m), teniendo así un total de 18 parcelas, con una superficie total de 12,726 m2 de muestreo por bosque. En cada parcela se registró la altitud con un GPS (Garmin 12XL).
Los heterópteros se colectaron con redes entomológicas de golpeo, pasando estas sobre hierbas y arbustos en 3 lapsos de 10 min por parcela. Los heterópteros capturados se retiraron de la red con pinzas (número 5) y aspirador (Leather, 2005). Los especímenes recolectados se conservaron en frascos de vidrio etiquetados y con alcohol etílico al 70%, posteriormente se trasladaron al Instituto de Biología de la Universidad Nacional Autónoma de México (Permiso de colecta Semarnat Ofic. Núm. SGPA/DGVS/12891/13). Cada ejemplar se montó en alfileres entomológicos y están depositados en la Colección Nacional de Insectos del Instituto de Biología de la Universidad Nacional Autónoma de México. Los organismos fueron identificados a nivel de género y especie (apéndice 1) con apoyo de claves taxonómicas (Bierle et al., 2002; Brailovsky, Mariño y Barrera, 2007; Brailovsky y Zurbia, 1979; Fiuza-Ferreira y Thomas, 2011; Froeschner, 1996, 2001; Hernández y Henry, 2010; McAtee, 1919; Packauskas, 1994; Schuh y Slater, 1995; Schaefer, 2004; Slater y Baranowski, 1990; Stonedahl, Dolling y DuHeaume, 1992; Thomas, 1992; Van Duzee, 1916). Los organismos de la familia Miridae fueron determinados en el Museo Nacional de Historia Natural del Instituto Smithsoniano (Washington, D.C., EUA). Los organismos no identificados a nivel de especie fueron clasificados como morfoespecies, cuyo nivel mínimo de determinación fue la tribu. Las morfoespecies se reconocieron con base en diferencias anatómicas de la cabeza, tórax, segmentos abdominales, artejos, pigóforo, parámeros, así como en la coloración, presencia o ausencia de espinas, tubérculos y sedas. Para fines del análisis de la riqueza y diversidad, cada morfoespecie se consideró una especie distinta. También se obtuvieron los hábitos alimenticios de los géneros y las especies registradas (Bierle et al., 2002; Brailovsky et al., 2007; Fauvel, 1999; Fiuza-Ferreira y Thomas, 2011; Froeschner, 1996, 2001; Hernández y Henry, 2010; Packauskas, 1994; Schaefer, 2004; Schuh y Slater, 1995; Slater y Baranowski, 1990; Stonedahl et al., 1992; Thomas, 1992).
En cada parcela de bosque se estableció la existencia de alteraciones mediante: 1) indicios de extracción de madera y leña evidenciada por la presencia de tocones y por la presencia de árboles con ramas cortadas, 2) extracción de resina a través de marcas de escaras y secreción de resina en el tronco, 3) fuego por la presencia de cenizas o material carbonizado, 4) presencia de ganado bovino u ovino por indicios de ramoneo (sensu Ramírez-Marcial et al., 2001), 5) presencia de desechos sólidos (basura), y 6) evidencia de extracción de hojarasca y suelo. Las variables de alteración se manejaron de forma categórica (presencia = 1, ausencia = 0) en cada parcela de muestreo. Se construyó un índice de alteración humana (IDiH) en el que se asume que cada tipo de alteración no es excluyente, entonces IDiH es el producto de la frecuencia de las distintas alteraciones en el sitio, de manera que se calculó el índice de alteración mediante la siguiente fórmula IDiH = Π[f(d) + 1], donde f es la frecuencia de los diferentes tipos de alteración; d es una alteración dada. La frecuencia de la alteración d es el cociente del número de parcelas que presentaron una alteración dada entre el total de parcelas muestreadas, los valores más cercanos a 1 señalan un nivel de alteración menor.
En cada parcela de muestreo se determinó la cobertura del dosel mediante 3 lecturas aleatorias con un densiómetro convexo (Forestry suppliers, Model C), además se tomaron muestras de plantas herbáceas y arbustivas (apéndice 2) para obtener su riqueza. La riqueza de árboles para los sitios se tomó de Ramírez-Marcial et al. (1998, 2014) y de observaciones en campo. Los ejemplares colectados fueron determinados y depositados en el herbario de El Colegio de la Frontera Sur (Unidad San Cristóbal). Esta información sirvió para obtener una descripción general de la estructura de la vegetación de los bosques y de la composición de hospederos potenciales para los heterópteros.
Para caracterizar la diversidad de especies de heterópteros de cada bosque se utilizaron curvas de interpolación (rarefacción)/extrapolación basadas en los 3 primeros números de la serie de Hill:
donde qD es la riqueza efectiva de especies y q es un parámetro que determina la sensibilidad de D a la abundancia relativa de las especies. La riqueza de primer orden o riqueza efectiva (0D) es cuando q = 0, que representa una condición en la que las especies están presentes al menos con un individuo, por lo tanto, solo las especies detectadas contribuyen a la estimación de D. La riqueza efectiva cuando q = 1 (1D) es indefinida, no obstante el límite de q tiende a 1, y es equivalente al exponente de la diversidad de Shannon. El estimador 1D es altamente sensible a la frecuencia de especies con abundancia baja o media (Jost, 2006). Para q = 2, la diversidad (2D) es equivalente al inverso del índice de Simpson, el cual es sensible a la presencia de especies comunes y dominantes (Jost, 2006, Chao et al., 2014). Los números de Hill forman parte de las llamadas diversidades verdaderas (qD) porque representan el número de especies de una comunidad, y se denominan números equivalentes de los índices de diversidad (Jost, 2006).
Se construyeron curvas de interpolación (rarefacción)/extrapolación con relación al número de individuos recolectados por sitio, con un intervalo de confianza construido mediante el método de remuestreo bootstrap para 0D, 1D, y 2D. Cuando la curva de extrapolación alcanza la asíntota permite estimar la proporción de especies que el muestro actual logró registrar con respecto a una riqueza total potencial indicada por la asíntota, donde valores cercanos a 1 indican un muestreo robusto de la diversidad (Chao et al., 2014).
Se hicieron curvas de rango-abundancia para cada sitio considerando la abundancia relativa de cada especie (log10 del número de individuos en un área), lo que aporta información relativa a la distribución de las especies sin pérdida de detalle o identidad de las especies y su abundancias (Rocchini y Neteler, 2012).
Análisis de la diversidad β
Se realizó un análisis de correspondencia canónica (ACC) para evidenciar las diferencias entre comunidades de heterópteros por la condición de alteración, cobertura arbórea y altitud (Ter-Braak y Verdonschot, 1995). El ACC es un método estadístico multivariado que supone que la abundancia y riqueza de especies es unimodal con respecto a combinaciones lineales de variables ambientales, las cuales ordenan a la riqueza en un gradiente por su grado de correlación con la variación en la diversidad de especies (Ter-Braak, 2014). Los efectos significativos de las variables ambientales (bosque, altitud, cobertura arbórea y alteración) se ponderan mediante la correlación de los valores de cada variable con respecto a los de la riqueza de especies. La diferencia en la riqueza por sitio se analizó mediante un Anova sobre una matriz de distancias euclidianas con 500 permutaciones. Posteriormente se realizó una comparación múltiple de las medias (Tukey HSD) con el 95% de confianza (Oksanen et al., 2015). Para estos análisis, los datos de las especies y su abundancia se agruparon por transecto, para ajustar los datos a una distribución normal, de este modo el tamaño de muestra (N) por sitio fue 6.
Con base en las estimaciones de 0D, 1D y 2D se obtuvo la diversidad β entre pares de comunidades y entre las 3 comunidades, cuyo valor indica el número hipotético de comunidades a partir del conjunto de datos disponibles (Jost, Chao y Chazdon, 2011). La diversidad β toma valores entre 1 y el máximo número de comunidades que se comparan, en el caso de 2 comunidades el máximo valor es 2; una β = 1 indica una sola comunidad, valores de β > 1 indica comunidades distintas y la diferencia de 1 – β puede interpretarse como la proporción de especies que son «volátiles» o en recambio constante (Jost et al., 2011).
Todos los análisis estadísticos de diversidad se realizaron en el programa R (v.3.0.0) con las rutinas BiodiversityR, MASS y Vegan (Kindt, 2015; Oksanen et al., 2015; Ripley et al., 2015). Los análisis de interpolación (rarefacción)/extrapolación se realizaron en la plataforma online iNEXT (Chao et al., 2014; Chao y Jost, 2012; Colwell et al., 2012; Hsieh, Ma y Chao, 2013).
Distribución de tamaños corporales y grupos tróficos
Se tomaron aleatoriamente 5 individuos de cada especie y con auxilio de un microscopio estereoscópico (ZEIZZ, STEMI SV8) se midió la longitud del cuerpo dorsalmente (de la cabeza al último segmento abdominal) y se obtuvo un promedio de su tamaño corporal. Posteriormente se consideraron 5 categorías de tamaño de acuerdo con la longitud del cuerpo, siguiendo a Caballero, León-Cortés y Morón-Ríos (2009): categoría I, ≤ 3 mm; categoría II, 3.1-4.5 mm; categoría III, 4.6-7 mm; categoría IV, 7.1-11 mm y categoría V, ≥ 11 mm. La diferencia en la distribución de categorías de tamaños de heterópteros entre bosques se analizó con la prueba de Kruskal-Wallis.
Para determinar si las categorías de tamaño de los heterópteros y los grupos tróficos difieren entre los sitios y si se relacionan con los parámetros ambientales medidos (altitud, cobertura del dosel y alteraciones) se utilizó un ACC, se realizaron Anova y pruebas de Tukey HSD.
Resultados
El IDiH fue más alto en Cerrito, seguido por El Encuentro y Huitepec (tabla 1). En Cerrito, sitio con la menor altitud, se registró la menor cobertura arbórea y riqueza de plantas (hierbas y arbustos), mientras que el Huitepec tuvo la mayor riqueza de hierbas y arbustos así como una mayor cobertura arbórea (tabla 1). La riqueza de especies de heterópteros más alta se registró en El Encuentro y la más baja en Huitepec (tabla 1).
Tabla 1 Condiciones ambientales y biológicas de 3 bosques secundarios de pino-encino en Chiapas, México.

IDiH: índice de alteración humana; SA: riqueza (número de especies) de árboles; SAr: riqueza de arbustos; SH: riqueza de hierbas; SHE: riqueza de heterópteros.
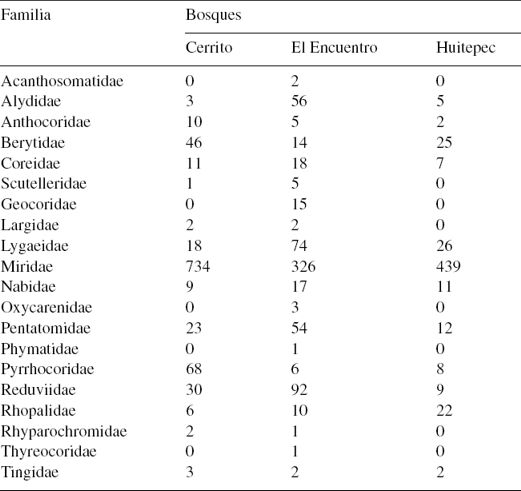
Se encontró un total de 19 familias (tabla 2), 78 géneros, 134 especies y morfoespecies (apéndice 1) con un total de 2,238 individuos. En Cerrito se registraron 15 familias (tabla 2) entre las cuales destaca Miridae con 32 especies y 734 individuos. En El Encuentro se registraron 20 familias (tabla 2), se colectaron 26 especies de la familia Miridae con 326 individuos y 6 especies de Reduviidae con 92 individuos. En el Huitepec se obtuvo el menor número de familias (12) y se mantuvo Miridae como la familia más rica, con 33 especies y 439 individuos (tabla 2). En Cerrito se colectó el mayor número de individuos (966), le siguió El Encuentro (704) y en el Huitepec se registró el menor número de individuos (568).
Tabla 2 Número de individuos de heterópteros por familia colectados en 3 bosques secundarios de pino-encino en Chiapas, México.
Con base en la muestra de individuos menor, que corresponde al Huitepec, la diversidad de heterópteros de primer orden (0D) fue de 64 especies para Cerrito y Huitepec, significativamente diferente con respecto a El Encuentro (0D = 80) (fig. 1). La diversidad de especies medianamente abundantes (1D) fue de 20 especies para Cerrito y Huitepec, mientras que en El Encuentro fue de 36 especies (fig. 1). Igualmente, los valores de 2D muestran que El Encuentro tiene el mayor número de especies dominantes (2D = 20), lo que difiere significativamente del Cerrito y Huitepec que presentaron una diversidad de especies dominantes de aproximadamente 10 especies (fig. 1).

Figura 1 Curvas de interpolación (rarefacción)/extrapolación de la diversidad de heterópteros en 3 bosques secundarios de Chiapas, México, con base en los números de Hill: 0D: riqueza (número efectivo de especies), 1D: exponente de la diversidad Shannon, 2D: inverso del índice de diversidad de Simpson. La línea vertical es referencia de D con respecto al sitio con el menor número de individuos (Huitepec).
Con base en los números de Hill de primer orden (sin ponderar la abundancia de las especies) se encontró que el sitio más diverso fue El Encuentro (0D = 83), Cerrito tuvo 5 especies menos (0D = 78) y el Huitepec (0D = 62) 11 menos que Cerrito; no se encontró una diferencia significativa de la diversidad entre Cerrito y Huitepec, pero sí entre estos últimos y El Encuentro (fig. 1). Sin embargo, la extrapolación de las curvas sugiere que la diversidad 0D puede igualarse al incrementar el esfuerzo de muestro. Al ponderar la abundancia de las especies se observó que El Encuentro es el más diverso (1D), el Huitepec y Cerrito presentaron valores de 1D similares, cuyo valor difiere significativamente del de El Encuentro (fig. 1). Este mismo patrón se observa para la diversidad de especies dominantes (2D).
Las especies más abundantes en Cerrito fueron Macrolophus sp. 1 Miridae, Proba sp. 2 Miridae, Tupiocoris sp. Miridae, Pycnoderes sp. Miridae y Dysdercus mimulus (Hussey, 1929) Pyrrhocoridae (fig. 2a). Las especies más raras en Cerrito fueron Homaemus sp. Scutelleridae, Kleidocerys virescens (Fabricius, 1794) Lygaeidae y Villasitocoris incospicuus (Herrich-Schäffer, 1842) Coreidae.

Figura 2 Curvas de rango abundancia en 3 bosques secundarios de Chiapas: a) Cerrito, b) El Encuentro y c) Huitepec.
Las especies más abundantes en El Encuentro fueron Pselliopus karleane (Hussey, 1954) Reduviidae, Macrolophus sp. 1 Miridae, Proba sp. Miridae (fig. 2b), Tupiocoris sp. Miridae, Euschistus chiapus (Rolston, 1974) Pentatomidae, Neortholomus sp. Lygaeidae y Darmistus subvitattus (Stål, 1859) Alydidae. Las especies más raras en El Encuentro fueron Galupha sp. Thyreocoridae, Orius sp. Anthocoridae y Largus fumosus (Stehlik n.) Largidae, esta última es importante por estar registrada como endémica de Panamá, sin embargo, ya se han encontrado varios registros para México.
Las especies más abundantes en Huitepec fueron Paraproba fasciata (Distant, 1884) Miridae, seguida por Paraproba mexicana (Barros de Carvalho, 1987) Miridae, y Falconia poetica (Distant, 1884) Miridae (fig. 2c). Otras especies con abundancias intermedias fueron Monalocoris sp. (Dahlbom, 1851) Miridae, Annona bimaculata (Distant, 1884) Miridae; las especies más escasas en Huitepec, fueron Macrolophus sp. 2 Miridae, Proba sp. 3 Miridae y la Morforespecie 17 (tribu Tingini) Tingidae.
Cerrito y El Encuentro tuvieron un 37% de similitud (índice de SØrensen) y se obtuvo una β = 1.46 con base en la riqueza efectiva de primer orden (0D). Los valores de β para especies de baja a media abundancia relativa (1D) indican que Cerrito y El Encuentro comparten un 65% de las especies (índice de similitud de Morisita) con una β = 1.21 y (2D) comparte un 60% de especies dominantes (índice de Morisita-Horn) con una β = 1.25.
Por su parte, Cerrito y Huitepec presentaron 6 especies compartidas (0D)), un 28% de semejanza y una β = 1.56. La similitud considerando el estimador 1D fue de un 25% con un valor de β = 1.60. En cuanto la diversidad, considerando a las especies dominantes (2D), se obtuvo una similitud de un 39% y una β = 1.44. El Encuentro y Huitepec comparten 14 especies, lo que equivale a un 36% de semejanza de especies dominantes y una β = 1.47. Entre estos bosques se comparte un 20% de especies con base en 1D y un 37% con 2D, con una β = 1.67 para 1D y β = 1.46 para 2D. Los 3 sitios comparten 25 especies con un 33% de semejanza y se obtuvo una β = 1.81, lo que indica la existencia de 2 comunidades de heterópteros. La similitud fue de un 38% y un 44%, con β = 1.67 para 1D, y un 39% con una β = 1.46 para 2D.
El Anova reveló diferencias significativas en la riqueza de especies de heterópteros en los 3 bosques (F2, 17 = 5.16, p = 0.008), posteriormente la prueba de Tukey HSD mostró diferencias significativas entre Cerrito y El Encuentro (p = 0.031), Cerrito y Huitepec (p = 0.01), pero no entre El Encuentro y Huitepec (p = 0.92).
El análisis de componentes canónicos mostró una relación altamente significativa entre la diversidad y el conjunto de las variables explicativas (altitud, cobertura y alteración; F5, 17 = 1.74, p = 0.002). Los 2 primeros componentes canónicos reunieron significativamente el 45% de la variación de la abundancia ponderada de las especies y el 61% de la variación de la distribución de las especies con respecto a las variables ambientales (CCA1, F1, 17 = 3.30, p = 0.001; CCA2, F1, 17 = 2.08, p = 0.006). La altitud se correlaciona de manera positiva y significativa con el primer componente canónico (CCA1) (F1, 17 = 2.76, p = 0.001) y de manera negativa con el segundo (CCA2). La cobertura arbórea se relacionó de la misma manera con CCA1 y CCA2, pero con menor intensidad (se expresa por la longitud de la línea terminada en flecha en la figura 3a). La alteración se relaciona de forma negativa con el primer eje (CCA1) (fig. 3a).

Figura 3 Análisis de correspondencia canónica (ACC) entre: a) la diversidad de heterópteros, b) tamaño corporal, c) grupos tróficos y las condiciones de altitud, cobertura y alteración de 3 bosques secundarios de Chiapas, México. En las figuras a, b y c, los transectos se indican con círculos y los centroides de cada bosque se indican con su nombre (Cerrito, El Encuentro o Huitepec); las variables ambientales se indican con vectores. En la figura a las especies se indican con el símbolo +.
Las especies que están cerca de la línea del gradiente de cada variable ambiental tienen una mayor correlación con esta variable (símbolo + en la fig. 3a). Las morfoespecies 6, 8, 13 (tribu Mirini), Podisus maculiventris subsp. 2 (Say, 1832) y Podisus sagitta (Fabricius, 1794) solo se registraron en Huitepec con un solo individuo, lo cual es ponderado durante el análisis de ACC. La morfoespecie 4 (tribu Hyalodini) y Colimacoris sp. 2 se relacionan con la altitud y se encontraron en el Huitepec y El Encuentro. Annona bimaculata, Arhyssus parvicornis (Signoret, 1859) y Podisus maculiventris subsp. 1 se relacionan con la altitud y se encontraron en los 3 sitios. La alteración y la cobertura arbórea no tuvieron una relación significativa con los 2 primeros ejes del ACC (alteración: F1, 17 = 1.18, p = 0.356; cobertura: F1, 17 = 1.24, p = 0.320); sin embargo, se puede identificar que Ozophora sp., Nabis sp. y Phytocoris sp. 3. se relacionan positivamente con la cobertura, en tanto que Stenodema vicinum (Provancher, 1872), Froeschneria sp., Phytocoris sp. 1, Orius sp. 1 Rinacloa mysteriosus (Schuh and Schwartz, 1985) y Sinea diadema (Fabricius, 1776) se encuentran asociados a alteraciones antropogénicas.
Todas las clases de tamaño de los organismos estuvieron presentes en los 3 sitios, aunque no en la misma proporción (tabla 3). El número de especies que constituyó cada una de las clases de tamaños fue variable entre sitios (tabla 3). El número de individuos por clase de tamaño fue significativamente diferente entre sitios (Kruskal-Wallis, H4, 90 = 34.55, p < 0.0001).
Tabla 3 Riqueza (S) y número de individuos (N) por grupo trófico y categoría de tamaño de heterópteros en 3 bosques secundarios estudiados en Chiapas, México.
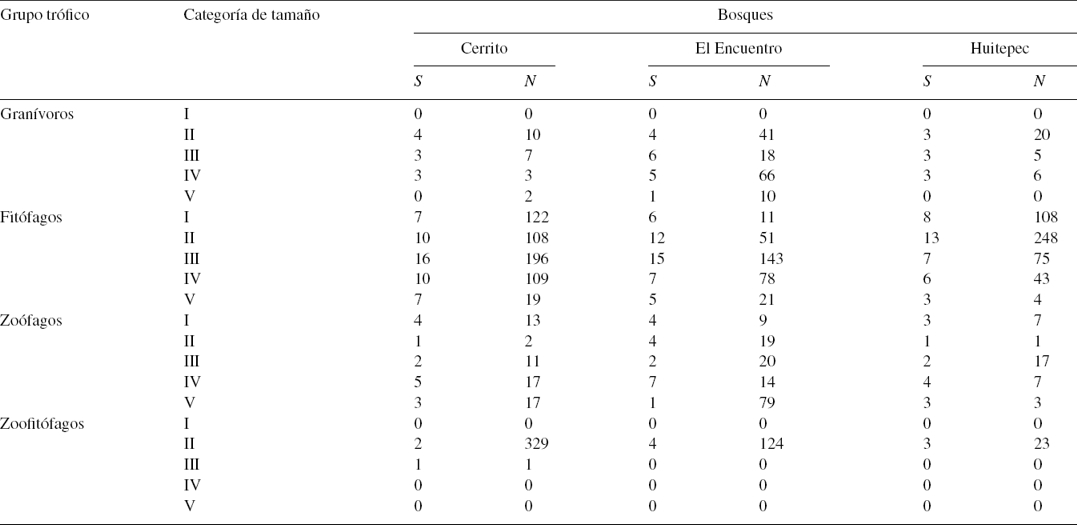
La clase de tamaño más abundante en todos los sitios fue el grupo II (3.1-4.5 mm), cuya abundancia destaca claramente con respecto a las otras clases en Cerrito y en Huitepec (tabla 3). En todos los sitios se observó (a excepción del grupo I ≤ 3 mm), una disminución paulatina de la abundancia conforme se incrementa el tamaño de los heterópteros, sin embargo, el cambio es más pronunciado en Cerrito (tabla 3).
El ACC realizado para el tamaño de hemípteros en los sitios de estudio mostró una alta correlación de cobertura, altitud y alteración, con la variación en el tamaño corporal (F5, 12 = 3.17, p = 0.003). Los primeros 2 componentes canónicos reunieron 45% de la variación de las abundancias ponderadas de las categorías de tamaño, y 91% en la distribución de las categorías de tamaño asociadas a las variables ambientales (CCA1: F1, 17 = 11.90, p = 0.001; CCA2: F1, 17 = 3.73, p = 0.030). Este análisis reveló diferencias significativas en el tamaño del cuerpo de heterópteros entre los bosques (F2, 12 = 5.93, p = 0.001) (fig. 3b), donde El Encuentro tiene un mayor número de especies grandes (categoría v), Cerrito y Huitepec tienen especies de tamaños pequeños (categorías i, ii y iii). Las otras categorías de tamaño no se relacionaron con ningún parámetro ambiental (fig. 3b).
De acuerdo con los hábitos alimenticios de los taxones encontrados, se reconocieron 4 grupos tróficos de heterópteros: fitófagos, zoófagos, granívoros y zoofitófagos. El grupo más abundante en todos los sitios fue el de los fitófagos (tabla 3). En Cerrito se registraron 50 especies fitófagas, 46 en El Encuentro y 38 en Huitepec. Excluyendo a los fitófagos, se observa un patrón de abundancia similar en los zoófagos, granívoros y zoofitófagos en El Encuentro y Huitepec, lo que contrasta con la distribución heterogénea de la abundancia de los grupos tróficos en Cerrito (tabla 3). El análisis de Kruskal-Wallis mostró que la diferencias en la distribución de la abundancia de los grupos tróficos entre sitios fue altamente significativa (H3, 72 = 31.01, p < 0.0001).
El CCA realizado para los grupos tróficos fue significativo (F5, 12 = 8.46, p = 0.001). Los 3 primeros componentes reunieron un 57% de la variación en las abundancias ponderadas de los grupos tróficos, y un 92% en la variación de la distribución de los grupos tróficos relacionados con las variables ambientales: CCA1 (F1, 17 = 27.26, p = 0.001), CCA2 (F1, 17 = 18.48, p = 0.001), CCA3 (F1, 17 = 3.6, p = 0.021). El CCA reveló diferencias significativas en los grupos tróficos relacionados con los sitios (F2, 12 = 12.56, p = 0.001) donde Cerrito tuvo una gran abundancia de organismos zoofitófagos, El Encuentro una mayor abundancia de zoófagos y granívoros, y en el Huitepec hubo una mayor abundancia de fitófagos, asociados con la cobertura de dosel (F1, 12 = 4.89, p = 0.024) y con altitud (F2, 12 = 12.04, p = 0.001), sin embargo, no tuvieron una relación significativa con la alteración (fig. 3c).
Discusión
Las especies de la familia Miridae contribuyeron con la mayor parte de la comunidad de heterópteros en los 3 bosques de estudio. Este resultado se debe probablemente a que es la familia más grande de Heteroptera, ya que constituye el 25% de los heterópteros a nivel mundial (Henry, 2009; Wheeler, 2001). Los míridos son organismos capaces de repoblar en poco tiempo sitios alterados o defaunados, la mayoría tiene alta capacidad de dispersión, y el ser fitófagos o depredadores generalistas les permite explotar una amplia gama de recursos e incrementar su población rápidamente (Aldritch, 1988; Becker, 1975). Los míridos pueden reproducirse casi todo el año y pueden tener explosiones demográficas hacia finales de la época lluviosa (Šedivý y Fric, 1999). Estas cualidades biológicas de los míridos contribuyen a que ciertas especies dominen en número de individuos en los bosques. Algunas especies de míridos pueden ser de interés para la conservación o como indicadoras de cambio en las condiciones de los bosques al monitorizar su abundancia. Se encontraron de uno a 8 individuos para Calocorisca sp. 3, Creontiades sp. (Distant, 1883), Deraeocoris sp. (Kirschbaum, 1856), Derophthalma sp. (Berg, 1883), Phytocoris sp. 7, Proba sp. 5, Proba sp. 6, Proba sp. 8 y Rhinacloa mysteriosus (Schuh y Schwartz, 1985); son especies asociadas a los bosques pino-encino, su ausencia o un incremento en su abundancia podría reflejar un cambio en la disposición de recursos o en factores ambientales (Henry, 2009). Cabe señalar que R. mysteriosus se considera endémica de México y hasta ahora no había sido registrada en Chiapas.
En Cerrito, el sitio con la menor altitud, se encontró una baja diversidad y la más alta abundancia de heterópteros, lo que coincide con la menor riqueza de árboles y arbustos, la menor cobertura de dosel y la mayor alteración. Este patrón de menor diversidad de heterópteros en un sitio con mayor alteración, se ha observado en estudios previos (v.gr., Acosta, Martínez-Martínez, Faz, van Mourik y Arocena, 2011; Fauvel, 1999; Gerlach, Samways y Pryke, 2013). A pesar de que el ACC no detectó un efecto significativo de la alteración y la cobertura de dosel sobre la diversidad de heterópteros, no se descarta que influyan en la estructura de la comunidad de estos, ya que podrían tener un efecto conjunto con otros factores ambientales asociados que no se consideraron, como la humedad y la precipitación, entre otros (Schaefer y Panizzi, 2000; Zurbrügg y Frank, 2006). Las familias Anthocoridae, Berytidae y Nabidae son altamente sensibles a la humedad local, presentándose más individuos a mayor humedad (Fauvel, 1999). La baja diversidad de Cerrito también puede atribuirse a que está inmerso en una zona urbana, lo que reduce la probabilidad de llegada y establecimiento de especies de heterópteros debido a la baja diversidad vegetal y aislamiento de áreas conservadas (Acosta et al., 2011; Manta, Angelone, Bellanca, Neri y Sprovieri, 2002).
La mayor diversidad de heterópteros se observó en El Encuentro, que tiene un bosque en una posición intermedia en términos de riqueza de árboles, arbustos, hierbas, altitud y grado de alteración, con respecto a Huitepec y Cerrito. Este bosque está dominado por especies de Quercus spp., los cuales promueven la presencia de una diversidad importante de artrópodos (Tovar-Sánchez y Oyama, 2006a, 2006b). Este sitio tuvo un número comparativamente alto de especies raras de heterópteros, donde destaca la presencia de Phytocoris spp. y Proba spp., que son géneros especialistas de Quercus spp. y Pinus spp. (Henry, 2009). La diversidad de El Encuentro concuerda con la hipótesis de la alteración intermedia, la cual señala que en las áreas donde hay niveles moderados de alteración se encuentra la máxima diversidad, tanto para animales como para plantas (Brown, 1997). En bosques de montaña se ha observado que la abundancia de heterópteros aumenta si la alteración por tala, extracción de leña, extracción de suelo e incendios incrementa hasta un nivel intermedio; a esta tendencia se le atribuye que en estos ambientes los recursos primarios puedan fluir a niveles tróficos superiores con relativa rapidez (Lange et al., 2011).
Huitepec es el sitio con menor nivel de alteración, que es prácticamente nula. Este sitio se caracterizó por tener una baja diversidad de especies abundantes (1D) y una diversidad alta con base en especies dominantes con base en (2D). La baja riqueza y abundancia de heterópteros contrasta con la alta riqueza de árboles, arbustos y hierbas, que podrían indicar un sitio sucesionalmente avanzado y con alta calidad ambiental para albergar una mayor diversidad de heterópteros (Mathieu et al., 2005). Torma y Császár (2012) registraron una relación lineal entre la diversidad de plantas y la diversidad de heterópteros cuando se trata de heterópteros sésiles o especializados, que dependen totalmente de la distribución de sus hospederos. La complejidad y heterogeneidad ambiental en Huitepec podría promover una alta diversidad, y es probable que para su registro se requiera de un mayor esfuerzo de colecta, como se aprecia en las curvas de extrapolación, en las cuales la diversidad de heterópteros de Huitepec sobrepasa a la del Cerrito, sin embargo, los límites de confianza se notan encimados.
La diversidad de heterópteros se relacionó positivamente con la altitud, y esto fue notable para Huitepec, en donde el intervalo de altitud fue mayor. La diversidad con frecuencia se asocia a la altitud, aunque el efecto no se refiere a la altitud por sí misma, sino a factores abióticos asociados a ella, como la temperatura, humedad, radiación, vegetación, entre otros, que son los que determinan la distribución de diversos grupos de insectos (Balam-Ballote y León-Cortés, 2010; Fauvel, 1999; Torma y Császár, 2012; Ulyshen, 2011; Zurbrügg y Frank, 2006).
Entre Cerrito y El Encuentro hay un recambio de especies del 46%, un valor semejante se observó entre El Encuentro y Huitepec, lo que indica un proceso de diferenciación temporal en la comunidad de heterópteros. Los bosques que difieren más en la composición de especies de heterópteros son Cerrito y Huitepec. La composición de la vegetación puede contribuir también a la diferenciación entre estas 2 comunidades, en particular si se considera que Huitepec y El Encuentro forman parte de una misma microcuenca con una historia geológica similar, pero historia de uso diferente, mientras que la fisonomía actual del Cerrito es de reciente creación, cuyo referente original no corresponde al de un bosque sino a vegetación abierta. Por otra parte, los heterópteros tienen una gran capacidad para colonizar (Becker, 1992), aspecto que contribuye a generar similitud entre los bosques.
La alta riqueza de especies en El Encuentro coincide con la observación de que también es el sitio que tuvo la mayor abundancia de gremios tróficos. Es posible que una comunidad rica en especies pueda ser también rica en grupos tróficos, debido a que se promueve la especialización y se reduce la competencia (Kraft, Godoy y Levine, 2015). Esta riqueza de grupos tróficos quizás refleje también la alta disponibilidad de alimento (Thiollay, 1992). El gremio de los fitófagos tuvo el mayor número de especies en todos los bosques, aunque el grupo de zoófagos fue el más abundante en El Encuentro. Los zoofitófagos que corresponden a 3 especies, sobresalen por su número de individuos en Cerrito.
Se ha observado que los heterópteros herbívoros y aquellos que se alimentan de otros heterópteros están presentes en la misma proporción tanto en islas (Canarias, Galápagos, Mediterráneo, Madeira), como en áreas continentales (noroeste de África, península Ibérica, Norteamérica) (Becker, 1992). En los bosques estudiados dominan los fitófagos tanto en número de especies como en abundancia, esto se puede explicar porque el recurso alimenticio para los fitófagos posiblemente es diverso y abundante en los 3 bosques. A su vez, los fitófagos pueden ser una fuente importante de alimento de los zoófagos.
Las 2 especies dominantes en Cerrito son zoofitófagas y pertenecen a la familia Miridae, Macrolophus sp. (nueva especie) y Tupiocoris sp. 1. Estas especies son de gran importancia en el control de poblaciones de otros insectos como áfidos (Aphididae), mosquita blanca (Aleyrodidae) y larvas de Heliothis zea (Boddie), entre otros (Dionyssios y Dionyssios, 2000; Lykouressis, Giatropoulos, Perdikis y Favas, 2008; Pérez-Hedo y Urbaneja, 2014). Tupiocoris se distribuye a lo largo de Sudamérica y se considera un género con amplio espectro de alimentación que generalmente se encuentra en solanáceas y cucurbitáceas, ya sea alimentándose de huevecillos de otros insectos (áfidos, trips, polillas y mosquita blanca) o alimentándose de los fluidos vegetales (Burla et al., 2014; López, Arce-Rojas, Villalba-Velásquez y Cagnotti, 2012). D. mimulus se registró en los 3 bosques, se considera una plaga importante del algodón y es propia de regiones tropicales (Fuseini y Kumar, 1975). En El Encuentro la especie más abundante fue P. karleane, que es de gran importancia por ser un depredador voraz, principalmente de Tetranychus urticae (Koch, 1836), la cual es una plaga importante de los cultivos de berenjena, calabacín y frijol, entre otros (Landeros-Flores et al., 2014). E. chiapus es otra especie de heteróptero dominante en El Encuentro y polífaga que se alimenta de pastos, árboles y arbustos frutales (McPherson y McPherson, 2000). En Huitepec las especies abundantes fueron: P. fasciata, P. mexicana, A. bimaculata, F. poetica y Monalocoris sp. 2., todas ellas son fitófagas (Wheeler, 2001).
Los fitófagos tuvieron una relación positiva a mayor altitud y cobertura de dosel en Huitepec y coincide con el hecho de que se colectaron pocos individuos (v.gr., Thyanta sp., Colimacoris sp. 1, F. poetica, Monalocoris sp. 2, Proba sp. 4, 7, 9 y Falconia intermedia). Este resultado sugiere que la distribución de los grupos tróficos puede estar relacionada con la disponibilidad y abundancia de plantas en las áreas de estudio. Mientras que los zoofitófagos se relacionaron con la alteración y se encontraron esencialmente en Cerrito y El Encuentro con especies como Macrolophus sp. 1, 2 y Tupiocoris sp. La presencia de los granívoros y los zoófagos en El Encuentro no se asoció a la altitud ni a la cobertura de los bosques.
La distribución de tamaños entre sitios varió significativamente. En general, los tamaños pequeños fueron los más abundantes y los tamaños grandes los menos abundantes. En El Encuentro se observó el mayor número de individuos grandes, después en Cerrito y Huitepec. El Encuentro tuvo un nivel intermedio de alteración, con respecto a los otros bosques, lo que posiblemente favorece que la energía fluya rápidamente entre las redes tróficas, lo cual se asume sucede en áreas con cierto grado de alteración (Lange et al., 2011), y eso permite que los organismos grandes puedan desarrollarse, aunque en menor abundancia que los pequeños. En Cerrito la categoría iv (7.1-11 mm) se relacionó con el grado de alteración y estuvo ampliamente representada por numerosos individuos de D. mimulus una importante plaga de cultivos de algodón y de D. subvittatus que se encuentran particularmente en sitios con gran cantidad de pastos.
Se ha postulado que los insectos pequeños, como los estafilínidos, son más susceptibles a los efectos de la fragmentación y perturbación (Caballero et al., 2009). Nuestro estudio sugiere que los heterópteros pequeños pueden persistir en ambientes alterados, ya que son abundantes en el sitio con la mayor perturbación como en el sitio con la menor perturbación y sucesionalmente más longevo (Huitepec). Los organismos grandes se encontraron con mayor frecuencia en ambientes con alteración intermedia como El Encuentro. Es posible que la mayor diversidad de especies de plantas de Huitepec (bosque con la menor perturbación) genere un ambiente heterogéneo y complejo para los heterópteros, en el que la búsqueda de alimento puede tener un costo energético mayor con un efecto negativo en reproducción y supervivencia de los heterópteros de tallas grandes (Torma y Császár, 2012).
En conclusión, la diversidad de heterópteros fue mayor en El Encuentro, mientras que la diversidad entre Cerrito y Huitepec no se observaron diferencias. Las curvas de interpolación (rarefacción)/extrapolación indican que si se incrementa el esfuerzo de muestreo la diversidad de los sitios puede llegar a ser similar. Todos los grupos tróficos estuvieron presentes en los 3 bosques, sin embargo, difieren en su abundancia. Los zoófagos y granívoros destacaron en El Encuentro, los zoofitófagos en Cerrito y los fitófagos en Huitepec. Todos los tamaños corporales se encontraron en los 3 bosques, pero difieren en la abundancia de heterópteros por rangos de tamaño. Las especies grandes fueron numéricamente más abundantes en El Encuentro que en cualquiera de los otros sitios. En Huitepec las especies más pequeñas resaltaron por su abundancia. La diversidad de heterópteros y fitófagos se correlacionó positivamente con la altitud. La diversidad de fitófagos se asoció con la altitud y la cobertura. La diversidad de zoofitófagos se relacionó con la alteración, particularmente en Cerrito.











 nueva página del texto (beta)
nueva página del texto (beta)



