Introducción
Desde el inicio de la taxonomía, la mayoría de las especies conocidas se han propuesto con base en rasgos morfológicos distintivos. Sin embargo, hay especies cuyos límites son difíciles de establecer con claridad por la plasticidad o la uniformidad de algunos atributos morfológicos. El análisis multivariado representa una herramienta útil para abordar esta problemática. Así lo muestran los trabajos sobre especies de diferentes familias de plantas como: Alliaceae (Gage y Wilkin, 2008), Boraginaceae (Peruzzi y Passalacqua, 2008), Brassicaceae (Salariato, Zuloaga y Al-Shehbaz, 2012), Bromeliaceae (De Faria, Wendt y Brown, 2010; Pinzón, Ramírez-Morillo y Fernández-Concha, 2011), Cactaceae (Baker, 2006; Sánchez, Arias y Terrazas, 2013), Hedwigiaceae (De Luna y Gómez-Velasco, 2008), Lamiaceae (Otieno, Balkwill y Paton, 2006), Leguminosae (Estrella, Aedo y Velayos, 2009; Egan, 2015; Fritsch, Schiller y Larson, 2009; Mascarenhas, Silveira y Paganucci, 2014; Pometti, Cialdella, Vilardi y Saidman, 2007), Lentibulariaceae (Domínguez, da Silva, Panfet-Valdés y de Miranda, 2014), Myristicaceae (Janovec y Harrison, 2002), Oleaceae (Hong-Wa y Besnard, 2014), Orchidaceae (Pedersen, 2010; Ponsie, Johnson y Edwards, 2009), Plantaginaceae (Sosa, Panseri y Dematteis, 2012), Poaceae (Gonzalo, Aedo, Nickrent y García, 2012; Harrison y Hebda, 2011), Potamogetonaceae (Kaplan y Marhold, 2012), Rosaceae (Joly y Bruneau, 2007), Sapindaceae (Pierre, le Moguédec, Lowry y Munzinger, 2014), Simaroubaceae (Schrader y Graves, 2011), Solanaceae (Fajardo, Castillo, Salas y Spooner, 2008) y Violaceae (Hodálová, Mered’a, Mártonfi, Mártonfiová y Danihelka, 2008). En estos casos, el análisis morfométrico permitió determinar con objetividad los límites entre complejos de especies, incluso en casos de hibridación o poliploidía, dando testimonio del valor que posee este método para solucionar diversas situaciones que la práctica taxonómica tradicional resuelve con dificultad. Un problema de esta índole lo representan los taxones afines a Cestrum guatemalense Francey.
El género Cestrum L. se reconoce morfológicamente por sus flores tubulares con 5 lóbulos pequeños, hojas enteras en disposición alterna, fétidas al estrujarse y bayas esferoides (para una descripción más detallada ver D’Arcy, 1999 y Nee, 2001). Las diferentes especies se distribuyen en zonas tropicales y subtropicales desde el sur de Florida y el norte de México hasta Chile, incluyendo las Antillas (Montero, Delgado, de Luna y Eguiarte, 2006). Algunas especies como C. nocturnum L., C. elegans (Brongn.) Schltdl. y C. parqui L’Hér. se han naturalizado alrededor del mundo (Benítez y D’Arcy, 1998). Varias de sus especies se conocen por su uso ornamental o por sus compuestos químicos tóxicos (Chakravarti y Chakravarti, 1969; Duperon, Thiersault y Duperon, 1983; Halim, Collins y Berigare, 1971; Hughes et al., 1977; Karawya, Rizk, Hammouda, Diab y Ahmed, 1971; Ripperberger y Schreiber, 1981). Recientemente se han publicado nuevos taxones dentro del género (Cuevas-Guzmán y Montero-Castro, 2011; Montero, 2011; Monro, 2012; Soto-Solís, 2007).
En el estudio sobre las relaciones filogenéticas de Cestrum, Montero et al. (2006) incluyeron entre otras especies a C. guatemalense y C. pacayense, las cuales conformaron un grupo monofilético con C. dasyanthum Donn. Sm., esta última especie también se distribuye en Guatemala, pero es fácilmente reconocible morfológicamente, en cambio las 2 primeras son muy similares (tabla 1). Tanto C. guatemalense como C. pacayense fueron descritas por Francey (1935), la primera de un ejemplar recolectado por E. W. Nelson proveniente de Huehuetenango, Guatemala. En cambio C. pacayense fue descrita con base en un ejemplar recolectado por W. A. Kellerman en el volcán Pacaya de ese mismo país. Otro ejemplar de este recolector en la misma localidad fue utilizado por Francey para describir a C. kellermanii. En esa misma obra se tipificó a C. mexicanum de un ejemplar de A. B. Ghiesbreght proveniente del cerro de Huitepeque, al oeste de San Cristóbal de las Casas, Chiapas.
Tabla 1 Características relevantes de acuerdo a Francey (1936) para diferenciar las especies de Guatemala mencionadas en el texto.

Sin embargo, las descripciones de Francey mencionan diferencias mínimas entre las 4 especies, las cuales difieren principalmente en el tamaño de las hojas, el cáliz, pedicelo y pubescencia (tabla 1). Esto lo detectó Morton (1936) en el caso de C. kellermanii, y solo un año después de haber sido publicada, consideró que el tipo de esta especie es un ejemplar de C. pacayense, proponiendo la sinonimia. Desde entonces cualquier ejemplar que pudo concordar con las características de C. kellermanii ha sido identificado como C. pacayense, con lo cual estamos de acuerdo en este estudio (después de comparar los tipos). Otro aporte de Morton es la descripción de C. guatemalense var. gracile, aunque lo hace de forma muy escueta, mencionando solo su cáliz pubérulo y el tubo de la corola alargado. Esta variedad se incluyó en la Flora de Guatemala (Gentry y Standley, 1974) sin un aporte complementario en la descripción morfológica o sin incluir alguna recolecta adicional al tipo; de hecho, hasta la fecha no se ha vuelto a recolectar. El especialista de la familia Solanaceae Michael Nee (comunicación personal), confirma la sinonimia de Morton al considerar a C. kellermanii como C. pacayense; por otro lado, considera que C. guatemalense var. gracile debe incluirse bajo la variación de C. guatemalense.
Por lo antes expuesto es necesario clarificar las diferencias entre estas entidades taxonómicas y proponer los criterios para su separación. En este trabajo, consideramos que un análisis morfométrico puede ser un criterio apropiado para establecer una posición menos ambigua en la sistemática de estos taxones. Por lo tanto, el objetivo de este trabajo es contribuir a la caracterización de C. guatemalense, C. mexicanum y C. pacayense proponiendo caracteres útiles para identificarlas.
Materiales y métodos
Se examinaron los ejemplares de las diferentes especies de los herbarios: Museo Field de Historia Natural de Chicago (F), Instituto de Ecología, Centro Regional del Bajío (IEB), Nacional de México (MEXU), Jardín Botánico de Missouri (MO), Jardín Botánico en New York (NY), Universidad de Texas-Austin (TEX) y Nacional de Estados Unidos de América (US). La consulta de las colecciones de los herbarios F, MO, NY y US se realizó cuando se encontraban en préstamo en MEXU, mientras que las colecciones de TEX se revisaron cuando estaban en préstamo en el herbario del IEB. Se procuró incluir a todos los ejemplares procedentes de Guatemala, El Salvador, Honduras y México, abarcando toda su distribución geográfica; sumando un total de 158 ejemplares, los cuales incluyen recolectas realizadas de la fecha hasta hace más de 100 años, por lo que se considera que se contó con una muestra bien representada de las especies estudiadas (apéndice 1). Los ejemplares carentes de flores en antesis fueron excluidos, analizando finalmente el 65% de los ejemplares, de los cuales 34 fueron: C. guatemalense, 23 C. mexicanum y 47 C. pacayense. Además, se examinaron los ejemplares tipo de C. guatemalense (US 252589), C. mexicanum (MO 3942646), C. pacayense (MO 2659005, US 2442998), C. kellermanii (MEXU 125408, US 2441914) y C. guatemalense var. gracile (US 1335349). Este último ejemplar tipo tiene una sola flor siendo inadecuado realizar disecciones del mismo, solo se pudo acceder a la imagen, por lo que fue excluido del análisis.
Las hojas e inflorescencias se midieron con un vernier de 0.02 mm de precisión, mientras que las partes florales se midieron con la ayuda de la regla del ocular del microscopio estereoscópico Olympus TL3. Se consideraron inicialmente 21 caracteres morfológicos cuantitativos, 4 de los cuales son vegetativos y 17 reproductivos (tabla 2, fig. 1). Se realizaron procedimientos exploratorios manuales para descartar datos aberrantes. Se evaluó la correlación (Pearson, 1905), la normalidad (Shapiro, Wilk y Chen, 1968) y la homocedasticidad de varianzas (Bartlett, 1937). A partir de este paso los caracteres se transformaron con logaritmo natural. A cada carácter se le aplicó un Anova con un nivel de significación de 0.05; los caracteres antera, estigma, ovario y los relativos a los lóbulos de la corola no presentaron diferencias estadísticas significativas entre los taxones estudiados, por lo que fueron excluidos. La uniformidad de las dimensiones de anteras y de ovarios entre especies Cestrum del centro de México ha sido documentada por Ramírez-Segura (2013).
Tabla 2 Resumen de los análisis de normalidad, homocedasticidad y diferencia entre medias de los caracteres utilizados en este estudio con el código utilizado en las gráficas de los análisis multivariados entre paréntesis.
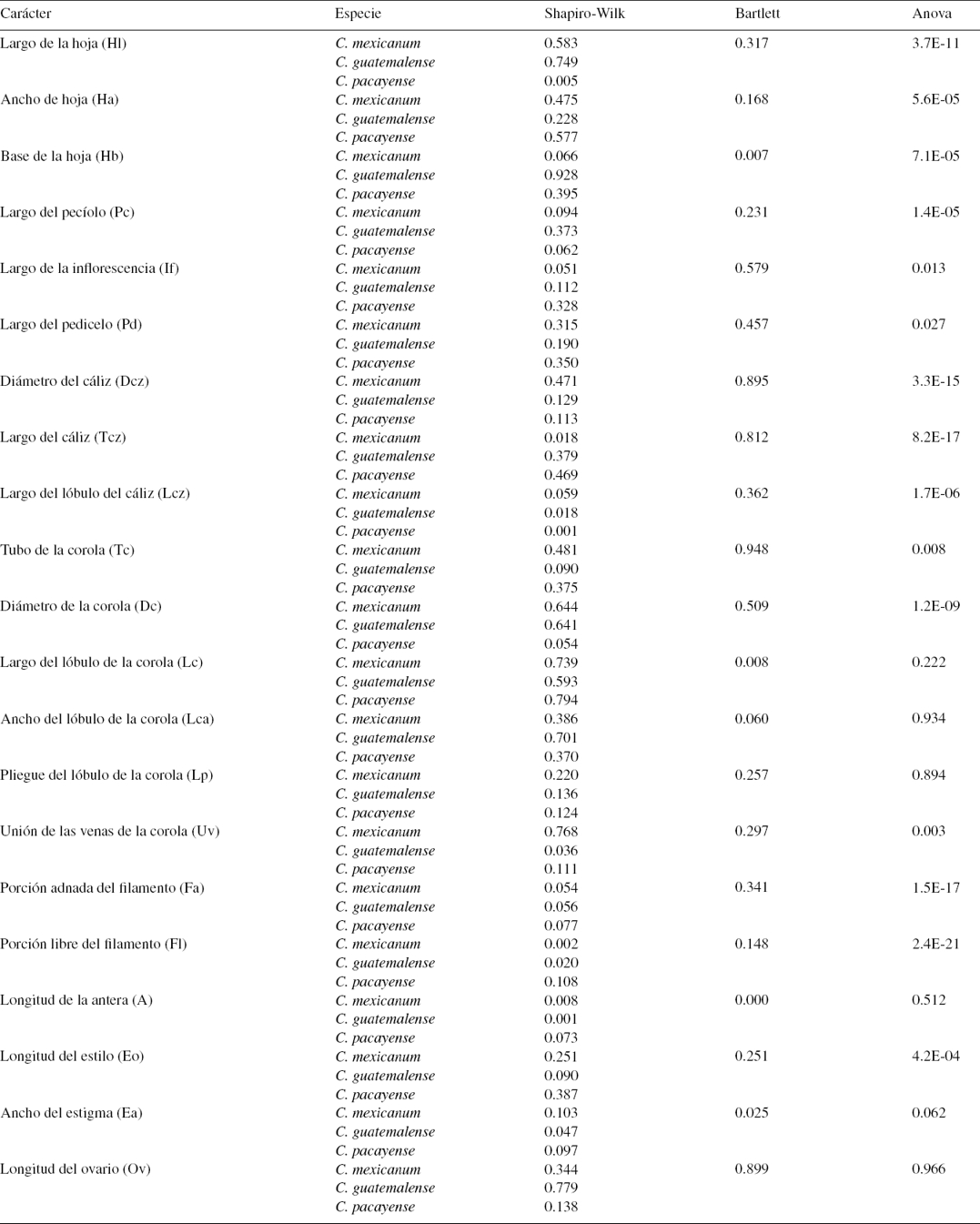
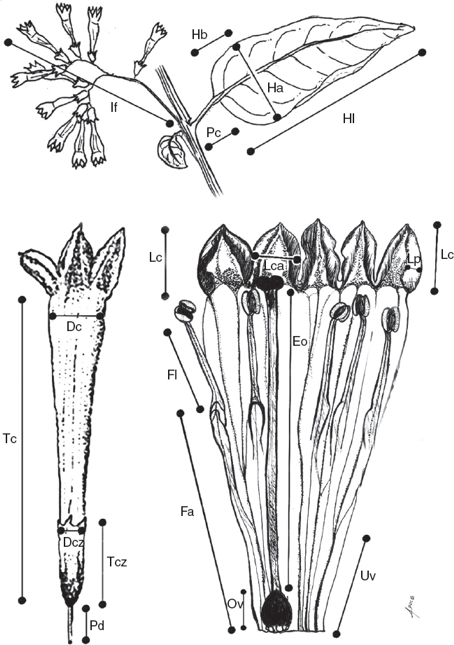
Figura 1 Esquema de la mayoría de los caracteres utilizados en el estudio: largo de la hoja (Hl), ancho de la hoja (Ha), base de la hoja (Hb), largo del pecíolo (Pc), largo de la inflorescencia (If), largo del pedicelo (Pd), largo del cáliz (Tcz), diámetro del cáliz (Dcz), largo de la corola (Tc), diámetro de la corola (Dc), largo de los lóbulos de la corola (Lc), ancho de los lóbulos de la corola (Lca), ancho del pliegue del lóbulo de la corola (Lp), unión de las nervaduras en la corola (Uv), porción adnada del filamentos (Fa), porción libre del filamento (Fl), largo del ovario (Ov), largo del estilo (Eo).
Se realizó una prueba de homogeneidad de dispersión multivariada (Anderson, 2006) implementada con la función «betadisper» y un análisis de varianza multivariada por distancias con permutaciones llevado a cabo con la función «adonis» (Anderson, 2001). Se realizó un análisis de componentes principales (ACP) con la matriz de correlación para obtener nuevos ejes que expliquen de manera más óptima la variación de los datos y para evaluar la utilidad de las diferentes variables en el estudio. Con base en los resultados encontrados en el ACP y los grupos predefinidos por las especies se hizo un análisis discriminante canónico. Todos los análisis se realizaron con el programa R versión 3.2.5 (R-Core-Team, 2016).
Resultados
Los caracteres presentaron correlaciones moderadas, el valor más alto (0.77) se presentó entre el largo y ancho de la hoja. La mayoría de los caracteres pasaron las pruebas de Shapiro-Wilk y Bartlett (tabla 2). Los caracteres: largo, ancho y pliegue de los lóbulos de la corola, antera, estigma y ovario, fueron excluidos al no mostrar diferencias significativas entre las especies según el Anova, por lo que en los análisis subsecuentes solo se incluyeron 15 caracteres (tabla 2). En el caso de la prueba de homogeneidad de dispersión multivariada no se detectaron desviaciones significativas (p = 0.269). El análisis de varianza multivariada por distancias produjo un R2 = 0.3 (p = 0.001).
Los 3 primeros componentes del ACP explican el 60% de la varianza. En el primer componente, la porción libre del filamento es el carácter que tuvo la carga más alta, en el segundo fue el pecíolo, mientras que en el tercero el predominio fue para el pedicelo (tabla 3). En el biplot (fig. 2) se observa que en uno de los cuadrantes se ubicaron casi exclusivamente ejemplares de C. mexicanum, influenciados por los caracteres: porción libre del filamento, largo y ancho del cáliz. En el resto de la gráfica se encuentran los ejemplares de los otros taxones incluidos en el análisis. La mayoría de los ejemplares de C. pacayense se disponen en la dirección de los caracteres, largo de las hojas y largo del pecíolo, mientras que los C. guatemalense se distribuyen en la dirección opuesta. Pocos ejemplares se alejan de los 2 grupos principales, 2 casos a notar son los rotulados como p41y p42 que se encuentran en una posición intermedia de los grupos principales, los cuales son ejemplares de C. pacayense que se distribuyen en los alrededores de Motozintla, Chiapas (datos de colecta en el apéndice 1).
Tabla 3 Desempeño de los caracteres en los 3 primeros componentes del ACP y en los determinantes canónicos.


Figura 2 Gráfico de ACP. Los ejemplares de Cestrum mexicanum se etiquetan con «m», los ejemplares de C. guatemalense se etiquetan con «g» y los ejemplares de C. pacayense se etiquetan con «p», los tipos de estas especies se etiquetan con letras mayúsculas; además se incluye el tipo de C. kellermanii etiquetado con «K».
La primera función discriminante explica el 80% de la variación, siendo el carácter de mayor importancia la porción adnada del filamento; en la segunda función discriminante el carácter más importante es el largo de la hoja (tabla 3). El porcentaje de casos bien clasificados fue del 92%. La clasificación más efectiva fue para C. mexicanum (con el 100% de clasificación correcta). En cambio, 5 individuos de C. guatemalense fueron clasificados como C. pacayense y 3 individuos de C. pacayense fueron clasificados como C. guatemalense. En el gráfico del espacio generado por las 2 primeras variables canónicas (fig. 3), los ejemplares de C. mexicanum conforman un grupo discreto sobre la parte positiva de la primera función discriminante. Hacia la parte negativa de esta función se agrupan los individuos de C. guatemalense y C. pacayense sin una separación clara. Al centro de este agrupamiento, cerca del cero de la segunda función se agruparon individuos de ambas especies y el tipo de C. kellermanii. Hacia la parte positiva del segundo componente se encuentra el tipo de C. pacayense con la mayoría de los ejemplares de esta especie. Hacia la parte negativa de este componente se encuentra el tipo de C. guatemalense y la mayoría de los ejemplares de esta especie. Los ejemplares p41y p42 que en el ACP se encontraban entre los 2 grupos principales, en este análisis se circunscriben a la elipse que delimita a los ejemplares de C. pacayense.
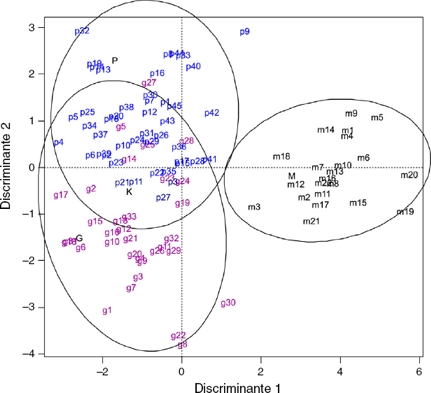
Figura 3 Gráfica del AD. Los ejemplares de Cestrum mexicanum se etiquetan con «m», los ejemplares de C. guatemalense se etiquetan con «g» y los ejemplares de C. pacayense se etiquetan con «p», los tipos de estas especies se etiquetan con letras mayúsculas; además se incluye el tipo de C. kellermanii etiquetado con «K».
Discusión
El ACP indica que los caracteres más importantes para resumir la variación de las especies son el largo de la porción libre del filamento, seguido por el diámetro del cáliz. Los discriminantes canónicos también indican la importancia del diámetro del cáliz en la ordenación, pero en lugar de destacar la porción libre del filamento asignan una mayor importancia a la porción adnada del mismo. De cualquier manera, esto va en concordancia con la ordenación en 2 grupos. En C. mexicanum, la porción libre del filamento tiene una media de 4.6 mm y la porción adnada del filamento de 7.2 mm, mientras que en C. guatemalense la porción libre es de 2.9 mm y la adnada es de 10.7 mm, similar a C. pacayense que tiene la porción libre del filamento de 2.8 mm y la adnada de 11.4 mm. La adnación de los filamentos se usó por Benítez y D’Arcy (1998) en la delimitación taxonómica de los Cestrum distribuidos en Venezuela con buenos resultados. En cuanto al diámetro del cáliz, C. mexicanum tiene una media de 3.1 mm, mientras que en C. pacayense y C. guatemalense es de 2.2 mm y 2.3 mm respectivamente. Otros caracteres que aportan en el mismo sentido de la separación en 2 grupos es el diámetro de la corola y el tamaño de la inflorescencia, ambos de mayores dimensiones en C. mexicanum comparados con los ejemplares de las otras especies. La concordancia de los ACP y el análisis discriminante canónico en la obtención de un agrupamiento discreto de los ejemplares de C. mexicanum incluyendo al tipo de esta especie nos brinda confianza para proponer a estos ejemplares que se restringen a las montañas del norte y a la meseta central de Chiapas como una especie distinta.
Por otro lado, el largo del pedicelo es una característica utilizada por Francey (1935, 1936) para diferenciar a los taxones aquí considerados; sin embargo, los análisis realizados evidenciaron este carácter como poco importante. Otro atributo que este autor utiliza para caracterizar a C. guatemalense es el tamaño de las hojas. La importancia de este carácter se refleja en el segundo componente principal y en ambos coeficientes de discriminación lineal. Sin embargo, la influencia de los caracteres de hoja no es suficiente para separar a las especies propuestas, encontrando en las gráficas de ambos análisis un grupo en el que se mezclan individuos de C. guatemalense y C. pacayense. Aunque el tipo de la primera especie se ubica entre los ejemplares de hojas más pequeñas y el tipo de la segunda con los de hojas grandes, hay un continuo de ejemplares de hojas medianas, donde por cierto se encuentra el tipo de C. kellermani, lo que podría estar indicando que C. guatemalense y C. pacayense son los extremos de la variación de las hojas de una sola especie. Con base en los caracteres analizados no es posi ble sugerir una separación adicional entre estos 2 taxones. Si bien se pueden detectar agrupamientos donde predominan ya sea C. pacayense o C. guatemalense, los ejemplares intermedios y su distribución compartida en las montañas de Guatemala podrían estar indicando una variación clinal. Para descartar este efecto clinal es necesario un estudio donde se registren datos de pendiente y orientación, y clima de las localidades de recolecta, contrastándolos con los datos morfométricos. También es recomendable procurar colectas con frutos y semillas para incluir caracteres de estas estructuras en subsecuentes estudios morfométricos. Un análisis adicional con marcadores moleculares contribuiría a indicar el flujo génico entre las poblaciones o a encontrar evidencia para proponer linajes independientes.
Si bien Benítez y D’Arcy (1998) y Castro-Laportte y Ruíz-Zapata (2000) propusieron que los polinizadores están incidiendo en la evolución de las flores de las especies de Cestrum —como el caso del cáliz en las especies del centro de México, del cual D’Arcy (1999) señala que la evolución de dicha estructura es una respuesta evolutiva al robo de néctar—, en este estudio se evidenció que algunos caracteres florales se han conservado entre las especies y otros se han diferenciado, lo que podría estar indicando que la evolución en las partes florales no está actuando sobre un síndrome, sino que cada componente evoluciona de forma independiente. De esta manera, para algunas estructuras la evolución está actuando de forma diversificadora y en otras estructuras actúa de forma estabilizadora. En estudios de biología reproductiva (Thomson y Wilson, 2008; Wilson, Wolfe, Armbruster y Thomson, 2007) se ha propuesto que la estasis de los caracteres florales podría estar indicando que están actuado restricciones funcionales importantes que impiden la divergencia evolutiva.
Caracteres como los lóbulos de la corola, antera, estigma y ovario son muy homogéneos entre las especies estudiadas. Las características morfométricas que permiten separar más fácilmente a C. mexicanum son el filamento del estambre adnado a la corola entre 3/5 a 3/4 partes de su longitud y el diámetro del cáliz de 2.7 a 3.4 mm. Otras características que han sido utilizadas en la separación de C. guatemalense y C. pacayense, como el pedicelo de las flores y las dimensiones de la hoja, aunque presentan variación, no son definitivas en la delimitación de estas entidades.











 nueva página del texto (beta)
nueva página del texto (beta)


