Introducción
La diversidad total de especies de una región es resultado de la combinación de la diversidad a nivel local, diversidad alfa, y de la disimilitud en la composición de especies entre comunidades, diversidad beta, componentes básicos para entender los patrones de variación espacial de la diversidad (Whittaker, 1960). Tradicionalmente, la diversidad alfa se evalúa contabilizando el número o riqueza de especies presentes en una comunidad y la diversidad beta a través de índices que miden la disimilitud en la composición de especies entre las comunidades. Diferentes autores han señalado limitaciones de las medidas tradicionales como la riqueza de especies y los índices de disimilitud, por ser medidas neutrales. Las medidas neutrales consideran de igual forma a todas las especies, asumiendo que todas ellas poseen el mismo valor y no incorporan información acerca de sus diferencias (Chao, Chiu y Jost, 2010; Gaston, 1996; Harper y Hawksworth, 1995; Magurran, 2004; Morrone, 2013). Las diferencias entre las especies pueden basarse en rasgos genéticos, ecológicos, morfológicos, fisiológicos, biogeográficos, taxonómicos, filogenéticos o funcionales (Gaston, 1996; Gaston y Spicer, 2004).
Para una medición más completa de la diversidad se han propuesto medidas que reconocen diferencias entre las especies (Chao et al., 2010; Purvis y Hector, 2000). Una de estas medidas no neutrales es la ‘diversidad taxonómica’, que toma en cuenta la clasificación jerárquica linneana por arriba de la categoría de especie (Pielou, 1975), y a lo que en este trabajo se le llama «estructura taxonómica». Así, el valor de la diversidad taxonómica de cada comunidad estará en función de la estructura taxonómica que posean sus especies. Una comunidad tendrá mayor diversidad taxonómica si sus especies pertenecen a distintos géneros, y más aún, si los géneros pertenecen a distintas familias, que si sus especies son cogenéricas y están relacionadas de manera cercana (Clarke y Warwick, 1998; Pielou, 1975). Bajo esta aproximación se puede incorporar información histórico-evolutiva de una comunidad para analizar tanto la diversidad alfa como la diversidad beta (Bacaro, Ricotta y Mazzoleni, 2007; Izsák y Price, 2001). La diversidad alfa taxonómica es el grado de relación entre las especies dentro de la estructura taxonómica de una comunidad, y es un reflejo de su diversidad evolutiva. Por su parte, la disimilitud o diversidad beta taxonómica es el grado de diferenciación en la composición de taxones entre comunidades.
En un ejemplo hipotético, se comparan 2 comunidades ecológicas (A y B) bajo 2 escenarios diferentes de estructura taxonómica (I y II) (fig. 1). En ambos escenarios, las comunidades A y B tienen la misma riqueza de especies y el mismo número de especies compartidas y exclusivas, de manera que la disimilitud de especies entre comunidades en ambos escenarios es la misma (0.79). Sin embargo, al considerar la estructura taxonómica, en el escenario I la comunidad A tiene una diversidad alfa taxonómica más alta (69.4) que en el escenario II. Este valor es distinto debido a que sus 9 especies representan a 7 géneros contenidos en 4 familias, mientras que en el escenario II, las 9 especies de la comunidad A pertenecen a solo 3 géneros, agrupados en 2 familias. En este mismo ejemplo, considerando la estructura taxonómica, la disimilitud taxonómica entre la comunidad A y B cambia en cada escenario. Hay una menor disimilitud taxonómica en el escenario I (0.44) porque todos los géneros y familias se comparten entre las comunidades A y B. En tanto que en el escenario II el valor de disimilitud taxonómica es más alto (0.80) porque solo se comparte un género y una familia.
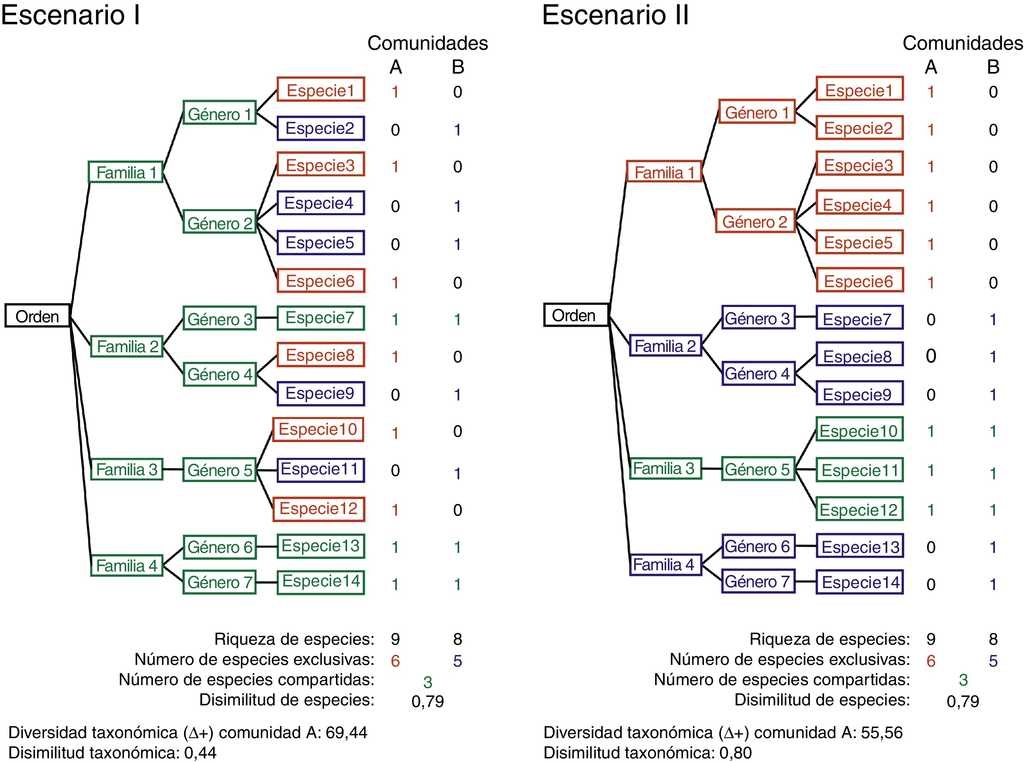
Figura 1 Escenarios hipotéticos (I y II) que representan pares de comunidades con la misma riqueza y disimilitud de especies pero con distinta diversidad y disimilitud taxonómica. En ambos escenarios se señalan en rojo los taxones exclusivos de la comunidad A, en azul los exclusivos de la comunidad B y en verde los taxones compartidos. La figura a color se muestra solo en la versión online de este artículo.
En México, la provincia biogeográfica más heterogénea y compleja en historia geológica y biótica es la Faja Volcánica Transmexicana (FVT), que se localiza principalmente entre los 19° y 21° de latitud norte, entre los 1,500 y 3,000 m de altitud, y forma una faja transversal extendida del Golfo de México al Océano Pacífico (Ferrusquía-Villafranca, 2007). Esta provincia queda incluida dentro de la Zona de Transición Mexicana y es reconocida como centro de diversificación, endemismo y transición para una gran variedad de taxones (Halffter, 2006; Gámez, Escalante, Rodríguez, Linaje y Morrone, 2012; Morrone, 2010). Se reconocen por lo menos 3 grandes sectores bióticos dentro de esta provincia: el sector occidental (Colima, Jalisco y Nayarit), central (estado de México, Hidalgo y Guanajuato) y oriental (Veracruz, Puebla y Tlaxcala). Es en esta última porción donde se localizan las montañas volcánicas de mayor altura del país: Pico de Orizaba (5,675 m), Popocatépetl (5,452 m), Iztaccíhuatl (5,286 m) y La Malinche (4,461 m), además de otras de menor altitud (Velasco-de León, Arellano, Silva-Pineda y Yussim, 2007). Entre los tipos de vegetación que ocupan la mayor extensión en esta provincia están los bosques de encino, pino, oyamel y sus diferentes asociaciones que cubren 30,764 de los 58,274 km2 de la provincia (Suárez-Mota, Téllez-Valdés, Lira-Saade y Villaseñor, 2013).
Los estudios sobre coleópteros en la FVT son aún escasos y principalmente de tipo biogeográfico. Un ejemplo ilustrativo de este tipo de estudios es el de Corona, Toledo y Morrone (2007), quienes analizaron la distribución de varias familias de coleópteros y concluyeron que la FVT no representa una unidad biogeográfica natural, debido a que su fauna de escarabajos muestra relación con la fauna de escarabajos de diferentes provincias biogeográficas. También existen estudios faunísticos de coleópteros de la superfamilia Scarabaeoidea en bosques de coníferas y encinos, en altitudes que van desde los 2,300 hasta los 3,500 m, en las zonas montañosas características de la porción centro-oriente: Villa de Allende, Pico de Orizaba, Popocatépetl, Iztaccíhuatl, La Malinche, Sierra Tlaxco-Caldera-Huamantla y Bloque Tlaxcala (Chacón, Aragón y Morón, 2013; Delgado-Solano, Aragón y Morón, 2013; García-de Jesús, 2011; García-de Jesús, Morón y Aragón, 2013; Minor, 2010; Morón y Zaragoza, 1976; Rodríguez, Aragón y Morón, 2013; Salamanca-Calixto, Aragón y Morón, 2013). En estos tipos de bosques la familia Melolonthidae reúne de 6 a 15 géneros que agrupan entre 14 a 44 especies, donde, a excepción de las faunas de Villa de Allende y Popocatépetl, la riqueza es muy similar.
Dentro de la superfamilia Scarabaeoidea, los escarabajos de las subfamilias Melolonthinae, Rutelinae y Dynastinae se incluyen en la familia Melolonthidae, que en México está integrada por 1,049 especies (Morón, 2010; Cherman y Morón, 2014). La mayoría de las especies tienen hábitos edafícolas, es decir, pasan la mayor parte de su ciclo de vida en el suelo, principalmente en estado larval, que es el periodo donde tienen mayor interacción e impacto en el ecosistema. Esta persistencia en estado larval, además de su marcada abundancia y biomasa, la alta capacidad de procesamiento del sustrato y su alta movilidad en los ambientes edafícolas hacen que este grupo de escarabajos sea uno de los más importantes de la fauna del suelo (Morón, 2001; Morón, Rodríguez-del Bosque, Aragón y Ramírez-Salinas, 2010). En ambientes forestales tienen un impacto en el ecosistema tanto por su participación en los procesos de fragmentación y reciclaje de la madera y la hojarasca como por su posible papel como plagas (Aragón, Tapia-Rojas y López-Olguín, 2013; Morón, 1985).
Por las características mencionadas, resulta importante conocer la distribución espacial de estos escarabajos y su variación en ecosistemas forestales en la FVT. Teóricamente, en hábitats similares la riqueza de especies tiende a mostrar valores parecidos, pero las circunstancias históricas y geográficas pueden tener efectos sobre las comunidades a nivel local (Schluter y Ricklefs, 1993). Estos efectos no se pueden observar al considerar solo el número de especies, de modo que los índices de diversidad taxonómica son medidas complementarias con un alto potencial en estudios sobre la variación espacial y ambiental de la diversidad (Warwick y Clarke, 1998).
El objetivo de este trabajo es describir los patrones de diversidad alfa y beta (disimilitud) de las comunidades de escarabajos melolóntidos en 8 regiones montañosas de la porción centro-oriente de la FVT. Para ello, se utilizan 2 medidas complementarias, riqueza de especies y diversidad taxonómica. Dada la compleja historia biogeográfica de la región, se espera que la riqueza de especies y la diversidad taxonómica sigan distintas tendencias. También debido a la complejidad de la FVT se espera que la diversidad beta sea alta y que se refleje tanto a nivel de especies (disimilitud de especies) como a niveles taxonómicos superiores (disimilitud taxonómica).
Materiales y métodos
Obtención de datos
A partir de la revisión de 8 estudios faunísticos de escarabajos de la superfamilia Scarabaeoidea, se elaboró una lista de especies de la familia Melolonthidae. Cuatro estudios son representativos de la fauna de las principales formaciones volcánicas: Pico de Orizaba, Popocatépetl, Iztaccíhuatl y La Malinche (Chacón et al., 2013; García-de Jesús et al., 2013; Rodríguez et al., 2013; Salamanca-Calixto et al., 2013); otros 2 se incluyen dentro de la parte de la Sierra de Tlaxco-Caldera-Huamantla (Delgado-Solano et al., 2013; García-de Jesús, 2011); el bloque de Tlaxcala se encuentra representado por el trabajo realizado en la Barranca de Huehuetitla (municipio de Panotla) (Minor, 2010); y el último estudio corresponde a Villa de Allende, en el estado de México (Morón y Zaragoza, 1976), que representa la porción central de la FVT (fig. 2). Se eligieron los registros de abundancia de las especies de las subfamilias Melolonthinae, Rutelinae y Dynastinae, incluidas dentro de la familia Melolonthidae (Cherman y Morón, 2014; Endrödi, 1966). No se consideraron los datos de los ejemplares que se recolectaron solo en zonas agrícolas y áreas urbanas (tabla 1). Se obtuvo una base de datos con 6,033 registros de escarabajos de 88 especies de la familia Melolonthidae. Las categorías taxonómicas (especie, subgénero, género, subtribu, tribu, subfamilia y familia) se establecieron siguiendo la clasificación propuesta por Morón (2010; Anexo).
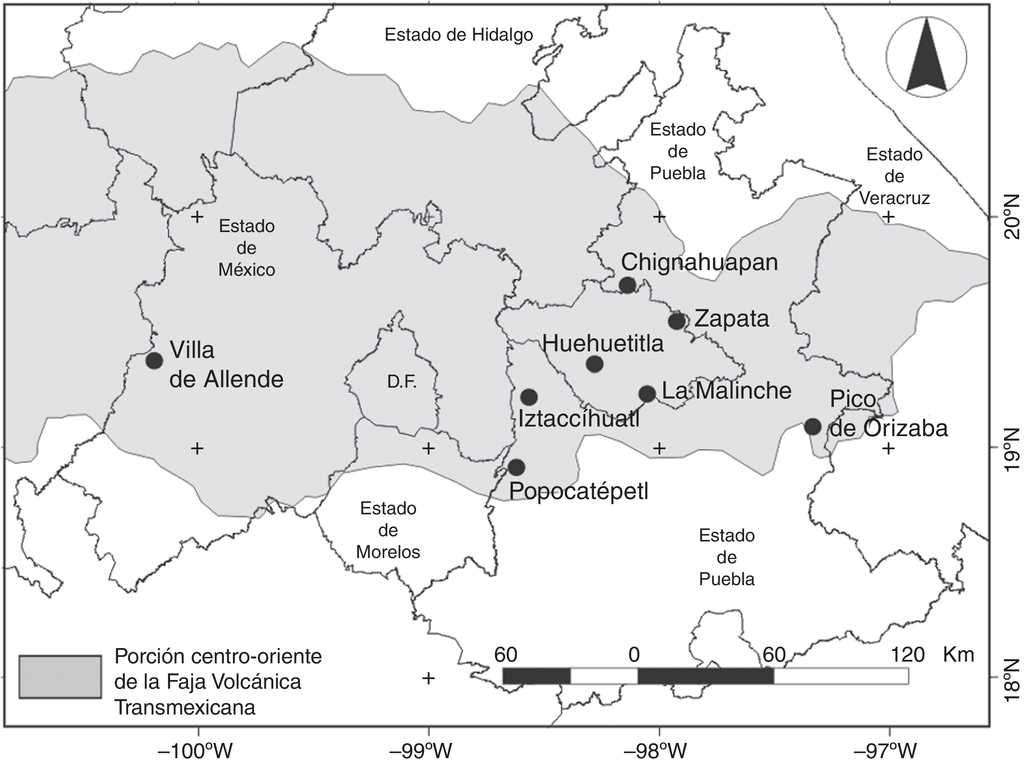
Figura 2 Ubicación de los 8 sitios donde se desarrollaron estudios faunísticos de escarabajos Scarabaeoidea (círculos negros) en la porción centro-oriente de la Faja Volcánica Transmexicana.
Tabla 1 Tipos de vegetación registrados para las localidades de cada fauna de escarabajos. Además, se muestran los valores de completitud para cada inventario (Cm: cobertura de la muestra) con base en los datos de abundancia (número de individuos recolectados) y especies raras (con uno y con 2 individuos).
| Región | Vegetación | Abundancia | Especies con Un individuo |
Especies con Dos individuos |
Riqueza específica |
Cm |
|---|---|---|---|---|---|---|
| Pico de Orizaba | BP, BO, BP/ATF | 866 | 3 | 4 | 19 | 0.997 |
| Popocatépetl | BP, BE, BEP/AT | 2,461 | 10 | 7 | 44 | 0.996 |
| Iztaccíhuatl | BP | 437 | 3 | 0 | 17 | 0.993 |
| La Malinche | BP, BO, BOP, BPE; BP/CM | 467 | 4 | 2 | 18 | 0.991 |
| Chignahuapan | BP, BPE; BEP, BP, CM | 260 | 7 | 2 | 16 | 0.973 |
| Zapata | BPE, BO | 312 | 1 | 3 | 15 | 0.997 |
| Huehuetilta | BE, BG, MX | 117 | 3 | 2 | 14 | 0.975 |
| Villa de Allende | BP, BPE | 1,111 | 7 | 2 | 28 | 0.994 |
ATF: agricultura de temporal y frutales; AT: agricultura de temporal; BE: bosque de encino; BEP: bosque de encino-pino; BG: bosque de galería; BO: bosque de oyamel; BP: bosque de pino; BPE: bosque de pino-encino; BOP: bosque de oyamel-pino; CM: cultivo de maíz; MX: matorral xerófilo.
Análisis de datos
Se evaluó la completitud de los inventarios por medio de la «cobertura de la muestra» (Cm), calculada como la proporción del número de individuos totales en la comunidad que pertenecen a las especies representadas en la muestra (Chao y Jost, 2012). El déficit de cobertura (1-Cm) representa la probabilidad de que el próximo individuo recolectado pertenezca a una especie aún no registrada previamente en el inventario (Chao y Jost, 2012).
Se calculó la riqueza de especies esperada de cada inventario considerando una Cm = 0.985, de esta forma, se estandarizó la riqueza de especies de las 8 comunidades a un mismo nivel de completitud en sus inventarios. Se utilizaron procedimientos de extrapolación e interpolación con 100 aleatorizaciones en el programa iNETX versión 1.3.0 disponible en línea https://chao.shinyapps.io/iNEXT (Hsieh, Ma y Chao, 2013). Los valores de riqueza de cada comunidad fueron comparados estadísticamente a través de los intervalos de confianza al 95%.
La diversidad taxonómica se midió con el índice de distancia taxonómica promedio (average taxonomic distinctness, Δ+) entre pares de especies de cada comunidad (Clarke y Warwick, 1998):
donde, S es el número de especies y ωij es la distancia que une a las especies i y j en la clasificación taxonómica, es decir, el número de taxones superiores que separan a 2 especies hasta que se unen en un nivel jerárquico superior. La distancia taxonómica promedio toma en cuenta la categoría taxonómica en la cual está relacionada cualquier pareja de especies y mide la separación taxonómica promedio entre 2 especies seleccionadas al azar de la comunidad. Se utilizó una estandarización en la que el valor máximo de este índice es 100, que correspondería a la distancia taxonómica de 2 especies que pertenecen a distintas subfamilias de la familia Melolonthidae. Así, un valor alto de distancia taxonómica promedio refleja una diversidad taxonómica alta. Este índice, así como la distancia taxonómica promedio esperada por azar fue calculada a partir de 1,000 aleatorizaciones del conjunto de especies de cada comunidad en el programa PRIMER v5 (Clarke y Gorley, 2001).
Para evaluar la hipótesis de que la diversidad taxonómica sigue una tendencia distinta a la de la riqueza de especies, se realizó un análisis de correlación de Pearson con los valores obtenidos en las 8 comunidades. El resultado esperado es una falta de correlación. Por el contrario, una correlación significativa indicaría que la riqueza y la diversidad taxonómica proporcionan la misma información y serían por lo tanto medidas redundantes de la biodiversidad.
La diversidad beta a nivel de especies se midió como la disimilitud basada en el índice de similitud de Jaccard (βJ). Este índice compara la composición de especies entre 2 comunidades en función de su incidencia:
donde, βJ es la similitud en composición de especies, a es el número de especies compartidas entre las 2 comunidades, b es el número de especies presentes en una comunidad, y c es el número de especies en la otra comunidad. El índice βJ es la proporción que representan las especies compartidas de la riqueza total presente en 2 comunidades. Por tanto, la disimilitud es 1-βJ, y varía de 0 (cuando la composición de especies es idéntica), a 1 (cuando la composición de especies es totalmente diferente).
La disimilitud taxonómica se midió como 1-ΔT, donde ΔT es el índice de similitud taxonómica descrito por Bacaro et al. (2007), que se basa en el índice de Jaccard y mide el grado de similitud en la clasificación taxonómica de 2 comunidades, incluyendo a los taxones supraespecíficos. La fórmula es la siguiente:
donde, ΔT es la medida estandarizada de similitud taxonómica, Ta es el número de categorías taxonómicas compartidas entre 2 comunidades, Tb es el número de categorías taxonómicas en la estructura taxonómica de una comunidad, y Tc es el número de categorías taxonómicas en la estructura taxonómica de la otra comunidad. Los valores de disimilitud taxonómica (1-ΔT) van de 0, cuando la estructura taxonómica del conjunto de especies de ambas comunidades es idéntica, a 1 cuando la estructura taxonómica de las especies de ambas comunidades es totalmente diferente (Bacaro et al., 2007). El índice ΔT es la proporción que representan los taxones compartidos del número total de taxones en 2 comunidades.
Para evaluar la hipótesis de una alta diversidad beta en la región, reflejada tanto a nivel de especies como a niveles taxonómicos superiores, se realizó un análisis de correlación de Pearson entre la disimilitud de especies y la disimilitud taxonómica. Se espera una correlación significativa entre ambas variables, lo que indicaría que la proporción de taxones supraespecíficos compartidos entre comunidades es similar a la proporción de especies compartidas.
Se realizaron análisis de ordenación no paramétrica (NMDS, del inglés Nonmetric Multidimensional Scaling) de los valores de 1-βJ y 1-ΔT con el propósito de ubicar y comparar la posición relativa de cada comunidad. El NMDS jerarquiza los valores de disimilitud entre pares de comunidades en un procedimiento iterativo para ubicar a cada comunidad en un espacio de 2 dimensiones que mantiene las distancias entre comunidades, como un reflejo de su disimilitud.
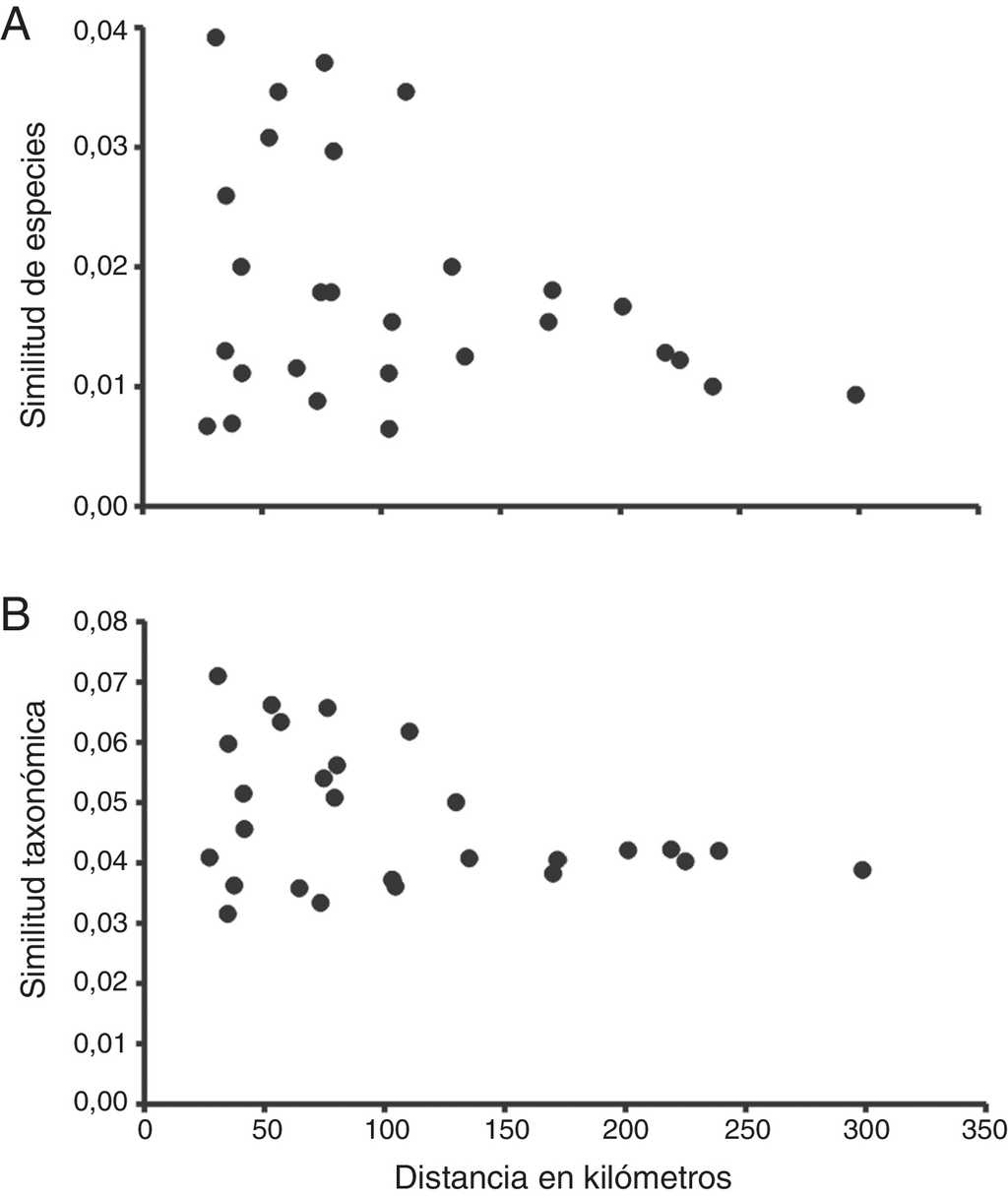
Uno de los patrones mejor conocidos de la diversidad beta es el decaimiento de la similitud con la distancia geográfica (Nekola y White, 1999; Soininen, McDonald y Hillebrand, 2007). Esto significa que 2 comunidades podrían ser poco similares en cuanto a su composición de especies simplemente por la distancia que hay entre ellas, y no por su historia evolutiva, i.e. por su estructura taxonómica. Para detectar una posible influencia de la distancia geográfica en la disimilitud, en este trabajo se calculó también la relación entre la similitud de especies (βJ) y la similitud taxonómica (ΔT) con la distancia lineal promedio en kilómetros entre pares de comunidades, a través de correlaciones de Mantel. La medición de las distancias geográficas se realizó a partir del centro del área cubierta por todos los sitios de muestreo para cada estudio faunístico.
Las correlaciones de Pearson y la de Mantel, así como el análisis de NMDS, se realizaron con el programa Past 3.0 (Hammer, Harper y Ryan, 2001).
Resultados
La cobertura de la muestra para los 8 inventarios faunísticos fue muy alta, en 2 de ellos del 97% y en el resto del 99%, por lo tanto los datos resultaron apropiados para representar la diversidad de Melolonthidae de la porción centro-oriente de la FVT (tabla 1).
Diversidad alfa
Una vez que se estandarizaron los inventarios de las 8 comunidades de escarabajos a una misma cobertura de la muestra (Cm = 0.985), se observó que en el Popocatépetl se espera el mayor número de especies (29.8), siendo esta una riqueza significativamente diferente con el resto de las comunidades. Le siguen en riqueza Chignahuapan (21.3) y Villa de Allende (20.9). El resto de las regiones (Huehuetitla, Zapata, La Malinche, Iztaccíhuatl y Pico de Orizaba) presentaron una riqueza de especies comparativamente bajas (de 14.2 a 15.4 especies), sin diferencias estadísticas significativas entre ellas (fig. 3A).
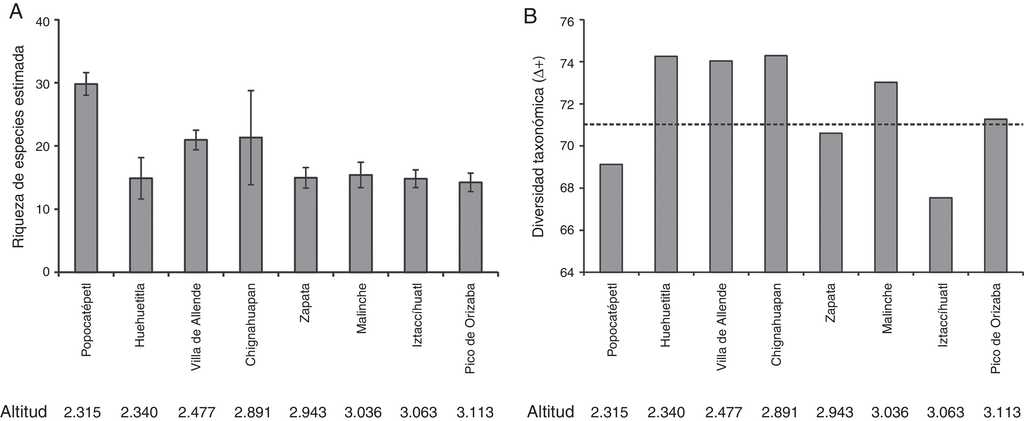
Figura 3 Riqueza y diversidad taxonómica de escarabajos Melolonthidae en 8 comunidades de la porción centro-oriente de la FVT. (A) Riqueza de especies estandarizada a una misma cobertura de muestra (Cm=0.985) con intervalos de confianza al 95% a 100 aleatorizaciones. (B) Diversidad taxonómica, la línea discontinua es el valor de la diversidad taxonómica promedio esperado por azar. En la parte inferior, se muestra como referencia las altitudes promedio de los sitios de muestreo de cada inventario, mismas que se encuentran ordenadas de menor a mayor altitud.
Con respecto a la diversidad taxonómica, 6 comunidades tuvieron un valor de diversidad taxonómica casi igual o mayor que el valor promedio esperado por azar (Δ+ = 71.2): Huehuetitla, Villa de Allende, Chignahuapan, Zapata, Malinche y Pico de Orizaba. Por el contrario, Popocatépetl (Δ+ = 69.13) e Iztaccíhuatl (Δ+ = 67.54) fueron comunidades que mostraron una diversidad taxonómica menor a la esperada (fig. 3B).
Como se esperaba, la correlación entre la riqueza de especies y la diversidad taxonómica no fue estadísticamente significativa (r = -0.104; p = 0.81). Al comparar la riqueza de especies y la diversidad taxonómica se observaron 2 respuestas importantes: 1) la comunidad con mayor riqueza de especies (Popocatépetl) mostró una baja diversidad taxonómica; 2) en las comunidades con una riqueza de especies similar (Huehuetitla, Zapata, La Malinche, Iztaccíhuatl y Pico de Orizaba) la diversidad taxonómica varió ampliamente: Huehuetitla se encuentra entre las comunidades con los valores de diversidad taxonómica más altos, mientras que la comunidad de escarabajos del Iztaccíhuatl, presenta la diversidad taxonómica más baja.
Diversidad beta
La disimilitud de especies (1-βJ) entre pares de comunidades tuvo valores entre el 61 y 94%, mientras que la disimilitud taxonómica (1-ΔT) varió del 29 al 68%. La relación entre los valores de disimilitud de especies (1-β) y disimilitud taxonómica (1-ΔT) fue estadísticamente significativa (r = 0.919, p < 0.001; fig. 4). Resultó interesante la distribución de valores como los que se ejemplifican en la figura 4: los puntos señalados como «a» (Iztaccíhuatl y Chignahuapan) y «b» (Villa de Allende y Popocatépetl), pues son pares de comunidades que presentan el mismo valor en disimilitud a nivel de especies (0.82), pero con valores diferentes de disimilitud en composición taxonómica (a = 0.46 y b = 0.60).
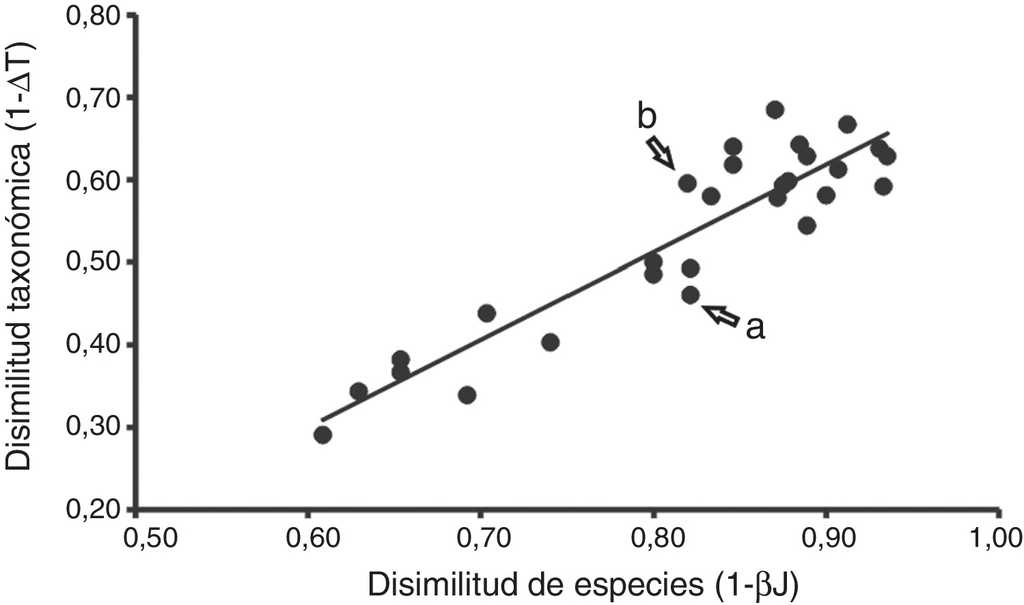
Figura 4 Relación entre los valores de disimilitud a nivel de especies (1-β) y taxonómica (1-ΔT) entre pares de comunidades de escarabajos Melolonthidae (r=0.919, p<0.001). Las letras señalan pares de comunidades con un mismo valor de disimilitud de especies pero con diferentes valores de disimilitud taxonómica (a, Iztaccíhuatl - Chignahuapan y b, Villa de Allende - Popocatépetl).
El resultado del análisis de ordenación mostró que las comunidades de escarabajos de Zapata, Chignahuapan, Malinche, Pico de Orizaba e Iztaccíhuatl, son muy parecidas en su composición de especies, en tanto que Villa de Allende y Popocatépetl, forman un grupo diferente. Huehuetitla es la comunidad con mayor disimilitud con respecto a las comunidades antes mencionadas (fig. 5A). En relación a la disimilitud taxonómica Pico de Orizaba, Malinche e Iztaccíhuatl mostraron diferencias notables, pero Zapata y Chignahuapan se mantuvieron cercanas con baja disimilitud taxonómica (fig. 5B). No se detectó un decaimiento de la similitud en la relación con la distancia geográfica a nivel de especies y tampoco a nivel de disimilitud taxonómica (r = 0.270, p = 0.20 y r = 0.331, p = 0.19, respectivamente) (fig. 6 A, B).
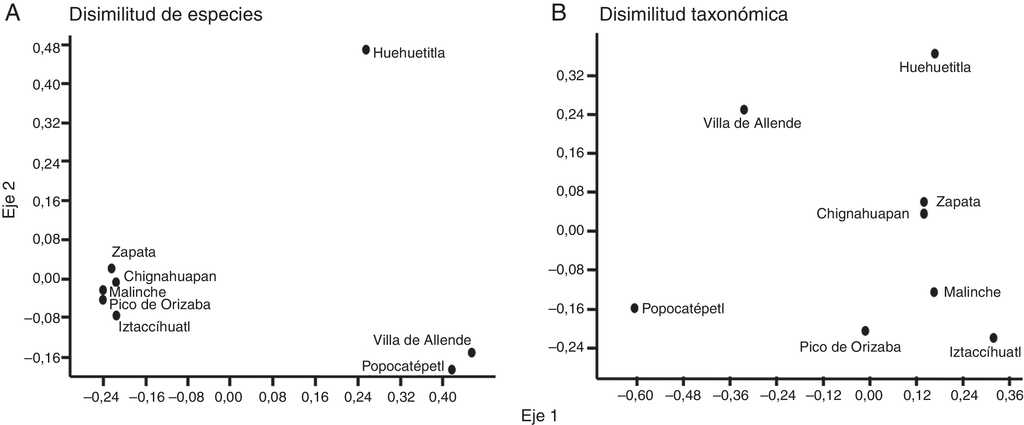
Figura 5 Ordenación no paramétrica multidimensional (NMDS) de las comunidades de escarabajos Melolonthidae estudiadas. (A), en función de la disimilitud de especies (1-βJ) y (B) en función de la disimilitud taxonómica (1-ΔT).
Discusión
En este trabajo, al evaluar la diversidad alfa y beta de 8 comunidades de escarabajos de la familia Melolonthidae en la FVT con 2 aproximaciones (una basada solamente en la riqueza especies, y otra basada en la estructura taxonómica de las comunidades), encontramos resultados complementarios. De acuerdo con lo esperado, los resultados muestran una ausencia de correlación entre la riqueza y la diversidad taxonómica, lo cual está relacionado con la compleja historia biogeográfica de la región. La alta riqueza de especies en Popocatépetl y su baja diversidad taxonómica tiene una posible explicación en el hecho de que esta comunidad se localiza en una zona de transición tanto ecológica como geográfica. Los registros de escarabajos se obtuvieron a una altitud promedio de 2,315 m (la altitud de muestreo más baja de las 8 regiones) entre los 18.8° y 18.9° N, 98.6 y 98.5° O, municipio de Tochimilco, Puebla. Es en este municipio donde se da la confluencia del Valle de Atlixco, con las faldas y la parte alta de la Sierra Nevada, y esta variación en la topografía ocasiona una zonación altitudinal y climática muy marcada que da lugar a 3 tipos de climas: el semicálido subhúmedo, el templado subhúmedo y el semifrío subhúmedo con lluvias en verano, que propician un cambio transicional de vegetación entre el bosque tropical caducifolio a bosques de pino y pino-encino (Rodríguez et al., 2013). La elevada riqueza de especies es resultado de este cambio transicional de la vegetación. Por otro lado, la entomofauna actual de esta región, especialmente en las altitudes por debajo de los 2,300 m tiene una influencia de la fauna de la Cuenca del Balsas y del Valle de Puebla. Además, en el pasado la entomofauna de la porción oeste de la Sierra Nevada tuvo contacto con la Sierra Madre Occidental, como lo evidencian los trabajos biogeográficos de Corona et al. (2007), Morón (2006a, b) y Morón y Carrillo-Ruiz (2013). Todos estos factores han enriquecido a nivel de especie la fauna de esta región dentro de la FVT. Es posible que la baja diversidad taxonómica sea un reflejo de la conformación reciente (post-Pleistoceno) de los ensambles a nivel de especie, principalmente de los géneros Phyllophaga, Diplotaxis y Paranomala, que son de penetración antigua, antes del Mioceno y muy diversificados en las montañas mexicanas (Morón, 1986; Morón, Nogueira, Rojas-Gómez y Arce-Pérez, 2014).
La localidad de Huehuetitla mostró una riqueza de especies relativamente baja, pero una alta diversidad taxonómica. Esta localidad se caracteriza por una vegetación con asociaciones florísticas de matorral xerófilo, bosque de juníperos, bosque de encino-pino y bosque de galería. Esta diversidad de ambientes hace que su fauna sea una mezcla de diferentes elementos paleomericano, del altiplano mexicano, neotropical y mesoamericano (Minor, 2010), que la han enriquecido a nivel supraespecífico. Por otro lado, la baja riqueza de especies podría ser un reflejo de las condiciones subóptimas a nivel local para el establecimiento de especies edáficas, pues la barranca de Huehuetitla se caracteriza por poseer suelos poco profundos con escasa materia orgánica. Además, es posible que la presión antropogénica a la que se ha sometido el bosque con la extracción de troncos haya eliminado especies principalmente de hábitos saproxilófagos (Minor, 2010).
Con respecto a la diversidad beta, como se esperaba, la disimilitud entre localidades de la FVT fue elevada y está correlacionada a nivel de especies y a nivel taxonómico. Este patrón se ha observado en escarabajos melolóntidos de bosques tropicales (García-López, Micó, Múrria, Galante y Vogler, 2013), en angiospermas (Qian, Swenson y Zhang, 2013), en moluscos (Terlizzi et al., 2009) y en helmintos (Quiroz-Martínez y Salgado-Maldonado, 2013).
Al comparar de forma pareada las distintas localidades, resulta interesante que algunas comunidades tienen la misma disimilitud en la composición de especies, pero una disimilitud taxonómica diferente. Esto ocurre al comparar las faunas de Popocatépetl y Villa de Allende, y las faunas de Iztaccíhuatl y Chignahuapan. En el primer caso los géneros Chrysina, Dyscinetus, Golofa y Parabyrsopolis, son géneros presentes solo en Villa de Allende. En el segundo caso, los géneros Paranomala y Chrysina se encuentran solo en Chignahuapan. Esto se relaciona con el ejemplo hipotético presentado en la figura 1, donde el par de comunidades Popocatépetl y Villa de Allende corresponde al escenario I, en donde se comparten la mayoría de taxones por arriba de la categoría taxonómica de especie. En cambio, las comunidades Iztaccíhuatl y Chignahuapan tienen pocos taxones exclusivos, caso similar al escenario II pues comparten pocos géneros y familias.
A la escala espacial de este trabajo la distancia geográfica no es un factor determinante de la disimilitud en la composición de las comunidades de escarabajos (Bacaro et al., 2012). Sin embargo, para este grupo biológico otros estudios sí han demostrado un decaimiento de la similitud con la distancia. Por ejemplo, en bosques tropicales de Costa Rica se detectó una relación entre la beta filogenética y la beta a nivel de especies con la distancia geográfica entre los sitios (García-López, Micó y Galante, 2012; García-López et al., 2013). Lo anterior fue explicado por la capacidad de dispersión que tienen estos organismos, pues esto determina el tamaño del área que ocupan las especies, así como el flujo genético entre ellas. Es probable que los procesos que están llevando a la especiación de las poblaciones de escarabajos melolóntidos en la FVT sean aún muy recientes como para identificar un patrón espacial en la diversidad beta, o bien puede ser solo un efecto de la escala espacial.
La ubicación geográfica de la FVT dentro de la zona de transición mexicana marca 2 puntos importantes que deben considerarse para explicar los patrones de diversidad encontrados en escarabajos melolóntidos. Primero, la fauna de escarabajos es el resultado de los cambios ecológicos e históricos que han tenido lugar en esta provincia y que han permitido la interacción de diferentes elementos bióticos provenientes de otras provincias. De esta manera la fauna de algunas partes de la FVT tiene más relación con Sierra Madre Oriental, Sierra Madre del Sur, Sierra Madre Occidental y la Cuenca del Balsas (Corona et al., 2007; Morón, 2006a, b). Segundo, las montañas tienen un papel particular en la discontinuidad espacial, pudiendo ser un factor de aislamiento y/o especiación. Esto se evidencia en la entomofauna de la FVT, donde las especies de origen neártico son de reciente formación (Pleistoceno) (Halffter, 2006). Así, las condiciones climáticas, el paisaje y la historia volcánica han influenciado la divergencia ecológica en las poblaciones distribuidas a lo largo de la FVT (Ruiz-Sanchez y Specht, 2013). En cada región o incluso en cada localidad se conjugan varios de estos factores para enriquecer o empobrecer la fauna de escarabajos melolóntidos, por tanto, no es redundante usar 2 enfoques ya que resultan complementarios en la descripción de los patrones de diversidad de este grupo.
En general, los resultados de este trabajo remarcan la importancia de realizar estudios de diversidad alfa y beta considerando una aproximación taxonómica y no solo los valores de riqueza absoluta (Morrone, 2013). Esta aproximación permite dilucidar procesos ecológicos y evolutivos que influyen en los patrones de diversidad de especies que suceden a diferentes escalas espacio-temporales (García-López et al., 2013; Graham y Fine, 2008).











 nueva página del texto (beta)
nueva página del texto (beta)