La bioacústica es una herramienta práctica y accesible para el estudio de la conducta y el monitoreo de especies. Entre muchas de sus aplicaciones, permite estudiar la variación de las señales de comunicación acústica, dado que dichas señales suelen ser específicas, por lo que también pueden ser utilizadas como rasgos taxonómicos para diferenciar especies, así como plantear hipótesis acerca de los impactos negativos que puede tener la intervención antropogénica —mediante el ruido, por ejemplo— en el desempeño social e individual de los organismos durante su comunicación (Gerhardt y Huber, 2002; Laiolo, 2010).
Entre los vertebrados cuya comunicación depende principalmente de la vía sonora, los anuros se distinguen por tener repertorios de cantos y respuestas bastante estereotipadas (Gerhardt y Huber, 2002; aunque Feng, Narins y Xu, 2002 y Opazo, Velásquez, Veloso y Penna, 2009 han descrito excepciones). El repertorio vocal en los anuros incluye principalmente señales de apareamiento, agresión y alarma. El canto de anuncio es una señal sexual que permite atraer parejas y es principalmente ejecutado por los machos (Gerhardt y Huber, 2002), aunque en algunas especies también lo hacen las hembras (Dixon, 1957; Serrano, 2009).
Entre los anuros que habitan en México, la familia Eleutherodacylidae consta de 27 especies conocidas hasta ahora, de las cuales el 74% son endémicas para el país (Parra-Olea, Flores-Villela y Mendoza-Almeralla, 2014; Reyes-Velasco, Ahumada-Carrillo, Burkhardt y Devitt, 2015). Desafortunadamente, la ecología de este grupo de especies ha sido poco estudiada en México, siendo escaso el conocimiento sobre la variación y diferenciación de sus cantos (Serrano, 2009), pese a su amplia diversidad y peculiar modo de reproducción fuera del agua mediante desarrollo directo —oviposición de huevos con reservas energéticas en microambientes terrestres húmedos, hasta la eclosión de ranas completamente formadas (Townsend y Stewart, 1985)—.
La rana de El Pedregal Eleutherodactylus grandis es una especie con distribución restringida al derrame de suelo volcánico del volcán Xitle, cuya extensión intacta es menor a 10 km2 en la ciudad de México, por lo que se encuentra catalogada como especie críticamente amenazada en la Lista Roja de la UICN (Santos-Barrera y Flores-Villela, 2004). Esta superficie comprende un gradiente altitudinal y de urbanización desde la región más prístina en el Ajusco medio, dentro del Parque Ecológico de la Ciudad de México hasta la Reserva Ecológica del Pedregal de San Ángel (REPSA), en el campus de la Universidad Nacional Autónoma de México (observación personal). El ambiente marcadamente estacional y xerófilo del ecosistema del Pedregal de San Ángel (Castillo-Argüero et al., 2004) contrasta con los ambientes boscosos y húmedos en los que comúnmente se presenta la estrategia reproductiva de desarrollo directo (Hödl, 1990). En este trabajo se presentan observaciones sobre la historia natural de la rana de El Pedregal, E. grandis, y la descripción acústica del canto en la población de la REPSA.
Los cantos de anuncio de E. grandis fueron grabados con la finalidad de realizar una descripción cuantitativa y registrar su variación. Dos individuos fueron grabados, en julio de 2011, en la zona núcleo oriente (19°19′5.19” N, 99°11′47.0” O) y 8 individuos entre junio y julio de 2012, en la zona núcleo poniente (19°10′00.3” N, 99°11′00.1” O) de la REPSA. Los cantos fueron grabados utilizando una grabadora Olympus DS30, en 2011, y una grabadora Tascam DR-100, en 2012. En ambos casos se utilizó el micrófono incorporado a cada una de las grabadoras, a una tasa de muestreo de 22-44 kHz y 16 bits. El micrófono fue orientado en un ángulo de 0 a 90° con respecto a la rana y a una distancia de entre 20 y 50 cm. La grabadora era sujetada por la mano del observador, cuya presencia no pareció modificar la conducta vocal de las ranas al aproximarse a los individuos utilizando luz roja. La duración de las grabaciones fue de 2 a 6 min. En total se grabaron 61.7 min con la vocalización de la especie, registrando de 7 a 70 cantos (promedio= 23.8) de 10 machos.
La amplitud de los cantos fue registrada como el máximo nivel de sonido (sound pressure level, SPL, por sus siglas en inglés) en decibeles (dB) utilizando un sonómetro (RadioShack 33-2066). Dicho sonómetro fue colocado junto al micrófono de la grabadora apuntando en dirección de la rana focal durante 199 seg y ajustado a una ponderación de frecuencia C y a una tasa de muestreo rápida (fast). Después de realizada cada grabación, los individuos fueron capturados para registrar el SPL del ruido ambiental durante 15 seg, manteniendo el micrófono del sonómetro en la misma posición con el que se hizo el registro del SPL del canto de la rana. Adicionalmente para cada individuo, se registró el tamaño longitud hocico-cloaca (LHC) usando un calibrador Vernier con precisión de 0.01 mm, y el peso mediante una báscula electrónica (AMW-100) con precisión de 0.01 g. El sexo de los individuos se determinó descartando la presencia de ovocitos (Lynch, 1970) inspeccionando visualmente y a contra luz la zona ventral de los mismos. Todos los organismos encontrados fueron determinados como machos y fueron liberados en el punto donde se recolectaron después de la obtención de datos. Finalmente, se registraron la temperatura y humedad relativa en el punto de recolecta de los individuos con una estación meteorológica portátil (Sper Scientific Ltda.). La temperatura y humedad relativa registradas varió entre 15.8-18.6 °C y 72.3-83%, respectivamente.
Todos los cantos grabados se analizaron utilizando el software SoundRuler 0.9.6.0 (Gridi-Papp, 2007). Los sonogramas fueron construidos con una ventana Hanning y un FFT de 512 puntos. A partir de la base de datos generada por la detección manual de los cantos en SoundRuler, se extrajeron 4 variables acústicas, para las cuales se estimó el promedio y coeficiente de variación (desviación estándar/promedio × 100) de todos los cantos grabados de cada individuo: duración del canto que representa la duración desde el inicio al final de cada nota; frecuencia dominante, la frecuencia alcanzada a la máxima amplitud de la nota; incremento entre la frecuencia inicial y la frecuencia de la máxima amplitud de la nota (ΔF), la diferencia entre la frecuencia de la máxima amplitud y la frecuencia inicial; el tiempo de intervalo entre cantos y el tiempo transcurrido entre notas o cantos sucesivos (Bee, 2004; Gridi-Papp, 2007). Asimismo, se contabilizó el número de cantos por minuto considerando el cociente del número de cantos registrados con el tiempo total de grabación para cada individuo. Para analizar la relación entre el promedio de las características acústicas de los cantos de anuncio de cada individuo con respecto a la variación del tamaño (LHC), así como con la temperatura y humedad relativa registradas al final de cada grabación se obtuvo el coeficiente de correlación de Pearson mediante el software R 3.0.2 (http://www.r-project.org).
Adicionalmente, se realizaron muestreos nocturnos, durante julio de 2012, en la zona núcleo poniente de la REPSA para contabilizar el número de ranas que se escucharon vocalizando a una distancia menor a 20 m del observador durante distintos recorridos en rutas hechas al azar. Los recorridos se llevaron a cabo por un solo observador durante 2 h, entre las 21:00 y las 2:00, en 3 noches distintas. Debido a que se desconoce si la especie mantiene alguna fidelidad al sitio de canto o si exhibe rangos hogareños amplios, se procuró que cada recorrido se realizara por rutas separadas —aproximadamente 500 m de distancia entre ellas—, cubriendo una longitud de entre 0.5 y 1.2 km en cada recorrido.
Entre 2011 y 2012 la vocalización de E. grandis en la REPSA se registró entre los meses de junio y julio, con un evidente decline a inicios de agosto. Las fechas de mayor actividad vocal corresponden al inicio de la estación lluviosa en la ciudad de México. En ambos años la estación lluviosa comenzó a finales del mes de mayo. La vocalización fue más intensa después de un día lluvioso o disminuye si la lluvia es intensa durante la noche. Los machos de E. grandis vocalizan principalmente desde la superficie expuesta de roca volcánica, aunque también fue común encontrarlos vocalizando entre pastos amacollados de Muhlenbergia robusta. Durante el día es posible escuchar ranas vocalizando de manera esporádica, desde oquedades entre las rocas (observación personal).
El ruido ambiental registrado en la REPSA osciló entre 50 y 58 dB (promedio = 54 dB, n = 6), lo cual es menor al SPL máximo del canto de E. grandis (promedio = 95.5 dB, tabla 1). Salvo el canto de Lithobates montezumae, que se encuentra presente en pozas artificiales del Jardín Botánico de la zona poniente de la REPSA, ningún otro anuro fue escuchado vocalizando en la Reserva. La principal fuente de ruido ambiental en la REPSA entre las noches de muestreo estuvo conformada por el canto de los grillos Oecanthus niveus y O. californicus, cuya actividad vocal y reproductiva inicia en los meses de junio y julio, respectivamente (Pérez-Escobedo y Cano-Santana, 2007). Aparentemente, el ruido ambiental al interior de la REPSA es menor que el ruido del tráfico vehicular que rodea a la Ciudad Universitaria, el cual asciende a alrededor de 70 dB (Gobierno del Distrito Federal, 2011), sin embargo, el efecto del ruido de tránsito vehicular sobre el canto de E. grandis debería investigarse.
Tabla 1 Características acústicas y morfológicas registradas en 10 individuos de Eleutherodactylus grandis en la REPSA.
| Características | Individuos |
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| Número de cantos | 7 | 40 | 13 | 11 | 15 | 20 | 19 | 37 | 70 | 28 | 26 | |
| CM | 5 | 6.4 | 2.8 | 1.9 | 2.4 | 3.7 | 3.4 | 6.6 | 5.5 | 4.4 | 3.9 | |
| DC (ms) |
|
176.3 | 184.6 | 144.9 | 144.9 | 143.5 | 167 | 182.2 | 178.5 | 182.2 | 192.3 | 169.7 |
| CV | 14.6 | 4.5 | 2.3 | 2.8 | 9.6 | 2.5 | 7.8 | 7.9 | 10.1 | 10.4 | 7.3 | |
| FD (Hz) |
|
2,383.9 | 2,428.1 | 2,062.5 | 2,437.5 | 2,141.8 | 2,161.9 | 2,325.6 | 2,153.3 | 2,158.2 | 2,134.9 | 2,238.8 |
| CV | 5.9 | 2.4 | 0 | 0 | 2.1 | 1.8 | 3.4−06 | 0 | 1.3 | 2.5 | 1.6 | |
| ΔF (Hz) |
|
0 | 9.4 | 144.2 | 0 | 11.5 | 17.2 | 0 | 158.3 | 96 | 12.3 | 44.9 |
| CV | NR | 632.5 | 131.7 | NR | 387.3 | 307.8 | NR | 30.1 | 89.8 | 367.2 | 278 | |
| IC (s) |
|
10.5 | 9.3 | 13.4 | 17.7 | 13.9 | 14.1 | 17 | 9.3 | 10.5 | 12.5 | 12.8 |
| CV | 44.43 | 34 | 273 | 74.2 | 49.5 | 49.3 | 62.7 | 24 | 89.1 | 121.7 | 82.2 | |
| SPL (dB) |
|
NR | 99 | 102 | 94 | 100 | 98 | 96 | 93 | 84 | 94 | 95.5 |
| LHC (mm) | NR | 29.5 | 31.1 | 29.2 | 28.9 | 27.5 | 28.5 | 25.1 | NR | NR | 28.5 | |
| Peso (g) | NR | 1.89 | 2.28 | 1.93 | NR | NR | NR | 1.25 | NR | NR | 1.84 | |
Se presentan los valores promedio (
El canto de anuncio de E. grandis consiste en un silbido intermitente o chirrido corto de una sola nota de baja frecuencia. El canto, que es repetido de 1 a 6 veces por minuto, no presenta modulación espectral (ΔF ∼ 175 Hz), pero sí una notable modulación de la amplitud, generando un sonido parecido al canto de un grillo (fig. 1). La modulación de la amplitud también es notoria entre cantos sucesivos (fig. 2). Las características registradas para describir el canto, tamaño LHC y peso de los organismos grabados se presentan en la tabla 1. Una grabación representativa del canto de la especie fue depositada en el Mapa Sonoro de la Fonoteca Nacional de México y puede consultarse en Internet en: http://fono.blob.core.windows.net/contentmaps/819.mp3.
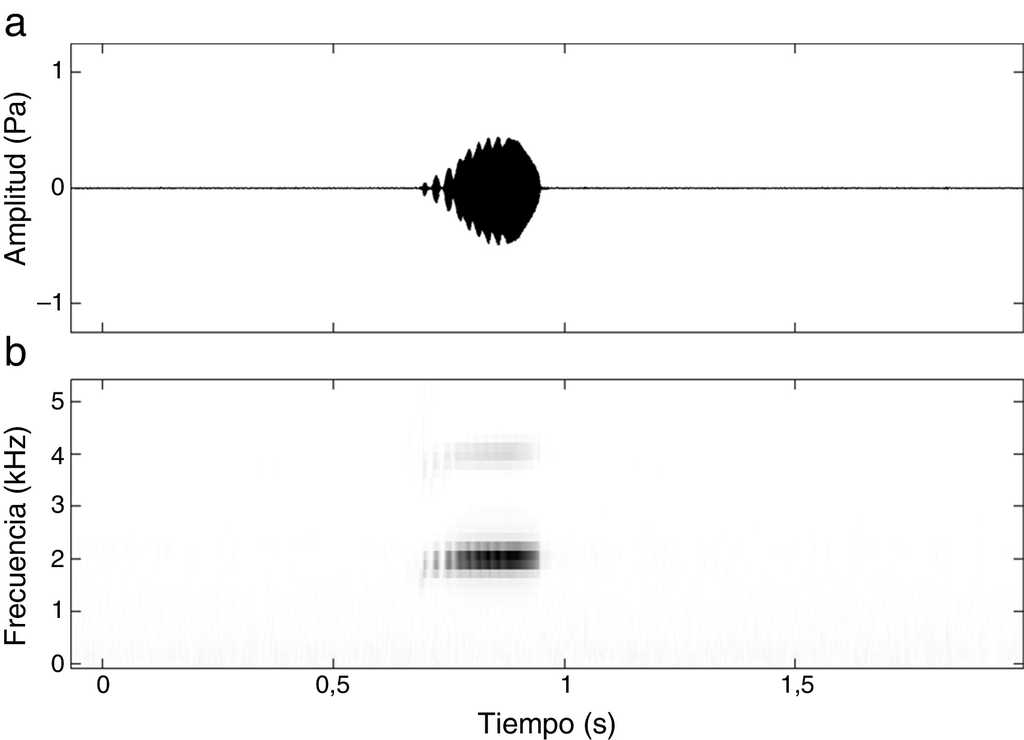
Figura 1 Sonograma (a) y espectrograma (b) de un canto de anuncio representativo de Eleutherodactylus grandis. Duración del canto: 191.6ms. Frecuencia dominante: 2059.4Hz. Registrado el 14 de julio de 2011. Temperatura 15.8°C y un 83% de humedad relativa. Tasa de muestreo: 22kHz y 512 puntos de FFT.
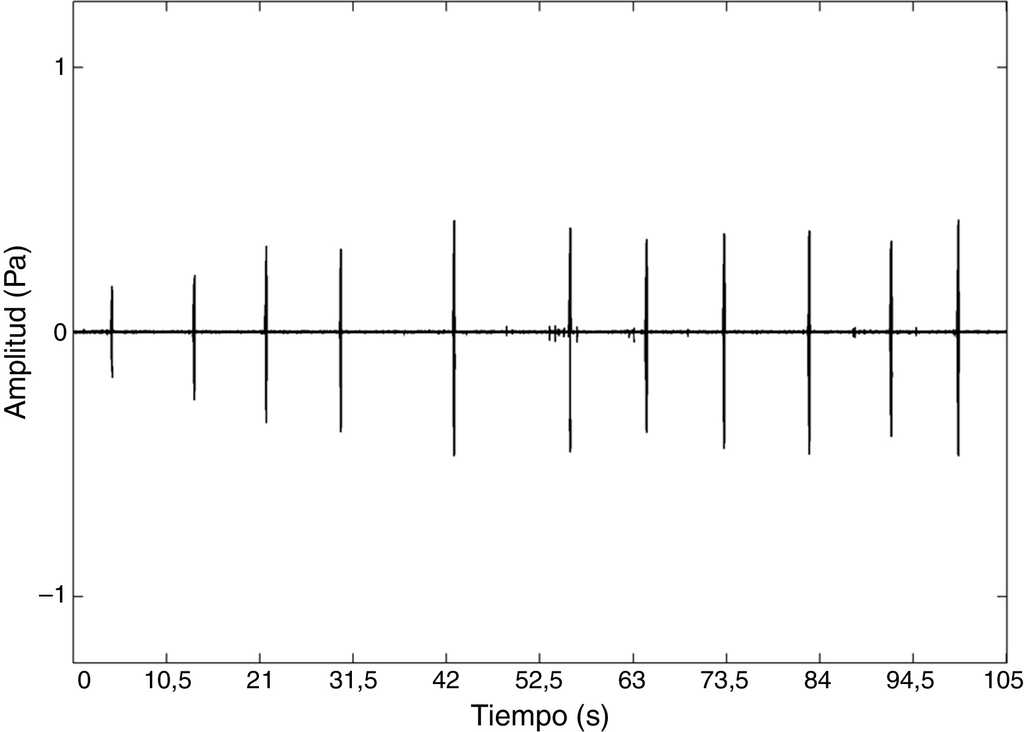
Figura 2 Sonograma de la secuencia de cantos de anuncio producidos por un macho de Eleutherodactylus grandis. El nivel de presión de sonido (SPL) máximo registrado durante la grabación fue de 94dB. El individuo fue grabado el 14 de julio de 2011. Temperatura 15.8°C y un 83% de humedad relativa. Tasa de muestreo: 22kHz y 512 puntos de FFT.
La duración del canto tuvo una relación negativa con la temperatura (r = −0.93, p < 0.05), de manera que a mayor temperatura se observaron valores de duración del canto más bajos, lo cual es una relación común observada en el canto de otros anuros (Márquez y Bosch, 1995). Ninguna otra relación significativa con la temperatura o el tamaño (LHC) fue encontrada. La variación de la frecuencia dominante tuvo los valores de coeficiente de variación más bajos con respecto al resto de las variables analizadas. La mitad de los individuos obtuvo un coeficiente de variación = 0, debido a que la desviación estándar para los registros individuales correspondía a un valor 0. Esta constancia espectral es bastante inusual y sugiere la posibilidad de que el canto de anuncio de E. grandis posee una firma espectral invariable, es decir, que tiene una variación individual e independiente que le provee una distinción dentro de la población y que podría estar involucrada en el reconocimiento individual (Tibbetts y Dale, 2007), al menos durante cortos periodos de tiempo.
Los individuos de E. grandis registrados vocalizando durante este estudio fueron exclusivamente machos, aunque Dixon (1957) ha sugerido que es posible que en muchas especies del subgénero Syrrhophus las hembras podrían estar produciendo cantos de anuncio. La baja frecuencia registrada en el canto de E. grandis probablemente está relacionada con el tamaño de la especie, ya que se trata de una de las especies con una LHC más grande dentro del subgénero Syrrhophus (Dixon, 1957; Lynch, 1970; Reyes-Velasco et al., 2015; Serrano, 2009). Durante los recorridos nocturnos se estimó un promedio de 27 ranas/h/persona por visita (rango: 10-44) entre el 24 de junio y el 10 de julio de 2012. Aunque la distancia entre los organismos vocalizando no se registró, fue posible observar que E. grandis mantenía interacciones de duetos vocales a pocos metros de distancia.
Al igual que el canto de anuncio de otros Eleutherodactylus de distribución restringida en México (Dixon, 1957; Lynch, 1970; Reyes-Velasco et al., 2015), el canto de E. grandis está compuesto por una sola nota, en tanto que el canto de anuncio de E. cystignathoides, especie de amplia distribución al este de México y sur de Estados Unidos de América, posee de una y hasta 6 notas, siendo más común el canto de 3 notas (Serrano, 2009). En las islas del Caribe, donde los Eleutherodactylidos tienen una distribución restringida, el canto de anuncio es típicamente de una o 2 notas (Díaz y Estrada, 2000; Drewry y Rand, 1983; Watkins, Baylor y Bowen, 1970). Eleutherodactylus coqui y E. johnstonei han ampliado su distribución debido a introducciones accidentales en otras islas y áreas continentales de América sin que se haya modificado el número de componentes en su canto (Tárano y Fuenmayor, 2008).
En México es necesario comenzar a examinar la ecología de la familia Eleutherodactylidae presente en una gran diversidad de ambientes, con gran proporción de endemismos y total desconocimiento sobre el estado de sus poblaciones (Frías-Álvarez, Zúñiga-Vega y Flores-Villela, 2010). Las herramientas que ofrece la bioacústica son cada vez más accesibles para los biólogos, y la extensión de su uso permitiría conocer tanto la ecología reproductiva como las tendencias poblacionales y fenología de estas y otras especies animales que producen señales acústicas.
La Reserva Ecológica del Pedregal de San Ángel autorizó y facilitó la realización de este estudio. Agradezco la ayuda en campo de Tere López, Guillermo de León y Luis León. Así como a Adriana Sandoval-Comte, Mario Penna y a 2 revisores anónimos que realizaron comentarios que ayudaron a mejorar el presente manuscrito.











 nueva página del texto (beta)
nueva página del texto (beta)


