Introducción
La nutrición es un proceso indispensable para el mantenimiento de las funciones vitales de los organismos (Bennett y Dawson, 1976; Dorcas, Hopkins y Roe, 2004; Nagy, Girard y Brown, 1999; Simandle, Espinoza, Nussear y Tracy, 2001), y se basa en la asimilación adecuada de los alimentos adquiridos en un determinado periodo de tiempo (Andrews y Pough, 1985; Barreto-Lima, 2009; Cosgrove, Beermann, House, Toddes y Dierenfeld, 2002; Pough, 1973; Rocha, 1996). Cuando los recursos alimentarios son escasos, la nutrición puede verse seriamente comprometida, lo que afecta a los procesos fisiológicos (Bennett y Dawson, 1976; Cosgrove et al., 2002; Gross, Wang y Wunder, 1985; Simandle et al., 2001; Van Dyke, Griffith y Thompson, 2014). Por ello, la cantidad de energía adquirida es fundamental para los organismos, que, bajo diferentes escenarios espacio-temporales, pueden llegar a un balance positivo en el almacenamiento de la grasa corporal (Andrews, 1982; Huey, Pianka y Vitt, 2001; Nagy et al., 1999; Pough, 1973; Van Dyke y Beaupre, 2011). Es decir, en un escenario ecológico la cantidad de energía almacenada influye directamente sobre el mantenimiento, el crecimiento, la supervivencia y la reproducción (Bennett, 1982; Demarco y Guillette, 1992; Dunham, 1978; Hare, Pledger, Thompson, Miller y Daugherty, 2006; Huey, 1982; Méndez-de la Cruz, Casas-Andreu y Villagrán-Santa Cruz, 1992); mientras que bajo un escenario evolutivo, el alimento puede influir directamente en la capacidad de respuesta y adaptación a diferentes presiones de selección o a presiones selectivas específicas (Perry y Garland, 2002; Perry y Pianka, 1997; Pyke, Pulliam y Charnov, 1977; Van Dyke et al., 2014; Zari, 1999). Por lo tanto, un mayor entendimiento del grado de variación de la dieta en las poblaciones naturales permite una mayor comprensión de la amplitud y solapamiento de la dimensión trófica del nicho (Altamirano, Vidal, García y Ferriz, 1990; Dunham, 1983; Hurlbert, 1978; Lawlor, 1980; Pianka, 1974; Vitt y Carvalho, 1995), que son esenciales para la estabilidad y complejidad de las propiedades emergentes de las comunidades (Araujo, 1991; Luiselli, 2008; Schoener, 1974, 1986; Sutherland, 2011; Toft, 1985).
En reptiles escamados, los patrones de consumo de alimento proporcionan ideas claras sobre la historia evolutiva de los organismos, de sus características conductuales, así como de su modo de forrajeo (Andrews, 1979; Cooper, 1994; Huey y Pianka, 1981; Huey et al., 2001; Nagy et al., 1999; Perry, 1999). Por lo que la especialización sobre el consumo de alimento ha sido relacionada con una estrategia de captura que va de intermedia a «captura activa», mientras que las especies generalistas presentan más una estrategia que va de intermedia a «sentarse y esperar» (Huey y Pianka, 1981; Perry y Pianka, 1997; Pyke et al., 1977; Stephens y Krebs, 1986; Toft, 1981). Es decir, las especies que son relativamente sedentarias tenderán a consumir presas que son mucho más activas y con altas tasas de dispersión, en comparación con aquellas especies que forrajean activamente, las cuales tenderán a consumir presas impredecibles, agrupadas o menos móviles; por lo tanto, las especies que forrajean de manera sedentaria tenderán a aprovechar mucho más el recurso, por lo que su amplitud de nicho trófico podría ser mayor que el de las especies de amplio forrajeo (Anderson y Karasov, 1981; Cooper, 2005; Durtsche, 1995; Huey y Pianka, 1981; Kolodiuk, Ribeiro y Freire, 2010; Nagy, Huey y Bennette, 1984).
Este es el caso de algunas de las especies de lagartijas pertenecientes al género Xenosaurus, que han sido consideradas como forrajeros generalistas y oportunistas en la forma en cómo adquieren su alimento (Ballinger, Lemos-Espinal, Sanoja-Sarabia y Coady, 1995; Lemos-Espinal, Smith y Ballinger, 2003, 2004; Woolrich-Piña, Smith, Lemos-Espinal, Oliver-López y Montoya-Ayala, 2012). Su dieta se basa casi exclusivamente en insectos, principalmente de los órdenes Coleoptera, Orthoptera y larvas de Lepidoptera (Lemos-Espinal et al., 2003; Lemos-Espinal, Smith y Ballinger, 2004). No obstante, también se ha registrado el consumo ocasional de pequeños vertebrados, como lagartijas del género Sceloporus y de la familia Teiidae (Ballinger et al., 1995; Presch, 1981), así como de pequeños mamíferos (Lemos-Espinal et al., 2003) como roedores del género Reithrodontomys (García-Vázquez, Nolasco-Vélez y Zamora-Abrego, 2009). Esto puede deberse principalmente a sus hábitos y al tipo de microhábitat al cual están supeditados, ya que al ser habitantes estrictos de grietas en rocas y árboles (Lemos-Espinal, Smith y Ballinger, 1996, 1997, 2004, Lemos-Espinal y Smith, 2005; Zamora-Abrego, Zúñiga-Vega y Nieto-Montes de Oca, 2007), se encuentran restringidos al consumo de presas que pasan frente a ellas o cerca de ellas (Ballinger et al., 1995; Lemos-Espinal et al., 2003; Woolrich-Piña et al., 2012). Estos aspectos de su ecología trófica indican que debería existir un balance energético positivo entre la tasa de obtención de sus presas y la utilización energética invertida al esperar pasivamente por ellas (Huey et al., 2001; Lemos-Espinal et al., 2003).
Xenosaurus mendozai es una especie endémica recientemente descrita y de distribución restringida al noreste del estado de Querétaro, en las cercanías de las localidades de Tilaco y Acatitlán de Zaragoza, municipio de Landa de Matamoros, en la Reserva de la Biosfera Sierra Gorda (Nieto-Montes de Oca, García-Vázquez, Zúñiga-Vega y Schmidt-Ballardo, 2013), y al noroeste del estado de Hidalgo en las cercanías de la localidad de El Pinalito, municipio de Jacala (Nieto-Montes de Oca et al., 2013; Zamora-Abrego, 2009), por lo que los datos de su ecología, así como de su comportamiento, aún son escasos (Molina-Zuluaga, Doherty, Zúñiga-Vega y Zamora-Abrego, 2013; Zamora-Abrego, Chang, Zúñiga-Vega, Nieto-Montes de Oca y Johnson, 2010; Zamora-Abrego, Zúñiga-Vega y Ortega-León, 2012; Zamora-Abrego et al., 2007) y, hasta hace poco tiempo se describió de una manera general la composición de su dieta (Lemos-Espinal et al., 2004). Sin embargo, hasta este momento no se ha identificado la importancia relativa de las presas consumidas, ni la diferenciación de los demás aspectos de su nicho trófico, por lo que el principal objetivo de este trabajo fue determinar las categorías de las presas de mayor valor de importancia en su dieta, identificar las posibles fluctuaciones estacionales que podrían presentarse en su composición y analizar las diferencias intersexuales que podrían presentarse. Además, cabe resaltar que todas las especies descritas, así como aquellas en proceso de descripción, pertenecientes a este particular género de lagartijas, presentan características en común que las hacen altamente sensibles, ya sea por su distribución restringida o insular, por ser microendémicas, termoconformistas con tendencia hacia temperaturas significativamente más bajas, con madurez tardía y baja producción de crías, con escasa vagilidad y restringida capacidad de dispersión (Lemos-Espinal et al., 1996; Lemos-Espinal, Smith y Ballinger, 1997; Rojas-González, Zúñiga-Vega y Lemos-Espinal, 2008; Woolrich-Piña et al., 2012; Zamora-Abrego et al., 2007). Esto las hace sumamente vulnerables ante los cambios climáticos globales, la deforestación y el cambio de uso de suelo (Zúñiga-Vega, Valverde, Rojas-González y Lemos-Espinal, 2007), por lo que un mayor entendimiento de su historia natural puede ayudar a generar programas de protección y conservación de estas especies.
Materiales y métodos
El sitio de estudio se encuentra ubicado en las cercanías del poblado de Tilaco, municipio de Landa de Matamoros al noreste del estado de Querétaro (México), a una altitud de 1,180 m snm (21°10’41” N, 99°10’04” O). La vegetación dominante es principalmente bosque de encino (Quercus sp.) y vegetación secundaria con varios elementos de bosque tropical subcaducifolio (Inegi, 1986; Zamudio, Rzedowski, Carranza y De Rzendowski, 1992). El clima que predomina en esta zona es del tipo (A)C1(w0)(w), que es el más seco de los subhúmedos con lluvias en verano. Presenta sequía intraestival y bajo porcentaje de lluvias invernales, menor del 5.0%, con verano cálido isotermal (Reyna, 1970; Soto y Jáuregui, 1970). Los datos climáticos fueron obtenidos de la Estación La Lagunita, proporcionados por la Comisión Nacional del Agua, gerencia estatal en Querétaro (fig. 1).
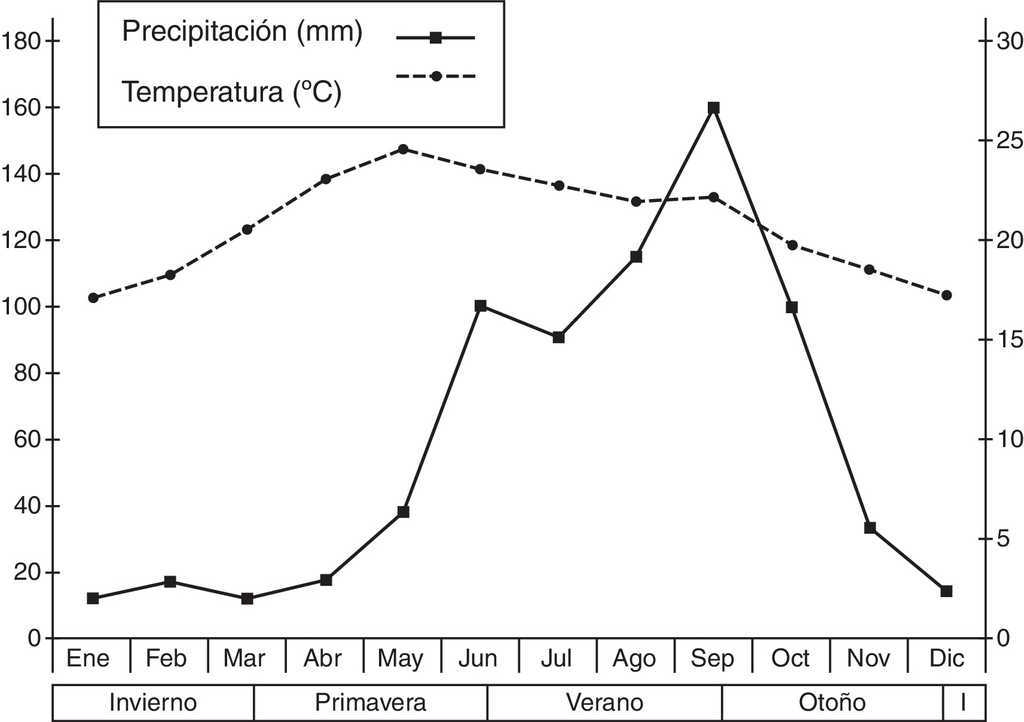
Figura 1 Valores mensuales promedio de temperatura y precipitación de la zona de estudio, proporcionados por la estación meteorológica La Lagunita de la Comisión Nacional del Agua, Gerencia Estatal Querétaro (México).
Los ejemplares analizados pertenecen a la colección herpetológica del Laboratorio de Ecología de la Unidad de Biología, Tecnología y Prototipos (Ubipro), de la Facultad de Estudios Superiores Iztacala-UNAM, con serie número JLE 8542-56, JLE 8934-64, JLE 8975-99 y JLE 10110-126.
Identificación de la dieta
Primero se registró la longitud hocico-cloaca de cada ejemplar, por medio de un calibrador digital milimétrico de precisión 0.01 mm. Posteriormente, se estimó la masa total del tracto digestivo por medio de una balanza analítica con precisión de 0.01 g. Para la determinación de la dieta se consideró la totalidad del tracto digestivo: estómago e intestinos, debido a que generalmente se asume que son irrelevantes las diferencias encontradas entre ellos, cuando en realidad el proceso digestivo implica muchos cambios cualitativos y cuantitativos entre la ingestión y la defecación, lo que puede disminuir la identificación correcta de las presas consumidas (Carretero y Llorente, 2001), además de que es la forma más real y precisa de identificarla. Los contenidos fueron determinados taxonómicamente por medio de claves taxonómicas (Borrow y White, 1970) hasta el nivel de orden o familia, siempre que fuera posible. A cada lagartija se le cuantificó el número total de individuos de cada taxón ingerido, y se estimó su volumen por medio del método de desplazamiento de agua, con una precisión de 1.0 mm3.
Análisis de los contenidos gastrointestinales
Para identificar la importancia relativa de las presas consumidas, se calculó el valor de importancia (IX) mediante la fórmula:
donde n X , v X , y f X son el número, el volumen y la frecuencia de presencia para cada tipo de presa (X), respectivamente; y N, V y F es la suma total de cada factor de las presas. La fórmula produce un índice entre 1 y 0, que representa la importancia de un simple taxón con respecto al total de la dieta. Debido a que este valor de importancia considera 3 medidas (N, V, F), se reduce cualquier sesgo asociado con los índices al usar pocas medidas (Acosta, 1982; Pinkas, Oliphant y Iverson, 1971; Powell, Parmerlee, Rice y Smith, 1990). Asimismo, para cada sexo se evaluó el nivel de especialización mediante el índice estandarizado de amplitud trófica de Levins (BA, Levins, 1968), empleando el método de Hurlbert (1978) con la siguiente fórmula:
donde n es igual al número de diferentes taxones. Los valores de este índice tienden a 1 cuando los organismos consumen diferentes recursos alimenticios en la misma proporción, lo que significa que la especie no discrimina entre los recursos y, por lo tanto, pueden ser consideradas como generalistas. Por el contrario, si tiende a 0, los individuos son selectivos y se alimentan preferentemente de un único tipo de alimento, por lo que se maximiza hacia la especialización (Álvarez y Sarabia, 2006, 2007; Krebs, 1999). Además, se calculó el índice de solapamiento del nicho trófico de Pianka (1973) entre sexos (machos: M; hembras: H), usando la fórmula:
donde IiM y IiH representan el valor de importancia de las presas consumidas por machos y hembras, respectivamente. Este índice genera valores entre 0 (sin solapamiento) y 1 (máximo solapamiento).
Los cálculos de los índices de importancia (IX), amplitud (BA) y solapamiento del nicho trófico (OMH) se realizaron para cada estación del año: primavera, verano, otoño e invierno; tanto para cada orden ingerido como por cada sexo. Las masas de los tractos digestivos se compararon por estaciones: primavera, verano, otoño e invierno, por medio de un análisis de varianza (ANDEVA) y, posteriormente, se aplicó una prueba post hoc de Tukey para identificar entre qué estaciones se presentaban las mayores diferencias en los tractos digestivos, para cada sexo por separado.
Resultados
En total se analizaron 87 ejemplares (39 ♂ y 48 ♀), de los cuales un macho (2.5%) y 3 hembras (6.2%) presentaron el tracto digestivo vacío. Asimismo, 36 individuos presentaron el estómago vacío (14 ♂ y 22 ♀), pero todos los demás tenían algún tipo de alimento en el intestino. Los resultados de los análisis del contenido estomacal de estas lagartijas indicaron que son insectívoras y su dieta se basa principalmente en 12 diferentes órdenes, que conforman el 86.0% del consumo total, seguidos por gastrópodos (3.0%) y material vegetal (3.0%). Solo se presentó un 8.0% de material no identificado (tabla 1). De estos órdenes, tan solo 3 de ellos representan más del 60.0% del total de su dieta, entre los que se encuentran las larvas de mariposa (Lepidoptera) con un 25.0%, seguido por una gran variedad de escarabajos (Coleóptera, familia Scarabaeidae) con un 22.0% y, finalmente, grillos y chapulines (Orthoptera, familias Acrididae y Gryllidae) con un 14.0%; por lo que se puede decir que la tendencia de los individuos de esta especie es hacia la especialización (BA = 0.015). El consumo restante quedó repartido entre los demás taxones de las clases Insecta, Arachnida, Diplopoda e Isopoda (tabla 1).
Tabla 1 Composición del contenido del tracto digestivo de Xenosaurus mendozai en el estado de Querétaro, México.
| Ítems | Total (87) | Machos (39) | Hembras (48) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N | V | F | N | V | F | N | V | F | |
| Arthropoda | |||||||||
| Arachnida | |||||||||
| Araneida | 0.032 | 0.042 | 0.026 | ||||||
| 13 | 0.86 | 11 | 7 | 0.54 | 5 | 6 | 0.32 | 5 | |
| Acarina | 0.003 | - | 0.005 | ||||||
| 1 | 0.08 | 1 | 0 | 0.00 | 0 | 1 | 0.08 | 1 | |
| Diplopoda | 0.039 | 0.071 | 0.020 | ||||||
| 10 | 2.50 | 10 | 6 | 2.20 | 5 | 4 | 0.30 | 4 | |
| Isopoda | 0.005 | - | 0.008 | ||||||
| 3 | 0.06 | 1 | 0 | 0.00 | 0 | 3 | 0.06 | 1 | |
| Insecta | |||||||||
| Coleoptera | 0.224 | 0.224 | 0.223 | ||||||
| 88 | 10.75 | 58 | 40 | 3.42 | 22 | 48 | 7.33 | 26 | |
| Diptera | 0.009 | 0.016 | 0.005 | ||||||
| 3 | 0.32 | 3 | 2 | 0.28 | 2 | 1 | 0.04 | 1 | |
| Dermaptera | 0.006 | - | 0.011 | ||||||
| 3 | 0.13 | 2 | 0 | 0.00 | 0 | 3 | 0.11 | 2 | |
| Hemiptera | 0.021 | 0.025 | 0.019 | ||||||
| 8 | 0.33 | 8 | 4 | 0.19 | 4 | 4 | 0.14 | 4 | |
| Homoptera | 0.003 | - | 0.005 | ||||||
| 1 | 0.03 | 1 | 0 | 0.00 | 0 | 1 | 0.03 | 1 | |
| Hymenoptera | 0.083 | 0.048 | 0.109 | ||||||
| 51 | 1.29 | 21 | 11 | 0.25 | 6 | 40 | 1.04 | 13 | |
| Isoptera | 0.007 | - | 0.012 | ||||||
| 2 | 0.28 | 2 | 0 | 0.00 | 0 | 2 | 0.28 | 2 | |
| Lepidoptera | 0.256 | 0.240 | 0.263 | ||||||
| 96 | 14.97 | 61 | 41 | 4.15 | 22 | 55 | 10.82 | 23 | |
| Orthoptera | 0.143 | 0.132 | 0.147 | ||||||
| 32 | 10.81 | 31 | 15 | 3.02 | 13 | 17 | 7.79 | 14 | |
| Zoraptera | 0.020 | 0.037 | 0.009 | ||||||
| 5 | 1.20 | 5 | 3 | 1.12 | 2 | 2 | 0.08 | 2 | |
| Mollusca | |||||||||
| Gastropoda | 0.030 | 0.015 | 0.042 | ||||||
| 10 | 0.90 | 10 | 2 | 0.20 | 2 | 8 | 0.70 | 8 | |
| No identificados | 0.056 | 0.069 | 0.048 | ||||||
| 17 | 2.54 | 17 | 9 | 1.26 | 8 | 8 | 1.28 | 8 | |
| Material vegetal | 0.038 | 0.049 | 0.029 | ||||||
| 14 | 1.27 | 12 | 7 | 0.59 | 7 | 7 | 0.68 | 4 | |
| Otros | 0.024 | 0.031 | 0.020 | ||||||
| 9 | 0.65 | 8 | 5 | 0.40 | 4 | 4 | 0.25 | 4 | |
| Total | 366 | 48.97 | 262 | 152 | 17.62 | 103 | 214 | 31.33 | 123 |
| BA | 0.015 | 0.039 | 0.023 | ||||||
| OMH | 0.946 | ||||||||
El número entre paréntesis representa el tamaño de la muestra. N, V y F se refieren al número total de ítems, el volumen y la frecuencia de cada presa consumida, respectivamente.
Los valores en negritas representan el índice de importancia de cada presa consumida (IX), que van de 0 (bajo) a 1 (alto). BA y OMH representan los índices de la amplitud y solapamiento del nicho trófico, respectivamente.
Con base en el índice estandarizado de amplitud trófica, se identificó que las hembras son proporcionalmente más selectivas que los machos (♂BA = 0.039; ♀BA = 0.023), ya que a pesar de que las hembras consumieron una mayor cantidad de presas con respecto a los machos (15 y 10 órdenes, respectivamente), estas basaron su dieta en mayor proporción en menos órdenes (4/15: 74.2% y 3/10: 59.6%, respectivamente) (tabla 1). Por su parte, el índice de solapamiento del nicho trófico entre ambos sexos fue alto (OMH = 0.946), lo que indica que están consumiendo presas similares, aunque no en las mismas proporciones (tabla 1).
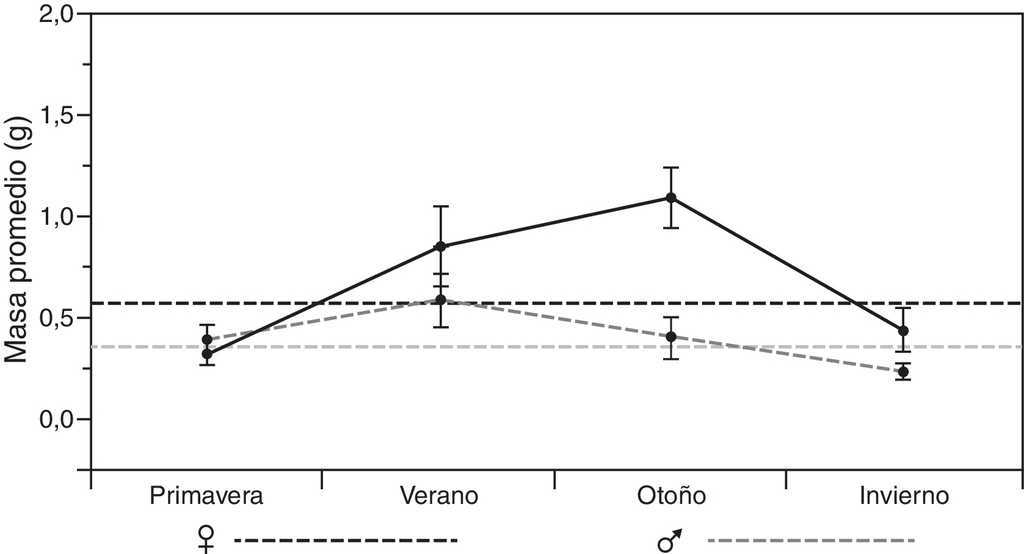
En el análisis por estaciones se pudo observar variación tanto en el tipo de presas consumidas como en el porcentaje de consumo de cada uno de los diferentes órdenes (tabla 2). El otoño fue la estación que presentó una mayor diversificación de presas, con una mayor tendencia hacia la generalización (♂BA = 0.217; ♀BA = 0.111), seguido por el invierno para el caso de las hembras, y del verano para los machos (tabla 2). Asimismo, durante el invierno se observó el más bajo solapamiento del nicho trófico entre ambos sexos (tabla 2: OMH = 0.807), lo que indica que hay un mayor solapamiento entre ambos sexos en los primeros meses del año, y que la dieta tiende a diversificarse un poco más hacia finales del año. No obstante estas diferencias, se pudo observar que la dieta estacional para ambos sexos de estas lagartijas está conformada en una proporción que varía entre 34.4 y 60.2% por 2 principales órdenes de insectos: Coleoptera y larvas de Lepidoptera, con un incremento considerable de ortópteros del verano al invierno (fig. 2), y un consumo adicional similar de himenópteros para el caso de las hembras, y de diplópodos durante la primavera para los machos (tabla 2). También se encontraron diferencias significativas en la masa total del tracto digestivo entre las estaciones tanto para machos (F3,34 = 7.91, p < 0.001) como para hembras (F3,44 = 3.73, p < 0.05). El verano y el invierno fueron las estaciones más diferentes en los machos (post hoc de Tukey: p = 0.05) y, en las hembras, fueron las estaciones primavera y verano, primavera y otoño, y otoño e invierno (Post hoc de Tukey: p = 0.05) las que presentaron las mayores diferencias (fig. 3).
Tabla 2 Porcentaje de la composición alimentaria por estaciones de Xenosaurus mendozai en el estado de Querétaro, México.
| Ítems | Primavera | Verano | Otoño | Invierno | ||||
|---|---|---|---|---|---|---|---|---|
| Machos (11) | Hembras (13) | Machos (6) | Hembras (15) | Machos (5) | Hembras (7) | Machos (17) | Hembras (13) | |
| Arthropoda | ||||||||
| Arachnida | ||||||||
| Araneida | 2.0 | 4.42 | 6.01 | 1.51 | 6.46 | 2.08 | 4.26 | 3.09 |
| Acarina | - | - | - | - | - | 2.26 | - | - |
| Diplopoda | 14.55 | 2.01 | 3.89 | 1.54 | - | 4.63 | 4.32 | - |
| Isopoda | - | - | - | 2.58 | - | - | - | - |
| Insecta | ||||||||
| Coleoptera | 24.90 | 33.13 | 29.16 | 26.01 | 21.08 | 17.10 | 15.71 | 13.55 |
| Diptera | 1.81 | - | 5.01 | - | - | 2.12 | - | - |
| Dermaptera | - | - | - | - | - | 2.89 | - | 2.29 |
| Hemiptera | 5.76 | 1.82 | 3.05 | 1.54 | - | 2.05 | - | 2.24 |
| Homoptera | - | - | - | 1.48 | - | - | - | - |
| Hymenoptera | 5.23 | 7.00 | 4.72 | 2.92 | 4.27 | 10.88 | 4.74 | 26.67 |
| Isoptera | - | 1.75 | - | - | - | 2.90 | - | - |
| Lepidoptera | 22.96 | 18.28 | 30.17 | 34.19 | 27.47 | 26.95 | 19.18 | 20.80 |
| Orthoptera | 4.49 | 7.41 | 11.67 | 12.89 | 12.37 | 19.93 | 23.61 | 18.53 |
| Zoraptera | - | 1.95 | - | - | 11.61 | - | 6.95 | 2.18 |
| Mollusca | ||||||||
| Gastropoda | 4.39 | 6.83 | - | 6.55 | - | - | - | 2.44 |
| aPresas/órdenes | 3/9 | 2/10 | 3/8 | 3/10 | 4/6 | 4/11 | 3/7 | 4/9 |
| b Órdenes en % | 62.4 | 51.4 | 71.0 | 73.1 | 72.5 | 74.9 | 58.5 | 79.6 |
| BA | 0.114 | 0.096 | 0.113 | 0.057 | 0.217 | 0.111 | 0.133 | 0.099 |
| OMH | 0.902 | 0.959 | 0.872 | 0.807 | ||||
El número entre paréntesis representa el tamaño de la muestra por sexo entre las distintas estaciones. BA y OMH representan los índices de la amplitud y solapamiento del nicho trófico para cada estación, respectivamente.
a Relación de las presas más importantes con respecto al total de órdenes consumidos por estaciones para cada sexo.
b Porcentaje total de los principales órdenes de insectos consumidos por estaciones para cada sexo.
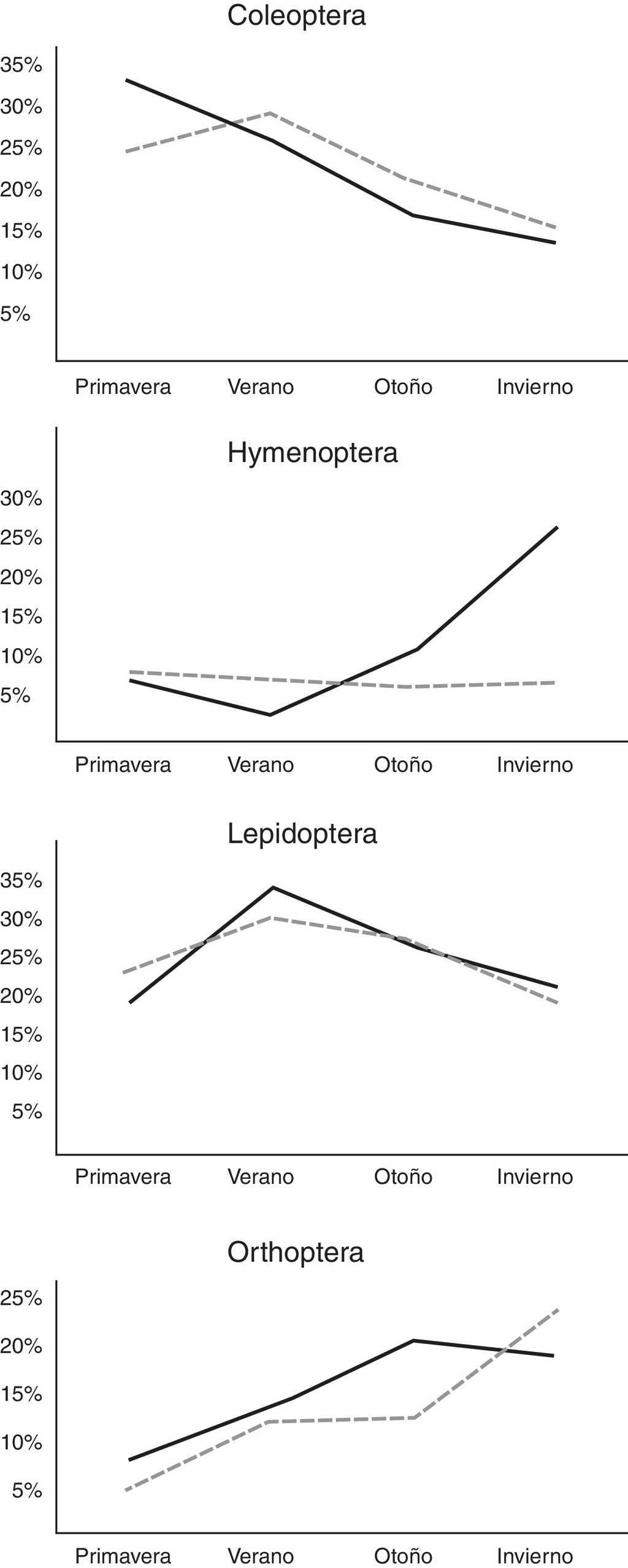
Figura 2 Patrones de consumo estacional de los principales órdenes de insectos consumidos a lo largo de un año, de hembras (línea continua) y machos (línea punteada) de la lagartija Xenosaurus mendozai en el estado de Querétaro (México).
Discusión
El contenido del tracto digestivo de 83 ejemplares de Xenosaurus mendozai muestra que la composición de la dieta se basa principalmente en insectos (86.0%), lo que es consistente con lo anteriormente documentado por Lemos-Espinal et al. (2004), así como con lo observado en las otras especies del género estudiadas (Ballinger et al., 1995; Lemos-Espinal et al., 2003; Woolrich-Piña et al., 2012). No obstante, la diversidad de presas documentadas por Lemos-Espinal et al. (2004) es considerablemente diferente, ya que ellos solamente documentan el consumo de 6 órdenes distintos, entre los que se encuentran 5 de la clase Insecta (Coleoptera, Hemiptera, Isoptera, Lepidoptera y Orthopera) y uno de la clase Arachnida (Araneae), lo cual puede deberse a los periodos en los cuales se realizaron las colectas —ver más adelante—. En este trabajo estamos registrando al menos 12 diferentes órdenes, adicionalmente el consumo de caracoles, isópodos y material vegetal; sin embargo, este último puede deberse a un consumo simultáneo con las presas, como ya había sido señalado que ocurre en otras especies del género (Ballinger et al., 1995; Lemos-Espinal et al., 2003), y esto puede corroborarse debido a la baja proporción en que fueron encontrados estos restos vegetales en los tractos digestivos de estas lagartijas (IX = 0.038), así como al hecho de que estas tienen la capacidad de discriminar químicamente a sus presas (Cooper, Lemos-Espinal y Smith, 1998), por lo que es poco probable que se trate de un consumo adicional.
De acuerdo con los valores de importancia (IX: tabla 1), los insectos más consumidos fueron las larvas de lepidópteros (25.6%), los coleópteros (22.4%) y los ortópteros (14.3%). Estos resultados concuerdan con lo anteriormente documentado por Lemos-Espinal et al. (2004), sin embargo, difieren en el orden de importancia, ya que el mayor porcentaje de consumo registrado por ellos lo presentaron los ortópteros (72.7%), seguidos por los coleópteros (15.5%) y, finalmente, las larvas de lepidópteros (8.5%). Estas diferencias podrían deberse al sesgo de los años y los meses (octubre 1998, noviembre 1998, marzo 1999, abril 1999 y 2000 y diciembre 2000) en que se realizaron las recolectas de esos ejemplares, ya que en este trabajo se incluyó y se separó de manera sistematizada las muestras mensuales a lo largo de un año.
En cualquier caso, la importancia alimentaria que tienen estos órdenes de insectos, principalmente las larvas de lepidópteros y los ortópteros, puede deberse a los tamaños o volúmenes corporales que presentan, ya que son las presas más grandes registradas en ambos trabajos. Adicionalmente, estos insectos presentan picos de actividad diurna (Janzen y Schoener, 1968; Tauber y Tauber, 1981; Wolda, 1979, 1988), por lo que posiblemente son mucho más activos y visibles que las demás presas consumidas, con una mayor probabilidad de acceder a ellos. Asimismo, la baja amplitud del nicho trófico estimada (BA = 0.015) señala que estas lagartijas tienden a ser más especialistas en el consumo de presas, ya que aunque no se estimó la disponibilidad de alimento, se evidencia una tendencia clara de preferencia en la dieta, debido a que con al menos 15 diferentes opciones alimentarias (tabla 1), estas lagartijas parecen preferir presas de mayor tamaño o volumen corporal. Además, al ser habitantes estrictos de grietas de roca o árboles (Lemos-Espinal et al., 1996, 1997, 2004; Lemos-Espinal y Smith, 2005; Zamora-Abrego et al., 2007) están restringidas hacia el consumo oportunista de presas, por lo que la adecuada selección de presas podría ser determinante en sus diferentes procesos somáticos y sobrevivencia futura (Ballinger, 1980; Bennett, 1982; Díaz y Carrascal, 1993; Ferraton, Harmelin-Vivien, Mellon-Duval y Souplet, 2007; Nagy, 2000; Simandle et al., 2001). Consecuentemente, el consumo de estos 3 principales tipos de presas apoya el supuesto de que las especies de forrajeo activo consumen presas que son sedentarias, fosoriales o que se distribuyen de forma agrupada; mientras que las especies que forrajean de forma pasiva, como estas lagartijas, permanecen inmóviles buscando visualmente presas mucho más activas (Anderson y Karasov, 1981; Huey y Pianka, 1981; Nagy et al., 1984; Pyke et al., 1977), como es el caso de los ortópteros, las larvas de lepidópteros y algunas especies de escarabajos (Dyer et al., 2007; Tauber y Tauber, 1981; Wolda, 1979, 1988).
Por otro lado, en términos generales, la conformación de la dieta de esta especie de Xenosaurus es similar en ambos sexos tanto en la frecuencia, en la composición, como en el tamaño de las presas consumidas. Esto se corrobora con base en el alto valor del índice de solapamiento del nicho trófico (OMH = 0.946), lo que lleva a suponer que tanto los machos como las hembras tienen acceso a alimento cualitativamente semejante (Feria-Ortiz, Nieto-Montes de Oca y Salgado-Ugarte, 2001; Ortega, González-Romero y Barbault, 1995; Pianka, 1974; Rodríguez, Nogales, Rumeu y Rodríguez, 2008) y a que puede estar determinado en gran proporción, debido a que no hay diferencia en el uso del microhábitat, ya que ambos sexos siempre están utilizando grietas y sus hábitos son esencialmente los mismos (Lemos-Espinal et al., 2004; Lemos-Espinal y Smith, 2005; Zamora-Abrego et al., 2007). No obstante, cabe resaltar que, aunque ambos sexos presentaron gran similitud en la conformación de su dieta, las hembras incluyeron una mayor proporción de hormigas (fig. 2), lo que indica que estas aprovechan en mayor medida cualquier otro recurso disponible (Ballinger, 1977; Durtsche, 1995; James, 1991; Rissing, 1981). Aunque no tenemos forma de corroborar esta hipótesis, este consumo adicional de las hembras podría deberse al alto gasto energético que representa la reproducción de lagartijas vivíparas (Beuchat y Vleck, 1990; Feria-Ortiz et al., 2001; Méndez-de la Cruz et al., 1992; Rodríguez-Schettino y Martínez-Reyes, 1996). Por su lado, los machos, que no presentaron este consumo adicional y que además mostraron menor variación estacional de la masa total del contenido del tracto digestivo (fig. 3), al parecer, tienden a presentar un menor balance energético positivo con respecto a las hembras, como ha sido señalado para otras especies que forrajean pasivamente (Huey et al., 2001; Perry y Garland, 2002; Perry y Pianka, 1997; Webb, Brook y Shine, 2003), ya que la frecuencia de tractos digestivos vacíos varió entre machos y hembras (2.5 y 6.2%, respectivamente). Esto indica que los machos podrían ser más sensibles a la falta de alimento que las hembras (Huey et al., 2001), o que tienen un mejor acceso a la presas, ya sea por la posición, por el tipo de grieta utilizada, o porque tal vez son menos secretivos que las hembras; ya que, de acuerdo con Lemos-Espinal et al. (2004), encontraron una mayor proporción de individuos con la cabeza, las patas delanteras, e incluso completamente fuera de las grietas, que completamente dentro de ellas (53.8 vs. 46.2%), lo que podría indicar que existe una diferenciación entre la conducta de búsqueda-espera, aunque ellos no discriminaron entre sexos o edades. No obstante, para poder probar estas ideas, sería necesario realizar estudios dirigidos o con experimentos de índole energética, que permitan diferenciar si existen o no preferencias o requerimientos alimenticios entre ambos sexos.
Además, el periodo reproductivo podría ser un factor determinante en la diferenciación de la dieta entre ambos sexos, debido a que el ciclo reproductivo de las hembras es de tipo invernal, con un incremento del volumen folicular que comienza durante el mes de noviembre y termina entre los meses de febrero-marzo con la ovulación, y coincide con el consumo adicional de hormigas (fig. 2). Asimismo, el periodo de gestación, que es de 6 meses y que finaliza entre los meses de agosto-septiembre (Zamora-Abrego, 2003), coincide con la mayor proporción de hembras con el estómago vacío (33.3%). Esto indicaría que el progresivo desarrollo embrionario de estas lagartijas vivíparas podría limitar la capacidad abdominal para almacenar alimento (Feria-Ortiz et al., 2001; Méndez-de la Cruz et al., 1992), podría reducir el apetito (Crews y Garrick, 1980; Van Dyke y Beaupre, 2011) y afectar el comportamiento (Olsson, Shine y Bak-Olsson, 2000; Van Dyke et al., 2014), al hacerlas permanecer mucho más tiempo dentro de sus grietas (Bauwens y Thoen, 1981; Scwarzkopf y Shine, 1992; Sinervo, Hedges y Adolph, 1991) y, por lo tanto, influir directamente en el consumo y composición de su dieta (Smith y Ballinger, 2001).
Pero, además, el consumo de presas, que tiende a variar entre las 4 estaciones (tabla 2), podría estar fuertemente influido por el efecto que puede tener la precipitación sobre la producción primaria, la brotación y la germinación (Janzen y Schoener, 1968; Tauber y Tauber, 1981; Wolda, 1988). Estas, del mismo modo, determinan en gran medida la emergencia y propagación de varias especies de insectos fitófagos, como es el caso de los himenópteros, lepidópteros, coleópteros y ortópteros (Dyer et al., 2007; McCluskey, 1992; Wolda, 1979, 1992; Young, 1982), en los que el crecimiento de sus poblaciones está condicionado a los periodo más húmedos del año (Carey, 2001; Janzen y Schoener, 1968; Robinson, 1987), ya que durante este periodo da inicio la actividad reproductora, los vuelos nupciales y la activación de sus nidos, como ocurre tanto en las hormigas como en las termitas (Armbrecht, Perfecto y Vandermeer, 2004; Castaño-Meneses, Benrey y Palacios-Vargas, 2009; McCluskey, 1992; Wolda, 1988), por lo que es factible suponer que la mayor presencia de este tipo de presas en estas lagartijas puede estar condicionado a este periodo del año (Janzen y Schoener, 1968; Wolda, 1992; Young, 1982). Como ya se había mencionado, aunque en este estudio no fue posible estimar la oferta de alimento, varios estudios han identificado cómo las fluctuaciones en la diversidad y abundancia de las presas están determinadas por la precipitación y la humedad del ambiente (Ballinger, 1977; Dunham, 1981, 1983; James, 1991; Rocha, 1996; Rodríguez et al., 2008; Stephen, Goodyear y Pianka, 2011; Whitford y Creusere, 1977).
Del mismo modo, las diferencias estacionales encontradas en la masa total del tracto digestivo en ambos sexos (fig. 3), así como la tendencia de los principales órdenes de insectos consumidos (fig. 2), indican que dicha disponibilidad es variable; lo cual podría deberse a las características propias del tipo de vegetación en la que se encuentra esta población, ya que, el estar ubicados sobre un bosque de encino entremezclado con especies caducifolias (Inegi, 1986; Zamudio et al., 1992) y con una mayor incidencia de lluvias durante el verano (Reyna, 1970; Soto y Jáuregui, 1970) podría condicionar directamente la disponibilidad de presas (Janzen y Schoener, 1968; Wolda, 1979, 1988, 1992; Young, 1982). Asimismo, podría afectar directamente el ciclo de vida de estos organismos, ya que es clara la tendencia de los coleópteros y las larvas de lepidópteros a disminuir del verano al invierno, con un incremento inverso de ortópteros y en el caso de las hembras de himenópteros (Armbrecht et al., 2004; Carey, 2001; Castaño-Meneses et al., 2009; Davidson, Cook, Snelling y Chua, 2003; Dyer et al., 2007). No obstante, es necesario realizar un estudio de disponibilidad de presas para poder probar esta idea y, con ello, poder describir con mayor precisión los hábitos alimentarios de estas lagartijas, así como realizar pruebas experimentales de capacidad sensorial y discriminación química que permitan determinar si existe preferencia por alguna presa en particular, ya sea por su tamaño, color o, tal vez, olor.
Finalmente y a manera de recomendación, considerando los diferentes aspectos de vulnerabilidad de las especies de este género tan particular de lagartijas, se hace necesario implementar métodos alternativos no invasivos (Barreto-Lima, 2009) para este u otro tipo de estudios, los cuales no consideren el sacrificio de individuos, de tal manera que no se afecten irreversiblemente las poblaciones naturales de estos organismos.











 nueva página del texto (beta)
nueva página del texto (beta)