Introducción
La modificación de los ecosistemas como consecuencia de las actividades humanas es un fenómeno global, pero la magnitud y características de los cambios difieren en distintas regiones. La pérdida y fragmentación de ambientes naturales por la expansión agrícola, la deforestación y el sobrepastoreo desencadenan problemas ambientales a diferentes escalas, alteran la estructura y funcionamiento de los ecosistemas y originan la pérdida de hábitats y una disminución en la biodiversidad (Cabido et al., 1999).
El aumento de la frontera agrícola en Sudamérica, como en otras partes del mundo, se produce principalmente por deforestación de bosques nativos. Argentina está enfrentando en las últimas décadas uno de los procesos de deforestación más fuertes de su historia que se manifiesta con mayor intensidad en la región Chaqueña (Adámoli, Ginzburg y Torrella, 2011). Una estrategia de conservación de estos y otros bosques tropicales ha sido la creación de reservas naturales que alberguen los ecosistemas naturales (Schnack y López, 2003). La Reserva Natural Educativa Colonia Benítez (RNECB) está integrada al sistema de áreas protegidas bajo la jurisdicción de la administración de parques nacionales de Argentina, y se ubica en la ecorregión del Chaco Húmedo. Esta región clasificada como vulnerable dado el incremento de la degradación de sus bosques, cuenta con tan solo el 3% de su superficie protegida (Burkart, 2006). Dos aspectos relevantes caracterizan a la reserva; está rodeada de ambientes donde se desarrollan actividades agropecuarias y su superficie es reducida, sin embargo, resguarda relictos de bosque de quebracho y de selva en galería, ambientes típicos del Chaco Húmedo (Chebez, 2005). Su flora ha sido meticulosamente revelada, principalmente por Schulz (1957), y con respecto a la fauna de artrópodos, se estudió la diversidad de hormigas (Gómez-Lutz y Godoy, 2010), arañas (Escobar, Ávalos y Damborsky, 2012) y termitas (Godoy, Laffont, Coronel y Etcheverry, 2013).
La estimación de la diversidad es una tarea compleja y requiere la búsqueda de estrategias, entre ellas el uso de bioindicadores. Los invertebrados son componentes significativos de los ecosistemas e indicadores adecuados de la biodiversidad, no solo por su abundancia, sino también por las múltiples funciones que desempeñan; sin embargo, durante un largo tiempo no fueron considerados en las estrategias de monitorización y conservación, tendencia que se ha modificado en los últimos años (Mc Geoch et al., 2011). El abordaje de aspectos relacionados a la biodiversidad se efectuó históricamente evaluando la fauna de algunos vertebrados y de fanerógamas presentes en un ecosistema (Oliver y Beattie, 1993). Kremen et al. (1993) mencionan que la diversidad y abundancia de artrópodos terrestres también pueden proveer una valiosa base de información para ser utilizada en las estrategias y manejos de reservas naturales. Los escarabajos copronecrófagos de la subfamilia Scarabaeinae han sido propuestos como un taxón indicador de biodiversidad y para monitorizar el impacto de alteraciones antrópicas en bosques tropicales, ya que son vulnerables a la modificación del hábitat, sus métodos de recolección están estandarizados y su historia natural y taxonomía son bien conocidas (Favila y Halffter, 1997; Halffter y Favila, 1993; Nichols et al., 2007; Spector, 2006).
Los Scarabaeinae son un grupo diverso, abundante y con distribución global, que resultan indispensables en el funcionamiento de los ecosistemas (Halffter y Matthews, 1966). Los escarabajos del estiércol están involucrados en una serie de procesos ecológicos, tales como el reciclaje de nutrientes y la aireación del suelo, ya que manipulan, relocalizan, consumen y reciclan heces de mamíferos y cadáveres en descomposición (Nichols et al., 2008). El conocimiento de la composición de un ensamble en una determinada localidad para lograr una estimación más aproximada de la diversidad de especies demanda la utilización de diferentes métodos de recolecta (Sackmann, 2006). De esta manera, de la técnica de muestreo empleada dependerá que ciertas especies sean más propicias a ser recolectadas que otras. El efecto temporal también influye en la probabilidad de captura; la actividad diferencial de las especies en las distintas estaciones del año determina que su presencia varíe según la fecha en que se efectúen los muestreos (Jiménez-Valverde y Hortal, 2003). Esta característica se evidencia también en los escarabeinos que muestran variaciones temporales en su actividad, incluso en periodos de tiempo cortos (Andresen, 2008).
En este trabajo se propone conocer la diversidad de escarabajos copronecrófagos y la variación temporal de las especies en 2 formaciones vegetales de la RNECB: la selva de galería y el bosque de quebracho. Nuestras hipótesis son: 1) la escasa superficie de la RNECB limita el establecimiento de comunidades importantes de vertebrados, por lo que la riqueza de escarabajos copronecrófagos es reducida en este sitio; y 2) la composición de especies y la estructura del ensamble de escarabajos copronecrófagos serán diferentes entre las formaciones vegetales que resguarda la RNECB y entre los meses muestreados.
Materiales y métodos
Los muestreos se efectuaron en la RNECB (27°19'04" S, 58°57'00" O), departamento Primero de Mayo de la provincia del Chaco, Argentina (fig. 1). La RNECB se encuentra a 64 m de altitud, el clima es subtropical con un promedio de precipitación anual de 1,300 mm y una temperatura mínima promedio de 19 °C y máxima de 35 °C (Bruniard, 1999). Es parte de la terraza fluvial del valle del río Paraná, la pendiente es escasa y presenta algunos problemas de drenaje. Desde el punto de vista biogeográfico el área está situada en la región Neotropical, subregión Chaqueña, en el sector del Chaco Oriental o Chaco Húmedo (Ginzburg y Adámoli, 2006). A pesar de su tamaño tan reducido (7 ha), incluye una alta riqueza de alrededor de 280 especies de plantas (Ginzburg y Adámoli, 2006). Entre sus formaciones vegetales se distingue el bosque con dominio de Schinopsis balansae (quebracho) y la selva en galería, en la que se reconocen Holocalyx balansae (ibirá pepé), Enterolobium contortisiliqum (timbó), Ficus monckii (ibapoí), Phytolacca dioica (ombú), Peltophorum dubium (ibirá pitá) y Syagrus romanzoffiana (palmera pindó) (Chebez, 2005).
Aunque su escasa superficie impide el desarrollo de grandes poblaciones de animales, el grupo de aves está bien representado, seguido por los anfibios y reptiles (Chebez, 2005). Entre los mamíferos se pueden mencionar a Dasypus novemcinctus (armadillo), Akodon cursor (ratón de hierba mostrador), Hydrochoerus hydrochaeris (carpincho o capybara), varias especies de murciélagos y el mono carayá Alouatta caraya (Heinonen-Fortabat y Chebez, 1997). En la RNECB no se practica la caza furtiva o la extracción de madera. Se encuentra dentro del predio que ocupa la Estación Experimental Agropecuaria Colonia Benítez del Instituto Nacional de Tecnología Agropecuaria (INTA), en donde se desarrollan estudios de producción pecuaria.
Se realizaron 6 muestreos, en estación lluviosa (diciembre de 2009, mayo y diciembre de 2010) y en estación seca (marzo y octubre de 2010 y marzo de 2011) en 2 formaciones vegetales, el bosque de quebracho y la selva en galería, empleando trampas de caída. En ambas unidades vegetales se ubicaron 2 transectos distanciados por 80 m, en cada uno de ellos se instalaron 3 trampas separadas por 30 m. Las trampas de un transecto se cebaron con materia fecal humana (coprotrampas) y las del otro con calamar en descomposición (necrotrampas). En total, se utilizaron 72 trampas en el estudio, las que permanecieron expuestas durante 3 días en cada muestreo, totalizando 432 h de trabajo de campo.
Cada trampa consistió de un recipiente descartable de 1,000 cc (11 cm de diámetro superior × 12 cm de longitud), enterrado a ras del suelo en el que se colocó 20 g de cebo. Complementariamente se realizaron otros 5 muestreos con trampas de luz. Se instalaron 2 trampas tipo pantalla, separadas por una distancia de 50 m, las cuales se mantuvieron activas durante 4 h a partir del crepúsculo. Se obtuvieron datos de temperaturas y precipitaciones de los registros de la estación meteorológica instalada en el INTA de Colonia Benítez. La temperatura promedio osciló entre 31.4 °C en diciembre de 2009 y 11.5 °C en mayo de 2010, con máximas y mínimas diarias que variaron entre los 37.6 y 4 °C. La temperatura más baja a nivel del suelo se registró en mayo y la más elevada en diciembre de 2009. Se calificaron como lluviosos los meses en los cuales los registros pluviométricos superaron los 100 mm, aquellos meses en los que el registro fue inferior se calificaron como secos (tabla 1). Los ejemplares recolectados se identificaron a nivel de especies, utilizando las claves de Edmonds y Zidek (2010), Génier (1996, 2009) y Vaz de Mello, Edmonds, Ocampo y Schoolmeesters (2011). Los ejemplares recolectados se depositaron en la colección del laboratorio de Biología de los Artrópodos de la Universidad Nacional del Nordeste (CARTROUNNE).
Tabla 1 Temperatura promedio (°C) y lluvias (mm) registradas por la estación meteorológica del INTA Colonia Benítez, durante los muestreos realizados en la RNECB, Chaco, Argentina, 2009-2011.
| Meses | Temperatura | Temperatura del suelo | Lluvias registradas | Periodo | ||
|---|---|---|---|---|---|---|
| Máxima | Mínima | 30 días anteriores al muestreo | 14 días anteriores al muestreo | |||
| Dic-09 | 31.4 | 22.2 | 21.4 | 191.1 | 27.1 | Lluvioso |
| Mar-10 | 31 | 21 | 18.5 | 97.9 | 16.9 | Seco |
| May-10 | 20.9 | 11.5 | 9.5 | 178.7 | 158.8 | Lluvioso |
| Oct-10 | 26 | 13.7 | 11.8 | 87.3 | 56.6 | Seco |
| Dic-10 | 31.2 | 19.7 | 18.3 | 271.3 | 235.6 | Lluvioso |
| Mar-11 | 30.1 | 19.4 | 17.2 | 67.5 | 0 | Seco |
Análisis de datos
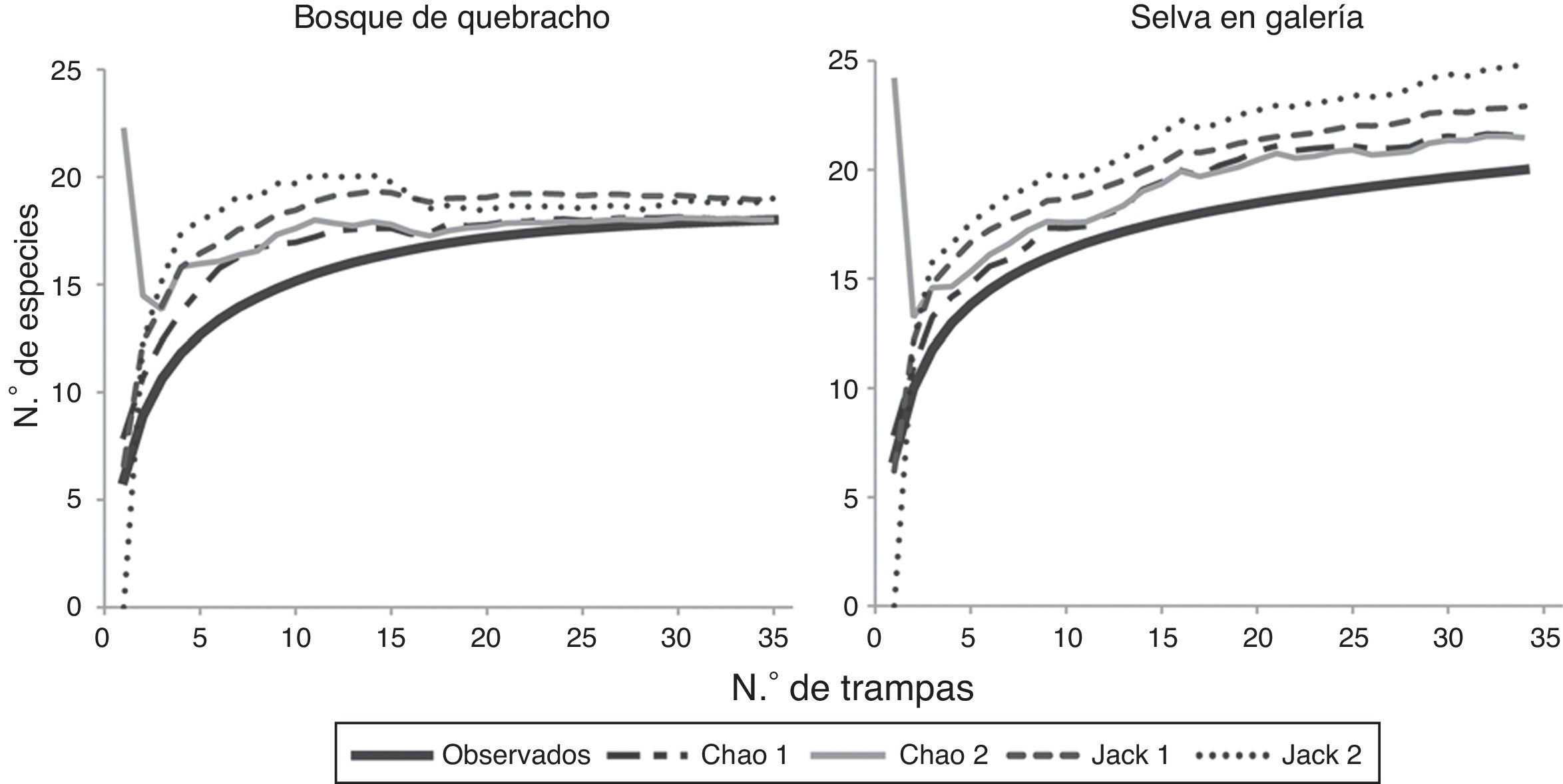
La eficiencia del muestreo en cada ambiente se evaluó mediante estimadores no paramétricos de riqueza: Chao1, Chao2 y Jacknife de primer y segundo orden. Teniendo en cuenta la inexistencia de criterios objetivos para decidir si un inventario está lo suficientemente completo, se juzgó como un valor eficiente de muestreo cuando la riqueza observada fue equivalente al 80% de la riqueza estimada. Los estimadores no paramétricos se calcularon con el programa EstimateS versión 8.0 (Colwell, 2006).
También se estimó la cobertura del muestreo (Chao y Shen, 2003) para cada ambiente, ya que la representatividad de una muestra no solo depende de las especies que faltan, sino también de sus abundancias promedio (Moreno, Barragán, Pineda y Pavón 2011). Se utilizó el modelo multinomial (Shen, Chao y Lin, 2003) que permite predecir el número de nuevas especies que podrían ser capturadas en una futura recolecta de m individuos. Para este modelo se utilizó el estimador de Shen et al. (2003), usando un punto de corte de 10 individuos. Estos 2 últimos análisis se realizaron con el programa SPADE (Chao y Shen, 2010). Se consideraron raras las especies con menos de 10 ejemplares; se identificaron las representadas por solo uno y por 2 individuos (Colwell, 2006).
La diversidad del ensamble de estercoleros recolectados con trampas cebadas se evaluó mediante el uso de número de especies efectivas propuesto por Jost (2006). Para este análisis se utilizó la diversidad de orden 0 (0 D) o riqueza de especies; la diversidad de orden 1 (1 D), que es el exponencial de la entropía del índice de Shannon; y la diversidad de orden 2 (2 D), que es el inverso del índice de Simpson. Los órdenes de estas medidas determinan qué tanto influyen las especies abundantes en la medida de la diversidad; 0 D es completamente insensible a las abundancias de las especies, por lo tanto, equivale a la riqueza de especies; 1 D todas las especies son incluidas con un peso proporcional a su abundancia en la comunidad y, 2 D incluye solo las especies más abundantes (Gotelli y Chao, 2013; Moreno et al., 2011). La composición y la distribución de abundancia de las especies en cada unidad vegetal se contrastaron mediante curvas de rango-abundancia.
Para evaluar la disimilaridad de especies entre los 2 tipos de cebos utilizados se aplicó el índice de complementariedad (Colwell y Coddington, 1994). La preferencia alimentaria se analizó en especies con abundancia superior a 9 individuos a fin de minimizar el sesgo. Se calificaron como coprófagas o necrófagas cuando más del 80% de los individuos se recolectaron en copro- o necrotrampas, y generalistas, aquellas especies en las que menos del 80% de individuos se recolectaron en uno de los 2 tipos de trampa. Los Scarabaeinae fueron separados de acuerdo con su estrategia de relocalización del recurso en 3 grandes gremios: cavadores, rodadores y residentes (Halffter y Edmonds, 1982).
Para establecer si existen diferencias en la estructura del ensamble entre ambientes, periodos, meses de muestreo y tipos de cebos, se utilizó un análisis de varianza multifactorial PERMANOVA, con interacción basada en permutaciones multivariadas (Anderson, 2005), ya que se verificó que los datos no siguen una distribución normal. Se utilizó el procedimiento SIMPER para detectar las especies que caracterizaron a cada estación, se tuvo en cuenta aquellas especies que aportaron más del 10% de la abundancia. Con el propósito de evaluar el efecto de las variables ambientales sobre la composición del ensamble de escarabajos se aplicó el análisis Bioenv (Clarke y Ainsworth, 1993), el cual utiliza el coeficiente de correlación de rangos rs de Spearman, donde valores cercanos a 1 indican que la variable estudiada es relevante. Las variables analizadas fueron: temperatura máxima, temperatura mínima, temperatura del suelo y lluvias registradas entre 14 y 30 días anteriores al retiro de las trampas. Ambos procedimientos se efectuaron con el programa PRIMER 5.0 (Clarke y Gorley, 2001). En todas las pruebas se consideró un nivel de significación α = 0.05.
Resultados
En las trampas cebadas se recolectaron 3,238 ejemplares y 21 especies. Eurysternus aeneus Génier fue la especie dominante, con una abundancia del 18.4% en relación con el total de los ejemplares capturados, seguido por Canthon quinquemaculatus Castelnau (13.1%), Canthon chalybaeus Blanchard (11.7%), Deltochilum komareki Balthasar (11.4%) y Canthidium (Canthidium ) sp. (10.2%), que agruparon el 65% del total de individuos recolectados; estas especies, junto a Canthon chiriguano Martínez y Halffter, Onthophagus hirculus Mannerheim, Ontherus sulcator (Fabricius) y Anisocanthon villosus Harold, se capturaron en todos los muestreos.
Mediante trampas de luz se capturaron 131 individuos pertenecientes a 13 especies, de las cuales 5: Deltochilum valgum Burmeister, Ontherus (Ontherus) sp., Pseudocanthon xanthurus (Blanchard), Trichillum externepunctatum Borre y Trichillum heydeni (Harold), fueron capturadas exclusivamente con esta técnica. Asimismo, la especie más abundante y presente en todos los muestreos fue O. sulcator que representó el 71% del total de individuos. De esta forma, se capturaron con trampas cebadas y de luz 3,369 individuos pertenecientes a 26 especies agrupadas en 6 tribus y 14 géneros (tabla 2). Deltochilini fue la tribu mejor representada (S = 11), seguida por Coprini (S = 5). El género Canthon Hoffmannsegg reunió el mayor número de especies (S = 5). Se encontraron 10 especies calificadas por su abundancia como raras, de las cuales 6 estuvieron representadas por un solo individuo y 4 con abundancias entre 2 y 9 ejemplares (tabla 2).
Tabla 2 Escarabajos copronecrófagos recolectados mediante trampas cebadas con calamar y materia fecal y trampas de luz en bosque de quebracho y selva en galería de la RNECB, Chaco, Argentina, 2009-2011.
| Cod. | Especies | Pref. | Trampas cebadas | Luz | Total | ||||
|---|---|---|---|---|---|---|---|---|---|
| alim. | BQ | SG | Total | ||||||
| Cal | MF | Cal | MF | ||||||
| Ateuchini | |||||||||
| At | Ateuchus robustus Harold, 1868 | - | 2 | 1 | 3 | 6 | 2 | 8 | |
| Tq | Trichillidium quadridens Arrow, 1932 | - | 6 | 3 | 9 | 6 | 15 | ||
| - | Trichillum heydeni Harold, 1868 | - | 2 | 2 | |||||
| - | Trichillum externepunctatum Borre, 1880 | - | 1 | 1 | |||||
| Coprini | |||||||||
| Ca | Canthidium (Canthidium) sp. | G | 40 | 66 | 60 | 174 | 340 | 5 | 345 |
| Dn | Dichotomius nisus Olivier, 1789 | - | 1 | 1 | 1 | ||||
| Dc | Dichotomius carbonarius Mannerheim, 1829 | G | 45 | 27 | 46 | 61 | 179 | 13 | 192 |
| - | Ontherus (Ontherus) sp. | - | 2 | 2 | |||||
| Os | Ontherus sulcator (Fabricius, 1775) | C | 4 | 23 | 1 | 46 | 74 | 93 | 167 |
| Deltochilini | |||||||||
| Av | Anisocanthon villosus Harold, 1868 | G | 3 | 4 | 28 | 10 | 45 | 45 | |
| Cc | Canthon chalybaeus Blanchard, 1843 | N | 180 | 33 | 154 | 26 | 393 | 393 | |
| Ch | Canthon chiriguano Martínez y Halffter, 1972 | N | 51 | 4 | 67 | 6 | 128 | 128 | |
| Cmu | Canthon mutabilis Lucas, 1857 | - | 1 | 1 | 1 | ||||
| Cq | Canthon quinquemaculatus Castelnau, 1840 | N | 191 | 4 | 219 | 27 | 441 | 441 | |
| Cs | Canthon septemmaculatus Latreille, 1811 | G | 2 | 1 | 4 | 9 | 16 | 16 | |
| Dk | Deltochilum komareki Balthasar, 1939 | N | 109 | 15 | 229 | 29 | 382 | 1 | 383 |
| - | Deltochilum valgum Burmeister, 1873 | - | 1 | 1 | |||||
| De | Deltochilum elongatum Felsche, 1907 | N | 6 | 9 | 15 | 3 | 18 | ||
| Ma | Malagoniella astyanax punctatostriata (Blanchard, 1843) | - | 2 | 2 | 1 | 3 | |||
| - | Pseudocanthon xanthurus (Blanchard, 1843) | - | 1 | 1 | |||||
| Oniticellini | |||||||||
| Ea | Eurysternus aeneusGénier, 2009 | G | 150 | 209 | 80 | 179 | 618 | 618 | |
| Ec | Eurysternus caribaeus (Herbst, 1789) | C | 16 | 96 | 17 | 112 | 241 | 241 | |
| Onthophagini | |||||||||
| Oo | Onthophagus (Onthophagus) sp. | C | 42 | 113 | 155 | 155 | |||
| Oh | Onthophagus hirculus Mannerheim, 1929 | C | 4 | 89 | 8 | 80 | 181 | 181 | |
| Phanaeini | |||||||||
| Cy | Coprophanaeus cyanescens Olsoufieff, 1924 | - | 1 | 1 | 1 | ||||
| Cmi | Coprophanaeus milon (Blanchard, 1843) | N | 9 | 1 | 10 | 10 | |||
| Total | |||||||||
| Número de individuos | 810 | 622 | 925 | 881 | 3,238 | 131 | 3,369 | ||
| Número de especies | 14 | 16 | 16 | 17 | 21 | 13 | 26 | ||
BQ: bosque de quebracho; Cal: calamar; C: coprófago; G: generalista; Luz: trampas de luz; MF: materia fecal; N: Necrófago; Pref. alim.: preferencia alimentaria; RNECB: Reserva Natural Educativa Colonia Benítez; SG: selva en galería.
Representatividad del inventario
De acuerdo con los estimadores no paramétricos Chao1 y Chao2, se alcanzó una eficiencia de captura del 95% en la selva en galería y del 100% en bosque de quebracho (fig. 2). En la selva, Jacknife de primer y segundo órdenes predijeron 23 (87%) y 25 (81%) especies respectivamente, y para el bosque de quebracho ambos estimaron 19 especies (95%). La eficiencia de muestreo fue superior en el bosque de quebracho debido a la presencia de un mayor número de especies con un solo individuo en la selva. La cobertura de muestreo estimada para la selva y el bosque de quebracho fue del C = 0.998 y C = 0.999, respectivamente. El estimador de Shen et al. (2003) predijo que se necesitaría capturar otros 750 individuos para recolectar una nueva especie en la selva; mientras que para el bosque de quebracho, un incremento de captura de 1,500 ejemplares no asegura el hallazgo de otra especie.
Estructura del ensamble
Al comparar los ambientes estudiados, se registró en la selva una mayor abundancia, riqueza (0 D) y diversidad (1 D y 2 D) que en el bosque de quebracho (tabla 3), y presentaron entre 8 y 9 especies muy abundantes. En ambos ambientes, los valores de diversidad 1 D y 2 D fueron relativamente similares. El análisis PERMANOVA no mostró diferencias significativas en la composición de Scarabaeinae entre ambientes (F = 1.92, p = 0.335). Las curvas de rango-abundancia mostraron que en ambos ambientes las 6 especies más abundantes fueron las mismas, aunque el orden jerárquico fue distinto. Ambas curvas en su zona media y posterior mostraron una distribución similar, con pendientes poco pronunciadas. Sin embargo, la distribución fue más equitativa en la selva, donde 4 especies (Eurysternus aeneus [E. aeneus] , Deltochilum komareki [D. komareki] , Canthon quinquemaculatus [C. quinquemaculatus] y Canthidium (C .) sp.) fueron dominantes (fig. 3). En cambio, en el bosque se registró una pendiente pronunciada debido a una marcada abundancia de E. aeneus (25%).
Tabla 3 Diversidad verdadera del ensamble de Scarabaeinae en el bosque de quebracho y selva en galería en los distintos meses muestreados y periodos en la RNECB, Chaco, Argentina, 2009-2011.
| n | 0 D | 1 D | 2 D | ||
|---|---|---|---|---|---|
| Ambientes | Bosque de quebracho | 1,432 | 18 | 9.66 | 7.56 |
| Selva en galería | 1,806 | 20 | 11.15 | 9.62 | |
| Meses | Diciembre 2009 | 338 | 17 | 6.29 | 4.43 |
| Marzo 2010 | 548 | 15 | 5.42 | 3.82 | |
| Mayo 2010 | 140 | 11 | 5.25 | 4.02 | |
| Octubre 2010 | 367 | 14 | 8.44 | 6.77 | |
| Diciembre 2010 | 586 | 16 | 6.36 | 4.85 | |
| Marzo 2011 | 1,258 | 18 | 10.80 | 9.65 | |
| Periodos | Húmedo | 1,064 | 18 | 9.11 | 7.70 |
| Seco | 2,174 | 19 | 10.34 | 8.64 |
0 D: riqueza de especies; 1 D: exponencial del índice de Shannon; 2 D: inverso del índice de Simpson; RNECB: Reserva Natural Educativa Colonia Benítez.
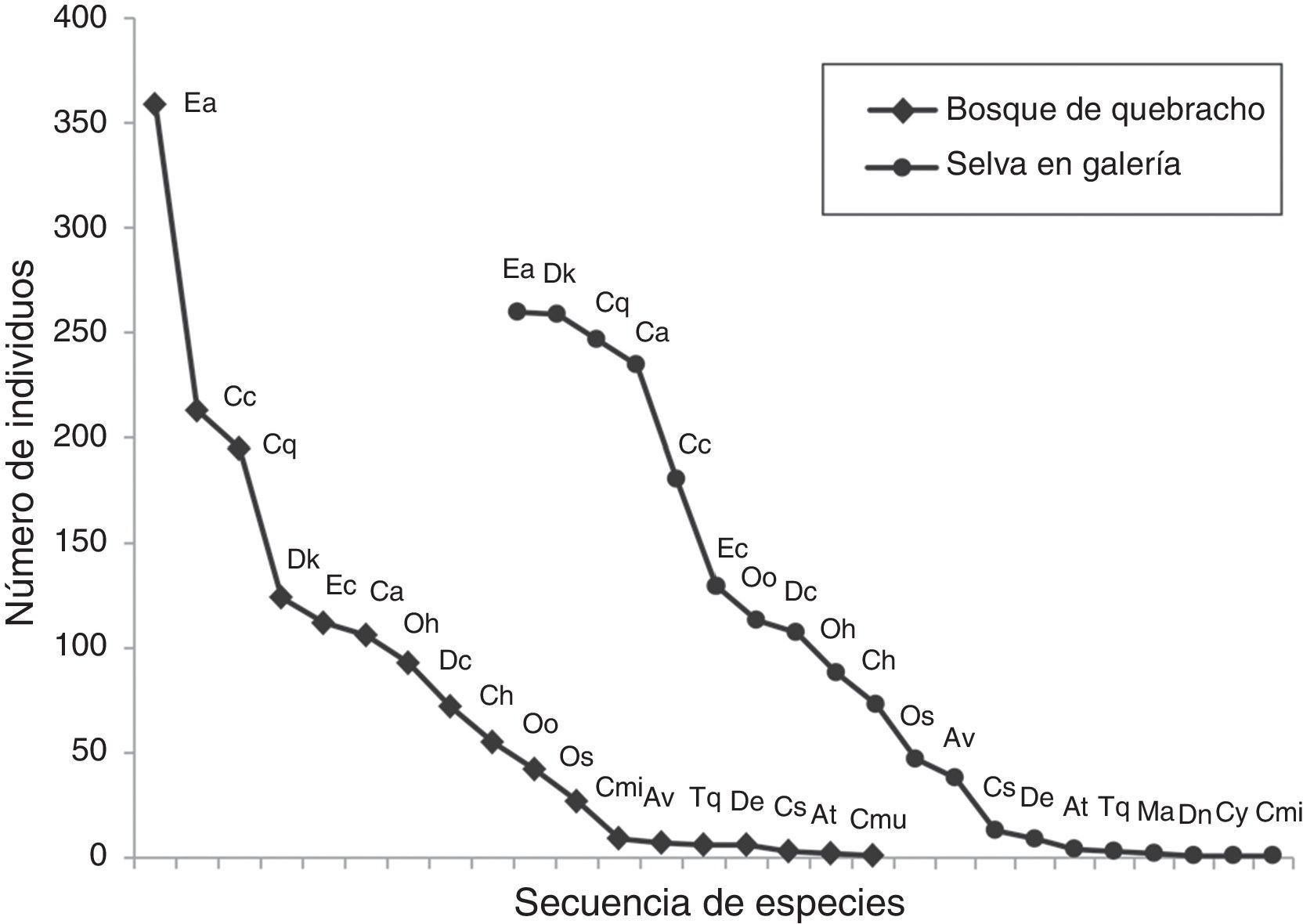
Figura 3 Curvas de rango-abundancia para las especies de Scarabaeinae recolectados mediante trampas cebadas en 2 unidades ambientales de la RNECB, Chaco, Argentina. (Cada punto en la curva representa una especie identificada con abreviatura (cod.), detallada en el tabla 2).
Al analizar los muestreos agrupados de acuerdo con el periodo en que se realizaron, se observó que durante el periodo seco el número de especies y diversidad fue levemente mayor que en el lluvioso, mientras que la abundancia fue 2 veces superior (tabla 3). Las diferencias entre periodos resultaron significativas (F = 7.41, p 0.001). En cuanto a los meses estudiados, en marzo de 2011 se presentaron los máximos valores de abundancia, riqueza 0 D) y diversidad (1 D y 2 D) (tabla 3). En contraposición, en las recolectas de mayo de 2010 se registraron los valores más bajos de los índices antes mencionados, con una pérdida del 51% de diversidad con respecto al mes de marzo de 2011. La diversidad 2 D fue menor en el muestreo de marzo de 2010, debido a la dominancia de E. aeneus y Canthon chalybaeus (C. chalybaeus) que representaron en conjunto el 72% del total de individuos capturados en ese mes. Se encontraron diferencias significativas entre meses de muestreo (F = 9.82, p = 0.001).
De acuerdo con el procedimiento SIMPER, las especies que contribuyeron con la similaridad de cada estación fueron: E. aeneus , Canthidium (C .) sp., E. caribaeus y D. carbonarius que caracterizaron al periodo lluvioso, y aportaron el 80% de la abundancia (tabla 4), esta última especie mostró marcados picos poblacionales en los meses húmedos, registrándose en los meses de diciembre (2009 y 2010) el 81% de su abundancia. E. aeneus, C. chalybaeus , D. komareki y C. quinquemaculatus caracterizaron al periodo seco y representaron el 75% de la abundancia.
Tabla 4 Porcentaje de similaridad (SIMPER) de especies recolectadas mediante trampas cebadas que caracterizan a cada una de las estaciones en la RNECB, Chaco, Argentina, 2010-2011.
| Especies | Seco | Húmedo |
|---|---|---|
| Eurysternus aeneusGénier, 2009 | 10.00 | 9.61 |
| Canthidium (C .) sp. | 9.42 | |
| Canthon chalybaeus Blanchard, 1843 | 7.43 | |
| Eurysternus caribaeus (Herbst, 1789) | 5.30 | |
| Deltochilum komareki Balthasar, 1939 | 4.89 | |
| Dichotomius carbonarius Mannerheim, 1829 | 3.44 | |
| Canthon quinquemaculatus Castelnau, 1840 | 3.07 | |
| Similitud promedio | 33.91 | 34.33 |
Preferencia alimentaria y gremios funcionales
El análisis de preferencia alimentaria mostró que 6 especies fueron necrófagas, 5 generalistas y 4 coprófagas (tabla 2). Tres especies se comportaron como estenófagas, consumiendo exclusivamente excremento (Onthophagus sp.) o calamar (Coprophanaeus milon y Deltochilum elongatum ). Los necrófagos reunieron el 40% de la abundancia al igual que los generalistas, el restante 20% correspondió a los de hábitos coprófagos. De las especies capturadas mediante trampas cebadas, 10 fueron cavadoras, 9 rodadoras y solo 2 endocópridas. El gremio de los rodadores fue el dominante, representando el 44% de los individuos recolectados, seguido por los cavadores (29.5%) y los residentes (26.5%). El 88% del total de rodadores fue capturado con necrotrampas, mientras que con las mismas solo fueron atrapados el 31% de los residentes y el 23% de los cavadores. Las diferencias entre cebos resultaron significativas (F = 3.09, p = 0.007). El índice de complementariedad determinó un recambio del 38% entre ambos tipos de cebos.
Variables ambientales
De las variables analizadas en este estudio, las que mejor explicaron los cambios en la composición del ensamble fueron la temperatura máxima (r = 0.44), temperatura del suelo (r = 0.36) y la temperatura mínima promedio (r = 0.33). No se registraron correlaciones con las precipitaciones.
Discusión
El número de especies encontradas en este estudio en las trampas cebadas (S = 21), es semejante al encontrado por Damborsky, Bar, Álvarez-Bohle y Oscherov (2008) en otra área protegida de la provincia del Chaco, el Parque Provincial Pampa del Indio (S = 20), aunque en este último el esfuerzo de muestreo fue menor. La RNECB preserva una riqueza de escarabajos copronecrófagos que se mantiene en valores semejantes a los estimados para el Neotrópico (Halffter, Favila y Halffter, 1992).
Representatividad del inventario
A medida que el inventario se hace más completo, las probabilidades de encontrar una nueva especie disminuyen, mientras que el esfuerzo necesario para un nuevo hallazgo se eleva, pudiendo llegar a ser desproporcionadamente alto (Jiménez-Valverde y Hortal, 2003). En nuestro estudio, tanto los estimadores no paramétricos como los de cobertura de muestreo estimaron una riqueza muy cercana a la observada, lo que indica un inventario considerablemente fiable en ambos ambientes. De acuerdo con el estimador de Shen et al. (2003), en la selva es necesario recolectar en un futuro muestreo un número equivalente al 42% de los individuos ya recolectados para incrementar en tan solo un 5% el inventario de escarabajos. En el bosque de quebracho, con un esfuerzo de muestreo aún superior, no se asegura el hallazgo de otra especie. De esta forma, se consideró innecesario seguir realizando muestreos, ya que la contribución al inventario sería muy baja, mientras que el esfuerzo y el costo para las poblaciones de escarabajos serían muy elevados, dado principalmente el pequeño tamaño de esta reserva.
Arellano (2002), en un estudio sobre metodologías de muestreo realizado en paisajes antropizados de Veracruz (México), menciona que utilizando otros tipos de cebos y otros métodos de recolecta (captura directa y trampas de intercepción de vuelo) se incrementaría en un 5% el inventario de escarabeinos, dada la posibilidad de la existencia de unas pocas especies con hábitos tróficos especiales. Sin embargo, en relación con esta predicción, se resalta que en este trabajo las especies capturadas exclusivamente con trampas de luz (S = 5) contribuyeron con el 19% de la riqueza total de la RNECB (S = 26). Por lo tanto, se considera conveniente no incrementar el número de muestreos, pero sí utilizar una mayor variedad de técnicas.
Ontherus sulcator fue la única especie recolectada en todos los meses muestreados, con trampas de caída y trampas de luz; la atracción de esta especie hacia la luz artificial también es citada por Génier (1996). Cabrera-Walsh y Gandolfo (1996) identifican esta especie como representativa de los ambientes ganaderos del centro de Argentina, aunque también se cita en bosques de la región Neotropical (Campos y Hernández, 2013; Damborsky, Álvarez-Bohle, Ibarra-Polesel, Porcel y Fontana, 2015). Favila (2005) afirma que los fragmentos de bosque menores a 10 ha son invadidos por especies de pastizales circundantes; no es extraño entonces la presencia de O. sulcator en ambientes boscosos de la RNECB.
Estructura del ensamble
El análisis multivariado y las curvas de rango-abundancia no mostraron diferencias en la composición de escarabajos capturados en los distintos ambientes. Esta semejanza de los ensambles podría deberse a que entre la selva en galería y el bosque de quebracho no hay límites de separación definidos, y se desarrollan bajo un mismo dosel vegetal que permite un flujo constante de individuos. Asimismo, tanto en el bosque de quebracho como en la selva en galería, los valores entre la diversidad 1 D y 2 D no variaron considerablemente, lo que indica una composición equitativa de especies con abundancias altas e intermedias. En cambio, fue mayor la diferencia de los valores 0 D con respecto a 1 D y 2 D, debido al gran número de especies raras, las cuales se ven representadas hacia el final de las curvas de rango-abundancia. Este modelo, en el que se registran muchas especies raras, es característico de los bosques tropicales con estaciones secas y húmedas definidas (Halffter, 1991).
Los mayores valores de riqueza, abundancia y diversidad se obtuvieron en marzo de 2011, un mes de elevadas temperaturas y escasas lluvias. Se comprobó que la temperatura fue la variable que más influyó en el ensamble. Hernández y Vaz de Mello (2009), quienes trabajaron en áreas montañosas con predominio de bosque mesófilo, también demuestran la importancia de esta variable en el incremento del número de especies. No se registró correlación entre la composición del ensamble y las precipitaciones. Resultados similares han sido encontrados por Orozco y Pérez (2008) en 2 bosques (seco premontano y montañoso húmedo), aunque difieren con los de otros autores (Barbosa-Silva, Hernández, Ide y Moura, 2007; Bustos-Gómez y Lopera-Toro, 2003; Damborsky et al., 2015; Martínez, 2010; Milhomem, Vaz de Melo y Diniz, 2003) quienes encontraron la mayor riqueza y abundancia de especies durante los periodos lluviosos. Escobar (2000) destaca que las variaciones de la comunidad de escarabajos coprófagos entre periodos dependen también de los ambientes, y no encuentra relación entre la riqueza y los niveles de precipitación en bosques de montaña.
E. aeneus fue la única especie que caracterizó ambos periodos según el análisis SIMPER, debido a su abundancia en la mayoría de los meses muestreados. El conocimiento de los hábitos alimenticios de esta especie, recientemente descrita por Génier (2009), es escaso. Silva, Vaz de Mello y di Mare (2012) la citan como coprófaga, mientras que en este estudio, en el que se halló un mayor número de ejemplares, E. aeneus mostró hábitos generalistas con tendencia a la coprofagia. De las 4 especies que caracterizaron el periodo seco, 3 fueron rodadores (C. chalybaeus , C. quinquemaculatus y D. komareki ). Esto podría deberse a que el gremio de los cavadores disminuye su actividad durante este periodo, ya que la compactación del suelo les dificulta la excavación de túneles (Janzen, 1983; Martínez, 2010).
Preferencia alimentaria y gremios funcionales
Con el uso de coprotrampas se colectó un mayor número de especies, mientras que con las necrotrampas el número de individuos fue superior. Estos resultados son similares a los obtenidos por Silva, Rosa-García y Vidal (2009a), mientras que Bustos-Gómez y Lopera-Toro (2003), Milhomem et al. (2003), Silva y di Mare (2012) y Silva, Rosa-García y Vidal (2009b) encontraron un mayor número de especies e individuos con coprotrampas. En la RNECB las especies generalistas y necrófagas duplicaron en abundancia al grupo de coprófagos; esto se podría deber a que la oferta de excremento dentro de la RNECB es baja, el ganado no puede ingresar y el número de mamíferos es reducido, por lo que los animales muertos podrían estar constituyendo el recurso más frecuente, particularidad que es sobresaliente en la región Neotropical (Campos y Hernández, 2013; Halffter, 1991). Asimismo, las especies generalistas presentan una mejor capacidad de respuesta a la escasez de recursos, pudiendo utilizar otros alimentos, como hongos o frutos en descomposición (Hanski y Cambefort, 1991). Se identificaron un número similar de especies generalistas, necrófagas y coprófagas, lo que sugiere que la utilización equilibrada de los alimentos disponibles atenúa la competencia por el recurso y facilita la convivencia de las especies (Gill, 1991; Halffter y Halffter, 2009).
La mayor proporción de especies e individuos con hábitos cavadores y rodadores con respecto a los residentes es documentada por Barraza, Montes, Martínez y Deloya (2010) y Martínez, García, Pulido, Ospino y Narváez (2009). Esta característica se atribuye a la necesidad de los residentes de contar con gran cantidad de excremento (Halffter y Edmonds, 1982), recurso poco abundante en esta área. Asimismo, los suelos de la RNECB son de textura franco-limo-arcillosa (Ledesma, 1995), y es reconocida la afinidad de los cavadores por estas características edáficas (Hanski y Cambefort, 1991; Martínez-Hernández, Muñoz, Sierra-Quintero y Barraza-Méndez, 2012). Si bien el análisis de complementariedad indicó un bajo recambio de especies entre ambos tipos de cebos, el uso de diferentes atrayentes permitió la captura de especies estrictamente coprófagas y necrófagas. Así también, el uso de diferentes técnicas de captura, y la planificación de muestreos estacionales, contribuyeron para el logro de un inventario satisfactorio.
Pese a que la RNECB es un área reducida, el número de especies halladas en este trabajo refleja su buen estado de conservación. La RNECB no solo resguarda una muestra representativa de la fauna de escarabajos regional, sino también de los vertebrados de los cuales dependen. Por otro lado, este es el primer estudio de la diversidad de Scarabaeinae realizado en un área protegida del Sitio Ramsar Humedales Chaco. La caracterización del ensamble de escarabajos copronecrófagos en la RNECB resultaba necesaria, y constituye un punto de partida para la realización de estudios que permitirán una monitorización y un diagnóstico del impacto de las actividades humanas sobre la riqueza y diversidad de estercoleros en otras áreas. Desafortunadamente, la superficie protegida en el Chaco Húmedo se encuentra lejos de los estándares internacionales de conservación, que recomiendan la protección de al menos un 15% del área original de cada región (Burkart, 2006). Por lo tanto, es indispensable incrementar las áreas protegidas de esta región, sobre todo, por tratarse de uno de los 3 biomas de más alta diversidad de la Argentina.











 nueva página del texto (beta)
nueva página del texto (beta)