Introducción
Los recientes y continuos cambios climáticos globales incluyen modificaciones drásticas, por lo que se requiere caracterizar las condiciones de línea de base en los ambientes vulnerables. La Puna argentina es un ambiente de elevada biodiversidad y riqueza en minerales, aunque de extrema fragilidad ante las intervenciones humanas, no siendo exhaustivo el conocimiento de los cuerpos de agua en ella existentes. Los patrones de distribución de la ficoflora presentan peculiaridades únicas en los humedales de altura, relacionados con la historia geológica, con la presencia de numerosos endemismos y particularidades biogeográficas, con una marcada estacionalidad en las abundancias, más elevadas durante la estación de lluvias (Álvarez-Blanco, Cejudo-Figueiras, de Godos, Muñoz y Blanco, 2011).
El proyecto minero denominado Mina Pirquitas se ubica al noroeste de la provincia de Jujuy a una altitud superior a los 4,020 m snm, considerado uno de los yacimientos de estaño, plomo y plata de mayor relevancia a nivel mundial, y desde 2009 se reactivó después de 20 años de inactividad. Los componentes bióticos existentes en las aguas superficiales que aportan al río Grande de San Juan, principal colector que atraviesa el área del proyecto, no han sido evaluados. El estudio de la biota acuática, y en particular del fitoplancton, por su capacidad adaptativa y valor indicador de la calidad de las aguas, cobran especial interés en esta región sometida a intensa mineralización, donde es factible que existan condiciones idóneas para el desarrollo de especies endémicas (Rumrich, Lange-Bertalot y Rumrich, 2000), y con biopotencialidad para la remediación. Se evaluó la estructura y composición del fitoplancton en 6 campañas realizadas en el periodo 2011-2013, en aguas altas (mes de abril) y en estiaje (noviembre) en 5 cuerpos de agua tributarios del río Orosmayo, y los posibles efectos negativos ocasionados por la acidificación sobre la diversidad y conformación de ensambles algales.
Materiales y métodos
Mina Pirquitas se localiza a 4,200 m snm entre las coordenadas 22°41′ S, 66°28′ O. El río Grande de San Juan, cuenca exorreica que vierte sus aguas al río Pilcomayo, es el colector principal del drenaje originado en la vertiente occidental de las sierras de Carahuasi y de la Rinconada. Uno de sus principales afluentes es el río Orosmayo (Ajedrez), que se conforma con los aportes de varios cursos, entre los que se destacan: el río Coyaguaima de carácter permanente que desemboca en los ríos Ajedrez y Pircas, formado por los aportes de las quebradas Médanos y Pirquitas (fig. 1). El clima es frío y seco, con una gran amplitud térmica diaria, lluvias estivales y falta de nieve durante casi todo el año. El área presenta un promedio anual de temperatura de 7 °C y precipitaciones de 259.4 mm, con vientos medios de 8.2 km/h.
En el área de Mina Pirquitas están representados los componentes fitogeográficos de la región Altoandina y Puneña (Cabrera, 1957). Entre los 3,000 y 4,000 m snm domina la estepa arbustiva xerofítica, y sobre los 4,000 m snm predomina la estepa graminosa. Otra comunidad típica, pero de poca extensión, son las vegas o turberas de manantiales, integradas por plantas rizomatosas que conforman un césped denso y compacto. Se relevaron las comunidades fitoplanctónicas en los ríos y quebradas del área del proyecto en 6 campañas realizadas en los meses de abril y noviembre entre los años 2011 y 2013 en 5 cuerpos de agua tributarios del río Orosmayo (tabla 1; fig. 1).
Tabla 1 Sitios de muestreo relevados en el área de estudio de Mina Pirquitas.
| Código | Lugar | Alturam snm | Caudales(m3.seg−1) | Coordenadas |
|---|---|---|---|---|
| SW1 | Quebrada Médanos | 4,299 | 113.67 | 22°41'36.8" S, 66°33'06.7" O |
| SW4 | Quebrada Cortaderas | 4,434 | 44.84 | 22°39.5'0.8" S, 66°33'0.4" O |
| SW28 | Río Pircas | 4,074 | 311.19 | 22°42'10.1" S, 66°28'17.7" O |
| SW18 | Río Coyaguaima | 4,088 | 152.44 | 22°44'53.4" S, 66°28'09.6" O |
| SW3 | Río Ajedrez | 4,024 | 246.36 | 22°41'41.9" S, 66°24'15.1" O |
Las muestras para los análisis limnológicos fueron colectadas según protocolos de la APHA (2005). Los análisis de los parámetros fisicoquímicos fueron realizados por la Empresa Mina Pirquitas SRL, según técnicas normalizadas. El análisis cuantitativo del fitoplancton se llevó a cabo bajo microscopio invertido marca Zeiss Axiovert 40 CFL, utilizando la técnica de Utermôhl (1958). Las algas unicelulares, coloniales y filamentosas fueron consideradas como unidades y los resultados se expresaron en individuos.ml−1. Las muestras cualitativas se obtuvieron mediante filtrado de agua por red de 20 μm de poro, fijadas in situ con formaldehído al 4%. La identificación taxonómica se realizó con base en diversos trabajos: Fott (1972); Komárek y Anagnostidis (1969, 1986, 2005); Krammer y Lange-Bertalot (1986, 1988, 1991), Patrick y Reimer (1966); Rumrich et al. (2000); Tell y Conforti (1986), entre otros. Submuestras para el análisis de diatomeas fueron digeridas con H2O2 (30%), luego lavadas con agua destilada (Battarbee, 1986) y montadas en preparados permanentes utilizando NAPHRAX como medio de montaje. El análisis estadístico se realizó empleando el programa InfoStat bajo entorno Windows, Versión 2013 (Di Rienzo et al., 2013). A fin de contrastar diferencias entre las fases del ciclo hidrológico se utilizó la t de Student , y para la comparación de las variables en las distintas fechas de muestreos se usó el análisis de la varianza, y la prueba de Tukey para realizar comparaciones post-hoc . Se utilizó el análisis de correlación canónica para relacionar la información aportada por 2 conjuntos de variables X e Y , siendo dependientes las abundancias de los distintos grupos de algas presentes en los sitios de estudio y las variables independientes, los parámetros fisicoquímicos de calidad del agua (excluido el estiaje de 2013).
Resultados
Variables fisicoquímicas del agua
El río Pircas (SW28), en donde se emplaza la explotación minera, presentó diferencias altamente significativas en la mayor parte de los parámetros fisicoquímicos en comparación con los restantes sitios de muestreo (tabla 2). Los metales pesados incrementan su concentración en solución en este río en forma significativa, comparado con los otros cursos lóticos provistos de pH más altos. La disminución del pH incrementa la disolución del aluminio y otros metales trazas, lo cual puede a su vez alterar el ciclo del fósforo al formarse y precipitar compuestos insolubles como el fosfato de aluminio (Kopácek, Ulrich, Hejzlar, Borovec y Stuchlík, 2001). El elevado tenor salino de Pircas (STD = 2,376.50 mg.l−1), se debe principalmente a los sulfatos de calcio y magnesio, presentando eventualmente también SW3 altas concentraciones de sulfatos, cloruros, sodio y potasio (tabla 2).
Tabla 2 Promedio de valores de variables fisicoquímicas en los diferentes sitios muestreados en Mina Pirquitas.
| SW1 | SW4 | SW28 | SW18 | SW3 | p ≤ | |
|---|---|---|---|---|---|---|
| pH | 7.06a | 7.62a | 3.10b | 7.76a | 7.31a | 0.0001 |
| Conductividad | 247.60a | 184a | 2847b | 854a | 1146a | 0.0001 |
| Ca2+ | 15.88a | 12.86a | 231.8b | 28.13a | 58.55a | 0.0001 |
| Mg2+ | 12.2a | 6.95a | 69.1b | 10.75a | 13.05a | 0.0001 |
| Na+ | 15.85a | 12.45a | 124.75b | 114.5b | 149.25b | 0.0001 |
| K+ | 3.8a | 3.35a | 12.85b | 13.2b | 13.09b | 0.0001 |
| SO42= | 93.7b | 28.95a | 1905c | 62.7b | 148.8b | 0.0001 |
| Cl- | 10.85a | 9.35a | 154.95b | 159.5b | 235b | 0.0001 |
| Mn2+ | 0.58a | 0.18a | 22b | 0.06a | 0.87a | 0.0008 |
| Al3+ | 0.77a | 0.22a | 62.11b | 1.38a | 3.17a | 0.0026 |
| Fe3+ | 0.29a | 0.09a | 23.76b | 0.22a | 1.87a | 0.0015 |
| Zn2+ | 0.04a | 0.04a | 106.64b | 0.02a | 8.31a | 0.0001 |
Letras diferentes indican diferencias significativas en la variable.
Análisis del fitoplancton por sitio
Las algas tuvieron en el sistema del Orosmayo una densidad promedio de 311.76 ind.ml−1, con un valor máximo de 828 ind.ml−1 en SW3 en abril de 2011, a pesar de que el caudal líquido en esa fecha y sitio no fueran reducidos (fig. 2). El valor mínimo de densidad fue 0 ind.ml−1 en SW28 durante abril de 2012, momento en el cual se alcanzó la temperatura más elevada del muestreo (14.69 °C), lo que pudo impactar ocasionando la aceleración de la disolución de metales trazas y del metabolismo celular, induciendo mayor inhibición del crecimiento algal.
El sitio de mayor abundancia promedio fue Quebrada Cortaderas con 395.67 ind.ml−1 y el de menor densidad media fue el río Pircas con 175.60 ind.ml−1 (tabla 3). SW28 también se diferenció del resto por presentar menor diversidad (2.47), riqueza de especies (11.40 spp.) y equitatividad (0.63). Por contraparte, SW4 se diferenció por el número de especies más elevado (26.33) y SW3 por el promedio de diversidad más alto (3.98), siendo el colector final de aguas del subsistema considerado. En el río Pircas (SW28) predominaron las Cloroficeas (fig. 3), representadas principalmente por Chlamydomonas , Dunaliella , Chlorella , Klebsormidium , Ulothrix ; siendo la proporción relativa de diatomeas significativamente más baja, con especies tolerantes como: Brachysira , Eunotia exigua , Frustulia , Nizschia palea , N. linearis , Navicula cryptocephala , Pinnularia interrupta , Tabellaria sp., características de condiciones ácidas.
Tabla 3 Promedios de atributos ecológicos del fitoplancton por sitio en el periodo 2011-2013.
| Lugar | Densidad fitoplancton | Hespecífica | Riquezade especies | J |
|---|---|---|---|---|
| SW1 | 244.83a,b | 3.59a,b | 21.33a,b | 0.85b |
| SW28 | 175.60a | 2.47a | 11.40a | 0.63a |
| SW18 | 380.17b | 3.88a,b | 25.50ab | 0.85b |
| SW4 | 395.67b | 3.68a,b | 26.33b | 0.80b |
| SW3 | 339.83b | 3.98b | 24.83a,b | 0.87b |
| p ≤ | 0.036 | 0.013 | 0.042 | 0.041 |
Las letras en superíndice indican diferencias altamentente significativas en las abundancias de las fechas detalladas en la tabla 5.

Figura 3 Porcentajes de representatividad de los grupos taxonómicos del fitoplancton por sitios en el periodo 2011-2013.
Las diatomeas disminuyeron sensiblemente en este sitio en comparación con los restantes cursos lóticos vecinos. En apariencia, existiría un umbral de pH, por debajo de 4.5, en el cual muchas especies de diatomeas serían eliminadas o no tienen capacidad de crecimiento (Aguilera et al., 2007; DeNicola, 2000), debido a la precipitación del sílice por la presencia de Al3+ y Fe3+ (Birchall, Exley, Chappell y Phillips, 1989), con la aparición de un cierto número de formas teratológicas (Falasco, Bona, Badino, Hoffmann y Ector, 2009).
Se registraron, además, Euglenoficeas con Euglena mutabilis , E. viridis , Lepocinclis ovum , Cianobacterias: Chroococcus spp., Oscillatoria spp.; Cryptofitas con Cryptomonas erosa y Crysoficeas con Chromulina ovalis , Ochromonas sp. La mayoría de las clorófitas dominantes se han documentado también en cursos lóticos montañosos sometidos a drenaje ácido de minería (Niyogi, McKnight y Lewis, 1999; Romanov, Ermolaeva y Bortnikova, 2011). La acidificación puede alterar la estructura de la comunidad algal con disminución de cianobacterias filamentosas e incrementos de algas verdes, especialmente Zygnematophyceae (Cosmarium , Closterium , Spirogyra , Mougeotia y Zygnema [Vinebrooke et al., 2002]). Los géneros de diatomeas comunes bajo condiciones neutras de pH incluyeron Achnanthidium , Planothidium y Fragilaria sensu lato . En los ambientes alcalinos del sistema del Orosmayo, las cianobacterias estuvieron representadas por Lyngbya , Komvophoron , Pseudanabaena , Phormidium y Oscillatoria .
Distribución del fitoplancton en el ciclo hidrológico
La densidad total del fitoplancton estuvo regida por las condiciones hidroclimáticas, existiendo diferencias significativas entre las fases de estiaje vs. crecidas (tabla 4). Las restantes variables no se diferenciaron entre épocas, aun las concernientes a la composición por grupos taxonómicos, aunque si se excluye el río Pircas, las diatomeas fueron más abundantes durante la fase de crecidas en relación con el estiaje. En un análisis más detallado se evidencian importantes fluctuaciones interanuales en los valores de densidad del fitoplancton en todos los sitios, siendo más elevados durante el primer periodo de crecidas de 2011 (fig. 4) en concordancia con los registros pluviométricos que favorecieron la escorrentía de materia orgánica desde la cuenca de aportes y la presencia de un amesetamiento significativo de los valores de abundancias en la fase de crecidas de 2012, cuando los cursos lóticos alcanzaron los caudales más elevados (fig. 2).
Tabla 4 Comparación de las fases del ciclo hidrológico en Pirquitas en el periodo 2011-2013.
| Periodo | Abundancia fitoplancton | Diversidad específica | Riqueza de especies | Equitatividad específica | Dominancia Simpson |
|---|---|---|---|---|---|
| Crecidas | 387.93 | 3.44 | 27.43 | 0.76 | 0.12 |
| Estiaje | 230.14 | 3.69 | 21.50 | 0.85 | 0.11 |
| Nivel signif. | 0.037 | No signif. | No signif. | No signif. | No signif. |
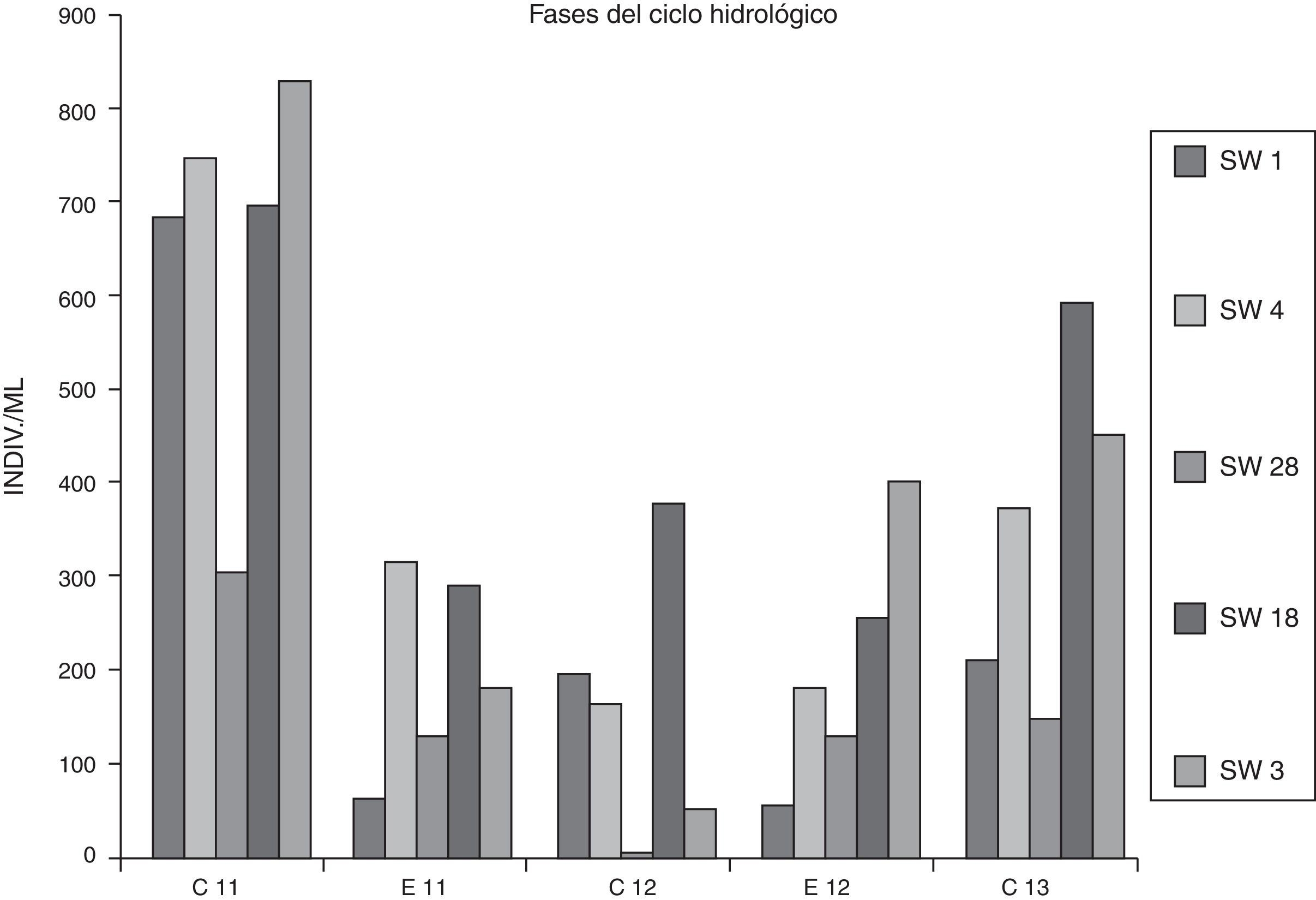
Figura 4 Abundancias del fitoplancton en los sitios muestreados en ambas fases del ciclo hidrológico (C: fase de aguas altas; E: fase de estiaje). E11: nov 2011; E12: nov 2012; C11: abril 2011; C12: abril 2012; C13: mayo 2013; E: nov 2013.
El río Ajedrez detentó ambos extremos de rangos de abundancias: 53 y 828 ind.mL−1, si exceptuamos al río Pircas que no tuvo representación algal en abril de 2012, a pesar de coincidir con un caudal elevado (144.8 l.seg−1) por efecto de los efluentes mineros, y en diciembre de 2013 cuando no presentó caudal líquido. La biomasa algal en el río Pircas no se diferenció según las fases del ciclo hidrológico. El efecto negativo en el ambiente del aluminio se debe a que estos iones pueden reaccionar con los fosfatos y causar que el fosfato no esté disponible para los organismos acuáticos. La acidificación también puede alterar los procesos microbianos que son importantes para el reciclado de nutrientes, como, por ejemplo, la cesación del proceso de nitrificación, estimulación del proceso de desnitrificación (Rudd, Schindler y Turner, 1988; Schindler, 1988) y reducción del proceso de descomposición de materia orgánica (Camargo y Alonso, 2006; Dangles, Gessner, Guèrold y Chauvet, 2004).
Distribución del fitoplancton por fechas
El análisis conjunto del fitoplancton de todos los sitios por fechas solo arrojó diferencias significativas en los valores de densidad, que fue mucho mayor en el primer muestreo de abril 2011 (tabla 5), más allá de la variabilidad estacional de caudales en las diferentes etapas del ciclo hidrológico. Los restantes atributos no mostraron diferencias estadísticas entre sitios (ni entre épocas). No obstante, la diversidad y riqueza de especies fueron máximas en todos los sitios en el primer muestreo. Hubo, en general, un progresivo decaimiento con el tiempo en los valores de abundancia y número de especies del fitoplancton en todos los sitios, existiendo una correlación significativa entre este último parámetro y el pH (r2 = 0.71; p ≤ 0.017). La diversidad específica no varió significativamente a lo largo del muestreo, aunque en el área del río Pircas fue más baja (promedio 2.47). La distribución de las abundancias de organismos entre las especies o equitatividad fue menor en abril de 2012, en consonancia con los máximos caudales en esa fecha, que favorecieron a pocas especies adaptadas.
Tabla 5 Comparación de valores de variables ecológicas del fitoplancton en las diferentes fechas de muestreo realizadas en el área de Mina Pirquitas.
| Fecha | Abundancia fitoplancton | Diversidad específica | Riqueza de especies | Equitatividad |
|---|---|---|---|---|
| Abril 2011 | 651.80b | 3.86 | 32.20 | 0.79 |
| Nov 2011 | 197.00a | 3.73 | 20.20 | 0.88 |
| Abril 2012 | 157.40a | 3.07 | 18.60 | 0.69 |
| Nov 2012 | 204.60a | 3.65 | 18.80 | 0.88 |
| Mayo 2013 | 354.60a,b | 3.40 | 19.00 | 0.81 |
| Nov 2013 | 303.50a | 3.64 | 25.25 | 0.79 |
| Nivel de signif. | < 0.0009 | No signif. | No signif. | No signif. |
Letras en superíndice indican diferencias significativas en la variable.
El análisis de correlaciones canónicas realizado considerando como variables dependientes las abundancias de diatomeas, cianófitas, euglenófitas, clorófitas y criptófitas; y como variables independientes a los datos de pH, conductividad, así como las concentraciones de magnesio, sulfatos, sodio, potasio, aluminio y cinc, mostró que la primera correlación canónica fue altamente significativa, con un valor de 0.97 y p = 0.01. La porción de la varianza total de los datos explicada por el primer par de variables canónicas fue del 94%. La construcción del primer par de variables canónicas (C1-1 = dependiente y C2-1 = independiente) en función de los coeficientes canónicos estandarizados de las combinaciones lineales, resultó en las siguientes fórmulas:
Variable canónica dependiente o variable de criterio o endógena:
Variable canónica independiente o variable predictora o exógena:
Los coeficientes canónicos de la variable canónica dependiente indican que las abundancias de diatomeas y criptófitas poseen la mayor influencia en su formación, mientras que para la construcción de la variable canónica independiente los valores de conductividad, aluminio, sodio y magnesio son los que poseen el mayor peso. Al graficar la primera correlación canónica observamos que hacia la parte negativa de la C1-1 y positiva de la C2-1 se ubican las muestras correspondientes al sitio SW28 tomadas tanto en estiaje como en época de lluvias, caracterizadas por poseer los mayores registros de conductividad, acompañados por predominio de clorófitas y mayores tenores de los oligoelementos mencionados (fig. 5). Los restantes sitios, independientemente de la fase del ciclo hidrológico que se muestrearan se ubicaron en el otro extremo, caracterizadas principalmente por el neto predominio de diatomeas. El río Ajedrez (SW3) en el primer muestreo (abril de 2011) tuvo mayor abundancia del fitoplancton (828 ind.mL−1), H (4.356) y altos registros de R (41) y J (0.83), y estuvo caracterizado por su elevado porcentaje de diatomeas (80.43%). Otro sitio con tendencias positivas en dichas variables fue SW18 en los 3 primeros muestreos. Por su parte, SW1 en el segundo muestreo tuvo mayor concentración de cianobacterias (25.37%) y criptófitas (55.23%), así como menores registros de abundancia total del fitoplancton (67 ind.mL−1) y reducida riqueza de especies (10 spp.), tratándose de un ambiente de escaso caudal.
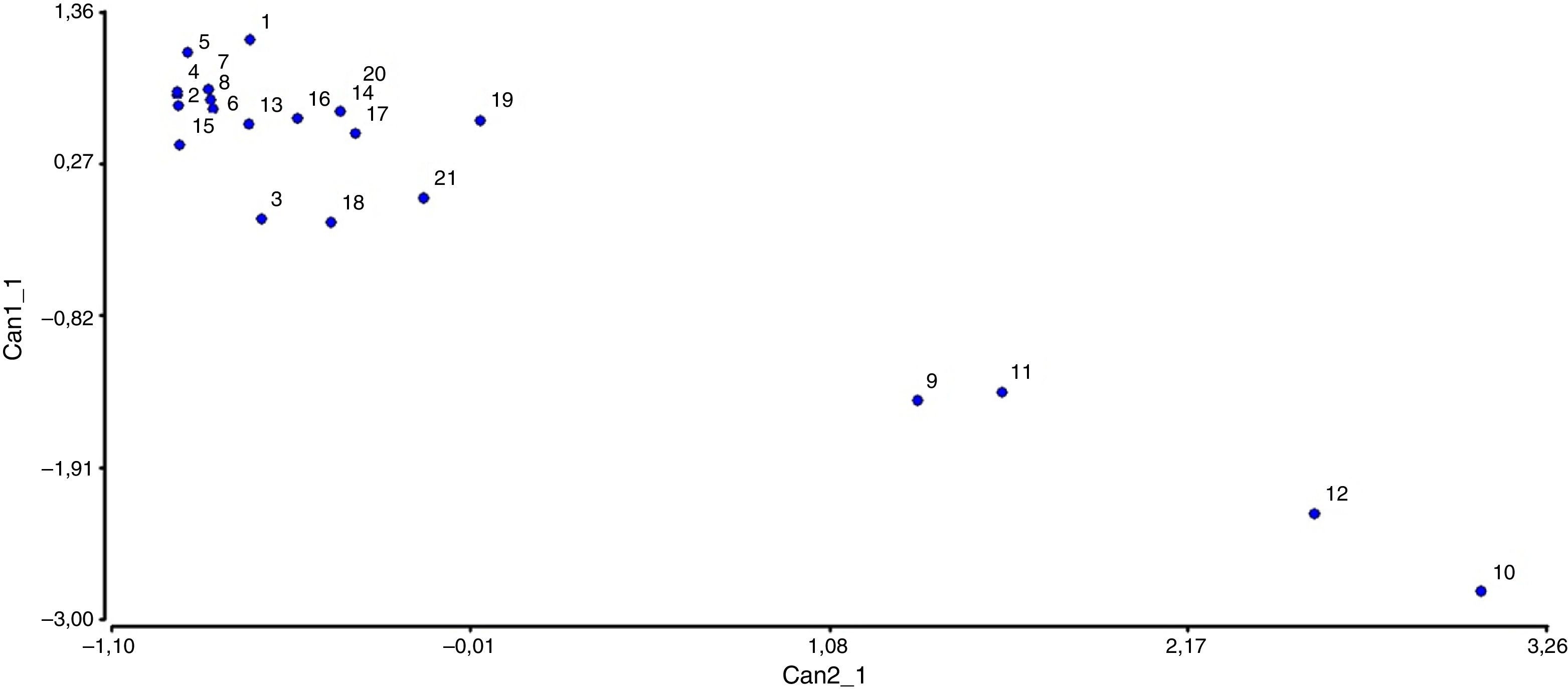
Figura 5 Diagrama del análisis de correlación canónica en el periodo de estudio (1-4: SW1, 5-8: SW4, 9-12: SW28, 13-16: SW18, 17-21: SW3).
Las especies de clorófitas ácido tolerantes y acidofílicas tienen un gran potencial para mediar la bioacumulación de metales pesados y formar sedimentos orgánicos ricos en hierro (Brake y Hasiotis, 2010). La adsorción extracelular del metal es una estrategia común para limitar el acceso de los elementos tóxicos al interior de las células y poder sobrevivir en condiciones de estrés (Gaur y Rai, 2001), habiéndose observado dicha acumulación en especies filamentosas en el río Pircas, por ejemplo, Zygogonium ericetorum . Como resultado, las algas pueden controlar la acidez y metales en soluciones, alcanzando la atenuación natural al impacto ácido (Valente y Gomes, 2007).
Discusión
El río Pircas presentó ensambles algales similares a otros ríos de extrema acidez natural como el río Tinto de España (Aguilera et al., 2007) y el río Agrio de Argentina (Pedrozo, Díaz, Temporetti, Baffico y Beamud, 2010), donde predominan miembros de clorófitas, además de euglenófitas y crisófitas, con especies conocidas por su tolerancia a la alta concentración de metales (Visviki y Santikul, 2000). Las clorófitas tienen muchas especies tolerantes a la acidez y, por otra parte, también habilidad para sobrevivir a la desecación y congelamiento (Stibal, 2004).
Se ha documentado que las comunidades bénticas de ambientes con pH ácido se caracterizan por bajos valores de diversidad y riqueza de especies, aunque por lo general presentan elevada productividad (Baffico, 2010), lo que en nuestro estudio no se cumple en relación con el fitoplancton, probablemente por la precipitación del fosfato soluble con el aluminio, como sucede naturalmente en otros ambientes ácidos (Kopácek et al., 2001). Los procesos de acidificación promueven ionización y disolución de metales contenidos en los minerales y ocasionan el incremento de elementos disueltos. Estos ambientes tienden a ser deficientes en carbono inorgánico y fósforo, y limitan la producción primaria del bentos (Nixdorf y Kapfer, 1998), lo que puede restringir en el tiempo la diversidad y riqueza a pocas especies (Aguilera, Manrubia, Gómez, Rodríguez y Amils, 2006; DeNicola, 2000; Mulholland, Elwood, Palumbo y Stevenson, 1986; Verb y Vis, 2000) y, por lo visto también alcanza a los componentes del fitoplancton en cuerpos de agua de escasos caudales como los del presente estudio. Se presentaron formas teratológicas, que han ido en aumento en el último año, atribuibles a los efectos del estrés ambiental de carácter químico, en especial en Ulnaria ulna , lo que estaría vinculado a la contaminación con metales pesados (Morin et al., 2008).
En conclusión, los cursos lóticos presentaron diferencias en los iones analizados con valores significativamente más elevados en el río Pircas. Los sitios no mostraron diferencias significativas entre sí en función de los atributos ecológicos del fitoplancton, excepto el río Pircas que presentó valores significativamente menores. La composición de los grupos taxonómicos diferenciaron también al río Pircas por la menor representación de diatomeas y cianobacterias, con la dominancia de clorófitas. Las actividades mineras a la vera del río Pircas están produciendo un cambio gradual en las abundancias del fitoplancton en todos los sitios, en especial cuando las precipitaciones son escasas.











 nueva página del texto (beta)
nueva página del texto (beta)






