Introducción
Las actividades antropogénicas han transformado grandes extensiones de bosques tropicales en todo el mundo en paisajes compuestos por fragmentos esparcidos en una matriz de pastizales ganaderos, tierras agrícolas, plantaciones forestales, huertos frutícolas y bosques secundarios (Martínez-Ramos y García-Orth, 2007). En el sureste de México el elemento dominante son los pastizales para la ganadería extensiva y en menor grado plantaciones y bosques secundarios (Bray y Klepeis, 2005). El caso del estado de Tabasco es particularmente extremo, pues conserva menos del 4% de la vegetación original, que era principalmente de bosques tropicales (Bello-Gutiérrez, 2004).
Los bosques secundarios son asociaciones vegetales que se desarrollan a partir de la alteración de los bosques tropicales (Miranda y Hernández, 1963). El proceso por el cual se regenera esta vegetación es conocido como sucesión secundaria, resultando en la recuperación de bosques tropicales o bien, dependiendo de la magnitud y duración de la alteración en la formación de bosques secundarios con estructura similar al bosque tropical (Martínez-Ramos y García-Orth, 2007). Los bosques secundarios pueden ser importantes para la conservación de la fauna silvestre, ya que en ellos pueden encontrar alimento, refugio y sitios para reproducirse (Cruz-Lara, Lorenzo, Soto, Naranjo y Ramírez-Marcial, 2004). En el Neotrópico los bosques secundarios ofrecen a la fauna una gran abundancia y diversidad de recursos para sobrevivir y establecerse (Bobrowiec y Gribel, 2010). En el caso de los murciélagos, estos pueden adaptarse muy bien a los bosques secundarios, ya que en ellos encuentran diversos recursos alimentarios, que permiten la presencia de gremios como los animalívoros (insectívoros y carnívoros), frugívoros y hematófagos (Castro-Luna, Sosa y Castillo-Campos, 2007a).
Los murciélagos frugívoros suelen ser abundantes en bosques secundarios debido a la gran producción de frutos de las plantas características de estos ambientes (e. g. Piper y Cecropia ) durante todo el año (Bobrowiec y Gribel, 2010). La capacidad de volar a grandes distancias les permite trasladarse desde sus sitios de refugio a zonas de forrajeo como los bosques secundarios y viceversa (Galindo-González, 1998). Las especies frugívoras de los géneros Artibeus , Carollia y Sturnira son particularmente exitosas en el aprovechamiento de los bosques secundarios con diferentes grados de alteración (Castro-Luna et al., 2007a; Gonçalves da Silva, Gaona y Medellín, 2008).
En el sureste de México, se han realizado estudios sobre la ecología de murciélagos en sitios en constante fragmentación que pueden ser áreas focales para la conservación de este grupo (Ávila-Torresagatón, Hidalgo-Mihart y Guerrero, 2012). Los murciélagos son importantes para la recuperación de vegetación en zonas alteradas del sureste de México por sus hábitos alimentarios que incluyen especies de plantas características de distintos estadios de sucesión secundaria (Galindo-González, Guevara y Sosa, 2000; Gonçalves da Silva et al., 2008; Olea-Wagner, Lorenzo, Naranjo, Ortiz y León-Paniagua, 2007). Sin embargo, se han registrado cambios en la composición y abundancia relativa de algunas especies de murciélagos en distintos estados de sucesión (Castro-Luna et al., 2007a).
Se ha mencionado que la estructura y composición de la vegetación pueden influir en la composición de los ensamblajes de murciélagos frugívoros (Klingbeil y Willig, 2009). Hasta la realización de este estudio, las investigaciones de murciélagos en Tabasco se han realizado a nivel de comunidad (e. g. Castro-Luna et al., 2007a; Guzmán y Bello-Gutiérrez, 2006; García-Morales, Moreno y Bello-Gutiérrez, 2011), pero los requerimientos y usos de hábitat varían de acuerdo con las características de las especies y las condiciones del ecosistema (Bobrowiec y Gribel, 2010). Por lo tanto, es indispensable conocer más en detalle el comportamiento de gremios y especies, específicamente cómo estas cambian frente a las distintas condiciones de alteración presentes en la región. Por ello, en este estudio analizamos la composición y diversidad de murciélagos frugívoros en 4 bosques secundarios del estado de Tabasco, México, que forman un gradiente de alteración, para conocer cómo los cambios estructurales en la vegetación inciden en los ensamblajes de murciélagos frugívoros.
Materiales y métodos
El trabajo de campo fue realizado en 4 bosques secundarios ubicados en la planicie costera del golfo de México, en el estado de Tabasco, México (fig. 1). Con alturas cercanas a los 10 m snm, presenta clima cálido húmedo con lluvias en verano (AmW"ig), con precipitaciones anuales entre 1,600 y 2,010 mm (Conagua, 2001). Cada bosque secundario presenta un historial particular de alteración y para clasificarlos utilizamos una modificación del criterio propuesto por Miranda y Hernández-X. (1963), quienes plantean que de manera similar a los bosques tropicales originales, estos deben ser clasificados con base en su altura. Tomando en cuenta su historial de alteración y la estructura de la vegetación las nombramos alto, mediano, bajo y cacaotal (tabla 1).
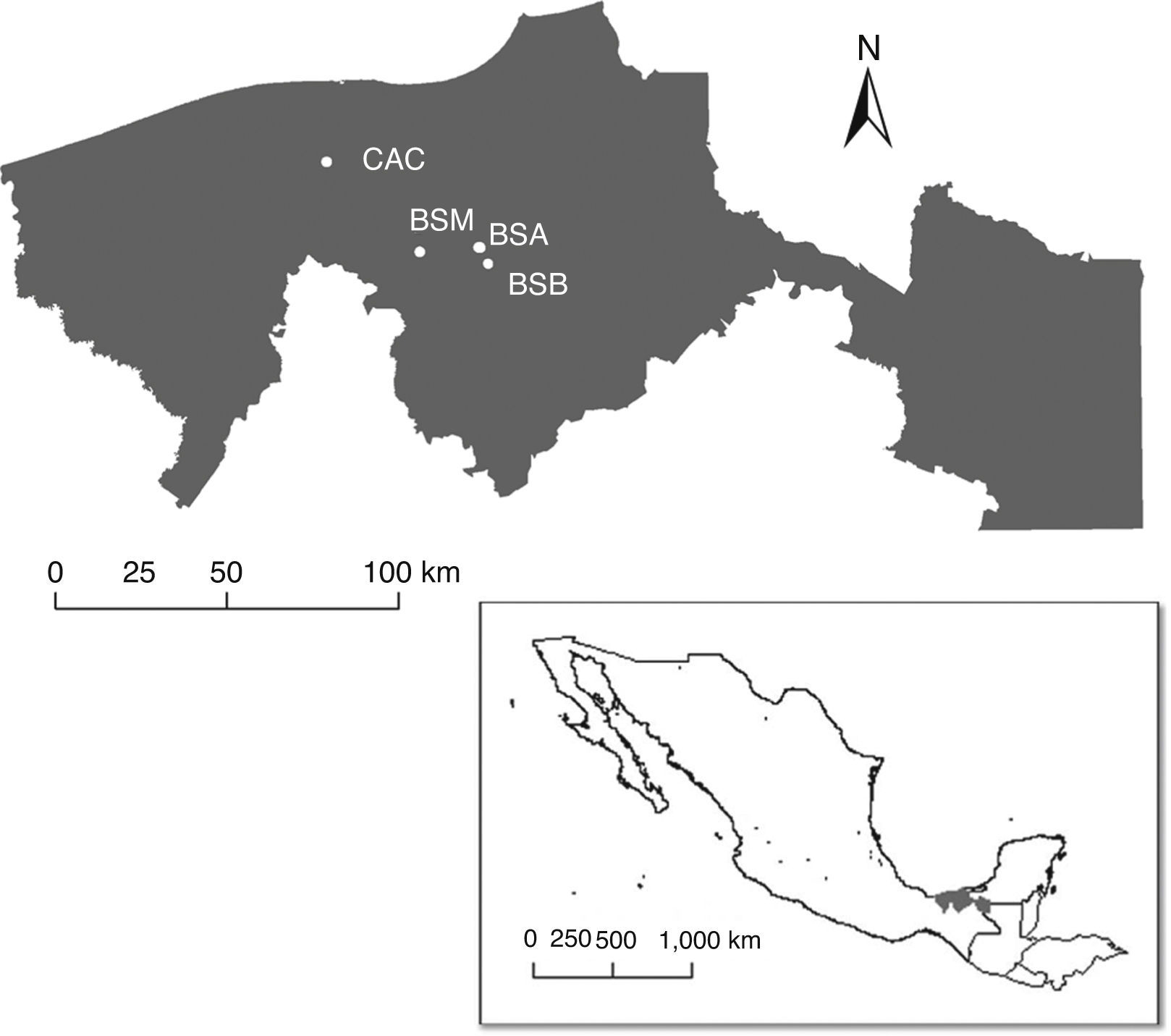
Figura 1 Localización de los sitios de estudio en el estado de Tabasco, México. BSA: bosque secundario alto; BSB: bosque secundario bajo; BSM: bosque secundario mediano; CAC: cacaotal.
Tabla 1 Valores promedios de las variables estructurales de la vegetación, altura de dosel (m); altura de sotobosque (cm); porcentajes de la cobertura herbácea, de dosel y de sotobosque (%); obtenidos en 4 bosques secundarios de Tabasco, México.
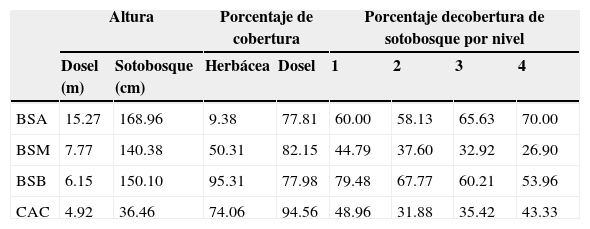
BSA: bosque secundario alto; BSB: bosque secundario bajo; BSM: bosque secundario mediano; CAC: cacaotal.
Para conocer la estructura de la vegetación, en cada bosque secundario fueron establecidos 4 cuadros de 30 x 30 m, en los que se estimaron 8 variables: porcentaje de cobertura de dosel con el uso de un densiómetro cóncavo, altura de dosel y altura de sotobosque mediante una aproximación con una barra medidora de 15 m, porcentaje de cobertura de plantas herbáceas calculado visualmente en cada cuadro y cobertura de sotobosque con el uso de una regla de cobertura para calcular el porcentaje de obstrucción visual en 4 niveles, nivel 1: de 0 a 50cm, nivel 2: 51 a 100 cm, nivel 3: 101 a 150 cm y nivel 4: 151 a 200 cm de acuerdo con el método propuesto por Griffith y Youtie (1988).
1. Bosque secundario alto (BSA): ubicado a 18°00'18" N, 92°80'94" O, dentro del Área Natural Protegida Yumká, en la Ría. Las Barrancas, Centro, Tabasco. Tiene una extensión de 32 ha y parte de este es utilizada como zona de recreación (Becerra, Heredia y Arias, 2007). El dosel de esta asociación vegetal alcanza hasta 15 m de altura y tiene una cobertura cercana al 78%. El sotobosque tiene una altura promedio de 168 cm, y su cobertura es mayor en los estratos 3 (66%) y 4 (70%). Las herbáceas cubren menos del 10% del suelo en este bosque secundario.
2. Bosque secundario mediano (BSM): se ubica a 17°99'02" N, 92°97'47" O, en la periferia oeste de la ciudad de Villahermosa, Tabasco. Cuenta con una superficie de 24 ha con fragmentos de bosque secundario mediano, bosque espinoso de tinto (Haematoxylum campechianum ) y zonas acuáticas (Ascencio-Rivera y Maldonado-Mares, 2002; Sandoval, 2011). Este bosque secundario es comúnmente utilizado para la investigación científica y se ubica en el campus de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco (UJAT). La altura promedio del dosel es de 7.8 m y la cobertura de 82.2%. El sotobosque tiene una altura promedio de 140 cm, con mayor porcentaje de cobertura de sotobosque en los estratos 1 (45%) y 2 (38%). El 50% del suelo de este bosque secundario está cubierto por herbáceas.
3. Bosque secundario bajo (BSB): se ubica a 17°95'87" N, 92°78'57" O, en la Ría. La Cruz del Bajío, Centro, Tabasco. Cuenta con una superficie de 3 ha. Es un predio de propiedad privada, reforestado hace más de 10 años, con desmontes periódicos y poca alteración en los 2 años previos al trabajo de campo. En este bosque secundario el dosel alcanza 6.2 m de altura y tiene una cobertura promedio del 78%. El sotobosque tiene una altura promedio de 150 cm, es muy denso y la cobertura de sotobosque de los primeros 2 estratos es la más alta de los 4 bosques secundarios. La cobertura de plantas herbáceas es del 95%.
4. Cacaotal (CAC): este bosque secundario se ubica en 18°22'76" N, 93°23'10" O, en la Ría. Sur, cuarta sección, Comalcalco, Tabasco. Tiene una extensión de 9.1 ha y originalmente fue una plantación de cacao que actualmente pertenece a la UJAT. La altura promedio del dosel es de 4.9 m, y su cobertura promedio es del 95%. El sotobosque tuvo una altura promedio de 36 cm, con un bajo porcentaje de cobertura sotobosque, proporcionada principalmente por las ramas bajas de los árboles de cacao (Theobroma cacao ). Las plantas herbáceas tienen una cobertura del 74%, solo más baja que en el BSB (tabla 1).
Captura de murciélagos
En cada bosque secundario se eligieron 4 sitios de muestreo potencialmente usados por los murciélagos frugívoros, considerando que estos forrajean o se trasladan comúnmente a lo largo de corredores biológicos o áreas sin vegetación que les permiten desplazarse fácilmente (Caras y Korine, 2009), donde se colocaron 4 redes de niebla de 12 x 3 m, a una distancia promedio de 50 m con la red más cercana. Las redes permanecieron abiertas 6 h a partir de la puesta del sol y revisadas cada 30 min. El esfuerzo de muestreo, calculado de acuerdo con Straube y Bianconi (2002), fue diferente entre bosques secundarios, realizándose 10 noches (8,640 m2h) en BSM, 10 noches (8,640 m2h) en CAC, 6 noches (5,184 m2h) en BSB y 4 (3,456 m2h) en BSA, distribuidas aleatoriamente (una noche por muestreo) entre octubre de 2012 y julio de 2013. Los murciélagos capturados fueron identificados con la guía de campo de Medellín, Arita y Sánchez (2008), marcados mediante el corte de un manchón de pelo del dorso para no incluir en los análisis datos de individuos recapturados (Montero-Muñoz y Sáenz, 2007), y posteriormente liberados en el sitio de captura. Tomando en cuenta tanto murciélagos que consumen frutos como parte principal de dieta, como frugívoros facultativos.
Análisis de datos
Los atributos de los ensamblajes de murciélagos frugívoros fueron evaluados en función de la riqueza, riqueza esperada, diversidad verdadera, composición de especies; donde la riqueza es la riqueza del número de especies registradas y la composición el listado de especies con sus abundancias. Debido a que se realizaron distintos esfuerzos de muestreo entre bosques secundarios, se estandarizó la riqueza esperada mediante un bootstrap (Sbootstrap), tomando en cuenta el menor esfuerzo de muestreo y haciendo 1,000 remuestreos. Esta técnica está basada en el remuestreo con remplazo y no asume la normalidad de los datos, por lo que permitió analizar los datos obtenidos en este estudio (Oksanen, 2013). También fueron calculados la diversidad verdadera de grado 1 (1 D), que permite determinar el número de especies efectivas de una comunidad sin sobrevalorar a las especies raras o las comunes (Jost, 2006). Estos análisis se realizaron en el programa R versión 3.0.2 usando los paquetes Vegan (bootstrap ; Oksanen et al., 2013) y Simba 0.3-5 (diversidad verdadera; Jurasinski y Retzer, 2013). La riqueza esperada mediante bootstrap y la diversidad verdadera registradas en los 4 bosques secundarios se compararon mediante modelos lineales generalizados y un análisis post -hoc X i 2 para coeficientes estandarizados (Saldaña-Vázquez, Sosa, Hernández-Montero y López-Barrera, 2010), usando el software R versión 3.0.2 y el paquete Rcmdr versión 2.0-2 (Fox et al., 2013).
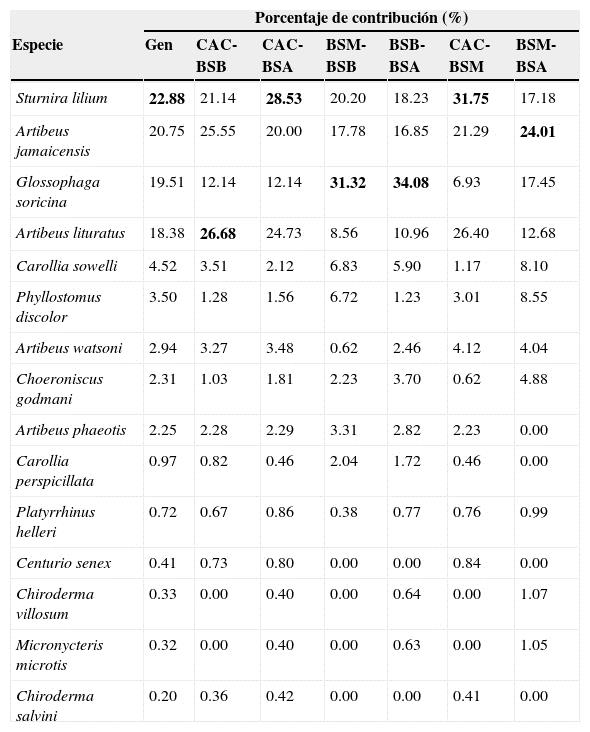
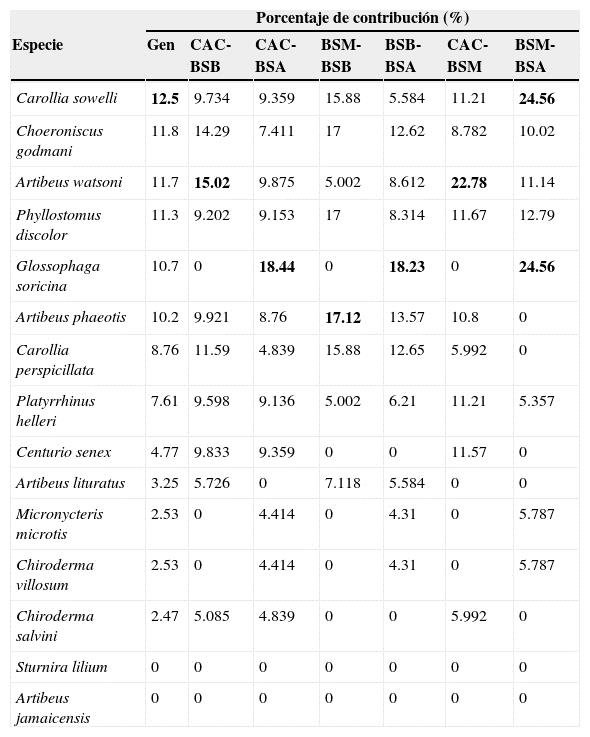
El grado de disimilitud en la composición de especies de murciélagos frugívoros entre bosques secundarios fue determinado mediante análisis de similitudes (ANOSIM; Clarke, 1993), el cual ofrece un valor de R entre 0 (máxima similitud) y 1 (máxima disimilitud) y un valor de p que menor a 0.05 indica que los resultados del análisis son confiables. Para estimar el porcentaje de contribución de cada especie a estas disimilitudes fue calculado el porcentaje de similitudes (SIMPER; Clarke, 1993). Para las comparaciones en ANOSIM y SIMPER se elaboraron matrices de similitud/distancia basadas en abundancias y en presencia-ausencia, utilizando el índice de Bray-Curtis (Hammer, 2012). Estos análisis se realizaron en el programa PAlaeontological STatistics (PAST) versión 2.17c (Hammer, Harper y Ryan, 2001).
Resultados
Se capturaron un total de 691 murciélagos frugívoros, descartando 10 recapturas. Se identificaron 15 especies de murciélagos frugívoros, que representan una riqueza ligeramente menor respecto de la riqueza esperada mediante bootstrap (S bootstrap = 16.3 ± ES 0.9). El valor de diversidad verdadera total de nuestro estudio fue de 1 D = 6.3. Las especies más abundantes en el estudio fueron Artibeus jamaicensis (A. jamaicensis) y Sturnira lilium (S. lilium) , que representaron el 28 y 25% del total de capturas, respectivamente. En el CAC se capturaron 326 individuos de 13 especies, una menos que las estimadas por bootstrap 14.1 ± ES 0.9. En BSB capturamos 159 individuos de 9 especies, la riqueza registrada está dentro del rango de riqueza esperada (Sbootstrap= 9.8 ± ES 0.8). Se capturaron 104 individuos de 10 especies en BSA, riqueza cercana a la esperada (Sbootstrap= 11.2 ± ES 1.0). En BSM se capturaron 102 individuos de 6 especies, que coinciden con la riqueza esperada (Sbootstrap= 6 ± ES 0.2). La diversidad verdadera fue similar entre bosques secundarios. En CAC se registró el valor más alto de diversidad verdadera (1 D = 5.5), seguida de la BSA con 1 D = 5.4. Los bosques secundarios menos diversos fueron BSM y BSB, con 1 D = 4.6 y 1 D= 4.5 (tabla 2).
Tabla 2 Abundancia de murciélagos frugívoros en 4 bosques secundarios de Tabasco, México, riqueza de especies, diversidad verdadera de orden 1 (1 D) y riqueza estimada por bootstrap (±SE).
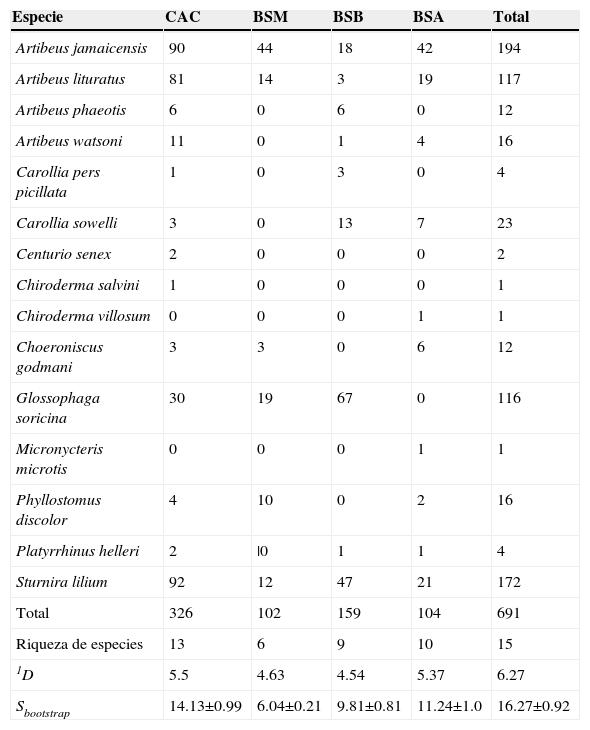
BSA: bosque secundario alto; BSB: bosque secundario bajo; BSM: bosque secundario mediano; CAC: cacaotal.
Las especies dominantes difirieron entre tipos de vegetación. En CAC fueron S. lilium , A. jamaicensis y Artibeus lituratus (A. lituratus) , con 92, 90 y 81 individuos, respectivamente. En BSA las especies más abundantes fueron A. jamaicensis , S. lilium y A. lituratus , con 42, 21 y 19, respectivamente. En el BSM las especies más abundantes fueron A. jamaicensis con 44 y Glossophaga soricina (G. soricina) con 19 capturas, mientras que en BSB fueron G. soricina y S. lilium con 67 y 47 individuos capturados, respectivamente (tabla 2). No hubo diferencias significativas en la riqueza estimada por bootstrap (GLM X 2= 3.64, gl = 3, p = 0.303) y diversidad verdadera 1 D (GLM X 2 = 0.7, gl = 3, p = 0.873) entre bosques secundarios. En general, la composición de especies de murciélagos frugívoros fue diferente entre los bosques secundarios (R ANOSIM= 0.61, p < 0.001). Al realizar comparaciones pareadas, comprobamos que la composición de especies fue marcadamente diferente entre CAC-BSM (R ANOSIM= 0.83, p < 0.05), CAC-BSB (R ANOSIM= 0.71, p < 0.05), CAC-BSA (R ANOSIM= 0.84, p < 0.05) y BSB-BSA (R ANOSIM= 0.69, p < 0.05). En cambio, la composición de especies fue diferente entre BSM-BSB (R ANOSIM= 0.43, p > 0.05) y similar entre BSM-BSA (R ANOSIM= 0.12, p < 0.05), aunque el análisis no fue significativo para estas últimas comparaciones. Las especies que más contribuyeron a las disimilitudes entre los 4 bosques secundarios fueron S. lilium , A. jamaicensis y G. soricina . El análisis pareado entre bosques secundarios reveló que S. lilium , A. lituratus y A. jamaicensis fueron las especies que más contribuyeron a la disimilitud entre CAC-BSA y CAC-BSM; A. jamaicensis , G. soricina y S. lilium fueron las principales entre BSM-BSA, BSM-BSB y BSB-BSA; y A. lituratus , A. jamaicensis y S. lilium en CAC-BSB (anexo 1).
El ANOSIM basado en la presencia-ausencia de las especies indicó que existen diferencias en la composición de especies de murciélagos frugívoros (R ANOSIM= 0.39, p < 0.001). Las pruebas pareadas con ANOSIM de presencia-ausencia indicaron que la composición de especies fue marcadamente diferente entre BSA-BSM (R ANOSIM= 0.86, p < 0.05), BSA-BSB (R ANOSIM= 0.80, p < 0.05) y BSM-BSB (R ANOSIM= 0.80, p < 0.05); e indicaron que existen diferencias entre CAC-BSA (R ANOSIM= 0.54, p < 0.05), CAC-BSB (R ANOSIM= 0.41, p > 0.05) y CAC-BSM (R ANOSIM= 0.60, p <0.05). Las especies con mayor contribución a las disimilitudes entre bosques secundarios fueron Carollia sowelli (C. sowelli) , Choeroniscus godmani (C. godmani) y Artibeus watsoni (A. watsoni) . C. sowelli y G. soricina fueron las especies que más contribuyeron a las disimilitudes entre BSM-BSA, A. watsoni y C. godmani entre CAC-BSB, A. watsoni , Phyllostomus discolor (P. discolor) y Centurio senex entre CAC-BSM, G. soricina y A. watsoni fueron las especies que más contribuyeron a las diferencias entre CAC-BSA, G. soricina y Artibeus phaeotis (A. phaeotis) entre BSB-BSA. Entre BSM y BSB fueron A. phaeotis , Carollia perspicillata y C. sowelli las que más contribuyeron a las diferencias (anexo 2).
Discusión
Aunque el esfuerzo de muestreo fue distinto entre bosques secundarios, en todos ellos la riqueza fue similar a la riqueza estimada mediante bootstrap . La riqueza de murciélagos frugívoros en este estudio fue similar a la registrada en vegetación secundaria de la región sierra de Tabasco, donde se encuentran los principales relictos de bosques tropicales del estado, y similar a la riqueza en algunos estudios de la región (Castro-Luna et al., 2007a; Cruz-Lara et al., 2004; Galindo-González y Sosa, 2003; García-Morales et al., 2011; Montiel, Estrada y León, 2006; Schulze, Seavy y Whitacre, 2000). Sin embargo, comparada con otras regiones del Neotrópico, la riqueza de murciélagos frugívoros registrada para este estudio es notablemente baja (Harvey y González-Villalobos, 2007; Klingbeil y Willig, 2009). Lo anterior puede estar relacionado con el alto grado de alteración antropogénica en la región, por lo que es importante resaltar que los bosques secundarios estudiados son actualmente los únicos refugios disponibles para la fauna silvestre, debido a que la vegetación original (bosques tropicales) ha sido talada y sustituida por pastizales para ganadería.
La mayor diversidad de murciélagos frugívoros se registró en el cacaotal y el bosque secundario alto, por lo que se comprueba la hipótesis de que por su similitud estructural con los bosques conservados, serían los más diversos. La diversidad 1 D de murciélagos frugívoros en los bosques secundarios de nuestro estudio es ligeramente menor que aquella registrada para murciélagos frugívoros en la sierra de Tabasco (García-Morales et al., 2011). Cabe destacar que por la naturaleza del índice de diversidad verdadera, las especies de otros gremios, que generalmente fueron poco abundantes en la sierra, tienen poco peso sobre el valor de diversidad verdadera (Moreno, Barragán, Pineda y Pavón, 2011). La menor diversidad registrada en nuestro estudio puede ser explicada por la carencia de bosques conservados o fragmentos de bosques cercanos a nuestros sitios. Al respecto, se ha mencionado que los fragmentos de bosques conservados juegan un papel importante en la conservación de la biodiversidad (Numa, Verdú y Sánchez-Palomino, 2005), funcionando como fuente de potenciales colonizadores, que de ser capaces de desplazarse y resistir en zonas perturbadas, actuarían en pro de una rápida recolonización a nivel regional (Bennett, 1999). Es precisamente la carencia de bosques conservados lo que hace de los bosques secundarios de la región de nuestro estudio sitios fundamentales para la conservación de murciélagos frugívoros; pues ellos podrían funcionar como fuentes de individuos que potencialmente recolonicen la región y eviten las extinciones locales de estos ensamblajes.
Los 4 bosques secundarios fueron similares en diversidad de murciélagos frugívoros, lo que indica que el grado de alteración de los bosques secundarios no influyó en este atributo del ensamblaje. Se ha mencionado que la edad de los bosques secundarios está relacionada con la riqueza de especies de otros grupos de fauna (Dunn, 2004), pero en nuestro caso, posiblemente no ocurrió porque las especies registradas en los 4 bosques secundarios son aquellas que se alimentan de los frutos que crecen en zonas alteradas (e. g. Cecropia , Piper , Solanum ; Gonçalves da Silva et al., 2008; Olea-Wagner et al., 2007) y suelen ser las más resistentes a las alteraciones (e. g. Artibeus , Sturnira , Carollia ), por lo que pueden sobrevivir en estos ambientes que son inadecuados para otras especies y taxa. La riqueza de especies de muchos grupos taxonómicos puede recuperarse rápidamente después de un disturbio. Sin embargo, la recuperación de la composición de especies es un proceso a largo plazo (Dunn, 2004), y es probable que la composición de especies no llegue a ser la misma después de evento de disturbio demasiado largo o intenso como los que enfrentan actualmente los bosques tropicales en el Neotrópico.
En común, los bosques secundarios de nuestro estudio tuvieron una composición de especies diferente, pero en general las especies dominantes fueron las mismas, y son aquellas que frecuentemente están asociadas a zonas alteradas en el Neotrópico como son las especies de los géneros Artibeus , Carollia y Sturnira (Clarke, Rostant y Racey, 2005; Harvey y González-Villalobos, 2007). No obstante, son especies resistentes a la alteración, las condiciones ambientales pueden favorecer más a unas que a otras; por ejemplo, las especies que, además de consumir frutos, consumen néctar, son más abundantes en sistemas agroforestales y bosques secundarios en estadios tempranos de sucesión (Harvey y González-Villalobos, 2007; Kalko, 1998). En nuestro estudio, este patrón se presenta en G. soricina , una especie conocida por consumir néctar que es resistente a la alteración, pero fue notablemente más abundante en CAC y BSB. Esta capacidad de algunas especies para complementar o modificar su dieta, puede ser un factor importante para su supervivencia.
El estadio de sucesión es otro de los factores que influyen en el éxito de las especies. En estudios anteriores, S. lilium ha mostrado ser más exitosa en estadios tempranos de sucesión (Castro-Luna et al., 2007a), patrón que se presenta en nuestro estudio y, aunque estuvo presente en todos los bosques secundarios, fue notoriamente menos abundante en el BSM y BSA. Algunos autores han registrado diferencias significantes en algunos parámetros estructurales de la vegetación (e. g. altura y cobertura de dosel) en bosques secundarios con distintos estadios de sucesión (Castro-Luna, Castillo-Campos y Sosa, 2011). Estas diferencias estructurales pueden incidir en la presencia y abundancia de los murciélagos frugívoros. Por ejemplo, las especies de frugívoros grandes suelen forrajear en áreas donde el sotobosque es poco denso, lo que les permite desplazarse y forrajear fácilmente (Muscarella y Fleming, 2007); además, su abundancia es directamente proporcional a la cobertura de dosel, donde normalmente encuentran los frutos que consumen (Castro-Luna et al., 2007a). Nuestros datos corroboran lo anterior, ya que los grandes frugívoros del género Artibeus , así como P. discolor fueron poco abundantes en el BSB donde el sotobosque es muy denso.
Además de la estructura de la vegetación, se ha demostrado que la composición de murciélagos en el Neotrópico es influida negativamente por el tamaño de los fragmentos (Gorresen y Willig, 2004). En nuestro estudio, el tamaño de los fragmentos aparentemente no influyó en la riqueza de murciélagos frugívoros, pues en el fragmento más pequeño (BSB) y en el más grande (BSA) se registraron 9 y 10 especies, respectivamente. Sin embargo, al analizar la composición de especies, la influencia del tamaño de fragmentos parece ser importante. En otros estudios, los grandes frugívoros han sido más abundantes en bosques continuos y los frugívoros de menor tamaño más abundantes en fragmentos (Schulze et al., 2000). Esto coincide con nuestros resultados, donde A. jamaicensis , A. lituratus y P. discolor fueron notablemente más abundantes en los fragmentos más grandes, a diferencia de G. soricina y S. lilium que dominaron el ensamblaje en el BSB.
A pesar de que las especies raras tienen poca importancia en el valor de diversidad verdadera, la presencia de especies únicas con abundancia baja en BSA y CAC, puede indicar una mayor importancia ecológica de estos bosques secundarios. Se ha demostrado que las plantaciones agroforestales y los bosques conservados comparten algunas características estructurales y proveen recursos cuantitativamente similares para los murciélagos (Saldaña-Vázquez et al., 2010). La diversidad estructural de los sistemas agroforestales como CAC, proveen diversas oportunidades de refugio y crean condiciones microclimáticas apropiadas para muchas especies de bosques tropicales, y los recursos alimentarios provistos por árboles plantados o de especies que se regeneran naturalmente en ellos son fundamentales para muchas especies de frugívoros (Harvey y González-Villalobos, 2007). A su vez, los bosques secundarios de estadios tardíos de sucesión secundaria como BSA, son similares estructuralmente a los bosques originales (Martínez-Ramos y García-Orth, 2007). Por ello, ambos tipos de bosques secundarios son importantes para amortiguar la pérdida de especies.
Conocer el estado de los ensamblajes de murciélagos frugívoros y analizar sus atributos, permite generar una idea clara de la importancia ecológica de los bosques secundarios. Sin duda, la composición de murciélagos frugívoros es el resultado de un cúmulo de factores, más que de un factor en particular y, aunque es necesario comprender cómo se comporta cada especie en circunstancias particulares y conocer el historial de disturbios al que han estado sometidos, los estudios a nivel de ensamblajes proveen resultados rápidos y confiables sobre el estado los murciélagos frugívoros.
En el sureste de México, la pérdida de los bosques tropicales originales hace que los bosques secundarios sean cada vez más importantes para la fauna silvestre, debido a que muchas veces representan la única opción para la supervivencia de las poblaciones locales de murciélagos. Si bien, el grado de alteración de los bosques secundarios influye sobre la abundancia y composición de especies de murciélagos (Castro-Luna, Sosa y Castillo-Campos, 2007b), la alta diversidad de especies que estos ambientes pueden conservar, puede contribuir en amortiguar la pérdida de especies de bosques tropicales, sobre todo, en paisajes altamente fragmentados.
Los sistemas agroforestales son importantes para la conservación de la riqueza de especies de murciélagos y, en general, de la fauna silvestre, porque contienen un alta diversidad florística y estructural (Harvey y González-Villalobos, 2007), y algunas especies de murciélagos se adaptan a los recursos alimentarios disponibles en estos ambientes (Olea-Wagner et al., 2007). La presencia de estos sistemas en los paisajes del sureste de México, representa una última oportunidad de supervivencia para muchas especies del bosque tropical. Un ejemplo de lo anterior, es el sistema agroforestal de cacao (CAC), el más diverso de los bosques secundarios que estudiamos, no obstante, se localizaba en un paisaje dominado por pastizales para ganadería extensiva (sin cobertura arbórea) y zonas urbanas.
Tanto los bosques secundarios con alto grado de recuperación como las totalmente transformadas (e. g. algunos sistemas agroforestales), son importantes para el establecimiento de los ensamblajes de murciélagos frugívoros. La abundancia de frugívoros en bosques secundarios sugiere que, desde una perspectiva conservacionista, son casi tan importantes como los bosques tropicales prístinos en la conservación de las especies resistentes a ciertos grados de alteración. Por lo tanto, es necesario mirar hacia estos ambientes como opciones para la conservación de murciélagos (Bobrowiec y Gribel, 2010). En Tabasco, donde más del 90% de los bosques tropicales originales han desaparecido (Bello-Gutiérrez, 2004), la importancia de los bosques secundarios para la conservación de la fauna silvestre es evidente, y prueba de ello es la considerable riqueza de murciélagos frugívoros que habitan los bosques secundarios de nuestro estudio, por lo que los esfuerzos locales de conservación deben ser incluyentes de este tipo de vegetación. Por ello, es necesario estudiar a fondo la importancia de estos ecosistemas para otros grupos de fauna silvestre a esta y otras escalas espaciales.











 nueva página del texto (beta)
nueva página del texto (beta)