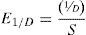Introducción
La reducción de la riqueza de especies con el incremento de la latitud, tendencia conocida como gradiente latitudinal de diversidad (GLD de aquí en adelante) es uno de los patrones más consistentes en biogeografía (Sax, 2001), incluyendo evidencia a favor para grupos de organismos tan disímiles como mamíferos, peces, insectos y plantas (ver revisión en Willig, Kaufman y Stevens, 2003). A pesar de esta generalidad, algunos estudios han documentado excepciones al GLD las cuales, no obstante, pueden contribuir en la elucidación de los mecanismos que explican dicho gradiente (Morales-Castilla y García-Valdés, 2014). En este contexto, la puesta a prueba del GLD con información empírica incrementa la probabilidad de que pueda entenderse la medida en que este es universal y los contextos en los que existen excepciones (Ruggiero, 2001).
Los corredores fluviales ofrecen un marco interesante para la evaluación del GLD. Como elementos lineales en el paisaje, los sistemas fluviales representan corredores biológicos a través de los cuales los organismos pueden dispersarse (Gallé et al. , 1995; Giraudo y Arzamendia, 2004; Nores, Cerana y Serra, 2005). En consecuencia, puesto que en ambientes donde la dispersión de los organismos no se encuentra limitada las comunidades tienden a mostrar una menor diferenciación espacial (Soininen, McDonald y Hillebrand, 2007), puede esperarse que los sistemas ribereños no exhiban un alto grado de variación latitudinal.
En aves, el GLD ha sido encontrado en una gran cantidad de estudios (ver revisión en Willig et al., 2003). No obstante, los estudios sobre aves que evalúen esta tendencia en corredores fluviales son escasos y están basados en recuentos del número de especies a escala regional (e. g., Buckton y Omerod, 2002; Di Giacomo y Contreras, 2002; Rabinovich y Rapoport, 1975; pero ver Nores et al., 2005). Estos estudios han encontrado evidencia tanto a favor (Di Giacomo y Contreras, 2002; Nores et al., 2005) como en contra (Buckton y Omerod, 2002) del GLD en corredores fluviales. En el caso de Rabinovich y Rapoport (1975), estos autores, aunque informaron un GLD para las aves paseriformes de Argentina, mencionan que este es menos notable en el área abarcada por los corredores fluviales de los ríos Paraná y Uruguay. Por otra parte, con excepción de Nores et al. (2005), quienes realizaron un estudio a nivel de ensambles locales, los mencionados estudios caracterizan la riqueza regional (i. e., unidades de muestra ≥ 25 km2; Stevens y Willig, 2002), por lo que no permiten dilucidar si estos patrones reflejan gradientes subyacentes en la diversidad alfa (e. g., riqueza de ensambles locales), beta (e. g., recambio de especies entre localidades) o en ambas (Willig et al., 2003). Puesto que los patrones ecológicos pueden ser escala-dependientes, aquellos obtenidos en una determinada escala no pueden ser extrapolados hacia otras (García, 2006; Wiens, 1989; Willig et al., 2003).
La metodología empleada normalmente en los estudios que evalúan el GLD, basada en la compilación de registros de especies disponibles en mapas de distribución, guías de campo y bibliografía en general, no permite obtener datos sobre la abundancia de las especies (Stevens y Willig, 2002). Esta información es importante en la medida en que algunos de los mecanismos propuestos para explicar el GLD, como aquellos derivados de la hipótesis energética (i. e., hipótesis que propone que la mayor disponibilidad de energía en regiones de menor latitud es responsable de generar y mantener los GLD; Morales-Castilla y García-Valdés, 2014), sostienen que la riqueza de especies es una consecuencia, a través de una relación positiva, del número de individuos de una comunidad (Buckley y Jetz, 2010; Currie et al., 2004; Evans, Warren y Gaston, 2005). Para explicar esta relación positiva se ha postulado que la mayor disponibilidad energética permite que los tamaños poblacionales de las especies se encuentren por encima de sus mínimos viables, evitando así su extinción local (Srivastava y Lawton, 1998). Esta idea ha sido establecida en la literatura bajo la denominación de "hipótesis de más individuos" (HMI, de aquí en adelante; Evans et al., 2005; Srivastava y Lawton, 1998).
La ausencia de datos de abundancia relativa tampoco permite evaluar los patrones de otros atributos comunitarios como la equidad (i. e., de la similitud de las especies en cuanto a sus abundancias relativas; Magurran, 2004), lo que limita la comprensión de la variación latitudinal de las comunidades (Stevens y Willig, 2002; Willig et al., 2003). Existe muy poco consenso sobre cómo la riqueza varía en relación con la equidad a lo largo de gradientes ambientales (Symonds y Johnson, 2008). La HMI predice que a lo largo de un gradiente de productividad, las áreas con más individuos -y, por tanto, con mayor riqueza de especies-, tendrán un mayor número de especies raras (i. e., de especies con baja abundancia relativa; Evans et al., 2005) y, en consecuencia, una menor equidad (Symonds y Johnson, 2008; Willig et al., 2003). Esta predicción asume que las distribuciones de abundancia relativa de los ensambles permanecen esencialmente constantes a lo largo del gradiente, aunque el incremento del número total de individuos en áreas de mayor productividad resulta en un aumento de la riqueza mediante la adición de especies raras (Hurlbert, 2004).
El tramo medio del río Paraná transcurre predominantemente en sentido norte-sur, atravesando un gradiente climático a lo largo de 600 km (Iriondo y Paira, 2007) y permitiendo, así, la dispersión meridional de numerosas especies de organismos (Giraudo y Arzamendia, 2004). El presente trabajo describe los patrones latitudinales de la estructura de los ensambles de aves en bosques ribereños a lo largo de este corredor fluvial, con el objetivo de: 1) dilucidar si los ensambles de aves de los bosques ribereños presentan un GLD; 2) determinar si el GLD informado a escala regional para este corredor fluvial por Di Giacomo y Contreras (2002) refleja un gradiente de diversidad alfa, beta o de ambas y 3) evaluar cómo es la variabilidad relativa a lo largo del gradiente de los parámetros estructurales de los ensambles de aves (riqueza, abundancia y equidad).
Materiales y métodos
El área comprendió el tramo medio del río Paraná, el que se inicia en la confluencia de los ríos Paraguay y Paraná (27°17' S, 58°38' O), y se extiende hasta la latitud correspondiente a la ciudad de Diamante, Entre Ríos (32°04' S, 60°38' O) (Giraudo y Arzamendia, 2004; fig. 1). Este tramo está incluido en la ecorregión Delta e Islas del Paraná (Burkart, Bárbaro, Sánchez y Gómez, 1999). A lo largo de su recorrido atraviesa las provincias fitogeográficas del Chaco, Espinal y Pampeana (Cabrera, 1994; fig. 1). Sumado a esto, la provincia fitogeográfica paranaense se extiende meridionalmente a través de este corredor fluvial (Cabrera, 1971; Menalled y Adámoli, 1995).
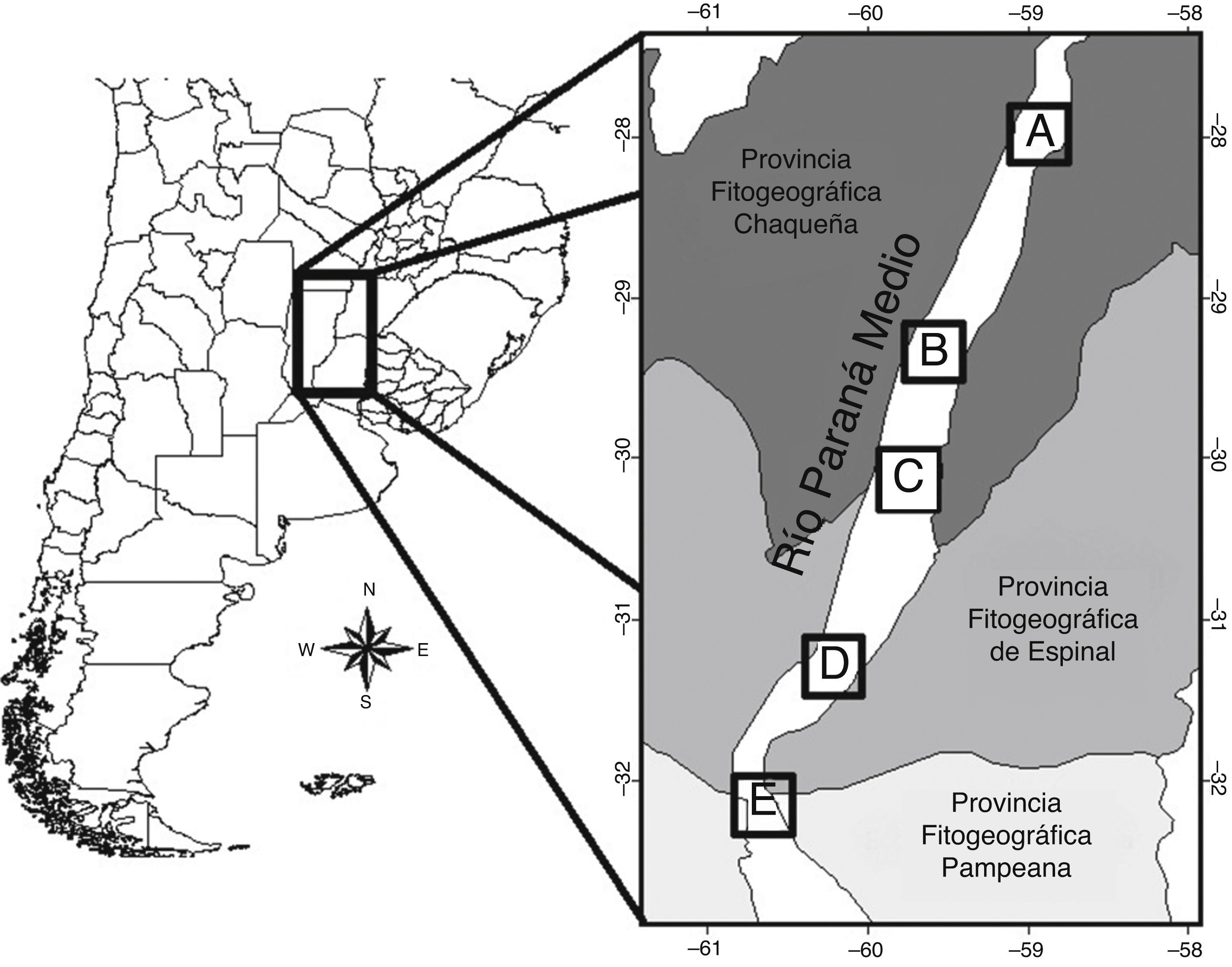
Figura 1 Ubicación del río Paraná medio en el cono sur de Sudamérica y disposición de las localidades de estudio (A, B, C y D) a lo largo de este tramo del río.
El río Paraná medio representa un gradiente latitudinal energético debido a su orientación norte-sur y al rango de variación climática que incluye. El clima general de este tramo es subtropical-húmedo en la porción norte, variando a templado-húmedo hacia el sur (Iriondo y Paira, 2007). La temperatura media anual en el extremo norte del área es de 21 °C y la precipitación media anual es de 1,100 mm (Cáceres, 1980). En el extremo sur, las temperaturas medias anuales se encuentran alrededor de los 19 °C y la precipitación media anual es de 900 mm (Rojas y Saluso, 1987).
El estudio se realizó en bosques ribereños del río Paraná medio, bosques que dependen en algún grado de la presencia del río para su formación y se presentan siguiendo los márgenes de este en forma de franjas. Para controlar la dimensión lateral del corredor fluvial, se estudiaron solo los bosques ubicados en el margen oriental del cauce del río. De acuerdo con Neiff (2004), se incluyeron tanto bosques en galería, los que no son alcanzados por las inundaciones, como bosques fluviales, los que sí son afectados por las inundaciones periódicas provenientes del incremento en los niveles hidrométricos del río. De este modo, las comunidades vegetales presentaron variaciones tanto de composición específica como de estructura, aunque siempre conservaron una fisonomía de bosques definida y diferenciada de las formaciones fitogeográficas no dependientes del río.
Las localidades de muestreo más australes (fig. 1D, E) incluyeron bosques cuyo estrato arbóreo incluye especies dominantes como Ruprechtia laxiflora , Myrsine laetevirens , Phytolacca dioica y Myrcianthes cisplatensis . A partir de los 30° de latitud y hacia el norte, el cauce del río Paraná ya no se presenta limitado orientalmente por un área topográfica elevada, sino que el área lindante es relativamente baja y está sujeta, por tanto, a los pulsos de inundación-sequía (Neiff, 2004). Así, las comunidades vegetales de las 3 localidades ubicadas más al norte (A-C) poseen una identidad estructural y específica diferente, dado que presentan un fuerte componente de especies arbóreas propias de terrenos inundables tales como Inga uruguensis , Salix humboldtiana , Croton urucurana , Albizia inundata , Sapium haematospermum y Tessaria integrifolia . En todos los casos, los sitios seleccionados para realizar los conteos fueron aquellos que no presentaron una marcada alteración antropogénica.
Diseño de muestreo
Se establecieron 5 localidades de muestreo a lo largo del tramo medio del río Paraná (fig. 1), abarcando una distancia de aproximadamente 500 km y una extensión latitudinal de 4°. El muestreo de las 5 localidades fue realizado durante el invierno (julio-agosto de 1996) y repetido durante el verano (enero-febrero de 1997), para incluir las condiciones más contrastantes de variabilidad climática e hidrológica, puesto que estas estaciones coincidieron, además, con los periodos de aguas bajas (invierno) y aguas altas (verano).
Los muestreos se realizaron mediante una técnica mixta, llevando a cabo transectos de banda doble y puntos de conteo fijos (Ralph, Geupel, Pyle, Martin y DeSante, 1996), método especialmente adecuado para brindar una representación completa de la ornitofauna de un área determinada (Bibby, Burgess, Hill y Mustoe, 1992). Se ubicaron 8 transectos de 200 m de longitud en cada localidad con una separación de al menos 150 m. Así, la longitud total abarcada en cada localidad fue de 1,600 m. En cada transecto, se registraron todas las aves vistas y escuchadas en 2 bandas contiguas y paralelas situadas a cada lado de estas. El ancho de las primeras y segundas bandas fue de 15 y 10 m, respectivamente. Estos anchos de bandas fueron establecidos según criterios propios de detectabilidad de aves y con base en el conocimiento previo del ambiente. En cada transecto se ubicaron adicionalmente 3 puntos de conteo con una distancia entre sí de 100 m (i. e., un punto de conteo en el comienzo, uno en la parte media y otro al final de cada transecto). De este modo, se llevaron cabo un total de 24 puntos de conteo en cada una de las localidades. En estos puntos se registraron todas las aves vistas y escuchadas en un radio de 20 m durante 10 min (Barker, Sauer y Link, 1993; Fuller y Langslow, 1984). Los muestreos fueron llevados a cabo solamente por un único y mismo observador en condiciones de buen tiempo (Bibby et al., 1992) y dentro de las 4 primeras horas luego del amanecer (aproximadamente entre las 6:00 y las 10:00 en verano y entre las 8:00 y las 11:30 en invierno), horario de mayor actividad de las aves (Ralph et al., 1996). En los análisis se excluyeron aquellas especies registradas que son propias de ambientes acuáticos o de hábitos nocturnos, debido a que no son propias de bosques, o debido a que los métodos de muestreo utilizados no son adecuados para registrarlas.
Análisis de datos
La unidad de muestreo utilizada para realizar todas las comparaciones de los parámetros de los ensambles fue la combinación de las variables (i. e., riqueza, abundancia y equidad) entre los transectos y los 3 puntos realizados sobre cada una de estas, debido a la ausencia de independencia espacial entre estas subunidades de muestreo.
El análisis de la variación latitudinal de la estructura de los ensambles se realizó en 2 escalas, variando el grano espacial de las comparaciones, lo que puede influir en las características de los patrones descritos (Barton et al., 2013). Estas escalas, teniendo en cuenta la propuesta de Whittaker (1972), son: la escala de localidad (o de hábitat), comparando entre las 5 localidades las variables combinadas entre las distintas muestras (e. g., número total de especies por localidad); y la escala puntual, comparando los valores por muestra (e. g., promedio del número de especies por muestra) entre las localidades. Las comparaciones espaciales fueron realizadas con base en los datos de invierno y verano por separado, y combinados, informando solo esto último en los casos en los que no se encontraron diferencias entre estaciones.
Las variables utilizadas para evaluar los cambios en la estructura de los ensambles a lo largo del gradiente latitudinal fueron: 1) riqueza de especies; 2) abundancia; 3) equidad, calculada mediante el índice de Simpson, el cual no es sensible a la riqueza de especies (Magurran, 2004):
donde S es la riqueza de especies y D es el índice de dominancia de Simpson (Beisel, Usseglio-Polatera, Bachmann y Moreteau, 2003). Para evaluar las distribuciones de abundancia relativa de los ensambles de cada localidad se graficaron curvas de rango-abundancia (Magurran, 2004); 4) número de especies únicas, esto es, aquellas especies que solo estuvieron en una muestra; 5) número de "singletons", esto es, especies con solo un individuo en cada una de las muestras. Estas últimas variables (4 y 5 ) fueron utilizadas para definir las especies como raras, y para analizar los cambios de estas variables entre localidades.
Siguiendo a Gotelli y Colwell (2001) se utilizaron análisis de rarefacción basados en individuos y en muestras para la comparación de la riqueza de especies entre localidades. Estos análisis estuvieron basados en el procedimiento de simulación de Monte Carlo (con 1,000 simulaciones) implementado mediante el programa informático ECOSIM, versión 7 (Gotelli y Entsminger, 2006). Del mismo modo, el número de especies únicas fue comparado entre las localidades mediante una curva de rarefacción basada en muestras. Para cada número acumulado de muestras (i. e., para cada valor del eje de las abscisas en el gráfico), el número de especies únicas fue calculado con base en la media de 100 corridas aleatorias de la curva de acumulación por localidad. Este cálculo fue implementado mediante el programa EstimateS, versión 8.2.0 (Colwell, 2006).
Para comparar la riqueza total de especies entre las 5 localidades se calcularon los intervalos de confianza del 95% de este parámetro de acuerdo con Colwell, Mao y Chang (2004) (ecuación 6). Este análisis asume que la riqueza de especies proveniente de un conjunto de muestras es medida con error, lo que permite derivar un estimador de la varianza y de los intervalos de confianza (Colwell et al., 2004). Este cálculo fue implementado mediante el programa EstimateS, versión 8.2.0 (Colwell, 2006). La no superposición de los intervalos de confianza indica diferencias estadísticamente significativas.
La variación de la diversidad beta se evaluó a través de la prueba de homogeneidad de dispersiones multivariadas (Anderson, Ellingsen y McArdle, 2006), calculando la diversidad beta dentro de cada localidad (entre las 8 muestras) y comparando este valor entre las localidades a través de permutaciones (999 en este estudio) de los residuos mínimos cuadrados. Para este análisis se utilizó el índice de disimilitud de Sörensen, el cual mide la variación en la composición entre comunidades (Koleff, Gaston y Lennon, 2003). Este análisis fue implementado mediante el paquete Vegan (Oksanen, 2011) en el programa estadístico R (R Development Core Team, 2012).
La evaluación de la variación latitudinal de la riqueza, la abundancia y la equidad, por muestra, se realizó mediante el análisis de correlación de rangos de Spearman, debido a que las distribuciones de estas variables no siguieron una distribución normal. De este modo, se hizo un análisis de correlación entre cada uno de los atributos de los ensambles (riqueza, abundancia y equidad) y la latitud. Para la riqueza de especies, además de los valores por muestra observados, se correlacionaron los valores de riqueza por muestra obtenidos mediante rarefacción con base en las muestras de menor abundancia, con el objetivo de controlar el efecto del diferente número de detecciones entre las muestras. A pesar de requerir menos supuestos que las pruebas paramétricas, el análisis de correlación de Spearman se ve afectado por la ausencia de independencia entre muestras (Maestre y Escudero, 2008). Por lo tanto, se verificó la independencia de los residuos mediante el estadístico I de Moran, probando su significación mediante un proceso de permutación (500 corridas) implementado con el programa estadístico SAM (Rangel, Diniz-Filho y Bini, 2010) en cada una de las pruebas realizadas. La ausencia de autocorrelación en los residuos permite una correcta inferencia de los parámetros de la correlación (Diniz-Filho, Bini y Hawkins, 2003). El nivel de significación de todas las pruebas estadísticas fue fijado en α < 0.05.
Resultados
Se registraron un total de 13,167 detecciones pertenecientes a 101 especies y 24 familias. En el muestreo de invierno se contabilizaron 6,369 detecciones pertenecientes a 80 especies y 22 familias, mientras que en el muestreo de verano fueron registradas 6,798 detecciones pertenecientes a 88 especies y 22 familias.
Variación latitudinal de la estructura de los ensambles a escala de localidad
Los patrones latitudinales de las variables no mostraron, en general, diferencias entre invierno y verano (tabla 1), por lo que se presentan los resultados combinados entre los muestreos de estas 2 estaciones. La riqueza total de especies por localidad decreció con el incremento de la latitud (tabla 1). No obstante, con excepción de la localidad A que presentó una alta riqueza de especies con respecto a las demás, no se encontraron diferencias significativas entre las localidades adyacentes (i. e., los intervalos de confianza se superpusieron entre las localidades ubicadas de manera adyacente a lo largo del gradiente latitudinal [fig. 2]). El patrón latitudinal estuvo presente en diferentes niveles de muestras acumuladas (i. e., las curvas por localidad no se superpusieron en la figura 3A). La abundancia presentó valores decrecientes con el incremento de la latitud, aunque en el muestreo de verano el mayor valor de esta variable fue registrado en la localidad D (tabla 1). El análisis de rarefacción basado en el número de individuos confirmó la tendencia latitudinal negativa de la riqueza de especies (fig. 3B). Los ensambles presentaron índices de equidad total muy similares entre las localidades (tabla 1). No obstante, las curvas de rango-abundancia por localidad difirieron entre sí, puesto que el número de especies raras (i. e., especies que se ubican a la derecha de la curva) se redujo con el incremento de la latitud de las localidades (fig. 4). El número de especies únicas no presentó un patrón de variación latitudinal (tabla 1; fig. 5). En cuanto a la diversidad beta, no se encontraron diferencias significativas entre las localidades (prueba de homogeneidad: F4, 35: 1.64; p = 0.2, tabla 1).
Tabla 1 Variables que caracterizan la estructura (sumatorias entre muestras por localidad) de los ensambles de aves obtenidas en 2 muestreos (invierno de 1996 y verano de 1997) en 5 localidades ubicadas a lo largo de los bosques ribereños del río Paraná medio, Argentina.
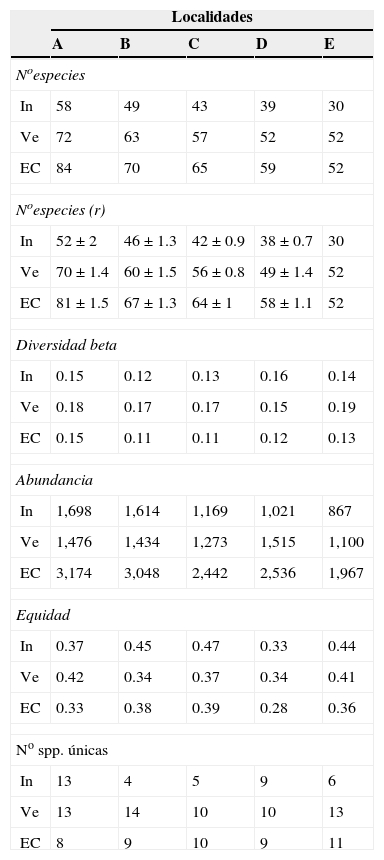
El orden de las letras de las localidades indica una reducción de la latitud.
Muestreos: invierno (In), verano (Ve), combinados (EC).
El número de especies obtenido mediante rarefacción <<N° especies (r)>> incluye las desviaciones estándar del promedio de las repeticiones, excepto para la localidad con la menor abundancia.
El número de especies únicas es calculado para las 8 muestras de cada localidad.
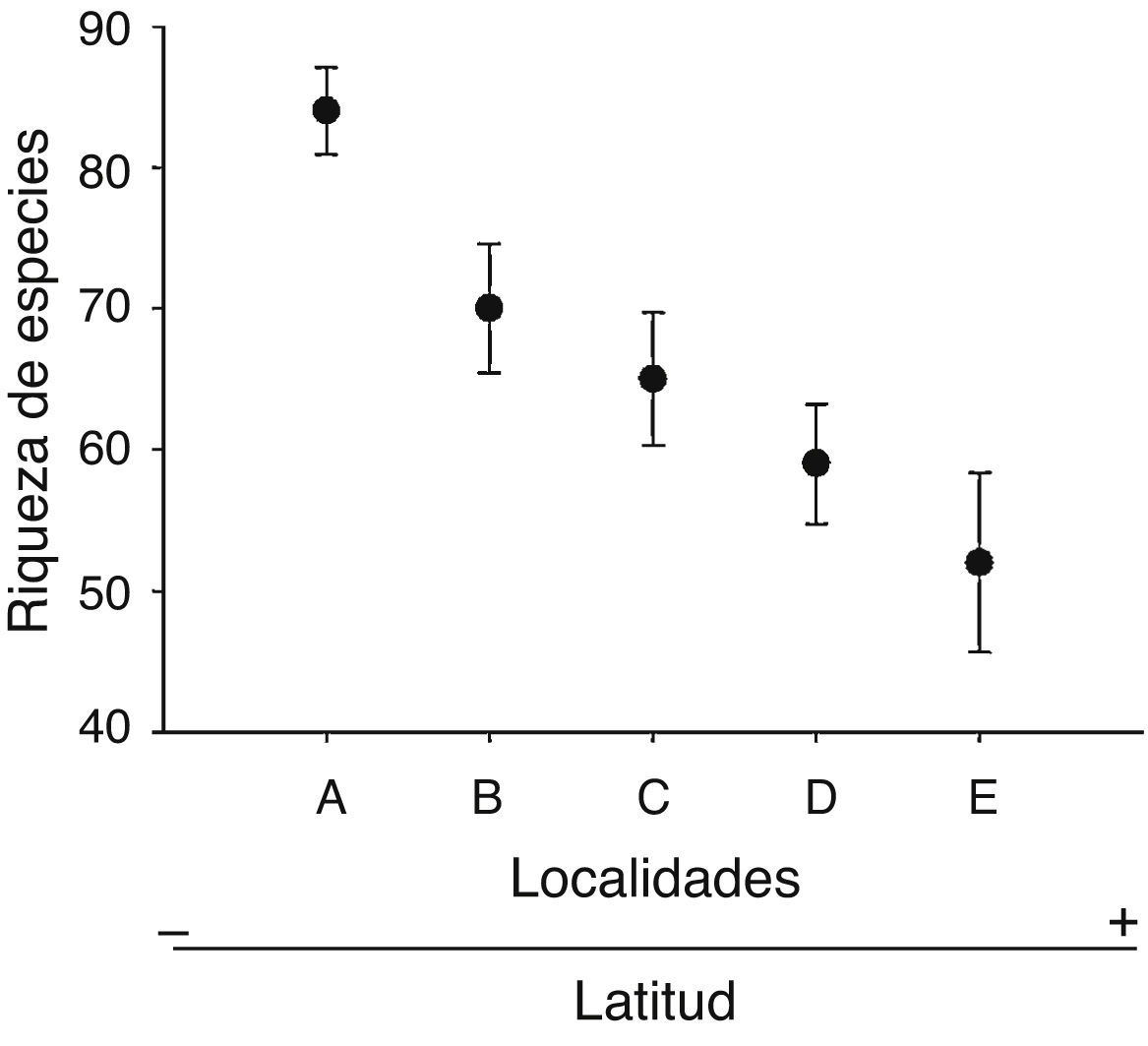
Figura 2 Riqueza de especies de aves registrada ± intervalos de confianza del 95% en función de cada una de las localidades ubicadas a lo largo del gradiente latitudinal de bosques ribereños del río Paraná medio.
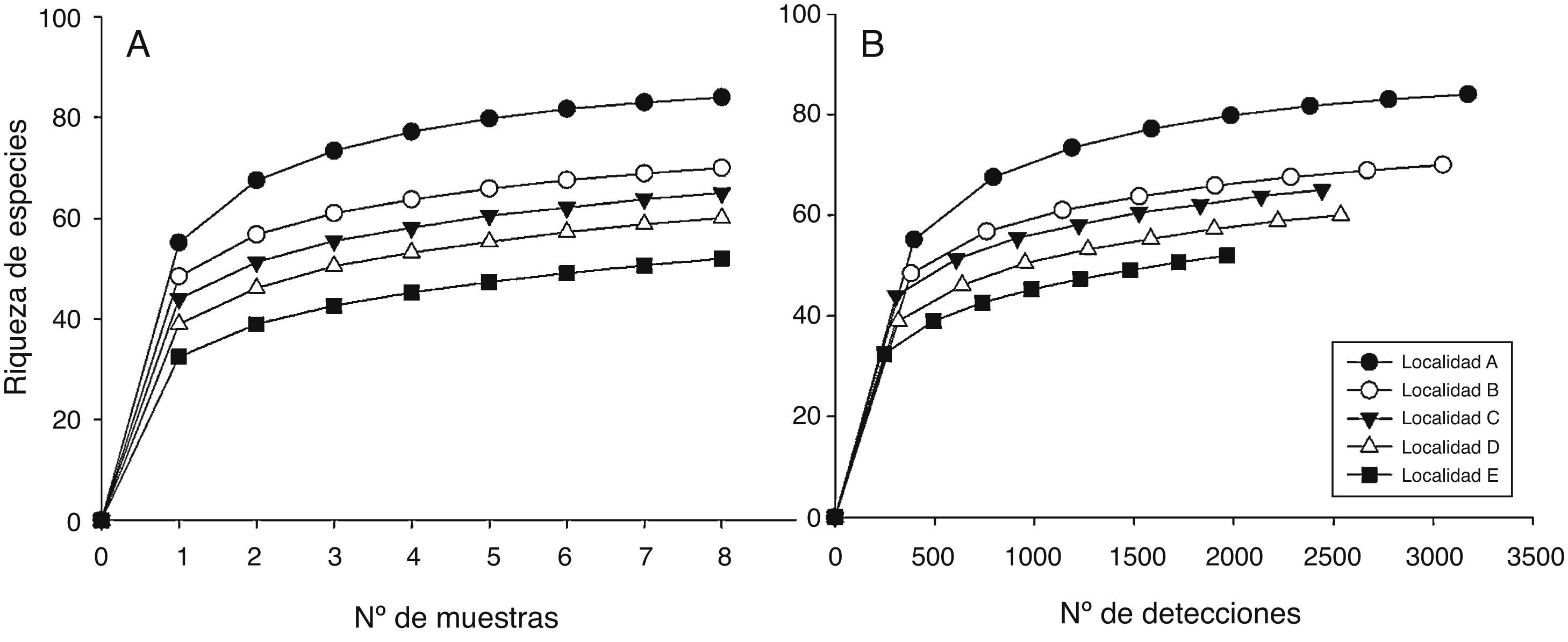
Figura 3 Curvas de rarefacción (con base en los muestreos de invierno y verano combinados) basada en muestras (A) y en individuos (B) para las 5 localidades estudiadas.
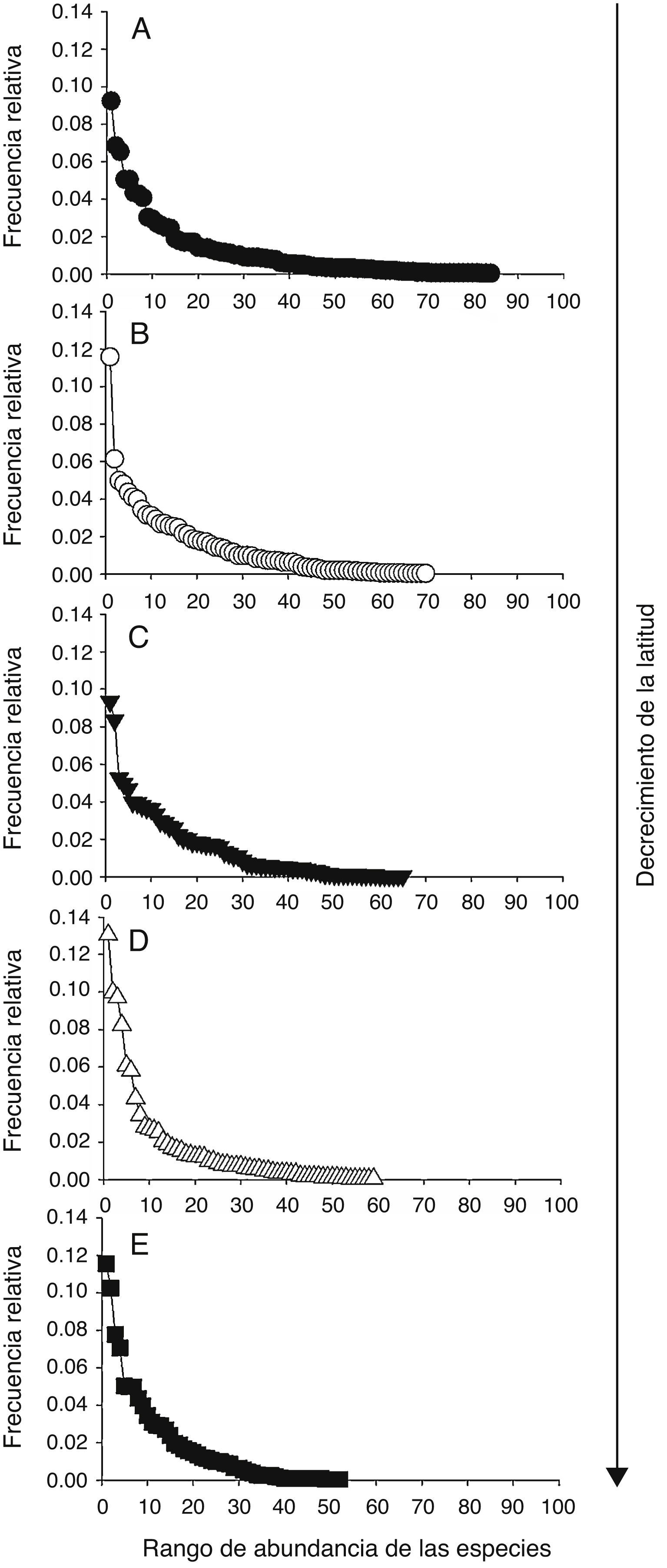
Figura 4 Curvas de rango-abundancia de los ensambles de aves (con base en las muestras combinadas) de las localidades A (A), B (B), C (C), D (D) y E (E).
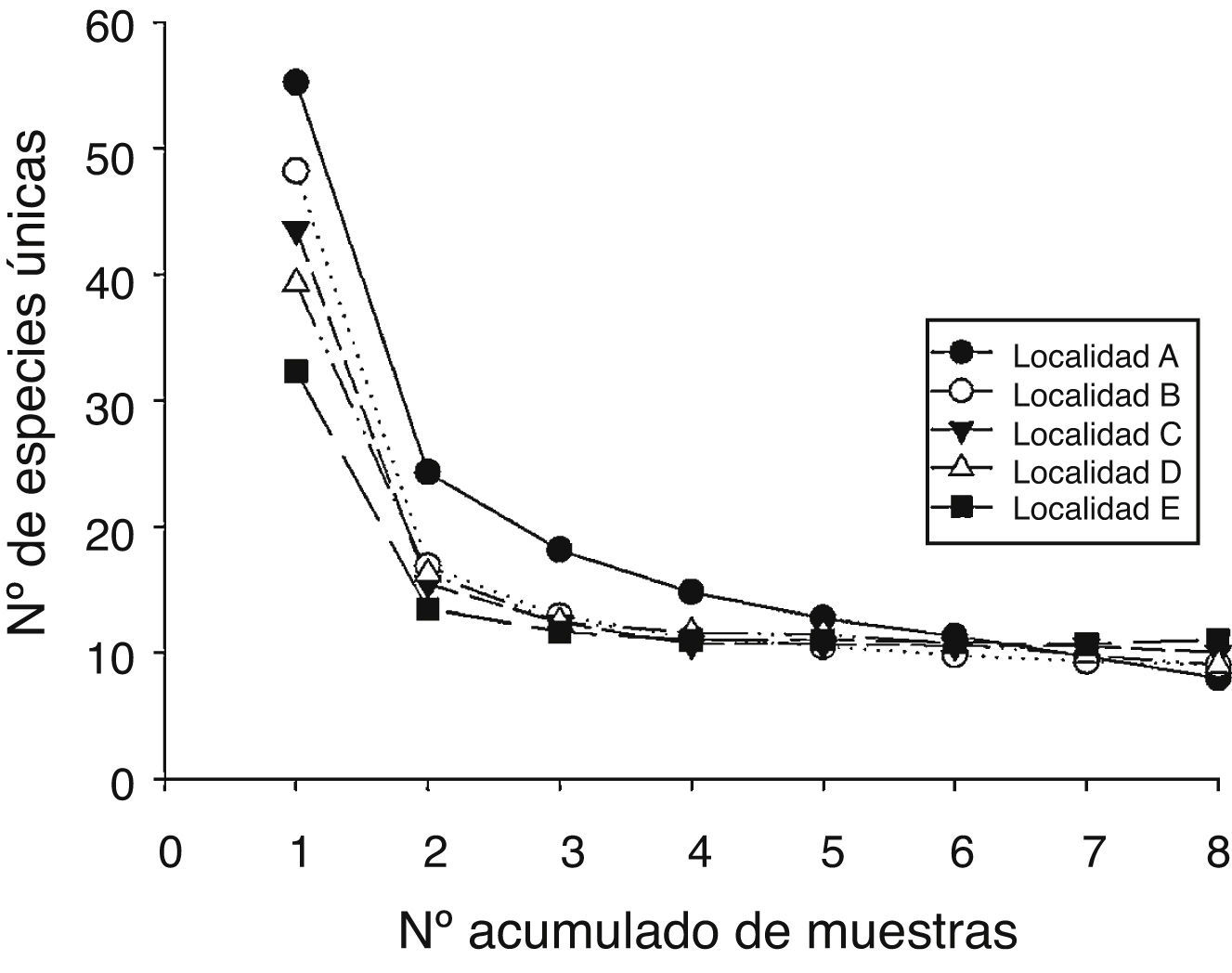
Figura 5 Número de especies únicas en relación con el número acumulado de muestras en las 5 localidades estudiadas.
El número de especies exclusivas decreció con el incremento de la latitud de las localidades: la localidad A presentó el mayor número (10 spp.), seguido por las localidades B (5 spp.), C (4 spp.) y D (2 spp.). La localidad E no presentó especies exclusivas. En conjunto, el 21% (21 spp.) de las especies fueron exclusivas de una sola de las localidades.
Variación latitudinal de la estructura de los ensambles a escala puntual
Los patrones latitudinales a escala de muestra no variaron entre los muestreos de invierno y verano (tabla 2), por lo que se presentan los resultados con base en los muestreos combinados. Tanto la riqueza de especies por muestra como la riqueza de especies para muestras estandarizadas mediante rarefacción (calculada para muestras de 187 detecciones) decrecieron con el incremento de la latitud de las localidades (rho = −0.91, p < 0.001 y rho = −0.87, p < 0.001, respectivamente [tabla 2; fig. 6A, B]). Lo mismo ocurrió con la abundancia por muestra (rho = −0.84, p < 0.001, [tabla 2; fig. 6C]). La equidad por muestra, en cambio, no se asoció con la latitud (rho = 0.05, p = 0.78 [tabla 2; fig. 6D]). El número de singletons por muestra decreció con el incremento de la latitud (rho = −0.62, p < 0.001 [tabla 2; fig. 6E]).
Tabla 2 Variables que caracterizan la estructura (promedios±desviación estándar) de los ensambles de aves obtenidas en 2 muestreos (invierno de 1996 y verano de 1997) en 5 localidades ubicadas a lo largo de un gradiente latitudinal de bosques ribereños del río Paraná medio, Argentina.
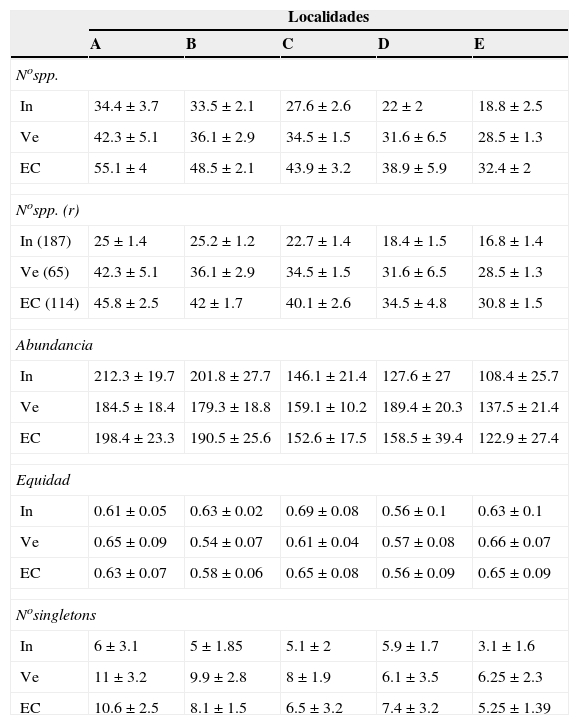
Se presentan los valores de las variables promediados por muestra (medias±desviación estándar) para los muestreos de invierno (In) y verano (Ve) y para estas estaciones combinadas (EC).
La variable "No de especies (r)" corresponde al número de especies calculado mediante rarefacción para las muestras de menor abundancia entre las localidades.
Estos niveles de abundancia se dan entre paréntesis para invierno (In), verano (Ve) y para las estaciones combinadas (EC).
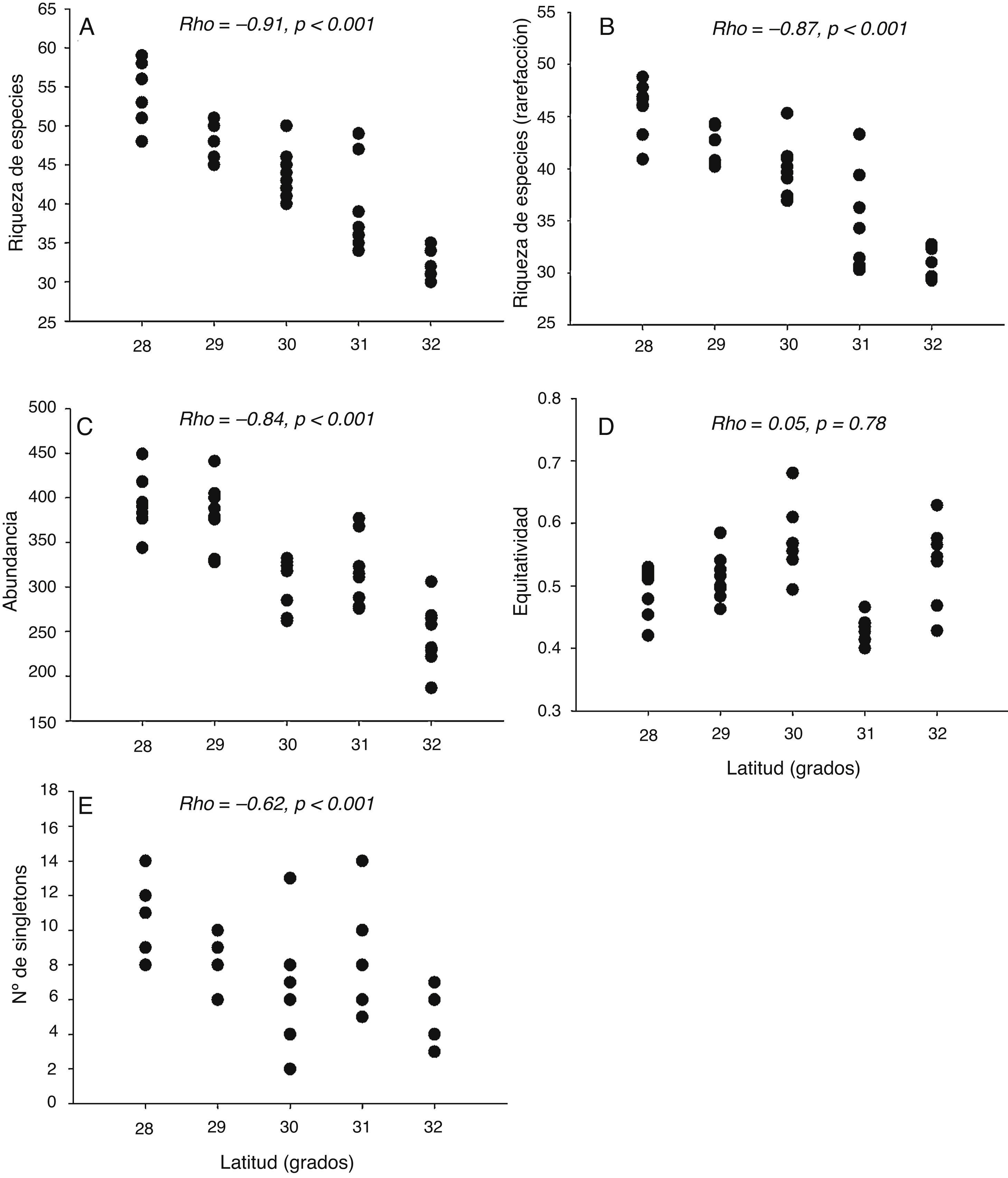
Figura 6 Riqueza de especies (A), riqueza de especies obtenida mediante rarefacción (B) abundancia (C), equidad (D) y número de singletons (E) por muestra en relación con la latitud. Se muestran el coeficiente de correlación de Spearman (rho) y el nivel de probabilidad (p) de cada prueba estadística.
Cambios latitudinales relativos de las variables estructurales de los ensambles
En general, las asociaciones significativas entre variables estuvieron a su vez relacionadas con cambios latitudinales (fig. 7A-E). La reducción del número de singletons se relacionó negativamente con la equidad, aunque no se observó un patrón claro de influencia latitudinal en esta relación (fig. 7F). Aunque la riqueza de especies fue calculada mediante rarefacción para eliminar la influencia de la abundancia, estas variables presentaron igualmente una asociación positiva significativa (fig. 7B). Esto fue así debido a la correlación de ambas variables con la latitud, puesto que la abundancia por muestra no dio cuenta completamente del patrón latitudinal negativo de la riqueza de especies. No se encontraron asociaciones significativas entre la riqueza de especies y la equidad (rho = −0.17, p= 0.29), entre la riqueza obtenida mediante rarefacción y la equidad (rho = −0.02, p= 0.91), y entre la abundancia y la equidad (rho = −0.19, p = 0.25).
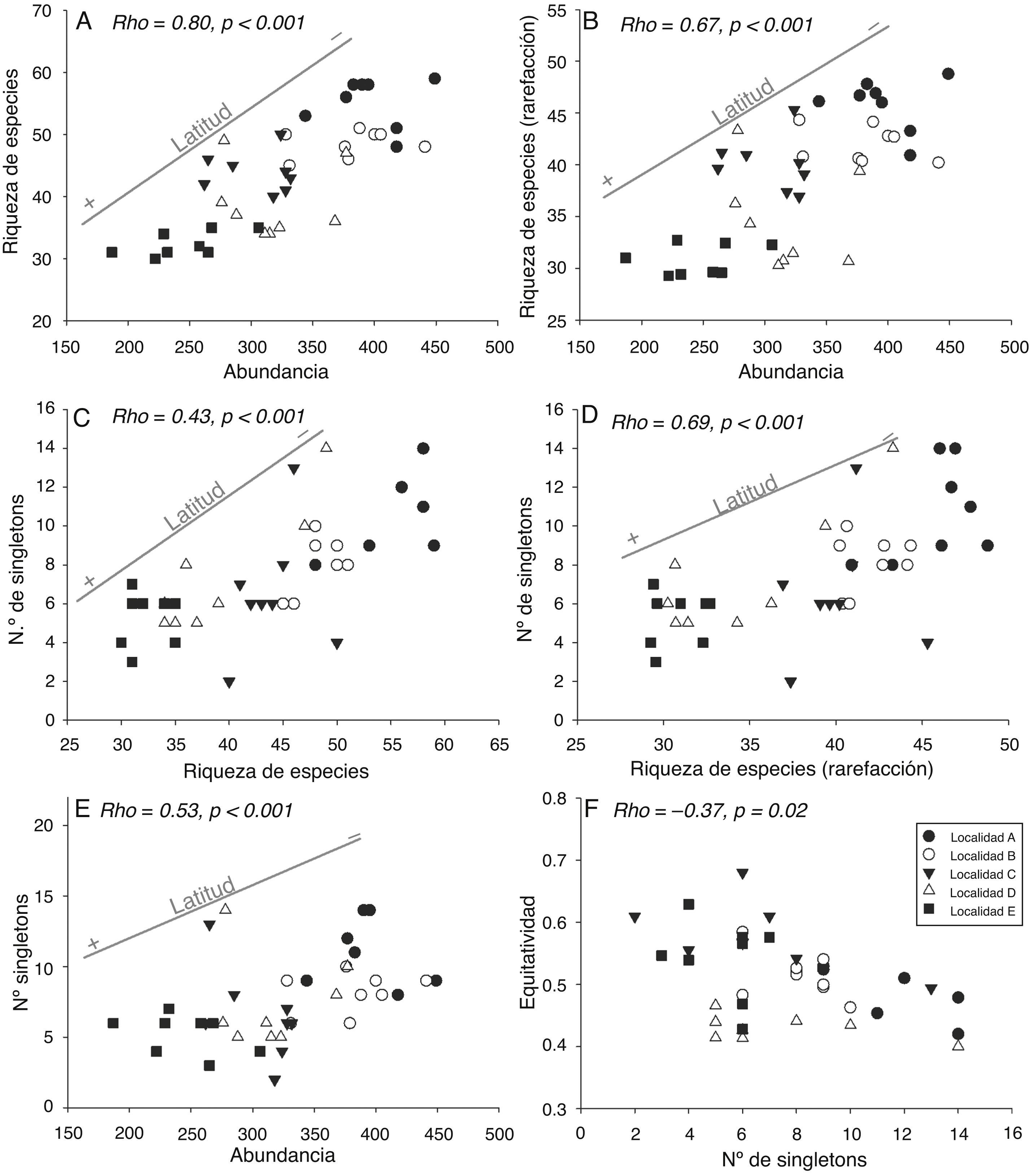
Figura 7 Diagramas de dispersión que muestran la relación de la abundancia con la riqueza de especies (A) y con la riqueza de especies obtenida mediante rarefacción (B); la riqueza de especies y el número de singletons (C); la riqueza de especies obtenida mediante rarefacción y el número de singletons (D); la abundancia y el número de singletons (E) y el número de singletons y la equidad de Simpson (F). En aquellos casos en los que se observó una influencia latitudinal en las asociaciones entre variables, se grafica, además, una recta que indica la variación de la latitud entre las muestras. Se muestran el coeficiente de correlación de Spearman (rho) y el nivel de probabilidad (p) de cada prueba.
Discusión
Los resultados encontrados sustentan la existencia de una relación inversa entre la riqueza de especies de aves y la latitud en el gradiente ambiental conformado por los bosques ribereños del río Paraná. Estos resultados contrastan con la revisión realizada por Willig et al. (2003), quienes informaron que gran parte de las excepciones al GLD se corresponden con estudios de poca extensión (i. e., menos de 20° de latitud). El GLD se presentó tanto en el muestreo invernal como en el estival, y bajo condiciones hidrológicas contrastantes del río, característica que distingue los ambientes fluviales de los ambientes de tierra firme y que afecta de distintas maneras la estructura de los ensambles de aves (Beja et al., 2010; Knutson y Klaas, 1997).
Los resultados encontrados apoyan la idea de control regional de la diversidad en la que la riqueza de los ensambles locales está condicionada por el pool regional de especies. Los estudios sobre variación latitudinal han sido realizados en su mayoría en escalas regionales o por encima de estas (Stevens y Willig, 2002). Di Giacomo y Contreras (2002) encontraron un GLD de aves en el corredor fluvial de los ríos Paraguay y Paraná comparando grillas geográficas de aproximadamente 3,000 km2 que incluyen varias comunidades y paisajes, por lo que su trabajo informa un gradiente de diversidad regional. A escalas locales, otros procesos tales como la interacción entre especies pueden ser más importantes (Huston, 1999) y resultar en patrones de diversidad diferentes. Debido a esto, los resultados obtenidos en una escala particular no pueden ser extrapolados hacia otras.
En el caso de los corredores fluviales, se ha sugerido que la variación espacial de la riqueza de los ensambles locales podría ser independiente del pool regional de especies debido a las limitantes físicas propias de este tipo de sistemas (e. g., regímenes de inundaciones; Boulton et al., 2008). El presente estudio constituye un abordaje a escala local (diversidad alfa) y no sustenta la idea de independencia entre la riqueza local y regional en sistemas fluviales en el caso de las aves, dado que los patrones de riqueza de los ensambles locales reprodujeron el patrón latitudinal negativo informado para la riqueza regional. La gran capacidad de dispersión de las aves explicaría en parte esta consistencia, puesto que esta es una de las características que favorece una relación positiva entre la riqueza regional y local (Hillebrand y Blenckner, 2002). Por otra parte, aunque la dispersión de los organismos puede reducir la diferenciación espacial de las comunidades, lo cual podría ser particularmente cierto en sistemas fluviales de acuerdo con los estudios que los definen como corredores biológicos (Gallé et al., 1995; Giraudo y Arzamendia, 2004), se encontró una elevada variación de la riqueza de especies a lo largo del sistema ribereño estudiado, variable que refleja uno de los aspectos de los cambios de la composición de las comunidades (Baselga, Jiménez-Valverde y Niccolini, 2007).
La diversidad alfa, medida como la riqueza de especies de los ensambles, se presentó como el componente de diversidad más importante en la generación del GLD regional de aves a lo largo del corredor fluvial del río Paraná informado por Di Giacomo y Contreras (2002). Los GLD informados a escala regional (i. e., diversidad gamma) pueden reflejar GLD en la riqueza (i. e., diversidad alfa) y/o en la diversidad beta (i. e., recambio de especies) de los ensambles locales incluidas en las unidades de muestra definidas como región (e. g., grillas geográficas ≥ 25 km2; Stevens y Willig, 2002, Willig et al., 2003). Entre los pocos trabajos que incluyen el estudio de la variación latitudinal de los 3 niveles de diversidad (alfa, beta y gamma), Stevens y Willig (2002), estudiando murciélagos del nuevo mundo, encontraron que la diversidad alfa es más importante que la beta en la generación de los patrones de riqueza regional correspondientes a la diversidad gamma. Del mismo modo, el presente trabajo permite concluir que el GLD regional de aves informado para el corredor fluvial del río Paraná, mediante la cuantificación de la riqueza de especies en grillas geográficas de aproximadamente 3,000 km2 (Di Giacomo y Contreras, 2002), refleja, al menos en una gran proporción, un gradiente de diversidad alfa (i. e., de la riqueza de los ensambles locales) más que un gradiente de diversidad beta (i. e., del recambio de especies entre ensambles locales), puesto que esta última no varió latitudinalmente.
Los resultados apoyaron la HMI, puesto que se encontró un gradiente latitudinal de la riqueza de especies y de la abundancia en la misma dirección. Una segunda hipótesis, la "hipótesis de muestreo aleatorio", predice también una variación espacial lineal y positiva entre la riqueza de especies y la abundancia. Esta hipótesis postula que el número de individuos registrados representa una muestra aleatoria del pool regional de especies. Por tanto, cuanto mayor sea el número de individuos registrados, mayor será la riqueza de especies encontrada (Evans et al., 2005). No obstante, el gradiente latitudinal negativo de la riqueza de especies se sostuvo aun cuando se controló la variación de la abundancia mediante rarefacción. Esto permitió rechazar la "hipótesis de muestreo aleatorio", puesto que con muestras del mismo tamaño (i. e., el mismo número de individuos), las localidades de menor latitud presentaron igualmente un mayor número de especies. Aunque se han postulado otras hipótesis para explicar el GLD (Currie et al., 2004; Morales-Castilla y García-Valdés, 2014), estas no hacen ninguna predicción sobre la variación latitudinal de la abundancia (Currie et al., 2004). De acuerdo con esto, los resultados de este trabajo apoyan el mecanismo propuesto por la HMI para explicar el GLD a lo largo del corredor ribereño.
Se ha sugerido que el aumento en la complejidad del hábitat puede ser el factor involucrado en la generación de ensambles más equitativos, con mayor número de especies para la misma cantidad de individuos, en áreas de mayor productividad (Hurlbert, 2004). Los resultados encontrados, en contraposición a lo informado por Hurlbert (2004) para aves de América del Norte, mostraron que la reducción del número de especies y de la abundancia a lo largo del gradiente latitudinal no implicó cambios lineales de la equidad. No obstante, la equidad que Hurlbert (2004) analizó no es independiente del número de especies (ver Nimmo, James, Kelly, Watson y Bennett, 2011). Nimmo et al. (2011) destacaron la importancia de considerar índices de equidad independientes de la riqueza de especies para evitar seudocorrelaciones como resultado de artefactos estadísticos. El índice de equidad utilizado en este trabajo es independiente del número de especies, y no presentó un patrón de decrecimiento latitudinal.
Aunque los resultados no apoyaron la predicción de la HMI relacionada con la variación de la equidad a lo largo del gradiente latitudinal (i. e., que las áreas con más individuos, y, por tanto, con mayor riqueza de especies, a lo largo de un gradiente latitudinal de productividad tendrán un número más grande de especies raras), sí se encontró sustento para la idea de que las áreas de mayor productividad (i. e., las áreas ubicadas en latitudes menores), además de mantener un mayor número de especies y de individuos, también sostienen un número más elevado de especies raras. El número de singletons varió lineal y positivamente con respecto a la riqueza y la abundancia a lo largo del gradiente latitudinal. Esto está acorde con la HMI, puesto que sostiene la idea de que el mayor número de individuos registrado en áreas de mayor productividad mantiene más especies por encima de sus mínimos tamaños poblacionales viables. Las mismas se incorporan a la estructura de los ensambles como un mayor número de especies raras, tal como se observó al comparar las distribuciones de abundancia relativa entre las localidades. Sin embargo, y en contra de lo predicho a partir de la HMI, este patrón en las especies raras no resultó en una relación negativa entre la riqueza de especies y la equidad, lo que contrasta con lo informado por Symonds y Johnson (2008), quienes encontraron este patrón estudiando aves de Australia. Aunque el número de especies raras se relacionó positivamente con la riqueza y negativamente con la equidad, no fue suficiente para generar una relación negativa entre estas 2 últimas variables. Sin embargo, esto podría estar relacionado con los cambios en la composición florística de los bosques considerados (ver el apartado relativo a métodos), puesto que si se excluyen las 2 localidades más australes (i. e., localidades D y E), la equidad presenta un patrón de crecimiento en función del incremento de la latitud.
En conclusión, los resultados encontrados muestran que el componente alfa de la diversidad, medido como la riqueza de especies de los ensambles locales, es más importante que el componente beta en cuanto a su influencia sobre el GLD regional de aves en un área subtropical. Este GLD puede ser explicado a través de la HMI, puesto que los datos soportaron las asunciones de variación lineal y positiva de la riqueza y la abundancia, y pudo descartarse la "hipótesis de muestreo aleatorio". Esto coincide con los demás estudios en los que se ha abordado la HMI en aves, aunque en todos los casos estos han sido realizados en el hemisferio norte (Currie et al., 2004; Chiari, Dinetti, Licciardello, Licitra y Pautasso, 2010; Evans, James y Gaston, 2006; Hurlbert, 2004; Mönkkönen, Forsman y Bokma, 2006). El presente trabajo destaca la importancia del corredor fluvial formado por el río Paraná, en la medida en que representa un sistema con características físicas y biogeográficas especialmente adecuadas para entender las variaciones geográficas de diferentes comunidades de organismos y el papel de los sistemas fluviales como corredores de biodiversidad.
Agradecimientos
Los autores agradecen a Alfredo Berduc (padre), Andrés Bortoluzzi, Gustavo Marino, Eduardo Gonzáles, Andrés Petric, Eduardo Narvaja y Ricardo Ormache su asistencia en el trabajo de campo. A Omar Bejarano, Julián Alonso y Reinaldo Zanello, del Parque Nacional Pre-Delta, su asistencia en la logística de los muestreos en esta área. Al personal del Club Náutico de Paraná y a la Prefectura Naval Argentina, su asistencia en aspectos de navegación. Al Dr. Javier López, su lectura crítica del manuscrito, así como a 2 revisores anónimos, su contribución en la mejora del mismo.











 nueva página del texto (beta)
nueva página del texto (beta)