Introducción
La conservación de las especies depende del conocimiento que tengamos de su biología reproductiva (Martin, 1992). El éxito de anidación se considera un elemento clave en la tasa reproductiva de las aves, y esta es la probabilidad que tiene la nidada de sobrevivir, desde la puesta de los huevos hasta que los volantones dejan el nido (Rotella, Dinsmore y Shaffer, 2004). La estimación del éxito de anidación se utiliza para predecir tendencias poblacionales y permite desarrollar estrategias de manejo para frenar o prevenir extinciones a nivel local (Manolis, Anderson y Cuthbert, 2000).
La depredación es una de las causas principales del fracaso de anidación en aves (Martin, 1995; Ricklefs, 1969), con consecuencias importantes para sus poblaciones. La depredación de nidos se considera la principal causa de pérdida de nidos y en promedio representa el 80% de la pérdida de nidos en una amplia diversidad de especies, localidades y tipos de hábitats (Martin, 1992, 1993; Ricklefs, 1969). La biodiversidad insular es especialmente vulnerable a las especies introducidas, debido a que en estos ambientes hay una alta proporción de especies endémicas que carecen de mecanismos de defensa ante las especies exóticas (Conabio, 2010), las cuales han provocado la extinción de más de 2 tercios de especies insulares de aves endémicas en el mundo (Blondel, 2000).
El archipiélago San Benito se considera un sitio de gran importancia ecológica, ya que es el área de distribución de especies y subespecies endémicas: 9 especies de plantas, 1 de lagartija, 2 de escarabajos y 4 subespecies de aves terrestres, entre las que se encuentra el gorrión sabanero de San Benito (P. sandwichensis sanctorum ) (Junak y Philbrick, 2000). Este gorrión está catalogado por la Nom-059-Semarnat-2010 como amenazado (Semarnat, 2010).
La información que existe referente al gorrión sabanero de San Benito se limita al trabajo realizado por Rodríguez-Malagón et al. (2010), quienes estimaron a través de transectos lineales su abundancia poblacional. En San Benito Este obtuvieron una densidad de 6-39 ind/ha, en San Benito Oeste de 2-8 ind/ha y en San Benito Medio de 3-15 ind/ha. Sus resultados indican que este gorrión es abundante en las 3 islas que conforman el archipiélago, y que es la especie terrestre más representativa.
No se sabe cuáles son los depredadores naturales de los nidos del gorrión sabanero de San Benito, pero entre ellos podrían estar algunas aves marinas como las gaviotas (e. g., Larus occidentalis ) y los cuervos (Corvus corax ) (Wheelwright, Lawler y Weinstein, 1997), ya que las 3 islas que conforman el archipiélago no presentan mamíferos nativos. Desafortunadamente en 2006 se introdujo accidentalmente en San Benito Oeste el ratón de cactus de isla Cedros (Peromyscus eremicus cedrocensis ) (Rodríguez-Malagón et al., 2010). Los efectos que esta introducción pueden tener sobre las poblaciones del gorrión sabanero de San Benito son aún desconocidas. Sin embargo, en otras islas se ha demostrado que los roedores introducidos son depredadores de los nidos de Passeriformes endémicas (Cuthbert y Hilton, 2004; Remeš, Matysioková y Cockburn, 2012; Vanderwerf, 2009).
La biología reproductiva del gorrión sabanero de San Benito no ha sido estudiada, no hay trabajos sobre la tasa de supervivencia de sus nidos y se desconoce el efecto que está teniendo sobre su reproducción el ratón de cactus, recientemente introducido a la isla de San Benito Oeste. Por lo tanto, el objetivo de este trabajo fue describir la biología reproductiva del gorrión sabanero de San Benito, determinar su éxito reproductor y conocer si el ratón está depredando sus nidos. Se espera encontrar que el éxito reproductivo en la isla con ratones será menor que en las otras 2 islas libres de ratones.
Materiales y métodos
Este trabajo se realizó en el archipiélago San Benito, está constituido por 3 pequeñas islas de origen continental, y se encuentra ubicado en el océano Pacífico (28°18'30" N, 115°34'00" O) a 25 km de la costa oeste de la isla Cedros y a 145.5 km al oeste de punta Eugenia, Baja California (Cohen et al., 1963; Fig.1 ). La isla San Benito Oeste (SBO) tiene una superficie de 364 ha, es la más grande de las 3 y está habitada por un pequeño campamento pesquero de la Cooperativa Pescadores Nacionales de Abulón, S. C. de R. L. La isla SBE de 146 ha y SBM de 44 ha, se encuentran deshabitadas (Rodríguez-Malagón et al., 2010).
Figura 1 Localización geográfica del archipiélago San Benito en el noroeste de México (modificado de Samaniego-Herrera, Peralta-García y Aguirre-Muñoz, 2007).
La vegetación predominante es el matorral desértico marítimo. Este tipo de vegetación se caracteriza por presentar arbustos perennes, entre las especies dominantes se encuentran: Agave sebastiana , los arbustos Euphorbia misera , Frankenia palmeri , Lycium brevipes , L. californicum , Malva pacifica , Suaeda moquinii y las cactáceas Mammillaria neopalmeri , Opuntia sp. y Lophocereus schottii (Junak y Philbrik, 2000).
El trabajo de campo se realizó en la temporada reproductiva, de abril a julio del 2011, en las 3 islas que conforman el archipiélago. La localización de nidos se hizo por medio de búsqueda intensiva, mediante la observación de señales conductuales de la especie, como la ubicación de adultos acarreando material para la construcción del nido y alimento para los polluelos, y la revisión directa de lugares donde podían estar los nidos (Ralph et al., 1996). Para cada nido encontrado se anotó la fecha, el código de ubicación, isla, observador, número de nido y sus coordenadas geográficas. Los nidos fueron revisados cada 3 o 4 días para determinar su estado de actividad (con huevos o polluelos), o determinar si habían fracasado (Martin y Geupel, 1993). Para cada nido se determinó la especie de planta utilizada como soporte y se contabilizó el número de huevos y pollos. Para determinar la depredación de nidos se buscaron evidencias de depredación (huevos rotos, cascarones en el nido y pollos muertos). En SBO se colocaron 3 cámaras trampa (Bushnell "Nature View Cam HD") en 3 nidos de gorrión, durante 4 noches en cada nido, para documentar la depredación por ratones. Con los datos obtenidos de cada nido se calculó la tasa de supervivencia y la probabilidad de supervivencia para el periodo de incubación, el periodo de empollamiento y para todo el ciclo del nido, y se determinaron los parámetros reproductivos de viabilidad, fertilidad, éxito de eclosión y éxito de volantón (Erwin y Custer, 1982; Mayfield, 1961, 1975).
La viabilidad se obtuvo al dividir el número de huevos que sobrevivieron el periodo de incubación entre el total de huevos puestos. La fertilidad se calculó al dividir el número total de huevos que eclosionaron entre el número total de huevos que sobrevivieron al periodo de incubación. El éxito de eclosión se obtuvo al dividir el total de huevos que sobrevivieron el periodo de incubación y eclosionaron entre el total de huevos puestos. El éxito de volantón se calculó dividiendo el número total de polluelos que sobrevivieron el periodo de empollamiento entre el total de huevos eclosionados. La comparación entre islas de cada uno de estos parámetros se realizó mediante una prueba de x² con la ayuda del paquete estadístico Statistica versión 7.0 (StatSoft, 2004). Para comparar la supervivencia de nidos por día entre islas, se realizó un análisis de supervivencia de Wilcoxon para el periodo de incubación y empollamiento, con el programa JMP (SAS Institute Inc, 2007).
Al finalizar el periodo reproductivo se colectaron 3 de los nidos exitosos, más conservados y con mejor estructura, y se les tomó medidas como diámetro externo, diámetro interno, altura total, profundidad. Los nidos fueron depositados en la colección de vertebrados de la Universidad Autónoma del Baja California, campus Ensenada, con números de catálogo 1916, 1917 y 1918, con la finalidad de contribuir con la colección y a sus futuros usos.
Resultados
En el archipiélago se encontraron 251 nidos, con un esfuerzo de búsqueda de 465.7 h (Tabla 1). De todos los nidos encontrados se identificaron 3 que fueron reutilizados por segunda vez, en un periodo de 7 a 10 días después de que los nidos fueron exitosos o fallidos. No se pudo determinar si fueron utilizados por las parejas originales o por parejas diferentes.
Tabla 1 Nidos encontrados durante la temporada reproductiva 2011 en el archipiélago San Benito, México. SBO= San Benito oeste, SBM= San Benito medio, SBE= San Benito este.
| Isla | Esfuerzo | Total | Activos | Exitosos | Fallidos | Depredados | Abandonados |
|---|---|---|---|---|---|---|---|
| SBO | 299.5 | 102 | 68 | 67.6% | 32.4% | 77.3% | 22.7% |
| SBM | 103.3 | 87 | 34 | 58.8% | 41.2% | 71.4% | 28.6% |
| SBE | 62.9 | 62 | 27 | 37.0% | 62.9% | 52.9% | 41.1% |
El gorrión utilizó 8 especies de plantas como soporte para sus nidos. Las más utilizadas fueron la cactácea Cilindropuntia sp . (35.2%), el arbusto Lycium californicum (18.2%), el arbusto S. moquinii (14.9%), el arbusto Aphanisma blotoides (12.1%) y en menor grado el arbusto F. palmeri (7.6%), el A. sebastiana (5.2%), el arbusto E. misera (0.8%) y el arbusto Atriplex barclayana (0.4%). También fueron encontrados 2 nidos en madrigueras abandonadas de mérgulo de Xantus (Synthliboramphus hypoleucus ) o petrel de Leach (Oceanodroma leucorhoa ) entre rocas (Fig. 2).

Figura 2 Nido de Passerculus sandwichensis sanctorum dentro de madriguera abandonada de mérgulo de Xantus (Synthliboramphus hypoleucus ) o petrel de Leach (Oceanodroma leucorhoa ). Fotografía: Jesús Gustavo Marina Hipólito.
La temporada reproductiva inició a principios de mayo, considerando que el 3 de mayo se observó al primer gorrión cargando material de construcción de nido. Desde el inicio de la construcción hasta la deposición del primer huevo transcurrieron entre 3 y 9 días (n= 3 nidos). El número de días promedio de incubación fue de 11 días (n= 14 nidos) y el número de días de empollamiento fue de 15 días (n= 24 nidos). Con estos 2 últimos datos se determinó que la longitud del ciclo del nido fue de 26 días. Por último, el promedio estimado para el tamaño de puesta fue de 3 huevos (2.20±0.75).
Basándose en 2 videos obtenidos por las cámaras trampa de 2 nidos, en SBO se demuestra que el ratón de cactus (P. eremicus cedrocensis ) puede llegar a visitar los nidos sin depredarlos. Mediante observaciones directas en SBM, se vio que el cuervo común (C. corax ) destruyó 6 nidos de gorrión y la gaviota occidental (L. occidentalis ) 1 nido, y en SBE se vio que el cuervo común destruyó 1 nido de gorrión.
La tasa de supervivencia diaria para el periodo de incubación fue: SBO= 0.9785 (n= 47), en SBM= 0.9690 (n= 25) y en SBE= 0.9451 (n= 20). La probabilidad de supervivencia para el periodo de incubación en SBO fue de 78.7%, en SBM de 70.7% y en SBE de 53.7%. Mientras que la tasa de supervivencia para el periodo de empollamiento fue: SBO= 0.9775 (n= 59), en SBM= 0.9730 (n= 27) y en SBE= 0.9633 (n= 14). La probabilidad de supervivencia para el periodo de empollamiento en SBO fue de 71.0%, en SBM de 66.4% y en SBE de 57.0%.
La tasa de supervivencia diaria para el ciclo del nido fue: SBO= 0.9779 (n= 68), en SBM= 0.9711 (n= 34) y en SBE= 0.9508 (n= 27). La probabilidad de supervivencia para el ciclo de nido en SBO fue de 56.0%, en SBM de 46.7%, en SBE de 26.9% y para todo el archipiélago fue de 46.5%. Con base en la información obtenida, la viabilidad fue del 86%, la fertilidad del 72%, el éxito de eclosión del 62% y el éxito de volantón del 59% para todo el archipiélago (Tabla 2). De acuerdo con el análisis estadístico, no se encontraron diferencias significativas de las variables reproductivas entre islas (χ2= 0.8586, p > 0.05, gl 2, n= 3). Asimismo, los análisis de supervivencia de Wilcoxon para el periodo de incubación (χ2= 3.2104, gl 2, p > 0.05; Fig. 3) y el periodo de empollamiento (χ2= 0.6628, gl 2, p > 0.05; Fig. 4) demuestran que no hay diferencias estadísticamente significativas entre el número de nidos que quedan por día entre islas.
Tabla 2 Variables reproductivas de la temporada 2011 en el archipiélago San Benito, México.
| Isla | Número de huevos | % viabilidad | % fertilidad | % éxito de eclosión | % éxito de volantón |
|---|---|---|---|---|---|
| SBO | 159 | 89 | 75 | 67 | 61 |
| SBM | 78 | 86 | 72 | 62 | 58 |
| SBE | 47 | 72 | 62 | 45 | 48 |
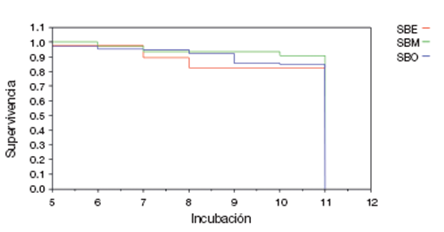
Figura 3 Supervivencia de nidos de Passerculus sandwichensis sanctorum para el periodo de incubación en el archipiélago San Benito.
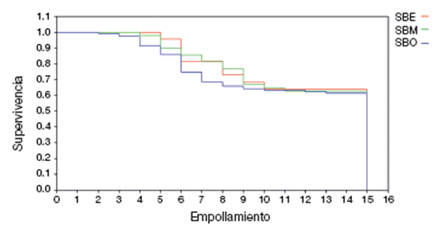
Figura 4 Supervivencia de nidos de Passerculus sandwichensis sanctorum para el periodo de empollamiento en el archipiélago San Benito.
Los nidos del gorrión sabanero de San Benito presentan una estructura en forma de copa y estuvieron construidos, principalmente de ramas, fibras de agave, líquenes y plumas de gaviota. Los 3 nidos colectados tuvieron un diámetro externo promedio de 122.8 mm, un diámetro interno promedio de 64.8 mm, una altura promedio de 73.3 mm y una profundidad promedio de 46.6 mm (Tabla 3). El primer nido colectado fue construido en la bifurcación de una rama de S. moquinii , a una altura de 44 cm del nivel del suelo, la planta de soporte tenía un diámetro promedio de 252 cm, con una altura de 72 cm. El segundo nido fue construido a una altura de 4 cm, cerca de la base del arbusto L. californicum , la planta de soporte tenía un diámetro promedio de 142 cm. El tercer nido fue construido en la bifurcación de una rama de L. californicum , con un diámetro promedio de 196.5 cm y una altura de 74 cm.
Tabla 3 Medidas de los nidos de Passerculus sandwichensis sanctorum, recolectados en el archipiélago San Benito, México (datos en mm) y depositados en Universidad Autónoma del Baja California (UABC) campus Ensenada.
| Número de catálogo | 1916 | 1917 | 1918 |
|---|---|---|---|
| Diámetro externo | 109.3 | 144 | 115 |
| Diámetro interno | 66.4 | 63 | 65 |
| Altura total | 85 | 50 | 85 |
| Profundidad | 40 | 45 | 55 |
Discusión
Este es el primer estudio que documenta la reproducción del gorrión sabanero de San Benito. El número de nidos encontrados en el archipiélago fue elevado, probablemente debido a que la subespecie es abundante en el archipiélago. Las variables reproductivas encontradas en este trabajo son similares a las registradas en la isla de Kent, Quebec y California para Passerculus sandwichensis (Dixon, 1978; Wheelwright y Rising, 2008). Sin embargo, el periodo reproductivo podría ser mayor en el archipiélago San Benito, debido a que cuando se concluyó el trabajo de campo aún había nidos activos.
Los valores de viabilidad indican que 11% (17/159), 19% (15/81) y 28% (13/47) del total de huevos puestos en SBO, SBM y SBE, respectivamente, fueron abandonados o depredados durante el periodo de incubación. No se pudo identificar a los depredadores de los nidos en las islas, pero sí la destrucción de nidos activos por el cuervo común (C. corax ) y la gaviota occidental (L. occidentalis ). No se encontraron evidencias de que el ratón introducido en SBO esté depredando al gorrión sabanero de San Benito. Sin embargo, algunos estudios demuestran que el 70% de la perdida de nidos en Passeriformes se encuentra asociada a la depredación (Stutchbury y Morton, 2001).
Tanto la fertilidad como el éxito de eclosión fueron bajos. La causa de la infertilidad se desconoce, ya que los huevos no fueron analizados. Sin embargo, Schreiber (2002) menciona que los bajos valores de éxito de eclosión de los huevos pueden estar relacionados con la alteración en el desarrollo embrionario, causado por sobre exposición al sol o por falta de calor. El éxito de sobrevivencia de volantones en las 3 islas fue bajo, lo que equivale a un éxito de un volantón por nido en una nidada con 3 huevos. Sin embargo, no se encontró información de éxito reproductivo como viabilidad, fertilidad, éxito de eclosión y éxito de volantón que nos permita comparar nuestro estudio con trabajos previos en distintas localidades.
Rodríguez-Malagón et al. (2010) mencionan que la densidad de gorriones en SBE es mayor (6-39 ind/ha), en comparación con SBO (2-8 ind/ha) y SBM (3-15 ind/ha). Lo que sugiere que en SBE puede haber una mayor competencia por disponibilidad de hábitat reproductivo, lo que podría explicar los bajos valores de viabilidad, fertilidad, éxito de eclosión y éxito de volantón obtenidos en esta isla. Sin embargo, las diferencias entre las variables reproductivas entre islas no fueron estadísticamente significativas.
La tasa de supervivencia de la nidada de P. sandwichensis sanctorum en el archipiélago San Benito fue mayor (46.5%) que lo registrado en otras islas con Passeriformes. Por ejemplo, en el estudio realizado por Cristinacce, Switzel, Cole, Jones y Bell (2009) en la isla Mauritus, se registra una tasa de supervivencia para Foudia rubra de 35%, al igual que lo documentado en el estudio de Sachtleben (2005) en islas Mariana para Zosterops conspicillatus saypani (17.1%); mientras que la tasa de supervivencia de la nidada registrada por Marina-Hipólito (datos no publicados) en isla Cozumel para Melanoptila glabrirostris (45.2%) es parecida a la obtenida en el presente estudio.
De acuerdo con las observaciones en campo los depredadores potenciales del gorrión sabanero de San Benito fueron el cuervo común (C. corax ) y la gaviota occidental (L. occidentalis ). Nuestros resultados no permiten demostrar que este ratón esté afectando al éxito reproductivo del gorrión sabanero de San Benito, ya que no obtuvimos evidencias al respecto. Por otro lado Veal y Caire (1979) mencionan que la dieta de P. eremicus está constituida en mayor parte por semillas de plantas anuales, insectos y vegetación verde, lo que podría indicar que el ratón compite con el gorrión por alimento y no lo depreda. Por tal motivo, es necesario realizar más estudios de éxito reproductivo y comparar entre temporadas reproductivas para conocer la dinámica poblacional de esta subespecie en el transcurso del tiempo.
Agradecimientos
Este proyecto fue financiado por el Grupo de Ecología y Conservación de Islas, A. C. Agradecemos a la Cooperativa Pescadores Nacionales de Abulón, S. C. de R. L. por proporcionarnos una casa dentro del campamento pesquero y por brindarnos el transporte a las islas, al Dr. Miguel Ángel Moreno-García por su asesoría y apoyo brindado durante la realización de los análisis estadísticos y a los revisores por sus comentarios que ayudaron al fortalecimiento del manuscrito.











 text new page (beta)
text new page (beta)


