Introducción
A finales de la década de 1990, algunas investigaciones científicas se enfocaron en determinar la dieta in situ de abulones (Haliotis spp.) de la costa occidental de la península de Baja California, México; esto, con la finalidad de generar información sobre sus hábitos alimentarios. La idea aceptada era que la dieta era a base de macroalgas, tanto para juveniles (Guzmán Del Próo, Serviere-Zaragoza y Siqueiros-Beltrones, 2003; Serviere-Zaragoza, García-Hernández y Siqueiros-Beltrones, 2003) como para adultos de abulón (Mazariegos-Villarreal, Casas-Valdez, Siqueiros-Beltrones, Piñón-Gimate y Serviere-Zaragoza, 2012).
No obstante, también se ha reconocido el papel de las diatomeas (Bacillariophyceae) en la dieta de abulones jóvenes y sus poslarvas (Siqueiros-Beltrones, 2000, 2002; Siqueiros-Beltrones y Voltolina, 2000). Así, se han elaborado inventarios sobre las diatomeas disponibles para el consumo de abulones silvestres, e inventarios de las consumidas de facto por juveniles (Siqueiros-Beltrones, Serviere-Zaragoza y Guzmán-Del Próo, 2005; Siqueiros-Beltrones y Valenzuela-Romero, 2001, 2004; Siqueiros-Beltrones, Valenzuela-Romero, Hernández-Almeida, Argumedo-Hernández y López-Fuerte, 2004). A la fecha se han registrado 300 taxa disponibles en los sustratos del ambiente natural del abulón, principalmente formas epifitas de macroalgas; de estas, 150 taxa han formado parte de los contenidos intestinales de juveniles de Haliotis spp. (Argumedo-Hernández y Siqueiros-Beltrones, 2010).
Algunos estudios demuestran que las macroalgas consumidas por el abulón en la región occidental de la península de Baja California, tales como Macrocystis pyrifera (L.) C. Agardh conforman un sustrato sobre el que proliferan diatomeas (Siqueiros-Beltrones y Argumedo-Hernández, 2005), las cuales podrían proporcionar elementos nutritivos complementarios e indispensables para los abulones adultos. De acuerdo con esto, surgió la hipótesis de que las diatomeas epifitas juegan un papel importante en la dieta de Haliotis spp. (Siqueiros-Beltrones et al., 2004).
Dada la importancia de este recurso, se requiere seguir ampliando la base científica para la adecuada administración de sus poblaciones naturales y en cultivo. Asimismo, acceder eventualmente al contraste de la hipótesis referida. Nuestro objetivo fue conocer cuáles especies de diatomeas son ingeridas por abulones adultos; para ello, se inició la elaboración de una lista representativa de las especies de diatomeas que conforman la dieta de abulones adultos en su ambiente natural.
En este estudio se contrastó la primera hipótesis de que las muestras de diatomeas en contenidos intestinales de adultos de Haliotis fulgens Philippi y H. corrugata Swainson (Fig. 1) estarían conformadas principalmente por formas epifitas; muchas de las cuales serían formas que proliferan sobre láminas de M. pyrifera. Asimismo, con base en observaciones previas (Argumedo-Hernández y Siqueiros-Beltrones, 2010; Siqueiros-Beltrones y Argumedo-Hernández, 2012), se contrastó también la segunda hipótesis de que las diatomeas ingeridas in situ por abulones adultos representarían la taxocenosis de diatomeas disponibles en el medio natural, dado que estos moluscos no muestran selectividad en el consumo de diatomeas.
Materiales y métodos
Se examinaron los contenidos intestinales de 107 especímenes silvestres de abulón: 57 de abulón azul (H. fulgens) y 50 de abulón amarillo (H. corrugata). Los especímenes fueron recolectados en la localidad La Bocana en la costa occidental de Baja California Sur (BCS), México (26°44' N, 113°36' O) (Fig. 2), durante 7 muestreos realizados entre marzo y septiembre de 2012. En cada fecha, mediante buceo autónomo, se recolectaron a una profundidad de 4 a 12 m, de 4 a 10 especímenes de abulones adultos (azul y amarillo) con tallas de 96 a 173 mm, y un promedio general de 130 mm (Tabla 1). Los especímenes de abulón fueron mantenidos 2 a 3 días en los tanques de cultivo de la Cooperativa Progreso de La Bocana, antes de ser transportados en hielo (cubiertos con láminas de M. pyrifera) a los laboratorios del CICIMAR-IPN en La Paz, BCS.

Figura 2 Localización del área de recolecta, La Bocana (recuadro) de especímenes de Haliotis fulgens y H. corrugata en la costa occidental de la península de Baja California.
Tabla 1 Cantidad de especímenes de H. fulgens y H. corrugata recolectados en La Bocana por fecha y tallas promedio.

Una vez disecados los ejemplares, el intestino se separó y se abrió longitudinalmente con un bisturí; una parte del contenido intestinal se recuperó con una pipeta de plástico (5 ml) y se colocó en un frasco de plástico de 250 ml con alcohol al 80%. Los organismos de la misma especie recolectados en una misma fecha representaron una muestra base, esto es, una muestra compuesta de H. fulgens y otra de H. corrugata por muestreo.
Para la identificación de las diatomeas, se tomaron 5 submuestras (réplicas) de cada muestra base y cada una de ellas se colocó en un tubo de ensayo. La materia orgánica de las frústulas fue oxidada, utilizando una mezcla de muestra, alcohol comercial y ácido nítrico en una proporción de 1:3:5 (Siqueiros-Beltrones y Voltolina, 2000), variando las proporciones de alcohol y ácido, de acuerdo con la cantidad de materia orgánica en cada muestra. Después de la oxidación se hicieron lavados repetidos con agua purificada hasta obtener un pH≥ 6. De cada submuestra se elaboró una laminilla permanente doble (con una repetición) usando la resina sintética Pleurax (IR= 1.7).
Las diatomeas fueron identificadas bajo un microscopio con contraste de fases y óptica planapocromática a 1000× y se fotografiaron especímenes representativos para la elaboración de una referencia iconográfica. La identificación se realizó con base en: Cleve-Euler (1968); Desikachary (1988); Foged (1984); Hendey (1964); Hustedt (1959; 1961-1966); López-Fuerte, Siqueiros-Beltrones y Navarro (2010); Peragallo y Peragallo (1908); Round, Crawford y Mann (1990); Schmidt et al. (1874-1959); Siqueiros-Beltrones (2002); Siqueiros-Beltrones y Hernández-Almeida (2006); Siqueiros-Beltrones y Valenzuela-Romero (2001); Siqueiros-Beltrones et al. (2004); Van Heurck (1986); Witkowski, Lange-Bertalot y Metzeltin (2000). Se hicieron actualizaciones nomenclaturales según Algaebase (http://www.algaebase.org/) cuando estuvieron disponibles; en caso contrario se incluyó la referencia utilizada.
Resultados
Se identificaron 151 taxa de diatomeas en contenidos intestinales de ambas especies de abulón, incluyendo especies y variedades (Tabla 2); el número de taxa varió entre 28 y 61 por muestra. Estos valores son altos e indican una elevada riqueza de especies de diatomeas (S) disponibles en el ambiente, tanto a lo largo del periodo de muestreo como por cada fecha de muestreo. Asimismo, dicha riqueza coincide con los hábitos alimentarios no selectivos de abulones, lo que apoya nuestra segunda hipótesis.
Tabla 2 Taxa de diatomeas identificados entre los contenidos intestinales de Haliotis fulgens y H. corrugata recolectados en La Bocana, BCS de marzo a septiembre de 2012.
| Taxa | |
|---|---|
| 1. | Achnanthes brevipes var. intermedium (Kützing) Cleve 1895: 193 |
| 2. | Achnanthes curvirostrum J. Brun |
| 3. | Achnanthes pseudogroenlandica Hendey |
| 4. | Actinocyclus curvatulus Janisch (Fig. 6) |
| 5. | Actinocyclus octonarius Ehrenberg (Fig. 9) |
| 6. | Actinoptychus adriaticus Grunow (Fig. 25) |
| 7. | Actinoptychus aster J. Brun |
| 8. | Actinoptychus minutus Greville (Fig. 28) |
| 9. | Actinoptychus senarius (Ehrenberg) Ehrenberg (Fig. 8) |
| 10. | Amphicocconeis disculoides (Hustedt) M. De Stefano et D. Marino |
| 11. | Amphora angusta Gregory (Fig. 114) |
| 12. | Amphora bigibba Grunow |
| 13. | Amphora bigibba var. interrupta (Grunow) Cleve (Fig. 110) |
| 14. | Amphora holsaticoides T. Naguma et H. Kobayasi |
| 15. | Amphora sp. 1 |
| 16. | Amphora laevis Gregory |
| 17. | Amphora pediculus (Kützing) A. Grunow ex A. Schmidt |
| 18. | Amphora pusio var. parvula Floegel. Peragallo (1908), p. 199 |
| 19. | Amphora proteus var. contigua Cleve (Figs. 104, 109 ). Peragallo (1908), p. 201 |
| 20. | Amphora wisei (M. M. Salah) R. Simonsen |
| 21. | Asteromphalus heptactis (Brébisson) Ralfs |
| 22. | Aulacodiscus affinis Grunow |
| 23. | Bacillaria socialis (Gregory) Ralfs |
| 24. | Berkeleya rutilans (Trentepohl ex Roth) Grunow |
| 25. | Biddulphia biddulphiana (J. E. Smith) Boyer |
| 26. | Biddulphia tuomeyii (Bailey) Roper |
| 27. | Caloneis linearis (Grunow) Boyer |
| 28. | Campylodiscus simulans Gregory (Fig. 7) |
| 29. | Campylopyxis garkeana (Grunow) L. Medlin (Figs. 79- 80 y 86 ) |
| 30. | Catacombas gallionii (Bory de Sait Vincent) D. M. Williams et Round (fig. 81) |
| 31. | Cocconeiopsis patrickae (Hustedt) Witkowski. Witkowski, Lange-Bertalot y Metzeltin (2000), p. 174 |
| 32. | Cocconeis cf. nitens H. Edsbagge |
| 33. | Cocconeis convexa M. H. Giffen |
| 34. | Cocconeis costata var. hexagona Grunow (Fig. 54) |
| 35. | Cocconeis diminuta Pantocsek |
| 36. | Cocconeis dirupta W. Gregory (Figs. 49, 52 , 57 y 65 ) |
| 37. | Cocconeis dirupta var. flexella (Janish et Rabenhorst) Cleve |
| 38. | Cocconeis diruptoides Hustedt |
| 39. | Cocconeis distans W. Gregory |
| 40. | Cocconeis guttata Hustedt et Aleem (Figs. 53 y 55 ) |
| 41. | Cocconeis pediculus Ehrenberg |
| 42. | Cocconeis peltoides Hustedt |
| 43. | Cocconeis placentula var. euglypta (Ehrenberg) Grunow (Fig. 48) |
| 44. | Cocconeis pseudomarginata Gregory |
| 45. | Cocconeis scutellum Ehrenberg (Figs. 44- 45 , 51 , 56 , 61 - 62 y 64 ) |
| 46. | Cocconeis speciosa Gregory (Figs. 46- 47 ) |
| 47. | Cocconeis sublittoralis Hendey (Figs. 59 y 69 ) |
| 48. | Cocconeis vetusta A. W. F. Schmidt (Fig. 58) |
| 49. | Coscinodiscus radiatus Ehrenberg |
| 50. | Cyclotella litoralis Lange et Syvertsen (Fig. 11) |
| 51. | CymbelloNitzschia sp. |
| 52. | Delphineis surirella var. australis (P. Petit) P. M. Tsarenko |
| 53. | Diplomenora cocconeiformis (A. Schmidt) K. L. Blazé |
| 54. | Diploneis crabro (Eherenberg) Eherenberg |
| 55. | Diploneis didyma (Ehrenberg) Eherenberg |
| 56. | Diploneis papula (A. W. F. Schmidt) Cleve (Fig. 63) |
| 57. | Diploneis smithii (Brébisson) Cleve |
| 58. | Diploneis vacillans var. renitens (A. Schmidt) Cleve |
| 59. | Ehrenbergia granulosa (Grunow) Witkowski (Figs. 16-17 y 26-27 ) |
| 60. | Eunotograma sp. 1 |
| 61. | Fallacia litoricola (Hustedt) D. G. Mann |
| 62. | Fogedia finmarchica (Cleve et Grunow) Witkowski, D. Metzeltin et Lange-Bertalot |
| 63. | Fragilariopsis pseudonana (Hasle) Hasle |
| 64. | Gephyria media Arnott in C. Johnston |
| 65. | Gomphonemopsis psudoexigua (R. Simonsen) L. K. Medlin (Figs. 85 y 88 ) |
| 66. | Gomphoseptatum aestuari (Cleve) L. K. Medlin (Figs. 72-75) |
| 67. | Grammatophora hammulifera Kützing (Figs. 33 y 40 ) |
| 68. | Grammatophora gibberula Kützing (Figs. 31, 32 , 35 , 39 y 41 - 43 ) |
| 69. | Grammatophora marina (Lyngbye) Kützing (Figs. 30 y 36-37 ) |
| 70. | Grammatophora oceanica Ehrenberg (Figs. 29, 34 y 38 ) |
| 71. | Gyrosigma tenuissimum var. genuinum A. Cleve. Cleve (1968), p. 14. |
| 72. | Halamphora acutiuscula (Kützing) Levkov |
| 73. | Halamphora coffeaeformis (C. Agardh) Levkov (Figs. 102, 107 y 108 ) |
| 74. | Halamphora costata (W. Smith) Levkov |
| 75. | Halamphora hybrida (Grunow) Levkov (Fig. 113) |
| 76. | Hantzschia virgata (Roper) Grunow (Figs. 111-112) |
| 77. | Hyalodiscus scoticus (Kützing) Grunow (Fig. 18) |
| 78. | Hyalosira delicatula var. gibbosa (Østrup) Witkowski |
| 79. | Hyalosira sp. 1 |
| 80. | Licmophora abbreviata C. Agardh (Fig. 71) |
| 81. | Licmophora communis (Heibeg) Grunow (Fig. 83) |
| 82. | e Licmophora flabellata (Greville) C. Agardh |
| 83. | Licmophora gracilis (Ehrenberg) Grunow (fig. 84) |
| 84. | Licmophora remulus Grunow |
| 85. | Luticola mutica (Kützing) D. G. Mann |
| 86. | Mastogloia acutiuscula Grunow |
| 87. | Mastogloia crucicula var. alternans Zanon (Fig. 98) |
| 88. | Mastogloia pusilla var. subcapitata Hustedt |
| 89. | Melosira nummuloides C. Agardh (Fig. 14) |
| 90. | Melosira polaris Grunow (Fig. 20). Schmidt, Schmidt, Fricke, Heiden, Muller y Hustedt. (1874-1959). Lam. 179, f. 8 |
| 91. | Navicula cf. agnita Hustedt (Fig. 93) |
| 92. | Navicula cf. britannica Hustedt. Hendey (1964), p. 195 |
| 93. | Navicula caribaea Cleve. López-Fuerte, Siqueiros-Beltrones y Navarro (2010), p. 38 |
| 94. | Navicula cincta (Ehrenberg) Ralfs in Pritchard (Figs. 3 y 101 ) |
| 95. | Navicula cluthensis Gregory* (Figs. 97 y 99 ) |
| 96. | Navicula digito-radiata (Gregory) Ralfs |
| 97. | Navicula directa (W. Smith) Ralfs in Pritchard (Figs. 94, 96 ) |
| 98. | Navicula diversistriata Hustedt (Fig. 100). Hustedt (1955), p. 28 |
| 99. | Navicula cf. diserta Hustedt |
| 100. | Navicula johanrossii Giffen* (Fig. 105) |
| 101. | Navicula longa Gregory Ralfs ex Pritchard (Fig. 95) |
| 102. | Navicula cf. normalis Hustedt |
| 103. | Navicula parva (Ehrenberg) Ralfs (Fig. 103) |
| 104. | Navicula pavillardi Hustedt |
| 105. | Navicula pennata A. Schmidt (Fig. 92) |
| 106. | Navicula aff. phylleptosoma Lange-Bertalot |
| 107. | Navicula cf. rusticensis Lobban |
| 108. | Navicula sp. 1 |
| 109. | Nitzschia bicapitata Cleve |
| 110. | Nitzschia capitellata Hustedt |
| 111. | Nitzschia constricta W. Gregory (Fig. 115). Peragallo (1908), p. 270 |
| 112. | Nitzschia dissipata var. genuina Kützing. Cleve-Euler (1952), p. 71 |
| 113. | Nitzschia distans W. Gregory |
| 114. | Nitzschia frustulum (Kützing) Grunow |
| 115. | Nitzschia frustulum var. perminutum Grunow |
| 116. | Nitzschia gracilis Hantzsch |
| 117. | Nitzschia laevis Hustedt. Hustedt (1955), p. 46 |
| 118. | Nitzschia lanceola Grunow |
| 119. | Nitzschia lorenziana var. subtilis Grunow |
| 120. | Nitzschia scalpelliformis (Grunow) Grunow. Foged (1984), p. 79 |
| 121. | Odontella aurita (Lyngbye) C. Agardh |
| 122. | Opephora pacifica (Grunow) Petit (Fig. 76) |
| 123. | Paralia sulcata f. radiata Grunow (Figs. 10 y 15 ) |
| 124. | Parlibellus cruciculoides (C. Brockman) Witkowski, Lange- Bertalot et Metzeltin |
| 125. | Parlibellus hamulifer (Grunow) E. J. Cox (Figs. 5 y 106 ) |
| 126. | Planothidium hauckianum (Grunow) Round et Bukhtyarova |
| 127. | Pleurosigma sp. 1 |
| 128. | Pleurosigma formosum W. Smith |
| 129. | Pleurosigma intermedium W. Smith |
| 130. | Podosira stelliger (Bailey) D. G. Mann (Fig. 19) |
| 131. | Proschkinia complanata (Grunow) A. D. G. Mann |
| 132. | Psammodyction sp. 1 |
| 133. | Psammodiscus nitidus (W. Gregory) Round et D. G. Mann (Fig. 12 y 22 ) |
| 134. | Pseudo-Nitzschia sicula (Castracane) H. Peragallo |
| 135. | Rhabdonema arcuatum (Lyngbye) Kützing |
| 136. | Rhaphoneis surirella var. ceylanica (Cleve) Foged (Fig. 24) |
| 137. | Rhoicosphenia adolphii M. Schmidt, Schmidt, Fricke, Heiden, Muller y Hustedt (Fig. 77- 78 ) |
| 138. | Rhoicosphenia genuflexa (Kützing) L. K. Medlin (Figs. 68 y 69 - 70 ) |
| 139. | Rhoikoneis sp. 1 |
| 140. | Rhopalodia pacifica Krammer |
| 141. | Seminavis strigosa (Hustedt) Danieledis et Economou-Amilli |
| 142. | Stauronella sp.1 |
| 143. | Stephanodiscus cf. niagarae Ehrenberg (Fig. 13) |
| 144. | Striatella unipunctata (Lyngbye) C. Agardh (Figs. 82 y 91 ) |
| 145. | Tabularia investiens (W. Smith) D. M. Williams et Round (Fig. 90) |
| 146. | Tabularia fasciculata (C. Agardh) D. M. Williams et Round (Figs. 87 y 89 ) |
| 147. | Thalassionema nitzschioides (Grunow) Mereschkowsky |
| 148. | Toxarium undulatum Bailey |
| 149. | Trachyneis aspera (Ehrenberg) Cleve |
| 150. | Trigonium alternans (Bailey) A. Mann (Fig. 21) |
| 151. | Tryblionella hungarica (Grunow) Frenguelli |
* Nuevos registros para el Pacífico mexicano.

Figuras 3-5 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 3: cúmulo de Navicula cincta entre los contenidos intestinales de Haliotis spp., después de la oxidación con ácido nítrico (1000×); 4: misma, pero a 400×; 5: fragmento de una cadena de Parlibellus hamulifer. Barra= 10 µm.
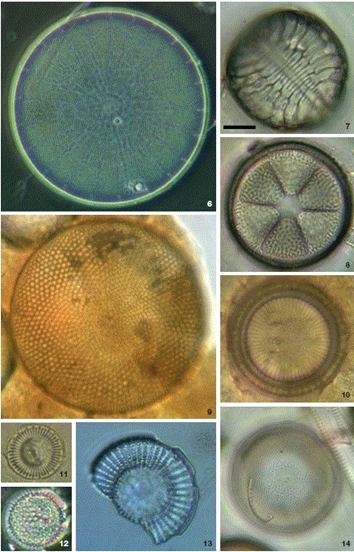
Figuras 6-14 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 6: Actinocyclus curvatulus; 7: Campylodiscus simulans; 8: Actinoptychus senarius; 9: Actinocyclus octonarius; 10: Paralia sulcata f. radiata; 11: Cyclotella litoralis; 12: Psammodiscus nitidus; 13: Stephanodiscus cf. niagarae; 14: Melosira numuloides. Barra= 10 µm.

Figuras 15-28 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 15: Paralia sulcata f. radiata; 16, 17,26, 27: Ehrenbergia granulosa; 18: Hyalodiscus scoticus; 19: Podosira stelliger; 20: Melosira polaris; 21: Trigonium alternans; 22: Psammodiscus nitidus; 23: Delphineis surirella var. australis; 24: Raphoneis surirella var. ceylanica; 25: Actinoptychus adriaticus; 28: Actinoptychus minutus. Barra= 10 µm.

Figuras 29-43 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 29, 34, 38: Grammatophora oceanica; 30, 36-37: Grammatophora marina; 31-32, 35, 39, 41-43: Grammatophora gibberula; 33, 40: Grammatophora hamulifera. Barra= 10 µm.

Figuras 44-67 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 44-45, 51, 56, 61-62, 64: Cocconeis scutellum; 46-47: Cocconeis speciosa; 48: Cocconeis placentula var. euglypta; 49, 52, 57, 65: Cocconeis dirupta; 53, 55: Cocconeis guttata; 54: Cocconeis costata var. hexagona; 58: Cocconeis vetusta; 59-60: Cocconeis sublitoralis; 63: Diploneis papula. Barra= 10 µm.

Figuras 68-91 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 68-70: Rhoicosphenia genuflexa; 71: Licmophora abreviata; 72-75: Gomphoseptatum aestuari; 76: Opephora pacifica; 77, 78: Rhoicosphenia adolphii; 79-80, 86: Campylopyxis garkeana; 81: Catacombas gaillioni; 82, 91: Striatella unipunctata; 83: Licmophora communis; 84: Licmophora gracilis; 85, 88: Gomphonemopsis pseudexigua; 87, 89: Tabularia tabulata var. fasciculata; 90: T. investiens. Barra= 10 µm.

Figuras 92-115 Diatomeas en contenidos intestinales de Haliotis spp. en la costa oeste de la península de Baja California. 92: Navicula pennata; 93: Navicula cf. agnita; 94, 96: Navicula directa; 95: Navicula longa; 97, 99: Navicula cluthensis; 98: Mastogloia crucicula var. alternans; 100: Navicula diversistriata; 101: Navicula cincta; 102, 107-108: Halamphora coffeaeformis; 103: Navicula parva; 104, 109: Amphora proteus var. contigua; 105: Navicula johanrossi; 106: Parlibellus hammulifer; 110: Amphora bigibba var. interrupta; 111-112: Hantzschia virgata; 113: Halamphora hybrida; 114: Amphora angusta; 115: Nitzschia constricta. Barra= 10 µm.
Entre los taxa identificados se encuentran diatomeas formadoras de colonias (sensu Round et al., 1990), algunas de las cuales se conservaron formando grumos o cadenas en las preparaciones permanentes (Figs. 3 - 5 ), habiendo resistido el paso por el tracto digestivo de los abulones y a la oxidación de las muestras con ácido nítrico.
Se identificaron 61 géneros, de los cuales los mejor representados fueron: Cocconeis con 17 especies, Navicula (15), Amphora (15) y Nitzschia (11), mismos que comprendieron cerca del 45% de la florística. Nueve taxa no pudieron ser identificados a nivel de especie, pero se sumaron a la riqueza específica. Por otra parte, se encontraron 2 nuevos registros para la región: Navicula johanrossi Giffen y N. cluthensis Gregory, las cuales fueron poco frecuentes. En la referencia iconográfica (Figs. 4- 115 ) se representan 64 taxa (42.38%). El resto de los taxa de diatomeas que aparecen en la lista han sido registradas como epifitas de macroalgas comunes en el ambiente rocoso en donde habitan Haliotis spp. del noroeste mexicano, lo que apoya nuestra primera hipótesis.
Discusión
Esta es la primera lista florística de diatomeas que son consumidas in situ por abulones adultos de cualquier especie, derivada de un estudio ex profeso. Las diatomeas en los contenidos intestinales de los abulones adultos representaron menos de la mitad del número de especies y variedades de diatomeas registradas (S= 322) como alimento potencial de Haliotis spp. en la región (Siqueiros-Beltrones et al., 2004). Sin embargo, independientemente de la riqueza de especies de diatomeas disponibles para consumo por abulones en su ambiente natural, el número de especies registrados (151) es muy similar al contabilizado previamente en contenidos intestinales de juveniles de Haliotis spp. (150) (Siqueiros-Beltrones et al., 2005; Siqueiros-Beltrones et al., 2004).
La riqueza de especies (S) ha sido frecuentemente utilizada como medida de diversidad (Magurran, 1988) y la registrada aquí refleja una alta diversidad. Asimismo, la (S) observada corresponde con valores altos de diversidad (H' promedio ≥ 3.5, calculados para las mismas muestras (Siqueiros-Beltrones, datos no publicados). De acuerdo con los hábitos alimentarios no selectivos de los abulones (Argumedo-Hernández y Siqueiros-Beltrones, 2010; Siqueiros-Beltrones y Argumedo-Hernández, 2012), esta descripción se aplica a la taxocenosis de diatomeas que se hallan disponibles para consumo por abulones en el ambiente natural (rocoso) tanto en La Bocana como en otras localidades costeras de la península de Baja California.
La diferencia entre la riqueza de especies en contenidos intestinales de abulón adulto y lo registrado como disponible en su ambiente (322 taxa) se explicaría porque la última cifra abarca estudios relacionados con la distribución de Haliotis spp., los cuales comprenden registros de 2 localidades (bahía Magdalena y bahía Tortugas). Entre estas se aprecian variaciones en la composición y riqueza de macroalgas (Serviere-Zaragoza et al., 2003), que al proporcionar mayor heterogeneidad de sustratos, garantizan una mayor riqueza de especies y diferente composición de especies de diatomeas epifitas (Hernández-Almeida y Siqueiros-Beltrones, 2012).
Por otra parte, en un estudio sobre diatomeas epifitas de M. pyrifera (considerado el alimento primordial de estas especies de abulón) se registraron 171 especies y variedades de diatomeas epifitas (Siqueiros-Beltrones y Argumedo-Hernández, 2005), cifra mayor que la encontrada en contenidos intestinales de Haliotis spp.; algunos de estos taxa se conservaron formando cúmulos monoespecíficos semejantes a grumos registrados en estudios previos (Siqueiros-Beltrones et al., 2005). La presencia de grumos de diatomeas (de una o varias especies) en contenidos intestinales de abulones parece una característica frecuente; es ocasionada quizá por el raspado de la rádula de los abulones sobre las macroalgas. Su permanencia, a pesar de los procesos digestivos de los herbívoros y de la oxidación de las muestras, sugiere que no son aprovechados adecuadamente por abulones.
Por otra parte, estaría implícito en la primera hipótesis que taxa conspicuos registrados previamente en láminas de M. pyrifera, como Climacosphenia moniligera Ehrenberg y Cocconeis costata var. pacifica (Grunow) Grunow (Siqueiros-Beltrones, Serviere-Zaragoza y Argumedo-Hernández, 2001, 2002; Siqueiros-Beltrones et al., 2004) aparecerían entre las muestras examinadas. El primer taxón alcanza los 1000 micrómetros de longitud y forma colonias asociadas a otras colonias tubulares de Navicula sp.; mientras que el segundo cubría áreas extensas de las láminas. No obstante, ninguno de estos taxa se observó entre los contenidos intestinales. Así, aunque ciertos taxa podrían presentarse solo temporalmente y de manera conspicua sobre M. pyrifera, la segunda parte de nuestra primera hipótesis queda refutada por ahora.
El tiempo que permanecieron los especímenes de abulón en tanques de cultivo antes de ser transportados y disecados pudo alterar la dieta natural; sin embargo, dada la escases del recurso en la región NO de México y las restricciones para su captura comercial o para su investigación, el haber procesado el contenido intestinal proveniente de más de 100 ejemplares proporciona una base inductiva confiable que confirma estas observaciones sobre ecología trófica de abulones y refuerzan la hipótesis acerca de la importancia de las diatomeas en la dieta de los abulones adultos.
Consecuentemente, se enfatiza que la dieta de abulones adultos (Haliotis spp.) no debe estar minimizada al consumo de una o varias especies de macrofitas, sino que implica una amplia riqueza de especies, principalmente de diatomeas y otros taxa que las utilizan como sustrato. De esta manera, los resultados de nuestro estudio constituyen una primera referencia florística ex profeso que puede ser utilizada de manera confiable en el manejo del recurso abulón en cuanto a las estrategias para su cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)



