Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.85 n.3 México Sep. 2014
https://doi.org/10.7550/rmb.36603
Ecología
Termorregulación de dos poblaciones de lagartijas simpátridas: Sceloporus lineolateralis y Sceloporus poinsettii (Squamata: Phrynosomatidae) en Durango, México
Thermoregulation in two sympatric populations of lizard: Sceloporus lineolateralis and Sceloporus poinsettii (Squamata: Phrynosomatidae) in Durango, Mexico
Rafael A. Lara-Reséndiz1,4, Aníbal H. Díaz de la Vega-Pérez5,6*, Víctor H. Jiménez-Arcos1,3, Héctor Gadsden2 y Fausto R. Méndez-De la Cruz1
1 Laboratorio de Herpetología, Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México. Apartado postal 70515, 04510, México, D. F., México.
2 Instituto de Ecología, A. C., Miguel de Cervantes Núm. 120. Complejo Industrial Chihuahua, 31109 Chihuahua, Chihuahua, México.
3 Posgrado en Ciencias Biológicas, Instituto de Biología, Laboratorio de Herpetología, Universidad Nacional Autónoma de México. Apartado postal 70515, 04510 México, D. F. México.
4 Department of Ecology and Evolutionary Biology, Earth and Marine Sciences Building A316, University of California. Santa Cruz, CA. 95064, USA.
5 Centro de Investigación en Ciencias Biológicas. Km 10.5 autopista Texmelucan-Tlaxcala, 90122 Ixtacuixtla, Tlaxcala, México.
6 Consejo Nacional de Ciencia y Tecnología. Av. Insurgentes Sur 1582, Col. Crédito constructor, Delegación Benito Juárez C.P. 03940, México, D.F. * anibal.helios@gmail.com
Recibido: 26 marzo 2013
Aceptado: 01 febrero 2014
Resumen
La temperatura ambiental es un factor importante en la regulación de la actividad y los procesos fisiológicos de los organismos ectotermos. Las especies que habitan en simpatría están expuestas a un nicho térmico similar y aquellas especies que están cercanamente emparentadas pueden presentar requerimientos térmicos similares. En el presente trabajo, se estudió la ecología térmica de 2 poblaciones de lagartijas vivíparas, Sceloporus lineolateralis y S. poinsettii, pertenecientes a los grupos Sceloporus torquatus y Sceloporus poinsettii, las cuales habitan en simpatría en la localidad de Peñón Blanco, Durango, México. Las temperaturas corporales de las lagartijas activas en campo y el intervalo de temperaturas corporales preferidas fueron similares entre ambas especies; sin embargo, S. poinsettii registró mayor eficiencia y precisión en la termorregulación, debido a que el intervalo de temperaturas preferidas de esta especie es más amplio. Finalmente, las preferencias térmicas fueron análogas a las registradas anteriormente para los grupos S. torquatus, S. poinsettii y para otras especies del género.
Palabras clave: calidad térmica, eficiencia termorreguladora, matorral desértico, sceloporinos, simpatría, nicho térmico.
Abstract
Environmental temperature is an important factor that regulates activity and physiological processes of ectotherms. Because sympatric species are exposed to similar thermal niche conditions, closely related species could present similar thermal requirements. This similarity may generate interspecific competition for optimal thermal space. The thermal ecology of the sympatric viviparous lizards Sceloporus lineolateralis and S. poinsettii (Sceloporus torquatus and Sceloporus poinsettii groups, respectively) were studied in natural populations in Peñón Blanco, Durango, Mexico. We found that active body temperatures and selected body temperatures were similar among species. However, S. poinsettii exhibited higher efficiency and accuracy of thermoregulation because the preferred thermal range of this species was wider. Finally their thermal preferences are analogous to those previously reported for the both groups and the genus.
Key words: thermal quality, thermoregulatory efficiency, desert scrub, sceloporines, sympatry, thermal niche.
Introducción
La termorregulación es clave en la biología de organismos ectotermos, como los reptiles, debido a la influencia en su ecología, fisiología, evolución y comportamiento (Avery, 1979; Huey, 1982; Angilletta, 2009). Las estrategias de termorregulación les permiten mantener en campo una temperatura corporal de actividad (Tc) relativamente alta y constante dentro o cerca de su intervalo térmico óptimo, lo que determina sus actividades biológicas diarias (Bartholomew, 1982). Por lo tanto, la Tc de una especie ectotérmica está influenciada generalmente por la tigmotermia, es decir, la absorción de calor a través del sustrato (Ts; i. e., conducción) y por la heliotermia o absorción de calor por medio del aire o directamente del sol (Ta; i. e., convección) (Huey y Slatkin, 1976). Además, la oferta térmica del hábitat influye en la eficiencia termorreguladora debido a la estrecha relación entre la temperatura operativa ambiental (To) y el intervalo de temperaturas seleccionadas o "preferidas" del organismo (Tsel; Hertz et al., 1993).
Las especies simpátridas presentan factores ecológicos similares y pueden coexistir mediante su distribución seleccionando diferentes tipos de presas, empleando diferentes conductas de forrajeo y ocupando diferentes microhábitats o estrategias para termorregular (Avery, 1979; Pianka y Vitt, 2003; García-De la Peña et al., 2007). Sin embargo, las especies cercanamente emparentadas tienden a mantener preferencias térmicas similares, incluso habitando diferentes ambientes (Bogert, 1949; Rocha y Vrcibradic, 1996; Guzmán-Juárez, 2011; Rivera-Hernández, 2012; Torres-Durán, 2012; Díaz de la Vega-Pérez et al., 2013; Grigg y Buckley, 2013). Por lo tanto, los requerimientos térmicos de cada especie y la variabilidad térmica ambiental son determinantes en el balance energético de costos y beneficios para la termorregulación (Huey y Slatkin, 1976; Blouin-Demers y Nadeau, 2005; Vickers et al., 2011).
Desde la década de los 70, se ha presentado un interés por estudiar la Tc de reptiles en situación de simpatría (Huey y Pianka, 1977; Dial, 1978; Hertz, 1979; Rocha y Vrcibradic, 1996; Vitt y Avila-Pires, 1998; Luiselli y Akani, 2002; Singh et al., 2002; Dias y Rocha, 2004; Lelievre et al., 2010a, 2010b). Sin embargo, los trabajos que evalúan la calidad térmica del hábitat y la termorregulación de especies simpátridas han sido escasos (e. g., Hertz, 1992; Hertz et al., 1993; Grbac y Bauwens, 2001; Sartorius et al., 2002). Por lo tanto, en este trabajo se analizó la ecología térmica de 2 poblaciones de lagartijas pertenecientes a los grupos hermanos Sceloporus torquatus y S. poinsettii; Sceloporus lineolateralis y Sceloporus poinsettii, respectivamente; que habitan en simpatría (Wiens et al., 2010). Por un lado, se examinó la relación entre la Ta y Ts con la Tc de ambas especies; además, se analizó la variabilidad de la Tsel de las lagartijas en laboratorio y la To ambiental disponible en el sitio de simpatría. Finalmente, se cuantificó y comparó la precisión y eficiencia en la termorregulación de las lagartijas y la calidad térmica del hábitat.
Materiales y métodos
Área y especies de estudio. La zona de estudio se ubica en la localidad de La Concha a 11 km de la cabecera municipal de Peñón Blanco, Durango, México (24°43' N, 104°06' O y 1 770 m de elevación). El tipo de vegetación es matorral desértico micrófilo con asociación de pastizal natural y nopaleras. Presenta un clima seco semicálido, temperatura y precipitación media anual entre 18 y 22° C y de 300 a 400 mm, respectivamente (Rzedowski, 1981; Inegi, 2004). La zona de estudio se caracteriza por presentar paredones de roca, rocas expuestas y grietas que sirven como sitios de asoleo y refugio para las lagartijas.
Sceloporus lineolateralis Smith, 1936 y Sceloporus poinsettii Baird y Girard, 1852 coexisten en el área de estudio y pertenecen a los grupos vivíparos Sceloporus torquatus y Sceloporus poinsettii (Wiens et al., 2010). Ambas especies ocupan las grietas de paredes en cañones rocosos y albarradas (Gadsden et al., 2005; Lemos-Espinal y Smith, 2009). Además, S. lineolateralis tiene una distribución microendémica localizada únicamente en el noreste de Durango y límites con Coahuila y Zacatecas (Baker et al., 1981; Castañeda et al., 2007), sin embargo, S. poinsettii se distribuye desde el sur de Estados Unidos hasta el norte de México (Martínez-Méndez y Méndez-De la Cruz, 2007). Sceloporus lineolateralis puede llegar a medir hasta 73 mm de longitud hocico-cloaca (LHC) (Smith, 1936), mientras que S. poinsettii puede alcanzar los 105 mm (Gadsden et al., 2005). Ambas especies presentan un collar oscuro en la nuca, exhiben características morfológicas similares (i. e., folidosis) y conductas asociadas a hábitos saxícolas.
Trabajo de campo. Se realizaron 5 días de muestreo efectivo y consecutivo en el área de estudio durante abril de 2007, desde las 10:00 a 19:00 h bajo condiciones climáticas similares. Se capturaron 18 individuos adultos de S. lineolateralis (> 60 mm; Smith, 1936) y 17 ejemplares adultos de S. poinsettii (> 77 mm; Gadsden et al., 2005) con una caña de pescar con nudo corredizo o manualmente. Inmediatamente después de la captura se registró la Tc, Ta, a 2 cm del sustrato con el bulbo a la sombra, y Ts, con el bulbo directo sobre el sustrato, donde fueron observadas las lagartijas por primera vez. Los registros fueron realizados con un termómetro cloacal de lectura rápida Miller-Weber: precisión 0.2° C y con un intervalo de 0-50° C. Posteriormente, todas las lagartijas se mantuvieron en cajas de plástico con sustrato y rocas a temperatura de 30° C en el día y 20° C en la noche con 10 h de luz por 14 h de oscuridad. Durante el cautiverio se mantuvieron con el menor estrés posible, fueron restringidas de alimento y se hidrataron (Crowley, 1987; Robert y Thompson, 2000).
Simultáneamente, se registró la temperatura operativa de 10 modelos nulos de cobre huecos de acuerdo con Bakken (1992) y Hertz et al. (1993) durante el periodo de actividad observado en campo para ambas especies (10:45-19:00 h). Cada modelo midió 100 mm de largo por 15 mm de ancho y no se aplicó esmalte alguno. El tamaño de los modelos está basado en la LHC entre ambas especies, tallas de adultos, los cuales son adecuados para determinar la energía térmica disponible en el ambiente según calibraciones para el grupo Sceloporus torquatus y S. poinsettii. Héctor Gadsden y Gamaliel Castañeda (datos no publicados) encontraron una correlación significativa de la Tc de S. poinsettii y la To del modelo de cobre durante la calibración (r= 0.91; n= 49; p< 0.0001). Se asumió que los modelos se equilibran a la misma temperatura dentro del hábitat, debido a que la disponibilidad térmica es similar (Hertz, 1992). Los modelos nulos se conectaron individualmente a Dataloggers (HOBO® Pro v2) para el registro y monitoreo de las temperaturas operativas (i. e., To; Dzialowski, 2005). De acuerdo con observaciones realizadas durante la recolección de las lagartijas, así como registros bibliográficos previos (Bogert, 1949; Smith y Ballinger, 1994; Gadsden et al., 2005), los modelos se colocaron únicamente en 2 ambientes donde se observó y registró la actividad de ambas especies. Cinco modelos se colocaron en paredones de roca, donde predomina S. lineolateralis, 5 modelos en bardas de construcciones, donde es más abundante S. poinsetti, y en condiciones de sol y sombra completos en ambos casos.
Trabajo de laboratorio. El día posterior a su captura, las lagartijas en cautiverio fueron colocadas en un gradiente térmico permitiendo que se aclimataran durante 2 h antes de tomar el primer registro de Tsel para su utilización eficiente (Fernández e Ibargüengoytía, 2012). El gradiente térmico fue diseñado de acuerdo con estudios de termorregulación en sceloporinos (Andrews et al., 1999; Lara-Reséndiz y Díaz de la Vega-Pérez, 2013). Éste consistió en una caja de madera de 150 x 100 x 80 cm (largo, ancho y alto) dividido en 10 carriles con barreras de aislamiento para evitar influencia conductual, como cortejo o agresión entre las lagartijas. La caja se mantuvo dentro de un habitación con temperatura controlada de 20° C por medio de aire acondicionado, el cual proporcionó la temperatura fría en uno de sus extremos, además, sobre la mitad de la caja se colocaron 3 lámparas de 100 watts a 80 cm de altura y en el extremo opuesto se colocaron 5 lámparas de 100 watts a 50 cm de altura para proveer un gradiente térmico lineal entre 20 y 50° C en todos los carriles. Se colocaron rocas y arena como sustrato dentro del gradiente para minimizar el estrés de los organismos y proveerles condiciones adecuadas de percha (Díaz de la Vega-Pérez et al., 2013). Únicamente se utilizaron las temperaturas seleccionadas en gradiente térmico de 12 ejemplares de S. lineolateralis y 16 de S. poinsettii, ya que las lagartijas que presentaron signos de estrés: inmovilidad, boquear o respiración excesiva; fueron descartadas del análisis de laboratorio. Las lagartijas permanecieron en el gradiente desde las 08:00 hasta las 19:00 h, abarcando su periodo de actividad observado en campo. Se registró la Tsel con el termómetro de lectura rápida cada 3 h desde las 10:00 hasta las 19:00 h. El intervalo de temperaturas seleccionadas en laboratorio (i. e., Tsel) fue calculado para cada ejemplar con los cuartiles centrales (25 y 75%, i. e., Tsel inferior y Tsel superior) utilizando todas las temperaturas registradas en el
gradiente.
Índices de termorregulación. Se calcularon los índices de termorregulación por medio del protocolo propuesto por Hertz et al. (1993), mediante el empleo de 3 índices biofísicos: calidad térmica del hábitat (de), precisión (db) y eficiencia (E) en la termorregulación. Dichos índices fueron calculados con 3 variables térmicas: la distribución de Tc en campo durante el periodo de actividad, la Tsel en el gradiente térmico y la distribución de To de los ambientes ocupados por los organismos. Si la Tc o To< Tsel, entonces db= Tsel inferior- Tc y de= Tsel inferior- To, respectivamente, y si la Tc o To> Tsel entonces db= Tc-Tsel superior y de= To- Tsel superior, respectivamente; considerándose sólo valores absolutos. Cuando la Tc o To estuvo dentro del intervalo Tsel se consideró db y de igual a 0. Valores altos de db y de indican precisión y calidad térmica baja, un valor igual o cercano a 0 significa que los organismos son altamente precisos y representa ambientes térmicamente óptimos. Posteriormente, se calculó el índice E con la
ecuación:

un valor de E cercano a 1 refiere termorregulación activa, mientras que igual o cercano a 0 indica termorregulación pasiva (ver detalles en Hertz et al., 1993). Se calculó el índice E para las poblaciones de cada especie, suponiendo que la Tc no varía de un día a otro, ni entre estaciones o sexo. Se determinó la desviación estándar de E para cada especie por medio de bootstrap utilizando el db promedio para cada especie y 1 000 simulaciones de de. Se compararon los valores de E entre S. lineolateralis y S. poinsettii utilizando estimaciones de bootstrap, es decir, para determinar si una especie tuvo el mayor valor de E en 95% de confianza o más en comparación con otra especie, se consideró que ambas especies tienen valores de E significativamente diferentes (Hertz et al., 1993). El procedimiento de remuestreo se realizó en R (R Development Core Team, 2013).
Finalmente, se identificó la proporción de Tc y To que fue superior, inferior o que permaneció dentro del intervalo de Tsel para ambas lagartijas en porcentaje.
Análisis estadístico. Para el análisis estadístico de temperaturas corporales en campo se excluyeron las lagartijas que requirieron más de 45 segundos en su captura y únicamente se tomó la temperatura a las lagartijas que estuvieron activas. Por otro lado, la Tc y Tsel no fueron analizadas por sexo debido al tamaño de muestra y se asumieron temperaturas poblacionales para ambas lagartijas. Para determinar diferencias entre la Tc y entre los límites del intervalo de Tsel se realizaron comparaciones con una prueba de t de Student, cuando los datos cumplieron los requerimientos para el uso de pruebas paramétricas —normalidad y homogeneidad de varianzas; prueba de Kolmogorov-Smirnov y Levene, respectivamente— y cuando no cumplieron los supuestos, se utilizó la prueba no paramétrica de Mann Whitney. Por otro lado, se realizó un ANDEVA de 2 factores con medidas repetidas —factor 1= tomas de temperatura [4] y factor 2= número de especies [2]— para encontrar posibles diferencias en la Tsel entre las especies y entre las tomas de temperatura dentro del gradiente térmico. También se realizó un análisis de regresión múltiple para determinar la relación de la Tc con la Ta y la Ts y se compararon las pendientes para cada especie. El análisis de los datos y la elaboración de gráficas se realizaron con los programas JMP v10 (SAS Institute Inc., Cary, NC, 1989-2007) y SigmaPlot v10 (Systat Software, San José, CA). Las pruebas se realizaron con una α= 0.05 y las medias son expresadas ± 2 errores estándar, entre paréntesis el tamaño de muestra (n) y el intervalo general correspondiente.
Resultados
Las 2 especies de lagartijas fueron poco abundantes en esta zona de simpatría, además, la ocupación de paredones de roca y grietas dificultó su captura. Por lo tanto, únicamente se recolectaron 18 ejemplares adultos de S. lineolateralis (7 machos; 11 hembras), los cuales estuvieron activos desde las 11:05 hasta 18:15 h, cuando se observó el primer y último individuo; dicha actividad comenzó cuando se registró una To de 31.7±1.78° C y cesó por debajo de 29.1±0.47° C durante los días de muestreo. También se recolectaron 17 individuos adultos de S. poinsettii (11 machos; 6 hembras), quienes estuvieron activos desde las 10:45 hasta 19:00 h; su actividad comenzó cuando se registró una To de 26.1±2.02° C y cesó por debajo de 28.0±0.55° C según los días de muestreo. Todos los ejemplares recolectados estuvieron asociados a paredones de roca y bardas de construcciones. Sceloporus lineolateralis fue más abundante en paredones de roca (94%) que en bardas de construcciones (6%), mientras que S. poinsettii utiliza por igual ambos microhábitat (53 y 47%, respectivamente).
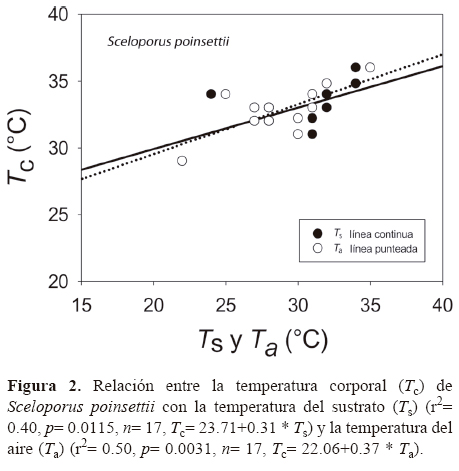
Los resultados de Tc e intervalo de Tsel de ambas especies, así como las Ta, Ts y To se muestran en el Cuadro 1 y en las figuras 1 y 2. Para S. lineolateralis, el análisis de regresión múltiple mostró una relación positiva de la Tc con la Ts y Ta (F2, 15= 8.415, P= 0.004, R= 0.529, ecuación en la figura 1); sin embargo, el análisis de las pendientes indicó que la Ta ejerce un efecto significativamente mayor en la Tc que la Ts (βTa= 0.316, βTs= 0.170, p< 0.05). Por otro lado, para S. poinsettii el análisis indicó que la Tc está relacionada con la Ta y Ts (F2, 12= 7.359, p= 0.008, R= 0.551, ecuación en la figura 2), pero las pendientes indicaron que la Ta presenta un efecto significativamente mayor en la Tc que la Ts (βTa= 0.836, βTs= 0.444, p< 0.05). Por lo tanto, la comparación de las figuras 1 y 2 muestran que ambas especies dependen principalmente de la temperatura del aire. No se observaron diferencias significativas entre las Tc de ambas especies (Mann-Whitney, U1= 119, p= 0.257). Con respecto a la Tsel en gradiente térmico, la prueba de ANDEVA con medidas repetidas confirmó un efecto significativo dentro de las 4 tomas de Tsel (λ de Wilks= 0.175; F3, 30= 14.137; p= 0.001), es decir, ambas especies seleccionaron temperaturas diferentes a lo largo de su periodo de actividad. Sin embargo, no hubo diferencias significativas entre la Tsel de ambas especies (λ de Wilks= 0.779; F1, 30= 3.127; p= 0.105). Las diferencias encontradas entre los registros de temperatura a lo largo de la prueba en el gradiente térmico no fueron determinadas por las especies (λ de Wilks= 0. 526; F3, 30= 2.702; p= 0.108). Dentro del intervalo de Tsel, el límite inferior de la Tsel no presentó diferencias significativas (t= 0.592, g. l.= 26, p= 0.559), sin embargo, el límite superior fue estadísticamente diferente (t= 2.315, g. l.= 26, p= 0.029). Por lo tanto, ambas especies presentan requerimientos térmicos similares tanto en campo como en laboratorio, a pesar de que S. poinsettii presentó un intervalo de Tsel más amplio.

El índice de precisión de la termorregulación (db) fue significativamente diferente entre ambas especies (Mann-Whitney, U1= 1063, p< 0.001), lo cual indica que S. poinsettii es más precisa para termorregular que S. lineolateralis (Cuadro 1). En cuanto al índice de calidad térmica del hábitat (de) no fue significativamente diferente entre ambas especies (U1= 111451.5, p= 0.092). Por otro lado, el índice de eficiencia de la termorregulación (E) para S. lineolateralis fue de 0.83±0.032 con un intervalo de confianza entre 0.7652 y 0.8887, mientras que para S. poinsettii fue de 0.93±0.006 con un intervalo de confianza de 0.9018 a 0.927, en ambos casos con un nivel de confianza del 95%. Sceloporus lineolateralis y S. poinsettii tuvieron valores de E significativamente diferentes con base en las estimaciones generadas con boostraps, ya que S. poinsettii tuvo valores mayores de E en al menos 95% de las comparaciones.
Finalmente, la proporción de Tc y To que fue superior, inferior y dentro del intervalo de Tsel se resume en la figura 3. Los principales resultados destacan que S. poinsettii mantuvo un porcentaje alto de Tc dentro del intervalo Tsel (66.7%), determinando su precisión térmica alta; sin embargo, S. lineolateralis mantuvo un porcentaje bajo (16.7%) de Tc dentro de Tsel. El porcentaje mayor de To ambiental se registró por encima de las Tsel para ambas especies (S. poinsettii 55.6% y S. lineolateralis
62.4%).


Discusión
La familia Phrynosomatidae presenta una Tc promedio de 35.2±0.20° C (Sinervo et al., 2010 y su material de apoyo en línea), en el presente trabajo se determinó que las temperaturas corporales obtenidas en el campo y laboratorio de S. lineolateralis y S. poinsettii fueron ligeramente más bajas en comparación. Sin embargo, los lacertilios de esta familia pueden presentar temperaturas entre 26.8 y 41.5° C, lo cual concuerda con los valores registrados para estas especies de lacertilios (S. lineolateralis= 31.6 y 30.3; S. poinsettii= 32.7 y 31.2° C; Tc y Tsel, respectivamente). Asimismo, las temperaturas corporales de actividad registradas en campo y laboratorio se encuentran dentro de los intervalos registrados previamente para otras especies de los grupos vivíparos Sceloporus torquatus y S. poinsettii (Cuadro 2). En este sentido, existen varios trabajos que abordan la pregunta si la biología térmica de lagartijas es lábil o estática (e. g., Andrews, 1998; Angilletta et al., 2002; Angilletta, 2009; Moreno-Azócar et al., 2012) y se ha propuesto que la Tc tiende a conservarse entre las especies cercanas filogenéticamente, inclusive a nivel de género, a pesar de presentar diferencias morfológicas evidentes, como el tamaño, la coloración, modo de reproducción o habitar en condiciones ambientales diferentes (Bogert, 1949; Adolph, 1990; Andrews, 1998; Díaz de la Vega-Pérez et al., 2013; Grigg y Buckley, 2013). Esto fue consistente con nuestros resultados, ya que las temperaturas corporales registradas en campo y laboratorio fueron similares entre ambas especies, a pesar de pertenecer a grupos diferentes (Fig. 3).
Los phrynosomátidos son organismos típicamente helio y tigmotérmos que obtienen el calor con el contacto en el suelo y del aire (Lemos-Espinal et al., 1997; Gadsden y Estrada-Rodríguez, 2007; Jiménez-Arcos, 2008). Lo cual concuerda con los resultados del presente trabajo, ya que las Tc de S. poinsettii y S. lineolateralis mostraron una fuerte correlación con la Ta y Ts, por lo tanto, pueden ser consideradas especies con estrategias de termorregulación basadas en la conducción y convección (Huey y Slatkin, 1976). Según el modelo de costo y beneficio en la termorregulación de Huey y Slatkin (1976), las especies con pendientes similares suponen estrategias análogas de termorregulación, debido a que utilizan hábitats similares y están expuestos a la misma oferta térmica. Sin embargo, los resultados de este análisis se limitan únicamente al empleo de la Ts o Ta como las variables principales que influyen en la Tc de las lagartijas. De acuerdo con este enfoque, el método de Hertz et al. (1993) proporcionó mayor información sobre las diferencias entre la termorregulación de ambas especies, por medio de las preferencias térmicas determinadas y la disponibilidad de temperaturas ambientales (Tc, Tsel y To), así como por los índices de termorregulación calculados (db, de y E).
Ambas especies mantuvieron conductas de termorregulación similares en campo bajo condiciones de simpatría (i. e., periodo de actividad y Tc similar), a pesar de esto es importante mencionar que se observaron diferencias notables en sus hábitos, lo que puede ser debido a que forman parte de 2 clados distintos (Wiens et al., 2010). La diferencia principal entre ambas especies fue que S. lineolateralis habitó en paredones inclinados con pequeñas grietas; sin embargo, S. poinsettii ocupó rocas bajas con presencia de grietas significativamente más anchas (Héctor Gadsden datos no publicados; Gadsden et al., 2005). Por lo tanto, no hay solapamiento de los sitios de percha o asoleo entre las especies, lo cual genera la posibilidad de que ambas especies coexistan en simpatría. Otra diferencia fisiológica registrada fue que S. poinsettii mantuvo un intervalo más amplio de Tsel que S. lineolateralis, lo cual le confiere restricciones menores para habitar sitios con calidades térmicas diferentes. El intervalo de temperatura seleccionada corresponde al intervalo adecuado para realizar sus actividades y procesos fisiológicos como alimentación, digestión, reproducción, crecimiento, socialización, escape de depredadores, etc. (Bartholomew, 1982; Huey, 1982). Por lo tanto, la capacidad de S. poinsettii de ser un organismo euritermo, en comparación con S. lineolateralis, repercute en la manera en que ambas lagartijas afrontan el mismo ambiente térmico. Además, este rasgo le permite a la población de S. poinsettii mantenerse activa durante mayor tiempo que S. lineolateralis. Por otro lado, y aunque ambas especies resultaron ser altamente precisas y eficientes en la termorregulación, S. poinsettii fue más precisa y eficiente que S. lineolateralis debido a la amplitud de su Tsel principalmente y a la selección diferencial de sitios de percha. Estos resultados sugieren que S. poinsettii puede mantener su Tc en niveles óptimos con menor esfuerzo termorregulador que S. lineolateralis.
El solapamiento de microhábitat en simpatría fue bajo, considerando que los sitios de percha tienden a ser estructuralmente diferentes en ambas especies, incluso dentro del mismo sitio. Estudios previos de eficiencia en la termorregulación y uso de hábitat de especies simpátridas sugieren una diferenciación en los micrositios ocupados, por ejemplo, Sartorius et al. (2002) observaron que Uta stansburiana selecciona micrositios con áreas abiertas y Sceloporus arenicolus ocupa aquellos que contienen mayor cubierta vegetal, este patrón espacial representó efectos diferenciales en la precisión y eficiencia térmica de ambas especies. Además, los resultados encontrados en el presente trabajo concuerdan con los obtenidos por Grbac y Bauwens (2001), quienes sugieren que las especies de lagartijas cercanas filogenéticamente, Podarcis melisellensis y Podarcis muralis (pertenecientes a clados distintos como en el presente estudio, ver Poulakakis et al., 2005), mantienen Tc similares, pero difieren en la precisión térmica debido a las diferencias en la Tsel y a las diferencias en el periodo de actividad. Análogamente, Hertz (1992) encontró que la Tc de Anolis cooki fue más alta que su especie hermana, Anolis cristatellus, sin embargo, a lo largo del ciclo anual la Tc de ambas especies se sobreponen ampliamente. El autor supone que la Tc de ambas especies podría ser igual si ambos Anolis percharan en los mismos micrositios. En estos Anolis la competencia por los sitios de percha en condiciones de simpatría es alta, además, A. cooki tiene requerimientos térmicos específicos y distribución restringida, lo cual podría situarla bajo condiciones de riesgo de extinción (Hertz, 1992). En el caso de las especies de la familia Phrynosomatidae se ha determinado que presentan temperaturas corporales similares, por lo que son consideradas especies térmicamente conservativas (Andrews, 1998). Asímismo, los resultados de este trabajo apoyan el conservadurismo de requerimientos térmicos para el género Sceloporus, basándose en especies de grupos diferentes, pero que habitan en simpatría.
Los patrones de distribución geográfica de los ectotermos están limitados por múltiples factores ambientales y/o evolutivos, pero la temperatura es particularmente importante debido a la sensibilidad térmica y su dependencia, sobre todo en especies estenotermas (Huey y Slatkin, 1976). El intervalo de temperaturas óptimas para realizar adecuadamente sus procesos fisiológicos podría restringir su distribución (Ruibal y Philibosian, 1970; Huey y Stevenson, 1979). Es evidente que este patrón podría influenciar el área de distribución de ambas especies, por un lado S. lineolateralis se distribuye únicamente en la parte limítrofe entre Durango, Zacatecas y Coahuila (Baker et al., 1981; Castañeda et al., 2007; Martínez-Méndez y Méndez-De la Cruz, 2007), mientras que S. poinsettii es una especie ampliamente distribuida en México y Estados Unidos (Gadsden et al., 2005; Martínez-Méndez y Méndez-De la Cruz, 2007). La capacidad que tienen los organismos euritermos, como es el caso de S. poinsettii, puede conferir mayor tolerancia a la variabilidad térmica en una escala espacio-temporal; mientras que un organismo estenotermo, similar a S. lineolateralis, puede estar restringido a ambientes térmicamente homogéneos. Por lo tanto, las especies que presentan requerimientos térmicos estrictos o con intervalos estrechos podrían ser susceptibles a cambios ambientales a corto plazo, debido a la limitante fisiológica que presentan. Finalmente, es importante considerar que el tamaño de muestra de ambas especies y el periodo de estudio podrían limitar nuestras observaciones, sin embargo, nuestros resultados se robustecen fuertemente con los trabajos para las especies en simpatría mencionados previamente. Además, los resultados obtenidos expanden el trabajo previo sobre la termorregulación de especies de grupos diferentes en condiciones de simpatría y proporcionan un marco de referencia para futuros estudios.
Agradecimientos
Este trabajo fue parte del proyecto financiado por PAPIIT/DGAPA (IN224208 e IN215011). Agradecemos al Posgrado en Ciencias Biológicas de la UNAM y las becas otorgadas por Conacyt a Rafael A. Lara-Reséndiz (165066), Aníbal H. Díaz de la Vega-Pérez (165067) y Víctor H. Jiménez-Arcos (290541). A Gamaliel Castañeda por su apoyo en campo con las calibraciones de los modelos. A UCMEXUS-Conacyt por el apoyo financiero de una beca posdoctoral otorgada a R. A. Lara-Reséndiz (FE-14-2) para completar el artículo. También agradecemos a Christopher Blair, Guillermo Woolrich-Piña y a un revisor anónimo por sus valiosas sugerencias para mejorar el escrito. Finalmente, agradecemos a Norberto Martínez-Méndez por la identificación de los ejemplares.
Literatura citada
Adolph, S. C. 1990. Influence of behavioral thermoregulation on microhabitat use by two Sceloporus lizards. Ecology 71:315-327. [ Links ]
Andrews, R. M. 1998. Geographic variation in field body temperature of Sceloporus lizards. Journal of Thermal Biology 23:329-334. [ Links ]
Andrews, R. M., F. R. Méndez-De la Cruz, M. Villagrán-Santa Cruz y F. Rodríguez-Romero. 1999. Field and selected body temperatures of the lizards Sceloporus aeneus and Sceloporus bicanthalis. Journal of Herpetology 33:93-100. [ Links ]
Angilletta, M. J. 2009. Thermal adaptation: a theoretical and empirical synthesis. Oxford University Press, New York. 285 p. [ Links ]
Angilletta, M. J., P. H. Niewiarowski y C. A. Navas. 2002. The evolution of thermal physiology in ectotherms. Journal of Thermal Biology 27:249-268. [ Links ]
Avery, R. A. 1979. Lizards-a study in thermoregulation. University Park Press, Baltimore. 56 p. [ Links ]
Baker, R. H., M. W. Baker, J. D. Johnson y R. G. Webb. 1981. New records of mammals and reptiles from northwestern Zacatecas, Mexico. The Southwestern Naturalist 25:568-569. [ Links ]
Bakken, G. S. 1992. Measurement and application of operative and standard operative temperatures in ecology. American Zoologist 32:194-216. [ Links ]
Bartholomew, G. A. 1982. Physiological control of temperature. In Biology of the reptilia, C. Gans y F. H. Pough (eds.). Academic Press, New York. p. 167-211. [ Links ]
Beuchat, C. A. 1986. Reproductive influences on the thermoregulatory behavior of a live-bearing lizard. Copeia 1986:971-979. [ Links ]
Blouin-Demers, G. y P. Nadeau. 2005. The cost-benefit model of thermoregulation does not predict lizard thermoregulatory behavior. Ecology 86:560-566. [ Links ]
Bogert, C. M. 1949. Thermoregulation and eccritic body temperatures in Mexican lizards of the genus Sceloporus. Anales del Instituto de Biología Universidad Nacional Autónoma de México 20:415-426. [ Links ]
Castañeda, G., M. C. García-De la Peña, U. O. García-Vázquez y J. Estrada-Arellano. 2007. Geographic distribution Sceloporus lineolateralis. Herpetological Review 38:484. [ Links ]
Crowley, S. R. 1987. The effect of desiccation upon the preferred body temperature and activity level of the lizard S. undulatus. Copeia 1987:25-32. [ Links ]
Dial, B. E. 1978. The thermal ecology of two sympatric nocturnal Coleonyx (Lacertilia: Gekkonidae). Herpetologica 32:194-201. [ Links ]
Dias, E. J. R. y C. F. D. Rocha. 2004. Thermal ecology, activity patterns, and microhabitat use by two sympatric whiptail lizards (Cnemidophorus abaetensis and Cnemidophorus ocellifer) from northeastern Brazil. Journal of Herpetology 38:586-588. [ Links ]
Díaz de la Vega-Pérez, A. H., V. H. Jiménez-Arcos, N. L. Manríquez-Morán y F. R. Méndez-De la Cruz. 2013. Conservatism of thermal preferences between parthenogenetic Aspidoscelis cozumela complex (Squamata: Teiidae) and their parental species. Herpetological Journal 23:93-104. [ Links ]
Dzialowski, E. M. 2005. Use of operative temperature and standard operative temperature models in thermal biology. Journal of Thermal Biology 30:317-334. [ Links ]
Fernández, J. B. y N. R. Ibargüengoytía. 2012. Does acclimation at higher temperatures affect the locomotor performance of one of the southernmost reptiles in the world? Acta Herpetologica 7:281-296. [ Links ]
Gadsden, H. y J. L. Estrada-Rodríguez. 2007. Ecology of the spiny lizard Sceloporus jarrovii in the central Chihuahuan desert. The Southwestern Naturalist 52:600-608. [ Links ]
Gadsden, H., F. J. Rodríguez-Romero, F. R. Méndez-De la Cruz y R. Gil-Martínez. 2005. Ciclo reproductor de Sceloporus poinsetti Baird y Girard 1852 (Squamata: Phrynosomatidae) en el centro del desierto chihuahuense, México. Acta Zoológica Mexicana (nueva serie) 21:93-107. [ Links ]
García-De la Peña, C., H. Gadsden, A. J. Contreras-Balderas y G. Castañeda. 2007. Daily and seasonal activity patterns of a lizard guild in the sand dunes of Viesca, Coahuila, Mexico. Revista Mexicana de Biodiversidad 78:141-147. [ Links ]
Garrick, L. D. 1974. Reproductive influences on behavioral thermoregulation in the lizard, Sceloporus cyanogenys. Physiology y Behavior 12:85-91. [ Links ]
Grbac, I. y D. Bauwens. 2001. Constraints on temperature regulation in two sympatric Podarcis lizards during autumn. Copeia 2001:178-186. [ Links ]
Grigg, J. W. y L. B. Buckley. 2013. Conservatism of lizard thermal tolerances and body temperatures across evolutionary history and geography. Biology Letters 9:20121056. [ Links ]
Guzmán-Juárez, M. Z. 2011. Eficiencia termorreguladora estacional de Uta stansburiana (Sauria: Phrynosomatidae) en dunas semiestabilizadas de "El Vergel", Samalayuca, Chihuahua. Tesis, Universidad Autónoma de Ciudad Juárez. Ciudad Juárez, Chihuahua. 37 p. [ Links ]
Hertz, P. E. 1979. Comparative thermal biology of sympatric grass Anoles (Anolis semilineatus and A. olssoni) in lowland Hispaniola (Reptilia, Lacertilia, Iguanidae). Journal of Herpetology 13:329-333. [ Links ]
Hertz, P. E. 1992. Evaluating thermal resource partitioning by sympatric lizards Anolis cooki and A. cristatellus: a field-test using null hypotheses. Oecologia 90:127-136. [ Links ]
Hertz, P. E., R. B. Huey y R. D. Stevenson. 1993. Evaluating temperature regulation by field-active ectotherms: the fallacy of the inappropiate question. The American Naturalist 142:796-818. [ Links ]
Huey, R. B. 1982. Temperature, physiology, and ecology of reptiles. In Biology of the reptilia, C. Gans y F. H. Pough (eds.). Academic Press, New York p. 25-91. [ Links ]
Huey, R. B. y E. R. Pianka. 1977. Patterns of niche overlap among broadly sympatric versus narrowly sympatric Kalahari lizards (Scincidae: Mabuya). Ecology 58:119-128. [ Links ]
Huey, R. B. y M. Slatkin. 1976. Cost and benefits of lizard thermoregulation. Quarterly Review of Biology 51:363-384. [ Links ]
Huey, R. B. y R. D. Stevenson. 1979. Integrating thermal physiology and ecology of ectotherms: a discussion of approaches. American Zoologist 19:357-366. [ Links ]
Inegi (Instituto Nacional de Estadística y Geografía). 2004. Anuario estadístico del estado de Durango. 70 p. [ Links ]
Jiménez-Arcos, V. H. 2008. Biología térmica de la lagartija vivípara Sceloporus torquatus (Squamata: Phrynosomatidae) del Pedregal de San Ángel, México, D. F. México. Tesis, Universidad Nacional Autónoma de México. México, D. F. 31 p. [ Links ]
Lara-Reséndiz, R. A. y A. H. Díaz de la Vega-Pérez. 2013. Sceloporus grammicus (Mesquite Lizard). Selected body temperature. Herpetological Review 44:328-329. [ Links ]
Lelievre, H., G. Blouin-Demers, X. Bonnet y O. Lourdais. 2010a. Thermal benefits of artificial shelters in snakes: A radiotelemetric study of two sympatric colubrids. Journal of Thermal Biology 35:324-331. [ Links ]
Lelievre, H., M. Le Henanff, G. Blouin-Demers, G. Naulleau y O. Lourdais. 2010b. Thermal strategies and energetics in two sympatric colubrid snakes with contrasted exposure. Journal of Comparative Physiology B-Biochemical Systemic and Environmental Physiology 180:415-425. [ Links ]
Lemos-Espinal, J. A., R. E. Ballinger, S. S. Sarabia y G. R. Smith. 1997. Thermal ecology of the lizard Sceloporus mucronatus mucronatus in sierra del Ajusco, Mexico. The Southwestern Naturalist 42:344-347. [ Links ]
Lemos-Espinal, J. A. y H. M. Smith. 2009. Anfibios y reptiles del estado de Chihuahua, México/Amphibians and reptiles of the state of Chihuahua, Mexico. Universidad Nacional Autónoma de México; Comisión para el Conocimiento y Uso de la Biodiversidad, México, D. F. 613 p. [ Links ]
López-Alcaide, S. 2005. Biología térmica y desempeño locomotor en tres especies de lacertilios vivíparos del grupo Sceloporus torquatus. Tesis, Universidad Nacional Autónoma de México. México, D. F. 71 p. [ Links ]
Luiselli, L. y G. C. Akani. 2002. Is thermoregulation really unimportant for tropical reptiles? Comparative study of four sympatric snake species from Africa. Acta Oecologica-International Journal of Ecology 23:59-68. [ Links ]
Martínez-Méndez, N. y F. R. Méndez-De la Cruz. 2007. Molecular phylogeny of the Sceloporus torquatus species-group (Squamata: Phrynosomatidae). Zootaxa 1609:53-68. [ Links ]
Middendorf, G. A. y C. A. Simon. 1988. Thermoregulation in the iguanid lizard Sceloporus jarrovi: the influences of age, time, and light conditions on body temperature and thermoregulatory behaviors. The Southwestern Naturalist 33:347-356. [ Links ]
Moreno-Azócar, D. L., B. Vanhooydonck, M. F. Bonino, M. Gabriela Perotti, C. S. Abdala, J. A. Schulte y F. B. Cruz. 2012. Chasing the Patagonian sun: comparative thermal biology of Liolaemus lizards. Oecologia 171:773-788. [ Links ]
Pianka, E. R. y L. J. Vitt. 2003. Lizards: windows to the evolution of diversity. University of California Press, Berkeley. 333 p. [ Links ]
Poulakakis, N., P. Lymberakis, E. Valakos, P. Pafilis, E. Zouros y M. Mylonas. 2005. Phylogeography of Balkan wall lizard (Podarcis taurica) and its relatives inferred from mitochondrial DNA sequences. Molecular Ecology 14:2433-2443. [ Links ]
R Development Core Team. 2013, R: a Language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.Rproject.org; última consulta: 17.V.2013. [ Links ]
Rivera-Hernández, L. A. 2012. Termorregulación y modelación de nicho ecológico espacial de Uta stansburiana stejnegeri en las dunas de Samalayuca, Chihuahua. Tesis, Universidad Autónoma de Ciudad Juárez. Ciudad Juárez. 52 p. [ Links ]
Robert, K. A. y M. B. Thompson. 2000. Influence of feeding on the metabolic rate of the lizard, Eulamprus tympanum. Copeia 2000:851-855. [ Links ]
Rocha, C. F. D. y D. Vrcibradic. 1996. Thermal ecology of two sympatric skinks (Mabuya macrorhyncha and Mabuya agilis) in a Brazilian restinga habitat. Australian Journal of Ecology 21:110-113. [ Links ]
Ruibal, R. y R. Philibosian. 1970. Eurythermy and niche expansion in lizards. Copeia 1970:645-653. [ Links ]
Rzedowski, J. 1981. Vegetación de México. Limusa, México, D. F. 342 p. [ Links ]
Sartorius, S. S., J. P. S. Do Amaral, R. D. Durtsche, C. M. Deen y W. I. Lutterschmidt. 2002. Thermoregulatory accuracy, precision, and effectiveness in two sand-dwelling lizards under mild environmental conditions. Canadian Journal of Zoology 80:1966-1976. [ Links ]
Schuler, M. S., M. W. Sears y M. J. Angilletta. 2011. Food consumption does not affect the preferred body temperature of Yarrow's spiny lizard (Sceloporus jarrovi). Journal of Thermal Biology 36:112-115. [ Links ]
Sinervo, B., F. Méndez-De la Cruz, D. B. Miles, B. Heulin, E. Bastiaans, M. Villagrán-Santa Cruz, R. Lara-Reséndiz, N. Martínez-Méndez, M. L. Calderón-Espinosa, R. N. Meza-Lázaro, H. Gadsden, L. J. Avila, M. Morando, I. J. De la Riva, P. V. Sepulveda, C. F. D. Rocha, N. Ibargüengoytía, C. A. Puntriano, M. Massot, V. Lepetz, T. A. Oksanen, D. G. Chapple, A. M. Bauer, W. R. Branch, J. Clobert y J. W. Sites. 2010. Erosion of lizard diversity by climate change and altered thermal niches. Science 328:894-899. [ Links ]
Sinervo, B., D. B. Miles, N. Martínez-Méndez, R. Lara-Reséndiz y F. R. Méndez-De la Cruz. 2011. Response to comment on "Erosion of lizard diversity by climate change and altered thermal niches". Science 332:537. [ Links ]
Singh, S., A. K. Smyth y S. P. Blomberg. 2002. Thermal ecology and structural habitat use of two sympatric lizards (Carlia vivax and Lygisaurus foliorum) in subtropical Australia. Austral Ecology 27:616-623. [ Links ]
Smith, G. R. y R. E. Ballinger. 1994. Temperature relationships in the high-altitude viviparous lizard, Sceloporus jarrovi. American Midland Naturalist 131:181-189. [ Links ]
Smith, H. M. 1936. Descriptions of new species of lizards of the genus Sceloporus from Mexico. Proceedings of the Biological Society of Washington 49:87-96. [ Links ]
Torres-Durán, A. 2012. Ecología térmica estacional de la lagartija de costado manchado (Uta stansburiana) en Samalayuca, Chihuahua, México. Tesis, Universidad Autónoma de Ciudad Juárez. Ciudad Juárez. 46 p. [ Links ]
Vickers, M., C. Manicom y L. Schwarzkopf. 2011. Extending the cost-benefit model of thermoregulation: high-temperature environments. The American Naturalist 177:452-461. [ Links ]
Vitt, L. J. y T. C. S. Avila-Pires. 1998. Ecology of two sympatric species of Neusticurus (Sauria : Gymnophthalmidae) in the Western Amazon of Brazil. Copeia 1998:570-582. [ Links ]
Wiens, J. J., C. A. Kuczynski, S. Arif y T. W. Reeder. 2010. Phylogenetic relationships of phrynosomatid lizards based on nuclear and mitochondrial data, and a revised phylogeny for Sceloporus. Molecular Phylogenetics and Evolution 54:150-161. [ Links ]














