Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.85 no.1 México mar. 2014
https://doi.org/10.7550/rmb.38706
Ecología
Estructura y composición en dos comunidades arbóreas de la selva baja caducifolia y mediana subcaducifolia en Campeche, México
Structure and composition of two tree communities of tropical deciduous and subdeciduous forests in Campeche, Mexico
Benito Dzib-Castillo1*, Cristina Chanatásig-Vaca1 y Noel A. González-Valdivia2
1 Departamento de Ciencias de la Sustentabilidad, El Colegio de la Frontera Sur, Unidad Campeche. Libramiento carretero km 1.5, Av. Rancho, Polígono 2-A, Parque Industrial de Lerma, 24500 Campeche, Campeche, México. * bernadzib@yahoo.es.
2 Facultad de Ciencias Agropecuarias, Universidad del Norte de Nicaragua. Frente al km 148 carretera Panamericana Norte, Estelí, Nicaragua.
Recibido: 23 mayo 2013
Aceptado: 18 octubre 2013
Resumen
Se describe y compara la estructura y composición de la selva baja caducifolia (SBC) y la selva mediana subcaducifolia (SMS) en 2 localidades en Campeche, México. Se comparó la riqueza de especies, abundancia y distribución de los árboles, así como sus características dasométricas dentro de cada comunidad vegetal; establecimos 27 parcelas de 500 m2 y se contaron todos los individuos ≥ 3 cm de diámetro a la altura del pecho. Se registraron 3 162 individuos, pertenecientes a 83 especies y 30 familias. La riqueza de especies de árboles fue mayor en el SMS; 70 especies en 30 familias, 13 especies promedio por parcela; que en SBC fueron 50 especies en 21 familias y se registraron 11 especies por parcela. La diversidad de árboles en la SBC fue de 1.91 (±0.34) frente a 2.10 (±0.32) en la SMS. En consecuencia, las comunidades no se distribuyen uniformemente, tanto en SMS (J= 0.65 ± 0.12) y SBC (J= 0.63±0.12). La composición de especies fue estadísticamente diferente entre las comunidades de plantas (ANOSIM, R= 0.19, p= 0.01). El índice de diversidad beta de Sorensen confirma lo anterior, con 46 especies (55%) no compartidas, 13 registradas sólo para la SBC y 33 sólo en la SMS, mientras que 37 especies (45%) son comunes en ambos ecosistemas. El análisis SIMPER, indica que las especies características de la SMS son: Coccoloba barbadensis, Croton reflexifolius, Diospyros albens, Swartzia cubensis y Tecoma stans, y de la SBC son: Diospyros tetrasperma, Gymnopodium floribundum, Mimosa bahamensis, Randia aculeata y Sideroxylon americanum. En ambas selvas se presentaron de forma dominante Lonchocarpus xuul, Lysiloma latisiliquum, Piscidia piscipula, Bursera simaruba y Vitex gaumeri.
Palabras clave: diversidad arbórea, ecosistemas tropicales, península de Yucatán.
Abstract
Structure and composition of tropical dry forest (SBC) and tropical semideciduous forest (SMS) were described in 2 locations at Campeche, Mexico. We compare the species richness, abundance and distribution of trees as well as their dasometric characteristics within each plant communities. We established 27 plots (500 m2) were all individuals ≥ 3 cm of diameter at the breast height were counted and measured. We counted 3 162 individuals belonging to 83 species and 30 families. Tree species richness was higher in the SMS (70 species in 30 families; 13 species average per plot) than in SBC, were 50 species in 21 families and 11 species per plot were recorded. Tree diversity in SBC was 1.91 (±0.34) versus 2.10 (±0.32) in SMS. Consequently, communities are not equitably distributed both in SMS (J= 0.65±0.12) and SBC (J= 0.63±0.12). Species composition was statistically different between plant communities (ANOSIM, R= 0.19, p= 0.01). Beta diversity, estimated using the Sorensen index, confirms this, with 46 species non-shared (13 registered only for SBC and 33 only in SMS; while 37 species (45%) were common to both plant communities. Some species are considered as indicators of the SMS while others are for SBC as shown by SIMPER analysis; representative species of SMS were Coccoloba barbadensis, Croton reflexifolius, Diospyros albens, Swartzia cubensis and Tecoma stans. In SBC forests highlighted Diospyros tetrasperma, Gymnopodium floribundum, Mimosa bahamensis, Randia aculeata and Sideroxylon americanum. Conspicuous and dominant species present in both vegetation types were Lonchocarpus xuul, Lysiloma latisiliquum, Piscidia piscipula, Bursera simaruba and Vitex gaumeri.
Key words: tree diversity, tropical ecosystems, Yucatán Peninsula.
Introducción
Explicar la alta diversidad de especies en las selvas tropicales se ha convertido en un reto persistente en ecología, que inicia por conocer la alta y compleja composición de especies en muchas de estas comunidades forestales (Chesson, 2000; Wright, 2002). Los patrones de variación o distribución de la diversidad tropical han sido objeto de hipótesis que intentan explicarlos (Janzen, 1970; Connell, 1978). Existen diversos estudios que han explicado la coexistencia local de especies en ecosistemas forestales lluviosos húmedos (Hubbell et al., 1999; Chave et al., 2002; Volkov et al., 2005). Se ha puesto menos énfasis en estudiar patrones de diversidad entre las distintas selvas caducifolias (Trejo y Dirzo, 2002) y, menos aún, de ésta en función de gradientes climáticos locales o regionales (Chave, 2008).
La diversidad arbórea está influenciada por varios factores, tales como el clima, el suelo, la topografía y limitaciones en la dispersión de las especies (Nekola y White, 1999; Bell, 2001; Condit et al., 2002; Tuomisto et al., 2003). En las regiones tropicales, la precipitación anual y la estacionalidad han sido consideradas como determinantes en los patrones de distribución de la diversidad y de la riqueza arbórea (Gentry, 1988; Clinebell et al., 1995; Givnish, 1999; Leigh, 1999; Leigh et al., 2004). Esto se observa con la restricción que impone la baja precipitación en la estación seca al establecimiento de muchas plantas (Wright, 1992; Condit et al., 1995; Engelbrecht y Kursar, 2003), o con la disminución de la diversidad arbórea en selvas lluviosas debida al incremento en la estacionalidad mediante un gradiente latitudinal (Davidar et al., 2005). La influencia de las condiciones climáticas sobre la diversidad en bosques neotropicales indican que la diversidad puede incrementarse a lo largo de gradientes ambientales claros como la precipitación, pero no en otros ambientes de la Amazonía (Condit et al., 2002). De manera similar, Trejo y Dirzo (2002) no encuentran relación entre precipitación y diversidad de especies arbóreas entre selvas secas con diferentes regímenes pluviales. Aunque Gentry (1995) afirmaba que los bosques tropicales secos resultaban florísticamente menos diversos que los lluviosos, este patrón requiere de mayor verificación.
Los ecosistemas forestales estacionales representan hasta el 42% del total de los ecosistemas forestales tropicales y subtropicales del planeta (Holdridge, 1967). Estos ecosistemas se ubican en regiones con precipitación pluvial anual < 1 800 mm y más de 5 meses con menos de 100 mm de lluvia mensual (Gentry, 1995; Pennington et al., 2009). Entre las selvas tropicales estacionales en México se encuentran las selvas bajas caducifolias (SBC) y las selvas medianas subcaducifolias (SMS). Se supone que la cantidad de precipitación pluvial y su distribución anual proveen un criterio para clasificar estos ecosistemas (Beard, 1944; Holdridge, 1967; Dupuy et al., 2012).
La SBC se distribuye generalmente por debajo de los 1 700 m de altitud, en zonas con temperaturas que en promedio se ubican en los 24° C, precipitación promedio de 800 mm (máxima 1 200 mm) y una temporada seca entre 7 y 8 meses (Challenger y Soberón, 2008). La mayoría de los árboles pierden el follaje durante la estación seca, causando un contraste respecto a la temporada de lluvias (Trejo y Dirzo, 2002; Pennington y Sarukhán, 2005). La SMS se distribuye en condiciones térmicas semejantes a las selvas altas o medianas subperennifolias, pero con precipitación anual entre 1 000 y 1 200 mm, con una temporada seca muy bien definida y prolongada, que corresponde a climas cálidos subhúmedos con lluvias estacionales (Trejo, 1996). Los árboles pierden su follaje en la estación seca en una proporción entre el 50 al 75% del arbolado (Miranda y Hernández-X, 1963; Pennington y Sarukhán, 2005).
En la península de Yucatán se encuentran comunidades tanto de la SBC y SMS. Frecuentemente ambos tipos de vegetación se encuentran contiguos, y sus diferencias estructurales y de composición de especies pueden dificultar su reconocimiento con precisión. El reconocimiento de sus semejanzas y diferencias florísticas, especialmente en relación con sus límites hídricos y térmicos, proporcionan mayores elementos de juicio para dar mayor certidumbre a la distinción entre ambos tipos de vegetación en esta región.
Se han realizado estudios que describen la composición y estructura de la vegetación en la península de Yucatán, entre ellos los de Rico-Gray (1982); Flores (1983); Espejel (1984, 1986); Durán-García (1987, 1995); Olmsted y Durán-García (1986); Rico-Gray et al. (1988, 1991); Mizrahi et al. (1997); Díaz-Gallegos et al. (2002); González-Iturbe et al. (2002) y Martínez y Galindo-Leal (2002). No obstante, faltan estudios que comparen estos ecosistemas y den información sobre la modificación de la composición de especies arbóreas en los límites de su separación climática dentro de una misma región geográfica. En el presente estudio se compara la composición de la SBC y SMS en condiciones similares de topografía, laderas y lomas; tipo de suelos, leptosoles); de temperatura, 1° C de diferencia con base en registro histórico de temperatura anual, y de precipitación, 50 mm de diferencia en precipitación anual. Se pretende determinar si ambos tipos de vegetación difieren significativamente en la diversidad, composición y estructura de sus respectivas comunidades arbóreas, en esta estrecha distinción hídrica y térmica.
Materiales y métodos
Área de estudio. El estudio se realizó en una comunidad de selva baja caducifolia y otra en selva mediana subcaducifolia, ubicadas en los ejidos de Pomuch y San José Carpizo 1, respectivamente, separados entre sí 80 km y localizados en el norte-centro del estado de Campeche, México (Fig. 1). El ejido de San José Carpizo 1, localizado en la planicie de Campeche, se ubica sobre material sedimentario con rocas calizas dolomitizadas, silicificadas y detríticas. La SMS se presenta en suelos de tipo leptosol, en laderas y lomas, rodeadas de tierras agrícolas con suelos tipos gleysol y rendzina (Cuanalo-De la Cerda et al., 1989). La altitud varía entre 35 y 250 m, con temperatura media anual de 26° C y una precipitación media anual de 1 250 mm (Orellana-Lanza et al., 1999). El ejido de Pomuch se ubica en la planicie litoral de Yucatán, conformada por rocas sedimentarias calizas y materiales detríticos. Las altitudes varían de 0 a 50 m. La selva se distribuye en las lomas y laderas que presentan suelos de tipo leptosol, rodeadas de valles agrícolas donde dominan los suelos de texturas medias a someras, de los tipos regosol, rendzinas, gleysol, luvisol y vertisol (Cuanalo-De la Cerda et al., 1989). La temperatura media anual es 25° C y la precipitación media anual alcanza 1 200 mm (Orellana-Lanza et al., 1999).
Método de muestreo. Todos los árboles con diámetros del talo ≥ 3 cm a 1.3 m de altura fueron contabilizados e identificados hasta especie, estimando, además, la altura total del árbol (m), dentro de 27 parcelas circulares de 500 m2, establecidas en cada tipo de vegetación. Las parcelas de muestreo se distribuyeron sistemáticamente separadas al menos por 200 m entre sí. El material botánico colectado se identificó preliminarmente en campo con la ayuda de los listados de especies y guías florísticas existentes para la región (Martínez et al., 2001; Martínez y Galindo-Leal, 2002; Carnevali-Fernández-Concha et al., 2010). La determinación final se realizó mediante cotejo con especímenes en la colección de referencia del Herbario de la Universidad Autónoma de Campeche.
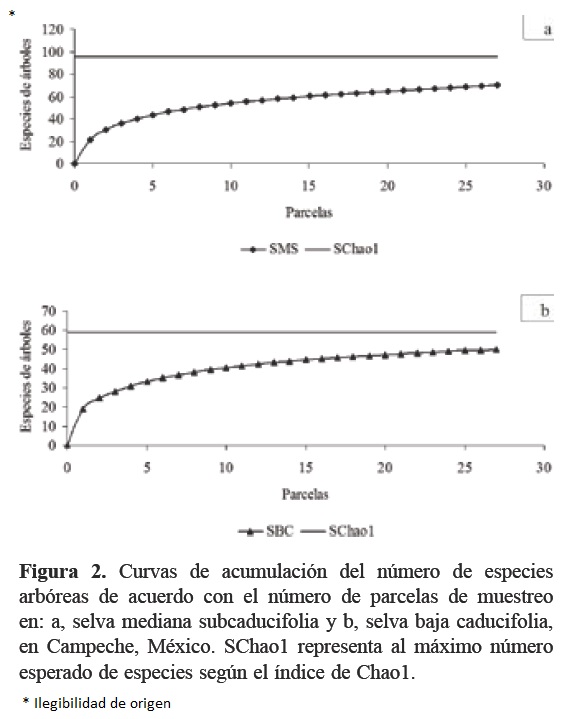
Análisis. Se determinó la representatividad del muestreo de especies arbóreas, considerado como el porcentaje de detección de las mismas respecto a la cantidad esperada de especies en cada selva. Como el número esperado de especies se consideró al máximo valor del índice de Chao1 en cada ecosistema estudiado (Escalante-Espinosa, 2003). Estos valores se compararon mediante curvas de acumulación de especies trazadas con los valores de rarefacción de Coleman, para ambas selvas. Para estos cálculos se utilizó el programa EstimateS, versión 8 (Colwell, 2006).
Se estimaron los índices ecológicos de diversidad alfa, de uniformidad (Shannon-Wiener), de dominancia (Simpson), así como el índice de diversidad beta de Sorensen (Magurran, 1987). Para estos análisis se utilizó el programa PAST 2.16 (Hammer et al., 2001). Se realizó un análisis de varianza (ANDEVA) para comparar la diversidad entre ambos tipos de vegetación mediante el programa InfoStat (Di Rienzo et al., 2009).
El análisis de la estructura de la vegetación arbórea para cada uno de los sitios de muestreo se basó en el cálculo de la densidad de individuos por hectárea, el área basal y la frecuencia. A partir de estos datos, se obtuvieron los respectivos valores de importancia relativa (VIR) por especie en cada sitio (Mueller-Dombois y Ellemberg, 2002). De esta forma se identificaron las especies dominantes en cada uno de los tipos de vegetación. Fue analizada la distribución de frecuencias del área basal y de la misma forma se analizó la estructura vertical (alturas) de cada uno de los sitios. El análisis de similitud (ANOSIM), dentro del programa Primer 6.0 (Clarke y Gorley, 2006), se utilizó para determinar si hay diferencias significativas en la composición de especies entre ambos ecosistemas selváticos. El análisis de similitudes porcentuales (SIMPER) fue realizado para determinar si algunas especies de árboles caracterizan y distinguen una selva de la otra.
Resultados
Riqueza y diversidad. El total de individuos contabilizados en los 2 tipos de vegetación fueron 3 162 individuos, que corresponden a 83 especies arbóreas distribuidas en 30 familias botánicas. En la SMS se contabilizaron un total de 1 522 individuos ubicados en 30 familias, 62 géneros y 69 especies (74% de las 90 esperadas). La familia Fabaceae es la más diversa (14 géneros, 17 especies), seguido de Sapotaceae (4 géneros, 6 especies) y Malvaceae (4 géneros, 5 especies). En la SBC se contabilizaron 1 640 individuos, pertenecientes a 21 familias, 48 géneros y 51 especies (85% de las 60 esperadas; Fig. 2). También, en este caso, Fabaceae es la familia con mayor número de géneros (16 géneros, 21 especies), seguido de Rubiaceae con 5 géneros y especies (Cuadro 1). El registro promedio y desviación estándar por parcela de muestreo es de 13 (±3) especies en SMS y de 11 (±3) especies en SBC. Ambos tipos de vegetación comparten 37 especies (45% del total). Dentro de estas especies compartidas, las 5 especies que presentaron el mayor número de individuos en ambas selvas fueron: L. xuul, L. latisiliquum, P. piscipula (Fabaceae), B. simaruba (Burseraceae) y V. gaumeri (Lamiaceae).
La diversidad más alta se observó en la SMS (Shannon-Wiener, H´= 2.77), en comparación con la SBC (H´= 2.31). De igual manera, el índice de diversidad Shannon-Wiener en promedio para la SMS fue mayor que en la SBC (Cuadro 2). El ANDEVA mostró diferencias significativas (p= 0.04) entre la diversidad de los 2 tipos de vegetación (Cuadro 2). Este resultado se confirmó con el índice de similitud de Sorensen, el cual indicó diferencias entre ambas comunidades de especies arbóreas que comparten una similitud de 40%. Tanto en la SMS como en la SBC el mayor registro para el índice de uniformidad fue 0.84. Los valores más bajos para cada uno de los tipos de vegetación resultan también bastante próximos (0.37 para SMS y 0.40 para SBC). En promedio, el índice de uniformidad para cada tipo de vegetación fue igualmente muy similar, 0.65 y 0.63, respectivamente (Cuadro 2).
Estructura de la vegetación. Respecto a las familias encontradas, la mayor cantidad de individuos registrados pertenecen a la familia Fabaceae, con un total de 727 individuos en la SMS y 851 individuos en la SBC. Las familias con menor número de individuos fueron las familias Rubiaceae (32) en SMS y Euphorbiaceae (18) en SBC, respectivamente. La familia Ebenaceae presentó la segunda menor cantidad de individuos en ambos casos (Fig. 3).
La altura promedio de los árboles (8.3 m) y el diámetro del tallo (11.2 cm) fueron mayores en SMS que aquellos obtenidos en SBC, donde los valores promedios fueron 6.3 m en altura y 6.9 cm en diámetro a la altura de pecho (DAP). Esto corresponde con los resultados en el área basal promedio que para SMS fue de 19.26 m2/ha, mientras que para SBC alcanzó 10.48 m2/ha. Sin embargo, en el caso de la densidad de individuos, éste fue mayor en SBC, teniendo en promedio 1 215 individuos por hectárea, mientras que en SMS se observaron en promedio 1 127 individuos por hectárea (Fig. 4).
La abundancia de las 5 especies arbóreas con mayor número de individuos en la SMS fueron: L. xuul (279), L. latisiliquum (268), B. simaruba (124), P. piscipula (107), y C. barbadensis (81). Mientras que en la SBC, las especies con mayor abundancia fueron: L. latisiliquum (345), B. simaruba (229), L. xuul (192), P. piscipula (117) y G. floribundum (81). Por otro lado, en SMS se presentaron 18 especies con un solo individuo, mientras que en SBC, solamente se presentaron 9 especies con un solo individuo. Las especies con los mayores valores de importancia relativa (VIR) en la SMS fueron: L. latisiliquum (60.3), L. xuul (35.9), P. piscipula (21.4) y V. gaumeri (10.3). Mientras que para el caso de la SBC las especies arbóreas con mayor VIR fueron: L. latisiliquum (71.1), B. simaruba (45.6), P. piscipula (23.6), L. xuul (19.3), G. floribundum (12.2) (Cuadro 1).
Especies características: Una de las diferencias entre la composición de la SBC y la SMS se detectó en la distinción de especies de árboles que caracterizan entre los 2 tipos de vegetación (ANOSIM, R= 0.19, p= 0.01). En la SMS se reconocieron 11 especies que en conjunto contribuyen con el 90% de la distinción de esta comunidad, y de éstas las más destacadas son: C. barbadensis, C. reflexifolius, D. albens, S. cubensis y T. stans.
La SBC está caracterizada por D. tetrasperma, G. floribundum, M. bahamensis, R. aculeata y S. americanum. Otro grupo de especies arbóreas que está presente de manera dominante y presentes en ambos tipos de vegetación fueron: L. xuul, L. latisiliquum, P. piscipula, B. simaruba y V. gaumeri. En ambos ecosistemas, las especies características no siempre presentan valores de importancia relativa elevados, sino que incluso, en algunos éstos resultan bajos (Cuadro 1).
Discusión
Riqueza, diversidad y estructura de la selva mediana subcaducifolia. La riqueza de especies registrada en la SMS está dentro del ámbito documentado en diferentes localidades de la península de Yucatán (Zamora-Crescencio, 2003, 2008; Gutiérrez-Báez et al., 2011, 2012a, 2012b), mientras su composición, dominada por especies pertenecientes de la familia Fabaceae, coinciden con la de otros estudios realizados en la península de Yucatán (Flores, 1987; Barber et al., 1999; Zamora-Crescencio et al., 2008, 2011).
La diversidad de la SMS estudiada es baja y, además, presenta más especies dominantes que la selva estudiada en Tekax, Yucatán por Gutiérrez-Báez et al. (2011), al compararse ambas mediante el índice de uniformidad. Por otro lado, los resultados muestran que la SMS en San José Carpizo 1, alcanzó menos altura que la mencionada para la condición forestal de selva baja subcaducifolia por Palacio-Aponte et al. (2002) quienes describen alturas de 12 a 20 m en el estrato arbóreo, 4 a 12 m más altas que en el caso de estudio en Campeche.
Riqueza, diversidad y estructura de la selva baja caducifolia. Respecto a la SBC la cantidad de información disponible para la península de Yucatán es aún incompleta (Cuadro 3). El número de especies arbóreas en la SBC es consistente con los valores hallados en otros estudios (Ceccon et al., 2002; Zamora-Crescencio, 2003; Zamora-Crescencio et al., 2011).
La diversidad de Shannon-Wiener en la selva baja caducifolia en los sitios de estudio es relativamente baja (H´= 1.91) en comparación con otros estudios; por ejemplo, en una selva baja caducifolia de Veracruz (H´= 2.78, Gallardo-Cruz et al., 2005), pero superan al de la vegetación secundaria en el norte de Campeche (H´= 1.59, Zamora-Crescencio et al., 2011). En 2 selvas caducifolias de Yucatán, Ceccon et al. (2002) estimaron valores de diversidad menores a los registrados en Pomuch, tanto en selva conservada como en regeneración después de cultivos agrícolas. Lo anterior es un fenómeno frecuente en la zona de estudio, que refleja cambios importantes en la diversidad de especies en las selvas debido a la agricultura. La posición intermedia de la diversidad en la SBC en Pomuch, puede representar un estadio intermedio, pero más cercano al de la condición de selva madura, en la sucesión en este ecosistema forestal.
El valor de la uniformidad en Pomuch es menor que en la SBC en Oaxaca (Gallardo-Cruz et al., 2005), lo que indica una mayor presencia de especies dominantes en Campeche. Lo anterior es confirmado por el índice de Simpson (Cuadro 2). Éste es probablemente debido al predominio de especies leguminosas en la península de Yucatán. Asimismo, la altura promedio en nuestro estudio indica que el arbolado de la SBC es más bajo que el de otras regiones neotropicales (Martínez y Galindo-Leal, 2002; Zamora-Crescencio, 2003; Castillo-Campos et al., 2007; Gutiérrez-Báez et al., 2011). Una probable causa de esto puede encontrase en la adaptación que estos ecosistemas presentan a la recurrente afectación por los huracanes, que pueden modificarlos en su estructura, composición y dominancia (Islebe et al., 2009; Sánchez-Sánchez e Islebe, 1999). En la SBC se obtuvieron valores superiores a 14 m2 de área basal por hectárea, similares a otros en la región, tanto para ecosistema conservado como en sucesión temprana o intermedia (Ceccon et al., 2002; Castillo-Campos et al. 2008; Zamora-Crescencio et al., 2011).
Análisis comparativo entre las 2 selvas. Los datos obtenidos en las selvas estudiadas en Campeche, coinciden con los de Zamora-Crescencio (2003); Zamora-Crescencio et al. (2011); Gutiérrez-Báez et al. (2011) y Dupuy et al. (2012) para estudios en la península de Yucatán y con los obtenidos en Oaxaca por Gallardo-Cruz et al. (2005). En todos ellos, se manifiesta la predominancia de la familia Fabaceae dentro de las comunidades de ambos ecosistemas selváticos. La dominancia de especies de la familia Fabaceae influye en los valores de uniformidad, relativamente bajos, que se registran en las selvas estudiadas en Campeche. Por otro lado, el patrón de abundancias refleja la frecuente aparición de pocas especies muy abundantes y un gran número de especies poco abundantes o raras (Gutiérrez-Báez et al. 2011).
Se concluye que ambas selvas de Campeche comparten varias similitudes de composición y estructura; aunque hay algunas diferencias en la riqueza de especies, que es más alta en la SMS (menos seca) que en la SBC, se considera que es el resultado del efecto directo de la humedad y pluviometría diferencial entre ambos tipos de vegetación, tal y como fue propuesto por Gentry (1995). La altura, el diámetro y el área basal resultaron mayores en la SMS, mientras el número de individuos arbóreos registrados por hectárea resultó mayor en la SBC. Estos resultados conjuntamente con las diferencias en la riqueza entre ambos tipos de vegetación, evidencian que, aún con suelo, temperatura y relieve semejantes, hay diferencias mínimas en la pluviometría que afectan la diversidad arbórea, la composición forestal y la estructura de la vegetación. Aunque existen diferentes elementos florísticos compartidos, hay otros exclusivos a cada tipo de vegetación que conjuntamente promueven una alta diversidad regional.
Agradecimientos
A los campesinos de las comunidades visitadas en Campeche por permitir el acceso a sus parcelas. Al Instituto Tecnológico de Chiná, Campeche por el apoyar los estudios doctorales del primer autor. Al Colegio de la Frontera Sur por las facilidades humanas, científicas, de infraestructura y logísticas. A Jorge Vargas, de la Universidad Autónoma de Campeche (UAC), por sus valiosos comentarios al documento. Al Dr. Neptalí Ramírez-Marcial y a 2 revisores anónimos que enriquecieron con su aporte este documento.
Literatura citada
Barber, A., J. Tun y M. B. Crespo. 1999. A new approach of the bioclimatology and potential vegetation of the Yucatán peninsula, Mexico. Phytocoenologia 31:1-31. [ Links ]
Beard, J. S. 1944. Climax vegetation in tropical America. Ecology 25:127-158. [ Links ]
Bell, G. H. 2001. Neutral macroecology. Science 293:2413-2417. [ Links ]
Carnevali, Fernández-Concha, G., J. L. Tapia-Muñoz, R. Duno-de Stefano e I. M. Ramírez-Morillo. 2010. Flora ilustrada de la península de Yucatán. Listado florístico. Centro de Investigación Científica de Yucatán A. C., Mérida, Yucatán. 328 p. [ Links ]
Castillo-Campos, G., P. Dávila-Aranda y J. A. Zavala-Hurtado. 2007. La selva baja caducifolia en una corriente de lava volcánica en el centro de Veracruz: lista florística de la flora vascular. Boletín de la Sociedad Botánica de México 80:77-104. [ Links ]
Castillo-Campos, G., G. Halffter y C. E. Moreno. 2008. Primary and secondary vegetation patches as contributors to floristic diversity in a tropical deciduous forest landscape. Biodiversity and Conservation 17:1701-1714. [ Links ]
Ceccon, E., I. Olmsted, C. Vázquez-Yanes y J. Campo-Alves. 2002. Vegetation and soil properties in two tropical dry forest of differing regeneration status in Yucatán. Agrociencia 36:621-631. [ Links ]
Challenger, A. y J. Soberón. 2008. Los ecosistemas terrestres en capital natural de México. Vol. I. Conocimiento actual de la biodiversidad. Conabio, México, D. F. p. 87-108. [ Links ]
Chave, J. 2008. Spatial variation in tree species composition across tropical forests: pattern and process. In Tropical forest community ecology, W. P. Carson y S. A. Schnitzer, (eds.). Oxford. p 11-30. [ Links ]
Chave, J., H. C. Muller-Landau y S. A. Levin. 2002. Comparing classical community models: theoretical consequences for patterns of diversity. American Naturalist 159:1-22. [ Links ]
Chesson, P. 2000. General theory of competitive coexistence in spatially varying environments. Theoretical Population Biology 58:211-237. [ Links ]
Clarke, K. R. y R. N. Gorley. 2006. Primer, versión 6. User manual/tutorial. Plymouth routine in multivariate ecological research. Primer-e Ltd. Plymouth. 182 p. http://www.primere.com; última consulta: 18.IX.2012. [ Links ]
Clinebell, R. R., O. L. Phillips, A. H. Gentry, N. Stark y H. Zuuring. 1995. Prediction of Neotropical tree and liana species richness from soil and climatic data. Biodiversity and Conservation 4:56-90. [ Links ]
Colwell, R. K. 2006. EstimateS: statistical estimation of species richness and shared species from samples, verión 8. http://www.purl.oclc.org/estimates; última consulta: 15.IX.2012. [ Links ]
Condit, R., N. Pitman, E. G. Leigh Jr., J. Chave, J. Terborgh, R. B. Foster, P. Núñez, S. Aguilar, R. Valencia, G. Villa, H. Muller-Landau, E. Losos y S. P. Hubbell. 2002. Betadiversity in tropical forest trees. Science 295:666-669. [ Links ]
Condit, R., S. P. Hubbell y R. B. Foster. 1995. Mortality rates of 205 Neotropical tree and shrub species and the impact of severe drought. Ecological Monographs 65:419-439. [ Links ]
Connell, J. H. 1978. Diversity in tropical rainforests and coral reefs. Science 199:1302-1310. [ Links ]
Cuanalo-De la Cerda H., E. Ojeda-Trejo, A. Santos-Ocampo y C. A. Ortiz-Solario. 1989. Provincias, regiones y subregiones terrestres de México. Colegio de Postgraduados, Centro de Edafología, Chapingo 624 p. [ Links ]
Davidar, P., J. P. Puyravaud y E. G. Leigh Jr. 2005. Changes in rain forest tree diversity, dominance and rarity across a seasonality gradient in the Western Ghats, India. Journal of Biogeography 32:493-501. [ Links ]
Díaz-Gallegos, J. R., O. Castillo y G. García. 2002. Distribución espacial y estructura arbórea de la selva baja subperennifolia en un ejido de la Reserva de la Biosfera Calakmul, Campeche, México. Universidad y Ciencia 18:11-28. [ Links ]
Di Rienzo, J. A., F. Casanoves, M. G. Balzarini, L. González, M. Tablada y C. W. Robledo. 2009. InfoStat, versión 2009. Grupo InfoStat, FCA, Universidad Nacional de Córdoba. [ Links ]
Dupuy, J. M., J. L. Hernández-Stefanoni, R. A. Hernández-Juárez, E. Tetetla-Rangel, J. O. López-Martínez, E. Leyequién-Abarca, F. J. Tun-Dzul y F. May-Pat. 2012. Patterns and correlates of tropical dry forest structure and composition in a highly replicated chronosequence in Yucatán, Mexico. Biotropica 44:151-162. [ Links ]
Durán-García, R. 1987. Descripción y análisis de la estructura y composición de la vegetación de Los Petenes del noroeste de Campeche, México. Biótica 12:181-198. [ Links ]
Durán-García, R. 1995. Diversidad florística de Los Petenes de Campeche. Acta Botanica Mexicana 31:73-84. [ Links ]
Engelbrecht, B. M. J. y Kursar, T. A. 2003. Comparative drought-resistance of seedlings of 28 species of co-occurring tropical woody plants. Oecologia 136:383-393. [ Links ]
Escalante-Espinosa, T. 2003. ¿Cuántas especies hay? Los estimadores no paramétricos de Chao. Elementos 52:53-56. [ Links ]
Espejel, I. 1984. La vegetación de las dunas costeras de la península de Yucatán. I. Análisis florístico del estado de Yucatán. Biótica 9:183-210. [ Links ]
Espejel, I. 1986. La vegetación de las dunas costeras de la península de Yucatán. II. Reserva de la Biosfera Sian ka´an, Quintana Roo. Biótica 11:7-24. [ Links ]
Flores, J. S. 1983. Vegetación insular de la península de Yucatán. Boletín de la Sociedad Botánica de México 45:23-37. [ Links ]
Flores, J. S. 1987. Yucatán: tierra de las leguminosas. Revista de la Universidad Autónoma de Yucatán 163:33-37. [ Links ]
Gallardo-Cruz, J. A., J. A. Meave y E. A. Pérez-García. 2005. Estructura, composición y diversidad de la selva baja caducifolia del cerro Verde, Nizanda, Oaxaca, México. Boletín de la Sociedad Botánica de México 76:19-35. [ Links ]
Gentry, A. H. 1988. Changes in plant community diversity and floristic composition on environmental and geographical gradients. Annals of the Missouri Botanical Garden 75:1-34. [ Links ]
Gentry, A. H. 1995. Diversity and floristic composition of neotropical dry forests. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press, Cambridge. p. 146-194. [ Links ]
Givnish, T. J. 1999. On the causes of gradients in tropical tree diversity. Journal of Ecology 87:193-210. [ Links ]
González-Iturbe, J. A., I. Olmsted y F. Tun-Dzul. 2002. Tropical dry forest recovery after long term Henequen (sisal, Agave fourcroydes Lem.) plantation in northern Yucatán, Mexico. Forest Ecology y Management 167:67-82. [ Links ]
Gutiérrez-Báez, C., J. J. Ortiz-Díaz, J. S. Flores-Guido, P. Zamora-Crescencio, M. R. Domínguez-Carrasco y P. Villegas. 2011. Estructura y composición florística de la selva mediana subcaducifolia de Nohalal-Sudzal Chico, Tekax, Yucatán, México. Foresta Veracruzana 13:7-14. [ Links ]
Gutiérrez-Báez, C., P. Zamora-Crescencio y S. C. Hernández-Mundo. 2012a. Estructura y composición florística de la selva mediana subcaducifolia de Mucuychacán, Campeche, México. Foresta Veracruzana 14:9-16. [ Links ]
Gutiérrez-Báez, C., J. J. Ortiz-Díaz, J. S. Flores-Guido y P. Zamora-Crescencio. 2012b. Diversidad, estructura y composición de las especies leñosas de la selva mediana subcaducifolia del Punto de Unión Territorial (PUT) de Yucatán, México. Polibotánica 33:151-174. [ Links ]
Hammer, Ø., D. Harper y P. Ryan. 2001. PAST: Paleontological statistics software package for education and data analysis. Paleontología Electrónica 4:1-9. [ Links ]
Holdridge, L. R. 1967. Life zone ecology. Tropical Science Center, San José. 206 p. [ Links ]
Hubbell, S. P., R. B. Foster, S. O'Brien, B. Wechsler, R. Condit, K. Harms, S. J. Wright y S. Loo de Lau. 1999. Light gaps, recruitment limitation and tree diversity in a Neotropical forest. Science 283:554-557. [ Links ]
Islebe, G. A., N. Torrescano-Valle, M. Valdez-Hernández, M. Tuz-Novelo y H. Weissemberger. 2009. Efectos del impacto del huracán Dean en la vegetación del sureste de Quintana Roo, México. Foresta Veracruzana 11:1-6. [ Links ]
Janzen, D. H. 1970. Herbivores and the number of tree species in tropical forests. American Naturalist 104:501-528. [ Links ]
Leigh Jr., E. G. 1999. Tropical forest ecology: a view from Barro Colorado Island. Oxford University Press, New York. 264 p. [ Links ]
Leigh Jr., E. G., P. Davidar, C. W. Dick, J. P. Puyravaud, J. Terborgh, H. Ter Steege y S. J. Wright. 2004. Why do some tropical forests have so many species of trees? Biotropica 36:447-473. [ Links ]
Magurran, A. 1987. Ecological diversity and its measurement. Princeton University Press, Princeton, New Jersey. 177 p. [ Links ]
Martínez, E., M. Sousa y C. H. Ramos-Álvarez. 2001. Región de Calakmul, Campeche. Capítulo XXII. In Listados florísticos de México, F. Chiang-Cabrera (ed.). Instituto de Biología, Universidad Nacional Autónoma de México, México, D. F. p. 1-55. [ Links ]
Martínez, E. y C. Galindo-Leal. 2002. La vegetación de Calakmul, México: clasificación, descripción y distribución. Boletín de la Sociedad Botánica de México 71:7-32. [ Links ]
Miranda, F. y E. Hernández. 1963. Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México 28:29-179. [ Links ]
Mizrahi, A., J. M. Ramos-Prado y J. J. Jiménez-Osornio. 1997. Composition, structure and management potential of secondary dry tropical vegetation in two abandoned plantations of Yucatán, Mexico. Forest Ecology y Management 94:79-88. [ Links ]
Mueller-Dombois, D. y H. Ellenberg. 2002. Aims and methods of vegetation ecology. The Blackburn Press, Caldwell, New Jersey. 547 p. [ Links ]
Nekola, J. C. y P. S. White. 1999. The distance decay in similarity in biogeography and ecology. Journal of Biogeography 26:867-878. [ Links ]
Olmsted, I. y R. Durán-García. 1986. Aspectos ecológicos de la selva baja inundable de la Reserva Sian Ka´an, Quintana Roo. Biótica 11:151-179. [ Links ]
Orellana-Lanza, R., M. Balam, I. Bañuelos, E. García, J. González-Iturbe, F. Herreray y J. Vidal. 1999. Evaluación climática. In Atlas de procesos territoriales de Yucatán, P. A. Chico (coord.). Facultad de Arquitectura, Universidad Autónoma de Yucatán, Mérida, Yucatán. p. 163-182. [ Links ]
Palacio-Aponte, A. G., R. Noriega-Trejo y P. Zamora-Crescencio. 2002. Caracterización físico - geográfica del paisaje conocido como "bajos inundables". El caso del área natural protegida de Balamkín, Campeche. Investigaciones Geográficas 49:57-73. [ Links ]
Pennington, R. T., M. Lavin y A. Oliveira-Filho. 2009. Woody plant diversity, evolution, and ecology in the tropics: perspectives from seasonally dry tropical forests. Annual Review of Ecology, Evolution and Systematic 40:437-457. [ Links ]
Pennington, T. D. y J. Sarukhán. 2005. Árboles tropicales de México. Manual para la identificación de las principales especies. Tercera edición. Universidad Nacional Autónoma de México-Fondo de Cultura Económica. México, D. F. 523 p. [ Links ]
Rico-Gray, V. 1982. Estudio de la vegetación de la zona costera inundable del noroeste del estado de Campeche, México: Los Petenes. Biótica 7:171-188. [ Links ]
Rico-Gray, V., J. G. García-Franco, A. Puch y P. Simá. 1988. Composition and structure of a tropical dry forest in Yucatán, Mexico. International Journal of Ecology and Environmental Science 14:21-29. [ Links ]
Rico-Gray, V. y G. García-Franco. 1991. The maya and the vegetation of the Yucatán peninsula. Journal of Ethnobiology 11:135-142. [ Links ]
Sánchez-Sánchez, O. y G. A. Islebe. 1999. Hurricane Gilbert and structural changes in a tropical forest. Global Ecology and Biogeography 8:29-38. [ Links ]
Trejo, I. 1996. Características del medio físico de la selva baja caducifolia en México. Investigaciones Geográficas 4:95-110. [ Links ]
Trejo, I. y R. Dirzo. 2002. Floristic diversity of Mexican seasonally dry tropical forests. Biodiversity and Conservation 11:2063-2048. [ Links ]
Tuomisto, H., K. Ruokolainen y M. Yli-Halla. 2003. Dispersal, environment and floristic variation of western Amazonian forests. Science 299:241-244. [ Links ]
Van der Wal, H., R. Espinoza-López y B. Dzib-Castillo. 2011. Evaluación preliminar del desmonte selectivo para establecer potreros diversificados en San José Carpizo No. 1, Campeche, México. Universidad y Ciencia 27:219-226. [ Links ]
Volkov, I, J. R. Banavar, F. He, S. P. Hubbell y A. Maritan. 2005. Density dependence explains tree species abundance and diversity in tropical forests. Nature 438:658-661. [ Links ]
Wright, S. J. 1992. Seasonal drought, soil fertility and the species density of tropical forest plant communities. Trends in Ecology and Evolution 7:260-263. [ Links ]
Wright, S. J. 2002. Plant diversity in tropical forests: a review of mechanisms of species coexistence. Oecologia 130:1-14. [ Links ]
Zamora-Crescencio, P. 2003. Contribución al estudio florístico y descripción de la vegetación del municipio de Tenabo, Campeche, México. Polibotánica 15:1-40. [ Links ]
Zamora-Crescencio, P., G. García-Gil, J. S. Flores-Guido y J. J. Ortiz. 2008. Estructura y composición florística de la selva mediana subcaducifolia en el sur del estado de Yucatán, México. Polibotánica 26:33-66. [ Links ]
Zamora-Crescencio, P., M. R. Domínguez-Carrasco, P. Villegas, C. Gutiérrez-Báez, L. A. Manzanero-Acevedo, J. J. Ortega-Haas, S. Hernández-Mundo, E. C. Puc-Garrido y R. Puch-Chávez. 2011. Composición florística y composición de la vegetación secundaria en el norte de Campeche, México. Boletín de la Sociedad Botánica de México 89:27-35. [ Links ]














