Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.84 n.4 México Dec. 2013
https://doi.org/10.7550/rmb.33799
Ecología
Estructura y diversidad de los bosques estacionales desaparecidos por la construcción de la presa Gral. Francisco J. Múgica, en la Depresión del Balsas, Michoacán, México
Structure and diversity of seasonally forests disappeared by the construction of the dam Gral. Francisco J. Múgica, in Balsas River Basin, Michoacán, Mexico
Juan Martínez-Cruz*, Moisés Méndez-Toribio, Jorge Cortés-Flores, Paz Coba-Pérez, Guadalupe Cornejo-Tenorio y Guillermo Ibarra-Manríquez
Centro de Investigaciones en Ecosistemas, Universidad Nacional Autónoma de México. Apartado postal 70-233, 04510 México, D. F., México. *jmc@cieco.unam.mx
Recibido: 03 octubre 2012
Aceptado: 10 mayo 2013
Resumen
Previo al llenado del embalse de la presa Gral. Francisco J. Múgica, en el municipio de Múgica, Michoacán, se caracterizó la estructura y diversidad en 3 sitios con bosque tropical caducifolio (BTC) y 1 con bosque tropical subcaducifolio (BTS). En cada sitio se muestrearon los árboles y lianas ≥2.5 cm diámetro enraizados en 10 transectos de 50 x 2 m (0.1 ha). En total, se censaron 947 individuos que incluyen 93 especies, 70 géneros y 32 familias (88 especies arbóreas y 5 lianas). En el BTC y BTS se censaron 54 y 39 especies, respectivamente. En ambos tipos de vegetación el componente arbóreo fue el dominante, ya sea por el número de especies, de individuos o el área basal. La familia Fabaceae presentó la mayor riqueza (26), área basal (7.36 m2), número de individuos (200) y número de troncos (422); otras familias importantes en alguna de estas variables son Euphorbiaceae y Rubiaceae. De acuerdo con el índice de importancia en el BTC las especies relevantes son Cordia elaeagnoides (Boraginaceae), Cyrtocarpa procera (Anacardiaceae), Handroanthus impetiginosus (Bignoniaceae), Manihot tomatophylla (Euphorbiaceae) y Sideroxylon celastrinum (Sapotaceae), mientras que para el BTS destacan Combretum farinosum (Combretaceae), Enterolobium cyclocarpum (Fabaceae), Ficus spp. (Moraceae) y Piper scabrum (Piperaceae). El número de especies y los valores de los índices de diversidad encontrados para el BTC son bajos, independientemente si se considera la presencia-ausencia de las especies o su densidad. La diversidad beta de los sitos con BTC es menor entre sí que con el BTS. Los atributos de estructura y diversidad documentados para estos bosques tropicales podrían explicarse por el efecto de las distintas actividades económicas que se desarrollan en esta región, especialmente la cría de ganado vacuno, el aprovechamiento de madera, la agricultura y las plantaciones de frutales.
Palabras clave: árboles, bosques caducifolios, diversidad alfa, diversidad beta, Fabaceae, índices de diversidad, lianas.
Abstract
Prior to filling the reservoir of the dam Gral. Francisco J. Múgica, in the municipality of Múgica, Michoacán, we characterized the structure and diversity in 3 sites for the tropical deciduous forest (TDF) and 1 more occupied by semi-deciduous tropical forest (TSF). At each site were sampled trees and lianas ≥2.5 cm diameter in 10 transects of 50 x 2 m (0.1 ha). A total of 947 individuals were recorded, including 93 species, 70 genera and 32 families (88 tree species and 5 lianas). In the TDF and TSF were recorded 54 and 39 species, respectively. In both vegetation types, tree component was the dominant, either by number of species, individuals or basal area. The family Fabaceae was the most diverse (26 species) and embraced the highest values of basal area (7.36 m2), number of individuals (200) and number of stems (422); other important families in any of these variables were Euphorbiaceae and Rubiaceae. Species important for its diversity, basal area and abundance for the TDF were Cordia elaeagnoides (Boraginaceae), Cyrtocarpa procera (Anacardiaceae), Handroanthus impetiginosus (Bignoniaceae), Manihot tomatophylla (Euphorbiaceae) and Sideroxylon celastrinum (Sapotaceae), meanwhile for TSF highlighted Combretum farinosum (Combretaceae), Enterolobium cyclocarpum (Fabaceae), Ficus spp. (Moraceae) and Piper scabrum (Piperaceae). The number of species and the values of diversity indexes found for the TDF were low. Regardless of the composition or abundance of species, beta diversity of the sites with TDF is minor among them that those found in the comparisons with the TSF. The attributes of structure and diversity documented for these tropical forests could be explained by the effect of different human activities taking place in this region, especially live-stock, timber extraction, agriculture and orchards.
Key words: trees, deciduous forests, alpha diversity, beta diversity, Fabaceae, diversity indexes, lianas.
Introducción
Las regiones con bosques tropicales climáticamente estacionales, particularmente el bosque tropical caducifolio (BTC), han experimentado un drástico cambio de uso de la tierra en los últimos 30 años (Miles et al., 2006; Ricker et al., 2007). En México, el BTC presenta tasas de deforestación anual de entre 1.4 y 2% (Trejo y Dirzo, 2000). Estimaciones de la deforestación a escalas más pequeñas muestran que, por ejemplo, en la zona del Bajío este tipo de vegetación llegó a cubrir cerca de 11 000 km2, del cual resta sólo el 5% (Hernández-Oria, 2007). En la cuenca del río Papagayo (1 331.9 km2), en el estado de Guerrero, del porcentaje estimado para el BTC (83.9%) en buen estado de conservación, se ha cuantificado recientemente sólo el 11.3% (Galicia et al., 2008). Esta severa degradación de los bosques tropicales caducifolios mexicanos contrasta con la notable diversidad vegetal que albergan (Gentry, 1995; Trejo y Dirzo, 2002), la cual incluye un elevado número de elementos endémicos que sobrepasan más del 60% (Rzedowski, 1991; Lott y Atkinson, 2010; Linares-Palomino et al., 2011). Otro ejemplo del endemismo de su flora son los géneros de Fabaceae, registrados en estos bosques, 80% de los cuales están restringidos a México (Sousa, 2010).
Directa o indirectamente, el ser humano ha intervenido en el deterioro de esta comunidad, especialmente por medio de actividades como la agricultura, la cacería, la ganadería, los incendios intencionales, la introducción de especies exóticas y la extracción de las nativas (Janzen, 1988; Sánchez-Velásquez et al., 2002; Alanís-Rodríguez et al., 2010; Maass et al., 2010). Una actividad menos frecuente, pero con un efecto también negativo sobre el BTC, es la construcción de presas. Se ha documentado que la construcción de este tipo de infraestructura provoca cambios drásticos, en ocasiones irreversibles, en la composición, la estructura y la dinámica de las comunidades vegetales afectadas (Shafroth et al., 2002; New y Xie, 2008; Mallik y Richardson, 2009).
En el presente trabajo se describe la estructura y diversidad de la vegetación que se encontraba antes de la construcción de la presa Gral. Francisco J. Múgica, en los alrededores de Nueva Italia, en el estado de Michoacán, la cual fue inaugurada hacia principios del 2011. Entre los antecedentes que pueden mencionarse están los resultados de 2 localidades con BTC en la Depresión del Balsas (Infiernillo, Michoacán y cañón del Zopilote, Guerrero), las cuales se ubican entre las más diversas en especies de árboles y lianas para este tipo de vegetación en México (Trejo y Dirzo, 2002; Trejo, 2005). Es pertinente mencionar que en los alrededores de Nueva Italia, la vegetación que predominaba era el BTC, el cual puede ser sustituido gradualmente por el bosque tropical subcaducifolio (BTS), sobre todo, hacia áreas marginales a cuerpos de agua. Este gradiente de vegetación se presenta en otras partes de México (Rzedowski, 1978; Lott et al., 1987). Hasta donde se conoce, no existe ninguna caracterización cuantitativa del BTS en la Depresión del Balsas, lo que realza la importancia del presente estudio.
Materiales y métodos
El área de estudio se ubica en la localidad de Nueva Italia, cabecera municipal del municipio de Múgica, en el centro-sur de Michoacán, México. El municipio se localiza entre los 19°01' N y 102°06' O, con una superficie aproximada de 378.6 km2 y una altitud promedio de 420 m snm. El área de estudio se encuentra en la provincia morfotectónica de la Sierra Madre del Sur, subprovincia de la Depresión del Balsas y es considerada por Ferrusquía-Villafranca (1993) como una de las más complejas del país. De acuerdo con la clasificación de Kóppen, modificada por García (2004), el clima predominante es semiárido, cálido, con régimen de lluvias de verano, con poca oscilación térmica, intertropical y con canícula (BS1(h')x'igw"); la temperatura media anual es de 26.5° C, siendo mayo el mes más caliente; la precipitación anual total es de 625.5 mm y la temporada de lluvias se presenta de junio a septiembre. De acuerdo con Rzedowski (1978), la vegetación predominante es el bosque tropical caducifolio, sin embargo, a lo largo del cauce de ríos es posible encontrar áreas con bosque tropical subcaducifolio.
Los tipos de vegetación censados fueron reconocidos por su fisonomía y composición, de acuerdo con lo descrito por Rzedowski (1978). Con base en su grado de accesibilidad y conservación se seleccionaron 3 sitios con bosque tropical caducifolio (BTC 1, BTC 2, y BTC 3) y 1 con bosque tropical subcaducifolio (BTS), distribuidos en la zona que ahora conforma el embalse de la presa (Fig. 1). En cada sitio se realizó un muestreo con base en lo propuesto por Gentry (1982), el cual consiste en colocar 10 transectos de 50 x 2 m (total de 0.1 ha). Para el BTC los transectos fueron distribuidos perpendicularmente a lo largo de la pendiente del terreno, mientras que en el BTS se ubicaron paralelos al cauce del río; en ambos tipos de vegetación la distancia de separación entre las líneas fue de 25 m. En estos 4 sitios sólo se censaron los individuos leñosos enraizados dentro de los transectos. Los árboles deberían de presentar troncos ≥2.5 cm de diámetro a la altura del pecho, mientras que las lianas deberían tener este diámetro a nivel del suelo. En el caso de plantas multicaules, se cuantificó el diámetro de cada tronco, se calculó su área basal y finalmente cada valor particular fue sumado para obtener esta variable por individuo.
La determinación de las especies fue realizada en el campo, aunque cuando no se tuvo certeza de su identidad a este nivel taxonómico, se recolectaron ejemplares. Para complementar la riqueza obtenida de los muestreos, se realizaron colectas de las plantas más frecuentes, especialmente de las leñosas (Apéndice 1). El material botánico fue identificado en el Herbario IEB, del Centro Regional del Bajío del Instituto Nacional de Ecología A. C. Se pueden encontrar duplicados de los ejemplares en este herbario y en el Herbario Nacional (MEXU), perteneciente al Instituto de Biología de la Universidad Nacional Autónoma de México.
Las categorías de riesgo fueron obtenidas mediante la consulta de la Nom-Ecol-059-2010 (Anónimo, 2010), la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (http://www.iucnredlist.org) y la convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (http://www.cites.org). En las 2 primeras referencias se citan a Tabebuia impetiginosa (Mart. ex DC.) Standl. y T. palmeri Rose (Bignoniaceae), las cuales son consideradas actualmente como sinónimos de H. impetiginosus (Mart. ex DC.) Mattos (Grose y Olmstead, 2007). Los nombres de las especies y la familia a la que pertenecen se citan por el arreglo propuesto en la base Trópicos (http://www.tropicos.org).
Para cada sitio se obtuvo el número de especies (S). Mediante el uso del software Biodiversity Pro ® (McAleece et al., 1997) se calcularon 3 índices de diversidad alfa (Magurran, 2004): el índice alfa (α) de Fisher, el de Shannon (H') y el de equidad (E1/D= (1/D)/S). Para el cálculo de H' se utilizó el logaritmo natural de n. Para comparar los valores de diversidad se aplicó la prueba de t modificada por Hutchenson en el índice de Shannon (H') (Zar, 1999) y un análisis de rarefacción para S con Biodiversity Pro®. Para la obtención de estimaciones del recambio de especies entre sitios (diversidad beta) se usó el índice de Simpson (βSIM= 1 - A / min (B, C) + A). En este algoritmo, A corresponde a la cantidad de especies compartidas entre 2 muestras, B y C representan el número de especies registradas únicamente en 1 de los sitios, en tanto que min es el valor mínimo de especies restringidas en las muestras que se comparan (B o C). Este índice permite evidenciar las diferencias en la composición de especies (Koleff et al., 2003; Koleff, 2005) y valores cercanos a 1 se presentan cuando el porcentaje de especies que se comparten es bajo, es decir, entre los sitios se detecta una alta diversidad beta. La diversidad beta también fue estimada con el índice de Sorensen cuantitativo (SSOR), usando EstimateS (Colwell, 2005), con base en la fórmula (Moreno, 2001): 2pN/ aN+bN, donde aNy bN es el número total de individuos en el sitio A y B, respectivamente y pN es la sumatoria de la densidad más baja registrada de las especies que se comparten entre los sitios comparados. Cuando este índice se aproxima a 1 indica que las muestras que se comparan tienen una mayor similitud y en consecuencia una baja diversidad beta (Magurran, 2004).
Resultados
En los 4 sitios censados se midieron 1 983 troncos, que correspondieron a 947 individuos (872 árboles y 75 lianas) y 93 especies (88 de árboles y 5 de lianas), incluidas en 70 géneros y 32 familias (Apéndice 2). Este listado incluye 12 especies cuya determinación sólo fue obtenida a nivel de género (11 árboles y 1 liana). En la Nom-Ecol-059-2010 se encontró que Pachycereus gaumeri (Cactaceae) es considerada en la categoría de riesgo en Peligro de Extinción, con 3 especies como Amenazadas (Licania arborea, Chrysobalanaceae; Sideroxylon capiri, Sapotacaeae y H. impetiginosus), esta última también incluida en la Lista Roja de la IUCN, en la categoría de Preocupación Menor. Tres cactáceas columnares registradas en el muestreo, están señaladas en el apéndice II de CITES (Pilosocereus alensis, Stenocereus queretaroensis y P. gaumeri). El BTC y el BTS registraron un total de 54 y 39 especies, respectivamente.
Estructura. Independientemente de la categoría diamétrica o sitio que se compare, el componente arbóreo fue el dominante, tanto en el número de especies, individuos o área basal, ya que incluso no se detectaron lianas con diámetro ≥10 cm en el BTC (Cuadro 1) y sólo se registró una especie (C. farinosum, Combretaceae) en el BTS (Cuadro 1). Dentro de una misma categoría diamétrica, el número de especies censadas en los 3 sitios con BTC es similar (Cuadro 1). Entre las variables de estructura obtenidas para el BTS, el área basal resultó mucho mayor a las documentadas para el BTC, ya que el sitio 3, que es más sobresaliente al respecto (3.366 m2) representa sólo el 34.5% de la cuantificada en el BTS (9.767 m2).
Fabaceae es la familia que presentó los valores más altos por número de especies (26), área basal (7.36 m2), número de individuos (200) y número de troncos (422); Rubiaceae se encontró también presente entre las 5 familias más importantes en los 4 atributos anteriormente mencionados (Cuadro 2). Fabaceae, junto con Burseraceae, Moraceae, Rubiaceae y Cactaceae abarcan el 52.7% de la riqueza total obtenida de los sitios de estudio; un total de 21 familias están representadas por una especie (Apéndice 2). El 74.1% del área basal es aportado por las primeras 5 familias, mientras que el área basal remanente es aportado por 27 de éstas (Cuadro 2). Las 5 familias dominantes aportan cerca del 60% de los individuos y de los troncos censados, siendo particularmente relevante la contribución de Fabaceae, Euphorbiaceae y Rubiaceae.
Por otro lado, para todos los sitios las 5 especies que tienen los valores de densidad más altos o área basal, suman porcentajes de entre el 45 y 78% (Cuadro 3). La especie arbórea Manihot tomatophylla (Euphorbiaceae) fue la única en ubicarse entre las 5 más importantes en los 3 sitios con BTC, tanto por su densidad como por su área basal. Para ambos atributos de estructura, C. elaeagnoides (Boraginaceae) fue el árbol dominante en el BTC 1 y fue la segunda más importante en área basal para el sitio 3, superada marginalmente por S. celastrinum (Sapotaceae). Los sitios BTC 2 y 3 comparten la especie más abundante (H. impetiginosus), en tanto que C. procera (Anacardiaceae) es la especie con mayor área basal en BTC 1 y 2 (Cuadro 3). La única liana presente entre las 5 especies más importantes en los 4 muestreos fue C. farinosum (56 individuos), que además fue la más abundante en BTS. Este sitio destaca por el área basal de las especies del género Ficus (Moraceae) y E. cyclocarpum (Fabaceae), que representan cerca del 50% de este atributo. En este sitio se registró entre las especies más abundantes el mango (Mangifera indica, Anacardiaceae), un árbol frutal exótico.
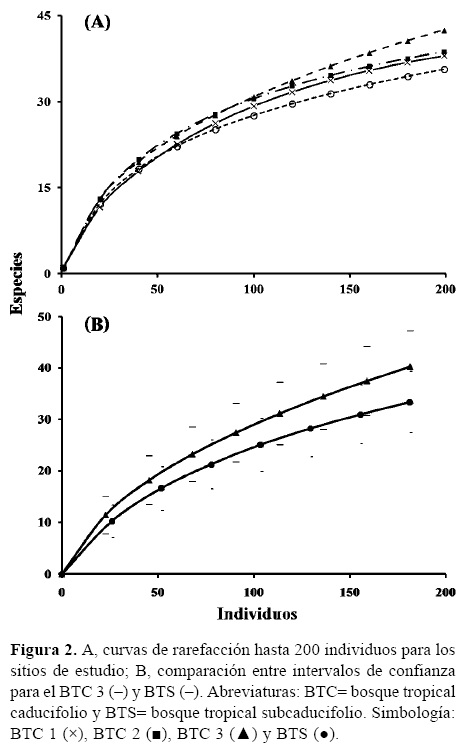
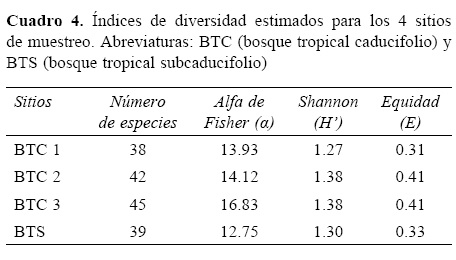
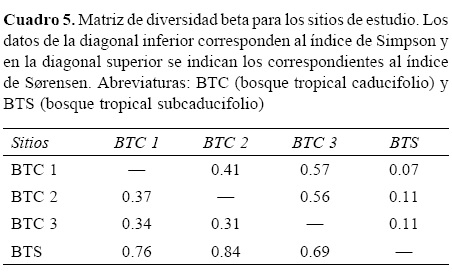
Diversidad. La mayor riqueza de especies (45) se obtuvo para el BTC 3 (Cuadro 4), mientras que la menor fue registrada para el BTC 1 (38). Estos resultados fueron confirmados con los índices a de Fisher, H', E y por el análisis de rarefacción (Fig. 2A). Las pruebas de t para Shannon mostraron que no existen diferencias entre los 4 sitios analizados. Este resultado se muestra en la figura 2B donde se comparó al sitio BTC 3 con el BTS cuyos intervalos de confianza se empalman expresando diversidades similares. Los sitios BTC 2 y BTS son los de mayor recambio de especies (β IM= 0.84), mientras que al realizar este ejercicio con valores cuantitativos es ahora la dupla de sitios BTC 1 y BTS los de mayor disimilitud (SSOR= 0.07). Los valores obtenidos en ambos índices indican que los sitos con BTC tienen una menor diversidad beta entre sí que los que se obtienen al compararlos con el BTS (Cuadro 5).
Discusión
Estructura. La riqueza encontrada en los 3 sitios censados con BTC en la zona de estudio (38-45 especies) es baja cuando se compara con los obtenidos en este tipo de vegetación en México (Lott et al., 1987; Trejo y Dirzo, 2002) e incluso están por debajo del valor promedio nacional, que es de 74 (± 24) especies (Trejo, 2005). Estas cifras también están distantes de los valores más altos registrados para el BTC a nivel mundial (Phillips y Miller, 2002), los cuales sobrepasan la centena de plantas leñosas. La riqueza de los sitios censados en el presente estudio se asemejan más a los encontrados por Pineda-García et al. (2007), que oscilan entre 36 y 50 especies, en la misma Depresión del Balsas y los consignados por Trejo (2005), en diversos estados de México (La Burrera, Baja California; cerro Zináparo, Michoacán; Jesús María, Nayarit; Calipam, Puebla; Ayutla, Quéretaro; Álamos, Sonora; El Pensil, Tamaulipas). Los valores de área basal del BTC (1.75-3.37 m2) encontrados en el presente estudio se encuentran dentro del intervalo mencionado previamente en algunas localidades de México (Lott et al., 1987; Pineda-García et al., 2007), los cuales oscilaron entre 2.4 y 3.5 m2, pero por debajo de lo encontrado en los bosques más sobresalientes en Ndakan, República Centroafricana, con valores entre 6.8 y 7.5 m2 (Phillips y Miller, 2002).
En el área de estudio la familia Fabaceae fue la más relevante respecto a su riqueza, área basal, número de individuos y troncos censados (Cuadro 2), un resultado afín a otros BTC del Neotrópico, especialmente en lo que concierne al número de especies (Lott et al., 1987; Zepeda-Gómez y Velázquez-Montes, 1999; Gillespie et al., 2000; Gallardo-Cruz et al., 2005; Pineda-García et al., 2007; Leirana-Alcocer et al., 2009). Además de Fabaceae, otras familias de plantas leñosas estructuralmente importantes de las selvas secas del occidente de México son Bignoniaceae, Burseraceae, Euphorbiaceae y Rubiaceae (Cué-Bár et al., 2006; Padilla-Velarde et al., 2006; Lott y Atkinson, 2010; Sousa, 2010), las cuales también destacaron en el presente estudio. El sitio de BTS difiere a lo descrito previamente en la importante representación de especies del género Ficus, Moraceae (Cuadro 3).
Las especies estructuralmente dominantes del BTC (Cuadro 3) han sido mencionadas anteriormente como elementos característicos en la Depresión del Balsas (Rzedowski, 1978; Pineda-García et al., 2007; Lott y Atkinson, 2010), por ejemplo Amphipterygium adstringens (Julianiaceae), C. procera, H. impetiginosus o C. elaegnoides. De hecho, Lott y Atkinson (2010) subrayan que esta última especie puede formar comunidades en donde predomina claramente. Por otro lado, a pesar de que el género Bursera (Burseraceae) es reconocido como un elemento fisonómicamente importante en este tipo de vegetación y particularmente en la Depresión del Balsas (Rzedowski, 1978; Rzedowski et al., 2005), probablemente sus especies presenten pocos individuos localmente, ya que de las 7 especies censadas (Apéndice 2), únicamente B. grandifolia se ubicó entre los 5 taxa más abundantes, pero sólo en el BTC 2 (Cuadro 3). Una situación similar fue obtenida por Pineda-García et al. (2007), quienes sólo mencionan como especie importante en 1 de los 4 sitios de 0.1 ha censados a B. fagaroides. Este fenómeno de rareza poblacional demanda una evaluación más amplia en los bosques estacionalmente secos de México. Las especies con mayor densidad que se registraron en el BTS han sido mencionadas como características de este tipo de vegetación por Rzedowski (1978), por lo que no sorprende su alto número de individuos, que se relaciona, en el caso del área de estudio, con valores sobresalientes de área basal. En este sentido, Rzedowski (1978) resalta el notable grosor de los troncos de Ficus spp. y E. cyclocarpum. De hecho, para esta última especie en el BTS censado se registró un individuo majestuoso de 1.6 m de d.a.p.
Los 3 sitios de BTC presentan una mayor riqueza de elementos arbóreos que de lianas, como sucede con comunidades similares en otras partes del Neotrópico (Gentry, 1995; Trejo y Dirzo 2002; Gillespie et al., 2006; Pineda-García et al., 2007). La riqueza de lianas se ha interpretado a la luz de la dinámica sucesional del BTC, ya que se ha determinado que fases más tardías presentan valores más altos al respecto (Castillo-Campos et al., 2007). Un relevante número de especies de esta forma de crecimiento también se ha asociado con áreas que confluyen hacia márgenes riparios (Rzedowski, 1978; Trejo, 2005; Lott y Atkinson, 2006). Esto último se confirma con la densidad de C. farinosum obtenida en el presente estudio, que fue la especie más importante en el número de individuos censados en el BTS (Cuadro 3). El bajo número de individuos de lianas del BTC es explicado por Madeira et al. (2009) porque en etapas sucesionales tardías la altura del dosel se incrementa, reduciendo la disponibilidad de hábitats para las lianas, debido al aumento de la energía que éstas requieren para trepar, aunado a una reducción en la disponibilidad de luz. Sin embargo, otra posible explicación en los sitios censados es discutida en la siguiente sección con respecto al posible efecto de las actividades económicas del ser humano en la región de estudio.
Diversidad. De manera similar a lo encontrado en el número de especies, los valores obtenidos con el índice a de Fisher en el presente estudio (13.93-16.83) se ubicarían entre los valores más bajos cuando se comparan con los obtenidos para otras regiones con BTC en el Neotrópico (Phillips y Miller, 2002); por ejemplo, 2 sitios en Bolivia alcanzan valores de 138.3 (Río Negro) y 95.8 (Nuevo Mundo). Un resultado similar fue encontrado al comparar los valores del índice de Shannon citados por Trejo y Dirzo (2002), donde incluso el BTC 3, que fue el que obtuvo el mayor valor de diversidad en el presente estudio (Cuadro 2), representa uno de los valores más bajos (1.38) a nivel de todo México.
Estos resultados podrían asociarse con las constantes actividades humanas a las que están sometidas las comunidades vegetales en la zona de estudio, especialmente por la práctica de libre pastoreo de ganado vacuno, la extracción de madera y la remoción de la vegetación natural para diversos tipos de cultivares como cítricos (Citrus spp., Rutaceae), maíz (Zea mays L., Poaceae), pepino (Cucumis sativus L., Cucurbitaceae), sandía (Citrullus lanatus (Thunb.) Matsum. and Nakai, Cucurbitaceae) o mango, este último, incluso, la cuarta especie con más individuos en el sitio con BTS (Cuadro 3). Esta hipótesis es apoyada por la baja riqueza y predominio de las lianas (Cuadros 1 y 3), las cuales son recurrentemente eliminadas por las comunidades locales para facilitar el tránsito del ganado y del hombre a través del bosque. Efectos similares sobre la estructura y diversidad de los sitios sometidos a disturbio han sido documentados por Sánchez-Velásquez et al. (2002) y Sagar y Singh (2005).
Como era de esperarse, los valores de la diversidad beta resultaron más contrastantes entre el sitio BTS con los que contienen BTC, independientemente si se compara el índice que sólo considera la presencia-ausencia de las especies o su abundancia (Cuadro 5). Para el caso particular de los 3 sitios de BTC, la similitud en la composición florística puede explicarse por su relativa cercanía, tal y como acontece para 2 de las localidades censadas en el estado de Tamaulipas por Trejo (2005), las cuales, a pesar de que difieren en el sustrato donde se establecen, son prácticamente contiguas. A pesar de lo anterior y de los gradientes que se establecen entre el BTC y BTS, sólo se encontraron 6 especies presentes en los 4 sitios muestreados (Apoplanesia paniculata (Fabaceae), C. elaeagnoides, Guettarda elliptica (Rubiaceae), Haematoxylum brasiletto (Fabaceae), H. impetiginosus y Lysiloma divaricatum (Fabaceae); Apéndice 2), todas ellas mencionadas como elementos frecuentes de la vegetación en la región (Rzedowski y Calderón de Rzedowski, 1987; Lott y Atkinson, 2010).
Miles et al. (2006) señalan que las diferentes actividades humanas representan la mayor amenaza para la conservación del BTC a nivel mundial, una conclusión que apoyan Soto et al. (2010). La región de la Depresión del Balsas ilustra esta situación, ya que carece de un ordenamiento que permita asegurar la conservación de sus bosques tropicales, ya que hasta ahora se ha priorizado, principalmente, actividades que generen directamente recursos económicos para el hombre, entre los que pueden citarse la crianza de ganado, el establecimiento de diversos cultivos o como en el caso del presente estudio, por la construcción de una presa. Con objeto de realizar un manejo más sustentable, se requiere valorar los servicios ambientales que este tipo de comunidades proveen al ser humano (p. ej. abastecimiento de agua o mantenimiento del suelo) y los recursos no forestales que aportan (p. ej. plantas medicinales o de ornato), además de incluir a los diferentes actores sociales involucrados en su uso (Sánchez-Azofeifa et al., 2009; Balvanera et al., 2011). También se requiere investigar los efectos de la construcción de la represa sobre la biodiversidad en los próximos años, así como evaluar los beneficios económicos y sociales que justificaron su construcción. En otra perspectiva, las instalaciones de la presa podrían convertirse en un centro de recreación, donde se realice un plan amplio de educación ambiental. El objetivo final de nuestro trabajo coincide con lo expresado por Lott y Atkinson (2010) y Sousa (2010), que es promover el interés por realizar estudios florísticos que aporten información importante para la restauración y conservación de áreas con BTC del occidente de México.
Agradecimientos
Los autores agradecen al Ing. Alberto Valencia García, de la Unidad de Cómputo del CIEco, por su ayuda en la planeación y manejo de la base de datos. Asimismo, agradecen al Dr. Eduardo García Moya y al revisor anónimo quienes aportaron sugerencias para mejorar el manuscrito.
Literatura citada
Alanís-Rodríguez, E., R. Aranda-Ramos, J. M. Mata-Balderas, P. A. Canizales-Velázquez, J. Jiménez-Pérez, J. I. Uvalle-Sauceda, A. Valdecantos-Dema y M. G. Ruiz-Bautista. 2010. Riqueza y diversidad de especies leñosas del bosque tropical caducifolio en San Luis Potosí, México. Ciencia Universidad Autónoma de Nuevo León 13:287-293. [ Links ]
Anónimo. 2010. Norma Oficial Mexicana NOM-ECOL-2010. Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010. Segunda Sección, México, D. F. p. 1-78. [ Links ]
Balvanera, P., A. Castillo y M. J. Martínez-Harms. 2011. Ecosystem services in seasonally dry tropical forests. In Seasonally dry tropical forest ecology and conservation, R. Dirzo, H. S. Young, H. A. Mooney and G. Ceballos (eds.). Island Press, Washington D. C. p. 259-277. [ Links ]
Castillo-Campos, G., P. Dávila-Aranda y J. A. Zavala-Hurtado. 2007. La selva baja caducifolia en una corriente de lava volcánica del centro de Veracruz: lista florística de la flora vascular. Boletín de la Sociedad Botánica de México 80:77-104. [ Links ]
Colwell, R. K. 2005. EstimateS: statistical estimation of species richness and shared species from samples. Version 7.5. User's guide and application: http://purl.oclc.org/estimates; última consulta: 03.VII.2012. [ Links ]
Cué-Bär, E. M., J. L. Villaseñor, L. Arredondo-Amezcua, G. Cornejo-Tenorio y G. Ibarra-Manríquez. 2006. La flora arbórea de Michoacán, México. Boletín de la Sociedad Botánica de México 78:47-81. [ Links ]
Ferrusquía-Villafranca, I. 1993. Geology of Mexico: a synopsis. In Biological diversity of Mexico: origins and distribution, T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (eds.). Oxford University Press, New York. p. 3-107. [ Links ]
García, E. 2004. Modificaciones al sistema de clasificación climática de Kóppen. Instituto de Geografía, Universidad Nacional Autónoma de México. México, D. F. 90 p. [ Links ]
Galicia, L., A. E. Zarco-Arista, K. I. Mendoza-Robles, J. L. Palacio-Prieto y A. García-Romero. 2008. Land use/cover, landforms and fragmentation patterns in a tropical dry forest in the southern Pacific region of Mexico. Singapore Journal of Tropical Geography 29:137-154. [ Links ]
Gallardo-Cruz, J. A., J. A. Meave y E. A. Pérez-García. 2005. Estructura, composición y diversidad de la selva baja caducifolia del cerro Verde, Nizanda (Oaxaca), México. Boletín de la Sociedad Botánica de México 76:19-35. [ Links ]
Gentry, A. H. 1982. Patterns of Neotropical plant species diversity. In Evolutionary biology, M. K. Hecht, B. Wallade and G. T. Prance (eds.). Plenum Press, New York. p. 1-84. [ Links ]
Gentry, A. H. 1995. Diversity and floristic composition of Neotropical dry forests. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press, Cambridge. p. 146-194. [ Links ]
Gillespie, T. W., A. Grijalva y C. N. Farris. 2000. Diversity, composition, and structure of tropical dry forests in Central America. Plant Ecology 147:37-47. [ Links ]
Gillespie, T. W., B. R. Zutta, M. K. Early y S. Saatchi. 2006. Predicting and quantifying the structure of tropidal dry forest in south Florida and the Neotropics using spaceborne imagery. Global Ecology and Biogeography 15:225-236. [ Links ]
Grose, S. O. y R. G. Olmstead. 2007. Taxonomic revisions in the polyphyletic genus Tabebuia s. l. (Bignoniaceae). Systematic Botany 32:660-670. [ Links ]
Hernández-Oria, J. G. 2007. Desaparición del bosque seco en El Bajío mexicano: implicaciones del ensamblaje de especies y grupos funcionales en la dinámica de una vegetación avanzada. Zonas Áridas 11:13-31. [ Links ]
Janzen, D. H. 1988. Tropical deciduous forests. In Biodiversity, E. O. Wilson (ed.). National Academy Press, Washington D. C. p. 130-137. [ Links ]
Koleff, P., K. J. Gaston y J. J. Lennon. 2003. Measuring beta diversity for presence-absence data. Journal of Animal Ecology 72:367-382. [ Links ]
Koleff, P. 2005. Conceptos y medidas de la diversidad beta. In Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma, G. Halffter, J. Soberón, P. Koleff y A. Melic (eds.). m3m-Monografías Tercer milenio, Sociedad Entomológica Aragonesa, Zaragoza/Conabio/Grupo Diversitas-México/ Conacyt, México, D. F. p. 19-40. [ Links ]
Leirana-Alcocer, J. L., S. Hernández-Betancourt, L. Salinas-Peba y L. Guerrero-González. 2009. Cambios en la estructura y composición de la vegetación relacionados con los años de abandono de tierras agropecuarias en la selva baja caducifolia espinosa de la reserva de Dzilam, Yucatán. Polibotánica 27:53-70. [ Links ]
Linares-Palomino, R., A. T. Oliveira-Filho y R. T. Pennintong. 2011. Neotropical seasonally dry forest: diversity, endemism and biogeography of woody plants. In Seasonally dry tropical forest ecology and conservation, R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (eds.). Island Press, Washington D. C. p. 3-22. [ Links ]
Lott, E. J. y T. H. Atkinson. 2006. Mexican and Central American seasonally dry tropical forests: Chamela-Cuixmala, Jalisco, as a focal point for comparison. In Neotropical savannas and seasonally dry forests: plant diversity, biogeography and conservation, R. T. Pennington, G. P. Lewis y J. A. Ratter (eds.). Taylor and Francis Press, Boca Ratón. p. 316-342. [ Links ]
Lott, E. J. y T. H. Atkinson. 2010. Diversidad florística y endemismo en las selvas secas de la vertiente Pacífico de México. In Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México, G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (eds.). Fondo de Cultura Económica, México, D. F. p. 63-76. [ Links ]
Lott, E. J., S. H. Bullock y J. A. Solís-Magallanes. 1987. Floristic diversity and structure of upland and arroyo forests of coastal Jalisco. Biotropica 19:228-235. [ Links ]
Madeira, B. G., M. M. Espírito-Santo, S. D'Angelo-Neto, R. F. Nunes, G. A. Sánchez-Azofeifa, G. Wilson-Fernández y M. Quesada. 2009. Changes in tree and liana communities along a successional gradient in a tropical dry forest in southeastern Brazil. Plant Ecology 201:291-304. [ Links ]
Magurran, A. E. 2004. Measuring biological diversity. Blackwell, Oxford. 256 p. [ Links ]
Mallik, A. U. y J. S. Richardson. 2009. Riparian vegetation change in upstream and downstream reaches of three temperate rivers dammed for hydroelectric generation in British Columbia, Canada. Ecological Engineering 35:810-819. [ Links ]
Maass, M., A. Búrquez, I. Trejo, D. Valenzuela, M. A. González, M. Rodríguez y H. Arias. 2010. Amenazas. In Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México, G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (eds.). Fondo de Cultura Económica, México, D. F. p. 321-346. [ Links ]
McAleece, N., P. J. D. Lambshead y G. L. J. Paterson 1997. Biodiversity professional beta. Natural History Museum and Scottish Association for Marine Science, Oban, Argyll. http://gcmd.nasa.gov/records/NHML_Biopro.html; última consulta: 3.VII.2012. [ Links ]
Miles, L., A. C. Newton, R. S. DeFries, C. Ravilious, I. May, S. Blyth, V. Kapos y J. E. Gordon. 2006. A global overview of the conservation status of tropical dry forests. Journal of Biogeography 33:491-505. [ Links ]
Moreno, C. E. 2001. Manual de métodos para medir la biodiversidad. Manuales y Tesis Sociedad Entomológica Aragonesa, Zaragoza. 84 p. [ Links ]
New, T., y Z. Xie. 2008. Impacts of large dams on riparian vegetation: applying global experience to the case of China's Three Gorges Dam. Biodiversity and Conservation 17:3149-3163. [ Links ]
Padilla-Velarde, E., R. Cuevas-Guzmán, G. Ibarra-Manríquez y S. Moreno-Gómez. 2006. Riqueza y biogeografía de la flora arbórea del estado de Colima, México. Revista Mexicana de Biodiversidad 77:271-295. [ Links ]
Phillips, O. y J. S. Miller. 2002. Global patterns of plant diversity: Alwyn H. Gentry's forest transect data set. Monographs in Systematic Botany from the Missouri Botanical Garden 89:1-319. [ Links ]
Pineda-García, F., L. Arredondo-Amezcua y G. Ibarra-Manríquez. 2007. Riqueza y diversidad de especies leñosas del bosque tropical caducifolio El Tarimo, Cuenca del Balsas, México. Revista Mexicana de Biodiversidad 78:129-139. [ Links ]
Ricker, M., I. Ramírez-Krauss, G. Ibarra-Manríquez, E. Martínez, C. H. Ramos, G. González-Medellín, G. Gómez-Rodríguez, J. L. Palacio-Prieto y H. M. Hernández. 2007. Optimizing conservation of forest diversity: a country-wide approach in Mexico. Biodiversity Conservation 16:1927-1957. [ Links ]
Rzedowski, J. 1978. Vegetación de México. Editorial Limusa, México, D. F. 432 p. [ Links ]
Rzedowski, J. 1991. Diversidad y orígenes de la flora fanerogámica de México. Acta Botanica Mexicana 14:3-21. [ Links ]
Rzedowski, J. y G. Calderón-de Rzedowski. 1987. El bosque tropical caducifolio de la región mexicana del Bajío. Trace 12:12-21. [ Links ]
Rzedowski, J., L. R. Medina y G. Calderón-de Rzedowski. 2005. Inventario del conocimiento taxonómico, así como de la diversidad y del endemismo regionales de las especies mexicanas de Bursera (Burseraceae). Acta Botanica Mexicana 70:85-111. [ Links ]
Sánchez-Azofeifa, G. A., M. Quesada, P. Cuevas-Reyes, A. Castillo y G. Sánchez-Montoya. 2009. Land cover and conservation in the area of influence of the Chamela-Cuixmala Biosphere Reserve, Mexico. Forest Ecology and Management 258:907-912. [ Links ]
Sánchez-Velásquez, L. R., G. Hernández-Vargas, M. A. Carranza, M. R. Pineda-López, R. Cuevas y F. Aragón. 2002. Estructura arbórea del bosque tropical caducifolio usado para la ganadería extensiva en el norte de la Sierra de Manantlán, México, antagonismo de usos. Polibotánica 13:25-46. [ Links ]
Sagar, R. y J. S. Singh. 2005. Structure, diversity, and regeneration of tropical dry deciduous forest of northern India. Biodiversity and Conservation 14:935-959. [ Links ]
Shafroth, P. B., J. C. Stromberg y D. T. Patten. 2002. Riparian vegetation response to altered disturbance and stress regimes. Ecological Applications 12:107-123. [ Links ]
Sousa, M. 2010. Centros de endemismo: las leguminosas. In Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México, G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (eds.). Fondo de Cultura Económica, México, D. F. p. 77-91. [ Links ]
Soto, J. C., J. Jiménez y C. Sánchez. 2010. El Infiernillo, Michoacán y Guerrero. In Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México, G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (eds.). Fondo de Cultura Económica, México, D. F. p. 464-467. [ Links ]
Trejo, I. 2005. Análisis de la diversidad de la selva baja caducifolia de México. In Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma, G. Halffter, J. Soberón, P. Koleff y A. Melic (eds.). m3m-Monografías Tercer milenio, Sociedad Entomológica Aragonesa, Zaragoza/ Conabio/Grupo Diversitas-México/ Conacyt, México, D. F. p. 111-122. [ Links ]
Trejo, I. y R. Dirzo. 2000. Deforestation of seasonally dry tropical forest: a national and local analysis in Mexico. Biological Conservation 94:133-142. [ Links ]
Trejo, I. y R. Dirzo. 2002. Floristic diversity of Mexican seasonally dry tropical forests. Biodiversity and Conservation 11:2048-2063. [ Links ]
Tropicos.org. Missouri Botanical Garden. 13 Sep 2012 <http://www.tropicos.org> [ Links ]
Zar, J. H. 1999. Biostatistical analysis. Prentice Hall, Upper saddle river, New Jersey. 660 p. [ Links ]
Zepeda-Gómez, C. y E. Velázquez-Montes. 1999. El bosque tropical caducifolio de la vertiente sur de la sierra de Nanchititla, Estado de México: la composición y la afinidad geográfica de su flora. Acta Botanica Mexicana 46:29-45. [ Links ]














