Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.84 n.1 México Mar. 2013
https://doi.org/10.7550/rmb.30996
Ecología
Mirmecofauna asociada con sistemas agroforestales en el Corredor Biológico Mesoamericano en Tabasco, México
Mirmecofauna associated with agroforestry systems in the Mesoamerican Biological Corridor in Tabasco, Mexico
Noel A. González-Valdivia1, Gabriela González-Escolástico1, Everardo Barba2*, Salvador Hernández-Daumás1 y Susana Ochoa-Gaona1
1 Departamento de Agroecología, Sistemas de Producción Alternativos, El Colegio de la Frontera Sur, Apartado postal 1042, 8620 Villahermosa, Tabasco, México.
2 Departamento de Aprovechamiento y Manejo de Recursos Acuáticos, Sistemas de Producción Alternativos, El Colegio de la Frontera Sur, Apartado postal 1042, 8620 Villahermosa, Tabasco, México. *ebarba@ecosur.mx
Recibido: 07 abril 2012
Aceptado: 22 agosto, 2012
Resumen
Se evaluaron la riqueza, la abundancia y la distribución de hormigas como indicadores para monitoreo ecológico en los sistemas agroforestales en 3 regiones dentro del Corredor Biológico Mesoamericano en Tabasco, México. Los sistemas agroforestales (SAF) analizados fueron de árboles en linderos (AL) y de árboles dispersos en potreros (ADP). El estudio establece una línea de base para evaluar el estado de conservación de este grupo biológico en SAF de las regiones prioritarias para el Corredor Biológico Mesoamericano (municipios de Huimanguillo, Tacotalpa y Tenosique). Se recolectaron 52 792 ejemplares, pertenecientes a 131 especies, asignadas a 7 subfamilias. Se presentan 32 especies como nuevos registros y 7 morfoespecies catalogadas como affinis para Tabasco. La riqueza total para ADP consistió en 16 (±6) especies en Tenosique, 19 (±6) en Huimanguillo y 20 (±4) en Tacotalpa. La riqueza de especies para AL fue de 20 (±5) especies en Tenosique, 21 (±5) en Huimanguillo y 21 (±4) en Tacotalpa. La diversidad de la mirmecofauna en ADP fue de 1.52 (±0.36) en Tenosique, 0.84 (±0.49) en Huimanguillo y de 1.35 (±0.44) en Tacotalpa. La diversidad en AL se estimó en 1.87 (±0.36) en Tenosique, 1.06 (±0.55) en Huimanguillo y 1.33 (±0.45) en Tacotalpa. La dominancia de especies tanto en AL como ADP de las 3 regiones fue D > 0.26. Las comunidades no se distribuyeron equitativamente y la mayor homogeneidad fue alcanzada en Tenosique (J≥ 0.57 en ADP y 0.63 en AL, respectivamente). La composición de hormigas difirió entre sistemas y regiones. Ninguna especie se detectó como indicadora, ya que éstas utilizan ampliamente todos estos agroecosistemas.
Palabras clave: conservación, corredor biológico, diversidad de hormigas, monitoreo, paisaje.
Abstract
Myrmecofaunal richness, abundance and distribution were studied as indicators for ecological monitoring of agroforestry systems (SAF) in 3 regions in the Mesoamerican Biological Corridor of Tabasco, Mexico. The agroforestry systems analyzed were linearly arranged trees (AL) and scattered trees on pastures (ADP). The research sets up the baseline to assess the conservation status of this biological group in SAF in prioritized regions in the Mesoamerican Biological Corridor (Tacotalpa, Tenosique and Huimanguillo municipalities). We collected 52 792 specimens belonging to 131 species assigned to 7 subfamilies. We found 32 species new to the area and 7 morphospecies catalogued as affinis for Tabasco. Total richness for ADP consisted of 16 (±6) species in Tenosique, 19 (±6) in Huimanguillo, and 20 (±4) in Tacotalpa. Species richness for AL consisted of 20 (±5) species in Tenosique, 21 (±5) in Huimanguillo, and 21 (±4) in Tacotalpa. Ant diversity in ADP systems was 1.52 (±0.36) in Tenosique, 0.84 (±0.49) in Huimanguillo, and 1.35 (±0.44) in Tacotalpa. Diversity for AL systems was estimated in 1.87 (±0.36) in Tenosique, 1.06 (±0.55) in Huimanguillo, and 1.33 (±0.45) in Tacotalpa. Ant species dominance was detected in all AL and ADP systems along the 3 regions (D> 0.26). Communities were inequitably distributed and the major homogeneity was reached in Tenosique (J≥ 0.57 to ADP and 0.63 to AL, respectively). Ant composition was different between systems and regions. No species were detected as indicators since all use broadly the agroecosystems.
Key words: conservation, biological corridor, ant diversity, monitoring, landscape.
Introducción
El Corredor Biológico Mesoamericano (CBM) es un esfuerzo multinacional por alcanzar objetivos de desarrollo que incluye, además de lo social y económico, un componente principal por la conservación de los ecosistemas de la región (Domínguez-Cervantes, 2009; IEG-WB, 2011). Esta iniciativa, adoptada en Tabasco (Sedespa, 2006), demanda desarrollar investigaciones sobre los recursos biológicos actuales y sentar las bases metodológicas para su posterior monitoreo. Un primer paso en ese sentido consiste en seleccionar grupos que resultaron indicadores ecológicos.
Las hormigas (Hymenoptera: Formicidae) son abundantes y diversas, constituyendo un grupo importante desde el punto de vista ecológico, como indicadoras de cambios ocasionados por influencia humana o por agentes naturales en los ecosistemas (Andersen, 1997; Brown, 1997; Alonso y Agosti, 2000; Andersen et al., 2002) e incluso como indicadoras de diversidad (Armbrecht y Ulloa-Chacón, 2003). Han sido estudiadas en el trópico americano con énfasis en su relación con los sistemas agrícolas (Perfecto y Vandermeer, 2002; Armbrecht et al., 2005; Chanatásig-Vaca et al., 2011). Los resultados han demostrado su potencial uso como indicadoras en el monitoreo ecológico (Nascimento et al., 2007; Fontalvo-Rodríguez y Solís-Medina, 2009). El estudio del efecto de las perturbaciones humanas o naturales sobre las comunidades de hormigas está consolidando herramientas de monitoreo biológico de utilidad práctica (Brown, 1997; Ribera y Foster, 1997). Una ventaja de este grupo proviene de la facilidad de su captura, de los avances en la identificación y clasificación taxonómica de las especies tropicales de América, de la disponibilidad de claves y de información sobre algunos aspectos de su distribución, grupos funcionales, ecología y etología (Rodríguez-Garza, 1998; Philpott y Armbrecht, 2005; Rivera y Armbrecht, 2005; Rodrigues et al., 2011). Todos estos atributos caracterizan a un indicador ecológico robusto (Spellerberg, 1995).
Los trabajos de investigación que han estudiado la mirmecofauna de Tabasco, México son: el de Rojas-Fernández (1996) que lista 36 especies, el de Del Toro et al. (2009) que mencionan 138 especies para selvas del estado y el de Vásquez-Bolaños (2011) que registra 144 especies. Entre los trabajos más relevantes están las claves elaboradas por MacKay y Vinson (1989) y MacKay y MacKay (1989) y los trabajos de Vásquez-Bolaños (2007a, b), Cupul-Magaña (2009) y Vásquez-Bolaños y Meza-López (2011).
El objetivo de este estudio es evaluar las comunidades de hormigas en 3 zonas consideradas por la Conabio (2009) como prioritarias para los objetivos de conservación de la biodiversidad dentro del Corredor Biológico Mesoamericano, enfocada particularmente en 2 sistemas agroforestales que dominan la matriz pecuaria en Tabasco. Este tipo de elementos del paisaje pueden servir de refugio para hormigas nativas y potencialmente ser usados como corredores dentro de las zonas de estudio, aspectos que aún permanecen sin investigar. La mirmecofauna se estudió comparando cuantitativamente la riqueza, abundancia y distribución de las especies asociadas con los sistemas de manejo agroforestal denominados árboles dispersos en potreros (ADP) y árboles en linderos (AL), característicos del área de establecimiento del CBM en el estado. Se analizaron índices ecológicos (riqueza de especies, de diversidad Shannon-Wiener, dominancia de Simpson y equitatividad de Pielou) y la composición de especies. El análisis de agrupamiento por el método de pares de medias no ponderadas (UPGMA) de los ambientes agroforestales en función de la composición de las especies registradas en cada ambiente, se hizo considerando las 3 regiones prioritarias seleccionadas.
Materiales y métodos
Zonas de estudio. El estudio incluye 3 zonas del estado de Tabasco, ubicados en sitios seleccionados como prioritarios para la conservación biológica (Arriaga et al., 2000; Conabio, 2009). Dichos sitios cuentan aún con importantes remanentes de bosques nativos, están dentro de los municipios de Huimanguillo (lomerío bajo, 2 sitios), Tacotalpa y Tenosique (sierra, 2 sitios cada uno) (Fig. 1). En el Cuadro 1 se muestra la información resumida de las zonas de estudio. La vegetación original era bosque tropical lluvioso. El relieve en las zonas va desde el nivel del mar hasta los 700 m snm, con clima cálido y húmedo con precipitaciones de 2 000 a 4 000 mm anuales y temperatura media anual superior a los 24° C (Sedespa, 2006). Diseño de muestreo. El estudio de la mirmecofauna se hizo en el 2011, durante los periodos de estación seca (abril-junio) y de lluvias (julio-octubre). Tres municipios (Huimanguillo, Tacotalpa y Tenosique) constituyeron las zonas de estudio, dentro de las cuales y para cada una fueron seleccionadas 2 comunidades como áreas piloto de monitoreo para mirmecofauna dentro del CBM en Tabasco (Conabio, 2009). En cada comunidad, se buscaron 4 fincas o parcelas (excepto en Villa Luz, Tacotalpa con sólo 2 parcelas), cuyos propietarios accedieran a permitir el ingreso del observador y que además contuviesen al menos un sistema de manejo agroforestal, principalmente AL y ADP. En total, se realizó el muestreo de hormigas en 22 parcelas. Se tomaron datos sobre las variables ambientales humedad relativa (%) y temperatura diurna (°C), ambas con un termo-higrómetro Steiner, así como la altitud sobre el nivel del mar (m) mediante un altímetro-barómetro Casio Forester FTS-100. Para caracterizar la estructura de la vegetación de las unidades de paisaje, se establecieron parcelas permanentes de 250 m2 cada una en cada finca. Las variables estructurales fueron área basal (m2/ha), calculada a partir de los diámetros a la altura del pecho del arbolado, medidos con cinta diamétrica; altura del fuste a la primera rama (m), medido con clinómetro Suunto y densidad de árboles con d.a.p. ≥ 5 cm (individuos/ha). El Cuadro 2 resume las características ambientales de cada sistema agroforestal estudiado.

Se establecieron 840 trampas de caída, con agua y jabón detergente como solución letal y con fenol como preservante. Las trampas fueron vasos plásticos con 10 cm de diámetro y 13 cm de profundidad. Se usaron 420 trampas en la época seca y 420 en la lluviosa. De estas trampas, 160 fueron ubicadas por estación en Huimanguillo, 140 en Tacotalpa y 120 en Tenosique. En cada sistema, se establecieron 10 trampas por parcela a lo largo de un transecto y separadas entre sí por al menos 6 m. Las trampas de caída permiten comparar, mediante técnicas multivariadas, si hay cambios en la composición de especies entre muchos sitios o ambientes muestreados, siempre que el esfuerzo de recolecta tenga la suficiente intensidad o tamaño (Dufrene y Legendre, 1997). Cada ejemplar fue retirado diariamente de las trampas y depositado en un frasco con alcohol al 70% debidamente etiquetado indicando su procedencia, para luego ser llevado al laboratorio donde se determinaron las morfoespecies. Identificación. Las morfoespecies y subfamilias se identificaron con las claves de MacKay y MacKay (1989), los géneros con las de Escalante-Jiménez et al. (2006) y páginas especializadas en Internet, especialmente AntWeb (2012). Aquellas especies muy semejantes, pero que tuvieron caracteres no coincidentes o dudosos, se distinguieron con el término affinis (Rodríguez-Garza, 1998).
Acumulación de especies. Se estimaron los valores del índice Chao1 como el mejor estimador, basado en la abundancia de las especies, para los valores esperados de hormigas bajo el esfuerzo de muestreo realizado por cada región y sistema agroforestal. Para el trazado de las curvas de acumulación se utilizaron los valores del índice de Coleman. Los valores para ambos índices fueron obtenidos mediante el programa EstimateS 7.5.2 (Colwell, 1997). Diversidad alfa. Se calcularon los índices de diversidad de Shannon-Wiener (H'), dominancia de Simpson (D) y equitatividad de Pielou (J) para las comunidades de hormigas de cada unidad (Pérez et al., 2007). Todos los índices se calcularon utilizando PAST 2.13 (Hammer et al., 2001).
Diversidad beta. Adicionalmente se aplicó el análisis por cúmulos con el método de agrupamiento por pares de medias no ponderadas (UPGMA), usando como distancia el índice Bray-Curtis (Zuur et al., 2007), para determinar agrupamientos de las comunidades por estación o zona fisiográfica y en función de los sistemas agroforestales estudiados, obteniendo así la magnitud de las similitudes o disimilitudes entre ensambles de cada zona o sistema respecto a las demás. El análisis de similitud (ANOSIM) y el de similitud porcentual (SIMPER) fueron realizados para comprobar si las diferencias entre las comunidades de hormigas para cada sistema en función de la región fisiográfica resultaban significativas. Para estos análisis se utilizó el programa PRIMER 5.2.8 (Clarke y Gorley, 2006).
Especies indicadoras. La identificación de especies indicadoras para cada tipo de sistema agroforestal se realizó mediante el método de valor indicador individual o IndVal, propuesto por Dufrene y Legendre (1997). Se trató de determinar si algunas especies se asociaban con un sistema particular de manejo agroforestal o no. Para ello, se consideró que una especie era indicadora de un sistema o hábitat agroforestal cuando presentara un valor mínimo de 70% con una probabilidad de error menor a 0.05 (McGeoch et al., 2002). Para los cálculos se utilizaron los datos de abundancia.
Resultados
Se recolectaron 52 792 especímenes de 131 especies de hormigas, incluidas en 7 subfamilias (Dolichoderinae, Ecitoninae, Ectatomminae, Formicinae, Myrmicinae, Ponerinae y Pseudomirmecinae). La subfamilia predominante, tanto por la cantidad de especies como de individuos, fue Myrmicinae (58 especies, 50 196 individuos), seguida de Dolichoderinae (11, especies, 1 585 individuos), Ponerinae (20 especies, 328 individuos), Formicinae (22 especies, 301 individuos), Ectatomminae (4 especies, 223 individuos), Ecitoninae (3 especies, 49 individuos) y Pseudomyrmecinae (14 especies, 110 individuos). Se registraron 44 géneros de hormigas en total (Cuadro 3). Un total de 32 especies conforman un grupo de hormigas que constituyen nuevos registros para Tabasco, además de 11 especies identificadas hasta género y 7 catalogadas como affinis, pero aún no determinadas con certeza. Destaca por su rareza Belonopelta deletrix, una especie depredadora que es un nuevo registro para Tabasco. Además se identificaron: Adelomyrmex foveolatus*, Anochetus bispinosus*, Camponotus senex, Cardiocondyla emeryi, C. minutior, Dolichoderus curvilobus*, Dorymyrmex flavus, D. pyramicus, Ectatomma gibbum*, Forelius mccooki, Linepithema iniquum, Messor pergandei, Monomorium pharaonis, Mycetosoritis vinsoni, Mycocepurus tardus*, Neivamyrmex opacithorax, Pheidole absurda, P. ajax*, P. alfaroi*, Odontomachus chelifer, Rogeria innotabilis, Trachymyrmex intermedius y T. carinatus. Las especies affinis fueron: Apterostigma aff. auriculatus, Camponotus aff. floridanus, C. aff. ligniperdus, C. aff. ochreatus, Cardiocondyla aff. nuda, Hypoponera aff. eduardi, Myrmica aff. rubra y Strumigenys aff. membranifera (las especies marcadas con asteriscos son posibles registros nuevos para México).
Acumulación de especies. Los resultados de la evaluación de la relación entre el esfuerzo de muestreo (número de trampas de caída) y la cantidad de especies registradas, demuestran que para los sistemas agroforestales se obtuvieron valores desde el 75% en el caso de aquellos de ADP (Huimanguillo 83%, Tacotalpa y Tenosique 75%; Fig. 2). Por otro lado, en el caso de AL (Fig. 3), se observó que la eficiencia de muestreo fue menor para 2 regiones (Huimanguillo 66% y Tenosique 69%), lo que significa que aún faltaba una proporción importante de la mirmecofauna por registrar. No obstante, el esfuerzo de muestreo resultó altamente efectivo para Tacotalpa, donde se obtuvo el 96% de las especies de hormigas esperadas según el índice Chao1.


Diversidad alfa. Los sistemas agroforestales con ADP estudiados en las 3 regiones presentaron riquezas de especies desde 10-27 especies en Tenosique, 14-23 en Tacotalpa y 10-29 en Huimanguillo. Para AL se obtuvieron registros desde 17-32 especies en Huimanguillo, 16-26 en Tacotalpa y 13-26 en Tenosique. Los índices ecológicos muestran comunidades con diversidad baja (H< 1.8; Cuadro 4). En promedio, las comunidades de hormigas asociadas con los distintos sistemas agroforestales, independientemente de la región, resultaron distribuidas de manera no equitativa (J< 0.8) y con valores que indican la presencia de especies dominantes (D≥ 0.2; Cuadro 4), aunque en todas las regiones hay algunos sistemas que muestran mejores estados respecto a sus comunidades de hormigas.
Diversidad beta. De las 131 especies registradas, 88 fueron recolectadas en la zona de lomeríos bajos (Huimanguillo), 71 en la sierra de Tacotalpa y 85 en la sierra de Tenosique. La diversidad estimada para la mirmecofauna en la región de Huimanguillo resultó la más baja (H'= 0.84), seguida por Tacotalpa (H'= 1.39), mientras que Tenosique alcanzó un valor de H'= 2.29. La dominancia al nivel de región fisiográfica resultó muy alta en Huimanguillo (D= 0.71) y Tacotalpa (D= 0.44), mientras Tenosique, aunque presentó el valor menor (D≤ 0.18), todavía presentó evidencia de que algunas especies predominan. Correspondientemente, la equitatividad resultó con valores de menos a más para Huimanguillo (J= 0.19), Tacotalpa (J= 0.33) y Tenosique (J= 0.52), respectivamente (Cuadro 4).
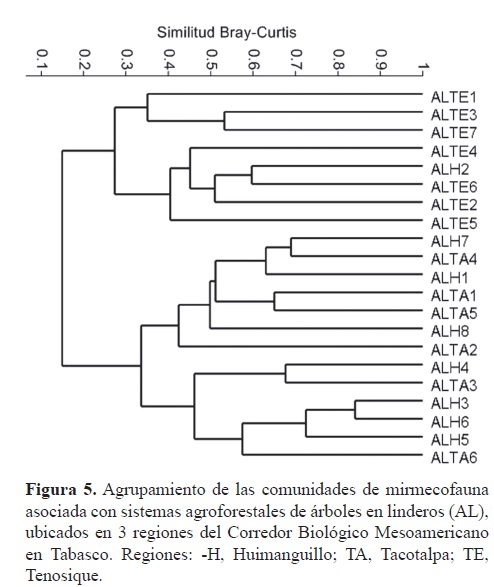
Con los sistemas agroforestales por cada zona, se pudo determinar que las comunidades de hormigas en los ADP en Huimanguillo, Tacotalpa y Tenosique resultan con una distribución heterógenea en su composición de especies, algunas unidades de los 3 municipios se asemejan en más del 50%, pero otras se separan con una disimilitud superior al 70% según el análisis UPGMA (Fig. 4). Las comunidades presentes en AL de Tacotalpa y Huimanguillo tienden a formar un grupo muy heterogéneo con algunas réplicas próximas en su composición de especies y otras no, pero en ambos casos mantienen la distancia de las comunidades presentes en los sistemas agroforestales de Tenosique, que tienden a agruparse aún con una amplia variación de arreglos que representan distanciamientos mayores entre algunas unidades respecto a otras, pero con otras muy cercanas entre sí (Fig. 5). El ANOSIM mostró que hay diferencias entre las comunidades de hormigas de los sistemas de árboles dispersos en los potreros de las regiones bajo estudio (R= 0.4, p= 0.01) debido a la diferencia entre los sistemas de Huimanguillo respecto a los de Tenosique (R= 0.6, p= 0.02). Entre Huimanguillo y Tacotalpa no hubo diferencias (R< 0.3, p < 0.05).

Según el SIMPER, la especie que más aporta a la diferencia entre las comunidades de hormigas asociadas con ADP fue Solenopsis geminata, en un gradiente de abundancia que va desde el mayor registro de individuos en Huimanguillo (2 089 ejemplares), seguido por Tacotalpa (818) hasta el menor en Tenosique (140).
Las diferencias resultan mayores cuando se analiza la mirmecofauna asociada con AL (R= 0.5, p= 0.01). Huimanguillo y Tacotalpa resultaron similares entre sí (R= 0.05, p= 0.25), mientras difirieron de las comunidades de hormigas registradas para Tenosique (R= 0.7, p= 0.01).
Para los AL, se encontró que la mayor distinción entre regiones fisiográficas es provocada por la predominante S. geminata, que nuevamente se presentó en un gradiente de abundancias con el mayor registro en AL en Tacotalpa (1 346 individuos), seguido por Huimanguillo (1 054) y Tenosique con el menor registro (51). Especies indicadoras. No se identificaron especies indicadoras asociadas con ninguno de los sistemas agroforestales estudiados. Aún cuando se presentaron valores de IndVal mayores a 70%, las asignaciones probabilísticas correspondientes en cada caso resultaron mayores al valor crítico de 0.05, considerado como límite máximo para aceptar que una especie está significativa y consistentemente ligada a una condición de hábitat particular.
Discusión
Diversidad alfa. Las comunidades de hormigas demuestran que la riqueza de especies varía mucho entre cada sistema, lo mismo que los demás índices utilizados para describir la mirmecofauna asociada con los distintos sistemas agroforestales. La riqueza de especies registrada en los 2 principales sistemas agroforestales evaluados, AL y ADP, superan las 50 especies. Estos valores superan al registro de 36 especies de Rojas-Fernández (1996) para todo Tabasco, así como las 37 morfoespecies reportadas por Chanatásig-Vaca et al. (2011) en huertos familiares de Tikinmul, Campeche.
Para géneros y subfamilias, los resultados superan a los de Díaz et al. (2009), quienes registraron 27 géneros en bosques secos de Colombia contra 44 encontrados en los sistemas agroforestales de Tabasco, coincidiendo en el número de subfamilias, 7 en ambos casos, y con el hecho de que la subfamilia Myrmicinae fue predominante. Este último dato es consistente con el comportamiento de Myrmicinae, en general para diferentes ambientes estudiados (Quiroz-Robledo y Valenzuela-González 1995; Agosti et al., 2000; Rocha-Ortega, 2009). La mayor riqueza encontrada en un sistema agroforestal (71 especies en AL de Huimanguillo) iguala al valor encontrado por Fontalvo-Rodríguez y Solís-Medina (2009) en bosques de La Guajira, Colombia. Por tanto, los resultados constituyen una evidencia del gran valor que los sistemas agroforestales tienen como estrategias agropecuarias compatibles con los objetivos del establecimiento de corredores biológicos dentro del paisaje del estado.
Los índices de diversidad en las unidades del paisaje en nuestro estudio (H'≤ 1.8) fueron bajos, e incluso muy bajos (Ramírez, 2006). Contrastando estos valores con los referidos a bosques tropicales secos (H'≥ 2.91) estudiados por Fontalvo-Rodríguez y Solís-Medina (2009), se puede considerar que aún cuando la riqueza de especies de hormigas en los sistemas agroforestales de Tabasco es alta, otros aspectos ecológicos importantes han sido afectados por el cambio de uso de suelo y la pérdida del hábitat original de bosque en Tabasco. La presencia de especies dominantes y oportunistas como Solenopsis geminata son indicadores de deterioro ambiental. No obstante, la existencia de los sistemas agroforestales puede haber mitigado un daño mayor a la biota de hormigas del territorio tabasqueño.
Diversidad beta. La riqueza de especies por zona fisiográfica (≥ 60) puede considerarse media, al compararla con los registros para Tabasco de Del Toro et al. (2009) y que alcanzan las 138 especies. No obstante, la totalidad de las especies encontradas en el presente estudio, además de ser próxima al más reciente registro de 144 especies identificadas para el estado (Vásquez-Bolaños, 2011), es cercano a las 135 de Los Tuxtlas, Veracruz (Rocha-Ortega, 2009) y superior al registro de 106 especies para los agroecosistemas cafeteros y de bosque mesófilo de Veracruz (Valenzuela-González et al., 2008), además de que se reportan nuevos taxones para Tabasco. Esto permite destacar el aporte tan importante que los sistemas agroforestales brindan a la conservación, en el contexto de conversión agropecuaria extensivo que ha sufrido el territorio. Estos sistemas parecen funcionar como refugios para la mirmecofauna remanente. La mayor riqueza de especies que se presenta en la matriz agropecuaria respecto a los ecosistemas de referencia ecológica (selvas o bosques) ya había sido documentada en Tabasco por González-Valdivia (2010) y González-Valdivia et al. (2010, 2011, 2012a, b) para otros grupos biológicos (gasterópodos, mariposas, aves y árboles) estudiados en un paisaje de la sierra en Tenosique. Estos autores y otros como Beier y Noss (1998) o Vandermeer y Perfecto (2007) aseguran que la conservación de la biodiversidad es posible si se mantiene un equilibrio entre las superficies de ecosistemas bajo protección y las áreas con uso diversificado, donde el componente forestal sea un elemento característico e intensivo que facilite el flujo biológico.
La composición de especies entre zonas difiere y la similitud entre Huimanguillo y Tacotalpa resulta tan interesante como su separación o diferencia respecto a Tenosique. La posible respuesta se encuentra en las afinidades y proximidad geográfica de las 2 primeras, las cuales colindan una con la otra y posiblemente intercambian más componentes biológicos que los que podrían compartir con la zona de Tenosique, más alejada. Tenosique como provincia biológica parece más cercana al bloque bioecológico compuesto por los macizos de El Petén, Guatemala y la selva lacandona en Chiapas, México.
La mirmecofauna detectada en el estudio de los sistemas agroforestales demuestra que estas prácticas de manejo pueden, al menos parcialmente, mejorar las capacidades de conservación de la mesofauna en la matriz del paisaje del estado de Tabasco. Por tanto, estas estrategias productivas pueden ser incorporadas y fomentadas en el marco del establecimiento del Corredor Biológico Mesoamericano en Tabasco. No obstante que no se detectaron especies indicadoras asociadas con una estrategia agroforestal, se pudo demostrar que las hormigas pueden indicar el efecto del cambio de uso de suelo al presentarse cambios en la equitatividad y la dominancia de las especies que componen las comunidades por zona y por sistema. La predominancia de especies que prefieren hábitats modificados y abiertos como S. geminata y la escasa presencia de individuos pertenecientes a otros taxones, invitan a reflexionar y a considerar que el equilibrio entre la superficie bajo uso activo y aquella bajo regímenes de protección, deben estudiarse en detalle para maximizar los objetivos del CBM en Tabasco.
Agradecimientos
A los campesinos de las comunidades visitadas en Tabasco, por permitir el acceso a sus parcelas. A Isidro Pérez Hernández por su apoyo en campo. A ECOSUR por las facilidades humanas, científicas, de infraestructura y logísticas; a FOMIX-CONACYT que posibilitó la realización de este trabajo mediante el proyecto "Aplicación del conocimiento agroforestal para la definición de una metodología para la implementación del corredor biológico mesoamericano en Tabasco" FOMIX-CONACYT TAB-2009-C16-122516. A UCATSE, por favorecer estos estudios en el país. A los revisores, que con sus aportes hicieron posible mejorar sustancialmente éste artículo.
Literatura citada
Agosti, D., J. D. Majer, L. E. Alonso y T. R. Schultz. 2000. Ants: standard methods for measuring and monitoring biodiversity. Smithsonian Institution Press, Washington, D. C. 304 p. [ Links ]
Alonso, L. E. y D. Agosti. 2000. Biodiversity studies, monitoring and ants: an overview. In Ants: standard methods for measuring and monitoring biodiversity, D. Agosti, J. D. Majer, L. E. Alonso y T. R. Schultz (eds.). Smithsonian Institution Press, Washington, D. C. p. 1-8. [ Links ]
Armbrecht, I., L. Rivera e I. Perfecto. 2005. Reduced diversity and complexity in leaf-litter ant assemblage of Colombian coffee plantations. Conservation Biology 19:897-907. [ Links ]
Armbrecht, I. y P. Ulloa-Chacón. 2003. The little fire ant Wasmannia auropunctata (Roger) (Hymenoptera: Formicidae) as a diversity indicator of ants in tropical dry forest fragments of Colombia. Environmental Entomology 32:542-547. [ Links ]
Andersen, A. N. 1997. Using ants as bioindicators: multiscale issues in ant community ecology. Conservation Ecology [online] 1(1):8. http://www.consecol.org/vol1/iss1/art8/; última consulta: 06.VII.2012. [ Links ]
Andersen, A. N., B. D. Hoffmann, W. J. Müller y A. D. Griffiths. 2002. Using ants as bioindicators in land management: symplifying assessment of ant community responses. Journal of Applied Ecology 39:8-17. [ Links ]
AntWeb. The California Academy of Sciences. 2012. http://www.antweb.org; última consulta: 26.I.2012. [ Links ]
Arriaga, L., J. M. Espinosa, C. Aguilar, E. Martínez, L. Gómez y E. Loa. 2000. Regiones terrestres prioritarias de México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México, D. F. 563-566 p. [ Links ]
Beier, P. y R. F. Noss. 1998. Do habitat corridors provide connectivity? Conservation Biology 12:1241-1252. [ Links ]
Brown, K. 1997. Diversity, disturbance, and sustainable use of Neotropical forests: insects as indicators for conservation monitoring. Journal of Insect Conservation 1:25-42. [ Links ]
Chanatásig-Vaca, C. I., E. Huerta-Lwanga, P. Rojas-Fernández, A. Ponce-Mendoza, J. Mendoza-Vega, A. Moron-Ríos, H. Van der Wal y B. B. Dzib-Castillo. 2011. Efecto del uso del suelo en las hormigas (Formicidae: Hymenoptera) de Tikinmul, Campeche, México. Acta Zoológica Mexicana (nueva serie) 27:441-461. [ Links ]
Clarke, K. R. y R. N. Gorley. 2006. PRIMER v6: User Manual/ Tutorial. PRIMER-E, Plymouth. [ Links ] Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). 2009. Ampliación del Corredor Biológico Mesoamericano-México, en los estados de Tabasco, Oaxaca y Veracruz. Conabio, México D. F., México. [ Links ]
Colwell, R. K. 2008. EstimateS: Statistical estimation of species richness and shared species from samples. Version 7.5.2. University of Connecticut. http://www.viceroy.eeb.uconn.edu/estimates; última consulta: 25.II.2012. [ Links ]
Cupul-Magaña, A. 2009. Primera observación del comportamiento defensivo por muerte simulada de la hormiga Ectatomma ruidum (Roger, 1861) (Formicidae: Ponerinae). Acta Zoológica Mexicana (nueva serie) 25:199-201. [ Links ]
Del Toro, I., M. Vázquez, W. P. MacKay, P. Rojas y R. Zapata-Mata. 2009. Hormigas (Hymenoptera: Formicidae) de Tabasco: explorando la diversidad de la mirmecofauna de las selvas tropicales de baja altitud. Dugesiana 16:1-14. [ Links ]
Díaz, J. A., C. E. Molano y J. C. Gaviria. 2009. Diversidad genérica de hormigas (Hymenoptera: Formicidae) en ambientes de bosque seco de los Montes de María, Sucre, Colombia. Revista Colombiana de Ciencia Animal 1:279-285. [ Links ]
Domínguez-Cervantes, E. 2009. Conectividad biológica y social: zonas de influencia de las áreas naturales protegidas. Corredor Biológico Mesoamericano, México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Serie Conocimientos 5. México, D. F. 134 p. [ Links ]
Dufrene, M. y P. Legendre. 1997. Species assemblages and indicator species: the need for a flexible symmetrical approach. Ecological Monographs 67:345-366. [ Links ]
Escalante-Jiménez, A. L., J. Ponce-Saavedra y M. Vásquez-Bolaños. 2006. Géneros de hormigas (Hymenoptera: Formicidae) del Estado de Michoacán. Biológicas 8:80-101. [ Links ]
Fontalvo-Rodríguez, L. y C. Solís-Medina. 2009. Ensamblaje de hormigas (Hymenoptera: Formicidae) en fragmentos de bosque seco en el complejo carbonífero del Cerrejón (La Guajira, Colombia). Intropica 4:3-12. [ Links ]
González-Valdivia, N. A. 2010. Conservación de biodiversidad y sustentabilidad en un paisaje cultural del sureste mexicano. Tesis doctoral, El Colegio de la Frontera Sur, Tabasco. 236 p. [ Links ]
González-Valdivia N., S. Ochoa-Gaona, L. J. Rangel-Ruiz, J. Gamboa-Aguilar, C. Pozo, B. G. Ferguson, C. Kampichler, E. Cambranis, O. Lara, I. Pérez-Hernández y A. Ponce-Mendoza. 2010. Gasterópodos terrestres asociados a un paisaje agropecuario y a un referente ecológico en el Sureste de México. In Perspectivas en Malacología Mexicana, L. J. Rangel-Ruiz, J. Gamboa-Aguilar, S. L. Arriaga-Weiss y W. M. Contreras-Sánchez (eds.). Universidad Juárez Autónoma de Tabasco, Villahermosa, Tabasco. p. 90-122. [ Links ]
González-Valdivia, N., S. Ochoa-Gaona, C. Pozo, B.G. Ferguson, L. J. Rangel-Ruiz, S. L. Arriaga-Weiss, A. Ponce-Mendoza y C. Kampichler. 2011. Indicadores ecológicos de hábitat y biodiversidad: perspectiva multitaxonómica. Revista de Biología Tropical 59:1433-1451. [ Links ]
González-Valdivia, N., S. Ochoa-Gaona, B. G. Ferguson, C. Pozo, C. Kampichler e I. Pérez-Hernández. 2012a. Análisis comparativo de la estructura, diversidad y composición de comunidades arbóreas de un paisaje agropecuario en Tabasco, México. Revista Mexicana de Biodiversidad 83:83-99. [ Links ]
González-Valdivia, N. A., S. Ochoa-Gaona, S. L. Arriaga-Weiss, B. G. Ferguson, C. Kampichler y C. Pozo. 2012b. Ensambles de aves diurnas a través de un gradiente de perturbación en un paisaje cultural en el Sureste de México. Acta Zoológica Mexicana (nueva serie) 28:237-269. [ Links ]
Hammer, Ø., D. Harper y P. Ryan. 2001. Past: Paleontological Statistics Software Package for education and data analysis. Paleontología Electrónica 4:1-9 p. http://palaeo-electronica.org/2001_1/past/issue1_01.htm; última consulta: 18.III.2012. [ Links ]
IEG-WB (Independent Evaluation Group-World Bank). 2011. Análisis de programa regional: el Corredor Biológico Mesoamericano. Banco Mundial, Análisis de Programa Regional 5, Washington D. C. 112 p. [ Links ]
Mackay, W. P. y E. Mackay. 1989. Clave de los géneros de hormigas en México (Hymenoptera: Formicidae). In Memorias del II Simposio Nacional de Insectos Sociales. Sociedad Mexicana de Entomología, Oaxtepec. 1-82 p. [ Links ]
MacKay, W. P. y S. P. Vinson. 1989. A guide to species identification of New World ants (Hymenoptera: Formicidae). Sociobiology 16:3-47. [ Links ]
McGeoch, M. A., B. J. Van Rensburg y A. Botes. 2002. The verification and application of bioindicators: a case study of duna beetles in a savanna ecosystem. Journal of Applied Ecology 39:661-672. [ Links ]
Nascimento, I. C., S. Campiolo y J. H. C. Delabie. 2007. Testando o índice "Valor indicador individual" de Dufrene y Legendre sobre uma grande série de dados de formigas da serapilheira do sudeste da Bahía. Biologico 69:49-52. [ Links ]
Philpott, S. C. e I. Armbrecht. 2005. Biodiversity in tropical agroforest and the ecological role of ants and ant diversity in predator function. Ecological Entomology 31:369-377. [ Links ]
Pérez, M., M. Sotelo, I. Siria, R. Alkemade y L. Aburto. 2007. Developing a species based model for biodiversity assessment in an agricultural landscape in Nicaragua. Gaia 8:1-54. [ Links ]
Perfecto, I. y J. Vandermeer. 2002. Quality of agroecological matrix in a tropical montane landscape: ants in coffee plantations in southern Mexico. Conservation Biology 16:174-182. [ Links ]
Quiroz-Robledo, L. y J. Valenzuela-González. 1995. A comparison of ground ant communities in a tropical rainforest and adjacent grassland in "Los Tuxtlas", Veracruz, Mexico. Southwestern Entomologist 20:203-213. [ Links ]
Ramírez, A. 2006. Ecología: Métodos de muestreo y análisis de poblaciones y comunidades. Editorial Pontificia Universidad Javeriana, Bogotá. 273 p. [ Links ]
Ribera, I. y G. Foster. 1997. El uso de artrópodos como indicadores biológicos. Boletín de la Sociedad Entomológica Aragonesa 20:265-276. [ Links ]
Rivera, L. e I. Armbrecht. 2005. Diversidad de tres gremios de hormigas en cafetales de sombra, de sol y bosques de Risaralda. Revista Colombiana de Entomología 31:89-96. [ Links ]
Rocha-Ortega, M. 2009. Estructura de dos comunidades de insectos indicadores sobre un gradiente de perturbación y área en dos paisajes de la reserva de los Tuxtlas, Veracruz, México. Tesis maestría, Instituto de Ecología, A. C. Xalapa. 69 p. [ Links ]
Rodrigues, M. S., E. F. Vilela, D. O. Azevedo y R. R. Hora. 2011. Multiple queens in foundig colonies of the Neotropical ant Pachycondyla striata Smith (Formicidae: Ponerinae). Neotropical Entomology 40:293-299. [ Links ]
Rodríguez-Garza, J. A. 1998. Mirmecofauna de la reserva ecológica de San Felipe Bacalar. Informe final SNIB-Conabio-Proyecto G032, Universidad de Quintana Roo, Quintana Roo. [ Links ]
Rojas-Fernández, P. 1996. Formicidae (Hymenoptera). In Biodiversidad, taxonomía y biogeografía de México: hacia una síntesis de su conocimiento J. Llorente, A. García y E. González (eds.). UNAM, México, D. F. p. 483-500. [ Links ]
Sedespa (Secretaría de Desarrollo Social y Protección al Ambiente). 2006. Programa de ordenamiento ecológico del estado de Tabasco. Gobierno de Tabasco, Villahermosa, Tabasco. [ Links ]
Spellerberg, I. F. 2005. Monitoring ecological change. Cambridge. Cambridge. 391 p. [ Links ]
Valenzuela-González, J., L. Quiroz-Robledo y D. L. Martínez-Tlapa. 2008. Hormigas (Insecta: Hymenoptera: Formicidae). In Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación, R. H. Manson, V. Hernández-Ortíz, S. Gallina y K. Mehltreter (eds.). Instituto de Ecología (INECOL) e Instituto Nacional de Ecología (INE-SEMARNAT), Xalapa. p. 107-122. [ Links ]
Vandermeer, J. y I. Perfecto. 2007. The agricultural matrix and a future paradigm for conservation. Conservation Biology 21:274-277. [ Links ]
Vásquez-Bolaños, M. 2007a. Primer registro para San Luis Potosí y nuevos registros para Jalisco de Mycocepurus smithii (Forel, 1893) (Hymenoptera: Formicidae). Acta Zoológica Mexicana (nueva serie) 23:145-146. [ Links ]
Vásquez-Bolaños, M. 2007b. Una especie nueva del género Tetramorium Mayr (Hymenoptera: Formicidae) de Mascota, Jalisco, México. Dugesiana 14:93-97. [ Links ]
Vásquez-Bolaños, M. y A. Meza-López. 2011. Primer registro del género Anochetus Mayr, 1861 (Hymenoptera: Formicidae) para el estado de Jalisco, México. Acta Zoológica Mexicana (nueva serie) 27:887-889. [ Links ]
Zuur, A., E. Ieno y G. Smith. 2007. Analyzing ecological data. In Statistics for biology and health, M. Gail, K. Krickeberg, J. Samet, A. Tsiatis y W. Wong (eds.). Springer Science Business Media, Nueva York. p. 163-179. [ Links ]














