Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.83 n.3 México Sep. 2012
https://doi.org/10.7550/rmb.24851
Ecología
Perros ferales en la isla de Cedros, Baja California, México: una posible amenaza para los pinnípedos
Feral dogs at Isla de Cedros, Baja California, Mexico: a possible threat for pinnipeds
María Concepción García–Aguilar1,* y Juan Pablo Gallo–Reynoso2
1 Laboratorio de Ecología de Pinnípedos, Centro Interdisciplinario de Ciencias Marinas del Instituto Politécnico Nacional. Av. IPN s/n, C. P. 23096, La Paz, B. C. S., México; dirección actual: Departamento de Biología de la Conservación, Centro de Investigación Científica y de Educación Superior de Ensenada. Carretera Tijuana–Ensenada 3918, 22860 Ensenada, Baja California, México. *gaguilar@cicese.mx
2 Centro de Investigación en Alimentación y Desarrollo, Unidad Guaymas.Carretera a Varadero Nacional Km. 6.6, 85480 Guaymas, Sonora, México.
Recibido: 05 abril 2011.
Aceptado: 21 febrero 2012.
Resumen
La presencia de perros ferales (Canis lupus familiaris) en la isla de Cedros, Baja California, México, fue documentada hace más de 15 años. En el verano de 2009 e invierno 2009/2010, se realizaron 2 campañas de muestreo en la costa noreste de la isla para evaluar los hábitos alimentarios de los perros en las cercanías de las zonas de reproducción y descanso del lobo marino de California (Zalophus californianus) y del elefante marino del norte (Mirounga angustirostris). Los mamíferos constituyeron el grupo consumido más importante en la alimentación de los perros (85.4%). Los resultados de este estudio muestran que en la costa noreste de la isla de Cedros los perros se alimentan de pinnípedos: el elefante marino fue la especie que más se consumió, con el mayor porcentaje en ambas temporadas (43.3% en verano y 51.9% en invierno); el lobo marino, fue la segunda durante el verano (23.3%), aunque su porcentaje disminuyó en el invierno (5.8%). Además del potencial impacto que el consumo por los perros pueda tener sobre las poblaciones de los pinnípedos, una amenaza adicional es la posible transmisión de los patógenos caninos, con serias consecuencias epizoóticas.
Palabras clave: especies introducidas, cánidos, lobo marino de California, elefante marino del norte, dieta.
Abstract
The presence of feral dogs (Canis lupus familiaris) in Isla de Cedros, Baja California, Mexico, has been documented for over 15 years. In the summer of2009 and the winter of 2009/2010, 2 sampling surveys were conducted in the northeast coastal portion of the island to assess the diet of feral dogs in the vicinity of hauled out California sea lions (Zalophus californianus) and northern elephant seals (Mirounga angustirostris). Mammals were the most important prey group in the diet of dogs (85.4%). Our results show that in the northeast coast of Isla de Cedros, feral dogs feed on pinnipeds: the elephant seal was the most important prey in both seasons (43.3% in summer and 51.9% in winter), followed by the sea lion as the second most important prey during the summer (23.3%), while its importance decreased in the winter (5.8%). Besides the potential predatory activity, there is an important likelihood that pinnipeds could be infected by pathogens of dogs, with serious epizootic consequences.
Key words: introduced species, canids, California sea lion, northern elephant seal, diet.
Introducción
Los perros ferales (Canis lupus familiaris, Canidae) son depredadores oportunistas que pueden adquirir su alimento depredando sobre la fauna silvestre o consumiendo carroña. Su alimentación puede ser muy variada, aunque son relativamente pocas las especies que componen la mayor parte de su dieta (Mitchell y Banks, 2005). La presencia de los perros ferales en la isla de Cedros, Baja California, México, fue documentada hace más de 15 años (Mellink, 1993). Un estudio preliminar sobre la dieta de los perros de esta isla, realizado en 2005, señaló al lobo marino como la presa más común (Gallo–Reynoso y García–Aguilar, 2008). Sin embargo, debido a que el tamaño de la muestra analizada fue muy pequeño (n= 5), esos resultados no pueden considerarse como representativos de las preferencias alimentarias de los perros.
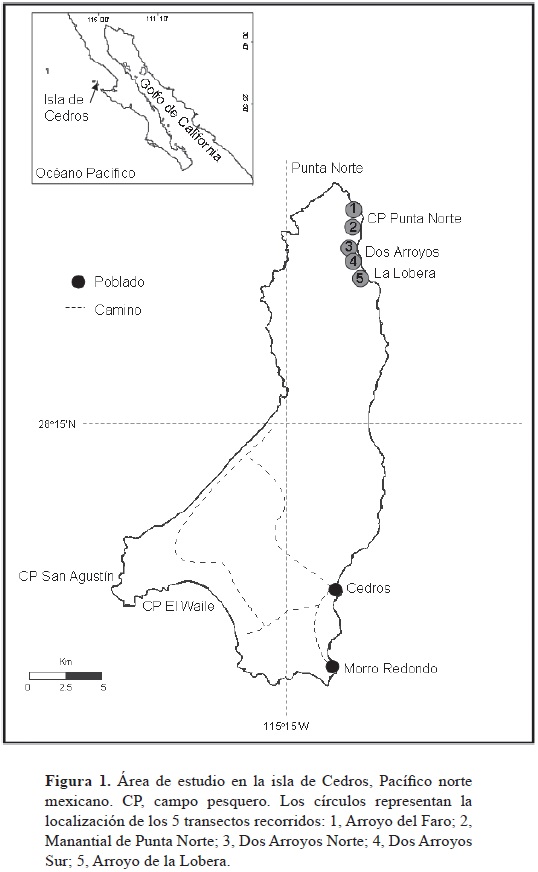
La isla de Cedros es la más grande del Pacífico norte mexicano y se localiza en la región central de la costa occidental de la península de Baja California, México, entre los 28°02'20"–28°22'55" N, 115°09'20"–115°21'55" O (Fig. 1). En la isla habitan 3 especies de pinnípedos (Le Boeuf et al., 1983; Reijnders et al., 1993, Stewart et al., 1994): el lobo marino de California (Zalophus californianus), el elefante marino del norte (Mirounga angustirostris) y la foca común (Phoca vitulina richardii).
El objetivo de este trabajo fue evaluar el uso de los pinnípedos en los hábitos alimentarios de los perros ferales en la isla de Cedros. El estudio se enfoca en el lobo marino de California y el elefante marino del norte, especies que se reproducen y descansan a lo largo de la costa noreste de la isla. Las focas no fueron consideradas porque, a partir de nuestras observaciones, al usar rocas aisladas e islotes, están fuera del alcance de los perros y no se ven afectadas.
Materiales y métodos
Se realizaron 2 campañas de muestreo en la costa noreste de la isla de Cedros durante las temporadas de reproducción de cada especie: en verano para el lobo marino y en invierno para el elefante marino (Le Boeuf et al., 1972; Odell, 1975). El muestreo de verano se realizó del 11 al 14 de agosto de 2009 y el de invierno del 4 al 7 de febrero de 2010.
El área de estudio comprendió las cercanías de las zonas de reproducción y descanso de los 2 pinnípedos seleccionados (Fig. 1). Los elefantes marinos se localizan en playas arenosas y de canto rodado, desde el sitio conocido como La Lobera (28°18'44" N, 115°10'54" O) hasta el campo pesquero de Punta Norte (28°21'21" N, 115°11'39" O). Por su parte, los lobos marinos se encuentran tanto en playas de canto rodado como en plataformas rocosas, desde el extremo norte del sitio conocido como Dos Arroyos (28°20'14" N, 115°11'47" O) hasta la Punta Norte (28°22'41" N, 115°13'03" O). Para recolectar el mayor número de excretas posibles, el área fue muestreada a través de 5 transectos (Fig. 1), recorriéndose un total de 8.10 km/campaña. La longitud de los transectos varió en función de las características de terreno, pero en ambas campañas se siguieron las mismas rutas que fueron georreferenciadas con un GPS (Magellan Triton 400).
Las excretas fueron procesadas en el laboratorio siguiendo protocolos establecidos (Reynolds y Aebischer, 1991). Para la obtención de los restos macroscópicos, las excretas se tamizaron (tamiz de ancho de malla 0.5mm) y los restos obtenidos se clasificaron y separaron para su identificación en 2 grupos: los provenientes de mamíferos y los de no mamíferos (i. e., aves, peces, invertebrados y semillas); la especie de mamífero o el grupo taxonómico se consideraron categorías de alimento. Los pelos recuperados se montaron en laminillas para la observación de las características internas (médula) y se obtuvieron impresiones cuticulares (escamas), siguiendo la técnica propuesta por Terrink (1991). Estas preparaciones se analizaron con un microscopio compuesto (Leica DMLS) con aumentos 10× y 40×, comparándolas con laminillas de referencia que se encuentran en el Laboratorio de Fauna Silvestre del Centro de Investigación Científica y de Educación Superior de Ensenada (CICESE) y con ejemplos en bibliografía especializada (Moore et al., 1974; Rodríguez de la Gala, 2002). Se calculó la frecuencia de aparición (FA) como la frecuencia total de una categoría de alimento consumido, dividida entre el número total de excretas, mientras que el porcentaje de presencia se estimó dividiendo la frecuencia de cada categoría de alimento consumido entre la suma de todas las frecuencias (Maher y Brady, 1986). Los valores de la diversidad de la dieta entre estaciones (verano e invierno) se compararon usando el índice de diversidad de Shannon–Weiner (Brower y Zar, 1984).
Resultados
Se colectaron y analizaron 52 excretas (16 en verano y 36 en invierno), de las cuales se identificaron 9 tipos de categoría de alimento entre los 2 grupos de mamíferos y no mamíferos (Cuadro 1). En ambas temporadas, los mamíferos fueron el grupo más importante en la alimentación de los perros (Cuadro 1), sin que la composición a nivel de grupo presentara una diferencia estadísticamente significativa entre el verano y el invierno (z= 0.53, g. l.= 1, p= 0.59).
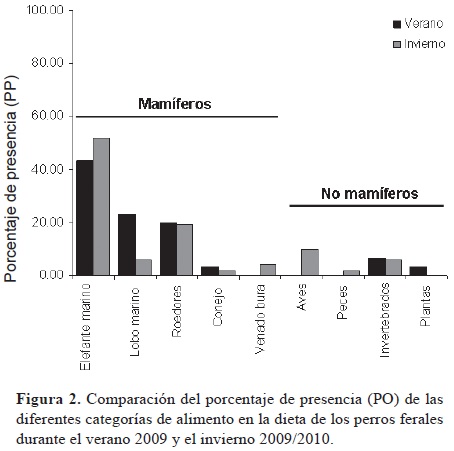
Las especies de mamíferos identificadas (categorías alimentarias) en el análisis de excretas incluyeron elefante marino del norte (M. angustirostris), lobo marino de California (Z. californianus), conejo matorralero (Sylvilagus bachmani cerrosensis) y venado bura (Odocoileus hemionus cerrosensis); a éstas se sumaron pelos de roedores que no pudieron ser identificados a nivel de especie, por lo que se presentan conjugados en una sola categoría (Cuadro 1). El elefante marino del norte fue la categoría de alimento que más se consumió en ambas temporadas, seguida por el lobo marino de California durante el verano, aunque la importancia de ésta última categoría disminuyó durante el invierno (Fig. 2). Los valores calculados para la diversidad de la dieta fueron similares entre estaciones (H'Verano= 0.62 y H'Invierno= 0.65).
Discusión
Los pinnípedos son especies gregarias que se reúnen en playas continentales aisladas o en islas para reproducirse y descansar (Bartholomew, 1970; Le Boeuf, 1978). Debido a sus adaptaciones morfológicas y funcionales para la vida acuática son altamente vulnerables y en especial las crías, al ataque por carnívoros depredadores terrestres. Este estudio muestra que en la isla de Cedros, los perros ferales tienen altos consumos de 2 especies de pinnípedos, el elefante marino del norte y el lobo marino de California, aunque no se pudo corroborar con observaciones in situ si los perros depredan activamente sobre estas especies o sólo se alimentan de cadáveres depositados en las playas.
Los perros ferales son los cánidos salvajes más ampliamente distribuidos en el mundo (Green y Gipson, 1994). Estudios realizados sobre su comportamiento alimentario han mostrado que generalmente buscan activamente su alimento, solos o en parejas y en áreas donde no existen otros mamíferos carnívoros pueden ser eficientes depredadores de la fauna nativa, particularmente de presas de menos de 50 kg de masa corporal (Kruuk y Snell, 1981; Butler et al., 2004).
En la isla de Cedros no hay mamíferos carnívoros nativos (Mellink, 1993) y los perros potencialmente pueden cazar crías de pinnípedos, ya que éstos últimos son una presa indefensa por su poca movilidad en tierra y adecuada para un cánido de talla mediana, como los perros ferales, cuyo tamaño es similar o un poco mayor al de los coyotes (Green y Gipson, 1994); de hecho, pescadores locales han referido este tipo de eventos de depredación (J. Arce, com. pers. abril, 2006; F. Ruelas, com. pers. febrero, 2010). El peso promedio de los neonatos de lobo marino es de 6 kg (García–Aguilar y Aurioles–Gamboa, 2003) y el de los neonatos de elefante marino es de 40 kg (Le Boeuf et al., 1989). El mayor porcentaje de presencia de estas 2 especies en la alimentación de los perros corresponde con la temporalidad de los nacimientos: en el verano para el lobo marino y en el invierno para el elefante marino. Sin embargo, también se encontraron restos de ambas especies en las excretas de los perros fuera de su temporada de reproducción, cuando los animales que se encuentran en las playas descansando (juveniles y adultos) son lo suficientemente grandes para evitar el ataque de los perros. Este resultado sugiere que los perros también podrían adquirir alimento de cadáveres de pinnípedos disponibles en las playas durante todo el año.
El análisis de materias fecales demostró que los perros se adentran en las playas, donde descansan y se reproducen los pinnípedos para conseguir alimento, sea en busca de sus cadáveres o cazándolos activamente, conforme a observaciones referidas por los lugareños. A la evidencia de que los perros consumen pinnípedos y de que éstos son una parte importante de su dieta, podría sumarse el posible riesgo de que les contagien sus patógenos a los pinnípedos, ya que los cánidos son reservorios de enfermedades como la difteria canina (Deem et al., 2000), la cual ha producido altas mortalidades en otros carnívoros silvestres, como es el caso del perro salvaje africano y el lobo de Etiopía (Woodroffe, 1999), o incluso en pinnípedos, como la foca del mar Caspio (Kuiken et al., 2006). Tanto el lobo marino como el elefante marino realizan movimientos migratorios a lo largo de la costa del Pacífico este (Brillinger y Stewart, 1998; Stern 2002), por lo que el contagio de enfermedades caninas a una sola colonia podría tener graves consecuencias para el resto de las poblaciones.
Desde el punto de vista de la conservación a largo plazo de estas especies de pinnípedos, se considera necesario, con base en este trabajo, desarrollar estudios sobre el comportamiento alimentario de los perros ferales que habitan en la isla de Cedros, así como sobre la incidencia de enfermedades infecciosas en ellos y la posible transmisión a los mamíferos marinos y en este sentido, también es indispensable monitorear el estado de salud de los pinnípedos, para inhibir o mitigar cualquier brote epizoótico que llegara a presentarse.
Agradecimientos
El trabajo de campo fue parcialmente financiado por la fundación Idea Wild y en colaboración con el área de Protección de Flora y Fauna "Valle de los Cirios" (CONANP). M. C. García–Aguilar contó con una beca posdoctoral del Consejo Nacional de Ciencia y Tecnología. Agradecemos a la Sociedad Cooperativa de Producción Pesquera "Pescadores Nacionales de Abulón" de isla de Cedros por el apoyo logístico y a E. Mellink, S. Rodríguez de la Gala y J. Luévano por la asistencia en el laboratorio. M. Lowry comentó la primera versión del manuscrito. El trabajo de campo se realizó con permiso del Gobierno de México (Of. Núm. SGPA/DGVS/00340/10).
Literatura citada
Bartholomew, G. A. 1970. A model for the evolution of pinniped polygyny. Evolution 24:546–559. [ Links ]
Brillinger, D. R. y B. S. Stewart. 1998. Elephant–seal movements: modeling migration. Canadian Journal of Statistics 26:431–443. [ Links ]
Brower, J. E. y J. H. Zar. 1984. Field and laboratory methods for general ecology. W. C. Brown Publishers, Dubuque. 226 p. [ Links ]
Butler, R. J. A., D. J. du Toit y J. Binham. 2004. Free–ranging domestic dogs (Canis familiaris) as predator and prey in rural Zimbabwe: threats of competition and disease to large wild carnivores. Biological Conservation 115:369–378. [ Links ]
Deem, S. L., L. H. Spelman, R. A. Yates y R. J. Montaldi. 2000. Canine distemper in terrestrial carnivores: a review. Journal of Zoo and Wildlife Medicine 33:441–452. [ Links ]
Gallo–Reynoso, J. P. y M. C. García–Aguilar. 2008. Análisis preliminar de la presencia de perros ferales en la isla de Cedros, Baja California. Revista Mexicana de Mastozoología 12:130–140. [ Links ]
García–Aguilar, M. C. y D. Aurioles–Gamboa. 2003. Cuidado materno del lobo marino de California en Los Islotes, Golfo de California. Ciencias Marinas 29:23–36. [ Links ]
Green, J. S. y P. S. Gipson. 1994. Feral dogs. In Prevention and control of wildlife damage, S. E. Hygnstrom, R. M. Timm y G. E. Larson (eds.). University of Nebraska Cooperative Extension Service, Lincoln, Nebraska. p. 77–81. [ Links ]
Kuiken, T., S. Kennedy, T. Barrett, M. W. G. van de Bildt, F. H. Borgsteede, S. D. Brew, G. A. Codd, C. Duck, R. Deaville, T. Eybatov, M. A. Forsyth, G. Foster, P. D. Jepson, A. Kydyrmanov, I. Mitrofanov, C. J. Ward, S. Wilson y A. D. M. E. Osterhaus. 2006. The 2000 canine distemper epidemic in Caspian seals (Phoca caspica): pathology and analysis of contributory factors. Veterinary Pathology 43:321–338. [ Links ]
Kruuk H. y H. Snell. 1981. Prey selection by feral dogs from a population of marine iguanas (Amblyrhynchus cristatus). Journal of Applied Ecology 18:197–204. [ Links ]
Le Boeuf, B. J. 1978. Social behavior in some marine and terrestrial carnivores. In Contrasts in behavior, B. S. Reese y F. J. Lighter (eds.). Wiley, Los Angeles. p. 251–279. [ Links ]
Le Boeuf, B. J., D. Aurioles–Gamboa, R. Condit, C. Fox, R. Gisiner, R. Romeo y F. Sinsel. 1983. Size and distribution of the California sea lion in Mexico. Proceedings of California Academic Science 43:77–85. [ Links ]
Le Boeuf, B. J., R. Condit y J. Reiter. 1989. Parental investment and the secondary sex ratio in northern elephant seals. Behavioral Ecology and Sociobiology 25:109–117. [ Links ]
Le Boeuf, B. J., R. J. Whiting y R. F. Grantt. 1972. Perinatal behavior of northern elephant seal females and their young. Behaviour 43:121–156. [ Links ]
Maher, D. S. y J. R. Brady. 1986. Foodhabits of the bobcat in Florida. Journal of Mammalogy 67:133–138. [ Links ]
Mellink, E. 1993. Biological conservation of Isla de Cedros, Baja California, México: assessing multiple threats. Biodiversity and Conservation 2:62–69. [ Links ]
Mitchell, B. y P. B. Banks. 2005. Do wild dogs exclude foxes? Evidence for competition from dietary and spatial overlap in the Greater Blue Mountains region of New South Wales. Austral Ecology 30:582–591. [ Links ]
Moore, T. D., L. E. Spence y C. E. Dugnolle. 1974. Identification of the dorsal guard hairs of some mammals of Wyoming. Wyoming Game and Fish Dept. Bull 14, Cheyenne. 77 p. [ Links ]
Odell, D. K. 1975. Breeding biology of the California sea lion, Zalophus californianus. Rapports et Procès–verbaux des Réunions Conseil International pour l'Exploration de la Mer 169:374–378. [ Links ]
Reijnders, P., S. Brasseur, J. van der Toorn, P. van der Wolf, I. Boyd, J. Harwood, D. Lavigne y L. Lowry. 1993. Seals, fur seals, sea lions, and walruses: status survey and conservation action plan. IUCN/SSC Seal Specialist Group, Gland. 88 p. [ Links ]
Reynolds, J. C. y N. J. Aebischer. 1991. Comparison and quantification of carnivore diet by faecal analysis: a critique, with recommendations, based on a study of the fox Vulpes vulpes. Mammal Review 21:97–122. [ Links ]
Rodríguez de la Gala, S. 2002. Catálogo del pelo de guardia de los mamíferos del estado de Baja California, México. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D. F. 88 p. [ Links ]
Stern, S. J. 2002. Migration and movement patterns. In Encyclopedia of marine mammals, W. F. Perrin, B. Würsig y J. G. M. Thewissen (eds.). Academic Press, San Diego, California. p. 742–748. [ Links ]
Stewart, B. S., P. K. Yochem, H. R. Huber, R. L. De Long, R. J. Jameson, W. J. Sydeman, S. G. Allen y B. J. Le Boeuf. 1994. History and present status of the northern elephant seals population. In Elephant seals: population ecology, behavior and physiology, B. J. Le Boeuf y R. M. Laws (eds.). University of California Press, Los Angeles. p. 29-48. [ Links ]
Terrink, B. J. 1991. Atlas and identification key: hair of west–European mammals. Cambridge Press, Cambridge. 224 p. [ Links ]
Woodroffe, R. 1999. Managing disease threats to wild animals. Animal Conservation 2:185–193. [ Links ]














