Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.83 no.3 México sep. 2012
https://doi.org/10.7550/rmb.21364
Ecología
Ocupación y abundancia de aves rapaces nocturnas (Strigidae) en la Reserva de la Biosfera Selva El Ocote, Chiapas, México
Occupancy and abundance of nocturnal raptors (Strigidae) in the Selva El Ocote Biosphere Reserve, Chiapas, Mexico
Emerenciano Rivera–Rivera1, Paula L. Enríquez1, Alejandro Flamenco–Sandoval2 y José Luis Rangel–Salazar1*
1 El Colegio de la Frontera Sur. Carretera Panamericana y Periférico Sur s/n, Apartado postal 63, 29290 San Cristóbal de Las Casas, Chiapas, México.*jlrangel@ecosur.mx
2 Laboratorio de Análisis de Información Geográfica y Estadística, El Colegio de la Frontera Sur. Carretera Panamericana y Periférico Sur s/n, Apartado postal 63, 29200 San Cristóbal de Las Casas, Chiapas, México.
Recibido: 25 noviembre 2010.
Aceptado: 22 febrero 2012.
Resumen
Evaluar la proporción de sitios ocupados explica la distribución espacial de los individuos dentro de una comunidad y es importante para desarrollar estrategias de conservación. En este estudio se evalúan los patrones de ocupación y abundancia de 5 especies de aves rapaces nocturnas en 2 sitios con diferentes niveles de heterogeneidad (estructura y composición del paisaje) en la Reserva de la Biosfera Selva El Ocote. Se utilizaron puntos de conteo y provocación auditiva para estimar índices de ocupación y abundancia y modelos lineales generalizados para determinar las posibles relaciones entre los índices estimados y los atributos estructurales del hábitat. La variación espacial de los patrones de ocupación y abundancia se explica por la estructura del hábitat (i.e., altura de árboles, área basal, distancia con asentamientos humanos y áreas abiertas) a escala local, y por la heterogeneidad (2 o más tipos de coberturas) en el paisaje. Dado que se encontraron relaciones especie–específicas con los atributos del bosque tropical perennifolio, es recomendable promover el manejo diversificado y sustentable del paisaje que favorezca la presencia de áreas extensas con cobertura forestal y por lo tanto la persistencia de especies amenazadas asociadas al interior del bosque.
Palabras clave: heterogeneidad, paisaje, hábitat óptimo, persistencia, especies.
Abstract
Evaluation of occupancy explains the spatial distribution of species in the community and is important to develop conservation strategies. We evaluated occupancy and abundance patterns of nocturnal raptors in 2 sites with different level of heterogeneity (landscape structure and composition) in the Selva El Ocote Biosphere Reserve. Through point counts and owl playback callings we estimate occupancy and abundance patterns. We explored possible relationships between patterns of recorded species and structural habitat attributes using generalized linear models. Occupancy and abundance spatial variation was explained by structural habitat characteristics (i.e., tree height, distance to human settlements and open areas) at local scale, and spatial heterogeneity (2 or more habitats) at landscape scale. We found species–specific relationships with old growth forest attributes, so we suggest a sustainable landscape management that promotes old growth forest conservation and thus persistence of threatened forest species.
Key words: heterogeneity, landscape, optimal habitat, persistence, species.
Introducción
La deforestación tropical extensiva y las actividades humanas asociadas (e.g., incendios, ganadería, agricultura, asentamientos) han promovido la creación de paisajes heterogéneos conformados por un mosaico de ambientes o "parches" con diferentes coberturas y usos del suelo. Los paisajes resultantes se caracterizan por contener fragmentos de vegetación remanente inmersos en una matriz de áreas con vegetación secundaria (acahuales), áreas abiertas para uso agropecuario y áreas con asentamientos humanos.
Estos paisajes varían en su composición (i.e., variedad y cantidad de ambientes) y configuración (i.e., arreglo espacial; Farina, 2000) y por lo tanto en su efecto sobre los patrones de ocupación (i.e. proporción de sitios ocupados; Mackenzie y Royle, 2005), abundancia y distribución de las especies silvestres. Estos efectos pueden ser positivos para especies generalistas con capacidad para utilizar varios ambientes y bordes (i.e., transición entre 2 tipos de coberturas) o negativos, si se trata de especies dependientes de hábitats específicos y sensibles a la perturbación humana (Thiollay, 1989).
La persistencia de las especies en paisajes heterogéneos dependerá principalmente de la disponibilidad y arreglo espacial de los hábitats óptimos (i.e., condiciones ambientales para el crecimiento, supervivencia y reproducción; Douglas, 1997). Paralelamente, los patrones de ocupación y abundancia dependerán en gran medida de los requerimientos particulares de hábitat y de la capacidad de los organismos para movilizarse y seleccionar los hábitats óptimos entre los elementos del paisaje circundante (Moilanen y Hanski, 1998). El proceso de selección de hábitat (i.e., intensidad en el uso de un recurso ambiental; Johnson, 1980) resulta crucial en la persistencia de una población en particular, debido al beneficio que genera la utilización de recursos adecuados en paisajes heterogéneos. Estos recursos proveen las condiciones ambientales dentro del intervalo de tolerancia de los organismos para sobrevivir y/o reproducirse (MacKenzie y Royle, 2005). No obstante, dentro de las comunidades ecológicas, el sobrelapamiento en distribución espacial, el tipo de hábitat preferido y las estrategias de forrajeo podrían ser la base para determinar relaciones interespecíficas (e.g., competencia y depredación), contribuyendo así, a la variación al seleccinar y ocupar el hábitat (Vrezec y Tome, 2004, Kissling et al., 2010).
Las aves rapaces nocturnas son importantes en la estructura y dinámica de las comunidades ecológicas debido a su función como depredadores tope en las cadenas tróficas (Sergio et al., 2008). Estas aves determinan los patrones estructurales de las comunidades de sus presas y controlan algunas plagas potenciales en cultivos agrícolas o en ambientes naturales (Bildstein, 2005). No obstante, por ser especies poco abundantes y con necesidad de territorios amplios, son vulnerables a cambios ambientales derivados de la perturbación antropogénica (Jullien y Thiollay, 1996). Aunque algunas especies toleran la perturbación y se benefician de la heterogeneidad del paisaje al encontrar una mayor variedad de recursos y condiciones propicias (Connell 1978; Ricklefs y Schluter, 1993; Rodríguez et al., 1998), la mayoría requieren de áreas boscosas naturales o plantaciones forestales para utilizarlas como sitios de reproducción, descanso y alimentación (Newton, 1979).
Las aves rapaces nocturnas neotropicales son difíciles de estudiar debido a sus bajas densidades, a su comportamiento nocturno y elusivo, y a las características ambientales de sus hábitats específicos (i.e. topografía, densidad de la vegetación, humedad). Por estos motivos, hay poca información referente a sus patrones de ocupación, abundancia, relaciones con el hábitat y respuesta a la perturbación antropogénica. Dado que la respuesta de las aves rapaces a la heterogeneidad ambiental puede ser variable, contexto dependiente y especie–específica (Sergio et al., 2008), resulta importante identificar los elementos ambientales y la estructura de parches del paisaje que puedan explicar la variación espacial de sus patrones de ocupación y abundancia. El reconocimiento de asociaciones específicas entre la presencia de las especies con atributos estructurales de hábitat y los elementos del paisaje es importante para proponer estrategias de conservación de las especies amenazadas, raras o dependientes de hábitats específicos. El objetivo principal de este estudio fue evaluar la variación espacial en los patrones de ocupación, abundancia y composición de 2 comunidades de aves rapaces nocturnas en 2 paisajes con diferente nivel de heterogeneidad espacial (estructura y composición de ambientes).
Materiales y métodos
Área de estudio. Este estudio se realizó de febrero a agosto de 2009 en la Reserva de la Biosfera Selva El Ocote (en adelante REBISO; 16°45'–17°09' N, 93°54'–93°21' O), que tiene una superficie aproximada de 101 288 ha y está localizada al noroeste del estado de Chiapas, México (Fig. 1). La REBISO se caracteriza por una gran heterogeneidad ambiental, atribuida a variaciones climáticas y topográficas, y presenta diferentes tipos de vegetación predominante: bosque tropical perennifolio, vegetación secundaria (acahuales), pastizal inducido y cultivos agrícolas. (Rzedowski, 2006). Los ambientes de la REBISO presentan variaciones altitudinales que van desde los 300 hasta los 1 450 m snm, con climas predominantes cálido húmedos, lluvias abundantes de mayo a septiembre (1 200 a 2 500 mm) y una temperatura media mensual superior a los 18° C (CONANP, 2001).
Se eligieron 2 sitios de estudio identificados por su variación en la heterogeneidad espacial y separados uno de otro por una distancia aproximada de 26 kilómetros: 1) sitio Emilio Rabasa, localizado en zona de amortiguamiento, y que se caracteriza por un mosaico de ambientes de bosque tropical perennifolio, acahuales, potreros para ganado bovino, cultivos agrícolas y asentamientos humanos (mayor información en Resultados–Análisis de paisaje), y 2) sitio El Encajonado, localizado en la zona núcleo I, con vegetación predominante de bosque tropical perennifolio y con un estado de conservación poco alterado, donde las actividades humanas son mínimas. Este sitio se encuentra asociado a un cuerpo de agua (Presa Netzahualcóyotl) y colinda con la zona de amortiguamiento donde se pueden encontrar cultivos agrícolas y asentamientos humanos. Cada sitio de estudio presentó una superficie aproximada de 23 km2, que es el promedio del área de acción de algunas rapaces nocturnas (Ganey et al., 2005).
Muestreo de las aves rapaces nocturnas. En los senderos existentes dentro de la REBISO se establecieron 3 trayectos lineales por sitio de estudio (N= 6), con una longitud de 2 km cada uno. La distancia mínima entre trayectos fue de 250 metros. Dentro de cada trayecto se ubicaron 8 puntos de conteo (N= 48 total) separados cada 250 metros. Se utilizó el método de puntos de conteo apoyado de la provocación auditiva (Fuller y Mosher, 1987), el cual consiste en emitir una vocalización pregrabada de la especie de interés con el fin de obtener respuesta y registrar la presencia de individuos. El alcance del sonido emitido por la bocina tuvo un promedio de 30 m con el máximo volumen; sin embargo, éste varió según las condiciones ambientales. Cada punto de conteo por trayecto fue muestreado mensualmente al anochecer durante 10 minutos, emitiendo al azar una vocalización pregrabada de 5 especies que podrían presentarse en los sitios de estudio (CONANP, 2001). El muestreo por trayecto lineal tuvo una duración de 4 horas (19:00 a 23:00 h); evitándose el viento fuerte y la lluvia intensa (Hardy y Morrison, 2000; Enríquez y Rangel–Salazar, 2001). Se contaron los individuos registrados por especie/noche de muestreo. La abundancia relativa total en los trayectos se estimó como la media mensual de individuos registrados por noche, entre el total de kilómetros recorridos (Núm. ind./km recorrido) por sitio. El índice de ocupación (v|/) por especie se obtuvo con base en los registros de presencia (1), o no presencia (0) en cada punto de muestreo para todas las especies registradas, y se calculó como la historia de encuentros por especie por punto de muestreo. Adicionalmente, se calculó el índice de probabilidad de detección (p, probabilidad de que un individuo sea registrado, estando presente en un punto de muestreo) para todas las especies registradas. La historia de encuentros por especie para estimar índices de ocupación y de probabilidad de detección se analizó con el programa PRESENCE (Hines, 2006). El modelo de ocupación presupone poblaciones cerradas en los sitios de muestreo, donde no se presentan cambios demográficos o dispersión hacia otras áreas. Por lo tanto, se da por hecho que las poblaciones de especies de búhos no presentaron cambios durante el periodo de muestreo.
Composición de especies. Se evaluó el recambio en la composición de especies (diversidad beta) entre ambos sitios de estudio, utilizando el número de especies (diversidad alfa) registradas por sitio. La diversidad beta (β) se expresó según el índice de complementariedad (Colwell y Coddington, 1994), donde la complementariedad es de 0% cuando la composición de especies es idéntica entre sitios y de 100% cuando la composición es completamente distinta (Koleff et al., 2003).
Análisis de hábitat local. Se describieron y evaluaron las características estructurales de vegetación y uso del suelo en cada trayecto lineal por sitio de estudio. Se utilizó el método de cuadrante desviado que es una variación del punto centrado en cuadrantes de Brower et al. (1990). En este método, la línea del cuadrante desviado siguió el entorno de los trayectos establecidos, donde cada punto que tocó la línea del trayecto fue un árbol con un diámetro igual o mayor a 20 cm de diámetro a la altura del pecho (DAP). En cada punto se midieron 8 variables estructurales de la vegetación y 4 variables fisiográficas propuestas por Hays et al. (1981) y Mosher et al. (1987). Las variables estructurales medidas fueron: a) abundancia de árboles por trayecto (Núm. ind. /km recorrido); b) altura de árboles (m); c) diámetro a la altura del pecho (DAP); d) área basal de árboles (m); e) porcentaje de cobertura del dosel; f) número de troncos caídos por sendero; g) número de estratos de vegetación y h) altura máxima del dosel (m). El porcentaje de cobertura del dosel se obtuvo con un densiómetro esférico y el DAP se obtuvo a partir de la medición de la circunferencia del tallo principal utilizando el siguiente modelo:
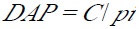
donde DAP representa el diámetro a la altura del pecho, C es la circunferencia y pi= 3.1416.
Las 4 variables fisiográficas medidas fueron: a) tipo de disturbio en la cobertura vegetal y uso del suelo (medida a través de una escala semicuantitativa: 0= sin disturbio, 1= incendios, 2= extracción leña, 3= cultivo y 4= pastoreo); b) distancia a la fuente de agua más cercana; c) distancia al área abierta más cercana y d) distancia al asentamiento humano más cercano.
Análisis del paisaje. Se obtuvieron las coordenadas geográicas de cada uno de los puntos de conteo en los trayectos lineales. A partir de una imagen de satélite SPOT multiespectral de 3 bandas (13 m de resolución por pixel, año 2007, LAIGE–ECOSUR) que corresponde al área de la REBISO y utilizando el programa MultiSpec W32®, se obtuvieron 2 subescenas que incluyeron los puntos de muestreo de aves rapaces por sitio de estudio. El tamaño de las subescenas seleccionadas (23km2) corresponde a una revisión de literatura sobre el área de acción de algunas especies de aves rapaces nocturnas (Ganey et al., 2005; Enríquez, 2007; Hamer et al., 2007). Posteriormente, con el programa ERDAS®, se realizó una clasificación no supervisada de cobertura y uso del suelo para cada sub–escena por sitio de estudio. Finalmente con el programa FRAGSTATS®, se describieron y calcularon 8 variables ambientales del paisaje dentro de cada subescena (McGarigal y Marks, 1995). Las variables medidas en hectáreas fueron: tamaño de bosque tropical perennifolio con dosel cerrado (BTMdc), tamaño de BTM con dosel abierto (BTMda), tamaño de área deforestada (TAD), tamaño área de acahual (TAA) y tamaño área inundada (TAI). Los patrones de BTM medidos fueron: tamaño de parches de BTM, número de parches por subescena y proporción de borde (porcentaje de parches con borde lineal entre BTM y otros tipos de cobertura) por subescena.
Análisis estadístico. Para comparar las variables de abundancia de aves y las variables estructurales de la vegetación entre sitios se utilizó el análisis de varianza (ANDEVA) o Kruskal Wallis (Zar, 1999), dependiendo de la distribución de los datos. La asociación entre patrones de ocupación y abundancia de las aves rapaces nocturnas y las variables estructurales de la vegetación se estimaron utilizando modelos lineales generalizados (en adelante MLG; Quinn y Keough, 2002). La relación entre la variable de ocupación de las aves rapaces nocturnas y variables estructurales de vegetación se evaluó a través de una regresión logística múltiple con un MLG (Zar, 1999). Para la variable de abundancia, se utilizó una regresión múltiple a través de un MLG considerando una distribución de tipo Poisson. Adicionalmente, se utilizó un MLG para evaluar la interacción de factores espaciales (sitio, sendero y punto de conteo) con las variables de ocupación y abundancia de las especies de aves rapaces nocturnas. Cada variable incluida en el MLG se analizó por separado (forward stepwise selection) con el fin de remover las interacciones no significativas e identificar aquellas significativas. Los análisis estadísticos se realizaron con los programas SPSS 11.5. y SAS–JMP 5.01 (Sall et al., 2005). Todas las medias se presentan con ± 1D.E. considerando significativas las pruebas estadísticas en un nivel de α < 0.05.
Resultados
Por primera vez y de manera sistemática, se documentó la variación espacial de los patrones de ocupación y abundancia de 5 especies de búhos neotropicales (Strigidae) que están presentes en la REBISO. Las especies de aves rapaces nocturnas registradas en los trayectos fueron 5: Megascops guatemalae, Lophostrix cristata, Pulsatrix perspicillata, Strix virgata y S. nigrolineata. En la reserva, pero fuera de los trayectos (en la localidad: Sima de las Cotorras), se registraron 3 especies más (Bubo virginianus, Glaucidium ridgwayi y Tyto alba) que no fueron incluidas en los análisis. De las registradas en los trayectos, 3 (Lophostrix cristata, Pulsatrix perspicillata y Strix nigrolineata) se encuentran en la categoría de Amenazadas en la NOM–059–ECOL–2010 (SEMARNAT, 2010). En el sitio Emilio Rabasa se registró la mayor riqueza (diversidad alfa= a) con 5 especies, mientras que el sitio El Encajonado presentó 4 especies con ausencia de P. perspicillata. Ocupación (ψ) y probabilidad de detección (ρ). Se presentó una variación espacial en los patrones de ocupación y probabilidad de detección en todas las especies de aves rapaces registradas en los sitios de estudio (Cuadro 1). El índice de ocupación varió desde 0.62 para las especies con mayor valor del índice, hasta 0.04 para las especies con menor valor. Las especies con mayores índices de ocupación en el sitio Emilio Rabasa fueron Strix virgata, Lophostrix cristata y Strix nigrolineata (Cuadro 1) y en el sitio El Encajonado fueron Megascops guatemalae, S. virgata y L cristata (Cuadro 1). La probabilidad de detección varió desde 0.21 para las especies con mayor número hasta 0.006 para las especies con menor número de detecciones. En Emilio Rabasa, las rapaces nocturnas con mayor probabilidad de detección fueron: S. virgata, L. cristata y S. nigrolineata (Cuadro 1), mientras que en El Encajonado, fueron: S. nigrolineata, M. guatemalae y S. virgata (Cuadro 1).
Al correlacionar las variables de la vegetación con los índices de ocupación, S. virgata presentó correlaciones con la altura de árboles y distancia al sitio abierto más cercano (χ21= 11.05, p= 0.001 y t1= –2.19, p< 0.05 respectivamente). Lophostrix cristata presentó una correlación signiicativa con la media de la distancia al sitio abierto más cercano (t1= –1.99, p= 0.05); tuvo también correlaciones marginales con las variables de área basal y media de la altura de los árboles (χ21= 3.39, p= 0.06 y χ21= 3.46, p= 0.06) y con la media de la distancia a una fuente de agua (t1= –1.89, p= 0.06). Megascops guatemalae presentó evidencia signiicativa de interacción entre sus patrones de ocupación y diferentes niveles espaciales como sitio, trayecto y punto de muestreo (χ21= 4.60, p< 0.05; χ22= 14.42, p< 0.0001 y χ27= 18.82, p< 0.05) en ambos sitios de estudio. De igual manera, el índice de ocupación de S. virgata presentó evidencia de interacción signiicativa con un factor espacial que fue el sitio de muestreo (χ21= 18.87, p< 0.05). Finalmente, la ocupación de L. cristata se explicó por su interacción con los puntos de muestreo en ambos sitios de estudio (χ27= 15.71, p< 0.05). Abundancia relativa. Las especies de aves rapaces nocturnas registradas en Emilio Rabasa de mayor a menor abundancia relativa fueron: S. virgata, S. nigrolineata, L. cristata, M. guatemalae y Pulsatrix perspicillata (Cuadro 2). En el sitio El Encajonado M. guatemalae presentó mayor abundancia relativa, seguida de S. virgata, L. cristata y S. nigrolineata. Al comparar las medias de las abundancias entre sitios, solamente la abundancia de S. virgata fue signiicativamente mayor (p< 0.001) para el sitio Emilio Rabasa (Cuadro 2).
Se presentaron correlaciones significativas entre la abundancia relativa de S. virgata con la media de altura de los árboles en los trayectos de muestreo y negativa con la media de la distancia al sitio abierto más cercano (χ21= 10.95, p< 0.001 y t1= –2.19, p< 0.05). Igualmente, la abundancia relativa de P. perspicillata presentó correlación signiicativa con la media de la altura de los árboles en los trayectos de muestreo (χ21= 4.76, p< 0.05). Finalmente, la abundancia relativa de L. cristata presentó una correlación negativa con la media de la distancia al sitio abierto más cercano (t1= –1.9, p= 0.05). Adicionalmente, se presentó evidencia signiicativa de interacción entre el sitio de estudio y los trayectos de muestreo con la abundancia relativa de S. virgatay M. guatemalae (χ21= 14.92, p= 0.001 y χ22= 13.25, p< 0.05, respectivamente).
Composición de especies. La diversidad beta (β) expresada según el índice de complementariedad fue de 20% para las especies de aves rapaces nocturnas. Este porcentaje indica que la composición de especies de aves rapaces nocturnas fue muy similar entre sitios al compartir 4 de las 5 especies registradas. Solamente P. perspicillata no se registró en el sitio El Encajonado.
Descripción del hábitat local. Entre sitios, fueron diferentes 2 de las variables estructurales de la vegetación la altura media de los árboles (F1,46 = 27.56, p< 0.001) y el número de troncos caídos por trayecto (x21= 3.97, p< 0.05); en El Encajonado fueron significativamente mayores. En Emilio Rabasa, dos variables fisiográficas, distancia al claro más cercano y distancia a un asentamiento humano, fueron menores, pero no presentaron diferencia estadística significativa (Cuadro 3).
Descripción del paisaje. El Encajonado presentó mayor proporción de área de bosque tropical perennifolio (en adelante BTM) con dosel cerrado (918.12 ha) y dosel abierto (562.48 ha), mayor área de acahual (371.19 ha.) y por lo tanto, menor proporción de área deforestada (110.69 ha.). En Emilio Rabasa, el área de BTM con dosel cerrado fue menor (683.21 ha) y el área de BTM con dosel abierto (585.23 ha.) fue muy similar entre sitios. El sitio Emilio Rabasa mostró una mayor proporción de área deforestada (647.62 ha) e incremento en el área de acahuales (363.38 ha). Las medias del tamaño de parches de BTM, el tamaño de parches de BTM y la proporción de borde fueron similares entre ambos paisajes de estudio. El área total estimada de BTM para ambos sitios de estudio correspondió al 0.05 % del total (aproximadamente 60 000 ha. de BTM) de área estimada para la REBISO en el año 2000 (CONANP, 2001).
Discusión
Ocupación y probabilidad de detección. Durante el periodo de muestreo, 4 de las especies registradas, Lophostrix cristata, Strix nigrolineata, Pulsatrix perspicillata y Megascops guatemalae, ocuparon frecuentemente sitios con cobertura de bosque tropical perennifolio. En el sitio El Encajonado, M. guatemalae y S. virgata presentaron mayores índices de ocupación y probabilidad de detección. Aunque estas especies se consideran como generalistas de hábitat, pueden presentarse en ambientes poco perturbados donde encuentren estratos con follaje denso que utilizan para refugio y protección (König y Weick, 2008). En este mismo sitio, L. cristata y S. nigrolineata con frecuencia ocuparon sitios con mayor densidad de árboles maduros y plantas epífitas. Los ambientes estructuralmente complejos pueden favorecer la presencia de microhábitats específicos (e.g., oquedades en árboles maduros) que se utilizan como posaderos y sitios de anidación (Gerhardt et al., 1994b, Enríquez y Rangel–Salazar, 2001). En Emilio Rabasa, S. virgata, L. cristata y S. nigrolineata, presentaron mayores índices de ocupación y probabilidad de detección. En particular, fue S. virgata la que presentó mayor abundancia y por lo tanto mayor índice de ocupación y probabilidad de detección. Esta especie, considerada como muy abundante en bosques neotropicales, puede tolerar la deforestación y habitar en sitios de borde y áreas semi–abiertas (Gerhardt et al., 1994b). Las 3 especies restantes registradas en Emilio Rabasa, L. cristata, S. nigrolineata y P. perspicillata, ocuparon frecuentemente sitios con mayor densidad de árboles maduros. De estas 3, L. cristata presentó el mayor índice de ocupación entre las especies de interior de bosque registradas en este sitio; se registra como afín a sitios poco perturbados, aunque también se le encuentra en bosques secundarios (Sberze et al., 2010). Finalmente, M. guatemalae se registró en la mayoría de los ambientes que se pueden identificar en Emilio Rabasa, principalmente en acahuales, cafetales y sitios con árboles maduros. La presencia de acahuales en Emilio Rabasa podría ser relevante para la diversidad de especies que están presentes en el sitio, debido a que los ambientes con este tipo de cobertura podrían utilizarse eventualmente como hábitats subóptimos, es decir aquellos lugares donde las especies pueden sobrevivir temporalmente (Law y Dickman, 1998). Se ha sugerido que algunas especies de aves rapaces utilizan estos hábitats para cumplir con ciertos requerimientos ecológicos (e.g. refugio temporal y alimentación) durante sus actividades diarias (Sberze et al., 2010). No obstante, la disponibilidad de sitios conservados y aledaños a hábitats subóptimos podría ser útil para compensar la falta de recursos en estos últimos.
Abundancia. Solamente la abundancia de S. virgata difirió entre sitios; fue mayor para Emilio Rabasa. Este sitio presenta mayor variación horizontal de ambientes y por lo tanto mayor efecto de borde asociado con la fragmentación del bosque. Un incremento en la heterogeneidad del sitio podría estar aumentando la disponibilidad de recursos utilizados por las especies que ahí habitan. En este sentido, una mayor abundancia de presas potenciales (e.g., mamíferos pequeños e insectos) asociadas con cultivos, podría generar una mayor abundancia de especies asociadas a sitios abiertos y de borde (Gerhardt et al., 1994a, 1994b). En el caso de L. cristata, S. nigrolineata y P. perspicillata, que son especies asociadas al bosque tropical maduro, aunque también se encuentran en bosques secundarios (König y Weick, 2008), los atributos estructurales de la vegetación como altura del dosel y área basal de árboles podría explicar su existencia y abundancia en paisajes más diversificados como el de Emilio Rabasa.
Relaciones de hábitat. La ocupación, abundancia y persistencia de las especies de interior de bosque en paisajes heterogéneos podría estar influenciada por la estructura y composición del paisaje. La disponibilidad de áreas de bosque tropical inmersas en una matriz de ambientes modificados (acahual, cultivo, pastizal) y la estructura de hábitat a escala local explicaron los índices de ocupación y abundancia de las especies de bosque registradas en Emilio Rabasa. Lo anterior fue confirmado al encontrar asociaciones signiicativas entre la altura de árboles y distancia a sitios abiertos con la ocupación y abundancia de P. perspicillata, y entre la altura de los árboles, área basal y distancia hacia áreas abiertas (e.g., cultivos y pastizal) con la ocupación y abundancia de L. cristata. Al igual que en estudios previos, la disponibilidad de atributos de hábitat, tales como mayor densidad de árboles, altura del dosel y presencia de microhábitats específicos, podrían explicar la ocupación de las especies de interior de bosque registradas en Emilio Rabasa (Ganey y Balda, 1994; Ganey, 2005; Hamer et al., 2007; Enríquez, 2007). Las asociaciones positivas entre atributos de bosque maduro y los índices de ocupación y abundancia, denotan la importancia de conservar ambientes de bosque tropical que aseguren la disponibilidad de recursos que podrían ser utilizados por las especies que habitan en paisajes heterogéneos. No obstante, en el contexto de Emilio Rabasa, el incremento de la perturbación y posible fragmentación del paisaje podría generar modiicaciones a diferentes escalas espaciales, desde la disrupción de la continuidad del paisaje forestal hasta la disminución de hábitats específicos para aquellas especies sensibles al disturbio. En este sentido, aunque un incremento de la heterogeneidad espacial podría beneiciar inicialmente algunas especies como S. virgata. La mayoría pudiera no llegar a adaptarse a la disminución de recursos útiles ni a un incremento en las distancias existentes entre parches de hábitat adecuados (Fahrig, 2003). En un contexto de fragmentación y heterogeneidad, la restricción del área de acción en áreas inconexas de bosque, podría generar el aislamiento de las poblaciones, derivando con ello un declive poblacional y un incremento del riesgo de extinción local dentro de fragmentos de bosque (Lawton, 1993).
Relaciones de ocupación y abundancia. Un índice de ocupación mayor en algunas especies no reflejó necesariamente una mayor probabilidad de detección y abundancia. En algunos casos, el índice representó la ocupación constante de un punto de muestreo y no así de todos los puntos por sitio de muestreo. Posiblemente, algunas especies ocuparon de manera frecuente sitios donde seleccionan y utilizan una mayor variedad de recursos útiles para su permanencia. Lo anterior podría estar influyendo en sus patrones de abundancia y por lo tanto en un mayor índice de ocupación y probabilidad de detección en sitios específicos. En diferentes comunidades de aves, se han documentado relaciones entre los patrones de ocupación y abundancia, de manera tal que al presentarse un incremento o decremento en la abundancia de una población se presenta también un incremento o decremento en el número de sitios ocupados (Gaston et al., 2000). En este sentido, un índice de ocupación mayor en hábitats específicos puede dar la pauta para establecer estrategias de manejo y conservación de las especies de interés.
Para fines de conservación es importante considerar el significado biológico–ecológico de la relación ocupación–abundancia. En especies de distribución geográica amplia, una ocupación de hábitat alta y una abundancia local reducida (especies comunes y/o generalistas) incrementa la probabilidad de un efecto adverso, debido a fenómenos estocásticos y/o poco frecuentes. No obstante, en especies con distribución geográica reducida, ocupación de hábitat alta, pero abundantes localmente (especies raras y/o especialistas), se incrementa la probabilidad de un efecto adverso debido a cambios ambientales drásticos, como la deforestación y fragmentación (Rey Benayas, 2009). En este sentido, es importante identiicar aquellas especies que cumplan con los parámetros establecidos para deinirlas como raras o especialistas, ya que éstas podrían considerarse como potencialmente amenazadas por la pérdida y degradación de sus hábitats específicos. Particularmente, las estrategias de conservación de las especies de bosque registradas durante este estudio (L. cristata, P. perspicillata y S. nigrolineata), deben considerar la relación ocupación–abundancia, además de sus características de historia de vida y necesidades ecológicas (generalistas vs. especialistas).
Distribución de las especies. La presencia de las especies en ambientes estructuralmente diferentes sugiere una segregación espacial de los ensambles de búhos en los sitios de estudio. No obstante, aunque durante este estudio se identificaron patrones de ocupación evidentes en diferentes tipos de hábitats, se observó interacción y coexistencia entre las especies que conforman el ensamble. Este sobrelapamiento en distribución espacial y ocupación de hábitat podría estar creando condiciones para la competencia interespecífica (Vrezec y Tome, 2004). En este sentido, la coexistencia, además de incrementar la competencia y posible exclusión de algunas especies hacia ambientes subóptimos (e.g., acahuales), podría generar como consecuencia la declinación poblacional de las especies menos dominantes (Fretwell y Lucas, 1970). En algunos casos, la presencia y detectabilidad de las especies de menor talla podrían estar influenciadas por la presencia de individuos de mayor talla (Kissling et al., 2010). No obstante, durante el periodo de muestreo se observó segregación espacial entre las especies de búhos, donde la utilización de diferentes estratos de la vegetación (e.g., sotobosque, subdosel y dosel) para posarse y vocalizar, sugirió un uso diferencial del hábitat (Fig. 2).
Heterogeneidad del paisaje y diversidad de especies. La riqueza de especies de aves rapaces nocturnas, así como sus patrones de ocupación, abundancia y composición de sus comunidades, puede explicarse por las características estructurales (altura del dosel, área basal, distancia a un asentamiento humano y sitios abiertos) del hábitat local y por la heterogeneidad del paisaje (estructura y tipos de cobertura; Wightman y Fuller, 2006; Enríquez y Rangel–Salazar, 2007).
En la actualidad, la heterogeneidad ambiental generada por deforestación en Emilio Rabasa y promovida por la cercanía de sitio El Encajonado a la zona de amortiguamiento, podría estar afectando de manera diferencial la composición de especies en ambos sitios de estudio (Anderson, 2001). En Emilio Rabasa, la presencia de fragmentos extensos de bosque tropical perennifolio aledaños a sitios abiertos permitió registrar especies de interior de bosque (L. cristata, S. nigrolineata y P. perspicillata; König y Weick, 2008) y especies asociadas a sitios abiertos, de borde y acahuales (S. virgata y M. guatemalae; König y Weick, 2008). En el caso de El Encajonado, donde se presentan ambientes de bosque tropical perennifolio, acahuales y un cuerpo de agua, se registraron especies de interior de bosque (L. cristata y S. nigrolineata) y especies de borde y acahuales (S. virgata y M. guatemalae; del Hoyo et al., 1999; König y Weick, 2008).
Una mayor variedad de recursos ambientales (e.g., sitio de refugio, alimento) en ambientes específicos dentro de paisajes heterogéneos podría estar incrementando la diversidad local y regional debido a la presencia de especies con diferentes requerimientos ecológicos (Ricklefs y Schluter, 1993). En comunidades de aves rapaces neotropicales, se han encontrado asociaciones positivas entre la heterogeneidad espacial y el incremento en la diversidad de especies (Anderson, 2001; Thiollay, 2007). No obstante, aunque una mayor riqueza y abundancia de especies podría ser indicativo para mantener las características de un paisaje heterogéneo, la perturbación excesiva y con duración prolongada, podría generar modiicaciones en la estructura y composición del paisaje y, por lo tanto, en la diversidad y composición de las comunidades de aves que estén presentes en éste. En términos de la respuesta especie–específica a la degradación y fragmentación del paisaje en la REBISO, se podría esperar un proceso de homogenización donde pocas especies generalistas (e.g., S. virgata y M. guatemalae) podrían incrementar su tamaño poblacional, mientras que otras (e.g., L. cristata, P. perspicillata y S. nigrolineata), con poca flexibilidad para ocupar ambientes subóptimos, podrían tener declinación poblacional. Implicaciones para el manejo del paisaje y la conservación de las especies. La estrategia de conservación de las aves rapaces nocturnas en el contexto de la REBISO, requiere un enfoque regional que considere un manejo diversificado y sustentable del paisaje. Los resultados sugieren que una mayor variación horizontal de ambientes generada por niveles intermedios de disturbio (i.e., fragmentación del paisaje forestal) podría favorecer la presencia de especies con diferentes requerimientos ecológicos. No obstante, la promoción de estrategias productivas (e.g., agroecológicas) compatibles con el ambiente y la restricción de actividades agropecuarias intensivas, podrían generar un incremento de la superficie de bosque tropical perennifolio en los paisajes de estudio. Una mayor proporción de área de bosque en paisajes heterogéneos, además de reducir posibles interacciones negativas entre especies generalistas y especialistas, podría asegurar a largo plazo la persistencia de las especies dependientes del bosque. Adicionalmente, la promoción de la regeneración natural de áreas de acahual y la restauración de áreas degradadas podría ser útil para promover la continuidad del paisaje forestal y la conectividad estructural de los fragmentos de bosque tropical. Finalmente, la restauración de potreros con cercos vivos y la plantación de árboles nativos, podría ser útil para generar una matriz susceptible de ser utilizada por las comunidades de aves rapaces nocturnas y por otros grupos de aves, mitigando con esto, algunos efectos negativos derivados de la fragmentación.
Los trabajos futuros en la REBISO deben considerar la evaluación de parámetros demográicos, uso de hábitat, relaciones interespecíficas y ocupación multianual, entre otros. La información generada será útil para establecer estrategias de conservación a largo plazo que permitan asegurar la persistencia de diferentes comunidades de aves rapaces nocturnas y de otros grupos de fauna en paisajes sujetos a diferentes dinámicas socio–económicas y ambientales.
Agradecimientos
A Sofía Carolina Ovalle, Carlos Morales, Romeo Montejo y Karla Leal, quienes ayudaron con la logística y trabajo de campo. A los pobladores de los ejidos Emilio Rabasa y El Encajonado, por su compañía en los recorridos de reconocimiento. A Darío Navarrete de LAIGE–ECO–SUR, por su apoyo con las imágenes de satélite y análisis del paisaje. Al CONACYT, por la beca otorgada al primer autor para la realización de estudios de maestría en ciencias en la ciudad de San Cristóbal de Las Casas, Chiapas. A ECOSUR– SCLC por el apoyo económico, con fondos fiscales, para la realización de esta investigación. A la organización IDEAWILD, por la donación de equipo para el trabajo de campo.
Literatura citada
Anderson, D. 2001. Landscape heterogeneity and diurnal raptor diversity in Honduras: the role of indigenous shifting cultivation. Biotropica 33:511–519. [ Links ]
Bildstein, K. 2005. Why migratory birds of prey make great biological indicators. Hawk Mountain Sanctuary, Kempton, Pennsylvania. p. 169–179. [ Links ]
Brower, J., J. Zar y C. von Ende. 1990. Field and laboratory methods for general ecology. Brown, Dubuque, Iowa. 87 p. CONANP/SEMARNAT. 2001. Programa de manejo de la Reserva de la Biosfera Selva el Ocote, Chiapas, México. [ Links ]
Connell, M. L. 1978. Diversity in tropical rain forests and coral reefs. Science 199:1302–1310. [ Links ]
Colwell, R. K. y J. A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London, Series B 345:101–118. [ Links ]
del Hoyo, J. E., A. Elliott y J. Sargatal (eds.). 1999. Handbook of the birds of the world. vol.5. Lynx, Barcelona. p. 204–205. [ Links ]
Douglas, J. W. 1997. Conservation reserves in heterogeneous landscapes. In Principles of conservation biology, G. K. Meffe y C. R. Caroll (eds.). Sinauer, Sunderland, Massachusetts. p. 305–343. [ Links ]
Enríquez, P. L. 2007. Ecology of the Bearded Screech Owl (Megascops barbarus) in the central highlands of Chiapas, Mexico. Ph.D. diss., University of British Columbia, Vancouver. [ Links ]
Enríquez, P. L. y J. L. Rangel–Salazar. 2001. Owl occurrence and calling behavior in a tropical rain forest. Journal of Raptor Research 35:107–114. [ Links ]
Enríquez, P. L. y J. L. Rangel–Salazar. 2007. The intensity of habitat use by an owl assemblage in a neotropical rainforest. In Neotropical raptors, K. L. Bildstein, D. R. Barber y A. Zimmerman (eds.). Hawk Mountain Sanctuary, Orwigsburg, Pennsylvania. p. 88–98. [ Links ]
Fahrig, L. 2003. Effects of habitat fragmentation on biodiversity. Annual Review of Ecology, Systematics and Evolution 34:487–515. [ Links ]
Farina, A. 2000. Landscape Ecology in Action. Kluwer Academic, London. 169 p. [ Links ]
Fretwell, S. D. y H. L. Lucas. 1970. On territorial behavior and other factors influencing distribution in birds. Acta Biotheoretica 19:16–36 [ Links ]
Fuller, M. R. y J. A. Mosher. 1987. Raptor survey techniques. In Raptor management techniques manual, B. A. Pendleton, A. B. Millsap, W. K.Cline y M. D. Bird (eds.). National Wildlife Federation, Washington, D.C. p. 39–46. [ Links ]
Ganey, J. L. y R. Balda. 1994. Habitat selection by Mexican Spotted Owls in northern Arizona. The Auk 111:162–169. [ Links ]
Ganey, J. L., Block W., J. P. Ward y B. E. Strohmeyer. 2005. Home range, habitat use, survival, and fecundity of Mexican Spotted Owls in the Sacramento Mountains, New Mexico. The Southwestern Naturalist 3:323–333. [ Links ]
Gaston, K., T. M. Blackburn, J. J. Greenwood, R. D. Gregory, R. M. Quinn y J. H. Lawton. 2000. Abundance–occupancy relationships. Journal of Applied Ecology 37:39–59. [ Links ]
Gerhardt, R. P., N. Bonilla, D. M. Gerhardt y C. J. Flaten. 1994a. The food habits of sympatric Ciccaba owls in northern Guatemala. Journal of Field Ornithology 65:258–264. [ Links ]
Gerhardt, R. P., D. M. Gerhardt, C. J. Flaten y N. Bonilla. 1994b. Breeding biology and home range of two Ciccaba owls. Wilson Bulletin 106:629–639. [ Links ]
Hamer, T. E., E. Foreman y E. Glenn. 2007. Home range attributes and habitat selection of barred owls and spotted owls in an area of sympatry. Condor 109:750–768. [ Links ]
Hardy, P. C. y M. L. Morrison. 2000. Factors affecting the detection of elf owls and western screech owls. Wildlife Society Bulletin 28:333–342. [ Links ]
Hays, R. L., C. Summers y W. Seitz. 1981. Estimating wildlife habitat variables. Fish and Wildlife Service. U.S. Department of the Interior, Washington, D.C. p. 15–92. [ Links ]
Hines, J. E. 2006. PRESENCE2: Software to estimate patch occupancy and related parameters. USGS–PWRC. http://www.mbrpwrc.usgs.gov/software.html; última consulta: 27.X.2010. [ Links ]
Johnson, D. H. 1980. The comparison of usage and availability measurements for evaluating resource preference. Ecology 61:65–71. [ Links ]
Jullien, M. y J. M. Thiollay. 1996. Effects of rainforest disturbance and fragmentation: comparative changes of the raptor community along natural and human–made gradients in French Guiana. Journal of Biogeography 23:7–25. [ Links ]
Kissling, M. L., S. B. Lewis y G. Pendleton. 2010. Factors influencing the detectability of forest owl in southeastern Alaska. Condor 112:539–548. [ Links ]
Koleff, P., K. Gaston y J. Lennon. 2003. Measuring beta diversity for presence–absence data. Journal of Animal Ecology 72:367–382. [ Links ]
König, C. y F. Weick. 2008. Owls of the world, segunda edición. Christopher Helm, London. 528 p. [ Links ]
Law, B. S. y C. R. Dickman. 1998. The use of habitat mosaic by terrestrial vertebrate fauna: implications for conservation and management. Biodiversity and Conservation 7:323–333. [ Links ]
Lawton, J. H. 1993. Range, population abundance and conservation. Trends in Ecology and Evolution 8:409–413. [ Links ]
McGarigal, K. y B. J. Marks. 1995. FRAGSTATS – Spatial pattern analysis program for quantifying landscape structure, ver. 2.0. Forest Science Department, Oregon State University, Corvallis. [ Links ]
MacKenzie, D. I. y J. A. Royle. 2005. Designing occupancy studies: general advice and allocating survey effort. Journal of Applied Ecology 42:1105–1114. [ Links ]
Moilanen, A. y I. Hanski 1998. Metapopulation dynamics: effects of habitat quality and landscape structure. Ecology 79:2503-2515. [ Links ]
Mosher, J. A., K. Titus y M. R. Fuller. 1987. Habitat sampling measurement and evaluation. In Raptor management techniques manual, B. A. Pendleton, A. B. Millsap, W. K.Cline y M. D. Bird (eds.). National Wildlife Federation. Washington, D.C. p. 91–97. [ Links ]
Newton, I. 1979. Population ecology of raptors. Poyser, Berkhamstead, Hertfordshire. 399 p. [ Links ]
Quinn, G. P. y M. J. Keough. 2002. Experimental design and data analysis for biologists. Cambridge University Press, New York. 359 p. [ Links ]
Rey Benayas, J. M. 2009. La rareza de las especies. Investigación y Ciencia, Alcalá. p. 62–69. [ Links ]
Ricklefs, R y D. Schluter. 1993. Species diversity in ecological communities (Historical and Geographical perspectives). The University of Chicago Press, Illinois. p. 66–74. [ Links ]
Rodríguez, R., J. A. Donazar y F. Hiraldo. 1998. Raptors as indicators of environmental change in the scrub habitat of Baja California Sur, México. Conservation Biology 12:921925. [ Links ]
Rzedowski, J. 2006. Vegetación de México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, D. F. p. 169–246. [ Links ]
Sall, J., L. Creighton y A. Lehman. 2005. JMP Start statistics: A guide to statistics and data analysis using jMP and JMP IN software. Thompson Learning, Belmont, California. 334 p. [ Links ]
Sberze, M, M. Cohn–Haft y G. Ferraz. 2010. Old growth and secondary forest site occupancy by nocturnal birds in a neotropical landscape. Animal Conservation 13:3–11. [ Links ]
SEMARNAT (Secretaría de Medio Ambiente y Recursos Naturales). 2010. Norma Oficial Mexicana 059–SEMARNAT 2010. Protección ambiental especies nativas de México de flora y fauna silvestres. Categorías de riesgo y especificaciones para su inclusión, exclusión, o cambio. Lista de especies en riesgo. Diario Oficial de la Federación, 30 de diciembre 2010, México D. F. [ Links ]
Sergio, F., T. Caro, D. Brown, B. Clucas, J. Hunter, J. Ketchum, K. McHugh y F. Hiraldo. 2008. Top predators as conservation tools: ecological rationale, assumptions, and efficacy. Annual Review of Ecology Evolution and Systematics 39:1–19. [ Links ]
Thiollay, J. M. 1989. Area requirements for the conservation of rainforest raptors and game birds in French Guiana. Conservation Biology 31:128–137. [ Links ]
Thiollay, J. M. 2007. Raptor communities in French Guiana: distribution, habitat selection, and conservation. Journal of Raptor Research 41:90–105. [ Links ]
Vrezec, A. y D. Tome. 2004. Altitudinal segregation between Ural Owl Strix uralensis and Tawny Owl Strix aluco evidence for competitive exclusion in raptorial birds. Bird Study 51:264269. [ Links ]
Wightman, C. y M. Fuller. 2006. Influence of habitat heterogeneity on distribution, occupancy patterns, and productivity of breeding peregrine falcons in Central West Greenland. Condor 108:270–281. [ Links ]
Zar, J. H. 1999. Biostatistical Analysis. Prentice Hall, Upper Saddle River, New Jersey. 663 p. [ Links ]














