Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de biodiversidad
versão On-line ISSN 2007-8706versão impressa ISSN 1870-3453
Rev. Mex. Biodiv. vol.83 no.2 México Jun. 2012
Ecología
Diversidad de reptiles en tres tipos de vegetación del estado de Hidalgo, México
Diversity of reptiles in three vegetation types of the Hidalgo state, México
Raciel Cruz–Elizalde* y Aurelio Ramírez–Bautista
Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Hidalgo. Apartado postal 1–69 Plaza Juárez 42001 Pachuca, Hidalgo, México. *cruzelizalde@gmail.com.
Recibido: 03 febrero 2011
Aceptado: 31 enero 2012
Resumen
La zona sureste del estado de Hidalgo presenta diversos tipos de vegetación, como el bosque mesófilo de montaña, bosque de pino–encino y bosque de pino, con alta riqueza de reptiles. En este estudio, se analizó la diversidad alfa y beta de los reptiles en los 3 tipos de vegetación presentes en la zona sureste. Durante el periodo de recolección, de junio 2008 a agosto del 2009, se realizaron 12 salidas, 1 por mes, con duración de 3 días cada una. La diversidad de reptiles está compuesta por 25 especies, incluyendo un registro nuevo para el estado, la culebra Thamnophis scaliger. El bosque mesófilo de montaña (BMM) presentó la mayor riqueza, con 15 especies, seguido del bosque de pino (BP), con 13, y el bosque de pino–encino (BPE), con 12. Las asociaciones realizadas entre el BMM–BP y BMM–BPE presentaron la más alta disimilitud en especies, y el menor valor fue para el BPE–BP. Este estudio muestra la riqueza y distribución de las especies de los reptiles en los diferentes tipos de vegetación del sureste del estado y presenta nuevos registros de especies para la entidad. El conocimiento de la riqueza de especies por tipos de vegetación de este estudio sienta las bases sobre la biodiversidad, lo que ayuda a plantear estudios dirigidos a la conservación de este grupo.
Palabras clave: riqueza de especies, lagartijas, serpientes, abundancia, recambio, Hidalgo.
Abstract
The southeast of Hidalgo in Mexico includes various vegetation types, such as cloud forest, pine–oak forest and pine forest, all harbouring a high species richness of reptiles. In this study we analyzed the alpha and beta diversity of reptiles in 3 vegetation types in the southeast of the state. The field work period was from June 2008 to August 2009, comprising 12 sampling periods of 3 days, 1 per month. The diversity of reptiles is composed of 25 species, reporting the snake Thamnophis scaliger as a new record for the state. The cloud forest (CF) has the highest richness, with 15 species, followed by pine forest (PF), with 13, and finally, the pine–oak forest (POF), with 12 species. The associations between the CF–PF and CF–POF showed the highest dissimilarity in species, and the lowest the POF–PF. This study shows the richness and distribution species of the reptiles in the different vegetation types from southeast of the state, presents new records of species from the state and provides the basis for future studies on the biology of some species of reptiles in the area. The knowledge of species richness by vegetation types from this study provides the basis on the biodiversity that help to raise studies directed to the conservation of this group.
Key words: species richness, lizards, snakes, abundance, turnover, Hidalgo.
Introducción
La riqueza de especies es una medida útil para reconocer la diversidad y estructura de las comunidades (MacArthur y Wilson, 1967), así como para describir las causas de la riqueza y diferenciación de distintos grupos biológicos en el espacio y tiempo (Whittaker et al., 2001; Baselga, 2010), por lo que para el estudio de las especies de una comunidad se recurre al uso de grupos o subgrupos de la misma (Halffter y Moreno, 2005). Por ello, se distinguen 3 componentes principales: la diversidad alfa, entendida como la riqueza de especies de una muestra territorial (Whittaker, 1972); la diversidad beta, como la diferencia en composición de biotas entre sitios (Koleff et al., 2003), y la diversidad gamma, como el número de especies que conforman un conjunto de sitios o comunidades que integran un paisaje (Magurran, 2004). Esta división ha generado distintos métodos e índices para medir y cuantificar la composición de especies en diferentes biotas a distintas escalas espaciales (Whittaker et al., 2001; Baselga et al., 2007; Jost, 2007), así como para calcular la similitud o disimilitud entre sitios respecto a la riqueza de especies (Sørensen, 1948; Koleff et al., 2003).
Los patrones biogeográficos en riqueza de especies han sido explicados por procesos como la especiación, la extinción o la dispersión a diferentes escalas espaciales y temporales (Wiens y Donoghue, 2004; Rabosky, 2009) que determinan la invasión a nuevas zonas con los requerimientos necesarios para establecerse (Mitter et al., 1988) y una variación morfológica distinta a la del origen (Adams et al., 2009); por ejemplo, algunos estudios sugieren que en zonas tropicales se presenta una mayor diversidad biológica debida a procesos como la especiación, lo que explicaría el elevado número de especies presentes en estas áreas (Ricklefs, 2006; Wiens et al., 2007). Además, varios grupos de organismos que muestran el gradiente de riqueza esperado por la biogeografía histórica con origen en los trópicos, se encuentran dispersos hacia las regiones templadas, como en el caso de angiospermas, aves, anfibios y reptiles (Wiens y Donoghue, 2004).
En las zonas de montaña del centro de México, donde predominan tipos de vegetación como los bosques de pino, pino encino y bosque mesófilo de montaña (Flores–Villela y Gerez, 1994) se ha registrado alta riqueza de especies y endemismos de anfibios y reptiles (Wake, 1987; Flores–Villela, 1993). En esta zona, se han llevado a cabo diversos estudios que analizan la riqueza, distribución, ecología y conservación de estas especies (Canseco–Márquez et al., 2004; Flores–Villela et al., 2010), evaluando los dos grupos de estos vertebrados en conjunto (Lips et al., 2004; Johnson et al., 2010), o bien, por separado (Parra–Olea et al., 2005; Paredes–García et al., 2011).
La riqueza y diversidad de especies de anfibios y reptiles en el estado de Hidalgo se estudia de forma consistente y sistemática, principalmente en la zona centro–norte (Mendoza–Quijano et al., 2006; Ramírez–Bautista et al., 2010), donde predominan algunos tipos de vegetación característicos de montaña (Rzedowski, 1978). Estos estudios aportan información haciendo uso de métodos que miden la riqueza y abundancia de especies de una área geográfica y por tipos de vegetación, así como el intercambio biótico entre sitios (Moreno, 2001; Ramírez–Bautista y Moreno, 2006). La riqueza de herpetozoos en el estado de Hidalgo es de 173 especies (Ramírez–Bautista et al., 2010), cifra que podría aumentar por los trabajos que se realizan en el estado enfocados a la taxonomía de ambos grupos (Leyte–Manrique, 2011); sin embargo, es necesario que anfibios y reptiles se analicen de manera separada, por tratarse de grupos con características e historias filogenéticas distintas (Vitt y Caldwell, 2009), y en los que la riqueza, composición, abundancia y distribución se evalúen en los distintos tipos de vegetación y a escalas espaciales diferentes para poder entender la biogeografía, ecología y conservación de las especies (Baselga et al., 2007; Baselga, 2010).
En el estado de Hidalgo existen regiones, como la sur y sureste, donde el conocimiento de su herpetofauna es escaso, y aunado ésto a que distintos factores han provocado que algunas poblaciones de reptiles experimenten una declinación similar a la de anfibios (Gibbons et al., 2000), el presente estudio tiene como objetivo conocer la riqueza y abundancia de las especies de reptiles en 3 tipos de bosques templados que se encuentran localizados en la región sureste del estado y asimismo, evaluar el recambio de especies entre las comunidades vegetales.
Materiales y métodos
Área de estudio. La zona de estudio se encuentra ubicada en la porción sureste del estado de Hidalgo, comprende parte de los municipios de Acaxochitlán y Cuautepec de Hinojosa (20°14'02"–19°58'22" N, 98°14'37"–98°07'16" O; INEGI, 2005) (Fig. 1). Los tipos de clima son templado húmedo con abundantes lluvias en verano y temperatura de 12 a 18 °C, y subhúmedo con lluvias en verano y temperatura media de 14.5 °C (INEGI, 2005; Pavón y Meza Sánchez, 2009). En estos municipios se encuentran los 3 tipos de vegetación en los que se basa el análisis de diversidad de este estudio: bosque mesófilo de montaña (BMM), que se distribuye en la porción norte de Acaxochitlán, a 1 400 a 1 800 m snm; bosque de pino–encino (BPE), que se ubica en el centro de Acaxochitlán y norte de Cuautepec, en un intervalo de elevación de 2 000 a 2 400 m snm, y bosque de pino (BP), en el centro de Cuautepec, entre los 2 300 y 2 600 m snm (Rzedowski, 1978; INEGI, 2005) (Fig. 1).
Trabajo de campo. El trabajo de campo se basó en recolectas sistemáticas. Se realizó una visita por mes al área de estudio con duración de 3 días cada una para muestrear los 3 tipos de vegetación. Los muestreos comprendieron de agosto de 2008 a julio de 2009; el método de muestreo para cada tipo de vegetación (BMM, BPE y BP) consistió en dedicar un día de recolectas con 2 horarios de observación (diurno y nocturno), de 10:00–14:00 y de19:00–23:00 horas. Los reptiles se observaron y recolectaron realizando recorridos (caminatas) en cada comunidad vegetal, y buscándolos en los diferentes tipos de microhábitats que utilizan (bajo roca, bajo troncos, entre grietas, etc.). En cada visita se recolectó con 3 personas, consideradas como horas/hombre (e.g. 4 horas por 3 personas= 12 horas/hombre), que al final dieron un esfuerzo de muestreo de 288 horas/hombre para cada tipo de vegetación. Debido a que también se observó la abundancia relativa de cada especie en los tipos de vegetación (véase Análisis de datos), se evitó muestrear repetidas veces un mismo sitio (pseudoréplicas) para prevenir el sesgo hacia las especies abundantes que pudieran influir en los resultados (Manzilla y Péfaur, 2000).
Los muestreos, curación y preservación de los organismos se realizaron con la técnica descrita por Casas–Andreu et al. (1991) modificada según los hábitos de cada especie que habita en los diferentes tipos de vegetación de esta área. Los organismos recolectados se determinaron hasta especie con las claves dicotómicas correspondientes (Smith y Taylor, 1966; Campbell y Lamar, 2004; Wilson y Townsend, 2007; Ramírez–Bautista et al., 2009), y la clasificación de cada especie se basó en los cambios taxonómicos para los reptiles de acuerdo con Wilson y Johnson (2010) y Ramírez–Bautista et al. (2010). Los organismos están depositados en el Laboratorio de Ecología de Poblaciones del Centro de Investigaciones Biológicas (CIB) de la Universidad Autónoma del Estado de Hidalgo (UAEH). Durante el trabajo de campo se contó con el permiso de colecta científica SEMARNAT–SGPA/DGVS/02726/10. Asimismo, se revisaron las bases de datos de colecciones nacionales y extranjeras, obtenidas de formatos impresos de las instituciones correspondientes, para generar una lista previa de la zona de estudio (Apéndice 1). De la literatura y bases de datos sólo se obtuvieron los registros históricos de presencia y no fueron utilizados para realizar los análisis de riqueza y diversidad.
Análisis de datos. Para conocer la completitud del inventario de reptiles en cada tipo de vegetación, se elaboraron curvas de acumulación de especies con los datos obtenidos del trabajo de campo (Moreno, 2001). Para la realización de las curvas de acumulación de especies, se utilizaron los estimadores no paramétricos ACE y Chao 1, por estar basados en la abundancia (Jiménez–Valverde y Hortal, 2003); además, se usaron logaritmos que evalúan las especies que en la muestra están representadas por 1 o 2 individuos (singletons o doubletons; Colwell y Coddington, 1994). La curva de acumulación de especies se realizó con el programa EstimateS, ver. 750 (Colwell, 2005). Para evaluar la diversidad de especies de reptiles para cada tipo de vegetación, se utilizó el método propuesto por Jost (2006), quien reconoce la "diversidad verdadera" (true diversity) mediante los números efectivos de especies. Para este análisis se tomó en cuenta el orden q = 1, es decir, donde se considera la abundancia proporcional de cada especie (Jost, 2006). La ecuación se representa como 1D = exp (H'), donde 1D es la diversidad verdadera, y exp (H') es el exponencial del índice de entropía de Shannon (Jost, 2006; Moreno et al.,2011).
Para evaluar la abundancia y equidad de los reptiles en las comunidades vegetales (BMM, BPE y BP), se elaboraron curvas de Whittaker o de rango–abundancia (Magurran, 1998; Feinsinger, 2003), en las que se usó el número de especies y de individuos por especie registrados en cada comunidad vegetal. La curva se graficó de acuerdo con el logaritmo de la proporción de cada especie p (n/N), y los datos se ordenaron desde la especie más abundante a la menos abundante. Finalmente, para conocer la diversidad beta (β) entre los tipos de vegetación, se utilizó el índice de disimilitud de Sørensen (Sørensen, 1948; Baselga, 2010) por ser una medida comúnmente usada por la dependencia en la proporción de especies compartidas entre 2 comunidades, incorporando tanto el recambio espacial como las diferencias en riqueza de especies de cada sitio (Diserud y Ødegaard, 2007; Baselga, 2010). La formula se representa: βsor= b + c / 2a + b + c, donde a es el número de especies presentes en ambos sitios, b es el número de especies presentes en el primer sitio pero no en el segundo, y c las especies presentes en el segundo sitio pero no en el primero (Sørensen, 1948; Koleff et al., 2003).
Resultados
Con base en el trabajo de campo aplicado en 12 muestreos, se generó una lista de 12 especies de lagartijas y 13 de serpientes, que hacen un total de 25 especies de reptiles encontrados en los 3 tipos de vegetación. En ésta se registra Thamnophis scaliger como nueva en el estado de Hidalgo (Cuadro 1). Con los datos bibliográficos y de las bases se agregaron 2 especies de lagartijas y 1 de serpientes, resultando 28 especies (50% lagartijas y 50% serpientes). El grupo de las lagartijas se encuentra representado por 5 familias y 8 géneros. Phrynosomatidae fue la familia mejor representada, seguida de Anguidae, Scincidae, Polychrotidae y Xantusiidae (con 7, 2, 2, 1 y 1 especies, respectivamente). Las serpientes están representadas por 4 familias, Natricidae, Dipsadidae, Colubridae y Viperidae y 9 géneros (Cuadro 1).

Curvas de acumulación y completitud del inventario. Los resultados de 12 muestreos fueron 25 especies de reptiles, distribuidas en los 3 tipos de vegetación (BMM, BPE y BP). Los estimadores no paramétricos ACE y Chao 1, predijeron un total de 33 y 30 especies, respectivamente (Fig. 2), ambos basados en la abundancia. Cada estimador predice una completitud del inventario del 77% y 83%, lo cual muestra un porcentaje aceptable conforme al grupo biológico (Moreno y Halffter, 2001; Pineda y Halffter, 2004). Asimismo y de acuerdo con los estimadores, es necesario aplicar más esfuerzo de muestreo y registrar entre 5 y 8 especies para alcanzar la asíntota y completitud del inventario (Fig. 2). En el inventario de especies por tipo de vegetación, el BMM presentó la mayor riqueza con 15 especies, seguido del BP y BPE con 13 y 12 especies, respectivamente; sin embargo, en cuanto a la completitud, el BP mostró los mayores valores, a diferencia del BPE y BMM (Fig. 3).
Los valores de diversidad verdadera contemplando las abundancias de las especies, muestran que el BMM presentó el mayor valor con 1D = 11.59; este tipo de vegetación, a su vez, presentó la mayor riqueza, seguido por el BPE con 1D = 9.12, y por último el BP, con 1D = 8.04.
Abundancia de reptiles. La abundancia y equidad en cuanto a las especies de reptiles fueron similares entre los tipos de vegetación, es decir, presentaron pocas especies con altas abundancias para las 3 comunidades vegetales (Fig. 4). Las curvas de rango–abundancia indicaron que en el BMM, las especies de reptiles dominantes fueron los scincidos Scincella gemmingeri y Plestiodon lynxe, en tanto que Sceloporus grammicus, S. variabilis y Anolis naufragus presentaron mediana dominancia; en el BPE, S. grammicus fue una de las especies dominantes junto con S. mucronatus, y esta última, junto con S. aeneus resultaron dominantes para el BP.
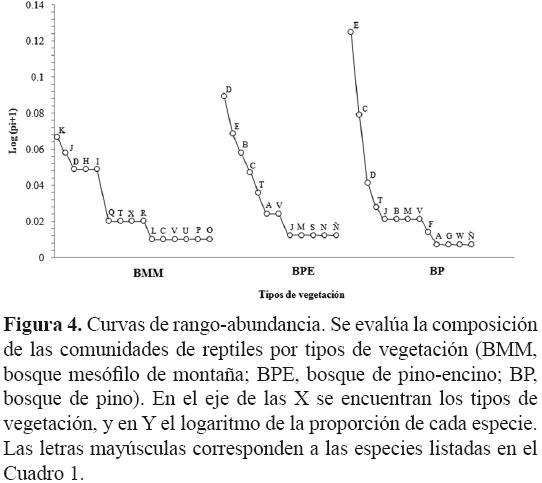
En los 3 ambientes, fueron raras las especies del grupo de serpientes. Thamnophis scalaris, T. proximus y Coniophanes fissidens en el BMM, Conopsis lineata, Crotalus triseriatus, Pituophis deppei y T. cyrtopsis en el BPE y finalmente, C. triseriatus y T. scaliger en el BP (Fig. 4).
Diversidad beta (β). De acuerdo con la medida de diversidad β de Sørensen (βsor), las asociaciones (pares) de tipos de vegetación BMM–BP y BMM–BPE presentaron los mayores valores (βsor= 0.64 y 0.63, respectivamente), mostrando un elevado recambio de reptiles entre los ambientes analizados (Cuadro 2); mientras que la combinación BPE–BP presentó el menor valor de diversidad β, reflejando un bajo recambio de especies entre sitios (βsor = 0.20; Cuadro 2).
Discusión
El conocimiento de la herpetofauna así como el análisis de su diversidad a partir de inventarios de especies resulta una manera óptima de medir la diversidad en comunidades ecológicas (Pielou, 1975). Con los registros de especies obtenidos de la literatura, bases de datos y trabajo de campo, el presente estudio muestra un alto número de especies de reptiles comparado con otros trabajos en los que se muestreó un mayor número de tipos de vegetación y registraron un menor número de especies de reptiles (Vite–Silva et al., 2010). En este estudio, la composición de especies del área está integrada por 9 familias, 17 géneros y 28 especies, mismas que constituyen el 29, 21 y 16%, respectivamente, de acuerdo con lo registrado en el estado (Ramírez–Bautista et al., 2010). De las 25 especies registradas en los 3 tipos de vegetación, 12 corresponden a lagartijas (48%) y 13 a serpientes (52%). En general, el BMM presentó la mayor riqueza con 15 especies, seguido por el BP con 13 y el BPE con 12. Además, en este trabajo se registra por primera vez en el estado de Hidalgo la culebra Thamnophis scaliger.
La riqueza de reptiles en los ambientes analizados del presente estudio sigue un patrón similar al registrado en estudios previos (Canseco–Márquez et al., 2004; Flores–Villela et al., 2010), donde se observa que los bosques templados, como el mesófilo de montaña o los de coníferas, albergan un número considerable de especies comparado con otras zonas del país (Canseco–Márquez et al., 2004; Flores–Villela y Martínez–Salazar, 2009), lo que puede deberse a que los ambientes templados de montaña presentan los requerimientos bióticos y abióticos necesarios para albergar una alta riqueza de especies, así como de endemismos (Wilson et al., 2010), que son resultado de procesos de vicarianza. La diversidad puede explicarse por factores biogeográficos, origen reciente del área en tiempo geológico, la accidentada topografía y la variación en las elevaciones de las montañas (Johnson et al., 2010); así también, por los factores ecológicos, como la capacidad de colonización, la susceptibilidad a la extinción o la tolerancia a las temperaturas (Patterson y Brown, 1991).
En la estructuración de comunidades ecológicas locales, son factores importantes de considerar el pool regional de especies (Wiens y Donoghue, 2004) y las condiciones ambientales capaces de tolerar los distintos miembros de clados, como es el caso de los anfibios y reptiles (Patterson y Brown, 1991; Wiens y Donoghue, 2004) por su capacidad de dispersión o vagilidad (Arita y Rodríguez, 2002). Sitios que presentan condiciones bióticas y abióticas similares tienden a ser colonizados por poblaciones de especies con tolerancias y requerimientos ecológicos similares (Patterson y Brown, 1991).
Los factores ecológicos de los ambientes templados influyen directamente en la riqueza y distribución espacial y temporal de los grupos de reptiles (Mendoza–Quijano et al., 2006; Vitt y Caldwell, 2009). Con el número de especies de reptiles, el análisis de riqueza por tipos de vegetación, las curvas de acumulación de especies y el uso de estimadores basados en la abundancia, se observa que en las 3 comunidades vegetales el número de especies es elevado (Figs. 2, 3) si se compara con otros estudios de ambientes templados del estado (Mendoza–Quijano et al., 2006; Ramírez–Pérez, 2008).
La riqueza de reptiles que se encontró en el BMM y BP probablemente es alta debido al grado de perturbación, que promueve más tipos de microhábitats disponibles, así como a la tolerancia de los reptiles hacia las variaciones de los factores abióticos de estos ambientes, principalmente de especies generalistas, ya que pueden invadir refugios o microhábitats que se encuentran dentro y en la periferia de los tipos de vegetación analizados (ecotonos), como lo mencionan Macip–Ríos y Muñoz–Alonso (2008) respecto a las lagartijas en fragmentos de bosque primario y cafetales. Este mismo patrón se observa en los tipos de vegetación analizados de este estudio. Sceloporus grammicus fue la especie más abundante en las 3 comunidades vegetales; S. mucronatus y S. aeneus en el BPE y BP; en el BMM, las especies dominantes fueron S. gemmingeri y P. lynxe. Un patrón similar al de este estudio se encontró en otros trabajos de ambientes templados del estado de Hidalgo (Ramírez–Bautista et al., 2010).
En el caso de las serpientes, el patrón que presentaron fue diferente. A pesar de mostrar una elevada riqueza de especies, la abundancia para cada una de éstas fue baja, varias especies sólo con 1 o 2 individuos, patrón que es consistente en todos los estudios hasta hoy analizados (e.g. Ryan et al., 2002; Urbina–Cardona y Reynoso, 2005). La abundancia de serpientes es baja debido, en mayor medida, a que las poblaciones en distintos ambientes, como los templados, son bajas de forma natural o tienen hábitos hipogeos (Vitt y Caldwell, 2009), como es el caso de especies del género Geophis que son poco conspicuas, por lo que se requiere del uso de técnicas de muestreo especializadas (e.g. trampas de caída; Manzilla y Péfaur,2000).
Tanto la riqueza como la abundancia de especies en los saurios y serpientes, se encuentran influidas por la ecología de las especies, tipo de hábitos, dieta y microhábitats a utilizar (Vitt y Caldwell, 2009); por ejemplo, la abundancia podría ser el reflejo de una alta explotación de tipos de microhábitats disponibles en el medio, es decir, si el número de microhábitats es alto, la densidad de la especie también lo será. Por ejemplo, las zonas húmedas, donde existen troncos y rocas disponibles, la densidad de las poblaciones de S. variabilis es alta; así también, donde existe una alta densidad de cactus y maleza, Aspidoscelis gularis es abundante (Vite–Silva et al., 2010).
La cobertura vegetal podría ser un factor que también afecta la riqueza y abundancia de especies, la cual está estrechamente relacionada con la ecología de algunos reptiles que ocupan ambientes húmedos, como los del BMM del presente estudio, donde se registran especies de lagartijas únicas, como Lepidophyma sylvaticum, S. gemmingeri, Anolis naufragus y serpientes, como Geophis mutitorques o C. fissidens, no así en las especies que habitan en BP o BPE (Flores–Villela et al., 2010).
El método utilizado para evaluar la diversidad muestra que el BMM presentó el mayor valor de diversidad, el cual está dado por la riqueza, abundancia y equitatividad de los individuos de cada una de las especies en cada comunidad vegetal (Stirling y Wilsey, 2001; Jost, 2006), mostrando que las abundancias de las especies varían en menor grado unas de otras (véase Fig. 4). En contraste, en el BPE y el BP se presentaron valores menores de diversidad; sin embargo, en estos ambientes el BPE presentó un valor de diversidad mayor que el BP a diferencia del número de especies registrado. Este resultado es el reflejo de las diferencias en las abundancias entre las especies presentes en cada ambiente, ya que para el BP, la elevada abundancia de S. mucronatus disminuyó la equitatividad en la comunidad, mostrando la dominancia de esta especie con respecto a las demás. Este patrón se ha registrado en otros ambientes templados, donde a pesar de que el BMM presenta un mayor número de especies, las abundancias son bajas; caso contrario en el BPE y BP, donde las abundancias de algunas especies características de estos ambientes es elevada (Ryan et al., 2002; Mendoza–Quijano et al., 2006; Ramírez–Bautista y Moreno, 2006), lo que sugiere que las condiciones favorecen en mayor medida a grupos de especies asociados a estos tipos de ambientes, como T. eques, S. mucronatus, S. aeneus, entre otros, que pueden explotar recursos en forma similar (Barbault et al., 1985; Howard y Hailey, 1999).

Lo anterior muestra la preferencia que presentan los reptiles por cada tipo de vegetación, como se observa en los altos valores de diversidad β obtenidos entre los tipos de vegetación que presentan características ambientales diferentes, como el BMM con respecto al BPE y BP (Cuadro 2). La alta disimilitud en la composición de reptiles entre tipos de vegetación, tomando en cuenta el recambio espacial y las diferencias en riqueza específica, se debe a los requerimientos ecológicos de cada grupo (lagartijas y serpientes), así como de cada especie; por ejemplo, C. lineata, T. eques, S. mucronatus, o S. grammicus, entre otras, se distribuyen en ambientes templados (bosque de pino y pino–encino) a secos, donde la disponibilidad de microhábitats, utilizados por estas especies es mayor (Jones, 1981); de la misma forma, las características morfológicas, como la talla corporal, limitan en gran medida la capacidad de dispersión de los organismos en los diferentes tipos de vegetación (Arita, 1997), lo que genera la presencia de especies exclusivas y endémicas y podría incrementar notablemente los valores de diversidad β a distintos niveles espaciales, como lo han mencionado Arita y Rodríguez (2002).
La composición de especies de cualquier grupo en un determinado paisaje no muestra necesariamente su dinámica, ni relaciones espaciales semejantes en los distintos sitios muestreados (Halffter y Moreno, 2005), debido a que en la composición de especies de las comunidades interfieren distintos aspectos del paisaje y/o región (fenómenos geográfico–históricos; Flores–Villela y Martínez–Salazar, 2009). Sin embargo, el conocer la riqueza de especies de reptiles en distintos sitios y a distintas escalas, así como los factores biogeográficos históricos que dieron origen a distintos clados de anfibios y reptiles en regiones tropicales y templadas de México, representan las bases para entender los patrones ecológicos, biogeográficos, así como el reemplazo biótico entre sitios (Wiens y Donoghue, 2004; Halffter y Moreno, 2005).
Este estudio muestra un conocimiento importante sobre la riqueza y distribución de los reptiles en ambientes templados del sureste del estado de Hidalgo, ya que éste presenta una alta diversidad que puede ser mayor si se consideran las especies que podrían faltar en la lista que aquí se presenta, los trabajos taxonómicos de algunos grupos (Leyte–Manrique, 2011), o bien, los nuevos registros y especies para el estado, lo que ayudará a plantear futuros estudios sobre diversidad, ecología, biogeografía y conservación, tanto de reptiles como de otros grupos biológicos.
Agradecimientos
Los autores agradecen a Uriel Hernández–Salinas, Christian Berriozabal–Islas, Osiel Barrera–Hernández y Gustavo Rivas–Granados por el apoyo que nos otorgaron durante el trabajo de campo. A las autoridades de las comunidades visitadas por el apoyo logístico brindado en este estudio. A los proyectos CONACYT S52552–Q y Diversidad Biológica del Estado de Hidalgo FOMIX–HGO–2008–95828 y a dos revisores anónimos por los comentarios que mejoraron el manuscrito de esta versión.
Literatura citada
Adams, D. C., C. M. Berns, K. H. Kozak y J. J. Wiens. 2009. Are rates of species diversification correlated with rates of morphological evolution? Proceedings of the Royal Society of London, series B, Biological Sciences 276:2729–2738. [ Links ]
Arita, H. T. 1997. The non–volant mammal fauna of Mexico: species richness in a megadiverse country. Biodiversity and Conservation 6:7 87–795. [ Links ]
Arita, H. T. y P. Rodríguez. 2002. Geographic range, turnover rate and the scaling of species diversity. Ecography 25:541–553. [ Links ]
Barbault, R., A. Ortega y M. E. Maury. 1985. Food partitioning and community organization in a mountain lizard guild of Northern Mexico. Oecología 65:5 50–554. [ Links ]
Baselga, A., A. Jiménez–Valverde y G. Niccolini. 2007. A multiple–site similarity measure independent of richness. Biology Letters 3:6 42–645. [ Links ]
Baselga, A. 2010. Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography 19:134–143. [ Links ]
Campbell, J. A. y W. W. Lamar. 2004. The venomous reptiles of the Western Hemisphere, vol. I y II. Cornell University, Ithaca, New York. 870 p. [ Links ]
Canseco–Márquez, L., F. Mendoza–Quijano y M. G. Gutiérrez–Mayén. 2004. Análisis de la distribución de la herpetofauna. In Biodiversidad de la sierra Madre Oriental, I. Luna, J. J. Morrone y D. Espinosa (eds.). Universidad Nacional Autónoma de México/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, D. F. p. 417–437. [ Links ]
Casas–Andreu, G., G. Valenzuela–López y A. Ramírez–Bautista. 1991. Cómo hacer una colección de anfibios y reptiles. Cuadernos del Instituto de Biología 10, Universidad Nacional Autónoma de México, México, D. F. 68 p. [ Links ]
Colwell, R. K. 2005. EstimateS: ver. 7.5. Statistical estimation of species richness and shared species from samples. [ Links ]
Colwell, R. y J. Coddington. 1994. Estimating terrestrial biodiversity through exploration. Philosophical Transactions of the Royal Society of London (Series B) 345:101–118. [ Links ]
Diserud, O. H. y F. Ødegaard. 2007. A multiple–site similarity measure. Biology Letters 3:20–22. [ Links ]
Feinsinger, P. 2003. El diseño de estudios de campo para la conservación de la biodiversidad. FAN (Fundación Amigos de la Naturaleza), Santa Cruz de la Sierra, Bolivia. 242 p. [ Links ]
Flores–Villela, O. 1993. Herpetofauna mexicana. Special Publication Carnegie Museum of Natural History 17:1–73. [ Links ]
Flores–Villela, O. y P. Gerez. 1994. Biodiversidad y conservación en México: vertebrados, vegetación y uso del suelo. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Universidad Nacional Autónoma de México, México, D.F. 439 p. [ Links ]
Flores–Villela, O. y E. A. Martínez–Salazar. 2009. Historical explanation of the origin of the herpetofauna of Mexico. Revista Mexicana de Biodiversidad 80:817–833. [ Links ]
Flores–Villela, O., L. Canseco–Márquez y L. M. Ochoa–Ochoa. 2010. Geographic distribution and conservation of the Mexican central highlands herpetofauna. In Conservation of the Mesoamerican amphibians and reptiles, L. D.Wilson, J. H. Towsend y J. D. Johnson (eds.). Eagle Mountain, Eagle Mountain, Utah. p. 303–321. [ Links ]
Gibbons, J. W., D. E. Scott, T. J. Ryan, K. A. Buhlmann, T. D. Tuberville, B. Metts, J. L. Greene, T. M. Mills, Y. A. Leiden, S. M. Poppy y C. T. Winne. 2000. The global decline of reptiles, deja'vu amphibians. Biological Science 50:653–666. [ Links ]
Halffter, G. y C. E. Moreno. 2005. Significado biológico de las diversidades alfa, beta y gamma. In Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma, vol. 4. G. Halffter, J. Soberón, P. Koleff y A. Melic (eds.). Monografías Tercer Milenio, Sociedad Entomológica Aragonesa/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Diversitas/ Comisión Nacional de Ciencia y Tecnología, Zaragoza. p. 5–18. [ Links ]
Howard, K. y A. Hailey. 1999. Microhabitat separation among diurnal saxicolous lizards in Zimbabwe. Journal of Tropical Ecology 15:367–378. [ Links ]
INEGI (Instituto Nacional de Estadística, Geografía e Informática). 2005. Mapa digital de México. Aguascalientes, Aguascalientes. http://www.inegi.org.mx/inegi/default.aspx; última consulta: 13.I.2011. [ Links ]
Jiménez–Valverde, A. y J. Hortal. 2003. Las curvas de acumulación de especies y la necesidad de evaluar los inventarios biológicos. Revista Ibérica de Aracnología 8:151–161. [ Links ]
Johnson, J. D., V. Mata–Silva y A. Ramírez Bautista. 2010. Geographic distribution and conservation of the herpetofauna of southeastern Mexico. In Conservation of the Mesoamerican amphibians and reptiles, L. D.Wilson, J. H. Towsend y J. D. Johnson (eds.). Eagle Mountain, Eagle Mountain, Utah. p. 323–369. [ Links ]
Jones, B. K. 1981. Effects of grazing on lizard abundance and diversity in western Arizona. The Southwestern Naturalist 26:105–107. [ Links ]
Jost, L. 2006. Entropy and diversity. Oikos 113:363–375. [ Links ]
Jost, L. 2007. Partitioning diversity into independent alpha and beta components. Ecology 88:2427–2439. [ Links ]
Koleff, P., K. J. Gaston y J. K. Lennon. 2003. Measuring beta diversity for presence–absence data. Journal of Animal Ecology 72:367–382. [ Links ]
Leyte–Manrique, A. 2011. Especiación en el complejo Sceloporus grammicus, evidencias morfológicas y ecológicas. Tesis, Doctorado Universidad Autónoma del Estado de Hidalgo, Pachuca. 87 p. [ Links ]
Lips, K. R., J. R. Mendelson III, A. Muñoz–Alonso, L. Canseco–Márquez y D. G. Mulcahy. 2004. Amphibian populations decline in mountane southern Mexico: resurveys of historical localities. Biological Conservation 119:555–564. [ Links ]
MacArthur, R. H. y E. O. Wilson. 1967. The theory of island biogeography. Princenton University Press, New Jersey. 203 p. [ Links ]
Macip–Ríos, R. y A. Muñoz–Alonso. 2008. Diversidad de lagartijas en cafetales y bosque primario en el Soconusco chiapaneco. Revista Mexicana de Biodiversidad 79:185–195. [ Links ]
Magurran, A. 1998. Ecological biodiversity and its measurement. Princenton University Press, New Jersey. 179 p. [ Links ]
Magurran, A. 2004. Measuring biological diversity. Blackwell, Oxford. 192 p. [ Links ]
Manzilla, J. y J. E. Péfaur. 2000. Consideraciones sobre métodos y técnicas de campo para el estudio de anfibios y reptiles. Revista de Ecología Latinoamericana 7:17–30. [ Links ]
Mendoza–Quijano, F., G. Quijano–Manilla y R. F. Mendoza–Paz. 2006. Análisis fenético de la herpetofauna de los bosques mesófilos de montaña del este de Hidalgo. In Inventarios herpetofaunísticos de México: avances en el conocimiento de su biodiversidad. Núm. 3, A. Ramírez–Bautista, L. Canseco–Márquez y F. Mendoza–Quijano (eds.). Sociedad Herpetológica Mexicana, México, D. F./ Benemérita Universidad Autónoma de Puebla, Puebla. p.99–109. [ Links ]
Mitter, C., B. Farrell y B. Wiegmann. 1988. The phylogenetic study of adaptive radiation: has phytophagy promoted insect diversification? American Naturalist 132:107–128. [ Links ]
Moreno, C. E. 2001. Métodos para medir la biodiversidad, vol. 1. M&T–Manuales y Tesis. Sociedad Entomológica Aragonesa, Zaragoza, 84 p. [ Links ]
Moreno, C. E. y G. Halffter. 2001. Spatial and temporal analysis of the alpha, beta a gamma diversities of bats in a fragmented landscape. Biodiversity and Conservation 10:367–382. [ Links ]
Moreno, C. E., F. Barragán, E. Pineda y N. P. Pavón. 2011. Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad 82:1249–1261. [ Links ]
Parra–Olea, G., M. García–Paris, T. J. Papenfuss y D. B. Wake. 2005. Systematics of the Pseudoeurycea belli (Caudata: Plethodontidae) species complex. Herpetologica 61:145–158. [ Links ]
Paredes–García, D. M., A. Ramírez–Bautista y M. A. Martínez–Morales. 2011. Distribución y representatividad de las especies del género Crotalus en las áreas naturales protegidas de México. Revista Mexicana de Biodiversidad 82:689–700. [ Links ]
Patterson, B. D. y J. H. Brown. 1991. Regionally nested patterns of species composition in granivorous rodent assemblages. Journal of Biogeography 18:395–402. [ Links ]
Pavón, N. P. y M. Meza–Sánchez. 2009. Cambio climático en el estado de Hidalgo: clasificación y tendencias climáticas. Ciencia al día, Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo. 168 p. [ Links ]
Pielou, E. C. 1975. Ecological diversity. Wiley–Interscience, Hoboken, New Jersey. 165 p. [ Links ]
Pineda, E. y G. Halffter. 2004. Species diversity and hábitat fragmentation: frogs in a tropical montane landscape in Mexico. Biological Conservation 117:499–508. [ Links ]
Rabosky, D. L. 2009. Ecological limits on clade diversification in higher taxa. American Naturalist 173:662–674. [ Links ]
Ramírez–Bautista, A. y C. Moreno. 2006. Análisis comparativo de la herpetofauna de cuatro regiones geográficas de México. In Inventarios herpetofaunísticos de México: avances en el conocimiento de su biodiversidad 3, A. Ramírez–Bautista, L. Canseco–Márquez y F. Mendoza–Quijano (eds.). Benemérita Universidad Autónoma de Puebla/ Sociedad Herpetológica Mexicana, México, D. F. p. 74–98. [ Links ]
Ramírez–Bautista, A., U. Hernández–Salinas, U. O. García–Vázquez, A. Leyte–Manrique y L. Canseco–Márquez. 2009. Herpetofauna del Valle de México: diversidad y conservación. Universidad Autónoma del Estado de Hidalgo/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, D. F. 240 p. [ Links ]
Ramírez–Bautista, A., U. Hernández–Salinas, F. Mendoza–Quijano, R. Cruz–Elizalde, V. D. Vite–Silva, B. P. Stephenson y A. Leyte–Manrique. 2010. Lista anotada de los anfibios y reptiles del estado de Hidalgo, México. Universidad Autónoma del Estado de Hidalgo, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México, D. F. 104 p. [ Links ]
Ramírez–Pérez, A. 2008. Herpetofauna del Parque Nacional El Chico y su zona de influencia, Hidalgo, México. Tesis, Universidad Autónoma del Estado de Hidalgo, Pachuca 100 p. [ Links ]
Ricklefs, R. E. 2006. Global variation in the diversification rate of passerine birds. Ecology 87:2468–2478. [ Links ]
Ryan, T. J., T. Philippi, Y. A. Leiden, M. E. Dorcas, T. B. Wigley y J. W. Gibbons. 2002. Monitoring herpetofauna in a managed forest landscape: effects of habitat types and census techniques. Forest Ecology and Management 167:83–90. [ Links ]
Rzedowski, J. 1978. Vegetación de México. Limusa, México, D. F. 432 p. [ Links ]
Smith, H. M. y E. H. Taylor. 1966.An anotated checklist and keys to the amphibians and reptiles. A reprint of bulletins 187, 194 y 199. Eric Lundberg, Ashton, Maryland. 429 p. [ Links ]
Sørensen, T. A. 1948. A method of stablishing groups of equal amplitude in plant sociology based on similarity of species content, and its application to analyses of the vegetation on Danish commons. Kongelige Danske Videnskabernes Selskabs Biologiske Skrifter 5:1–34. [ Links ]
Stirling, G. y B. Wilsey. 2001. Empirical relationships between richness species, evenness and proportional diversity. American Naturalist 1258:286–299. [ Links ]
Urbina–Cardona, J. N. y V. H. Reynoso. 2005. Recambio de anfibios y reptiles en el gradiente potrero–borde–interior en Los Tuxtlas, Veracruz, México. In Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma, vol. 4, G. Halffter, J. Soberón, P. Koleff y A. Melic (eds.). Monografías Tercer Milenio, Sociedad Entomológica Aragonesa/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Diversitas/ Comisión Nacional de Ciencia y Tecnología, Zaragoza. p. 191–207. [ Links ]
Vitt, L. J. y J. P. Caldwell. 2009. Herpetology. An introductory biology of amphibians and reptiles, tercera edición. Academic, New York 697 p. [ Links ]
Vite–Silva, V. D., A. Ramírez–Bautista y U. Hernández–Salinas. 2010. Diversidad de anfibios y reptiles de la Reserva de la Biosfera Barranca de Metztitlán, Hidalgo, México. Revista Mexicana de Biodiversidad 80:473–485. [ Links ]
Wake, D. B. 1987. Adaptative radiation of salamanders in Middle America cloud forests. Annals Missouri Botanical Garden 74:242–264. [ Links ]
Wilson, L. D. y J. H. Townsend. 2007. A checklist and key to the snakes of the genus Geophis (Squamata: Colubridae: Dipsadinae), with commentary on distribution and conservation. Zootaxa 1395:1–31. [ Links ]
Wilson, L. D. y J. D. Johnson. 2010. Distributional patterns of the herpetofauna of Mesoamerica, a biodiversity hotspot. In Conservation of the Mesoamerican Amphibians and Reptiles, L. D. Wilson, J. H. Towsend y J. D. Johnson (eds.). Eagle Mountain, Eagle Mountain, Utah. p.31–235. [ Links ]
Wilson, L. D., J. H. Towsend y J. D. Johnson. 2010. Conservation of the Mesoamerican amphibians and reptiles. Eagle Mountain, Eagle Mountain, Utah. 812 p. [ Links ]
Wiens, J. J. y M. J. Donoghue. 2004. Historical biogeography, ecology and species richness. Trends in Ecology and Evolution 19:639–644. [ Links ]
Wiens, J. J., G. Parra–Olea, M. García–Paris y D. B. Wake. 2007. Phylogenetic history underlies elevational patterns of biodiversity in tropical salamanders. Proceedings of the Royal Society of London Series B, Biological Sciences 274: 919–928. [ Links ]
Whittaker, R. H. 1972. Evolution and measurement of species diversity. Taxon 21:213–251. [ Links ]
Whittaker, R. H., K. J. Willis y R. Field. 2001. Scale and species richness: towards a general, hierarchical theory of species diversity. Journal of Biogeography 28:453–470. [ Links ]














