Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.83 no.1 México mar. 2012
Taxonomía y sistemática
Variación morfológica del camarón café (Farfantepenaeus californiensis) en el Pacífico mexicano
Morphological variation of brown shrimp (Farfantepenaeus californiensis) in Mexican Pacific
María de Lourdes Barbosa–Saldaña*, Píndaro Díaz–Jaimes y Manuel Uribe–Alcocer
Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. Apartado postal 70–305. Circuito exterior, Ciudad Universitaria, 04510 México, D. F., México.*lulubs_12@yahoo.com.mx.
Recibido: 26 agosto 2010;
aceptado: 04 septiembre 2011
Resumen
El análisis multivariado de datos morfométricos se ha utilizado ampliamente en especies comerciales para definir unidades de pesca independientes. En la presente investigación se analizó la diferenciación del camarón café Farfantepenaeus californiensis (Holmes, 1900) del Pacífico mexicano mediante el análisis morfométrico de 171 individuos recolectados en 4 localidades y se comparó con la subdivisión geográfica que el Instituto Nacional de la Pesca estableció para el monitoreo de sus poblaciones. La variación morfológica de cada muestra se estimó mediante el (CV%) promedio de 18 medidas. Se realizó un análisis discriminante utilizando proporciones estandarizadas de algunas de estas medidas y se calcularon las distancias de Manhattan entre las muestras; con éstas se obtuvo un dendrograma por el método UPGMA en el cual la agrupación de las localidades mostró una diferenciación morfológica clinal, relacionada con un gradiente geográfico. La baja variabilidad morfológica estimada al interior de las muestras permitió inferir que cada localidad conforma un grupo fenotípicamente homogéneo, aunque con claras diferencias entre sí, que podrían estar relacionadas con las características ambientales de cada localidad y con posibles variaciones genéticas entre las poblaciones. La diferenciación morfológica del camarón café del Pacífico mexicano que se encontró en esta investigación aporta elementos adicionales para sustentar la división geográfica que el Instituto Nacional de la Pesca ha establecido para el estudio de la pesquería del camarón.
Palabras clave: stock, pesquerías, subdivisión poblacional, análisis discriminante, zonas geográficas, variación clinal, cefalotórax, segmento abdominal.
Abstract
Multivariate analyses of morphometric data have been widely used to define independent fishing units for exploited species. In this study we analyzed the morphometric variability of 4 brown shrimp Farfantepenaeus californiensis (Holmes, 1900) locations from the Mexican Pacific to assess whether differentiation agrees with the geographical subdivision established by the Instituto Nacional de la Pesca to monitoring the brown shrimp populations. The morphologic variation of each sample was estimated through the variation coefficient (CV%) averaged over 18 measurements. A discriminant analysis was made using the standardized ratios for some of the measurements. Manhattan distances among samples were calculated to obtain a dendrogram with the UPGMA method where localities grouping showed a clinal pattern of morphological differentiation related to a geographical gradient. The low estimated morphologic variability within samples allowed us to conclude that each sampled locality conforms a phenotypically homogeneous group, with clear differences to the others. These differences could be explained on basis of the environmental characteristics of each locality in addition to possible genetic variations between populations. Thus, the morphological differentiation of the brown shrimp populations of the Mexican Pacific detected in this study provides additional elements to sustain the geographical division that the Instituto Nacional de la Pesca established to survey the shrimp fishery.
Key words: stock, fisheries, population subdivision, discriminant analysis, geographic zones, clinal variation, cephalotorax, abdominal segment.
Introducción
Uno de los aspectos fundamentales para el manejo de una pesquería es la identificación de las unidades de pesca, también conocidas como stocks (Begg et al., 1999). Un stock representa una entidad discreta ubicada en un mismo espacio y tiempo con parámetros biológicos únicos, tales como tasa de crecimiento, distribución, mortalidad, fecundidad y diversidad genética, entre otros (Carvalho y Hauser, 1994). El manejo sustentable de una pesquería se alcanza cuando con base en todas estas características se obtiene un equilibrio entre las capturas y el reclutamiento (Allendorf et al., 1987; Wallace y Fletcher, 2001). Lograr dicho equilibrio resulta difícil cuando no está considerado el número de unidades posibles de manejo que conforman el recurso. La administración de una pesquería en ausencia de información acerca de la delimitación de stocks puede derivar en el uso inadecuado de la misma, que incluso podría poner en riesgo de colapso poblaciones genéticamente diferenciadas (Mustafa y Rahman, 1999; Ward, 2006).
Es frecuente que factores físicos como la temperatura, el patrón de corrientes o la misma topografía del área delimiten geográficamente un stock (Slatkin, 1993). Sin embargo, los stocks también presentan características propias, que contribuyen en gran medida a definir su amplitud espacial (Hedgecock, 1994).
De ahí que se implanten técnicas que retoman diversos aspectos de la biología de las poblaciones para su delimitación, tales como el marcaje y recaptura, los análisis de composición bioquímica de tejidos y partes duras (Kumpf et al., 1987), la variación genética evaluada a partir de diferentes marcadores moleculares (De la Rosa–Velez et al., 2000; Díaz–Jaimes et al., 2006), o la variación morfológica (Cadrin y Friedland, 1999; Tzeng et al., 2001; Turan et al., 2006; Ferrito et al., 2007; Konan et al., 2010).
Los análisis morfométricos constituyen una técnica accesible y de muy bajo costo que ha mostrado su eficacia para diferenciar stocks. Por otra parte, la expresión fenotípica de los caracteres está en función tanto de las características del ambiente en el que un individuo se desarrolla como de la información contenida en sus genes (Ferritro et al., 2007; Konan et al., 2010), por lo que la delimitación de los stocks que utiliza este tipo de información proporciona una visión integral que abarca el componente ambiental y el evolutivo de las especies.
Es por ello que esta metodología se ha aplicado exitosamente para la identificación y discriminación de stocks en numerosas pesquerías (Cadrin y Friedland, 1999); por ejemplo, la proporción del tamaño de las quelas se ha utilizado para estudiar la variación geográfica en relación con la variación en talla y la madurez en algunos decápodos, como el cangrejo curtidor (Chionoecetes bairdi y C. opilio; Somerton, 1981) y el cangrejo rey dorado (Lithodes aequispina; Somerton y Otto, 1986). Asimismo, Díaz et al. (1995) relacionaron poblaciones de Penaeus schmitti, P. vannamei y P. stylirostris, utilizando la información tanto de caracteres morfométricos como de datos genéticos.
La pesquería del camarón en el Pacífico mexicano comprende desde la zona del alto golfo de California, en el delta del río Colorado, hasta la frontera con Guatemala; incluye la costa occidental de Baja California Sur y prácticamente todos los sistemas lagunares (Dore y Frimodt, 1987).
Para fines del monitoreo de las poblaciones, esta pesquería se ha dividido en zonas que a su vez se dividen en subzonas que están evaluadas por los diferentes centros regionales de investigación pesquera: zona 10 (alto golfo, costas de Baja California y Sonora); zona 50 (bahía Magdalena y costa occidental de Baja California); zona 20 (costa de Sonora); zonas 30, 40 y 60 (costa de Sinaloa); zona 70 (costas de Jalisco, Colima y Michoacán); zona 80 (costas de Guerrero y Oaxaca) y zona 90 (golfo de Tehuantepec) (SAGARPA, 2009).
La pesquería del Pacífico mexicano sustenta aproximadamente el 60% de la producción global por pesca de camarón, y aunque dicha producción se encuentra conformada por 5 especies: F. californiensis, Litopenaeus stylirostris, L. vannamei, F. brevirrostris y L. occidentalis (Martínez, 1993); el camarón café aporta el 40% de esta producción, seguido por L. stylirrostris (40%) y L. vannamei (17%) (SEMARNAP, 2006). Sin embargo, mientras que estas 2 últimas especies tienen una producción extra por cultivo, la producción del camarón café está restringida exclusivamente a la pesca (Martínez, 1993).
La delimitación de las unidades de pesca de camarón en el Pacífico mexicano se basa principalmente en la geografía de la zona (SAGARPA, 2009), y considera la producción en conjunto de todas las especies que la constituyen. No obstante, algunos estudios genéticos con diferente cobertura realizados en las áreas de estudio, revelaron la existencia de poblaciones genéticamente discretas. En un estudio de la variación genética del camarón café mediante aloenzimas, Díaz–Jaimes et al. (2006) separan las poblaciones de la zona norte, representadas por las costas de Sinaloa, de las del sur, representadas por las costas de Oaxaca. Por su parte, De la Rosa–Vélez et al. (2000), quienes analizaron camarones de la misma especie en el golfo de California, señalan una tendencia a diferenciar genéticamente las poblaciones del alto golfo, de las poblaciones de la zona centro y sur del golfo de California.
No se ha corroborado si la división de las zonas delimitadas por la SAGARPA corresponde con posibles diferencias morfológicas que permitan establecer métodos accesibles que contribuyan al desarrollo de estrategias integrales para el manejo del recurso. La presente investigación tiene como objetivo evaluar si la demarcación de las unidades de pesca de camarón café, comparada con otras metodologías, corresponde a la diferenciación de algunos de los stocks de esta especie, definidos a partir de 18 variables morfométricas.
Materiales y métodos
Se recolectaron muestras de camarón café F. californiensis de una talla superior a 134.5 mm, para asegurarse que estuvieran en la fase adulta (Romero–Sedano et al., 2004; Aragón–Noriega y Alcántara–Razo, 2005), en 4 localidades del Pacífico mexicano: Puerto San Carlos, Baja California Sur (n= 64); Mazatlán, Sinaloa (n= 50), Salina Cruz, Oaxaca (n= 32) y Puerto Madero, Chiapas (n= 31) (Cuadro 1). Dichas localidades coinciden con 4 de las zonas (50, 40, 80 y 90) delimitadas por la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA).
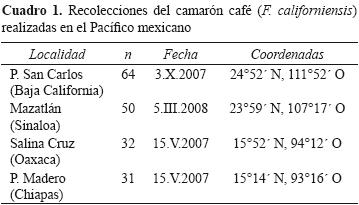
Los organismos se obtuvieron mediante arrastres a una profundidad de 13.5 brazas en las campañas de observación en la época de veda correspondientes a 2007 y 2008 que realizó el Instituto Nacional de la Pesca, SAGARPA (Cuadro 1). En cada muestreo fueron seleccionados ejemplares completos, sin ninguna preferencia de sexo, y sólo se verificó la presencia de características diagnósticas de la especie para su identificación, tales como la carina gastro–frontal bien definida y la carina gastro–orbital con longitud al menos de 4/5 de la distancia entre la espina hepática y el margen orbital (Pérez–Farfante, 1988). Los individuos seleccionados fueron colocados individualmente en bolsas de plástico para proteger en lo posible las estructuras; se congelaron y transportaron al laboratorio de genética en el Instituto de Ciencias del Mar y Limnología, UNAM. Las muestras de Puerto San Carlos fueron recolectadas directamente con los pescadores de pesca ribereña, que utilizan embarcaciones menores.
En cada organismo se registraron las medidas morfométricas empleadas en otros estudios con camarones peneidos (Díaz et al., 1995) y se incluyeron otras medidas que se consideraron similares a las registradas por dichos autores (Fig. 1); éstas fueron: longitud del rostro (LR); longitud del cefalotórax (LC); longitud entre el diente epigástrico y el primer diente rostral (LD); longitud de pedipalpos (LP); ancho del cefalotórax (AnC); longitud del primer segmento abdominal (LS1); altura del tercer segmento abdominal (AlS3); ancho del tercer segmento abdominal (AnS3); longitud del quinto segmento abdominal (flexionado) (LS5); altura del sexto segmento abdominal (AlS6); longitud del sexto segmento abdominal (LS6); ancho del sexto segmento abdominal (AnS6); ancho entre el quinto y el sexto segmento abdominal (AnS5S6); longitud del rostro al telson (L); longitud verdadera, de la espina antenal, al último segmento abdominal (LV); dientes dorsales (DD) y dientes ventrales (DV). Para las medidas se utilizó un vernier (±0.005 cm), fueron tomadas por una sola persona y se siguió siempre un mismo criterio; el peso de los organismos se registró mediante una balanza granataria Sartorious (± 0.05 g).
Debido al traslado, algunos organismos presentaron ruptura del rostro, telson o pereiópodos, por lo que no fueron considerados para la discriminación entre localidades, pero para la estimación de la variación morfológica sí fueron incluidos todos los organismos recolectados. Del mismo modo, para la muestra de Puerto San Carlos no fue posible registrar las medidas de peso y peso del abdomen; por ello, estas medidas sólo se consideraron para estimar la variación morfológica de cada localidad.
Análisis de datos. Se estimó la media, la desviación estándar y el coeficiente de variación para cada medición de las muestras respectivas; la estimación de la variación morfológica se realizó a partir del coeficiente de variación promedio (CV%) de todas las medidas por localidad y la confiabilidad de las estimaciones se verificó mediante la desviación estándar y la precisión.
A pesar de que sólo se consideraron organismos adultos, se realizaron análisis de ANOVA, utilizándose la LC y la L como variables de respuesta para comparar las tallas de los organismos en las diferentes muestras. Debido a que las tallas difirieron de manera significativa (p<0.05), se emplearon proporciones de las distintas medidas corporales: LC/AnC; L/LC; LR/LC; LC/LP; LR/LD; LR/LP; AlS3/AnS3; AlS3/LS1; LS5/ AnS5S6; LS6/AnS5S6, LS6/AlS6 y L/LV. Estas proporciones se estandarizaron con la media y la desviación estándar de todos los datos (Freund y Walpole, 1990).
Para descartar que la diferenciación de las muestras se viera influida por las diferencias entre los sexos y/o tamaño de los organismos, únicamente se consideraron aquellas proporciones para las cuales no existieron diferencias significativas entre sexos; para ello, se realizó una prueba de t para cada una de las proporciones y sólo se consideraron aquellas proporciones que no presentaran una correlación (r), relevante con la longitud total (L) (Turan et al., 2006). Las variables de DD y DV se incluyeron al análisis sólo estandarizadas.
Dado que las variables fueron transformadas, sólo se consideró relevante la correlación con la talla cuando el coeficiente de correlación mostró un valor mayor a 0.33, debido al énfasis que Pearson (1897) y Kronmal (1993) ponen en que 2 variables que son independientes entre sí pueden presentar un valor de correlación alto porque cada una de ellas presenta una relación significativa con una tercera variable, lo que al parecer, pudo presentarse en este caso, pues tanto la talla, como el valor de la proporción tienen relación con la variable que se utiliza como el denominador de la proporción. Por otro lado, las correlaciones espurias también pueden presentarse cuando 2 o más grupos de observaciones que relacionan 2 variables independientes se analizan simultáneamente. Para estimar el coeficiente de correlación en el análisis que aquí se presenta, se tomaron en cuenta las 4 localidades, las cuales mostraron tamaños significativamente diferentes.
Empleando las proporciones previamente seleccionadas se realizó un análisis discriminante para evaluar el grado de diferenciación entre las distintas localidades. A partir de este análisis, también se determinaron las variables que tuvieron mayor contribución en la separación de los sitios geográficos. Las diferencias estadísticas fueron revisadas mediante un MANOVA (Hair et al., 1989). Cada organismo fue asignado a un grupo determinado cuyo centroide se encontrara a una menor distancia. Los porcentajes correctos de clasificación fueron calculados para evaluar la eficiencia del análisis discriminante.
Para verificar que el uso de las proporciones seleccionadas en el análisis discriminante no presentase algún problema de correlación con las diferencias de talla entre las localidades, se realizó un análisis de componentes principales utilizando las 16 variables originales, y con dichas componentes, que tienen la ventaja de ser ortogonales, se realizó otro análisis discriminante. Tanto el análisis de las proporciones, descrito inicialmente, como el de los componentes principales tuvieron los mismos resultados; sin embargo, se optó por presentar los resultados del análisis empleando las proporciones, dado que al utilizarlas la interpretación de las variables que más contribuyen a la diferenciación entre localidades es más directa.
Puesto que las localidades de Salina Cruz y Puerto Madero exhibieron tamaños de muestra menores, para descartar que ello pudiera influir en el incremento de los errores en la reclasificación, primero se realizó el mismo análisis, sustrayendo la localidad de Salina Cruz, y posteriormente un tercer análisis en el que se excluyó la de Puerto Madero.
Las componentes canónicas producidas por el análisis discriminante de las proporciones (Hair et al., 1989) se utilizaron para identificar las variables con mayor contribución a la diferenciación entre las 4 localidades. Las distancias de Manhattan entre los centroides de las muestra se calcularon con los valores de estas componentes canónicas. A partir de las distancias de Manhattan entre pares de muestras se construyó un dendrograma mediante el método de agrupamiento UPGMA (Tzeng et al., 2001). Todos los análisis fueron realizados con el software JMP versión 7.0.
Resultados
La talla promedio de los organismos difirió de manera significativa (p < 0.05) entre localidades. Los organismos con la menor longitud correspondieron a la localidad de Salina Cruz (L= 14.78 cm ± 0.53 cm; LC= 3.78 cm ± 0.12 cm), seguidos de los de Puerto Madero (L= 15.05 cm ± 0.60 cm; LC= 3.86 cm ± 0.15 cm) y Mazatlán (L= 16.05 cm ± 2.5 cm; LC= 4.03 cm ± 0.42 cm) y los de mayor talla se encontraron en Puerto San Carlos (L= 16.10 cm ± 1.42 cm; LC= 4.04 cm ± 0.49 cm).
La localidad de Mazatlán mostró la mayor variación morfológica, con un coeficiente de variación promedio de 12.18% (desviación estándar (S)= 5.79; precisión (δ)= 1.60) seguida de la localidad de Puerto San Carlos con un coeficientes de variación promedio de 10.31% (S= 2.13; δ= 0.52). Las localidades del sureste, Salina Cruz y Puerto Madero, fueron las muestras más homogéneas, presentando los más bajos valores en sus coeficientes de variación promedio (promedio= 5.43%; S= 2.86; δ= 0.99 y promedio= 5.19%; S= 2.61; δ= 0.92, respectivamente).
De todas las proporciones ensayadas únicamente 7 cumplieron con las condiciones de no presentar diferencias significativas entre los sexos y no presentar una alta correlación con la talla de los organismos: LC/AnC (p= 0.1630, r= 0.32); LR/LD (p= 0.1836, r= 0.03); LR/LP (p= 0.2898, r= 0.19); AlS3/AnS3 (p= 0.8558, r= 0.18); AlS3/LS1 (p= 0.9484, r= 0.02); LS6/AnS5S6 (p= 0.1008, r= 0.07) y L/LV (p= 0.108, r= 0.04), además del DD (p= 0.1008, r= 0.11) y DV (p= 0.7118, r= 0.06).
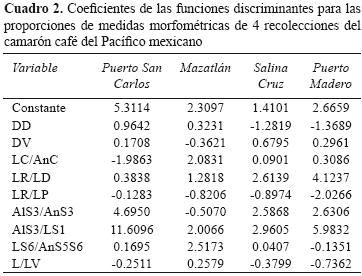
Las proporciones AlS3/LS1, AlS3/AnS3, LR/LD y LC/AnC fueron las variables que más contribuyeron a la discriminación entre las 4 localidades, mostrando en las funciones discriminantes los coeficientes con mayores valores (Cuadro 2). Las 2 primeras corresponden a características de la forma del abdomen, dado que consideran la longitud, el ancho y el largo de los segmentos abdominales tercero y primero, mientras que las segundas, corresponden a la forma del cefalotórax, dado que consideran la longitud con respecto al ancho del cefalotórax y la longitud total del rostro con respecto a la distancia entre los últimos 2 dientes.
Las diferencias estadísticas entre los grupos fueron sustentadas por un MANOVA (p< 0.0001).
En el análisis de las 4 localidades, la matriz de clasificación correcta mostró un porcentaje correcto de clasificación global superior al 70%. Las localidades de Salina Cruz y Puerto Madero presentaron los menores valores (58 y 68% respectivamente); Mazatlán, un valor moderado de (70%), mientras que Puerto San Carlos presentó el más alto (83%; Cuadro 3). Cuando la muestra de Salina Cruz se excluyó del análisis, 2 de los 25 organismos de Puerto Madero fueron clasificados erróneamente en Puerto San Carlos y 2 en Mazatlán. Puerto Madero tuvo un porcentaje correcto de reclasificación de 84%, Puerto San Carlos de 82.7% y Mazatlán de 75%. Mientras que al excluir Puerto Madero del análisis, de los 26 organismos de Salina Cruz, 2 fueron clasificados incorrectamente en Puerto San Carlos y 1 en Mazatlán. Salina Cruz tuvo un porcentaje correcto de reclasificación de 88.5%, Puerto San Carlos de 86.5% y Mazatlán de 77.5%.
La primera componente canónica para el análisis discriminante con las 4 localidades contabilizó 52% de la variación total de los datos y permitió diferenciar las localidades de Puerto San Carlos y Mazatlán, mientras que las localidades ubicadas en el golfo de Tehuantepec, Salina Cruz y Puerto Madero no se diferenciaron. La segunda componente canónica contabilizó el 34% de la variación total de los datos y únicamente hizo la diferenciación de las localidades en 2 grupos, uno formado por Puerto San Carlos y Mazatlán y otro por Salina Cruz y Puerto Madero (Fig. 2).

La localidad de Puerto San Carlos se caracterizó por presentar altos valores para la proporción LC/AnC y bajos valores para las proporciones Al3/AnS3 y AlS3/LS1. Mientras que la localidad de Mazatlán se caracterizó por presentar el patrón inverso, bajos valores para la proporción LC/AnC y altos valores para las proporciones AlS3/AnS3 y AlS3/LS1. Las localidades de Salina Cruz y Puerto Madero no se pudieron diferenciar, ambas presentan altos valores para las proporciones LR/LP, L/LV y LS6/AnS5S6 y bajos valores para la proporción LR/LD (Fig. 2).
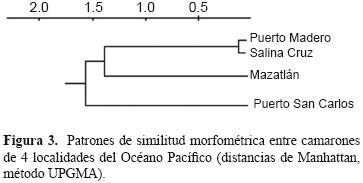
El dendrograma mostró que las localidades de Salina Cruz y Puerto Madero forman un grupo morfológico más similar con respecto a los otros sitios. La localidad de Mazatlán que se agrupa en seguida sería la más cercana a este grupo y la localidad de Puerto San Carlos sería una localidad más distinta (Fig. 3).
Discusión
En estudios previos se ha sugerido que los bajos valores de variación morfológica intrapoblacional son indicadores de grupos fenotípicamente homogéneos (Ferrito et al., 2007; Konan et al., 2010). Esto coincide con los resultados del presente estudio, donde los coeficientes de variación promedio para todos los grupos registraron valores menores de 13% y el análisis discriminante apoyó que los organismos que integran una muestra corresponden a un grupo morfológicamente homogéneo. Dichos grupos podrían estar asociados a distintos stocks, aunque las localidades de Puerto Madero y Salina Cruz podrían albergar individuos provenientes de una misma unidad, dada su similitud morfológica.
Las funciones canónicas del análisis discriminante mostraron que la localidad de Mazatlán se caracterizó por presentar altos valores para las proporciones AlS3/AnS3 y AlS3/LS1, lo que sugiere que los camarones en esta área presentan una mayor masa muscular. El litoral de Sinaloa, donde se ubica la localidad de Mazatlán, se caracteriza por la presencia de zonas importantes de afloramiento. Lo anterior se debe a que la termoclina se ubica a muy baja profundidad y permite que los nutrientes provenientes de la descomposición de materia orgánica suban a la superficie y al ser utilizados por el fitoplancton, éste incrementa su presencia de manera considerable (Alfaro y Lizano, 2001). El fitoplancton constituye el primer eslabón en las cadenas alimenticias de los ecosistemas acuáticos y su incremento repercute directamente en los siguientes niveles tróficos. Esta es la razón de que muchas pesquerías, incluso la del camarón, alcancen los mayores valores de producción en dicha área (SEMARNAP, 2006). En las costas de Pacífico mexicano se presenta este fenómeno en 2 regiones; una es precisamente la costa frente a Mazatlán y la otra es el golfo de Tehuantepec, donde se presenta con menor intensidad (Alfaro y Lizano, 2001). Probablemente los camarones en las costas de Mazatlán exhiben mayor masa muscular debido a que habitan una región altamente productiva.
La localidad de Puerto San Carlos se caracterizó por presentar los valores más altos para la proporción LC/AnC, la cual está relacionada con la forma del cefalotórax. En contraste, la localidad de Mazatlán mostró los valores más bajos para la proporción LC/AnC. Se sabe que la forma del cefalotórax representa un fuerte componente filogenético, con valores constantes para cada especie (Pérez–Farfante, 1988); por ello, se puede suponer que esta característica se encuentre ligada a la expresión de características genéticas en los camarones. De manera similar las localidades de Salina Cruz y Puerto Madero, que fueron caracterizadas por presentar bajos valores para la proporción LR/LD relacionada con la longitud del rostro, podrían estar diferenciándose de las otras por un componente genético, dado que la longitud del rostro es también una característica diagnóstica utilizada para la diferenciación entre especies de camarones (Pérez–Farfante, 1988).
Estos resultados aportan evidencia en el sentido de que la variación morfológica en los camarones podrían presentar un componente tanto ambiental como genético, lo cual también ha sido evidenciado en otros estudios basados en la variación morfológica de Aphanius fasciatus (Ferritro et al., 2007) y Macrobrachium vollenhovenii (Konan et al., 2010).
La diferenciación entre las localidades fue corroborada por los altos valores de correcta reclasificación obtenidos con el análisis discriminante para las localidades de Puerto San Carlos y Mazatlán, no siendo así para las localidades de Salina Cruz y Puerto Madero, las cuales mostraron porcentajes bajos de reclasificación correcta.
Los errores de clasificación en el análisis discriminante pueden atribuirse a 3 causas: 1), la exclusión de variables explicativas para la discriminación de los grupos; 2), la alta variación de los grupos y 3), la cercanía entre los centroides de grupos diferentes (Hair et al., 1989). En este estudio, para la discriminación de todas las localidades, fueron empleadas las mismas proporciones; si se hubiese excluido información importante para esta diferenciación se esperaría que todas ellas presentaran porcentajes de error de clasificación similares (Rawlings, 1988) y solamente Salina Cruz y Puerto Madero mostraron altos porcentajes de error en la clasificación. Por otro lado, la variación promedio de los puntos con respecto al centroide fue muy similar para todas las localidades, incluso Salina Cruz y Puerto Madero presentaron la menor variación morfológica, a pesar de tener los tamaños de muestra más pequeños; de hecho, en los análisis donde se excluyeron estas localidades, se pudo corroborar que con estos mismos tamaños de muestra las funciones discriminantes presentaban en la reclasificación una eficiencia mayor que Puerto San Carlos y Mazatlán que contaron con tamaños de muestra mayores; por lo cual, se pudo inferir que la causa de los errores de reclasificación no puede ser el tamaño de muestra ni la variación.
El punto más importante a considerar para este análisis es la distancia entre los centroides de los grupos. Si los centroides de 2 grupos son muy cercanos uno del otro, los datos sobre a cuál grupo pertenecen realmente pueden confundirse y, en tal caso, los errores de reclasificación se incrementan (Reyment et al., 1984; Hair et al., 1989). Es posible incluso, que no se trate de grupos diferentes, sino de un único grupo con un centroide intermedio. Por esta razón, en los análisis donde se excluyen los datos de Salina Cruz y Puerto Madero las funciones discriminantes de las poblaciones se realizan de manera muy eficaz, no sucediendo así cuando las 4 localidades aparecen juntas. En el caso de Salina Cruz los porcentajes correctos de reclasificación descienden de 88.5% a 58%; y en el caso de Puerto Madero de 84.0% a 68%. Lo que hace que los errores de reclasificación para la muestra de Salina Cruz se incrementen es la presencia de la muestra de Puerto Madero, y lo mismo sucede con esta última, sus errores de reclasificación se incrementan por la presencia de la muestra de Salina Cruz, lo cual se debe a que son muestras morfológicamente muy parecidas. Puerto San Carlos y Mazatlán presentaron baja dispersión y sus centroides se localizaron alejados; por ello los valores correctos de reclasificación fueron altos (Reyment et al., 1984).
En especies con limitada capacidad de dispersión y rangos amplios de distribución, como el camarón café (Martínez, 1993), la distancia puede constituir una barrera para el flujo genético entre las poblaciones (Slatkin, 1993). Así el agrupamiento por el método UPGMA agrupó a las localidades de Salina Cruz y Puerto Madero con una distancia mínima entre la distancia de sus centroides, evaluados a partir de las variables canónicas, y también una distancia geográfica mínima entre ellas. En seguida fue agrupada la localidad de Mazatlán como la localidad morfológicamente más similar a las anteriores y finalmente la localidad de Puerto San Carlos, que resultó la localidad que más diferencias morfológicas mostró respecto del resto, y es además, la más distante geográficamente. Esto nos aporta evidencia de la presencia de una variación morfológica en función de la distancia geográfica (Turan et al., 2006; Konan et al., 2010).
La similitud morfológica entre las localidades de Salina Cruz y Puerto Madero está relacionada con su proximidad geográfica, de ahí que se sugiera que ambas localidades podrían pertenecer a un mismo stock, mientras que Puerto San Carlos y Mazatlán, al exhibir altos porcentajes correctos de reclasificación de sus individuos, podrían constituir unidades de pesca independientes.
La subdivisión morfológica de las localidades del camarón café, encontrada en este estudio, corresponde con la que registran Díaz–Jaimes et al. (2006), quienes con base en análisis genéticos diferenciaron las poblaciones de la costa de Oaxaca y de la costa de Sinaloa, y atribuyen al patrón de corrientes y a la existencia de lagunas costeras la causa principal de dicha diferenciación. Asimismo, las diferencias genéticas registradas por De la Rosa–Vélez et al. (2000) parecen obedecer a los patrones de circulación predominantes en el golfo de California, los cuales incluyen la presencia de una serie de giros en la zona de islas del golfo (Lavín et al., 1997).
También la diferenciación morfológica de F. californiensis encontrada en el Pacífico mexicano coincide con la división geográfica que el Instituto Nacional de la Pesca ha establecido para el estudio de la pesquería del camarón. Puerto San Carlos corresponde a la zona 50, la localidad de Mazatlán corresponde a la zona 30 y las localidades de Salina Cruz y Puerto Madero corresponden a la zona 80.
Agradecimientos
Al Biol. Oswaldo Morales director del CRIP de Salina Cruz y al Dr. Juan Madrid del CRIP de Mazatlán por proporcionar los organismos. A Rosendo Martínez, dibujante de la Facultad de Ciencias, UNAM, por el esquema del camarón. Este proyecto es parte del proyecto de doctorado de María de Lourdes Barbosa–Saldaña apoyado por el Consejo Nacional de Ciencia y Tecnología CONACYT; asimismo, se recibió apoyo adicional de los proyectos PAPIT IN208408 y IN221910.
Literatura citada
Alfaro, E. J. y O. G. Lizano. 2001. Algunas relaciones entre las zonas de surgencia del Pacífico Centroamericano y los Océanos Pacífico y Atlántico Tropical. Revista de Biología Tropical 49 Supl. 2:85–193. [ Links ]
Allendorf, F. W., N. Ryman y F. M. Utter. 1987. Genetics and fishery management: past, present and future. In Population genetics and fishery management, N. Ryman y F. M. Utter (eds.). University of Washington Press, Seattle. p. 1–19. [ Links ]
Aragón–Noriega, E. A. y E. Alcántara–Razo. 2005. Influence of sea surface temperature on reproductive period and size at maturity of brown shrimp (Farfantepenaeus californiensis) in the Gulf of California. Marine Biology 146:373–379. [ Links ]
Begg, G. A., K. D. Friedland y J. B. Pearce. 1999. stock identification and its role in stock assessment and fisheries management: an overview. Fisheries Research 43:1–8. [ Links ]
Cadrin, S. X. y K. D. Friedland, 1999. The utility of image processing technique for morphometric analysis and stock identification. Fisheries Research 43:129–139. [ Links ]
Carvalho, G. R. y L. Hauser. 1994. Molecular genetics and the stock concept in fisheries. Reviews of Fish Biology and Fisheries 4:326–350. [ Links ]
De la Rosa–Vélez, J, R. Escobar–Fernández, F. Correa, M. Maqueda–Cornejo y J. De la Torre–Cueto. 2000. Genetic structure of two comercial penaeids (Penaeus californiensis and P. stylirostris) from the Gulf of California, as revealed by allozyme variation. Fishery Bulletin 98:674–683. [ Links ]
Díaz–Jaimes, P., M. L. Barbosa–Saldaña y M. Uribe–Alcocer. 2006. Allozyme variation in Eastern Pacific brown shrimp Farfantepenaeus californiensis populations. Fisheries Science 72:696–698. [ Links ]
Díaz, R., M. E. Márquez, G. Espinosa y V. Berovides. 1995. Estudio morfométrico y electroforético de tres especies de camarones penaeidos comerciales en cultivo. Revista de Investigaciones Marinas 16:83–88. [ Links ]
Dore, I y C. Frimodt. 1987. An illustrated guide to shrimp of the world. Van Nostrand Reinhold, New York. 229 p. [ Links ]
Ferrito, V., M. C. Mannino, A. M. Pappalardo y C. Tigano. 2007. Morphological variation among populations of Aphanius fasciatus Nardo, 1827 (Teleostei, Cyprinodontidae) from the Mediterranean. Journal of Fish Biology 70:1–20. [ Links ]
Freund, J. E. y R. E. Walpole. 1990. Estadística matemática con aplicaciones. Prentice Hall, México, D. F. 622 p. [ Links ]
Hair, J. E., R. E. Anderson, R. L. Tatham y W. C. Black. 1989. Multivariate data analysis. Prentice Hall, New Jersey. 730 p. [ Links ]
Hedgecock, D. 1994. Temporal and spatial genetics structure of marine animal populations in the California current. CalCOFI Reports 35:73–81. [ Links ]
Konana, K. M., A. B. Adépo–Gourène, A. Ouattara, W. D. Nyingy y G. Gourène. 2010. Morphometric variation among male populations of freshwater shrimp Macrobrachium vollenhovenii Herklots, 1851 from Côte d´Ivore Rivers. Fisheries Research 103:1–8. [ Links ]
Kronmal, R. 1993 Spurious correlation and the fallacy of the standard ratio revisited. Journal of the Royal Statistical Society 156:379–392. [ Links ]
Kumpf, H. E., R. N. Vaught, C. B. Grimes, A. G. Johnston y E. L. Nakamura. 1987. Proceedings of the stock identification workshop. NOAA Technical Memorandum NMFS–SEFC–199. US Department of Commerce, Washington, D.C. 228 p. [ Links ]
Martínez, C. L. R. 1993. Camaronicultura. AGT, México, D. F. 233 p. [ Links ]
Lavín, M. F., E. Beber y A. Badan 1997. Estructura hidrográfica y circulación del golfo de California: escalas estacional e interanual. Contribuciones a la oceanografía física en México, Monografía 3. Unión Geofísica Mexicana, México, D. F. 141–171 p. [ Links ]
Mustafa, S. y R. A. Rahman. 1999. Marine genetic resources and sustainable fisheries management. In Genetics in sustainable fisheries management, S. Mustafa (ed.). Fishing News, Oxford. p. 75–98. [ Links ]
Pearson, K. 1897. Mathematical contributions to the theory of evolution – on the form of spurious correlation which may arise when indices are used in the measurements of organs. Proceedings of the Royal Society of London 60:268–286. [ Links ]
Pérez–Farfante, I. 1988. Illustrated key to penaeid shrimps of commerce in the Americas. NOAA Technical report NMFS 64, US Department of Commerce, Washington, D.C. 32 p. [ Links ]
Rawlings, J. O. 1988. Applied regression analysis: a research tool. Wadsworth & Brooks/ Cole Advanced Books & Software, PacificGrove, California. 553 p. [ Links ]
Reyment, R. A., R. E. Blackith y N. A. Campbell. 1984. Multivariate morfhometrics. Academic, New York. 233 p. [ Links ]
Romero–Sedano, J. C., E. A. Aragón–Noriega, M. M. Manzano–Sarabia, C. A. Salinas–Zavala y A. R. García–Juárez. 2004. Periodo reproductivo del camarón café Farfantepenaeus californiensis (Holmes, 1900) en la laguna costera de Agiabampo, Sonora/Sinaloa, México. Ciencias Marinas 30:465–475. [ Links ]
SAGARPA (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación). 2009. Resultados del análisis de las poblaciones de camarón del litoral del Pacífico para implementar la veda durante el 2009. Informe de investigación. Dirección General de Investigación Pesquera en el Pacifico Norte, SAGARPA, México, D. F. 46 p. [ Links ]
SEMARNAP (Secretaría del Medio Ambiente, Recursos Naturales y Pesca). 2006. Anuario estadístico de pesca 2006. México, D. F. 265 p. [ Links ]
Slatkin, M. 1993. Isolation by distance in equilibrium and non–equilibrium populations. Evolution 47:264–279. [ Links ]
Somerton, D. A. 1981. Regional variation in the size of maturity of two species of tanner crab (Chionoecestes barrdi and C. opilio) in the eastern Bering Sea, and its use in defining management subareas. Canadian Journal of Fisheries and Aquatic Sciences 38:163–174. [ Links ]
Somerton, D. A. y R. S. Otto. 1986. Distribution and reproductive biology of the golden king crab, Lithodes aequispina in the eastern Bering Sea. Fishery Bulletin 84:571–584. [ Links ]
Turan, C., M. Oral, B. Öztürk y E. Düzgünes. 2006. Morphometric and meristic variation between stocks of Bluefish (Pomatomus saltatrix) in the Black, Marmara, Aegean and northeastern Mediterranean Seas. Fisheries Research 79:139–147. [ Links ]
Tzeng–D, D., C. S. Chiu y S. Y. Yeh. 2001. Morphometric variation in red–spot prawn (Metapenaeopsis barbata) in different geographic waters off Taiwan. Fisheries Research 53:211–217. [ Links ]
Wallace, R. K. y K. M. Fletcher. 2001. Understanding fisheries management. Mississippi–Alabama Sea Grant Consortium. 62 p. [ Links ]
Ward, R. D. 2006. The importance of identifying spatial population structure in restocking and stock enhancement programmes. Fisheries Research 80:9–18. [ Links ]














