Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.81 suppl.oct México Oct. 2010
Efecto del blanqueamiento del coral por baja temperatura en los crustáceos decápodos asociados a arrecifes del suroeste del golfo de California
Effect of coral bleaching induced by low temperature on reef–associated decapod crustaceans of the southwestern Gulf of California
Luis Hernández1*, Héctor Reyes–Bonilla1 y Eduardo F. Balart2
1 Departamento de Biología, Universidad Autónoma de Baja California Sur. Carretera al sur Km. 5.5, 23080 La Paz, Baja California Sur, México. *Correspondencia: lghm@uabcs.mx
2 Laboratorio de Necton y Ecología de Arrecifes, Centro de Investigaciones Biológicas del Noroeste S.C. Mar Bermejo 195, Colonia Playa Palo de Santa Rita, 23090 La Paz, Baja California Sur, México.
Recibido: 19 noviembre 2009
Aceptado: 26 abril 2010
Resumen
El blanqueamiento del coral es consecuencia de un estrés natural o antropogénico sobre los arrecifes. En la región del Pacífico tropical este, el blanqueamiento del coral se asocia comúnmente con el incremento de la temperatura superficial del mar, pero también se puede presentar por temperaturas bajas. A principio de 2008 se registró una anomalía de temperatura extraordinariamente baja, de hasta 1.8 °C menor al promedio registrado en los últimos 25 años, que se manifestó con un severo blanqueamiento de corales en varias localidades al sur del golfo de California, alcanzando cifras de hasta el 90% del coral blanqueado. El objetivo del presente trabajo fue describir los cambios en el ensamblaje de decápodos asociados a los arrecifes en la región afectada. Las bahías de La Paz (24° N) y Loreto (26° N) fueron visitadas antes, durante y después del evento, realizándose censos visuales en 6 sitios de cada bahía. Los resultados muestran que la riqueza y dominancia de decápodos cambió por efecto del blanqueamiento. La afectación fue diferencial entre ambas localidades: la fauna coralina de la región de Loreto fue más afectada que la de bahía de La Paz y los cambios en los ensamblajes de decápodos fueron diferentes.
Palabras clave: invertebrados marinos, coexistencia, censos visuales, bahía de La Paz, bahía de Loreto, México.
Abstract
Coral reef bleaching is a common stress response to natural or anthropogenic events. In the Tropical East Pacific, coral reef bleaching has been commonly associated to temperature increase of the sea surface, but it can also occur with low temperatures. In early 2008, an abnormality of very low temperature was recorded, up to 1.8 °C lower than the average temperature in the last 25 years, and a severe coral bleaching was observed in numerous localities in the southern part of the Gulf of California, which rose up to 90% of coral bleaching in some places. The aim of this work was to describe changes in decapod assemblages associated to coral reefs in the affected region. La Paz (24°N) and Loreto (26°N) bays were monitored before, during, and after the event by carrying out visual censuses at 6 sites in each bay. The results have shown that decapod richness and dominance changed because of coral bleaching. The effect was different between both localities, coralline fauna of the Loreto region was more damaged than that of La Paz bay and decapod assemblages were different.
Key words: marine invertebrates, co–occurrence, visual censuses, La Paz bay, Loreto bay, Mexico.
Introducción
Un coral arrecifal es una colonia de pólipos que forman estructuras calcáreas y que viven en simbiosis con dinoflagelados llamados zooxantelas. Estos organismos se encuentran preferentemente en regiones tropicales y subtropicales, con aguas claras, someras y poca variación en la temperatura superficial del mar (Veron, 1995). En el golfo de California los arrecifes de coral no son un hábitat común (Reyes–Bonilla y López–Pérez, 2009); ya que sólo algunos autores reconocen su presencia en las localidades de Cabo Pulmo, Los Frailes y bahía San Gabriel (Squires, 1959; Brusca y Thomson, 1975; Spalding et al., 2001). Cuando el coral está sometido a condiciones estresantes, tanto de origen natural como antropogénico, suele perder las zooxantelas y la colonia adquiere una coloración blanca; este fenómeno se conoce como "blanqueamiento" (Jones, 2008). Se ha observado que en el Pacífico oriental tropical (POT) cuando la temperatura superficial del mar aumenta al menos 1°C por encima del promedio anual del mes más cálido (agosto o septiembre, según la localidad) se presenta blanqueamiento en los arrecifes (Carriquiry et al., 2001; Glynn et al., 2001). En general, este fenómeno provoca la degradación o incluso la muerte de las agregaciones de colonias, y debido a que el coral brinda refugio y/o alimento a un gran número de peces e invertebrados (Idjadi y Edmunds, 2006), la pérdida de los arrecifes tiene graves consecuencias ecológicas para estas comunidades (Bruno et al., 2003). Uno de los grupos más afectados con la mortalidad coralina es el de los crustáceos decápodos, pues son los invertebrados más abundantes entre las ramas de los corales y se han identificado varias especies de camarones y cangrejos como simbiontes exclusivos en corales del género Pocillopora Lamarck, 1816 en todo el mundo (Abele, 1976; Gotelli y Abele, 1983). En el POT los estudios sobre decápodos asociados a arrecifes se han enfocado en los aspectos taxonómicos (Gotelli y Abele, 1983; Lemaitre y Álvarez, 1992), así como en describir las relaciones ecológicas de los cangrejos del género Trapezia Latreille, 1828 (Castro, 1982; Gotelli et al., 1985), los cuales protegen las colonias de corales ante las actividades depredadoras de la estrella corona de espinas, Acantaster planci Linnaeus, 1758 (Glynn, 1983).
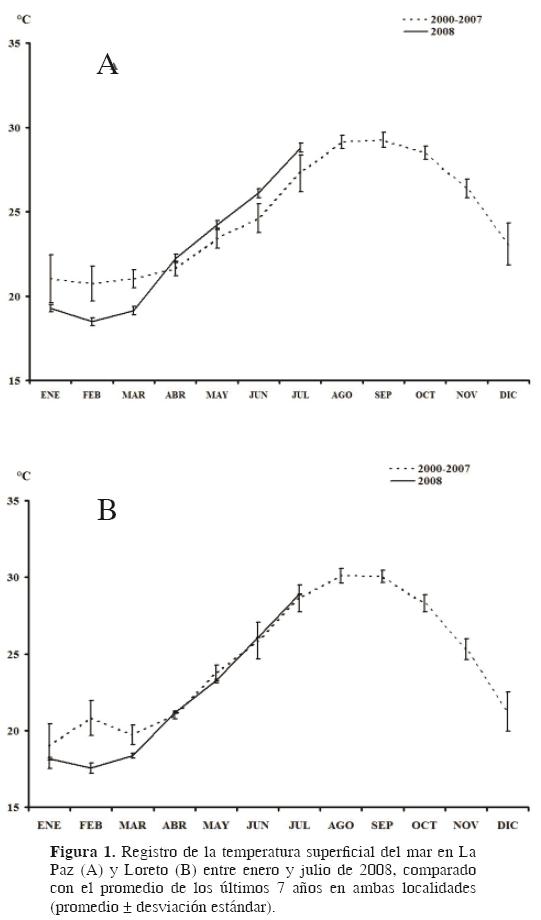
Entre febrero y abril de 2008, en el sur del golfo de California se registró un decremento anómalo en la temperatura superficial del mar, de hasta 1.8°C por debajo del promedio registrado en los últimos 7 años (Fig. 1), lo que provocó el blanqueamiento de coral en varias localidades. Esto llamó la atención, ya que a pesar de que en los últimos 10 años se han estado monitoreando los procesos de blanqueamiento en el POT por efecto del fenómeno de oscilación sureña El Niño (ENSO; Carriquiry et al., 2001; Reyes–Bonilla, 2001), no se tenía noticia de que la disminución de la temperatura también fuera un agente de perturbación tan importante. Previo a las observaciones en el golfo de California, Hoegh–Guldberg y Fine (2004) señalaron que además del blanqueamiento por calentamiento del agua, los corales de la Gran Barrera de Australia presentaron blanqueamiento por enfriamiento del agua del mar. Si bien en la región del POT se tiene información de los eventos de blanqueamiento de coral (Glynn et al., 2001), poco se sabe del efecto del blanqueamiento sobre la fauna asociada. Pratchett et al. (2009) mencionaron que se han analizado los cambios en la ictiofauna coralina principalmente en Panamá y en isla del Coco, Costa Rica.
En México, Iglesias–Prieto et al. (2003) señalaron los cambios en la abundancia y talla de los cangrejos del género Trapezia durante el blanqueamiento del coral por calentamiento del agua superficial del mar. Por lo anterior, el objetivo del presente estudio fue describir los cambios en la abundancia y riqueza de crustáceos decápodos asociados a los arrecifes, causados por el blanqueamiento de coral en el suroeste del golfo de California. Se detectó que la fauna coralina de Loreto fue más afectada que la de La Paz y en consecuencia un reemplazo en las especies dominantes de decápodos fue evidente en los arrecifes de Loreto.
Materiales y métodos
El estudio se realizó simultáneamente en las bahías de Loreto y La Paz, en el golfo de California (Fig. 2). En cada localidad fueron seleccionados 6 sitios que presentaban una importante cobertura de coral (Pocillopora spp.); cabe señalar que todos los sitios de Loreto y 4 de La Paz se encuentran dentro de áreas naturales protegidas (ANP). El registro de las especies de decápodos se realizó trimestralmente, mediante censos visuales por un buzo con equipo autónomo y en transectos de banda de 10 × 1 m, con 5 repeticiones por cada sitio. La determinación de las especies se hizo in situ y cuando se requirió se tomaron fotografías. Durante los muestreos no se recolectaron organismos ni se removió intencionalmente el fondo (algas, rocas, restos de coral), con el fin de no modificar el paisaje natural. Los datos se procesaron de la siguiente manera: la abundancia de cada especie se normalizó aplicando la transformación de raíz cuadrada de n + 0.5 (Zar, 2009) y enseguida se determinaron diversidad (índice de Shannon–Wiener empleando log2) y equidad (índice de Pielou) para describir la comunidad (Clarke y Warwick, 2001). Finalmente se estimó el grado de similitud entre arrecifes (coeficiente de Bray–Curtis) y se aplicó un escalamiento multidimensional no métrico (NMDS, por sus siglas en inglés) para comparar el grado de similitud entre las fechas de los muestreos de ambas localidades.
Resultados
El blanqueamiento de coral observado en abril de 2008 fue el efecto de un estrés causado por la temperatura excesivamente fría (17.5 ± 0.32°C) registrada entre enero y marzo de 2008 (Fig. 3), la cual descendió 1.8°C por debajo del promedio de los últimos 25 años (19.3 ± 0.9°C).

La fauna de decápodos asociada a arrecifes registrada entre enero y julio de 2008 fue de 21 especies: 19 en bahía de La Paz y 15 en bahía de Loreto. Durante el muestreo de abril de 2008, en La Paz se detectó un 90% de colonias con blanqueamiento (n= 350 colonias); en el muestreo de julio se observó una recuperación del coral; para ese tiempo, aproximadamente un 20% de las colonias presentes había muerto. Por otro lado, durante los censos de abril de 2008 en Loreto, se registró un blanqueamiento del 99% (n= 170 colonias) y en julio la mortalidad fue del 96% del total de las colonias (Fig. 4).
En el Cuadro 1 se muestran los resultados de los parámetros de la comunidad de decápodos en los arrecifes de La Paz y Loreto. En la primera localidad, la riqueza y la abundancia de decápodos no se vio fuertemente afectada por el blanqueamiento de coral. Sin embargo, en Loreto se observó un decremento significativo en la abundancia de organismos durante el muestreo de abril, con una pequeña recuperación en julio (F= 43.64, p < 0.05). El análisis de similitud de Bray–Curtis (Fig. 5), así como el NMDS (Fig. 6) muestran que en los 3 momentos del muestreo, los arrecifes de La Paz junto con los de Loreto forman un grupo antes del blanqueamiento; sin embargo, los sitios de Loreto visitados durante y después del blanqueamiento quedan separados. La misma tendencia se presentó con los análisis de equidad y diversidad (F= 28.44, p < 0.05; F= 53.06, p < 0.05, respectivamente).
Las especies de decápodos más importantes por el número de organismos en los arrecifes muestreados fueron principalmente especies simbiontes de los corales como Alpheus lottini, Harpiliopsis depressa, H. spinigera y Trapezia bidentata. Particularmente en Loreto, la pérdida de corales provocó la ausencia de especies simbiontes y en consecuencia un reemplazo de las especies dominantes por especies oportunistas (Cuadro 2).
Discusión
El efecto del blanqueamiento del coral sobre la fauna de decápodos fue diferencial en La Paz y Loreto. En La Paz, las especies asociadas a coral mostraron cambios en la abundancia, pero los taxa simbiontes permanecieron como dominantes. En contraste, en Loreto, la pérdida de coral provocó la desaparición de especies simbiontes y en consecuencia se observó un cambio cualitativo y cuantitativo en la fauna de decápodos.
A pesar de que en los últimos años se ha prestado gran atención al blanqueamiento de coral por el calentamiento superficial del mar (Hoegh–Guldberg et al., 2005), el mismo fenómeno pero originado por condiciones de agua fría no se había registrado en México. Con los datos de temperatura superficial marina presentados en la figura 1 fue posible detectar que a principios de 2008 la temperatura fue menor al promedio de los últimos 25 años y determinar que el blanqueamiento se presentó porque se rebasó el nivel crítico inferior de temperatura para los corales Pocillopora de la región (Reyes–Bonilla, en preparación).
El efecto del blanqueamiento por temperatura fría tuvo diferentes patrones geográficos a los señalados por Reyes–Bonilla (2001), quien observó que éste fue más severo en las localidades de La Paz y menor en Loreto, ya que la anomalía térmica en La Paz fue mayor que en Loreto. Además, se ha sugerido que los arrecifes con mayor influencia de surgencias o corrientes frías se ven menos afectados por elevaciones drásticas de la temperatura, por lo que hay menos blanqueamiento (Precht y Aronson, 2004). En el caso de invierno–primavera de 2008, algo inverso pudo haber sucedido en el sur del golfo de California ya que la temperatura del agua descendió de manera importante y por esa razón el blanqueamiento fue más severo en Loreto, a mayor latitud. Cabe mencionar que la región de Loreto es prácticamente el límite norte de la distribución geográfica de los corales pocillopóridos (Reyes–Bonilla et al., 2006), de modo que es posible que cada invierno de manera natural los corales estén sometidos a un estrés por agua fría. Simplemente se puede suponer que en esta ocasión la baja temperatura registrada así como el tiempo de exposición pudieron ser más intensos y provocaron mayor daño.
Por otro lado, el blanqueamiento de corales provocó cambios en la riqueza de especies y un decremento significativo en la abundancia de decápodos (Cuadro 1), especialmente en Loreto entre abril y julio. Lo anterior posiblemente obedece a que el estrés metabólico causado por la baja temperatura pudo provocar una disminución en la producción de mucus por parte del coral y a su vez generar menor alimento para los decápodos simbiontes, quienes se alimentan de ese mucus (Gotelli y Abele, 1983). Al respecto, Iglesias–Prieto et al. (2003) mencionaron que durante el blanqueamiento de coral causado por El Niño, los cangrejos del género Trapezia fueron los simbiontes que permanecieron en las ramas de los corales. Observaron también que estos cangrejos eran de tallas relativamente grandes deduciendo que los pequeños posiblemente no obtuvieron alimento (mucus del coral) y murieron (Iglesias–Prieto et al., 2003). En el presente estudio no se observó esa tendencia y tampoco se detectó evidencia de migración de decápodos de colonias blancas hacia colonias sanas. Sin embargo, es posible que debido al blanqueamiento, los corales disminuyeran su capacidad de carga (de fauna simbionte) y en consecuencia la secreción de mucus no fuera suficiente para mantener hospederos de colonias vecinas.
Posterior al blanqueamiento, se observó que las colonias que murieron fueron rápidamente cubiertas por algas filamentosas, así como macroalgas, lo cual ha sido observado frecuentemente. En estos casos, las ramas del coral sirvieron como sustrato para varias especies de cangrejos (Cuadro 2), quienes resultaron ser de los más abundantes ante la carencia de especies simbiontes.
El agrupamiento que se muestra en la figura 6 (NMDS) indica que la abundancia total de decápodos tuvo cambios entre las fechas de muestreo principalmente en la bahía de Loreto. Lo anterior sugiere que la muerte de corales propició la pérdida de especies simbiontes que normalmente son las más abundantes entre las ramas de los corales (Cuadro 2). Como no se observó recuperación del coral en julio, después del blanqueamiento, la ausencia de especies simbiontes fue sensible a este análisis.
En conclusión, puede decirse que el blanqueamiento de coral por agua fría tuvo un efecto diferencial en las 2 localidades y que este efecto es diferente a lo que se observa cuando el blanqueamiento es por agua cálida.
Agradecimientos
Agradecemos a los estudiantes de la Universidad Autónoma de Baja California Sur y el personal técnico del Centro de Investigaciones Biológicas del Noroeste, quienes participaron en las campañas de muestreo. Luis Hernández recibió apoyo económico por parte del CONACYT (Núm.37746). Agradecemos también las acertadas observaciones de los revisores anónimos que ayudaron a enriquecer el contenido de la presente contribución,y fortalecieron la versión final del Abstract.
Literatura citada
Abele, L. G. 1976. Comparative species composition and relative abundance of decapod crustaceans in marine habitats of Panamá. Marine Biology 38:265–278. [ Links ]
Bruno, J. F., J. J. Stachowicz y M. D. Bertness. 2003. Inclusion of facilitation into ecological theory. Trends in Ecology and Evolution 18:119–125. [ Links ]
Brusca, R. C. y D. A. Thomson. 1975. Pulmo reef: the only 'coral reef' in the Gulf of California. Ciencias Marinas 1:37–53. [ Links ]
Carriquiry, J. D., A. L. Cupul–Magaña, J. L. Rodríguez–Zaragoza y P. Medina–Rosas. 2001. Coral bleaching and mortality in the Mexican Pacific during the 1997–98 El Niño and prediction from a remote sensing approach. Bulletin of Marine Science 69:237–249. [ Links ]
Castro, P. 1982. Notes on symbiotic decapod crustaceans from Gorgona Island, Colombia, with a revision of the eastern species of Trapezia (Brachyura, Xanthidae), symbionts of scleractinian corals. Anales del Instituto de Investigaciones Marinas de Punta Betín 22:9–17. [ Links ]
Clarke, K. R. y R. M. Warwick. 2001. PRIMER v6. Users manual/Tutorial, 190 p. [ Links ]
Glynn, P. 1983. Extensive "bleaching" and death of reef corals on the Pacific coast of Panama. Environmental Conservation 10:149–154. [ Links ]
Glynn, P. W., J. L. Maté, A. C. Baker y M. O. Calderón. 2001. Coral bleaching and mortality in Panama and Ecuador during the 1997–1998 El Niño southern oscillation event: spatial/temporal patterns and comparisons with the 1983–1983 event. Bulletin of Marine Science 69:79–109. [ Links ]
Gotelli, N. J. y L. G. Abele. 1983. Community patterns of coral–associated decapods. Marine Ecology Progress Series 13:131–139. [ Links ]
Gotelli, N. J., S. Gilchrist y L. G. Abele. 1985. Population biology of Trapezia spp. and other coral–associated decapods. Marine Ecology Progress Series 21:89–98. [ Links ]
Hoegh–Guldberg, O. y M. Fine. 2004. Low temperature causes coral bleaching. Coral Reefs 24:444. [ Links ]
Hoegh–Guldberg, O., M. Fine, W. Skirving, R. Johnstone, S. Dove y A. Strong. 2005. Coral bleaching following wintry weather. Limnology and Oceanography 50:265–271. [ Links ]
Iglesias–Prieto, R., H. Reyes–Bonilla y R. Riosmena–Rodríguez. 2003. Effects of the 1997–1998 ENSO on coral reef communities in the Gulf of California, Mexico. Geofísica Internacional 42:467–471. [ Links ]
Idjadi, J. A. y P. J. Edmunds. 2006. Scleractinian corals as facilitators for other invertebrates on a Caribbean reef. Marine Ecology Progress Series 319:117–127. [ Links ]
Jones, R. J. 2008. Coral bleaching, bleaching–induced mortality, and the adaptive significance of the bleaching response. Marine Biology 154:65–80. [ Links ]
Lemaitre, R. y R. Álvarez. 1992. Crustáceos decápodos del Pacífico colombiano: lista de especies y consideraciones zoogeográficas. Anales del Instituto de Investigaciones Marinas de Punta Betín 21:33–76. [ Links ]
Pratchett, M. S., S. K.Wilson, N. A. J. Graham, P. L. Munday, G. P. Jones y N. V. C. Polunin. 2009. Coral bleaching and consequences for motile reef organisms: past, present and uncertain future. In Coral bleaching: patterns processes, causes and consequences, M. J. H. van Oppen y J. M. Lough (eds.). Springer, Berlin. p. 139–158. [ Links ]
Precht, W. y R. Aronson. 2004. Climate flickers and range shifts of reef corals. Frontiers in Ecology and the Environment 2:307–314. [ Links ]
Reyes–Bonilla, H. 2001. Effects of the 1997–98 El Niño–Southern Oscillation on coral communities of the gulf of California, Mexico. Bulletin of Marine Science 69:251–266. [ Links ]
Reyes–Bonilla, H. y R. A. López–Pérez. 2009. Corals and coral reef communities in the Gulf of California. In Atlas of coastal ecosystems in the western Gulf of California, A. Johnson y J. Ledezma–Vázquez (eds.). The University of Arizona Press, Tucson. p. 45–57. [ Links ]
Reyes–Bonilla, H., L. E. Calderón–Aguilera, G. Cruz–Piñón, P. Medina–Rosas, R. A. López–Pérez, M. D. Herrero–Perezrul, G. E. Leyte–Morales, A. L. Cupul–Magaña y J. D. Carriquiry–Beltrán. 2006. Atlas de corales pétreos (Anthozoa: Scleractinia) del Pacífico mexicano. Triciclo, México, 124 p. [ Links ]
Spalding, M., C. Revilious y E. P. Green. 2001. World atlas of coral reefs. University of California Press, Berkeley. 424 p. [ Links ]
Squires, D. J. 1959. Corals and coral reefs of the Gulf of California. Bulletin of the American Museum of Natural History 118:367–432. [ Links ]
Veron J. E. N. 1995. Corals in space and time: the biogeography and evolution of the Scleractinia. University of New South Wales Press, Sydney, 321 p. [ Links ]
Zar, J. H. 2009. Biostatistical analysis. Prentice Hall, New Jersey, 663 p. [ Links ]














