Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.81 suppl.oct México Oct. 2010
Macrocrustáceos (Peracarida, Decapoda) de fondos carbonatados del sector occidental del banco de Campeche en el sur del golfo de México
Macrocrustacea (Peracarida, Decapoda) from carbonated habitats in the western sector of the Campeche Bank in the Southern Gulf of Mexico
Elva Escobar–Briones* y Elvira Leticia Jiménez–Guadarrama
Laboratorio de Biodiversidad y Macroecología, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México. Apartado postal 70–305 Ciudad Universitaria 04510 México, D.F. * Correspondencia: escobri@cmarl.unam.mx
Recibido: 18 mayo 2010
Aceptado: 11 junio 2010
Resumen
Este estudio reconoce el número de familias, abundancia, diversidad biológica y distribución de las comunidades de macrocrustáceos asociadas a fondos carbonatados del sector occidental del banco de Campeche. Las muestras analizadas de fondos carbonatados provinieron de colectas realizadas a bordo del B/O Pelican de la Universidad de Louisiana con arrastres efectuados en un intervalo de 20 a 182 m de profundidad. Se identificaron 64 familias. El número de familias, la abundancia y diversidad biológica disminuyó con la profundidad. La distancia a los bancos y arrecifes determinan la variación en la riqueza de familias y la distribución de la asociación de macrocrustáceos. El banco de Campeche puede considerarse un hotspot de diversidad biológica marina para los macrocrustáceos asociados a fondos carbonatados.
Palabras clave: anfípodos, arrecifes, biodiversidad.
Abstract
This study contributes with information on the number of families, abundance, biodiversity and geographical distribution of the crustacean assemblage associated to carbonated habitats in the western sector of the Campeche Bank. The samples studied were collected onboard the R/V Pelican of the University of Louisiana from dredge materials obtained at a range of 20 to 182 m depth. The specimens were grouped into 64 families. The number of families, the abundance and diversity values decreased with increasing depth. The distance to the banks and reef islands determined the variability recorded in the richness of families and the distribution patterns of the macrocrustacean assemblage. The Campeche Bank is suggested to be a "hotspot" of biological diversity for the macrocrustaceans associated to the carbonated bottoms.
Key words: amphipods, diversity, reefs.
Introducción
Los fondos carbonatados se forman por el proceso químico y bioquímico de la precipitación de carbonato de calcio en ambientes marinos de aguas limpias y cálidas asociadas a los arrecifes de coral (Reijers y Hsü, 1986). Los sedimentos carbonatados se caracterizan por el depósito de material de origen biogénico proveniente de la degradación de exoesqueletos de celenterados, algas, moluscos y equinodermos (Tucker y Wright, 2001) que conforman refugios y hábitat para invertebrados bentónicos.
Las plataformas carbonatadas, determinadas principalmente por la geotectónica y el nivel relativo del mar (Carozzi, 1989), se presentan en la franja tropical. Regionalmente, resaltan el banco Gorda y la elevación de Nicaragua en el mar Caribe, el banco de Campeche y la plataforma de Florida en el golfo de México, y el banco de las Bahamas en el Atlántico occidental tropical (Tucker y Wright, 2001).
Los estudios que se ocupan de la macrofauna de fondos carbonatados son limitados y su enfoque principal es la diversidad asociada a los arrecifes de coral. Escobar–Briones et al. (2008) realizaron un estudio en el banco de Campeche que identificó la familia de crustáceos perácaridos Cirolanidae y 8 familias de crustáceos decápodos (Galatheidae, Diogenidae, Paguridae, Calappidae, Leucosiidae, Parthenopidae, Goneplacidae y Xanthidae) en un intervalo de 48 a 156 m de profundidad. En zonas aledañas, como es el arrecife Alacranes, los estudios se han enfocado en peces (González y Arias, 2001), moluscos (Rice y Kornicker, 1962) y la langosta espinosa (Ríos et al., 2007).
Este estudio contribuye con resultados de evaluación de similitud, distribución, composición taxonómica, abundancia y diversidad, en nivel de familia, de la comunidad macrobéntica de fondos carbonatados del banco de Campeche.
Materiales y métodos
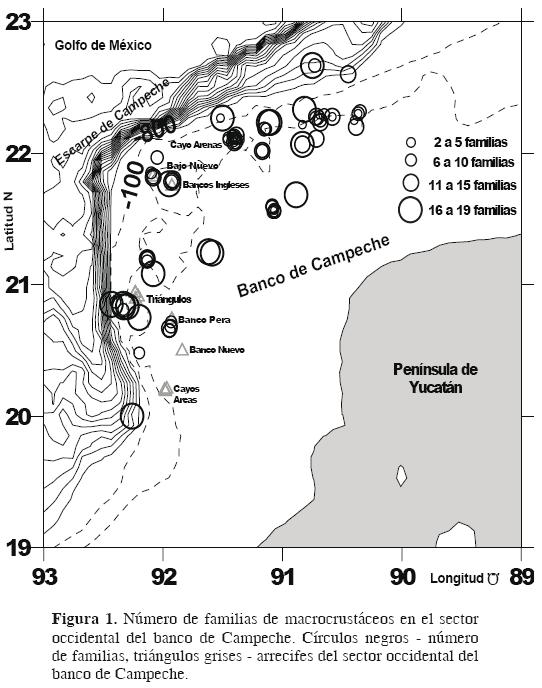
Área de estudio. El banco de Campeche se extiende entre los 19° y 23° N y los 89° y 93° O (Gore, 1992; Fig. 1) en el sur del golfo de México. Hacia el norte está delimitado por el escarpe de Campeche, al sur por la franja litoral de los estados de Campeche, Yucatán y norte de Quintana Roo, al occidente por el cañón de Campeche y al oriente por el canal de Yucatán (Gutiérrez, 1977).
Trabajo de campo. Las muestras provinieron de recolecciones realizadas en 67 estaciones en un intervalo de profundidad de 20 a 182 m (Cuadro 1) durante la campaña oceanográfica a bordo del B/O Pelican de la Universidad de Louisiana en una colaboración con el Instituto de Ciencias del Mar y Limnología (ICML) de la Universidad Nacional Autónoma de México (UNAM). La estrategia empleada consistió en arrastres de 25 a 30 minutos a 1.5 nudos en las estaciones someras y de 55 minutos en las más profundas por medio de una draga tipo Agassiz (Eleftheriou y McIntyre 2005). Las muestras recolectadas se documentaron con datos de posición geográfica y profundidad, y se preservaron con etanol al 95% en frascos etiquetados, para su estudio en el laboratorio.
Trabajo de laboratorio. Los fragmentos de roca carbonatada se fraccionaron para separar fauna críptica asociada. Los organismos encontrados en las muestras de arena gruesa se separaron con el apoyo de un microscopio de disección marca Zeiss con aumento de 3 × y un microscopio óptico marca Olympus con 10 × de aumento; se contaron y cada uno se identificó por familia, utilizando diversas claves (Abele y Kim, 1986; Bowman et al., 1985; Dahl, 1985; Escobar y Villalobos, 1995; Gerken y Watling, 1998; Hessler y Sanders, 1995; Kensley y Schotte, 1989; Ortiz et al., 2004; Schultz, 1969; Suárez et al., 2004; Haney y Matin, 2000; Winfield et al., 2007).
Análisis de datos. La similitud de la composición taxonómica entre estaciones se evaluó por medio de un análisis jerárquico de agrupamiento, con el índice de similitud de Bray–Curtis para datos de abundancia estandarizados y transformados con raíz cuadrada. El análisis de ordenamiento se realizó por escalamiento multidimensional, no métrico (MDS), a partir de las matrices de similitud, permitiendo generar gráficas bidimensionales. Todos los análisis se aplicaron con Primer versión 6.0 (Clarke y Warwick, 2001). Con los grupos reconocidos en el dendrograma se elaboró una representación geográfica de localidades similares. El mapa base se realizó con Surfer v. 8 usando datos de batimetría a resolucion de 2 minutos (ETOPO2) (http://www.ngdc.noaa.gov/mgg/image/2minrelief.html). El gráfico del estimado acumulativo de las familias para las muestras se construyó con datos de abundancia, permutando en orden las muestras 999 veces con la función de Michaelis Menten bajo los parámetros Smax = 70.82 y B = 9.69.
Resultados
La asociación de crustáceos estuvo compuesta por 64 familias agrupadas en 7 órdenes a partir de 1 239 ejemplares identificados (Cuadro 2). Las familias más abundantes pertenecieron a los órdenes Amphipoda (Amphitoidae presentó 242 organismos; Ampeliscidae y Aoridae, 52) y Decapoda (Majidae 105 organismos, Galatheidae 79 y Palicidae 68) que fueron, así mismo, las más frecuentes.
Distribución. El número mayor de familias se presentó en la rompiente norte–occidental y en cayo Arenas; 29 familias se encuentran en las inmediaciones de los arrecifes de Triángulos, cayo Arcas, bancos Pera y Nuevo. Los peracáridos del orden Amphipoda de las familias Anamixiidae, Corallanidae y Apseudidae y el decápodo de la familia Xanthidae solamente se encontraron en estos 2 bancos (Fig. 1).
La abundancia y el número de familias disminuyeron con la profundidad (Cuadro 3). En la plataforma interna (20 a 59 m) se presentó la mayor abundancia y el número más elevado de familias (1 140 ind., 7.38 ± 4.74 familias), la plataforma media (60 a 109 m) presentó un número de individuos y de familias menor que la plataforma interna (93 ind., 6.2 ± 7.19), mientras que la plataforma externa (110 a 182 m) presentó 6 individuos agrupados en 5 familias. La disminución en el número de familias fue evidente con el incremento en distancia de los bancos. El número mayor de individuos y de familias se presentó en las estaciones que se encontraban a una distancia entre 32 y 75 km de los bancos.
Agrupamiento y ordenamiento. La macrofauna que está asociada a los fondos carbonatados del banco de Campeche se agrupó en 2 conglomerados bien definidos, que se denominan grupos A y B (Fig. 2). El primero, más numeroso, agrupó las estaciones con el menor número de familias de crustáceos (<11 y hasta 2 ) y se dividió en 3 subgrupos (A1, A2, A3). El segundo se dividió en 2 subgrupos (B1, B2) y representó las estaciones con el mayor número de familias, (más de 11 y hasta 19 ). Los 2 grupos del conglomerado B (B1 y B2) se separan a partir de la distancia que las muestras tienen con respecto a los cayos, bajos y atolones en el banco de Campeche en un intervalo promedio de hasta 40 km (B2) y 65 km (B1). En promedio, las estaciones del grupo A se localizan a 80 km. Los factores que definieron estos 2 grupos son el número de familias y la distancia de las muestras a los bancos bordeados por arrecifes. El incremento en el número de familias y la conformación de los grupos se relacionan directamente con la menor distancia a los bancos y arrecifes (Fig. 3).
Diversidad y acumulativo de familias. La diversidad mostró tendencia a disminuir con la profundidad; ésta se relacionó exponencialmente con el número de individuos r2 = 0.62 y la riqueza de familias r2 = 0.93 (Fig. 4). Los valores más elevados de diversidad se registraron en la plataforma interna (H' 2.30 ± 0.89 bits) disminuyendo hacia la plataforma media (H' 1.79 ± 0.89 bits) y la plataforma externa (H' = 2.25). El estimado acumulativo de las familias muestra una curva que tiende a estabilizarse en casi 60 familias (Fig. 5).
Discusión
Los factores ambientales que pueden determinar la distribución espacial de la fauna en fondos carbonatados incluyen la temperatura del sedimento (Mc Lusky y McIntyre, 1988), la concentración de clorofila en el sedimento (Barnes y Hughes, 1988) y la salinidad del sedimento (Kinne, 1963).
La distribución espacial de las familias en el banco de Campeche estuvo determinada por la distancia a los bancos y arrecifes. Esta variable va asociada a la diferencia en la profundidad y en el tamaño de grano expresada por las proporciones de arenas, limos y arcillas. Riddle (1988) describió que en la Gran Barrera Arrecifal de Australia el tamaño de grano determinó la distribución espacial de la macrofauna. En contraste, en la plataforma de Florida los factores ambientales que influyeron en la distribución espacial de la comunidad bentónica fueron la profundidad, la salinidad del sedimento y la concentración de oxígeno disuelto (Wenner et al., 1984).
Los cambios en la riqueza de familias en relación con la profundidad se han atribuido a la variación del tamaño de grano (Riddle, 1988). La riqueza de especies está ligada directamente con la abundancia, por lo que los estudios que analizan la abundancia de invertebrados bénticos en fondos carbonatados dependen del número de muestras y frecuencia de colecta, como es el caso de la plataforma de Florida (Wenner et al., 1984), en la cual se reconocieron 60 739 organismos en muestreos realizados durante las 4 épocas del año con 2 réplicas en 6 estaciones. En la Gran Barrera Arrecifal de Australia, se reconoció un patrón similar con muestreos realizados en 3 épocas del año con 2 réplicas en 6 estaciones (Riddle, 1988). Al comparar el esfuerzo de muestreo empleado en esas zonas con el empleado en el banco de Campeche, se advierte que en este último el esfuerzo es bajo. A pesar de ello se alcanzó la asíntota en el número de familias, lo cual indica que el muestreo fue representativo. Así mismo, el patrón de disminución del número de familias obtenido en el banco de Campeche está relacionado con la profundidad y se atribuye a una reducción en el esfuerzo de muestreo en los estratos más profundos (Holme y McIntyre, 1984). Otros estudios en la misma zona con diferentes escalas de profundidad (48 a 156 m) y de talla muestran un número de familias bajo, pero elevado de especies (Escobar–Briones et al., 2008). La disponibilidad de materia orgánica, representando mayor alimento (Barnes y Hughes, 1988) en la plataforma interna con respecto a la plataforma externa, determina valores reducidos de abundancia en Florida (Hallock y Schlager, 1986), al igual que la baja temperatura del agua con la profundidad puede tener efectos sobre el metabolismo y, por ende, en la abundancia (Kinne, 1963). La variación en la disponibilidad de microhábitats para el establecimiento y refugio de la comunidad macrobentónica (Hartnoll, 1983) es otro factor que cambia con la profundidad y con la distancia de los bancos y arrecifes que los bordean.
En el presente estudio, un número elevado de familias y la diversidad más elevada se presentaron en la sección interna del banco de Campeche, encontrándose asociados a la cercanía de los bancos y arrecifes, mientras que en la sección externa se presentó el número más bajo de familias y la menor diversidad. Lo anterior se atribuye a que los arrecifes y bancos sirven como una frontera ecológica de 2 ecosistemas, el litoral con el sumergido somero, donde convergen las faunas de cada uno; por lo tanto, el número de familias y la diversidad se incrementan. Al alejarse de estas fronteras el número de familias disminuye y se observa un cambio en la diversidad. Un patrón similar se reconoció en la Gran Barrera Arrecifal de Australia, relacionándolo con cambios en la proporción de arenas que propicia el establecimiento de mayor número de organismos que aprovechan los microhábitats disponibles, la heterogeneidad (Wenner et al., 1984) y la complejidad del hábitat (Barnes y Hughes, 1988) en fondos carbonatados (Riddle, 1988).
La estabilización de la curva en la cual el número de familias se incorpora nos permite reconocer que aunque el esfuerzo de muestreo fue menor en la zona de bancos de la plataforma interna del banco de Campeche, los valores permiten reconocer un hotspot, con base en la definición de Myers et al., (2000), de la diversidad de familias de macrocrustáceos.
Muchas de las familias reconocidas son típicas de otros fondos carbonatados; por ejemplo, Corophiidae, Gammaridae, Portunidae, Majidae y Xanthidae (Netto et al., 2000). Los arrecifes en el mar Caribe, en las Bahamas (Brooks et al., 2002) y en Australia (Malcolm et al., 2006) son de las áreas más importantes en la conservación de la biodiversidad global. La asociación de macrocrustáceos asociada a fondos carbonatados se encuentra en una zona vulnerable al estar expuesta a diversas actividades antropogénicas que usan los fondos carbonatados para diversos fines (Tunnell, 1992).
Se concluye que: a) la distancia a los bancos y arrecifes determina el número de familias y los patrones de distribución de la asociación de crustáceos en el banco de Campeche; b) ésta actúa como el factor principal que reune las localidades de muestreo en 2 grupos y c) el banco de Campeche puede considerarse un hotspot de diversidad biológica marina y desde el marco de muestreo se reconoce una asociación de macrocrustáceos estable.
Agradecimientos
Por el apoyo de A. Gaytán en campo. Por el financiamiento a los proyectos "Factores que definen la variabilidad de la diversidad biológica" y "Biomasa béntica en el mar profundo del golfo de México", PAPIIT IN204307–3 y 207410; CONACYT 102433, y "A survey of the deep marine macroalgae and macrocrustaceans in the Gulf of Mexico" financiada por National Science Foundation a la University of Louisiana. A. R. Vázquez Bader, del Instituto de Ciencias del Mar y Limnología, UNAM, e I. Winfield, Facultad de Estudios Superiores Iztacala, UNAM, orientaron en la identificación de los crustáceos decápodos y anfípodos, respectivamente.
Literatura citada
Abele, L. y W. Kim. 1986. An illustrated guide to the marine decapod crustaceans of Florida. Florida State University, Tallahassee. 749 p. [ Links ]
Barnes, R. S. K. y R. N. Hughes. 1988. An introduction to marine ecology. Blackwell, Oxford. 357 p. [ Links ]
Bowman T., J. Yager y T. Iliffe. 1985. Speoneballia cannoni, N. Gen., N. Sp., from the Caicos Islands, the first hypogean leptostracan (Nebaliacea: Nebaliidae). Proceedings of the Biological Society of Washington 98:439–446. [ Links ]
Brooks, T., R. Mittermeier, G. Da Fonseca, A. Rylands, W. Konstant, P. Flick, J. Pilgrim, S. Oldfield, G. Margin y C. Hilton. 2002. Habitat loss and extinction in the hotspots of biodiversity. Conservation Biology 16:909–923. [ Links ]
Carozzi, A. V. 1989. Carbonate rock depositional models. Prentice Hall, Englaewoods Cliffs, New Jersey. 604 p. [ Links ]
Clarke, K. y R. Warwick. 2001. Change in marine communities: an approach to statistical analysis and interpretation. Primer–E, Plymouth, p. 1–5. [ Links ]
Dahl, E. 1985. Crustacea Leptostraca, principles of taxonomy and a revision of European shelf species. Sarsia 70:135–165. [ Links ]
Eleftheriou, A. y A. McIntyre. 2005. Methods for the study of marine benthos. Blackwell, Oxford. p. 160–228. [ Links ]
Escobar–Briones, E. y J. L. Villalobos. 1995. Nebalia lagartensis (Leptostraca) a new species from Yucatan Peninsula, Mexico. Crustaceana 68:1–11. [ Links ]
Escobar–Briones, E., A. Gaytán–Caballero y P. Legendre. 2008. Epibenthic megacrustaceans from the continental margin, slope and abyssal plain of the southwestern Gulf of Mexico: Factors responsible for variability in species composition and diversity. Deep–Sea Research II 55:2667–2678. [ Links ]
Gerken, S. y L. Watling. 1998. Diastylis tongoyensis, a new dyastylid (Crustacea: Cumacea) from the northern central coast of Chile, with an amendment to the description of Diastylis crenellate Watling & McCann. Proceedings of the Biological Society of Washington 111:857–874. [ Links ]
González, G. C. y G. A. Arias. 2001. Lista actualizada de los peces del arrecife Alacranes, Yucatán, México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología 72:245–258. [ Links ]
Gore R. H. 1992. The Gulf of Mexico. Pineapple, Sarasota, Florida. 384 p. [ Links ]
Gutiérrez, E. M. 1977. Sedimentología del área de transición entre las provincias terrígena y carbonatada del suroeste del golfo de México. Tesis Maestría, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D. F. 175 p. [ Links ]
Hallock, P. y W. Schlager. 1986. Nutrient excess and demise of coral reefs and carbonate platforms. Palaios 1:389–398. [ Links ]
Haney, T. y J. Martin. 2000. Nebalia gerkenae, a new species of Leptostraca (Crustacea: Malacostraca: Phyllocarida) from the Bennett Slough region of Monterey Bay, California. Proceedings of the Biological Society of Washington 113:996–1014. [ Links ]
Hartnoll, R. G. 1983. Substratum. In Sublitoral ecology. The ecology of the shallow sublittoral benthos, R. Earl y D. G. Erwing (eds.). Claredon, Oxford. p. 97–124. [ Links ]
Hessler, R. y H. Sanders. 1965. Bathyal Leptostraca from the continental slope of the northeastern United States. Crustaceana 9:71–74. [ Links ]
Holme, N. A. y A. D. McIntyre. 1984. Methods for the study of marine bentos. Blackwell Scientific, Oxford. 6–17. [ Links ]
Kensley, B. y M. Schotte. 1989. Guide to the Marine Isopod Crustaceans. Smithsonian Institute Press, Washington, D.C. 308 p. [ Links ]
Kinne, O. 1963. The effects of temperature and salinity on marine brackish water animals (Temperature). Oceanography and Marine Biology: an Annual Review 1:301–340. [ Links ]
Malcolm, J., C. Liu, R. Neilson, L. Hansen y L. Hannah. 2006. Global warming and extinctions of endemic species from biodiversity hotspots. Conservation Biology 20:538–548. [ Links ]
McLusky, D. S. y A. D. McIntyre. 1988. Characteristics of the benthic fauna. In Continental shelves (ecosystems of the world), H. Postma y J. J. Zijlstra (eds.). Elsevier, Amsterdam p. 131–154. [ Links ]
Myers, N., R. Mittermeier, C. Mittermeier, G. Fonseca y J. Kent. 2000. Biodiversity hotspots for conservation priorities. Nature 403:853–858. [ Links ]
Netto, S. A., M. J. Attrill y R. M. Warwick. 1999. Sublittoral meiofauna and macrofauna of Rocas Atoll: indirect evidence of a topographically controlled front. Marine Ecology Progress Series 175:175–186. [ Links ]
Ortiz, M., A. Martín, I. Winfield, Y. Díaz y D. Atienza. 2004. Anfípodos (Crustacea: Gammaridea): clave gráfica para la identificación de las familias, géneros y especies marinas y estuarinas del Atlántico occidental tropical. Facultad de Estudios Superiores Iztacala, UNAM, México, D.F. 162 p. [ Links ]
Reijers, T. A. y K. J. Hsü. 1986. Manual of carbonate sedimentology: a lexiocographical approach. Academic, London, 302 p. [ Links ]
Rice, W. H. y L. S. Kornicker.1962. Mollusks of Alacran Reef, Campeche Bank, Mexico. Institute of Marine Science, Port Aransas, Texas, p. 366–402. [ Links ]
Riddle, M. J. 1988. Patterns in the distribution of macrofaunal communities in coral reef sediments on the central Great Barrier Reef. Marine Ecology Progress Series 47:281–292. [ Links ]
Ríos, L. V., S. Salas, B. Javier. y P. I. Ayora. 2007. Distribution patterns of spiny lobster (Panulirus argus) at Alacranes reef, Yucatan: Spatial analysis and inferences of preferential habitat. Fisheries Research 87:35–45. [ Links ]
Schultz, G. 1969. The marine isopod crustacean. Brown, Dubuque, Iowa, 359 p. [ Links ]
Suárez, E., R. Heard, S. García, J. Oliva y E. Escobar. 2004. Catálogo de los tanaidaceos (Crustacea: Peracarida) del Caribe mexicano. Desarrollo Gráfico, Chetumal, Quintana Roo. R. 121 p. [ Links ]
Tucker, M. E. y V. P. Wright. 2001. Carbonate sedimentology. Blackwell, Cambridge, Massachusetts. 482 p. [ Links ]
Tunnell, J. W. 1992. Natural versus human impacts to southern Gulf of Mexico coral reef resources. Proceedings of Seventh International Coral Reef Symposium, Guam 1:300–306. [ Links ]
Wenner, E. L., P. Hinde, D. M. Knott y R. F. Van Dolah. 1984. A temporal study of invertebrate communities associated with hard–bottom habitats in the South Atlantic. National Oceanic and Atmospheric Administration Technical Report NMFS 18. [ Links ]
Winfield, I., E. Escobar–Briones y F. Álvarez. 2007. Clave para la identificación de los anfípodos bentónicos del golfo de México y el sector norte del mar Caribe. Instituto de Ciencias del Mar y Limnología, UNAM, México, D.F. 197 p. [ Links ]














