Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.80 no.3 México dic. 2009
Taxonomía y sistemática
Diversidad de Cantharidae, Lampyridae, Lycidae, Phengodidae y Telegeusidae (Coleoptera: Elateroidea) en un bosque tropical caducifolio de la sierra de San Javier, Sonora, México
Diversity of Cantharidae, Lampyridae, Lycidae, Phengodidae and Telegeusidae (Coleoptera: Elateroidea) in a tropical dry forest of the Sierra San Javier, Sonora, Mexico
Santiago Zaragoza–Caballero1,* y Enrique Ramírez–García2
1 Laboratorio de Entomología, Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México. Apartado postal 70–153, 04510 México D. F., México.
2 Estación de Biología Chamela, Instituto de Biología, Universidad Nacional Autónoma de México. Apartado postal 21, San Patricio 48980 Jalisco, México.
* Correspondencia:
zaragoza@ibiologia.unam.mx
Recibido: 01 diciembre 2008
Aceptado: 27 febrero 2009
Resumen
Se presenta un estudio de la diversidad faunística de las familias Cantharidae, Lampyridae, Lycidae, Phengodidae y Telegeusidae (Coleoptera: Elateroidea), presentes en un bosque tropical caducifolio de la sierra de San Javier, Sonora, México, que corresponde al límite boreal de este biotopo en América. La recolección incluyó trampas de atracción luminosa y red entomológica aérea, se realizó en noviembre de 2003, febrero y abril de 2004, y de julio a octubre de ese mismo año, durante 5 días de cada mes. Comprende la época lluviosa (julio–octubre) y la temporada seca (noviembre–abril). Se capturó un total de 1 501 individuos que representan 30 especies. La familia más abundante fue Cantharidae con 696 individuos, seguida de Lycidae con 561, Lampyridae con 166, Phengodidae con 66 y Telegeusidae con 12. La más rica en especies fue Lycidae con 12, seguida de Cantharidae con 11, Lampyridae con 3, Phengodidae con 3 y Telegeusidae con 1. Pocas especies fueron abundantes y la mayoría estuvieron representadas por pocos individuos. La abundancia y riqueza específica varió en el tiempo y espacio para cada familia. Se elaboró una curva de acumulación de especies, se calcularon los índices de diversidad de Shannon–Wiener, de equidad (Pielou), de dominancia de Simpson y de similitud (Bray–Curtis).
Palabras clave: abundancia, riqueza de especies, biodiversidad, temporalidad, cantaroideos, Sonora, México.
Abstract
The faunal diversity of the families Cantharidae, Lampyridae, Lycidae, Phengodidae and Telegeusidae (Coleoptera: Elateroidea), was studied in a dry forest in the Sierra de San Javier, Sonora, Mexico. Light trapping and insect nets were utilized in November 2003, February, April, July, August, September and October 2004 for 5 days of each month, including the rainy season (July–October) and the dry season (November–April). A total of 1 501 individuals, 30 species, and 15 genera were recorded. The most abundant family was Cantharidae with 696 individuals, followed by Lycidae with 561, Lampyridae with 166, Phengodidae with 66 and Telegeusidae with 12 individuals. The most diverse family was Lycidae with 12 species, followed by Cantharidae with 11 species, Lampyridae with 3 species, Phengodidae with 3 species and Telegeusidae with 1 species. Few species were abundant; most were represented by few individuals. Abundance and species richness varied over time and space for each family. A species accumulation curve was elaborated, and the indices of diversity Shannon–Wiener, equitability (Pielou), dominance of Simpson and similarity (Bray–Curtis) were calculated.
Key words: abundance, species richness, biodiversity, cantharides, temporality, Sonora, Mexico.
Introducción
El bosque tropical caducifolio (BTC) tiene una amplia distribución mundial y constituye una de las comunidades más diversas en América, pero también es uno de los ecosistemas más amenazados (Janzen, 1988). Los factores climáticos, como temperatura ambiente, humedad, propiedades químicas del suelo, etc., provocan en este sistema la caída de las hojas (Murphy y Lugo, 1986; Condit et al., 2000), fenómeno que se traduce en una marcada estacionalidad, contrastando una época seca y otra lluviosa, contraste que a su vez provoca efectos de sucesión ecológica (Arroyo–Mora, 2002).
Contrario a lo que sucede con el bosque tropical húmedo, más ampliamente estudiado en su conservación y diversidad biológica (Wolda, 1978a, b; Adis, 1981; Wilson, 1987; Basset, 1992; Wolda et al., 1998; Zilona y Nummelin, 2001), al BTC se le ha prestado relativamente poca atención (Money et al., 1995). Recientemente, se están estudiado aspectos de cuantificación foliar como estrategia de la conservación de su diversidad biológica (Sánchez–Azofeita et al., 2003). El conocimiento de la diversidad biológica resulta básico para la conservación mundial de comunidades naturales (Wilson, 1988) y en ese sentido, el estudio de los insectos ha sido colocado como una prioridad (Hawsworth y Ritchie, 1993).
El BTC que se distribuye en la vertiente continental del Pacífico mexicano, está correlacionado con las lluvias monzónicas y los macizos montañosos. Según Raisz (1964), ocupa esencialmente las áreas del piedemonte, porciones de la planicie costera, cuenca del Balsas y cuenca central de Chiapas. En otras áreas, donde la precipitación es más baja y la insolación es mayor, se registra la transición entre este ecosistema y el matorral xerófito, como sucede en el valle de Tehuacán en la porción central de Oaxaca (Osorio–Beristain et al., 1996). En México, el BTC cubre el 8% de su superficie (Trejo y Dirzo, 2000) y alberga un gran número de especies endémicas (Rzedowski, 1991; Flores y Gerez, 1994; Ceballos y García, 1995). Hasta 1990, solamente el 27% permanecía intacto (Trejo y Dirzo, 2000), el resto ha sido modificado por la actividad humana, sea por la agricultura o el pastoreo (Toledo, 1992; Maass, 1995). El daño causado por la deforestación sedesconoce, pero se estima que para el estado de Morelos es del 1.4% por año (Trejo y Dirzo, 2000). En general, el BTC parece ser menos diverso que otros ecosistemas tropicales; sin embargo, contiene un mayor número de especies endémicas (Ceballos, 1995; Ceballos y Brown, 1995; Gentry, 1995). Algunos cerambícidos (Coleoptera) también han sido considerados como endémicos (Chemsak y Noguera, 1993). Recientemente, Zaragoza et al. (2000, 2003), Zaragoza (2004a, b, c, d;), Noguera et al. (2002, 2008) y Toledo et al. (2002), han iniciado el estudio de comunidades de insectos asociados al BTC en localidades del Pacífico mexicano con el objeto de estimar y cuantificar su diversidad.
Este trabajo tiene el objetivo de dar a conocer la riqueza, diversidad y abundancia de coleópteros de las familias Cantharidae, Lampyridae, Lycidae, Phengodidae y Telegeusidae recolectados en 5 sitios de la sierra de San Javier, Sonora, localidad que representa el límite de distribución boreal del BTC en México (Búrquez et al., 1999). En general, las especies recolectadas en la zona representan los primeros registros para Sonora; sólo 6 se conocían previamente de ese estado (Zaragoza, 1995, 1999). Todo el material recolectado está depositado en la Colección Nacional de Insectos (CNIN) del Instituto de Biología, Universidad Nacional Autónoma de México (UNAM).
Material y métodos
Descripción del área. El área de estudio se ubica en la sierra de San Javier, perteneciente al municipio de San Javier en el centro del estado de Sonora; forma parte de la porción SO de la sierra del Aliso (Stewart y Roldán–Quintana 1991) y está considerada una de las regiones terrestres prioritarias de México (Arriaga et al., 2000). Representa el límite norteño del BTC en el continente americano (Búrquez et al., 1992; Búrquez et al., 1999) (Fig. 1). Se localiza entre las coordenadas, 28° 34' 40.1 y 28° 32' 18.2" N y 109° 44' 51.5" y 109°39' 54.3" O y a una altitud entre 795 y 433 m. La estructura fisiográfica accidentada de la región determina que en esta zona las barrancas y cañones estén ocupados por grandes árboles, muchas epífitas y pteridofitas. Entre los árboles de las cañadas se encuentran especies de Ficus, Guazuma ulmifolia, Platanus racemosa, Prosopis velutina y Taxodium distichum, el árbol más grande de la región,. Otras especies típicas son Conzattia multiflora, Lysiloma divaricatum, L. watsonii, Abarrida sonorae, Chloroleucon mangese, Senna atomaria, Lonchocarpus hermanii, Erythrina flabelliformis, Vitex mollis, Ipomea arborenscens, Bursera laxiflora, B. lancifolia, B. penicillata, B. arborea y B. stenophylla. Entre las cactáceas se reconocen Pachycereus pecten–aborigitum, Pilosocereus alensis Stenocereus montanus y S. thurberi,y entre las especies arbustivas, Jatropha cordata, J. malacophylla, Montanoa rosei, Ceiba acuminata, Croton fantzianus, Hintonia latiflora, Fouquieria macdougalli y Pisonia capitata (Búrquez y Martínez–Yrizar, en prensa).

Básicamente hay 2 tipos de clima, uno semiseco cálido BS'hw(x')(e'), con una temperatura media máxima mensual de 29.9 °C en verano y una media mínima mensual de 14°C en invierno; la media anual es de 21.7 °C, con una precipitación media anual de 508.8 milímetros; el otro tipo de clima es semicálido húmedo (A)C(wo)(x')d, con una temperatura media máxima mensual de 25.6 °C en los meses de junio y julio y una media mínima mensual de 11.3 °C en diciembre y enero. La época de lluvias se presenta en julio y agosto, con una precipitación media anual de 630.1 milímetros. En los meses de febrero y marzo hay heladas frecuentes (Enciclopedia de los Municipios de México, 2005).
Los suelos son someros y pedregosos de origen rocoso sedimentario paleozoico y triásico. También se reconocen parches de suelos ácidos alterados por acción hipotérmica que se refleja en la vegetación del área (Búrquez et al., 1992).
Desde el punto de vista hidrológico corresponde a la región RH9 Sonora sur, cuenca del río Yaqui (INEGI, 1993). Los escurrimientos son intermitentes, a excepción del tramo del arroyo San Javier que recorre parte del Rancho Cerro Verde y el Rancho El Cajón en el cañón de Lo de Campa, que en época de secas se alimenta de filtraciones.
Trabajo de campo. El trabajo de campo se desarrolló por 7 meses, entre noviembre de 2003 y octubre de 2004, sobre un transecto de aproximadamente 17 km (del Km . 140 al 157) en la carretera federal 16 (Hermosillo–Yécora). En ese tramo, se ubicaron arbitrariamente 5 localidades (Fig. 1) que se recorrieron durante el día, y por la noche, se instaló la trampa de atracción luminosa para la recolección de material entomológico. En el Rancho Las Peñitas también se instalaron aleatoriamente 6 trampas de intercepción tipo Malaise (Townes, 1972) que estuvieron activas por 5 días durante 12 meses (nov. 2003–oct. 2004) sin ningún resultado. Las localidades fueron: La Barranca, Rancho Las Peñitas, Rancho El Cajón, San Javier y Rancho Cerro Verde. Otra localidad de recolecta fue la estación de microondas Nahuila en la sierra de San Javier, ahí sólo se hicieron 2 muestreos.
Ubicación de las localidades. La Barranca (28° 34' 40.1" N, 109° 39' 54.3" O, altitud 562 m). Está ubicada en el Km. 156.5 de la carretera Hermosillo–Yécora, 37 km al SE de Tecoripa. Se encuentra al fondo de una hondonada umbrosa donde abundan higuerillas y leguminosas.
Rancho Las Peñitas (28° 32' 21.7" N, 109° 41' 31.5" O, altitud 645 m). Está en el Km. 129 de la carretera Hermosillo–Yécora, 29 km al SE de Tecoripa. Para llegar a esta localidad, se recorrieron unos 3 km por una brecha al SO de la carretera principal. Se caracteriza por la presencia de cactáceas y baja humedad.
En el cañón de Lo de Campa, se localiza el Rancho El Cajón (28° 32' 18.2" N, 109° 44' 37.7", altitud 433 m). Está en el Km. 124.4 de la carretera Hermosillo–Yécora, a 24.4 km al SE de Tecoripa. Para llegar a esta localidad se recorrieron alrededor de 3 km de terracería al SO de la carretera principal. Es un lugar delimitado por la pendiente de cerros, al fondo fluye el arroyo San Javier, que favorece el crecimiento de ahuehuetes.
San Javier (28° 34' 53.0" N, 109° 44' 51.5" O, altitud 795 m). Está en el Km. 120 de la carretera Hermosillo–Yécora, a 20 km de Tecoripa. Para llegar al sitio se recorrieron 5 km al NE de la carretera principal, es un sitio abierto con baja humedad.
Rancho Cerro Verde (28° 33' 09.5" N, 109° 43' 34" O, altitud 532 m). Está en el Km. 128.5 de la carretera Hermosillo–Yécora, a 28.5 km de Tecoripa. Es un lugar abierto, surcado por el arroyo San Javier con compuestas, mimosas y cactáceas columnares.
Estación de microondas Nahuila (28° 33.6' 47.6" N, 109° 45' 23.1" O, altitud 1318 m). Está en el Km. 120 de la carretera Hermosillo–Yécora, a 20 km de Tecoripa. Para llegar al lugar, se recorrieron unos 7 km por un camino empedrado al NE del poblado de San Javier. Es una localidad ubicada en promontorio con una cobertura de pino–encino.
Recolección y métodos de trampeo. La recolección del material de estudio se realizó durante 5 días de cada mes, coincidiendo con la fase del cuarto menguante lunar. El trabajo de campo se desarrolló en jornadas de 5 horas (09:00–14:00 hrs.) y en el crepúsculo (19:00 a 20:30 hrs.). La captura de insectos se hizo de forma directa usando la red entomológica aérea e indirecta mediante la colocación en cada localidad de una trampa de atracción luminosa (Fig. 2) tipo Pennsylvania–Minnesota (Southwood, 1966) modificada y adaptada a una pantalla reflejante la que funcionó de las 20 a las 24 horas los 5 días de labor. En total, se obtuvieron 29 muestras (cada muestra correspondió a un día de recolecta).

Métodos analíticos. Los valores de riqueza y abundancia corresponden al número de especies e individuos recolectados en 29 eventos. Se obtuvo la curva de especies acumuladas y la estimada, ajustada al coeficiente de determinación R2 (Jiménez–Valverde y Hortal, 2003), considerando el valor teórico del máximo número de especies existentes en un área determinada (Effor Predictor V 1.0 2009). La biodiversidad se estimó mediante los índices de diversidad de Shannon–Wiener (H'), de equidad de Pielou (J) y de dominancia de Simpson (D) (Magurran, 1988; Moreno, 2001). Se calculó el índice de similitud, al considerar su abundancia y temporalidad por especie para cada localidad (Bray–Curtis) (Whittaker, 1972). Estos últimos valores se obtuvieron con el programa Bio Diversity Pro (McAlleece et al., 1999). El ordenamiento taxonómico se hizo siguiendo lo establecido por Kleine (1933), McDermott (1966), Delkeskamp (1977) y Zaragoza (1984).
Resultados
En las 6 localidades anteriormente citadas se recolectaron 1 501 ejemplares de cantaroideos adultos que pertenecen a las familias: Cantharidae, Lampyridae, Lycidae, Phengodidae y Telegeusidae. En los análisis de 5 localidades de la zona con BTC que se estudió fueron considerados 1 258 individuos que corresponden a 26 especies en 15 géneros (Apéndice 1). En La Barranca, se registró la mayor abundancia perteneciente a 21 especies de 14 géneros. En el Rancho Las Peñi tas se obtuvieron 12 especies de 8 géneros. En el Rancho El Cajón, ubicado en el cañón de Lo de Campa, se obtuvieron 16 especies de 11 géneros. En San Javier se recolectaron principalmente sobre acacias del lugar, 10 especies de 9 géneros. En el Rancho Cerro Verde, se capturaron 11 especies de 9 géneros (Cuadro 1). En la estación de microondas Nahuila, los 243 individuos que se recolectaron en septiembre–octubre, pertenecen a 4 especies del género Chauliognathus: Cha. constrictus (19), Cha. nigrocinctus (79) Cha. ca. nigrocinctus (55), Cha. profundus (20) y Cha. sp. (70) que no se incluyeron en el análisis de la comunidad por ser representativas de otro tipo de vegetación.
Del total de individuos, destacan algunos géneros con más especies y algunas especies como las más abundantes, otras son escasas (Fig. 3). Al calcular la abundancia relativa en la muestra global de las familias registradas, se hace evidente que Calopteron bifasciatun Gorham (Lycidae) y Discodon sp. 1 (Cantharidae), constituyen las especies más abundantes, con 26.39% y 25.19% respectivamente; mientras que Plateros arizonensis Green (Lycidae) y Phengodes (Phengodes) sp. (Phengodidae) apenas alcanzan 0.08% de la muestra total, al registrar solamente un ejemplar de cada una. En ese mismo sentido, al calcular el porcentaje de la abundancia relativa que alcanza cada especie, pero dentro de cada familia, se encuentra que Telegeusis sp. (Telegeusidae), Distremocephalus sp.ca. mexicanus (Phengodidae) y Photinus sp. (Lampyridae) representan el 100, 81.81 y 72.89% dentro de sus respectivas familias. En tanto que Discodon sp. 1 con el 69.98% y C. bifasciatun con el 59.18% son las especies de Cantharidae y de Lycidae, respectivamente, con mayor porcentaje. Plateros arizonensis (Lycidae) es la más pobremente representada en la familia (0.17%), lo mismo que Phengodes (Phengodes) sp. (1.51%) (Phengodidae) (Fig. 3).
En general, el mes de julio fue el que tuvo mayor abundancia, y agosto el de mayor riqueza de especies. El mes con menor abundancia y riqueza de especies fue noviembre (Cuadro 2). En julio, agosto, septiembre y octubre, que comprenden la temporada lluviosa de la zona, se recolectaron 938 individuos por sólo 320 que se capturaron en abril y noviembre, meses que corresponden a la temporada seca.
De acuerdo con sus hábitos, los lampíridos, fengódidos, y telegeúsidos se recolectaron al crepúsculo o fueron atraídos a la luz. Los cantáridos del género Discodon cayeron también en el embudo atraídos a la luz durante la noche. En febrero no se obtuvo ningún registro, posiblemente debido a las bajas temperaturas registradas en la zona. El registro por familia resultó desigual según el mes. Cantharidae fue más abundante en julio y septiembre, Lampyridae en agosto, Lycidae tuvo mayor presencia en abril y octubre, Phengodidae en abril y Telegeusidae en agosto (Cuadro 2).
La curva (Fig. 4) de 26 especies acumuladas en el transcurso de 29 eventos, alcanzó valores cercanos a 1 [correlación de Pearson =0.99963, Effor Predictor V 1.0 (2009) y coeficiente de determinación R2 = 0. 99855 (Jiménez–Velarde y Hortal, 2003)]. Asimismo, se registran valores mayores y menores en sus índices para las 5 localidades estudiadas. El de diversidad de Shannon–Wiener (H') fue de 0.989 en El Cajón y de 0.522 en Las Peñitas. En tanto, el de Pielou o equidad (J') fue de 0.821 para El Cajón y de 0.476 para La Barranca. El de dominancia de Simpson (D') fue de 0.412 en Peñitas y 0.127 en El Cajón. San Javier y Cerro Verde, alcanzaron valores intermedios (Cuadro 1). Entre La Barranca y El Cajón el registro compartido de 13 especies es indicativo de una similitud del orden de 74.28%. Una menor afinidad se registró entre San Javier y Cerro Verde, con sólo 38.09% al compartir 4 especies (Cuadro 3). Sin embargo, la similitud en abundancia específica, resultó ser más significativa entre los ranchos El Cajón y Cerro Verde con un 50.47% de afinidad. Una menor relación se registró entre La Barranca y San Javier con tan sólo el 8.51% (Cuadro 3). Al considerar la riqueza temporal, se encontró que entre agosto–septiembre y julio–agosto tiene una afinidad del 51.55% y 51.05% al compartir 7 y 6 especies respectivamente, mientras que entre noviembre y julio no se compartió ninguna especie. Respecto a la abundancia temporal que se registra en la zona, se encontró que noviembre y octubre tienen una similitud del orden del 78.96% al compartir el mayor número de individuos (107–220), dado por la presencia de C. bifasciatum. Mientras que entre noviembre y julio el valor del índice de similitud es de 0 (Cuadro 4).

Entre los cantáridos, destacan por su estacionalidad Discodon sp. 1 y Malthinus sp. atraídos a la luz en La Barranca en tiempo de lluvias. Son también estacionales los lampíridos Photinus sp. y Microphotus dilatatus, procedentes de Cerro Verde y El Cajón capturados en agosto. La Barranca, El Cajón y Cerro Verde fueron localidades con mayor humedad, lo que aparentemente favorece la presencia de esta familia.
Entre los lícidos, C. bifasciatum tiene una mayor presencia al final de las lluvias y principio de secas. Fue más numerosa en Las Peñitas sobre leguminosas y en La Barranca, sobre higuerillas. Otra especie marcadamente estacional entre los lícidos es L. chamelensis, característica de la temporada seca y de localidades con mayor altitud donde la humedad es más baja (Las Peñitas y San Javier). Distremocephalus sp. ca. D. mexicanus (Phengodidae) es más frecuente durante la temporada seca, se obtuvo principalmente en abril, en El Cajón y en Cerro Verde. Finalmente, Telegeusis sp. (Telegeusidae) se registró en todos los meses de trabajo a excepción de noviembre y febrero; fue más abundante en La Barranca y Las Peñitas durante agosto.
En cuanto a la actividad temporal de las especies recolectadas, las pertenecientes a la familia Lycidae tuvieron presencia en los 6 meses de trabajo, 7 se registraron en agosto. Los cantáridos se registraron en el transcurso de 4 meses, de agosto fueron 6. Las 3 especies de lampíridos sólo tuvieron presencia en 2 meses. De las 26 especies recolectadas, sólo C. bifasciatun y Telegeusis sp. se recolectaron en el transcurso de 5 meses (Cuadro 2). Familias estudiadas
Cantharidae. Se recolectó un total de 453 individuos de 4 géneros y 7 especies que representan el 36.36% de la abundancia y el 36.66% de la riqueza específica del total de la muestra de cantaroideos. En La Barranca, los cantáridos fueron más abundantes y mayor el número de especies (Fig. 5A). La especie más abundante en julio fue Discodon sp.1, seguida de Malthinus sp. (Fig. 3), agosto y septiembre fueron los meses de mayor riqueza, con 6 especies (Cuadro 2). Discodon sp.1 y Malthinus sp. fueron atraídas a la trampa luminosa. Chauliognathus fue el género más abundante y rico en especies en Nahuila, localidad con vegetación un tanto diferente al BTC. En esta localidad, septiembre fue el mes de mayor abundancia y riqueza. La relación entre machos–hembras en la familia Cantharidae fue de 1.25: 1 (388 machos y 308 hembras).
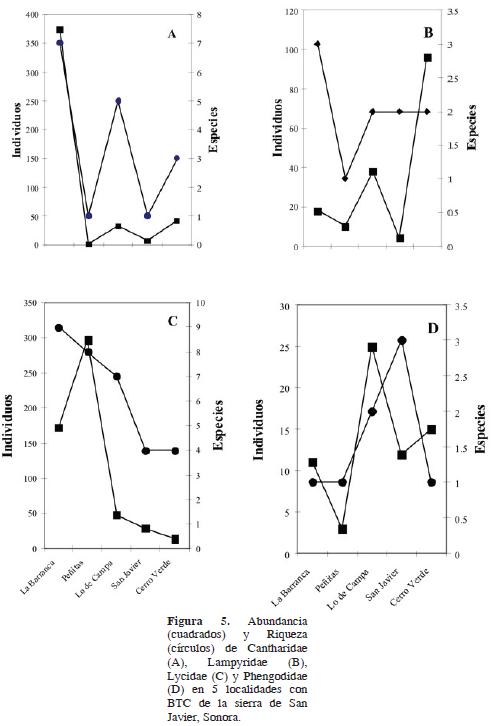
Lampyridae. Se recolectó un total de 166 individuos en 3 géneros y 3 especies, que representan el 11.05%. de la abundancia y el 10% de la riqueza del total de la muestra de cantaroideos. En Cerro Verde, los lampíridos fueron más abundantes y La Barranca tuvo la mayor riqueza de especies (Figs. 5B). Photinus sp. fue la especie más abundante, seguida de Microphotus dilatatus Leconte (Fig. 3). Agosto fue el mes de mayor abundancia y riqueza (Cuadro 2). Únicamente se recolectaron machos, y por primera vez para México, se registraron M. dilatatus y Pleotomus nigripennis LeConte, que originalmente fueron descritos de Arizona, EUA.
Lycidae. Fue la segunda familia más numerosa, con 561 cantaroideos en 5 géneros y 12 especies en la zona de trabajo, que representan el 37.37%, de abundancia y el 40% de la diversidad de total de la muestra de cantaroideos. El Rancho Las Peñitas fue la localidad con mayor abundancia y La Barranca la de mayor riqueza (Fig. 5C), octubre fue el mes de mayor abundancia y agosto el de mayor riqueza (Cuadro 2). La familia Lycidae, se recolectó en 6 meses de trabajo. El género más diverso resultó ser Lycostomus con 4 especies, seguida de Calopteron con 3. La especie más abundante fue C. bifasciatum, seguida de Lygistopterus chamelensis Zaragoza, mientras que P. arizonensis, fue la más pobremente representada (Fig. 3). La relación entre machos–hembras fue de 1 .75: 1. (357 machos y 204 hembras). Por otro lado, C. bifasciatum Gorham, C. jimenezi Dugés, Lycus fernandezi Dugés, Lycostomus minutus Green y L. sanguineus Gorham se han registrado previamente en Sonora (Green, 1949, 1952; Zaragoza, 1995, 1999), las otras 7 especies se registran por primera vez.
Phengodidae. De esta familia sólo se obtuvieron 66 individuos en 2 géneros y 3 morfoespecies, que representan el 4.39 % en abundancia y el 10% de la riqueza del total de la muestra de cantaroideos. En el Rancho El Cajón fueron más abundantes y con mayor riqueza en San Javier (Fig. 5D), abril fue el mes de mayor abundancia y riqueza (Cuadro 2). La especie más abundante fue Distremocephalus sp. ca. D. mexicanus (Wittmer), le siguió Phengodes (Phengodella) sp. y Phengodes (Phengodes) sp. (Fig. 3). La muestra fue únicamente de machos (las hembras son en general desconocidas), recolectados principalmente en la época seca. Representan el primer registro de la familia para el estado de Sonora.
Telegeusidae. De esta familia únicamente se tienen 12 individuos del género Telegeusis que fueron atraídos a la luz; constituyen el 0.79% de abundancia y el 3.33% de la riqueza de cantaroideos en la zona. En La Barranca se obtuvo la mayor abundancia y en agosto el mayor número de ejemplares (Cuadro 2). La muestra es únicamente de machos (las hembras no se conocen). La familia se registra por primera vez para Sonora.
Discusión
En el BTC se registra una marcada estacionalidad determinada principalmente por factores como la temperatura, periodos de lluvia con precipitaciones menores a 60 mm (que pueden extenderse a más de 9 meses), no obstante, otros factores como características edáficas, heterogeneidad ambiental y variaciones del relieve topográfico ocasionan cambios locales en la composición florística del mismo (Trejo, en prensa).
Las 5 localidades seleccionadas reflejan las característicasantes mencionadas, favoreciendo ambientes microclimáticas heterogéneos, determinantes en la presencia diferenciada de cantaroideos en tiempo y espacio en la sierra de San Javier. La Barranca, El Cajón y Cerro Verde son sitios más húmedos, los 2 primeros, un tanto cerrados, mientras que Las Peñitas y San Javier son lugares más altos y abiertos, con más viento y más secos. Es posible que ésas sean algunas de las causas determinantes de que Calopteron reticulatum Fabricius y Discodon sp. únicamente se hayan recolectado en La Barranca, en tanto que Lycostomus sagittatus sólo lo fue en el rancho Las Peñitas, mientras que Lycostomus sp. estuvo presente en el Rancho El Cajón y Plateros arizonensis y Phengodes (Phengodes) sp. en San Javier. Por otro lado, la abundancia por especie también fue diferenciada. La presencia de Calopteron bifasciatum Gorham y Ligistopterus chamelensis Zaragoza fue mayor en el rancho Las Peñitas, Discodon sp. 1 en La Barranca y Photinus sp. en el rancho Cerro Verde.
La Barranca resultó la localidad con mayor abundancia y diversidad, mientras que la de San Javier fue la de menor abundancia. La Barranca y El Cajón comparten 13 especies y un índice de similitud de 74.28%. En tanto, San Javier y Cerro Verde comparten sólo 4 especies y un índice de similitud de 38.09%. En función de la relación riqueza/abundancia, el índice de diversidad de Shannon–Wiener (H) resultó ser más alto en El Cajón (0.989) y menor en Las Peñitas (0.522). El índice de Pielou (J) fue mayor en El Cajón (0.821) y menor en La Barranca (0.476). Mientras que el índice de dominancia de Simpson (D) fue mayor en Las Peñitas (0.412) y menor en El Cajón (0.127). Los individuos del género Chauliognathus (Cantharidae) abundan en la temporada de lluvia julio, agosto, septiembre. Lygistopterus chamelensis Zaragoza (Lycidae) y Distremocephalus sp. ca. D. mexicanus (Phengodidae) son más abundantes en la temporada seca de abril. Calopteron bifasciatum Gorham a fines de la temporada lluviosa y principios de la seca.
Aparentemente, la disponibilidad de recursos en la zona también son determinante del comportamiento alimentario en cantaroideos, las especies de Lycidae que son reconocidas como carnívoras. Es probable que C. bifasciatum explote la posible variedad de organismos que se encuentran sobre las hojas de higuerilla y gramíneas, lo mismo que L. chamelensis que habita sobre las hojas de leguminosas en la temporada seca. Por el contrario, Photinus sp. (Lampyridae), también de hábitos carnívoros (al menos en estado larval), fueron más abundantes en El Cajón y Cerro Verde, localidades recorridas por el Arroyo San Javier. En tanto cantáridos, como las especies de Chauliognathus, aprovechan la época de floración, principalmente de compuestas, para alimentarse.
El comportamiento diurno o nocturno también distingue las diferentes especies de estas familias. En general, las especies de lampíridos, fengódidos, telegeúsidos y cantáridos del género Discodon son de hábitos nocturnos y fueron atraídas a la luz, con excepción de lampíridos capturados directamente al crepúsculo. En tanto, lícidos y cantáridos de hábitos diurnos fueron recolectados de forma directa.
En general, en el BTC existe una mayor abundancia de cantáridos, lampíridos y lícidos en la época de lluvias (julio–agosto), en tanto los fengódidos son mas frecuentes durante los meses secos de marzo–abril (Zaragoza, 2004a, b, c, d; Zaragoza et al., 2003). En contraste, en bosque tropical perennifolio, algunas especies de Phengodes y Eurymastinocerus (Phengodidae) son más frecuentes durante las lluvias (Zaragoza, 1989). También se han observado diferencias en abundancia y riqueza de las familias Cantharidae, Lampyridae, Lycidae, Phengodidae y Telegeusidae (Coleoptera) asociadas al BTC de diferentes localidades del Pacifico Mexicano (Zaragoza, 2004a, b, c, d; Zaragoza et al., 2003) (Cuadro 5). La fauna de Cantaroideos en la Sierra de San Javier, Sonora es menor a la registrada en otras localidades. Tal vez esto sea determinado por la ubicación más norteña de este biotopo. De las 26 especies reconocidas, solo 5 se habían registrado para el estado de Sonora, otras 2, descritas originalmente de Arizona se registran por primera vez para México.

Agradecimientos
A los dueños y encargados de los ranchos Las Peñitas, El Cajón y Cerro Verde en la región de San Javier, Sonora, por las facilidades permitidas. A Felipe Noguera, Enrique González, Verónica Jiménez y Lucía Salas, por la ayuda prestada en la recolección del material estudiado. A Mariza Sarmiento y a Martín Zurita, por el apoyo en la elaboración de gráficos. Al Consejo Nacional de Ciencia y Tecnología (CONACYT), por el apoyo otorgado bajo el convenio 2002–CO1–02580. A los revisores anónimos por sus pertinentes sugerencias.
Literatura citada
Adis, J. 1981. Comparative ecological studies of the terrestrial arthropod fauna in Central Amazonian inundation forest. Amazoniana 7:87–173. [ Links ]
Arriaga, L., J. M. Espinoza, C. Aguilar, E. Martínez, L. Gómez y E. Loa (coordinadores). 2000. Regiones terrestres prioritarias de México. Comisión Nacional para el Conocimiento y uso de la Biodiversidad, México. 609 p. [ Links ]
Arroyo–Mora, P. 2002. Forest cover assessment, Chorotega Region, Costa Rica. M. Sc. Thesis, University of Alberta, Edmonton. 111 p. [ Links ]
Basset. Y. 1992. Aggregation and synecology of arboreal arthropods associated with an over story rain forest tree in Australia. Journal of Tropical Ecology 8:317–327. [ Links ]
Búrquez, A., A. Martínez y P. S. Martín. 1992. From the high Sierra to the coast: changes in vegetation along highway 16, Maycoba–Hermosillo, Sonora. In Geology and mineral resources of northern Sierra Madre Occidental, México, F. Clark, J. Roldán–Quintana y R. H. Schmidt (eds.). El Paso Geological Society, El Paso, Texas. p. 239–252. [ Links ]
Búrquez, A. y A. Martínez–Yrizar (en prensa). Límites geográficos entre las selvas bajas caducifolias y los matorrales espinosos y xerófilos: ¿Qué conservar? In Diversidad, amenazas y regiones prioritarias para la conservación de las selvas secas del Pacífico de México, Medinilla, E. y G. Ceballos (eds.). [ Links ]
Búrquez, A., A. Martínez–Yrizar, R.S., Felger y D. Yerman. 1999. Vegetation and habitat diversity at the southern edge of the Sonoran Desert. In Ecology of Sonoran desert plants and communities, R.H. Robichaux (ed.). University of Arizona Press, Tucson. p. 36–67. [ Links ]
Ceballos, G. 1995. Vertebrate diversity, ecology, and conservation in neotropical dry forests. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press. New York. p. 195–220. [ Links ]
Ceballos, G. y H. Brown. 1995. Global patters of mammalian diversity, endemics, and endangerment. Conservation Biology 9:559–568. [ Links ]
Ceballos, G. y A. García. 1995. Conserving Neotropical diversity: the role of dry forests western Mexico. Conservation Biology 9:1349–1356. [ Links ]
Chemsak, A. J. y F. A. Noguera. 1993. Annotated checklist of the Cerambycidae of the Estación de Biología Chamela, Jalisco, México (Coleoptera) with descriptions of new genera and species. Folia Entomológica Mexicana 89:55–102. [ Links ]
Condit, R., K. Watts, S. A. Bohlman , R. Pérez, R. B. Foster y S. P. Hubbell. 2000. Quantifying the deciduousness of tropical forest canopies under varying climates. Journal Vegetation 11:649–658. [ Links ]
Delkeskamp, K, K. 1977. 1 .Cantharidae. In Coleopterorum catalogus, suplementa, pars 165, J.A. Wilcox (ed.). Dr. W. Junk. The Hague . 556 p. [ Links ]
Effor Predictor V 1.0. (http://faculty.jsd.claremont.edu/dmcfarlane/MiscPages/Allyson/) (03.II 2009). [ Links ]
Enciclopedia de los Municipios de México. 2005. Estado de Sonora. Instituto Nacional para el Federalismo y el Desarrollo Municipal, Gobierno del Estado de Sonora, Hermosillo. [ Links ]
Flores, V. O. y P. Gerez. 1994. Biodiversidad y conservación en México: vertebrados, vegetación y uso del suelo, segunda edición. CONABIO/UNAM, México, D.F. 463 p. [ Links ]
Gentry, A. H. 1995. Diversity and floristic composition of Neotropical dry forests. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press, New York. p. 146–194. [ Links ]
Google earth. 2009. Europa Technologies. http//earth.Google.es; 9.II 2009. [ Links ] Green, J. 1949. The Lycidae of the United States and Canada I. The tribe Lycini. Transactions of the American Entomological Society 75:53–70. [ Links ]
Green, J. 1952. The Lycidae of the United States and Canada V. Plateros. Transactions of the American Entomological Society 78:149–181. [ Links ]
Hawsworth, D. L. y J. M. Ritchie. 1993. Biodiversity and biosystematic priorities: microorganisms and invertebrates. CAB International, Wallingford, Surrey. 120 p. [ Links ]
INEGI (Instituto Nacional de Estadística Geografía e Informática). 1993. Estudio hidrológico del estado de Sonora. Aguascalientes, Aguascalientes. [ Links ]
Janzen, D. H. 1988. Tropical ecological and biocultural restoration. Science 239:243–244. [ Links ]
Jiménez–Velarde y J. Hortal. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología 8:151–161. [ Links ]
Kleine, R. 1933. Lycidae. Coleopterorum catalugus, pars 128, Dr. W. Junk, Berlin. 145 p. [ Links ]
Magurran, A. E. 1988. Ecological diversity and its measurement. Princeton University Press, New Jersey. 179 p. [ Links ]
Maass, M. 1995. Conversion of tropical dry forest to pasture and agriculture. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press, New York. p. 399–422. [ Links ]
McAleece, N., P. J. D. Lambshead y J. D. Cage. 1999 (version 2). Bio Diversity Pro. User's guide and application http://www.sams.ac.uk/research/software/software; 14.VI. 2008. [ Links ]
McDermott, F. A. 1966. Lampyridae. Coleopterorum catalugus, supplementa, pars 9, editio secunda, W.O. Steel. (ed.). Dr. W. Junk, The Hague. 149 p. [ Links ]
Money, H. A., S. H. Bullock y E. Medina. 1995. Introduction. In Seasonally dry tropical forests, S. H. Bullock, H. A. Mooney y E. Medina (eds.). Cambridge University Press, New York, p. 1–7. [ Links ]
Moreno, A. 2001. Métodos para medir la biodiversidad. Manuales y Tesis SEA. Ciencia y Tecnología para el Desarrollo, Sociedad Entomológica Aragonesa/UNESCO, Zaragoza. 83 p. [ Links ]
Murphy, P. y A. E. Lugo. 1986. Ecology of tropical forest. Annual Review of Entomology and Systematics 17:67–88. [ Links ]
Noguera, F. A., S. Zaragoza–Caballero, J. A. Chemsak, A. Rodríguez–Palafox, E. Ramírez, E. González–Soriano y R. Ayala. 2002. Diversity of the family Cerambycidae (Coleoptera) of the tropical dry forest, I. Sierra de Huautla, Morelos. Annals of the Entomological Society of America 95:617–627. [ Links ]
Noguera, F. A., J. A Chemsak, S. Zaragoza–Caballero, A. Rodríguez–Palafox, E. Ramírez–García, E. González–Soriano y R. Ayala. 2008. A faunal study of Cerambycidae (Coleoptera) from one region with tropical dry forest in México: San Buenaventura, Jalisco. Pan Pacific Entomologist 83:296–314. [ Links ]
Osorio–Beristain, O., A. Valiente Banuet, P. Dávila y R. Medina. 1996. Tipos de vegetación y diversidad β en el valle de Zapotitlán de las Salinas, Puebla, México. Boletín de la Sociedad Botánica de México 59:35–58. [ Links ]
Raisz, E. 1964. Landforms of México, segunda edición. Greografic Branch of the Office of Naval Research, Cambridge, Massachusetts. 354 p. [ Links ]
Rzedowski, J. 1991. Diversidad y orígenes de la flora fanerogámica de México. Acta Botanica Mexicana 14:3–21. [ Links ]
Sánchez–Azofeita, G. A., K. L. Castro, B. Rivard, M. R. Kalascka y R. C. Harris. 2003. Remote sensing research priorities in tropical forest environments. Biotropica 35:134–142. [ Links ]
Southwood, T. R. E. 1966. Ecological methods with particular reference to the study of insect populations. Methuen, London 592 p. [ Links ]
Stewart, J. H. y J. Roldán–Quintana. 1991. Upper Triassic Barranca Group, nonmarine and shallow–marine rift–basin deposits of northwestern Mexico. In Studies of Sonoran geology, E. Pérez–Segura y C. Jaques–Ayala (eds.). Geological Society of America, Special paper 254, Boulder, Colorado. p. 19–36. [ Links ]
Toledo, V. M. 1992. Bio–economic cost. In Development or destruction? The conversion of tropical forest to pasture in Latin America, T. E. Downing, S. Hecht, H. Pearson y C. García–Downing (eds.). Westview Press Boulder, p. 63–93. [ Links ]
Toledo, V. H., F. A. Noguera, J. A. Chemsak, F.T. Hovore y E. Giesbert. 2002. The cerambycid fauna of the tropical dry forest of "El Aguacero," Chiapas, Mexico (Coleoptera: Cerambycidae). The Coleopterists Bulletin 56:515–532. [ Links ]
Townes, H. 1972. A light–weight Malaise trap. Entomological News 83:239–247. [ Links ]
Trejo, I. Las selvas secas del Pacífico mexicano (en prensa). In Diversidad, amenazas y regiones prioritarias para la conservación de las selvas secas del Pacífico de México. Medinilla, E. y G. Ceballos (eds.). [ Links ]
Trejo, I. y R. Dirzo. 2000. Deforestation of seasonality dry tropical forest: a national and local analysis in Mexico. Biological Conservation 94:133–142. [ Links ]
Whittaker, R. H. 1972. Evolution and measurement of species diversity. Taxon 21:213–251. [ Links ]
Wilson, E. O. 1987. The arboreal ant fauna of Peruvian Amazon forests: a first assessment. Biotropica 19:245–251. [ Links ]
Wilson, E. O. 1988. The current state of biological diversity. In Biodiversity, Wilson E. O. (ed.). National Academic Press, Washington, D.C. p. 3–18. [ Links ]
Wolda, H. 1978a. Seasonal fluctuations in rainfall food and abundance of tropical insects. Journal Animal Ecology 47:369–381. [ Links ]
Wolda, H. 1978b. Fluctuations in abundance of tropical insects. The American Naturalist 112:1017–1045. [ Links ]
Wolda, H., C. W. O'Brien y H. Stockwell. 1998. Weevil diversity and seasonality in tropical Panama as deduced from light–trap catches (Coleoptera: Curculionidae). Smithsonian Contributions to Zoology 590:79 p. [ Links ]
Zaragoza–Caballero, S. 1984. Catálogo de la familia Phengodidae (Coleoptera). Anales del Instituto de Biología Universidad Nacional Autónoma de México, Serie Zoología 55:307–324. [ Links ]
Zaragoza–Caballero, S. 1989. La familia Phengodidae en Los Tuxtlas, Veracruz, México. Anales del Instituto de Biología Universidad Nacional Autónoma de México, Serie Zoología 59:77–98. [ Links ]
Zaragoza–Caballero, S. 1995. Cantharoidea (Coleoptera) de México. II. Lycinae de Veracruz. Folia Entomológica Mexicana 95:23–84. [ Links ]
Zaragoza–Caballero, S. 1999. Cantharoidea (Coleoptera) de México. VII. El género Plateros Bourgeois (Lycidae: Erotinae: Platerodini). Acta Zoológica Mexicana (n.s.) 78:1–71. [ Links ]
Zaragoza–Caballero, S. 2004a. Cantharidae (Coleoptera). In Artrópodos de Chamela, A. García Aldrete, R. Ayala–Barajas (eds.). Instituto de Biología, Universidad Nacional Autónoma de México. p. 127–137. [ Links ]
Zaragoza–Caballero, S. 2004b. Lampyridae (Coleoptera). In Artrópodos de Chamela. A. García Aldrete, R. Ayala–Barajas (eds.). Instituto de Biología, Universidad Nacional Autónoma de México. p. 139–150. [ Links ]
Zaragoza–Caballero, S. 2004c. Lycidae (Coleoptera). In Artrópodos de Chamela, A. García Aldrete, R. Ayala–Barajas (eds.). Instituto de Biología, Universidad Nacional Autónoma de México. p. 151–162. [ Links ]
Zaragoza–Caballero, S. 2004d. Phengodidae (Coleoptera). In Artrópodos de Chamela, A. García Aldrete, R. Ayala–Barajas (eds.). Instituto de Biología, Universidad Nacional Autónoma de México. p. 163–169. [ Links ]
Zaragoza–Caballero, S., E. González–Soriano, F. A. Noguera M., E. Ramírez–García, A. Rodríguez–Palafox y R. Ayala. 2000. Biodiversidad en Insecta (Odonata, Coleoptera (Cantharoidea, Cerambycidae) Diptera (Syrphydae) e Hymenoptera (Apoidea, Vespidae)) en tres zonas del Pacífico mexicano. 1er. Congreso de responsables de proyectos de investigación en ciencias naturales. SEP/CONACYT (4751P–N). Vereacurz, Veracruz, México. 8–11 octubre, 2000. [ Links ]
Zaragoza–Caballero, S., F. A. Noguera M., J. A. Chemsak, E. González–Soriano, A. Rodríguez–Palafox, E. Ramírez–García y R. Ayala. 2003. Diversity of Lycidae, Phengodidae, Lampyridae, and Cantharidae (Coleoptera) in a tropical dry forest region in Mexico: Sierra de Huautla, Morelos. The Pan Pacific Entomologist 79:23–37. [ Links ]
Zilona, I. J. E. y M. Nummelin. 2001. Coleopteran diversity and abundance in different habitats near Kihansi waterfall in the Udzungawa Mountains, Tanzania. Biodiversity and Conservation 10:769–777. [ Links ]














