Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.78 no.2 México dic. 2007
Ecología
Diversidad de géneros de hongos del suelo en tres campos con diferente condición agrícola en La Laguna, México
Diversity of soil fungi genera in three different condition agricultural fields in La Laguna, Mexico
José Alfredo Samaniego–Gaxiola* y Yasmín Chew–Madinaveitia
Campo Experimental La Laguna, INIFAP. Blvd. José Santos Valdez 1200, Col. Centro, 27440, Mpio. Matamoros, Coahuila, México.
* Correspondencia:
samaniego.jose@inifap.gob.mx
Recibido: 05 junio 2006
Aceptado: 04 mayo 2007
Resumen
En La Laguna, Coahuila–Durango, México (zona con una precipitación anual entre 80 a 250 mm) se estudió la estructura de géneros de hongos del suelo en 3 campos de cultivo agrícola. Del suelo de Tierra Blanca, una huerta de nogal de 51 años, fueron aislados 23 géneros de hongos y de otros 2 suelos, una huerta de nogal de 14 años, nombrada El Chupón y un campo con cultivo de alfalfa, denominado San Jorge, se aislaron l2 géneros. Para cada género se calculó su valor índice de ímportancia (V I I). El género Fusarium tuvo el mayor V I I en los 3 suelos estudiados (71–98). La diversidad (calculada con el índice de Shannon) de géneros fue diferente para cada suelo de acuerdo con intervalos de confianza (95%), con valores de 1.89, 1.72 y 1.19 para Tierra Blanca, El Chupón y San Jorge, respectivamente. Se calcularon índices ecológicos adicionales, como, Simpson, máxima riqueza (H' max) y regularidad (J'). Los valores del índice de Simpson y de J' fueron similares en Tierra Blanca y San Jorge, pero sólo H' max fue similar entre El Chupón y San Jorge. El índice de similitud de Shøresen fue igual al comparar Tierra Blanca con El Chupón o Tierra Blanca con San Jorge (51.4), pero distinto entre el Chupón y San Jorge (58.3). El índice β para las combinaciones Tierra Blanca vs. San Jorge y Tierra Blanca vs. El Chupón fueron de 0.43, pero para San Jorge vs. El Chupón fue de 0.83. Los géneros de hongos del suelo que se encontraron en La Laguna coinciden en 67–75% con los encontrados en suelos desérticos de Israel, pero en La Laguna la estructura de los géneros de hongos es distinta; aquí domina Fusarium y aparecen nuevos géneros, como Trichoderma. Los cambios en la micobiota del suelo pueden haber ocurrido por la actividad agrícola en los últimos 50 años.
Palabras clave: micobiota, hongos fitopatógenos en suelo, Phymatotrichopsis, Trichoderma.
Abstract
This study was carried out in agricultural soils in La Laguna, Coahuila – Durango, Mexico (annual precipitation 80–250 mm). The structure of soil fungal genera of three field soil was studied. In soil of Tierra Blanca, an orchard pecan of 51 years, there were isolated 23 genera of soil fungi, and only 12 genera of other two field soils (El Chupón, a pecan orchard of 14 years, and San Jorge, culturing with alfalfa). For each genus of soil fungi there were calculated the Importance Value Index (I V I). The genus Fusarium showed the greater I V I of the three field soils (71–98). The diversity (Shannon's index) of genera of fungi was different from each soil according to confidence intervals (95%), with values of 1.89, 1.72 y 1.19 for Tierra Blanca, El Chupón and San Jorge, respectively. Additional ecological indexes were calculated, as Simpson, maxim richness (H' max), regularity (J'). The values of Index Simpson and J' were similar between Tierra Blanca and San Jorge, but only H' max was similar between El Chupón and San Jorge. The similarity index of Shøresen was equal for Tierra Blanca vs. El Chupón, or Tierra Blanca vs. San Jorge (51.4), whereas El Chupón vs. San Jorge was 58.3. The index β for the genera of fungi in Tierra Blanca vs. El Chupón or Tierra Blanca vs. San Jorge was 0.48, but San Jorge vs. El Chupón was 0.83. The genera of soil fungi found in La Laguna are 67–75% similar to soil fungi isolated from desert, such as the Israel desert, but in soils of La Laguna the structure of genera fungal is different; here Fusarium is the most abundant, and appear new genera such as Trichoderma. The changes of soil mycobiota could be the result of the effect of agricultural activity during the last 50 years.
Key words: Mycobiota, soil borne plant pathogens, Phymatotrichopsis, Trichoderma.
Introducción
La Laguna es una cuenca que abarca parte de los estados de Durango y Coahuila, México. Se caracteriza por un clima seco desértico (García, 1973) con una precipitación anual que oscila dentro de la región entre 80 a 250 mm por año, y una temperatura máxima promedio de 33.7 °C. En La Laguna se han establecido cultivos como el nogal (Carya illinoiensis (Wangenh.) K. Koch), el algodonero (Gossypium hirstium L.) y la alfalfa (Medicago sativa L.), desde hace más de 50 años, con un manejo agrícola del suelo que incluye irrigación, fertilización e incorporación de residuos de las cosechas y la descomposición que ello conlleva.
En zonas áridas existen hongos del suelo característicos, representados por los géneros Aspergillus y Penicillium (Flanagan, 1981) o especies típicas como Aspergillus nidulans (Eidam) Winters (Klich, 2002); pero también hongos del suelo que causan enfermedades en plantas silvestres o cultivos agrícolas, como Phymatotrichopsis y Verticillium (Castrejón y Chew, 1994; Street y Bloss, 1973). Los hongos del suelo de regiones áridas y semiáridas, y hasta de regiones tropicales han sido estudiados ampliamente (Christensen, 1969; Flanagan, 1981; Domsch et al., 1980). En México, no son frecuentes los estudios de hongos del suelo en predios agrícolas que se encuentran en zonas áridas y semiáridas (Samaniego et al., 1988).
Se obtuvo información adicional de la ecología de los hongos del suelo en zonas desérticas o semidesérticas comparando su diversidad, abundancia, relación con la precipitación, salinidad y la vegetación (Grishkan y Nevo, 2004; Grishkan et al., 2000; Grishkan et al., 2003). El estudio de la diversidad de microorganismos en suelos ha adquirido importancia debido a que explica el éxito de cultivos agrícolas en forma orgánica y sustentable, así como el manejo de algunas enfermedades de plantas causadas por hongos que habitan el suelo (Mäder et al., 2002; Mazzola, 2004). El objetivo de este trabajo fue comparar índices de diversidad de los géneros de hongos del suelo aislados de 3 predios agrícolas con diferente manejo en La Laguna, México.
Materiales y métodos
Sitios de estudio. Tierra Blanca es un predio donde se estableció una huerta de nogal (40 hectáreas) hace 51 años; está ubicado en el municipio de Matamoros, Coahuila, (25° 26' N, 103° 22' O). El Chupón tiene 10 hectáreas con nogal, establecidas desde hace 14 años; se localiza en el municipio de Viesca, Coahuila (25° 22' N,103° 22' O). En el predio de San Jorge, ubicado también en el municipio de Viesca, Coahuila (25° 21' N, 103° 19' O), se encontraba establecido el cultivo de alfalfa desde hacia 10 años. Los predios se irrigan con agua extraída del subsuelo. Las características principales de los suelos del área muestreada se expresan en el Cuadro 1.
Aislamiento, identificación y recuento de hongos. Durante el verano del año 2000, fueron recolectadas 50 muestras de suelo de cada uno de los 3 predios estudiados (Tierra Blanca), El Chupón y San Jorge). Veinticinco muestras de 1 kg de suelo se recolectaron a 0–30 cm y las otras veinticinco a 30–60 cm. De cada muestra mezclada previamente, se inocularon 50 mg de suelo en 3 placas, según la técnica de Warcup (1950); las placas contenían el medio de cultivo usual para aislar hongos del suelo descrito por Papavizas y Davey (1959), excepto por carecer de bilis de buey. Las placas inoculadas con suelo se incubaron a 25 ± 3 °C durate10 días, y se contabilizaron las colonias de los hongos que aparecieron. La identificación de los géneros de hongos se realizó utilizando diversas claves (Arx, 1981; Barron; 1968; Carmichael et al., 1980; Domsch et al., 1980). En algunos casos, las colonias de los hongos se reaislaron para purificarlos e identificarlos, para ello se utilizaron los medios de cultivo papa dextrosa agar o extracto de Malta agar.
Tratamiento estadístico. De las colonias de hongos que aparecieron de las placas inoculadas con las muestras de suelo se obtuvo el valor índice de ímportancia (V I I) de cada género (Joshi, 1983). Los índices de diversidad de Shannon (H ' ), regularidad (J ') y de dominancia de Simpson fueron calculados según Danielo (1998); los de similitud de Sørensen y el de diversidad β, según Mueller–Dombois y Ellenberg (1974).
Las variables densidad, frecuencia y abundancia de las colonias de géneros de hongos se correlacionaron con el V I I utilizando el índice de correlación de Pearson.
Resultados
En El Chupón se contabilizó más del doble de colonias que en Tierra Blanca, en ambas profundidades; mientras que San Jorge tuvo menos hongos que El Chupón, destacando 4 veces menos a la profundidad de 30–60 cm (Fig. 1).
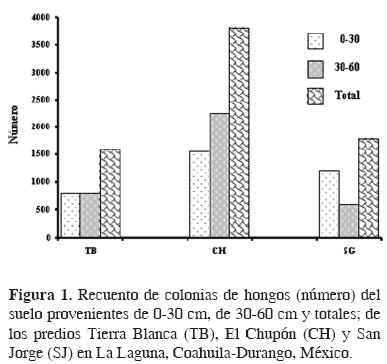
En los 3 predios, el género con mayor V I I fue Fusarium aunque su valor fue nuevamente mayor en El Chupón, con 98.8, y muy similar en San Jorge y Tierra Blanca con 71.3 y 70.4, respectivamente. En los 3 predios, los géneros Penicillium y Aspergillus tuvieron V I I mayor a 20, excepto en Tierra Blanca donde Aspergillus tuvo V I I de 17.7. Los géneros con V I I superior a 20 fueron 5 en San Jorge y 6 en los otros predios (Cuadro 2).
En Tierra Blanca se recobraron 23 géneros de hongos del suelo y mostró el valor más alto de H'. En los demás predios sólo se recobraron 12 géneros, aunque en San Jorge hubo un H' superior al de El Chupón; en todos los predios los intervalos de confianza de H ' no se traslapan. El valor más alto del índice de Simpson se obtuvo en El Chupón, y en los otros 2 predios sólo difirió en 0.01; en contraste, el índice de regularidad fue muy similar entre Tierra Blanca y San Jorge y casi la mitad en El Chupón, como se muestra en el Cuadro 3.

Entre Tierra Blanca y los otros 2 predios el índice de similitud de Sørensen fue 51.4% y el observado entre El Chupón vs San Jorge fue de 58.3%. En las combinaciones TB vs SJ y TB vs CH el índice de diversidad β fue de 0.43, pero SJ vs CH fue de 0.83.
El orden de correlación de Pearson fue < abundancia < frecuencia < densidad con el V I I en cada predio como seaprecia en el Cuadro 4.

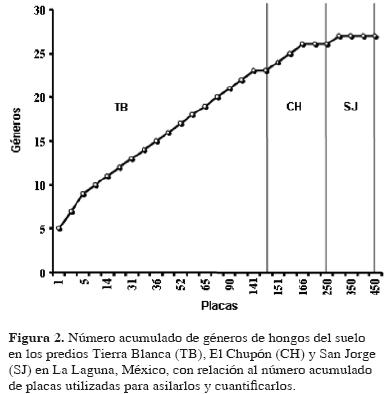
Después de utilizar alrededor de 300 placas el número acumulado de distintos géneros de hongos registrados en los 3 predios se estabilizó, como se aprecia en la Fig. 2.
Discusión
La diversidad de hongos en suelos desérticos es menor a la encontrada en suelos de bosques o selvas debido a que la precipitación en los desiertos es escasa lo que impide una sucesión importante de hongos durante la descomposición de los escasos residuos vegetales (Flanagan, 1981). Sin embargo, la actividad humana, particularmente la agricultura, impacta sustancialmente las condiciones de vegetación (cultivos introducidos) y humedad (riego) en el suelo, de tal manera que son de esperar cambios en la estructura de la micobiota en el suelo, desde su diversidad hasta la aparición de especies no típicas de suelos desérticos. Los hongos que aparezcan en los suelos agrícolas de zonas desérticas influirán los cultivos agrícolas así como la micobiota endémica.
En La Laguna, Phymatotrichopsis y Rhizoctonia son hongos del suelo que atacan los cultivos de nogal y de alfalfa, respectivamente; aunque no fueron asilados, el primero es desfavorecido por el incremento de residuos de cosechas de cultivos agrícolas (Papavizas et al., 1975), mientras que el segundo tiene un comportamiento opuesto (Chavez et al., 1976; Streets y Bloss, 1973). Tanto en Tierra Blanca como en San Jorge se encontró Trichoderma, un género cuyas especies pueden parasitar o ejercer otros efectos antagónicos sobre algunos hongos fitopatógenos incluyendo Phymatotrichopsis y Rhizoctonia. Trichoderma no es típico de ecosistemas desérticos; no obstante, en la zona desértica de Arizona, EUA su presencia fue asociada con suelos cultivados con vid Vitis vinifera L. a la cual se le aplicaron fertilizantes ácidos durante 10 años (Olsen et al., 1988). Tal vez en La Laguna, el cultivo de nogal esté favoreciendo el establecimiento de Trichoderma, particularmente en huertos mayores a 20 años, pues en más de 10 diferentes tipos de suelos cultivados con algodonero (Gossypium hirstium L.) no fue posible recobrarlo, aún después de utilizar más de 3500 placas, pero sí se pudo aislar de 5 suelos con huertas de nogal (datos no publicados).
Algunos monocultivos favorecen hongos fitopatógenos de cultivos (Shipton, 1977), micobiotas características (Leonard, 1957; Mazzola y Gu, 2000) o el incremento de hongos y bacterias antagónicos de los hongos fitopatógenos en el suelo (Liu y Baker1980; Scher y Baker, 1980). También ciertos residuos de cosecha, cultivos o suelos pueden favorecer especies de Trichoderma antagónicas hacia algunas especies de Fusarium y Macrophomina (Baird et al., 2003; Chet y Baker, 1981; Scher y Baker 1980). Pero aún no se sabe, en la mayoría de los casos, cómo manipular la secuencia de cultivos y/o el manejo del suelo para favorecer microbiotas antagónicas de hongos fitopatógenos.
Para Odum (1969) y Baker y Cook (1974), una mayor diversidad de especies le confiere una estabilidad y madurez a los ecosistemas y permite alcanzar un control biológico natural de la microbiota del suelo en contra de los hongos fitopatógenos. Sin embargo, en los ecosistemas agrícolas en zonas áridas la diversidad de plantas se ve prácticamente restringida a la especie cultivada, y algunas más, como malezas, que son limitadas en su crecimiento por el uso de herbicidas y otras prácticas agrícolas. En contraste, el suministro de fertilizantes, agua y restos de parte de los cultivos significa entrada considerable de nutrimentos y condiciones de humedad que favorecen la actividad metabólica de los microorganismos del suelo (Alexander, 1977). Contrasta en La Laguna la precipitación anual que oscila de 80 a 250 mm con el suministro de agua que reciben los cultivos de nogal y alfalfa que equivale hasta 1300 mm por año (Medina et al., 2002; Santamaría et al., 2000). Por tanto, es de esperar que los cambios inducidos por el suministro de agua y la incorporación de los residuos de los cultivos repercutan en la estructura de los hongos del suelo.
Los hongos típicos de 10 sitios en el desierto Israelí, que tiene menos de 250 mm de precipitación anual, son alrededor de 50 géneros que se caracterizan por micelios notoriamente oscuros (ricos en melaninas) y esporas de varias células (Grishkan et al., 2006). En un trabajo previo efectuado en La Laguna se registran géneros de hongos del suelo que coinciden en un 80% con los encontrados en suelos desérticos de Israel (Samaniego et al. 1988); mientras que en este trabajo los géneros de hongos de Tierra Blanca, El Chupón y San Jorge coincidieron en 75, 67 y 75%, respectivamente, con los encontrados en Israel en zonas desérticas con precipitación similar. Por otro lado, alrededor de 20% de géneros de hongos encontrados en este trabajo y en uno previo (Samaniego et al., 1988) coinciden con los encontrados en sitios de Israel donde la precipitación alcanza 700 mm por año (Grishkan et al., 2003).
La estructura de las comunidades de hongos en el suelo no sólo es afectada por la precipitación como parte del clima, también lo es por el microhábitat, que, a su vez, depende de la vegetación dominante o salinidad del suelo (Grishkan et al, 2003; Grishkan y Evo, 2004), de tal manera que en áreas desérticas, en los sitios cubiertos por vegetación, la densidad de hongos fue mayor y se recobró más Penicillium spp. que en sitios sin vegetación en donde dominaron hongos con micelio oscuro y esporas de varias células (Grishkan et al., 2003). Los resultados de este trabajo muestran que ningún hongo con micelio oscuro y esporas con células múltiples tuvo un V I I mayor a 10; en contraste, Aspegillus, Fusarium, y Penicillium tuvieron V I I mayores a 10, lo que sugiere que el predominio de hongos que habitan suelos con mayor humedad como serían, en este caso, los de uso agrícola. Particularmente, el V I I de Fusarium en todos los suelos estudiados en este trabajo indica su dominancia y coincide con la dominancia descrita en suelos con cultivos agrícolas y pastizales (Nash y Snyder, 1965; Park, 1959; Smith y Snyder, 1971).
La sucesión de géneros de hongos que degradan la hojarasca que cae de los árboles permite la aparición de más de 100 especies (Chitiva et al., 2002; Christensen, 1969; Flanagan, 1981). Si bien, la sucesión de la hojarasca del nogal no se ha estudiado en México, la degradación de la hojarasca del nogal establecido en Tierra Blanca podría explicar la diversidad y riqueza de géneros de hongos del suelo.
Un recuento detallado de los géneros de hongos del suelo, tanto de los suelos estudiados en este trabajo como de los suelos en general, implicaría el incremento de los sitios de muestreo, de placas sembradas con suelo por sitio muestreado, de muestreo durante el año; del uso de diferentes medios de cultivo, así como poner en práctica más métodos de aislamiento (dilución, lavado de suelo, separación de suelo por tamaño de partícula) y aumentar la temperatura de incubación de las placas, entre otros. De tal manera que el uso de técnicas moleculares podría permitir diferenciar más del 80% de especies de hongos en el suelo, que por medios convencionales no es posible hacerlo (Bridge y Spooner, 2001). Aún más, nuevas metodologías de análisis genéticos aplicadas para determinar la diversidad de bacterias del suelo parecen indicar que la diversidad de especies en un suelo forestal puede ascender a miles, con una gran cantidad de taxa aún sin clasificar (Torsvik et al., 1990).
El uso de H' ofrece la posibilidad de asociar la diversidad con una amplia gama de variables en diferentes ecosistemas (Danielo, 1998); por ejemplo, asociar H' para bacterias con relación al pH del suelo en una amplia gama de ecosistemas desde desiertos a selvas (Fierer y Jackson, 2006). El índice de diversidad de Shannon tiene la ventaja de poder utilizar especies, géneros o familias para calcularlo. De tal manera que, al aislar y cuantificar géneros de hongos, utilizando condiciones similares (número de muestras, medio de cultivo, época del año), como en los predios estudiados aquí, puede llegar a tener aplicación e importancia, pues los índices de diversidad pueden asociarse con variables de suelo, cultivo y manejo de los cultivos agrícolas. Mäder et al. (2002) encontraron un mayor H' en suelos con mayor fertilidad, los cuales fueron manejados en sistemas de agricultura orgánica durante más de 20 años.
La diversidad de hongos en los predios estudiados tienen diferencias según el índice H ' y sus intervalos de confianza, pero se detectan similitudes entre Tierra Blanca y San Jorge, particularmente sus índices de Simpson y el de regularidad J', lo que sugiere más relación entre estos suelos. El suelo de El Chupón es notoriamente más salino que el de Tierra Blanca, lo que hace que el nogal crezca significativamente menos (Miyamoto, 1997), con la consecuente disminución de residuos del cultivo en suelo, lo que podría explicar la menor diversidad encontrada. En contraste, el aporte de residuos del cultivo de alfalfa es importante,, pues en el lapso de 3 años tiene alrededor de 27 cortes (Santamaría et al., 2000) que al menos en parte son incorporados al suelo como residuos de cosecha.
Literatura citada
Alexander, M. 1977. Introduction to soil microbiology, segunda edición. John Wiley, New York, N.Y. 467 p. [ Links ]
Arx, J. A. 1981. The genera fungi sporulating in pure culture, tercera edición, Cramer, Vaduz. 424 p. [ Links ]
Baird, E. R., E. C. Watson y M. Scruggs. 2003. Relative longevity of Macrophomina phaseolina and associated mycobiota on residual soybean roots in soil. Plant Disease 87:563–566. [ Links ]
Baker, K. F. y R. J. Cook. 1974. Biological control of plant pathogens. Freemen , San Francisco. 433 p. [ Links ]
Barron, G. L. 1968. The genera of hyphomycetes from soil. Williams and Wilkins, Baltimore. 364 p. [ Links ]
Bridge, P. y B. Spooner. 2001. Soil fungi: diversity and detection. Plant and Soil 232:147–154. [ Links ]
Carmichael, J. W., W. B. Kendrick, I. L. Conners y L. Sigler. 1980. Genera of hyphomycetes. The University of Alberta Press, Edmonton. 386 p. [ Links ]
Castrejón, S. A. y M. Y. Chew. 1994. Variaciones morfológicas, fisiológicas y de virulencia en Verticillium dahliae raza SS–4 al reinocularse en la variedad resistente del algodonero Acala Laguna 1. Información Técnica Económica Agraria 90:187–199. [ Links ]
Chavez, H. B., H. E. Bloss, A. M. Bolyle y G. A. Gries. 1976. Effects of crop residues in soil on Phymatotrichum omnivorum root rot of cotton. Mycopathologia. 58:1–7. [ Links ]
Chet, I. y R. Baker. 1981. Isolation and biocontrol potential of Trichoderma hamatum from soil naturally suppressive of Rhizoctonia. Phytopathology 71:286–290. [ Links ]
Chitiva, A., G. R. Torrenegra, P. C. Cabrera, P. N. Díaz y P. V. Pineda. 2002. Contribución al estudio de microhongos filamentosos en los ecosistemas páramo de guasca y el tablazo. http://www.javeriana.edu.co/Facultades/Ciencias/gifuj/hongos_%20ecosistemas_%20paramo.pdf [ Links ]
Christensen, M., 1969. Soil microfungi of dry to mesicconifer–hardwood forests in northern Wisconsin. Ecology 22:9–27. [ Links ]
Danielo, O. 1998. Subsidios al uso del índice de diversidad de Shannon. In Congreso Latinoamericano. 1998. Tema 3. CD–ROM. IUFRO 1, Valdivia. [ Links ]
Domsch, K. H., W. Gams y T. Anderson. 1980. Compendium of soil fungi, vol. I. Academic, London. 859 p. [ Links ]
Fierer, N. y R. B. Jackson. 2006. The diversity and biogeography bacterial communities. Proceedings of the National Academy of Sciences 103:626–631. [ Links ]
Flanagan, P.W. 1981. Fungal taxa, physiological groups and biomass: a comparison between ecosystems. In The fungal community, D. T. Wicklow, and G. C. Carroll (eds.). Marcell Dekker, Nueva York. p. 569–592. [ Links ]
García, E. 1973. Modificaciones al sistema de Clasificación de Köpen. Instituto de Geografía, Universidad Nacional Autónoma de México, México, D. F. p. 7–51. [ Links ]
Grishkan, I., E. Nevo, S. P. Wasser y T. Pavlicek. 2000. Spatiotemporal distribution of soil fungi in "Evolution Canyon", Lower Nahal Oren, Carmel National Park, Israel. Israel Journal of Plant Sciences 48:318–330. [ Links ]
Grishkan, I., E. Nevo, S. P. Wasser y A. Beharav. 2003. Adapative spatiotemporal distribution of soil microfungi in "Evolution Canyon" II, Lower Nahal Keziv, Western Upper Galilee, Israel. Biological Journal of Linnean Society 78:527–539. [ Links ]
Grishkan, I. y E. Nevo. 2004. Soil microfungi of Nahal Meitsar, Golan Heights, Israel. Plant Biosystems 138:21–26. [ Links ]
Grishkan, I., E. Zaady y E. Nevo. 2006. Soil crust microfungi along a southward rainfall gradient in desert ecosystems. European Journal of Soil Biology 42:33–42 [ Links ]
Joshi, I. J., 1983. Investigations into the soil mycoecology of Chambal ravines of India II. Plant and Soil 73:117–186. [ Links ]
Klich, A. M., 2002. Biogeography of Aspergillus species in soil and litter. Mycologia 94:21–27. [ Links ]
Leonard, H. J. 1957. Soil mycoflora associated with continuous cropping of corn, oats, and wheat. The Ohio Journal of Science 57:203–211. [ Links ]
Liu, S. y R. Baker. 1980. Mechanism of biological control in soil suppressive to Rhizoctonia solani. Phytopathology 70:404–412. [ Links ]
Mäder, P., A. Flieβbach, D. Dubois, , L. Gunst, , P. Fried y U. Niggli..2002 : Soil fertility and biodiversity in organic farming. Science 296:1694–1697. [ Links ]
Mazzola, M. y Yu–Huan Gu. 2000. Impact of wheat cultivation on microbial communities from replant soils and apple growth in greenhouse. Phytopathology 90:114–119. [ Links ]
Mazzola, M. 2004. Assessment and management of soil microbial community structure for disease suppression. Annual Review of Phytopathology 42:35–59. [ Links ]
Medina, M. M., R. P. Cano, A. J. Arreola, M. A. Lagarda, V. U. Figueroa, G. J. Chávez, A. C. Godoy, C. U. Nava, D. M. Ramírez, P. T. Herrera, y G. J. Samaniego. 2002. El cultivo del nogal. Libro Técnico No. 3. INIFAP. Matamoros, Coahuila. Mexico. 223 p. [ Links ]
Miyamoto, S. 1997. Salinity management. In Irrigation. V. Texas Pecan handbook, G. R. McEachern and L.A. Stein (eds.) . Texas A&M University, College Station, Texas. p. 21–29. [ Links ]
Mueller–Dombois, D. y H. Ellenberg. 1974. Aims and methods of vegetation ecology. John Wiley, New York. 547 p. [ Links ]
Nash, S. M. y Snyder, W. C. 1965. Quantitative and qualitative comparisons of Fusarium populations in cultivated fields and noncultivated parent soils. Canadian Journal of Botany 43:939–945. [ Links ]
Odum, E. P. 1969. The strategy of ecosystem development. Science 164:262–270. [ Links ]
Olsen, M. W., R. B. Hine y G. R. Dutt. 1988. Control of Phymatotrichum root rot of wine grapes in calcareous soils with amonium–thiosulfate applied in drip irrigation systems. Phytopathology 78:1521. [ Links ]
Papavizas, G. C. y C. B. Davey. 1959. Evaluation of various media and antimicrobial agents for isolatium of soil fungi. Soil Sience 88:112– 117. [ Links ]
Papavizas, G. C., P. B. Adams, R. D. Lumsden, J. A. Lewis, L. R. Dow, W. A. Ayers y J. G. Kantzes. 1975. Ecology and epidemiology of Rhizoctonia solani in field soil. Phytopathology 65:871–877. [ Links ]
Park, D. 1959. Some aspects of biology of Fusarium oxysporum Schi. in soil. Annals of Botany 23:35–49. [ Links ]
Samaniego, G. J. A., S. M. Ulloa y S. T. Herrera. 1988. Micobiota del suelo en huertas de nogal atacadas por Phymatotrichum omnivorum. Revista Mexicana de Micología 4:43–57. [ Links ]
Santamaría, C. J., H. G. Núñez, G. G. Medina y C. Ruiz. 2000. Producción y utilización de la alfalfa en la zona norte de México. INIFAP, Matamoros, Coahuila. 171 p. [ Links ]
Scher, F. M. y Y. R. Baker. 1980. Mechanism of biological control in a Fusarium–suppressive soil. Phytopathology 70:412–417. [ Links ]
Shipton, P. J. 1977. Monoculture and soilborne plant pathogens. Annual Review of Phytopathology 12:387–407. [ Links ]
Smith, N. S. y W. C. Snyder. 1971. Relationship of inoculum density and soil type to severity of fusarium wilt sweet potatoes. Phytopathology 61:1049–1051. [ Links ]
Streets, R.B. y H.E. Bloss. 1973. Phymatotrichum root rot. Phytopathological Monograph 8, American Phytopathological Society. 38 p. [ Links ]
Torsvik, V., J. Goksøyr y F. L. Daae. 1990. High diversity in DNA of soil bacteria. Applied Environtal Microbiology 56:782–787. [ Links ]
Warcup, J. H. 1950. The soil method for isolation of fungi from soil. Nature 166:117. [ Links ]














