Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.78 no.2 México dic. 2007
Anatomía
Morfología y distribución de Porphyra hollenbergii (Bangiaceae, Rhodophyta) en la costa del Pacífico de México
Morphology and distribution of Porphyra hollenbergii (Bangiaceae, Rhodophyta) in the Pacific coast of México
R. Aguilar–Rosas1*, L. E. Aguilar–Rosas2, I. Sánchez–Rodríguez3 , J. E. Broom4 y W. A. Nelson5
1 Facultad de Ciencias Marinas, Universidad Autónoma de Baja California. Km 107 carretera Tijuana–Ensenada, 22830 Ensenada, Baja California, México.
2 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California. Km. 107 carretera Tijuana–Ensenada, 22830 Ensenada, Baja California, México.
3 Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional. Playa Palo Alto de Santa Rita s/n, Apartado postal 592, 23000, La Paz, Baja California Sur, México.
4 Department of Biochemistry, University of Otag., PO Box 56, Dunedin, New Zealand.
5 Museum of New Zealand Te Papa Tongarewa. PO Box 467, Wellington, New Zealand.
* Correspondencia:
raguilar@uabc.mx
Recibido: 25 octubre 2006
Aceptado: 30 abril 2007
Resumen
Se registra la presencia y estacionalidad de Porphyra hollenbergii (Bangiaceae, Rhodophyta) para la costa del Pacífico de México, con base en material recolectado durante el periodo de enero a mayo del 2003 y un análisis de ejemplares depositados en herbarios nacionales y extranjeros. Se describen en forma detallada los caracteres morfológicos y reproductores de los talos, así como su hábitat y distribución geográfica en el área de estudio. La estacionalidad de la fase macroscópica de P. hollenbergii comprende de febrero a mayo (invierno–primavera).
Palabras clave: Bangiaceae, estacionalidad, golfo de California, reproducción, morfología.
Abstract
Occurrence and seasonality of Porphyra hollenbergii (Bangiaceae, Rhodophyta) is reported for the Pacific coast of Mexico, based on sampling conducted in 2003 and those deposited in national and foreign herbarium. We describe details of morphology and reproductive characters of the thallus, as well as its habitat and geographic distribution. We determined that P. hollenbergii is a seasonal species in its macroscopic phase from February to May (winter – spring).
Key words: Bangiaceae, seasonality, Golfo de California, reproduction, morphology.
Introducción
Las especies del género Porphyra son algas de gran importancia económica, debido a su uso como alimento humano (Aguilar–Rosas et al., 1998). Se caracterizan por presentar un ciclo de vida en el cual se alterna una fase foliar macroscópica y otra filamentosa microscópica denominada conchocelis (Cole y Conway, 1980; Conway y Cole, 1981). Los caracteres morfológicos y reproductivos empleados para diferenciar las especies incluyen forma, tamaño, color y grosor de las láminas, presencia o ausencia de denticulaciones microscópicas, sexualidad (dioica o monoica), arreglo divisional y número de estructuras reproductivas, distribución del tejido fértil y dimensión de las células (Kurogi, 1972; Hwang et al., 1998; Klein et al., 2003).
Para la costa del Pacífico de México se reconocen 7 especies del género Porphyra (Aguilar–Rosas y Aguilar–Rosas, 2003a); de las cuales, P. pendula Dawson y P. hollenbergii Dawson se consideran endémicas del golfo de California y son también las menos conocidas (Dawson, 1953; Aguilar–Rosas et al., 2004). El género ha sido estudiado en algunas especies. En la mayoría de los casos es estacional, como en P. suborbiculata Kjellman, P. gardneri (G.M. Smith et Hollenberg) Hawkes, P. pendula y P. thuretii Setchell et Dawson (Aguilar–Rosas y Aguilar–Rosas, 2003a, 2003b; Aguilar–Rosas y Aguilar–Rosas, 2003; Aguilar–Rosas et al., 2004).
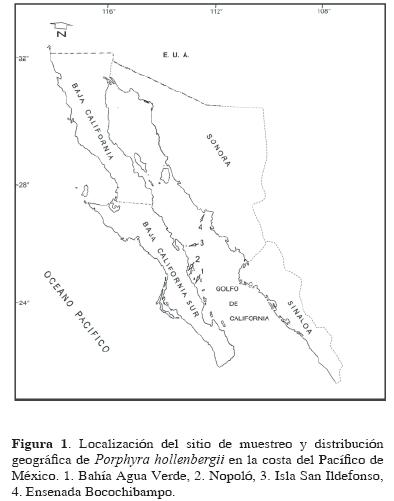
Como parte de la serie de estudios sobre la caracterización morfoanatómica de las especies de Porphyra presentes en la costa del Pacífico de México (Aguilar–Rosas y Aguilar–Rosas, 2003a, 2003b; Aguilar–Rosas y Aguilar–Rosas, 2003; Aguilar–Rosas et al., 2004), en este trabajo se describen a detalle las estructuras vegetativas y reproductoras de la fase foliar de P. hollenbergii, la proporción mensual de las fases reproductivas, su estacionalidad y distribución geográfica en la costa del Pacífico de México, con base en una revisión de especímenes recolectados en la bahía Agua Verde (localidad tipo), Baja California Sur, México, así como de ejemplares depositados en herbarios nacionales y extranjeros.
Materiales y métodos
El área de estudio se encuentra localizada en la bahía Agua Verde, Baja California Sur (21° 31' N y 110° 56' O), al sur del municipio de Loreto (Fig. 1). La bahía presentar un sustrato rocoso compuesto de material de origen volcánico perteneciente al grupo Comondú del Mioceno, con andesitas que se presentan como flujos de lava y depósitos piroclásticos incluyendo aglomerados volcánicos (Ledesma–Vázquez y Jonson, 2001). De febrero a mayo de 2003, se realizaron muestreos sistemáticos mensuales en la zona intermareal media–alta rocosa. Se recolectó una muestra de 250 especímenes para determinar la proporción relativa de plantas en la población (masculina, femenina, vegetativa), y para establecer los intervalos del ancho y largo de láminas se consideraron 250 mediciones, respectivamente. Asimismo, se realizó un promedio de 50 mediciones para determinar los siguientes caracteres: grosor de las láminas, dimensiones celulares (superficial y sección transversal), células rizoidales. En el caso del arreglo divisional y número de estructuras reproductivas en espermatangios y zigosporangios para la formula [a/–, b/–, c/–], se siguió el patrón descrito por Kurogi (1972),, en el que a/ y b/ corresponden a la vista superficial y c/ a la sección transversal de las láminas fértiles de Porphyra. El material fue recolectado y preservado de acuerdo a las técnicas establecidas por Abbott y Dawson (1978) y Aguilar–Rosas, R. y L. E. Aguilar–Rosas (2003a). La identificación de las muestras se realizó usando los trabajos de Dawson (1953) y Krishnamurthy (1972). Para la caracterización de estructuras reproductoras se consideró la terminología propuesta por Notoya (1997). Una colección de referencia quedó depositada en el Herbario CMMEX de la Facultad de Ciencias Marinas, perteneciente a la Universidad Autónoma de Baja California (Holmgren et al., 1990).
Asimismo, se analizaron los especimenes depositados en el herbario UC de la Universidad de California, en Berkeley, California, incluyendo el ISOTIPO; Herbario LAM del Museo de Historia Natural de Los Ángeles, California, incluyendo el PARATIPO; el Herbario ENCB de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional, en México, D.F.; el Herbario CICIMAR del Centro Interdisciplinario de Ciencias Marinas del Instituto Politécnico Nacional, en La Paz, Baja California Sur y el Herbario UABCS de la Universidad Autónoma de Baja California Sur.
Descripción
Porphyra hollenbergii Dawson (1953, p. 16–17, lám. 13, fig. 2). Figs. 2–10.
LOCALIDAD TIPO: Bahía Agua Verde, Baja California (Golfo de California), México.
Hábito y estructura vegetativa. Talo laminar o foliar de 1.0– 7.5 cm de ancho por 22 cm de alto, de color rojo rosado a rojo púrpura claro. Láminas lanceoladas o lineares–lanceoladas, flácidas, simples o divididas a partir de una porción basal común, con márgenes profusamente ondulados, adheridas por un pequeño disco rizoidal (Fig. 2). Las plantas son monostromáticas de 45–60 µm en grosor (Fig. 3), con células vegetativas poligonales irregulares en vista superficial, de 12–16 µm de largo y 8–12 µm de ancho (Fig. 4), en sección transversal son rectangulares a cuadradas con ángulos redondeados de 24–30 µm de largo y 10–14 µm de ancho (Fig. 3). En la porción basal de las láminas se presentan células rizoidales, en vista superficial son de forma oblongas, de 25–40 µm de largo y 15–28 µm de ancho, con proyecciones filamentosas delgadas, hialinas orientadas hacia el substrato (Fig. 5). La proporción de plantas vegetativas en la población analizada en la bahía Agua Verde, es relativamente baj a con relación a las plantas en reproducción masculinas o femeninas (Fig. 11).
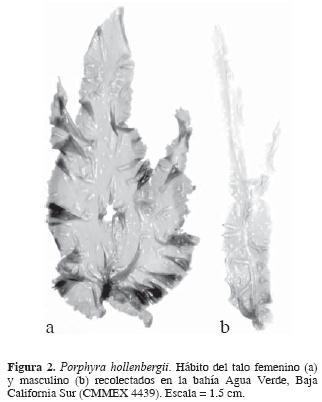
Reproducción. Plantas dioicas. Las plantas masculinas espermatangiales muestran los espermatangios localizados en los márgenes de la porción terminal de las láminas. Los espermatangios se desarrollan formando zonas de tejido de color más claro y contienen 64 espermacios, según la formula [a/4, b/4, c/4] (Fig. 6 y 7). En algunos casos se presentan 128 espermacios por paquete, según la formula [a/4, b/4, c/8] (Fig. 8). Por otro lado, las plantas femeninas muestran los zigosporangios en los márgenes de las partes terminales de las láminas y se presentan en áreas de color rosa púrpura más oscuro y cada uno contiene 8 zigósporas, según la fórmula [a/2, b/2, c/2] ((Fig. 9 y 10). En algunas plantas fue común observar la presencia de prototricoginos en el carpogonio (Fig. 10). Considerando las recolectas de P. hollenbergii en la bahía Agua Verde, se determinó que la mayor proporción de plantas reproductoras se da en marzo, con 122 plantas femeninas y17 masculinas, disminuyendo a 95 plantas femeninas en abril, cuando prácticamente las plantas masculinas (2) desaparecen (Fig. 11). No se registró la fase conchocelis.
Material revisado. BAJA CALIFORNIA SUR: bahía Agua Verde, hembra, macho, vegetativo, 25.III.2003, I. Sánchez–Rodríguez (CMMEX 4439); bahía Agua Verde, hembra, macho, vegetativo, 29.IV.2003, I. Sánchez–Rodríguez (CMMEX 4440); bahía Agua Verde, hembra, macho, vegetativo, 12.II.1940, E. Y. Dawson 539–40 ISOTIPO (UC 925752); isla San Ildefonso, hembra, macho, vegetativo, 24.IV. 1958, E. Y. Dawson 18736 (LAM 52712); Nopolo, hembra, vegetativo 3.II.1958, G. Guzmán, H 342 (ENCB 1711 como P. lanceolata). SONORA: Ensenada Bocochibampo, hembra, 12.II.1946, E. Y. Dawon 496 PARATIPO (LAM 4115).
Hábitat y estacionalidad. Los talos crecen sobre sustrato rocoso en la parte media–alta de la zona intermareal, formando mantos de 2 a 6 m de ancho y de 10 a 25 m de largo, a lo largo de 200 m de costa. De acuerdo con la información de herbario y las fechas de recolecta, las poblaciones de P. hollenbergii se desarrollan de febrero a abril (invierno–primavera). Durante el mes de marzo la mayoría de las plantas encontradas en la población eran de 5–10 cm de largo, mientras que en abril se observó una disminución en la talla, siendo la mayoría de 0.6–1.5 cm de largo.
Distribución. Endémica del golfo de California, se distribuye en Baja California Sur y Sonora.
Comentarios taxonómicos
Con el análisis de ejemplares depositados en herbarios se corrigieron algunas determinaciones erróneas entre P. hollembergii, P. pendula y P. lanceolada. Debido a que estas especies presentan cierta similitud morfológica, reproductiva y de hábitat se tiende a confundirlas al llevar a cabo la identificación de los talos. Sin embargo, existen algunos caracteres morfológicos y reproductivos que permiten diferenciarlas, como se muestra en el Cuadro 1. De acuerdo con la revisión de Porphyra pendula realizada por Aguilar–Rosas et al. (2004), los registros de P. hollenbergii registrados previamente para la bahía de La Paz, Baja California Sur (Riosmena–Rodríguez y Paul–Chávez, 1997) correspondieron a poblaciones de P. pendula localizadas en Calerita, Los Planes e isla Espíritu Santo (Paul–Chávez y Riosmena–Rodríguez, 2000).
Tomando en cuenta el seguimiento de una población localizada en la bahía Agua Verde (localidad tipo de la especie) y con base en los registros de ejemplares depositados en herbarios, determinamos que la fase foliar de P. hollenbergii presenta una marcada estacionalidad semejante a P. pendula (Aguilar–Rosas et al., 2004). Es posible que la aparición y desaparición de la fase foliar de P. hollenbergii esté determinada por la variación estacional de temperatura del agua de mar y fotoperiodo (Dawson, 1944), en virtud de que en el golfo de California se presentan condiciones extremas de periodos de luz cortos durante el invierno con 10.6 horas de luz y temperatura del agua de 18° C promedio, siendo la más baja del año, la cual se incrementa gradualmente hasta alcanzar 29° C, con 13.6 horas de luz en promedio durante el verano (NOAA, 1987–1991).
La disminución de las tallas de las plantas observada de marzo a abril en la bahía de Agua Verde, puede estar relacionada con varios aspectos, como pérdida de material fértil o desprendimiento de las partes terminales, debido a la liberación de los agentes reproductivos, al aumento en la temperatura del agua de mar y a que las plantas en abril sufren un periodo de desecación fuerte durante el tiempo de marea baja, a tal grado, que los talos se muestran quebradizos por el alto grado de deshidratación (Bergdahl, 1990).
Un número mayor de plantas femeninas con respecto a las masculinas es un patrón común observado en otras especies de Porphyra (Aguilar–Rosas et al., 2004) y en especies de otros órdenes como Gigartinales y Gracilariales (Umamaheswara Rao, 1973; Hansen y Doyle, 1976; Hay y Norris, 1984; Oza et al., 1989). Entre las posibles causas que determinan la baja proporción de plantas masculinas está la dificultad para encontrar las estructuras reproductoras en sus primeros estadios de desarrollo y/o al periodo corto de fertilidad (Tveter–Gallagher et al., 1980).
Se describe por primera vez la presencia de carpogonios con prototricoginos en las plantas femeninas de P. hollenbergii. La función del prototricogino en el carpogonio es facilitar la fertilización del mismo por el espermacio (gameto masculino). En la mayoría de las especies de Porphyra se presenta un prototricogino, estando ausente en algunas de ellas y en otras se requieren estudios más detallados que permitan caracterizar ampliamente al carpogonio (Hawkes, 1978). Tseng y Chang (1955) han sugerido que todas las especies de Porphyra pueden formar prototricoginos; sin embargo, no se desarrolla en las que poseen una pared celular gruesa. Otras especies de Porphyra reconocidas para el Pacífico de México en las cuales se presentan carpogonios con prototricoginos son: P. gardneri (Smith et Hollenberg) Hawkes, P. perforata J. Agardh y P. suborbiculata Kjellman (Tanaka, 1952; Hawkes, 1978).
Además de tomar en cuenta el carácter reproductor, Dawson (1953) consideró el ancho de las láminas para diferenciar P. hollenbergii deP. pendula (ambas endémicas del golfo de California), señalando que P. hollenbergii presenta intervalos de 1.0–3.5 cm de ancho, mientras que P. pendula presenta láminas menos anchas, de 0.3–1.2 cm. En la población estudiada de P. hollenbergii en bahía Agua Verde, se determinó que las plantas difieren significativamente de los intervalos establecidos para esta especie; se observó que en general el ancho de la lámina de los ejemplares se encuentra entre 1.0 y 7.5 cm. Esta diferencia en el ancho de las láminas, posiblemente se deba a que Dawson, al realizar la recolecta del material original de P. hollenbergii, consideró pocos ejemplares para su descripción, de acuerdo al material revisado en herbarios, sin considerar la variación de las plantas en el tiempo y el desarrollo de los talos conforme alcanzan su maduración sexual. Cabe señalar, que los resultados preliminares de un análisis molecular, realizado con muestras de P. hollenbergii recolectadas en Agua Verde y de P. pendula en Calerita, B.C.S., indican que existen diferencias entre estas especies a pesar de que presentan cierta similitud en la morfología, reproducción y hábitat (J.E. Broom, datos no publicados).
Porphyra hollenbergii es una especie dioica, con un ciclo de vida bifásico común en especies del género Porphyra, el cual consiste de un talo foliar que produce espermacios y otro zigósporas durante los meses de invierno y primavera, alternado con una fase filamentosa conchocelis que produce conchosporas y que al parecer se desarrolla durante el verano y otoño (Garbary et al., 1980). En esta especie no se presenta la formación de arquésporas en los talos foliosos, como en otras especies de Porphyra del Pacífico de México (Aguilar–Rosas y Aguilar–Rosas, 2003 a, 2003b). En su ambiente natural se observó que las plantas masculinas son de color rosa pálido amarillento, siendo las plantas femeninas fáciles de distinguir por su color rojo púrpura claro, mientras que los talos vegetativos presentaban coloraciones verduscas en las partes basales. El dimorfismo sexual observado en P. hollengergii está determinado por la variación en las tallas y la coloración de los talos en reproducción, de la misma manera que se presenta en P. pendula (Aguilar et al., 2004).
En conclusión, se amplían las características descriptivas morfológicas (largo y ancho de talos) y reproductivas (presencia de prototricoginos en los carpogonios) establecidas para P. hollenbergii (Dawson, 1953), como una especie endémica del golfo de California y una distribución geográfica que incluye los estados de Sonora y Baja California Sur, en la parte centro–sur del Golfo. Las poblaciones de P. hollenbergii se desarrollan en la zona intermareal media–alta en áreas rocosas, con una marcada estacionalidad que incluye los meses de febrero a abril (invierno a primavera).
Agradecimientos
A la Facultad de Ciencias Marinas y al Instituto de Investigaciones Oceanológicas de la Universidad Autónoma de Baja California y al Centro Interdisciplinario de Ciencias Marinas, por el apoyo financiero brindado para la realización del presente trabajo. A Ivonne Paredes, por su apoyo en la recolecta de muestras y a Filiberto Núñez Cebrero, por su colaboración en el análisis de muestras. A los curadores de herbarios, por el préstamo de material ficológico.
Literatura citada
Abbott, I. A. y E. Y. Dawson. 1978. How to know the seaweeds. Brown, Dubuque, Iowa. 141 p. [ Links ]
Aguilar–Rosas, L. E. y R. Aguilar–Rosas. 2003. El género Porphyra (Bangiales, Rhodophyta) en la costa Pacífico de México. II. Porphyra thuretii Setchell et Dawson. Hidrobiológica 13:159–164. [ Links ]
Aguilar–Rosas, L. E., R. Aguilar–Rosas, I. Sánchez–Rodríguez, J. E. Broom y W. A. Nelson. 2004. El género Porphyra (Bangiales, Rhodophyta) en la costa Pacífico de México. IV. Porphyra pendula E. Y. Dawson. Hidrobiológica 14:121–126. [ Links ]
Aguilar–Rosas, R., J. Espinoza–Ávalos y L. E. Aguilar–Rosas. 1998. Uso de las algas marinas en México. Ciencia y Desarrollo 24:65–73. [ Links ]
Aguilar–Rosas, R. y L. E. Aguilar–Rosas. 2003a. El género Porphyra (Bangiales, Rhodophyta) en la costa Pacífico de México. I. Porphyra suborbiculata Kjellman, Hidrobiológica 13:51–56. [ Links ]
Aguilar–Rosas, R. y L. E. Aguilar–Rosas. 2003b. El género Porphyra (Bangiales, Rhodophyta) en la costa Pacífico de México. III. Porphyra gardneri (G. M. Smith) et Hollenberg) Hawkes. Hidrobiológica 13:255–261. [ Links ]
Bergdahl, J. C. 1990. Nori (Porphyra C. Ag.: Rhodophyta). Mariculture research and technology transfer along the northeast Pacific coast. Introduction to applied phycology, I. Akatsuka (ed.). SPB Academic, The Hague. p. 519–551. [ Links ]
Dawson, E. Y. 1944. The marine algae of the Gulf of California. Allan Hancock Pacific Expeditions 3:189–453. [ Links ]
Dawson, E. Y. 1953. Marine red algae of the Pacific Mexico. Part 1. Bangiales to Corallinaceae subf. Corallinoidae. Allan Hancock Pacific Expeditions 17:1–239. [ Links ]
Garbary, D. J., G. I. Hansen y R. F. Scagel. 1980. The marine algae of British Columbia and northern Washington: division Rhodophyta (red Algae), class Bangiophyceae. Syesis 8:185–244. [ Links ]
Hansen, J. E. y W. T. Doyle. 1976. Ecology and natural history of Iridaea cordata (Rhodophyta; Gigartinaceae): Population structure. Journal of Phycology 12:273–278. [ Links ]
Hay, M. E. y J. N. Norris. 1984. Seasonal reproduction and abundance of six sympatric species of Gracilaria Grev. (Gracilariaceae; Rhodophyta) in a Caribbean subtidal sand plain. Hydrobiologia 116/117: 63–94. [ Links ]
Hawkes, M. W. 1978. Sexual reproduction in Porphyra gardneri (Smith et Hollenberg) Hawkes (Bangiales, Rhodophyta). Phycologia 17:329–353. [ Links ]
Holmgren, P. K., N. H. Holmgren y I. C. Barnett. 1990. Index herbariorum, pt 1: The herbaria of the world, eighth edition. Bronx, New York Botanical Garden, x + 693 p. [Regnum Vegetabile, vol. 20]. [ Links ]
Hwang, M. S., M. Han y I. K. Lee. 1998. Allozyme variation and species relationships in the genus Porphyra (Bangiales, Rhodophyta) from Korea. Algae 13:447–459. [ Links ]
Klein, A. S., A. C. Mathieson, C. D. Neefus, D. F. Cain, H. A. Taylor, B. W. Teasdale, A.L. West, E. J. Hehre, J. Brodie, C. Yarish y A .L. Wallace. 2003. identification of north–western Atlantic Porphyra (Bangiaceae, Bangiales) based on sequence variation in nuclear SSU and plastid rbcL genes. Phycologia 42:109–122. [ Links ]
Krishnamurthy, V. 1972. A revision of the species of the algal genus Porphyra occurring on the Pacific coast of North America. Pacific Science 2:24–49. [ Links ]
Kurogi, M. 1972. Systematics of Porphyra in Japan. In Contributions to the systematics of benthic marine algae of the north Pacific, I. A. Abbott and Kurogi M. (eds.). Japanese Society of Phycology, Kobe. p. 167–192. [ Links ]
Ledesma Vázquez, J. y M.E. Johnson. 2001. Miocene–Pleistocene Tectono–Sedimentary evolution of Bahía Concepción Region, Baja California Sur (Mexico): Sedimentary Geology 144:83–96. [ Links ]
NOAA, 1987–1991. Sea surface temperature. Oceanographic analysis. CD Rom COAB 5–05. NOAA, La Jolla, California. [ Links ]
Notoya, M. 1997. Diversity of life history in the genus Porphyra. Natural Histotry Research 3:47–56. [ Links ]
Oza, R. M., A. Tewari y M. R. Rajyaguru. 1989. Growth and phenology of red algae Gracilaria verrucosa (Hudson) Papenfuss. Indian Journal Marine Sciences 18:82–86. [ Links ]
Paul–Chávez, L. y R. Riosmena–Rodríguez. 2000. Floristic and biogeographical trends in seaweed assemblages from a subtropical insular Island Complex in the Gulf of California. Pacific Science 54:137–147. [ Links ]
Riosmena–Rodríguez, R. y L. Paul–Chávez. 1997. Sistemática y biogeografía de las microalgas de la Bahía de La Paz, B.C.S., México. In La Bahía de La Paz: Investigación y Conservación, J. Urbán y M. Ramírez–Rodríguez (eds.). Universidad Autónoma de Baja California Sur, Centro Interdisciplinario de Ciencias Marinas y Scripps Institution of Oceanography, La Paz, Baja California Sur. p 59–82. [ Links ]
Tanaka, T. 1952. The systematic study of the Japanese Protoflorideae. Memories of Faculty Fisheries Kakgoshima University 2:1–92. [ Links ]
Tseng, C. K. y T. J. Chang. 1955. Studies on Porphyra. III. Sexual reproduction in Porphyra. Acta Botanica Sinica 4:153–166. [ Links ]
Tveter–Gallagher E., E. Mathieson, A. C. y D. P. Cheney. 1980. Ecology and development morphology of male plants of Chondrus crispus (Gigartinales, Rhodophyta). Journal of Phycology 16:257–264. [ Links ]
Umamaheswara R. M. 1973. Growth and reproduction in some species of Gracilaria and Gracilariopsis in the Palk Bay. Indian Journal of Fisheries 20:182–192. [ Links ]














