Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.78 no.2 México dic. 2007
Taxonomía y Sistemática
Redescripción y algunos aspectos ecológicos de Girardia tigrina, G. cameliae y G. paramensis (Dugesiidae, Tricladida) en Antioquia, Colombia
Redescription and some ecological aspects of Girardia tigrina, G. cameliae y G. paramensis (Dugesiidae, Tricladida) in Antioquia, Colombia
Mauricio A. Muñoz * e Imelda Vélez
Instituto de Biología, Universidad de Antioquia, Calle 67 Núm. 53108, Apartado Aéreo 1226, Antioquia, Colombia
* Correspondencia:
mao.munoz@gmail.com
Recibido: 14 marzo 2006
Aceptado: 01 febrero 2007
Resumen
Turbellaria está integrada por 2 órdenes: Catenulida y Rhabditophora. Dentro del último, el suborden Paludicola comprende las familias Dendrocoelidae, Dugesiidae y Planariidae. En este estudio fueron encontradas: Girardia cameliae, G. paramensis y G. tigrina (Dugesiidae). Fueron analizados 22 sistemas acuáticos (captura manual en zonas de remanso) del centro y sur oriente de Antioquia. En 3 individuos por especie, se hizo descripción de: ancho, longitud y color corporal; forma y tamaño de cabeza; posición auricular; distancia entre manchas oculares; longitud y posición de faringe. Se efectuó análisis histológico de: gonoporo; bulbo, papila, glándulas y lúmen peneal; vesículas seminales y vasos deferentes; atrio masculino; testículos; canal bursal y bolsa copuladora; ovario y oviductos; glándulas de la cáscara. Se midieron: oxigeno disuelto, pH, conductividad y dureza en el agua. Se realizó reconstrucción gráfica de órganos reproductivos (caracteres taxonómicos) en cortes histológicos seriados. G. tigrina y G. paramensis, presentaron amplia distribución geográfica. Estas especies consumieron ex situ: Daphnia pulex, Chironomus sp., Culex sp. y Drosophila sp. (estados larvales). Tales planarias prefirieron aguas clase II y III (según BMWP/Col). Los aspectos físicos y químicos no exhibieron diferencias entre las preferencias de las especies. G. cameliae se encontró en una sola localidad en condiciones particulares.
Palabras clave: taxonomía, ecología, Turbellaria, planarias, Neotropico.
Abstract
The Turbellaria comprises 2 orders: Catenulida and Rhabditophora. In the latter, the suborder Paludicola contains the families Dendrocoelidae, Dugesiidae and Planariidae. In this study, we found Girardia cameliae, Girardia paramensis and Giardia tigrina (Dugesiidae) in 22 aquatic systems using manual capture in river ponds zones of central and southeastern Antioquia. In 3 individuals per species, a description of: corporal color, length, and wide; head form and size; auricles position; intraocular distance; pharynx length and position, was made. A histological analysis of gonopore; penis bulb, papilla, glands and lumen; seminal vesicles and vas deferens; masculine atrium; testes; bursal canal and copulatory bursa; ovary and oviducts; shell gland, was also conducted. Water oxygen content, pH, conductivity, and hardness, were measured. The graphical reconstruction of the reproductive organs (taxonomical characters) on serial histological cuts was made. G. tigrina and G. paramensis present a broad geographical distribution. These species ate ex–situ: Daphnia pulex, Chironomus sp., Culex sp. and Drosophila sp. (larval stages). These flatworms prefer waters (BMWP/Col index) II – III water class. The physical and chemical aspects did not exhibit differences between G. tigrina and G. paramensis. G. cameliae was found in one only locality with unusual conditions.
Key words: taxonomy, ecology, Turbellaria, flatworms, Neotropical.
Introducción
La clase Turbellaria comprende un grupo de invertebrados, predominantemente de vida libre, que forma parte de la cadena alimenticia. Se caracterizan por ser depredadores de gasterópodos, microcrustáceos, dípteros, rotíferos, etc. y son depredados por larvas de odonatos (Kenk 1974, Pennak 1978). Además son consumidores oportunistas que incluyen en su dieta restos orgánicos y componentes del perifiton. Generalmente se encuentran desplazándose entre los intersticios del material vivo y no vivo en el agua. En cuanto a los estudios con éste y otros grupos cercanos (los terrícola), en Colombia sólo se había practicado una serie de muestreos puntuales; el primero y más representativo de ellos, en el cual se involucró parte del departamento de Antioquia, lo realizó Furhmann en 1914.
El presente trabajo se realizó en diferentes ecosistemas lóticos del departamento de Antioquia en el extremo noroccidental de Colombia (Fig. 1). La región está altamente influenciada en su biodiversidad, hidrografía, cultura y economía por interacciones climáticas y ambientales; se encuentra entre montañas y valles, con orientación sur–norte en el extremo norte de los Andes, dándose lugar a la formación de diversos macro y microclimas y por consiguiente diferentes ecosistemas de montaña. Actualmente la mayoría de ellos degradados por la influencia antrópica. El principal núcleo urbano es su capital Medellín, ubicada en la zona sur–central del departamento. Como es de esperar, en esta zona ocurren diversos fenómenos en cuanto a la contaminación de los cuerpos de agua, esto ayudado por la topografía y las constantes precipitaciones del trópico. La presente investigación procuró analizar el estado de una biota prácticamente desconocida y que según los resultados, aun siendo preliminares, demuestran que este grupo taxonómico se ha encontrado y se encuentra en una zona de confluencia para especies provenientes del norte y del sur, algunas de las cuales quedaron en cierto grado de aislamiento bajo las condiciones anteriormente mencionadas. En la investigación se hallaron las especies: Girardia cameliae, G. paramensis y G. tigrina, recolectadas también en 1914 y posteriormente redescritas por Ball (1980) quien presentó correcciones y ampliaciones a las descripciones hechas por Furhmann. Esta investigación toma importancia extra en lo referente a los Dugesiidae del norte del Neotrópico, pues las descripciones originales de 1914 revelaron pérdidas de información histológica y malas interpretaciones de los caracteres taxonómicos, pues no se contaba con suficiente material.
Materiales y métodos
Se establecieron 44 estaciones de muestreo (remansos) en 22 cuerpos de agua del centro y sur del departamento de Antioquia, Colombia (entre los6°36' 111''N– 75°39'677"O, Río Chico a 2564 m snm, el punto más septentrional y los 5°35'850"N–75°48'662"O, Riachuelo La Salada a 1750 m snm, el punto más austral) (Fig. 1). En cada sitio fueron analizadas 2 zonas de remanso contiguas, con un esfuerzo de muestreo de 2 horas (Young y Reynoldson 1999), recolectando manualmente ejemplares tanto de turbellarios como de macroinvertebrados acompañantes. Para su fijación, los tricládidos fueron relajados con HNO3 2% y/o hielo. Posteriormente, sus estructuras se fijaron, durante 24 horas con formol, alcohol y ácido acético (FAA) y se conservaron en alcohol al 70%. Se realizaron cortes histológicos seriados (7 (jm), posteriormente teñidos con colorante tricrómico mediante el método Mallory–Cason (Paulete et al. 1967). Los gráficos respectivos fueron hechos bajo cámara lúcida. Se elaboró una clave dicotómica para las especies basada en la diferenciación externa de los organismos. Los macroinvertebrados acuáticos acompañantes fueron capturados manualmente y se identificaron hasta el nivel de familia; con esta última información se aplicó el índice biótico BMWP/Col. de calidad del agua (Roldán 2003). Los ejemplares tipo fueron remitidos al curador del museo de la Universidad de Ámsterdam, Dr. Ronald Sluys, para su inclusión.
Descripción
Girardia tigrina Girard (1850). (Fig. 2).

(Fuente: secciones sagitales de 3 ejemplares). Placas histológicas incluidas en la colección del Museo de la Universidad de Ámsterdam.
Tamaño: ejemplares de hasta 13 x 3mm. Coloración: dorso café claro con manchas café oscuro. Presencia de franja conspicua café claro a lo largo de la línea media del cuerpo, comenzando en la región anterior a las manchas oculares y finalizando en el extremo posterior del animal. Algunos ejemplares presentan dicha franja parcialmente. Su región ventral es café pálido sin ningún tipo de manchas.
Morfología externa: región cefálica relativamente pequeña, medianamente triangular. Aurículas poco conspicuas con despigmentaciones en forma de boomerang. Manchas oculares ubicadas al nivel aurícular, separadas 1/3 parte del ancho del cuerpo a ese nivel y rodeadas de áreas reniformes no pigmentadas. Cuerpo de apariencia robusta. Faringe altamente muscular y pigmentada como en todos los Dugesiidae (Ball 1974).
Morfología interna: la musculatura faríngea es típica de la familia Dugesiidae (Ball 1974). El epitelio faríngeo contiene numerosas células nucleadas. Los individuos analizados presentaron numerosos testículos dispuestos en grandes folículos de aproximadamente 120µm de largo, ventralmente ubicados hasta el extremo posterior del animal. El primer testículo se halló entre el 5 y 6 divertículo intestinal, posterior a los ovarios. El pene, compuesto por un bulbo peneal globular altamente muscular y una papila peneal campanuliforme, presenta grandes pliegues a ambos lados. Los vasos deferentes de bajo a medio desarrollo, se curvan en un ángulo de 180° aprox. antes de llegar al bulbo peneal donde se comunican con 2 cámaras bulbares amplias, revestidas por un epitelio nucleado. Estas cavidades desembocan a un estrecho ducto eyaculador que se abre en una posición subterminal, más dorsal que ventral (Fig. 3). Los epitelios son: alto infranucleado (atrio masculino y papila peneal); cuboidal, ciliado, supranucleado (canal de la bolsa copuladora); alto, ciliado, nucleado (gonoporo); y plano, nucleado (ducto eyaculador). Ovarios esféricos, de aprox. 120 µm de diámetro, situados ventralmente en el primer cuarto del animal, se hallaron entre el 4 y 5 divertículo intestinal. Los oviductos entran separadamente al canal de la bolsa copuladora en el lugar donde este se dirige hacia la región ventral. Antes de la desembocadura de los oviductos se presenta un ensanchamiento de su diámetro, este interrumpe la dirección del canal de la bolsa, similar a como se ve en la especie G. longistriata (Ball 1980). Las células glandulares de la cáscara eritrófilas desembocan justo después de la entrada de los oviductos en la forma usual. En una posición más ventral desembocan las células glandulares del pedúnculo de coloración xantofila (Fig. 3). El vitelo se encontró disperso por todo el cuerpo y hacia la región dorsal principalmente. El gonoporo se halló en la misma ubicación antero–posterior de la vagina, formando con ella un conducto más o menos recto. Se observó un pliegue en el atrio común, en frente de la apertura del atrio masculino. La bolsa copuladora es sacciforme de 300 x 400µm aproximadamente, ubicada anterior al pene y con restos de un espermatóforo (Fig. 3). El epitelio del canal de la bolsa presentó una capa subyacente de musculaturas circular y longitudinal entremezcladas. Los ejemplares presentaron 2 regiones glandulares en los extremos ventrales del cuerpo. Se observaron 18 divertículos prefaríngeos en el saco intestinal anterior y entre 17 a 19 divertículos postfaringeos en cada uno de los 2 sacos posteriores.
Distribución. Girardia tigrina fue encontrada en los siguientes cuerpos de agua: río Pantanillo, río Grande, río Chico, quebrada Santa Bárbara, quebrada San Juan y quebrada Las Cruces (Cuadro 1).
Comentarios taxonómicos.
Girardia tigrina se diferencia de otras especies por la siguiente combinación de caracteres. Papila peneal con pliegues laterales; bulbo peneal altamente muscular; vasos deferentes y vesículas seminales medianamente desarrollados; 2 cámaras bulbares muy características; testículos ventrales por toda la extensión del animal; una gran bolsa copuladora sacciforme; oviductos entrando dorso–ventralmente al canal de la bolsa copuladora, interrumpiendo su direccionalidad abruptamente (Ball, 1980) (Fig. 3).
Giardia cameliae Fuhrmann (1914). (Fig. 4).

(Fuente: secciones sagitales de 3 ejemplares). Placas histológicas incluidas en la colección del Museo de la Universidad de Ámsterdam.
Tamaño: ejemplares de hasta 10 X 2 mm.
Coloración: dorso café oscuro con aclaración paulatina hacia la periferia del cuerpo, sin línea media. Algunos individuos sin pigmentación en la zona correspondiente al complejo copulador. La región ventral es café clara. Sin manchas notorias en ambas superficies (Fig. 4). Morfología externa: región cefálica pequeña, medianamente triangular, con aurículas agudas totalmente despigmentadas. Manchas oculares ubicadas al nivel auricular, separadas 1/3 del ancho del cuerpo a ese nivel y rodeadas por áreas triangulares no pigmentadas. El cuerpo presenta apariencia robusta (Fig. 4). Faringe pigmentada como en todos los Dugesiidae, medianamente muscular y con menor diámetro al nivel de su apertura externa, su disposición muscular interna y externa es típica de la familia. En toda su extensión se observan numerosas células glandulares con núcleos eritrófilos.
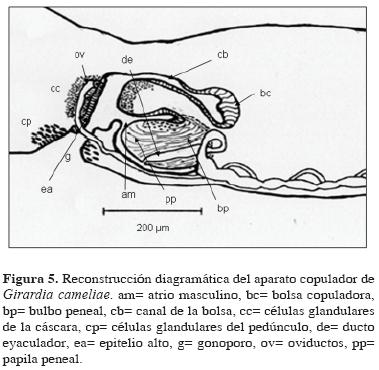
Morfología interna: vitelo xantófilo y cianófilo ubicado principalmente en la región media del animal, dispuesto ventralmente, debajo de los testículos e inter–diverticularmente. Ovarios más o menos esféricos hasta con 90µm de diámetro, ubicados en la región ventral entre el 5 y 6 divertículo intestinal, con al menos 2 grupos de células vitelinas anteriores a ellos. Los oviductos entran separadamente al canal de la bolsa copuladora, justo después de que dicho canal se dirige hacia la región ventral. La desembocadura de los oviductos no interrumpe la dirección del canal de la bolsa. Dicho canal presenta un epitelio alto. Numerosas células glandulares de la cáscara se abren justo después de la entrada de los oviductos. Se observan numerosas células glandulares del pedúnculo abriéndose hacia el epitelio alto en la región cercana al gonoporo; éste se encuentra ubicado al mismo nivel antero–posterior de la vagina, formando junto con ella un conducto más o menos recto. La bolsa copuladora es pequeña, sacciforme, de 70 x 180µm aprox. y en una posición anterior al pene (Fig. 5). Los testículos son numerosos y dispuestos en grandes folículos de aproximadamente 160µm de longitud, la mayoría dorsalmente ubicados. Los primeros testículos se hallaron después de cada ovario (entre el 6 y 7 divertículo intestinal) y en posición media dorsoventral. El pene compuesto por un bulbo de poca musculatura, semiesférico y una papila peneal de forma oval, con epitelio nucleado, eritrófilo en su región dorsal, epitelio alto en las regiones basales y el resto de la papila con epitelio plano. Los vasos deferentes exhibieron un desarrollo bajo a medio, curvándose 360° antes de llegar al bulbo peneal, donde se observó ventralmente una sola cámara bulbar pequeña. Dicha cámara desemboca en un ducto eyaculador con epitelio alto, nucleado y del mismo diámetro, que se abre subterminal y ventralmente, con una leve curvatura hacia la región ventral de la papila peneal (Fig. 5). El atrio masculino amplio, se halló parcialmente recubierto por un epitelio alto, nucleado y eritrófilo. En las regiones próximas a la papila peneal y en la región dorsal del atrio se observó un epitelio plano. El atrio masculino varía entre dividido a más o menos uniforme, ya que en uno de los ejemplares se presentó un tabique que lo separaba del resto del complejo copulador. Se observaron 16 divertículos intestinales prefaríngeos en el saco intestinal anterior y aproximadamente 21 postfaringeos en cada uno de los 2 sacos posteriores.
Distribución. Girardia cameliae se encontró en una sola localidad, en la Quebrada Aguas Claras (Cuadro 1).
Comentarios taxonómicos
G. cameliae se diferencia de las demás especies una papila peneal altamente desarrollada, sin ningún tipo de pliegues y más ubicada hacia la región ventral del animal; el bulbo peneal presentó poca musculatura; los vasos deferentes poco desarrollados, curvándose muy cerca del bulbo peneal y vesículas seminales de mediano desarrollo; una cámara bulbar estrecha que no evidenció una diferencia con respecto al conducto eyaculador; testículos dorsales; una diminuta bolsa copuladora; y sus oviductos no interrumpen la direccionalidad del canal de la bolsa copuladora (Ball, 1980) (Fig. 5).
Girardia paramensis Fuhrmann (1914). (Fig. 6).
(Fuente: secciones sagitales de 3 ejemplares). Placas histológicas incluidas en la colección del Museo de la Universidad de Ámsterdam.
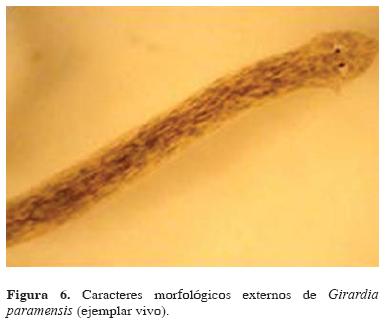
Tamaño: ejemplares de hasta 18.4 x 2.9mm Coloración: dorso traslúcido o de coloración variable, gris a café claro con manchas notorias de un tono más oscuro y sin franjas. La superficie ventral presentó las mismas tonalidades, pero con pequeñas manchas poco notorias (Fig. 6).
Morfología externa: región cefálica altamente triangular, con el extremo en forma de aguja y lados curvilíneos. Aurículas muy agudas y prominentes, con formaciones en boomerang no pigmentadas. Manchas oculares en una posición anterior al nivel auricular, separadas entre un 1/3 a 1/4 parte del ancho del cuerpo a ese nivel, rodeadas por áreas no pigmentadas generalmente reniformes. Cuerpo de apariencia delgada y alargada (Fig. 6).
Morfología interna: faringe altamente muscular, ocupando 1/3 de la longitud total del animal, presentó un epitelio externo con pequeños pigmentos. La musculatura faríngea interna y externa es típica de la familia. Vitelo de forma globosa dispuesto en grupos, disperso por todo el cuerpo, entre los divertículos intestinales y con igual abundancia en las regiones ventral y dorsal. Sin vitelo en posición anterior a los ovarios. Estos son semiesféricos, se hallaron entre el 4 y 5 divertículo intestinal en una ubicación ventral mas posterior de lo normal. Los oviductos entran separadamente en el canal de la bolsa, en el punto donde este se orienta verticalmente, en una ubicación levemente más dorsal que ventral y sin interrumpir la dirección de este canal. El canal de la bolsa revestido con un epitelio cuboidal infranucleado, denota una curvatura más o menos uniforme sobre el atrio masculino, con orientación hacia la región ventral del animal y con un ensanchamiento en su parte final, en el punto donde entran los oviductos. La bolsa copuladora anterior al bulbo peneal, sacciforme con alargamiento antero–posterior, mide 325 x 131µm de longitud. El gonoporo se encuentra en un nivel posterior al de la vagina (Fig. 7). Grandes folículos esféricos testiculares de hasta 230µm de diámetro, ocupando casi toda la extensión dorso–ventral del animal, con tendencia dorsal. El primero se encontró entre el 5 y 6 divertículo intestinal posterior a los ovarios. Bulbo peneal altamente muscular semiesférico, papila peneal de forma cónica, recubierta por un epitelio plano, excepto en sus regiones basales, donde se presentan epitelios altos supranucleados, con numerosas células glandulares eosinófi las desembocando en la región dorsal de la papila. La cual, dentro del complejo copulador, se encuentra levemente orientada hacia la región ventral del mismo. El ducto eyaculador con epitelio plano, de amplitud variable, puede presentar un ensanchamiento o estrangulamiento en la región terminal y desemboca sinuosamente subterminal y ventralmente (Fig. 7). Los vasos deferentes se extienden desde el nivel faríngeo, curvándose 360° antes de entrar al bulbo peneal. Cámara bulbar simple, mediana a pequeña, recubierta por un epitelio plano, ubicada ventralmente dentro del bulbo peneal y del mismo diámetro que el conducto eyaculador. Atrio masculino recubierto con un epitelio alto supranucleado de mayor espesor hacia su región dorsal. Puede presentarse, frente a la apertura del atrio, un tipo de recámara que separa aún más el pene del resto del aparato copulador y que desemboca a una protuberancia de la pared posterior del atrio común (Fig. 7).
Distribución. Girardia paramensis se encontró en los siguientes cuerpos de agua: Quebrada Fize bad, Quebrada La Pulgarina, Quebrada La Torura, Quebrada Miraflores, nacimiento del río Medellín, Quebrada San Juan, Quebrada Las Cruces, Quebrada La Pilluya, Quebrada El Cuervo, Río Aures, Quebrada La Chillona, Quebrada Guayabito, Fuente San Ignacio, Río Negro, Quebrada La Rápida, Quebrada La Arenal y Quebrada Manila (Cuadro 1).
Comentarios taxonómicos
Girardia paramensis exhibió las siguientes características. Una papila peneal cónica; un bulbo peneal altamente muscular, vasos deferentes y vesículas seminales altamente desarrollados; una cámara bulbar medianamente amplia con tendencia longitudinal, diferenciándose claramente del estrecho conducto eyaculador; testículos ubicados en la extensión dorsoventral; una conspicua bolsa copuladora; y un canal de la bolsa copuladora no interrumpido por la entrada de los oviductos (Ball, 1980) (Fig. 7).
Aspectos ecológicos
Distribución. Las especies dentro del hábitat, presentaron una tendencia hacia la distribución en grupos con fuerte actividad gregaria. Se encontraron frecuentemente formando pequeños grupos, en sitios con condiciones estables. Girardia tigrina y G. paramensis, se encontraron en varias localidades. Girardia cameliae exhibió tendencia hacia una distribución restringida, observándose en una sola localidad (Cuadro 1),
Alimentación (ex situ). La actividad alimenticia de estas especies presentó cambios según la oferta de alimento, en condiciones de abundancia, predominó la actividad carroñera; si se les somete a escasez, se observa predación por parte de uno o varios individuos. Cuando la presa es atrapada y se comienza a consumir, se dispara una reacción en cadena en el resto del grupo que incrementa su actividad, hasta lograr detectar el conjunto depredador–presa. Finalmente, entre 80 y 90% de los individuos se desplaza hasta el conjunto, formando un nudo con sus cuerpos e introducen sus faringes por el orificio hecho a la presa, para succionar su contenido. Las presas ofrecidas, Daphni pulex, larvas de Chironomus sp., Culex sp. y Drosophila sp. fueron bien aceptadas por G. tigrina y G. paramensis. También se aceptaron bien: hígado fresco, carne de res, pescado y harina de pescado.
Parámetros físicos y químicos. Los resultados no evidenciaron diferencias entre los requerimientos de oxígeno disuelto, pH y conductividad de las especies G. tigrina y G. paramensis; sin embargo, la primera especie se encontró en aguas con una mayor dureza cálcica. Girardia cameliae se halló en aguas más básicas, con mayor conductividad y temperatura. Los resultados se observan en el cuadro 2.
Índice BMWP/Col. Estos valores se obtuvieron mediante la identificación de las familias de macroinvertebrados acuáticos que se encontraron con las especies de Girardia (Cuadro 3). El índice asigna un valor numérico a cada familia según el grado de asociación a determinada calidad de agua; los puntajes bajos indican mala calidad del agua y los altos, calidades buenas (Roldán, 2003).
Clave dicotómica para las especies encontradas en el departamento de Antioquia, Colombia.
Discusión
Taxonomía. Girardia tigrina, G. cameliae y G. paramensis presentaron claras diferencias taxonómicas externas y principalmente internas. La última, mostró una alta variabilidad externa en cuanto a sus patrones de coloración, más no de su conformación anatómica. Generalmente en los tricládidos varía la tonalidad del cuerpo, de acuerdo al tipo de alimento que consumen.
Distribución. Los resultados confirman al departamento de Antioquia (Colombia) como zona de confluencia de 2 grupos de planarias (Ball, 1980). Uno de ellos ampliamente distribuido en Sur América, con G. tigrina como su principal representante, taxonómicamente, este grupo se caracteriza por presentar un canal de la bolsa copuladora interrumpido en el nivel de entrada de los oviductos, correlacionado esto con la presencia de testículos ventrales. El otro grupo, con su centro de distribución ubicado en las Antillas y Centro América, y representado en Colombia por G. cameliae y G. paramensis presenta la condición opuesta, que consiste en un canal suave e ininterrumpido y presencia de testículos dorsales (Ball 1980). Estos organismos presentaron una distribución restringida, lo cual concuerda con los antecedentes del grupo en otras latitudes (Ball 1980). Posiblemente, el modo de agrupamiento en el hábitat se deba al tipo de reproducción asexual que pueden presentar las planarias, que involucra la conformación de "familias" (visualizado en 3 cultivos de laboratorio para las 3 especies), es decir, animales cercanamente emparentados que mediante eventos reproductivos sucesivos provienen de un parental o de unos cuantos dentro de condiciones ambientales favorables.
Girardia tigrina y G. paramensis son las especies más abundantes y con mayor rango de distribución en diferentes calidades de agua en el departamento de Antioquia, lo que se relaciona con su gran capacidad de resistencia, bajo condiciones ex situ, a bajos niveles de oxígeno disuelto (5 mg/L), utilizando estrategias, como desplazamientos invertidos al nivel de la interfase aire agua, pudiendo de tal manera, protuír la faringe y tomar oxígeno atmosférico.
Entre tanto, G. cameliae se halló en una sola localidad que presenta conectividad geográfica con la región donde fue encontrada en 1914. Tal tipo de distribución restringida es común dentro de los tricládidos (Ball, 1980).
Alimentación. El modo de alimentación de las Girardia es de carácter gregario. El hecho de que los individuos que se encuentren en un mismo lugar hayan sido producidos por bipartición de un ejemplar o de unos cuantos, y por lo tanto presenten una información genética similar, puede infl uir sobre su comportamiento. Al mismo tiempo es una forma de evaluar la preferencia por determinado tipo de alimento. Muchos depredadores exhiben un nivel o grado de percepción del alimento que impide la depredación cuando hay bajas densidades de presa (Ojasti, 2000), es decir, requieren de un número mínimo de presas para poder detectarlas; esto podría ser minimizado por este tipo de alimentación grupal, pues la detección del alimento por parte de una planaria atrae en el 90% de los casos a sus con específicos. Más cuando se trata de organismos "ciegos" que se guían mediante quimiorreceptores. Se corrobora, que G. tigrina presenta un comportamiento alimenticio altamente voraz (Young y Reynoldson, 1999), llegando a devorar otras especies de planarias en condiciones de cautiverio. Además por el hecho de presentar tendencias carroñeras, los turbellarios pueden propiciar cierta "salubridad" en el cuerpo de agua y dentro de la comunidad adyacente, al disminuir en algún grado los niveles de descomposición orgánica.
Parámetros físicos y químicos. Girardia tigrina y G. paramensis mostraron preferencias muy similares, en cuanto a los porcentajes de saturación de oxígeno mayores al 60%, con pH ligeramente ácido, conductividades y temperaturas intermedias, y cierto grado de dureza cálcica. El ambiente en que se encontró G. cameliae presentó una cantidad de oxígeno intermedia, pH ligeramente básico, conductividad intermedia a alta, cierto grado de dureza cálcica y una temperatura relativamente cálida. Estos resultados permitieron determinar que las 3 especies de los Dugesiidae presentaron un alto grado de resistencia a las condiciones fisicoquímicas que más las afectan, lo que muy probablemente ayudó para que perduraran en ambientes colombianos desde 1914, cuando fueron descubiertas para la ciencia (excepto G. tigrina). Girardia tigrina y G. paramensis demostraron, tanto en campo como en laboratorio, cierto grado de adaptabilidad a condiciones adversas, lo que indica que son organismos de tipo eurioico en cuanto a sus requerimientos. Al respecto, se conoce que G. tigrina, de distribución cosmopolita, se comporta como invasora tanto en ambientes limpios como en los altamente contaminados, desplazando a otras poblaciones de planarias (Young y Reynoldson, 1999). En su mayoría, estos resultados concuerdan aproximadamente con la escasa literatura donde se menciona que los tricladidos de agua dulce son abundantes en aguas con más del 70% de saturación de oxígeno, bajas conductividades y pH ligeramente ácido (Galtsoff y Lutz 1959, Kenk 1974).
Este primer acercamiento a la ecología de los tricladidos de agua dulce en Antioquia, demuestra que los resultados para las 3 especies no son concluyentes en cuanto a su función como bioindicadores, para lo cual se requiere un mayor esfuerzo de muestreo mediante el seguimiento de las variables evaluadas y de otras aún más específicas como los nutrientes, metales pesados, tipo y textura del sustrato, entre otras.
Macroinvertebrados acompañantes. Las mayores frecuencias de aparición de los Trichoptera y Diptera acompañantes concuerdan con el hecho de que éstos, presentan cuerpos poco quitinizados, lo cual los hace presas potenciales de las planarias, ya que éstas al poseer cuerpos altamente musculares con buena capacidad de adherencia pueden debilitar o romper dichos tejidos por estrangulamiento, y/o utilizar sus secreciones faríngeas, ricas en enzimas proteolíticas para romper y absorber los contenidos internos de sus presas. Entre tanto, las menores frecuencias de aparición de fauna acompañante concuerdan con la actividad predadora que ejercen los integrantes de algunos órdenes (por ej., Odonata) sobre ellas. En una ocasión se observaron individuos de G. paramensis dentro de casas vacías de Hydropsychidae (Trichoptera).
Índice BMWP/Col. Los valores hallados demuestran que las 3 especies de planarias presentan tendencias por aguas con moderada contaminación. Las ocasiones en que fueron encontradas, G. tigrina y G. paramensis se recolectaron en este tipo de aguas, con frecuencias de 55% y 65.6% respectivamente. Las condiciones de contaminación orgánica promueven el aumento de la productividad en el agua y por consiguiente una mayor estabilidad de las cadenas alimenticias, permitiendo el establecimiento de potenciales presas; además, según las observaciones ex situ, estas dos especies presentaron cierta capacidad para soportar la disminución de oxígeno disuelto, lo cual ocurre frecuentemente en ambientes contaminados.
Agradecimientos
Agradecemos los apoyos económico y pedagógico ofrecidos por la Universidad de Antioquia (Colombia) y la Universidad UNISINOS (Brasil). A la Dra. Ana María Leal Zanchet por su colaboración en el adiestramiento para la determinación taxonómica del grupo. Al Dr. Ronald Sluys (Museo de Ámsterdam) por su disponibilidad para recibir los tipos de las especies encontradas.
Literatura citada
Ball, I. 1974. A contribution to the phylogeny and biogepgraphy of the freshwater triclads (Platyhelminthes, Turbellaria), establishes the family Dugesiidae and assesses the known valid species. In Biology of the Turbellaria, N.W Riser and M. P Morse (eds.). McGraw–Hill. New York. p. 339–401. [ Links ]
Ball, I. 1980. Freshwater planarians from Colombia; revision of Fuhrmann's types. Bijdragen tot Dierkunde 50:235–242. [ Links ]
Fuhrmann, O. 1914. Turbellariés d'eau douce de Colombie. Original descriptions of Dugesia longistriata, D. paramensis, and D. cameliae. D. polyorchis is a synonym of D. festai. Mémoire Societé Neuchâteloise Science Naturel 5:793–804. [ Links ]
Galtsoff, P. S. y F. E. Lutz. 1959. Phylum V. Platyhelminthes, Class Turbellaria. Culture Methods for Invertebrate Animals. Dover, New York. p. 148–156. [ Links ]
Kenk, R. 1974. Flatworms (Platyhelminthes: Tricladida). Pollution ecology of freshwater invertebrates, C. W. Hart and S. L. H. Fuller (eds.). Academic, Nueva York. p. 67–80. [ Links ]
Ojasti, J. 2000. Manejo de fauna silvestre neotropical. Smithsonian Institution, New York. 290 p. [ Links ]
Paulete, J., S. Scaglia, H. Gondinho, A. Backes y C. Fleck. 1967. Guía de técnicas microscópicas. Facultad de Filosofía, Ciencias y Letras de São Leopoldo, Departamento de Historia Natural. San Leopoldo(Brasil). 139 p. [ Links ]
Pennak, R. W. 1978. Fresh–water invertebrates of the United States. Keys to genera of Turbellaria, segunda edición. Wiley, Nueva York. 803 p. [ Links ]
Roldán, G. 2003. Bioindicación de la calidad del agua en Colombia, uso del método BMWP/Col. Editorial Universidad de Antioquia, Medellín. 170 p. [ Links ]
Young, J. O. y T. B. Reynoldson. 1999. Continuing dispersal of freshwater triclads (Platyhelminthes:Turbellaria) in Britain with particular reference tolakes. Freshwater Biology 42:247–262. [ Links ]














