Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista odontológica mexicana
Print version ISSN 1870-199X
Rev. Odont. Mex vol.16 n.1 Ciudad de México Jan./Mar. 2012
Trabajos originales
Adherencia in vitro de Candida albicans en tres diferentes acondicionadores de tejidos usados en prostodoncia total
Yasmín Bonilla Rodríguez,* Víctor Moreno Maldonado,§ Bertha Muñoz Hernández,II Gabriel Palma Cortés¶
* Egresada de la carrera de Odontología, FO, UNAM.
§ Coordinador del Departamento de Prostodoncia, FO, UNAM.
II Encargada del Laboratorio de Micología Médica, Departamento de Investigación en Virología, INER.
¶ Investigador en Ciencias Médicas, Laboratorio de Micología Médica, INER.
RESUMEN
Antecedentes: Los acondicionadores de tejidos, son materiales utilizados en la superficie de la base de la dentadura por un tiempo de 4-7 días. Presentan en su superficie irregularidades y con un uso inadecuado, existe la adherencia de microorganismos como Candida albicans provocando candidiasis bucal. Objetivo: Cuantificar y analizar los tres acondicionadores de tejidos por medio de un microscopio óptico (MO) y de un microscopio electrónico de barrido (MEB), en tres tiempos de inoculación. Estudio: Se elaboraron 36 muestras de inoculando Candida albicans, in vitro durante 24, 72 y 168 h; se observaron mediante MO y MEB de donde se obtuvieron fotografías a un aumento de 500x, 2,000x y 5,000x. Resultados: El acondicionador de tejidos Coe Comfort presentó superficie regular con adhesión de levaduras en gemación e hifa, Lynal presentó superficie agrietada de 3 µm a 72 y 168 h con levaduras en gemación y Flexacryl presentó superficie agrietada a 72 y 168 h de 4 µm y una gran cantidad de levaduras en gemación. Conclusiones: El acondicionador Coe Comfort presenta una superficie más regular y con menor adhesión de Candida albicans, mientras que el acondicionador Flexacryl es el que presenta mayores irregularidades y adherencia de Candida albicans en su superficie.
Palabras clave: Candida albicans, adherencia, microscopia electrónica de barrido, microscopio óptico, candidiasis bucal.
INTRODUCCIÓN
Las prótesis totales, gracias a su diseño, deben ser capaces de distribuir todas las cargas que actúen sobre ellas. La biomecánica de las prótesis consiste en su funcionamiento basado en tres principios: retención, soporte y estabilidad, pero cuando por diferentes causas alguno de estos factores se pierde, se obtiene una desadaptación de la unidad protésica, resorción del reborde residual; dolor, incomodidad e inflamación del tejido en relación directa a la prótesis. Esto sumado al hecho de que el empleo de prótesis es continuo, sin dar la oportunidad de recuperación tisular, y que además exista una higiene deficiente tanto de los rebordes como de la unidad protésica, el paciente se enfrenta a una inevitable reacción por parte de los tejidos que la soportan.1-6
Muchas de estas reacciones tisulares pueden ser revertidas si es que aliviamos la causa que está provocando el daño. Sin embargo, usualmente es necesario un tratamiento del área con un material tisular o acondicionador de tejidos que estará soportado por la prótesis, requiriendo de un periodo de varias semanas para revertir el daño del tejido.4,5,7
Los acondicionadores de tejidos son materiales plásticos y resilentes (visco-elásticos) que fluyen y adaptan íntimamente a la mucosa de los tejidos y la base de la prótesis bucal, funcionando como una almohadilla, absorbiendo parte de la energía producida por el impacto de la masticación entre el tejido bucal y la superficie de la prótesis, dando una zona de alivio al tejido irritado o lesionado.8-10 En la superficie de los acondicionadores de tejidos se presentan ciertas irregularidades (porosidades), las cuales propician la adherencia de distintos microorganismos, formando una placa microbiana compuesta principalmente de bacterias y levaduras.
Los acondicionadores de tejidos son de un uso temporal (5-7 días), después de los cuales van perdiendo su elasticidad y suavidad, siendo después de este tiempo irritantes por volverse ásperos, duros y con defectos. Dichos defectos pueden actuar como reservorios que contribuyen a la adherencia y proliferación de microorganismos, dentro de los cuales el más frecuentemente aislado en pacientes portadores de prótesis es Candida albicans.11-13
Candida albicans es un hongo microscópico, oval levaduriforme de 2 a 4 µm con paredes finas, sin embargo, en tejidos infectados también se han identificado formas filamentosas de longitud variable, con extremos redondos de 3 a 5 µm de diámetro y pseudohifas, que son células alargadas de levadura que permanecen unidas entre sí; es patógeno y oportunista, causante de procesos infecciosos importantes en la cavidad bucal, dentro de los cuales se encuentra la candidiasis bucal, en pacientes portadores de prótesis, donde el tejido epitelial que se encuentra en contacto con la prótesis está adelgazado y el tejido conjuntivo presenta inflamación excesiva, generalmente se localiza en la superficie del paladar, preferentemente en mujeres y refiriendo la sensación continua de ardor.20 La proliferación de Candida albicans y su adherencia en el aparato protésico se relaciona con el inicio, mantenimiento y agravamiento de la candidiasis bucal.3,5,6,14-16
La fase inicial de la adhesión de Candida albicans al acondicionador de tejidos es mediada por factores no específicos (hidrofobicidad superficial y fuerzas electrostáticas) y por componentes de la pared celular (manoproteínas y proteínas fibrilares) que actúan como adhesinas y reconocen receptores en células epiteliales, matriz extracelular y superficies colonizadas por estreptococos bucales.21-24 Una vez adherido, el microorganismo puede reproducirse, desarrollar biopelículas, cambiar su tipo de crecimiento del estado de blastoconidio a pseudohifas e hifas verdaderas, las cuales pueden guiar su crecimiento a través de contacto por las discontinuidades de las células de la mucosa bucal, penetrar entre ellas, invadir tejidos profundos y dificultar la fagocitosis.5,17
El objetivo de este estudio fue poder cuantificar y analizar los tres acondicionadores de tejidos por medio de un microscopio óptico (MO) y de un microscopio electrónico de barrido (MEB), en tres tiempos de inoculación.
MATERIAL Y MÉTODOS
Preparación de las muestras: Fueron elaboradas 36 láminas de acondicionadores de tejidos de 10 mm de largo x 10 mm de ancho x 1 mm de espesor, siendo 12 láminas de Coe Comfort, 12 láminas de Lynal y 12 láminas de Flexacryl, de las 12 láminas de cada acondicionador 6 muestras fueron para ser observadas en el microscopio óptico y 6 con el de MEB STEROSCAM 440; de esta manera se realizaron los estudios por duplicado y en tres tiempos de inoculación (24, 72 y 168 h), siguiendo las indicaciones de manufactura proporcionadas por el fabricante. Las muestras obtenidas se lavaron con agua destilada estéril y posteriormente se desinfectaron por 1 hora con un antibiótico de amplio espectro, que en este caso se trató de amikacina de 500 mg, para la eliminación de bacterias de las muestras dejando una superficie óptima para la adhesión de Candida albicans.18
Manejo de microorganismos y condiciones de cultivo: Se utilizó una cepa de referencia de Candida albicans, proporcionada por el Instituto Pasteur de Francia, la cual se conservó en placas de cultivo agar dextrosa Sabouraud. A esta cepa se le realizaron pruebas de formación de tubo germinativo, clamidoconidio, con el fin de comprobar la pureza de la cepa. El microorganismo fue cultivado en placas de agar dextrosa Sabouraud e incubadas a 37 °C durante 24 a 48 horas, de este cultivo fresco se tomó una azada microbiológica y se incorporó en 100 mL de caldo de soya tripticasa estéril, el cual se mantuvo en una incubadora elíptica toda una noche (12 h) a 37 °C con agitación a 60 rpm.15,19
El cultivo fue centrifugado 10 minutos a 1,000 rpm, posteriormente se retiró el caldo de soya tripticasa y los blastoconidios que están en el sedimento se lavaron dos veces con solución salina estéril. Al sedimento lavado se le agregó 2 mL de caldo de soya tripticasa estéril para resuspender los blastoconidios. Este concentrado se fue agregando a 100 mL de caldo de soya tripticasa estéril hasta que se obtuvo una suspensión del microorganismo a 0.8 OD520 (1 x 107 blastoconidios/mL).20,21
Ensayo de adherencia y formación de Biofilm: Las muestras fueron colocadas en placas de cultivo celular de 24 pozos con 2 mL de la suspensión de Candida albicans. Se incubaron durante los siguientes tiempos: 24, 72 y 168 h a 37 °C con agitación (6 rpm). Transcurridos estos tiempos las muestras se lavaron con PBS (NaCl 8 g, KCl .2 g, KH2PO4 2 g, KH2PO4-12H2O 2.89 g, H2ODest 1 litro, pH 7.4) para remover las células no adheridas.8
La cuantificación y determinación del crecimiento de la levadura se llevó a cabo por medio de un microscopio óptico utilizando la técnica de tinción de Gram, para su conteo se usó una retícula montada en el ocular, la cual contiene 10 campos de ancho por 10 de largo (1 mm2 cada uno), de esta manera se realizó el conteo de levaduras (Gram positivas) por mm.2,8
La determinación de las características y la estructura de la superficie de la muestra se llevó a cabo por medio de MEB STEROSCAM 440 donde se obtuvieron fotografías a un aumento de 500x, 2,000x y 5,000x, donde las muestras previamente fueron fijadas con glutaraldehído (2.5%), lavadas con buffer y deshidratadas con etanol a 20, 40, 60, 80 y 100% posteriormente son montadas en balines de latón y ionizadas con una capa de oro-paladio durante 3 min a 1,500 KV y a 10 µA.8
Análisis estadístico: Se realizó la cuantificación de las células adheridas mediante el paquete estadístico Sigma Stat Ver 3.1. Se realizó una estadística descriptiva general para todas las variables y se compararon los promedios de levaduras adheridas en los diferentes acondicionadores de tejidos utilizados y el tiempo de inoculación con un Anova de una vía, así como la comparación de datos con la prueba Tukey Test.
RESULTADOS
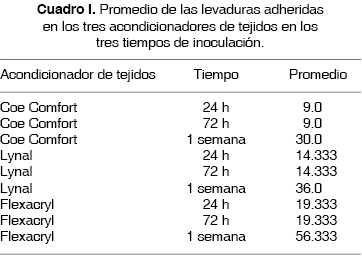
Los datos obtenidos mostraron que al utilizar el acondicionador de tejidos Coe Comfort a las 24 h por medio del MO, se obtuvo al conteo 9 levaduras por mm2 y con MEB, se observó la superficie en su mayoría regular, sin la presencia de porosidades y levaduras de 3 a 3.5 µm de diámetro, bien delimitadas en proceso de gemación (Figura 1-A). A las 72 h se obtuvo en el MO un conteo de 9 levaduras por mm2 y con MEB se observó la superficie con depresiones de 50 a 60 µm y con levaduras de 3.5 a 4 µm de diámetro en estado de gemación (Figura 2-A). A las 168 h se obtuvo en el MO un conteo de 30 levaduras por mm2 y con MEB se observó la superficie con depresiones y con levaduras en estado de hifas (Figura 3-A).
Al utilizar el acondicionador de tejidos Lynal a las 24 h por medio del MO se obtuvo al conteo 14 levaduras por mm2 y con MEB se observó la superficie en su mayoría lisa, con escasas irregularidades y levaduras de 3 a 3.5 µm de diámetro, bien delimitadas en estado de gemación (Figura 1-B). A las 72 h se obtuvo en el MO un conteo de 14 levaduras por mm2 y con MEB se observó en la superficie grietas irregulares de 2 a 3 µm de grosor y con levaduras de 3 a 3.5 µm de diámetro en estado de gemación en las grietas de la muestra (Figura 2-B). A las 168 h se obtuvo en el MO un conteo de 36 levaduras por mm2 y con MEB se observó la superficie con grietas de 3 µm de grosor y levaduras de 3 a 3.5 µm de diámetro, bien delimitados en gemación (Figura 3-B).
El acondicionador de tejidos Flexacryl a las 24 h por medio del MO se obtuvo al conteo 19 levaduras por mm2 y con MEB se observó la superficie regular y lisa, con muy pocas irregularidades y levaduras de 3 a 3.5 µm de diámetro, bien delimitadas en estado de gemación (Figura 1-C). A las 72 h se obtuvo en el MO un conteo de 19 levaduras por mm2 y con MEB se observó en la mayoría de su superficie grietas irregulares de 2 a 4 µm de grosor y con levaduras de 3 a 3.5 µm de diámetro en estado de gemación en la unión de las grietas de la muestra (Figura 2-C). A las 168 h se obtuvo en el MO un conteo de 56 levaduras por mm2 y con MEB se observó la superficie con grietas de 3 a 4 µm de grosor y levaduras de 3 a 3.8 µm de diámetro, bien delimitados en gemación y abundantes en toda su superficie (Figura 3-C).
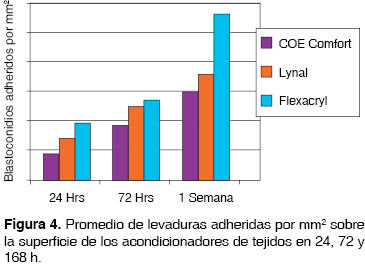
Con los datos anteriores se observó que estadísticamente existen variaciones de adherencia (p ≤ 0.05) entre los acondicionadores de tejidos Flexacryl y Coe Comfort a 24, 72 y 168 h y Flexacryl y Lynal a 168 h significativa dando como resultado Flexacryl 24 h (19.3 ± 3.055) y Coe Comfort 24 h (9 ± 3.6); Flexacryl 72 h (19.3 ± 3.055) y Coe Comfort 72 h (9 ± 3.6); Flexacryl 168 h. (56.3 ± 2.517) y Lynal 168 h (36.0 ± 1.0); Flexacryl 168 h (56.3 ± 2.517) y Coe Comfort 168 h ( 30.0 ± 2.0), los cuales se presentan en el cuadro I y en la figura 4.
DISCUSIÓN
De acuerdo a estudios realizados anteriormente, donde se compararon acondicionadores de tejidos con los mismos tiempos de inoculación pero con distintas marcas como Visco-gel, Fixo-gel, Fitt22 Coe-Comfort, Coe-Soft, GC-Soft,23 MJ Kim et al,22 Kulak Y et al23 observaron que la adherencia de Candida albicans a dichas muestras se presentó inmediatamente a las 24 h de su inoculación, existiendo adherencia de Candida albicans a 1 h de haberse inoculado demostrando que la adherencia se ve influenciada por la estructura del material, al igual que en el presente estudio en donde se demostró que los materiales al paso de los días sufren alteraciones importantes que provocan daños en el tejido oral por lo que debe ser cambiado constantemente.
En este estudio al igual que en el reportado por Kulak Y et al,22 MJ Kim et al,23 se observó que los acondicionadores de tejido, al estar en contacto directo con Candida albicans y al paso del tiempo favorecen la adherencia de dicho hongo, pero que dependiendo de la composición de cada acondicionador la adherencia va variando, ya que como se observó en el estudio que a mayor deterioro del material mayor es la adherencia.
Se coincide con otros autores, en señalar la importancia del estudio de las biopelículas,8-11,18,22-24 formadas por Candida albicans mediante el uso del MEB, ya que en la actualidad es uno de los métodos más confiables, prácticos y valiosos que permite observar la superficie del espécimen, así como la arquitectura de las comunidades microbianas que en ella se establecen.
CONCLUSIONES
En base a los resultados obtenidos en este trabajo se puede concluir que las características de la superficie de las muestras observadas mostraron defectos en cada uno de los acondicionadores de tejido, los cuales van siendo mayores a medida que van pasando los días, ya que se van tornando duros y ásperos, observándose grietas, depresiones e irregularidades.
El acondicionador Coe Comfort presentó una superficie más regular y con la menor adherencia de Candida albicans, por lo que no se obtuvieron datos de crecimiento estadísticos significativos.
Al analizar el acondicionador Flexacryl presentó en su primer día una superficie lisa, con escasas imperfecciones, pero conforme pasaron los días la muestra se volvió en su superficie muy irregular, con grietas de un tamaño de 3 µm de grosor las cuales propician una mayor adhesión de Candida albicans, dando como resultado que este material tenga la mayor cantidad de blastoconidios, con datos de crecimiento estadísticamente significativos a las 24, 72 y 168 h.
Por último el acondicionador de tejidos Lynal es el material que presenta una superficie completamente lisa en sus primeros días pero conforme pasan éstos se va volviendo una superficie irregular, con grietas, promoviendo la adhesión de blastoconidios, en los datos de crecimiento estadísticamente significativos, no existiendo una variante entre las 24 y 72 h pero sí entre las 24 y168 h.
AGRADECIMIENTOS
Al Laboratorio Interdisciplinario de Prostodoncia donde se realizaron las muestras, al Laboratorio de Micología Médica del Instituto Nacional de Enfermedades Respiratorias INER, en el cual se llevó a cabo el desarrollo microbiológico de este estudio y el conteo de las levaduras y al Instituto de Investigaciones en Materiales UNAM en donde se realizó el análisis mediante el microscopio electrónico de barrido STEROSCAM 440.
REFERENCIAS
1. Winkler S. Prostodoncia total. 1a ed. México, Editorial Limusa, 1999. [ Links ]
2. Zarb, GA, Hickey JC, Bolender CI, Carlsson G. Prostodoncia total de Boucher. 10a ed. México, Editorial Interamericana; 1990. [ Links ]
3. Pardi G. Determinantes de patogenicidad de Candida albicans. Acta Odontológica Venezolana 2002; 40 (2): 185-192. [ Links ]
4. Quiroga R. Acondicionador de tejidos . Universidad de Mayor. Fac. de Odontología, 2002: 1-14. [ Links ]
5. Serrano GC. Estudio in vitro de la adherencia de Candida albicans a las resinas. Univ. Complutense de Madrid, 2002; 127: 7-8, 19-20. [ Links ]
6. Pardi G, Cardozo EI, Perrone M, Salazar E. Detección de especies de Candida en pacientes con estomatitis subprotésica. Acta Odontológica Venezolana, 2001; 39 (3). [ Links ]
7. Rostoka D, Krocha IU, Kuznetsova V, Renis A, Tremane R, Uikovskaia T, Vanka A. Candida albicans adhesion to plastics during correction of removable dentures. Stomatologia (Mosk) 2004; 83 (5):14-6. [ Links ]
8. Romo AE. Análisis microscópico de la adherencia de Candida albicans in vitro sobre resina acrílica utilizada para bases de dentaduras procesadas con tres diferentes técnicas Revista Odontológica Mexicana 2006; 10 (4): 167-172. [ Links ]
9. Wright PS, Young KA, Parker S, Kalchandra S. Evaluating the effect of soft lining materials on the growth of yeast. J Prosthet Dent 1998; 79: 404-409. [ Links ]
10. Cal E, Kesercioglu A, Sen BH, Cilli F. Comparison of the hardness and microbiologic adherence of four permanent denture soft liners. Gen Dent 2006; 54 (1): 28-32. [ Links ]
11. Nikawa H, Taizo H. Interactions between thermal cycled resilent denture lining materials, salivary and serum pellicles and Candida albicans in vitro : Part II Effects on fungal growth. J Oral Rehabil 2000; 27: 124-130. [ Links ]
12. Nikawa H, Egusa H. Alteration of the coadherence of Candida albicans with oral bacterial by dietary sugars. Oral Microbiol Immunol 2001; 16: 279-284. [ Links ]
13. Nevelainen M, Nari T. Oral mucosal lesions and oral hygiene habits in the home-living elderly. J Oral Rehabil 1997; 24: 332-337. [ Links ]
14. Bulad K, Taylor RL, Verran J, McCord JF. Colonization and penetration of denture soft lining materials by C. albicans . Dent Mat 2004; 20: 167-175. [ Links ]
15. Liébana UJ. Microbiología oral. Características generales de los hongos patógenos humanos . 1a ed. Madrid, Mc Graw Hill Interamericana de España; 1995: 1362-75. [ Links ]
16. Rodríguez OJ, Miranda TJ, Morejón LH, Santana GJC. Candidiasis de la mucosa bucal. Revisión bibliográfica Rev Cubana Estomatol 2002; 39 (2): 187-233. [ Links ]
17. Gordon R, Stephen SP. Biofilm of Candida albicans. A update. Eukaryotic Cell 2005; 4 (4): 633-638. [ Links ]
18. Waltimo T, Johanna T. Adherence of Candida albicans to the surface of polimethylmethacrilate-e glass fiber compositeused in dentures. Int J Prosthodont 1999; 12: 83-86. [ Links ]
19. Adam B, Baillie GS. Mixed species biofilms of Candida albicans and Staphylococcus epidermidis . J Med Microbiol 2002; 51: 344-349. [ Links ]
20. García-Rodríguez JA, Picazo JJ. Microbiología médica general . Madrid: Ed. Mosby Doyma; 1996: 625-628. [ Links ]
21. Bermejo FA. Medicina bucal Vol. I. Madrid, Ed. Síntesis S.A. 1998: 139-51. [ Links ]
22. Kulak Y, Kadir T. In vitro study of fungal presence and growth on three conditioner materials: J Marmara Univ Dent Fac 1997; 2 (4): 682-4. [ Links ]
23. Kim MJ, Shin SW, Lee JY. In vitro study on the adherence and penetration of Candida albicans into denture soft lining materials. J Korean Acad Prosthodont 2006; 44 (4): 466-476. [ Links ]
24. Waters MGJ, Williams DW, Jagger RG, Lewis MAO. Adherence of C. albicans to experimental denture soft lining materials. J Prosthet Dent 1997; 777: 306-312. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Yasmín Bonilla Rodríguez
Calle Morelos Núm. 13-Int. 10
Col. Emiliano Zapata, Del. Coyoacán
04815 México, D.F.
Teléfono: 56840070
E-mail: yasboni@msn.com
o yasboniro@hotmail.com
Nota
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam











 text in
text in 


