Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista odontológica mexicana
versión impresa ISSN 1870-199X
Rev. Odont. Mex vol.16 no.1 Ciudad de México ene./mar. 2012
Trabajos originales
Grado de integración de injertos óseos nasoalveolares, en pacientes con secuelas de labio y paladar fisurados
Alejandro Montaño López,* Héctor Rincón Rodríguez,§ Carlos Landa SolísII
* Servicio de Cirugía Bucal y Maxilofacial. Hospital HMG Coyoacán, Profesor Titular de Patología General, Centro de Estudios Tecnológicos Industrial y de Servicios No. 57.
§ Jefe del Servicio de Cirugía Maxilofacial Pediátrica. Departamento de Estomatología. Hospital Infantil de México Federico Gómez.
II Ayudante de Investigador en Ciencias Médicas ''B'', Unidad de Ingeniería de Tejidos, Terapia Celular y Medicina Regenerativa. Instituto Nacional de Rehabilitación.
RESUMEN
Introducción: El labio y paladar fisurados son patologías del crecimiento y desarrollo que constituyen el 15% de las malformaciones congénitas, asociadas tanto a factores intrínsecos como extrínsecos. Una de las secuelas más frecuentes vinculadas a este padecimiento es la fisura nasoalveolar (FNA), cuyo tratamiento es a partir de una periosteoplastia o con un injerto óseo. Éstas pueden clasificarse con base en el tiempo o edad en la cual se apliquen así como el tipo o naturaleza del material utilizado. Objetivo: Determinar el grado de integración ósea en injertos óseos secundarios nasoalveolares (INA), obtenidos de la cresta iliaca en pacientes con secuelas de labio y paladar fisurado (SLPF) unilateral, tratados quirúrgicamente bajo la técnica del Dr. Phillipe Boyne, publicada en 1972; realizados en el Servicio de Cirugía Maxilofacial del Departamento de Estomatología del Hospital Infantil de México Federico Gómez. Métodos: Se estudiaron 104 expedientes clínicos y radiográficos de pacientes con SLPF unilateral de entre 7 y 14 años de edad que fueron clasificados bajo los criterios de edad, sexo, lado de la fisura y desarrollo de complicaciones, así mismo se evaluaron radiográficamente los injertos determinando su altura con respecto al piso nasal y se clasificaron sobre la base de lo publicado por Brusati y Garattini en el año 2000. Resultados: Se determinó que existe una dependencia entre el grado de integración ósea y el desarrollo de complicaciones; sin que exista otra dependencia con alguna de las variables. Conclusiones: La técnica descrita por el Dr. Phillipe Boyne, para la reconstrucción de la FNA como SLPF, con toma y aplicación de injerto de la cresta iliaca, mostró su eficacia al obtenerse grados suficientes de integración ósea en la población estudiada.
Palabras clave: Injerto nasoalveolar, fisura nasoalveolar, integración ósea.
INTRODUCCIÓN
Las patologías de crecimiento y desarrollo asociadas a la región craneofacial son muy diversas, dentro de ellas consideraremos a las fisuras o hendiduras orofaciales que comprenden, entre otras a las nasolabiales y nasopalatinas como las más frecuentes; a lo que también se le conoce como labio fisurado (LF) y paladar fisurado (PF), respectivamente. La clasificación general de estas fisuras se mencionará oportunamente.
Embriológicamente las fisuras labiopalatinas se definen como alteraciones en el desarrollo y unión de los procesos embriológicos faciales. De manera específica el LF se desarrolla a partir de una falta de engrosamiento del mesodermo de los procesos nasal lateral y nasomediano, que inicialmente se encuentran unidos en su porción más inferior o caudal por una delgada pared de epitelio. En este punto el mesodermo, alrededor de la cuarta semana de gestación, debe migrar hacia la porción cefálica y línea media invadiendo así esta unión epitelial y permitiendo el engrosamiento que ahora también es de tejido mesenquimatoso, creándose una continuidad entre ambos procesos que permiten la formación de la arquitectura del labio superior y la consecuente formación del piso nasal. La deficiencia de este fenómeno genera una evidente carencia en la migración de tejido mesodérmico, que finaliza en la reabsorción del puente de unión epitelial primitivo traduciéndose en un surco profundo desde el borde más inferior de los procesos nasomediano y nasal lateral hasta la base de la cavidad nasal.
En el caso de la fisura nasopalatina, ésta se encuentra formada por los procesos horizontales propios del proceso maxilar que alrededor de la séptima semana de gestación, los bordes de tejido mesenquimatoso que se encuentran cubiertos de tejido epitelial, deben desarrollar una migración hacia la línea media y su posterior unión con la porción contralateral dando origen al piso de las fosas nasales y techo o bóveda palatina, esto se desarrolla a partir del fenómeno de apoptosis que deben expresar las células epiteliales del recubrimiento de dichos bordes mediales de ambos procesos permitiendo así la exposición del tejido mesenquimatoso, la ulterior migración, el contacto y unión de estos procesos y finalmente su reepitelización. Aparentemente en el caso del PF no se desarrolla este proceso apoptótico en el borde epitelial de los procesos palatinos; esto en ocasiones está coadyuvado por la presencia del órgano de la lengua en la fisura, que en condiciones normales debería descender para permitir dicha unión.1,2
Las fisuras nasolabiales y nasopalatinas, desde el punto de vista etiológico , son consideradas como dos entidades patológicas distintas, tanto en su embriología como en su patogenia pero íntimamente relacionadas en su genética y función, por lo que se les considera como una patología congénita con un componente hereditario.1 Específicamente podemos clasificar los agentes etiológicos de labio y paladar fisurado (LPF) en: 1) factores genéticos o intrínsecos y 2) factores ambientales o extrínsecos.
En el grupo que implica a los factores genéticos se incluyen tanto a aquellos casos de patología única, como aquellos que se presentan asociados a complejos sindromáticos. Menos del 40% de los casos de LPF tienen una etiología genética. Al nacer un producto con LPF, sin que alguno de los padres esté afectado, existe una posibilidad del 4.4% de que el siguiente producto desarrolle LPF. Ahora bien, cuando uno de los padres se encuentra afectado por alguna de las fisuras labiopalatinas, existe una posibilidad de 3.2% de que su primer hijo desarrolle LPF, una vez que esto ocurre entonces un 17% es la probabilidad de que un segundo producto desarrolle LPF.2
En lo que respecta a las patologías sindromáticas asociadas a LPF podemos mencionar lo siguiente:
a) Trisomía 21 o Sx de Down. En ella se incluyen anomalías como retraso mental, displasia auricular, macroglosia, prognatismo mandibular, cardiopatías en el 12% de los casos y LPF en el 6% de los casos.
b) Trisomía 17-18 o Sx de Edwars. Se destaca retraso mental, malformaciones cardiacas congénitas, inserción baja de pabellones auriculares, hiperlaxitud de miembros, micrognasia, alteraciones en la función renal, malformaciones óseas y LPF en el 15-17% de los casos.
c) Trisomía 13-14 o Sx de Patau. Patología donde se desarrollan retraso mental, defectos cardiacos congénitos, sordera, alteraciones en el desarrollo ocular, micrognasia, displasias auriculares, trastornos urogenitales y LPF en 70 a 80% de los casos.
d) Síndrome de Vander Woude. Patología autosómica dominante no ligada al sexo, asociado a deleción del cromosoma 32 caracterizada por labio y/o paladar fisurados, fosas en labio inferior (borde bermellón) asociadas a defectos en glándulas salivales menores, anodoncia parcial maxilar, anquiloglosia y alteraciones en articulación temporomandibular. También se han reportado otras manifestaciones como malformaciones cardiacas y en miembros inferiores. Se presenta en uno de cada 100,000 nacimientos, mundialmente el 2% de los pacientes con LPF se asocia a este síndrome.
e) Síndrome de Tracher Collins. Patología autosómica dominante, no ligada al sexo, que afecta a las estructuras del primero y segundo arco branquial caracterizada por hipoplasias, que van de moderadas a severas en mandíbula, apófisis zigomática del temporal, maxilar, hueso malar y oídos medio y externo (microtia). Se puede observar coloboma lineal en el tercio externo del párpado inferior (50% de los casos reportados), así como oblicuidad antimongoloide. El 30% de los casos se asocian a LPF y el 15% a macrostomía.2,3
f) Síndrome velocardiofacial (síndrome de Shprintzen). Patología autosómica dominante asociada a delección del cromosoma 22 caracterizada por LPF, anomalías cardiacas, retraso en el aprendizaje y diversas alteraciones no constantes de tipo endocrino, ortopédico, oftalmológico e inmunológico.4
g) Secuencia de Robin. Conjunto de malformaciones orofaciales caracterizadas por micrognasia, glosoptosis y paladar fisurado característico en forma de ''u''. La severidad de la micrognasia puede desarrollar obstrucciones en la vía aérea superior.5
En el caso de los factores ambientales cuya vinculación es considerada como directa en las patologías congénitas, consideramos prudente mencionar a los siguientes:
a) Agentes infecciosos. Podemos mencionar a los de mayor incidencia como la rubéola congénita (togavirus), que además de LPF puede originar malformaciones oftálmicas (cataratas, coriorretinitis, glaucoma y microftalmia), auditivas principalmente asociadas a sordera por lesión al órgano de Corti; cardiacas que se manifiestan con persistencia de conducto arterioso, defectos septales, auriculoventriculares y estenosis pulmonar. Así mismo, otras infecciones por citomegalovirus, toxoplasmosis congénita ( Toxoplasma gondii ), y sífilis congénita ( Treponema pallidum ).6
b) Agentes farmacológicos. Los grupos farmacológicos asociados a esta patología son: corticosteroides (cortisona), benzodiacepinas, anticonvulsivos, talidomida y antimetabolitos como la aminopterina y el metrotexate los cuales antagonizan el metabolismo del ácido fólico. Así mismo, en este grupo incluiremos a las deficiencias hormonales en donde la deficiencia de hormona del crecimiento es un factor asociado al desarrollo de LPF. Los retinoides así como el consumo de alcohol y tabaco también se han asociado importantemente como agentes causales.6
c) Agentes físicos. En este grupo encontramos principalmente a la radiación Roentgen o radiación X, que además de LPF se asocia a microcefalia, espina bífida y alteraciones en el desarrollo de extremidades. El desarrollo de estados de hipertermia patológica (fiebre) o inducida (sauna) se ha relacionado además con alteraciones del SNC y defectos en el tubo neural.4
d) Otros agentes congénitos. En este rubro mencionaremos al oligodramnios severo, el cual puede generar una compresión anteroposterior de las paredes de la membrana placentaria sobre la mandíbula lo que impedirá el descenso del órgano de la lengua evitando así la unión de las porciones horizontales de los procesos maxilares, siendo esto una de las causales de la secuencia de Robin.1,4
Epidemiológicamente hablando, las fisuras labiopalatinas son dos entidades diferentes que pueden presentarse de forma aislada o conjunta como ya se ha mencionado.7 Se considera una patología relativamente frecuente constituyendo el 15% de las malformaciones congénitas y sólo el pie equinovaro y los defectos cardiacos congénitos ocurren con mayor frecuencia.8,9 De las incidencias de individuos con LPF, aproximadamente el 45% de los casos de labio fisurado se asocian también a paladar fisurado, el 30% desarrollan sólo labio fisurado y el 25% restante muestran sólo paladar fisurado. El labio fisurado unilateral incide 2:1 con tendencia al lado izquierdo y de la misma forma en hombres respecto a las mujeres. Así también el labio fisurado sólo incide 1.5:1 a hombres respecto a las mujeres.10
El labio fisurado y el paladar fisurado al presentarse como entidades patológicas aisladas, tienen una incidencia de 30% en el primero y el 20% en el caso del segundo; cuando se observan de forma conjunta implican el restante 50% de las fisuras labiopalatinas reportadas. Cabe mencionar que en el caso del paladar fisurado sólo, del 40 al 50% de los casos reportados están asociados a alguna patología sistémica o malformación congénita, comparativamente con el labio fisurado aislado que sólo del 7 al 13% de los casos lo están y el labio y paladar fisurados en conjunto del 2 al 11% de los casos se asocian.9,10
La incidencia promedio mundial étnica de pacientes nacido vivos, se expresa de la siguiente forma:
a) México: 1:700
b) América: Latina 1:650
c) Caucásicos: 1:1,000
d) Asiáticos: 1:500
e) Africanos: 1:2,000
En lo que respecta a la clasificación de las fisuras labiopalatinas, se considera un tema que regularmente genera controversia debido a los múltiples criterios que a la fecha existen para dicho fin. Dentro de los últimos 70 años las clasificaciones más reconocidas y aceptadas de las fisuras labiopalatinas encontramos:
a) Davis y Ritchie. Agrupa las fisuras en tres grupos: I fisuras anteriores (nasolabiales), II fisuras posteriores (palatinas) y III fisuras tanto nasolabiales como palatinas.
b) Veau. Crea cuatro grupos en números o letras, en donde el grupo 1 o A incluye las fisuras de paladar blando, el grupo 2 o B incluye fisuras de paladar duro y blando, el grupo 3 o C defectos de paladar y reborde alveolar que usualmente involucra el labio unilateralmente y el grupo 4 o D fisuras bilaterales.
c) Kernahan y Stark. El foramen incisivo funciona como punto de división entre las dos entidades embriológicas que involucran los defectos de LPF, éstas se mencionan como primarias y secundarias. Las fisuras labiopalatinas se dividen en cuatro grupos: A) fisuras labiales primarias, B) fisuras de paladar blando, C) fisuras de paladar duro, D) fisuras labiales y palatinas.
d) La clasificación de la Confederación Internacional de Cirugía Plástica y Reconstructiva menciona tres grupos: a) defectos labiales y alveolares, b) fisuras palatinas, primarias y secundarias y c) cualquier combinación de fisuras que involucren tanto paladar primario como secundario.10
Otras de las formas más aceptadas de nomenclatura y clasificación son con base en la descripción anatómica de las fisuras en donde se involucran las antes mencionadas.
Labio fisurado, con o sin paladar fisurado:
a) Labio fisurado unilateral
b) Labio y paladar fisurado unilateral
c) Labio fisurado bilateral
d) Labio y paladar fisurado bilateral
Paladar fisurado sólo:
a) Paladar fisurado
b) Paladar fisurado submucoso
c) Insuficiencia velofaríngea
d) Secuencia de Robin
Cabe mencionar la necesidad de añadir a las clasificaciones los siguientes adjetivos: 1) ''incompleto'', en el caso de que así se manifieste la extensión anatómica en la fisura labiopalatina, 2) ''primario'' cuando la fisura labiopalatina involucra la región más anterior del maxilar (premaxila) y 3) ''secundario'' cuando se afecta la región posterior al foramen oval, independientemente que involucra tanto al paladar duro, blando o ambos.
El tratamiento de las fisuras labiopalatinas es considerado multidisciplinario donde podemos separarlo en dos grandes grupos, el quirúrgico y el no quirúrgico y debido al enfoque del presente estudio nos limitaremos a la descriptiva del primero.
El tratamiento quirúrgico para el LPF puede clasificarse en dos estadios: primarios y secundarios.
El primero comprende el cierre del labio y el paladar fisurados (cierres primarios), así como una revisión quirúrgica nasal y la corrección de las insuficiencias velofaríngeas, lo anterior es usualmente definido en los primeros 5 años de vida. Sin embargo, algunos autores mencionan que los procedimientos primarios deben limitarse al cierre del labio y el paladar fisurados. Específicamente en lo que respecta al cierre primario del LF podemos encontrar la corriente que menciona el cierre temprano en la etapa neonatal, esto debido a que los niveles de colágena fetal aún son elevados, lo que garantiza una mejor regeneración de los tejidos conectivos evitando así el desarrollo de una cicatrización conspicua. Del mismo modo, la aún existencia de cantidades considerables de inmunoglobulinas maternas y corticosteroides plasmáticos naturales, reducen las posibles complicaciones postquirúrgicas. Otra de las ventajas del cierre primario temprano del labio fisurado es que permite una mejor alimentación del paciente así como su aceptación psicológica por parte de los padres y familiares. Sin embargo, no todo se ha reportado con resultados positivos en lo que al cierre primario respecta, autores han controversiado fundamentando en la posibilidad de una complicación anestésica debido a un relativo mayor requerimiento de fármacos, una mayor dificultad de intubación, así como las menores dimensiones anatómicas del LF. Esto permite entonces considerar un criterio con un periodo más amplio a este cierre primario apegándose entre otros elementos, en la regla de los dieces (10 mg mínimo de hemoglobina, por lo menos 10 lb de peso, hasta 10 mil leucocitos y 10 semanas de vida) publicada por Wihelmsen y Musgrave en 1966.11 De forma casi paralela, Veau sugirió que el mejor tiempo para ello es alrededor de los 18 meses de edad, fundamentado en el inicio del desarrollo integral del habla; sin embargo, otros estudios mostraron que un cierre temprano puede realizarse a partir de los 6 meses con base al desarrollo de una mejor actividad de los músculos del paladar blando y consecuentemente una mejoría en la competencia velofaríngea debido a una menor brida cicatrizal aplicada a los tejidos blandos del PF, ya que el cierre temprano del paladar duro compromete considerablemente el crecimiento anteroposterior del maxilar, por ello se ha sugerido postergar dicho cierre a los 18 meses de vida. Los principales objetivos a perseguir en este proceso del cierre primario son: a) optimizar la alimentación, b) mejorar la vía aérea, principalmente en asociaciones sindromáticas o casos que impliquen retrognasia mandibular, c) manejo de las patologías de oído medio en donde la fisura palatina condiciona una otitis serosa por insuficiencia muscular del esfínter de la desembocadura de la tuba auditiva, d) disminución de la insuficiencia velofaríngea que condiciona voz hipernasal, considerando a la edad el criterio primordial para realizar dicho cierre ya que el habla desarrolla fijación en la corteza cerebral alrededor de los 6 años de vida.
La segunda etapa quirúrgica, conocida también como secundaria, da inicio alrededor de los 7 años de vida comprendiendo el manejo de las fístulas y fisuras nasoalveolares (FNA), el tratamiento ortodóntico/ortopédico y la corrección de las deficiencias o desarmonías esqueletales maxilomandibulares, en donde los comunes denominadores son las hipoplasias anteroposteriores y transversales del maxilar así como un crecimiento vertical de la mandíbula. Lo anterior se conoce como secuelas de labio y paladar fisurados (SLPF).12
Dentro de este estadio de tratamiento quirúrgico secundario nos referiremos concretamente al manejo de las FNA, en donde el defecto óseo condiciona una importante secuencia de secuelas funcionales y estéticas que involucran tejidos duros y blandos y que frecuentemente se asocia a la presencia de fístulas nasoalveolares.
Uno de los principios fundamentales para el tratamiento de las FNA es el cierre de fístulas, en caso de que existan y su reconstrucción mediante la aplicación de un injerto óseo.
A través de los años se han utilizado diversos materiales para reconstruir los defectos óseos de la economía humana. En 1901 el Dr. Von Eiselberg, considerado uno de los pioneros en el tratamiento de FNA, aplicó un injerto óseo pediculado para corrección del defecto alveolar.13 Posteriormente en 1907 el Dr. Axhausen realizó una de las mayores contribuciones en el área de la trasplantación ósea y la osteogénesis, mediante la formulación del principio biológico de que el periostio estimulaba un índice celular de osteogénesis a partir de injertos autólogos, siendo esto considerablemente bajo en el caso de los heteroinjertos y prácticamente nulo en los xenoinjertos. A partir de sus estudios se llegó a lo que ahora se conoce como biología de la trasplantación ósea.3,13 Por otra parte, el Dr. Drachter en 1914 realizó el primer intento de un injerto óseo nasoalveolar para la reconstrucción de FNA.
Las reconstrucciones de las FNA mediante la aplicación de injertos óseos primarios de tipo autólogo tuvieron su mayor auge en la década de los 50, específicamente en 1955 con el Dr. Nodin quien es considerado pionero en la reconstrucción de FNA con injerto autólogo. Lo anterior, bajo las premisas de prevenir el colapso maxilar y otorgar estabilidad transversal al mismo tiempo que permite un crecimiento craneofacial óptimo y facilitando la erupción de órganos dentarios primarios en el sitio del injerto. A pesar de estas expectativas, el Dr. Jolley en 1968 determinó que a largo plazo los pacientes manifestaban un considerable compromiso de crecimiento facial y una alta incidencia de fenómenos de maloclusión.14
Posterior a esta corriente se introdujo la técnica de periosteoplastia primaria en donde únicamente se creaba el cierre de los tejidos blandos, con el objetivo de inducir un crecimiento óseo en el sitio de la fisura por el principio biológico de la estimulación o inducción perióstica. Ello se lograba de forma parcial al obtenerse estrechos puentes óseos que reconstruían la fisura y con la ventaja de no alterar el crecimiento facial; sin embargo la cantidad de hueso neoformado no era el suficiente para cubrir las expectativas ni los objetivos necesarios y propios de un injerto de reconstrucción nasoalveolar.8
Fue en la década de los 70 donde la reconstrucción secundaria de las fisuras nasoalveolares retoma su importancia con la publicación en 1972 ''Injertos óseos secundarios en hendiduras alveolares y palatinas'' por los cirujanos Phillipe J. Boyne y N.R. Sands, en donde se reafirman los conceptos de la reconstrucción secundaria de FNA y se da a conocer una técnica (Figura 1) que permite, entre otras ventajas, un adecuado cierre del piso nasal debido a la disección de la mucosa nasal de la bucal (Figura 2), así mismo la aplicación de un volumen más considerable de tejido óseo (Figura 3) logrando una mejor expectativa hacia los objetivos de los INA, mismos que serán comentados posteriormente. Por lo anterior, esta técnica es considerada como parte del protocolo de tratamiento de las FNA con INA en el presente estudio.
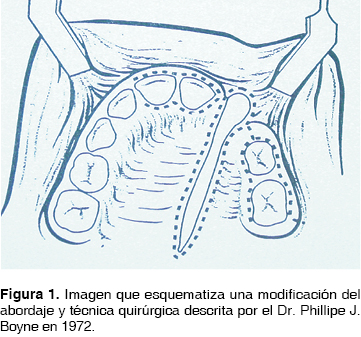
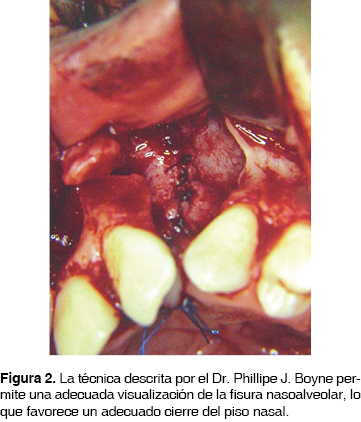
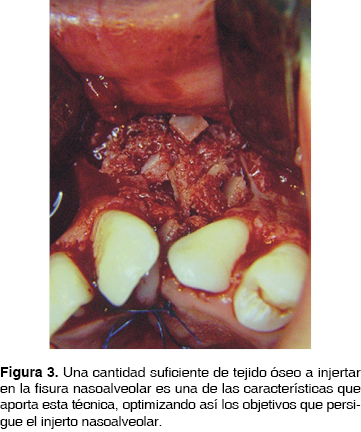
Como se mencionó con anterioridad, el establecimiento de las bases biológicas para un trasplante óseo permitió la determinación de criterios y propiedades ideales de los materiales para reconstrucción ósea: 1) biocompatibilidad, 2) viabilidad, 3) capacidad osteogénica, 4) neoformación de matriz ósea y 5) estabilidad mecánica.
Estos criterios han permitido establecer, su desarrollo biológico y evolución clínica, que el hueso autólogo sea considerado de elección primaria para las reconstrucciones óseas.
Por otra parte consideramos trascendente mencionar la clasificación de los INA, que con fundamento en la cronología de su aplicación, pueden clasificarse de la siguiente forma:
Injertos óseos secundarios tempranos: Son aquéllos aplicados durante la etapa de dentición primaria que oscila entre los 2 y 5 años de edad. La presencia de tejido óseo que permita una erupción de la dentición primaria así como proveer una salud periodontal adecuada es una de primordiales consideraciones para este injerto temprano, sin embargo se han observado alteraciones y deficiencias en el crecimiento y desarrollo hemifaciales en algunos pacientes sometidos a este tipo de injertos.
Injertos óseos secundarios: Aplicados en la etapa de dentición mixta que oscila entre los 6 y los 12 años. Se considera por la mayoría de los autores como el más óptimo de los injertos debido a que el hueso provee soporte para la erupción del canino permanente en el sitio de la fisura, así como provee suficiente tejido óseo para dar altura al proceso alveolar. Se tiene una expectativa mínima de interferencia con el crecimiento facial.12
Injertos óseos secundarios tardíos: Los requerimientos de un injerto óseo en un paciente esqueletalmente maduro son mucho menores que los de un paciente joven. La necesidad de tejido óseo para permitir la erupción dentaria queda obviada. En este tipo de injertos no se presenta modificación alguna en el crecimiento facial.12
Anteriormente se mencionó que la reconstrucción de las FNA es parte del manejo de las secuelas de LPF, un importante factor de éstas dependerá directamente del desarrollo de una hipoplasia, una hipofunción o la combinación de ambas tanto de los tejidos duros como blandos de las regiones anatómicas involucradas con las fisuras en cuestión; por tanto el principal objeto de la reconstrucción quirúrgica de estas deformidades o secuelas debe estar enfocado al reestablecimiento de una adecuada fisiología que permitirá un subsiguiente y óptimo crecimiento facial.8
Por lo anterior los injertos óseos nasoalveolares deben cumplir idealmente las siguientes propiedades y características:
1) Permitir el cierre de la fístula anterior nasoalveolar.
2) Proveer suficiente tejido óseo a la zona de la fisura no sólo para que permita una adecuada erupción del canino permanente, sino también para dar estabilidad maxilar (premaxila) y proporcionar adecuado soporte radicular a los órganos dentarios involucrados en la fisura.
3) Proveer una adecuada arquitectura ósea (continuidad) a la región de la premaxila, permitiendo a su vez un soporte labial óptimo.
4) Establecer una vía aérea funcional en la cavidad nasal involucrada con la fisura labiopalatina.
5) Proveer un adecuado volumen óseo que permita una rehabilitación dentaria lo más óptima posible.1,12
Dentro de los puntos que regularmente crean controversia en lo respectivo a injertos óseos nasoalveolares, podemos mencionar: a) tiempo quirúrgico para la reconstrucción de la FNA, b) tipo de hueso a utilizar en el injerto y el sitio donador y c) aspectos ortodóntico/ortopédicos que involucran al sitio de la fisura como la expansión maxilar para la corrección de la discrepancia anteroposterior.14
Debido al enfoque del presente documento, haremos hincapié en el punto que respecta a los tipos y sitios de hueso donador.
Como se mencionó con anterioridad, existen muy diversos materiales para la reconstrucción de los defectos óseos de la economía humana, entre los que destacan dos grandes grupos: Los injertos o trasplantes de hueso, los cuales se subdividen según su origen en injertos autólogos (aquellos que se obtienen del mismo individuo a injertar), injertos homólogos (aquellos que se obtienen de diferente individuo pero que pertenecen a la misma especie) y los heterólogos proceden de individuos de diferente especie al receptor). Estos materiales biológicos son sometidos a diversos procesos como la congelación, la desmineralización o la liofilización, que permiten, entre otras propiedades, modificar la capacidad antigénica del injerto. El segundo grupo implica los materiales aloplásticos, que son todos aquéllos de origen sintético o semisintético que permiten realizar una reconstrucción ósea, como la hidroxiapatita o el mismo hueso sintético.
Las investigaciones y la misma experiencia de diversos autores han demostrado que los injertos de hueso autólogo cubren la mayoría de las expectativas de los injertos para reconstrucción ósea. Esta superioridad está dada principalmente a la capacidad del injerto de integrarse al lecho receptor mediante los procesos biológicos de osteogénesis, osteoconducción y osteoinducción.12
Dentro de los injertos óseos de tipo autólogo podemos encontrar tres variantes del mismo: a) hueso corticocanceloso no vascularizado en bloque, en donde el trasplante consiste en mayor cantidad de matriz mineral ósea que componentes celulares de hueso, b) hueso corticocanceloso vascularizado el cual depende de una anastomosis de tejidos vasculares para su aplicación, con la desventaja del tamaño y forma anatómica del sitio donador como la fíbula o la costilla y c) hueso particulado de cortical o médula ósea el cual proporciona adecuada densidad celular al injerto, componentes minerales así como la proteína morfogenética ósea necesaria para la osteoinducción del injerto.
Los principales sitios de donación autóloga para reconstrucción ósea de la región maxilofacial, que por sus características histológicas y de osificación así como el sitio del abordaje y la cantidad de hueso a obtener, podemos mencionar los siguientes:
1) Borde superior y cara lateral, anterior y posterior de cresta iliaca
2) Eminencia parietal craneal
3) Cara medio lateral de tibia
4) Costilla (corticocanceloso o costocondral)
5) Región mentoniana
En lo que respecta a la cresta iliaca, se ha utilizado de forma rutinaria para la reconstrucción ósea de la región maxilofacial ya que presenta ventajas como la capacidad de obtención de los tres tipos de hueso (cortical, canceloso y corticocanceloso), así como la cantidad de material a obtener, en donde la región posterior está indicada para volúmenes de gran consideración. Las dos principales desventajas del uso de este sitio donador se fundamentan en que ésta es un centro de crecimiento que pudiera verse afectado con la donación y la morbilidad asociada al abordaje y toma de injerto. En el primer caso la toma del injerto en paciente en etapa de crecimiento y desarrollo, la técnica quirúrgica es modificada de forma que se respete el cartílago de crecimiento ubicado en la porción más superior y anterior de la cresta iliaca. En el segundo caso la principal morbilidad está asociada a la lesión del músculo iliaco o glúteo mayor, lo cual origina dolor al caminar en el paciente. Sin embargo, una meticulosa disección de los tejidos y una mesurada técnica de sutura permitirán una adecuada reposición de éstos, reduciéndose el riesgo de dichas complicaciones.2
Por las características antes expuestas, los injertos óseos nasoalveolares de tipo autólogo obtenidos de la cresta iliaca, son de las mejores alternativas de reconstruir los defectos óseos de las FNA en pacientes con SLPF.
Finalmente y en lo que respecta a la gradación o determinación de la cantidad de hueso presente en la FNA injertada o grado de integración ósea, la evaluación de los INA estará basada en la clasificación indicada por Bergland O. y Sembs en 1986,3 así como de la modificación y replanteamiento desarrollado por Brusati y Garattini publicada en el 2000;5 en donde su clasificación está determinada por la apreciación radiográfica de proyección oclusal del INA y su perspectiva del volumen óseo basado en la radioopacidad observable en el espacio de la FNA, así mismo su relación con las fosas nasales y el reborde alveolar. Lo anterior permitió a los autores clasificar de la siguiente forma:
Tipo 1: Injerto óseo con completa osificación y reconstrucción de la fisura, desde el piso de fosas nasales hasta la totalidad del reborde alveolar (100%).
Tipo 2: La osificación se observa desde el piso nasal, a una altura de tres cuartas partes del reborde alveolar (75%).
Tipo 3: La osificación del injerto abarca desde el piso nasal una altura menor a dos tercios de la altura del reborde alveolar (50%).
Tipo 4: La osificación está limitada a un escaso puente óseo equivalente a un tercio del volumen óseo requerido (25% o menos).3,5
Dentro de los puntos importantes en el tratamiento quirúrgico de los pacientes con LPF es el manejo de las posibles complicaciones o secuelas postquirúrgicas, si enfatizamos este rubro dirigido a los INA, las complicaciones de mayor incidencia son la dehiscencia de tejidos blandos y la consecuente exposición del tejido óseo a cavidad bucal y el desarrollo de un proceso infeccioso rinosinusítico que comprometa el fenómeno de integración ósea. En el primer caso es más frecuente en aquellas FNA amplias (mayores a 10 mm) en donde los colgajos de mucosa bucal pueden ser insuficientes para el cierre y recubrimiento del INA, por otra parte factores como alimentación, higiene, entre otros, son elementos que pueden influir tanto en el desarrollo de una dehiscencia de tejidos blandos como en el de un proceso infeccioso localizado.
El desarrollo de dichas complicaciones modifica negativamente los objetivos a perseguir con el cierre de fístula nasoalveolar y la reconstrucción ósea de la FNA. En un inicio del presente documento se hizo mención de los objetivos que se persiguen con dicha reconstrucción, sin embargo debe aterrizarse el hecho de que en muy pocos casos se pueden cumplir al 100% de éstos. Dentro de los protocolos de cierre y reconstrucción de la FNA se consideran como mínimos necesarios para considerarse como exitoso un INA las siguientes características: 1) El cierre adecuado de la fístula nasoalveolar, 2) una suficiente integración de tejido óseo que permita la estabilización del maxilar (premaxila) y 3) la erupción del canino permanente y/o su posterior rehabilitación protésica.
Por lo anterior y para efectos de descripción metodológica, los términos de ''Grado suficiente'' deberán entenderse para aquellos INA, que dentro de la clasificación de Brusati y Garattini puedan ostentar los grados I, II o III (Figura 4). Aquellos denominados como ''Grado No Suficiente'' son aquellos determinados como grado IV (Figura 5) 5,15
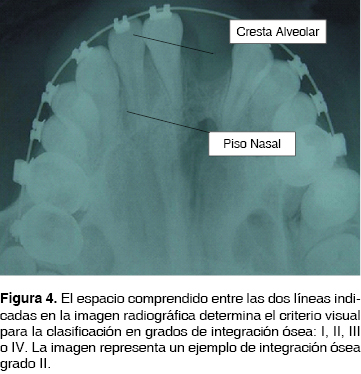

PLANTEAMIENTO DEL PROBLEMA
El Servicio de Cirugía Maxilofacial (CMF) del Hospital Infantil de México (HIM) ha venido realizando un promedio de 160 intervenciones quirúrgicas en los últimos 10 años concernientes a la reconstrucción y cierre de las FNA a partir de injertos óseos secundarios autólogos de cresta iliaca, esto como parte del protocolo de rehabilitación y tratamiento de los pacientes con SLPF y representando cuantitativamente más del 40% del total de procedimientos quirúrgicos llevados a cabo por el servicio. La necesidad de una documentación científica, estadística y de resultados que respalden esta conducta terapéutica, hace entonces necesario un estudio que sustente y proporcione elementos significativos que permitan corroborar, o en su defecto modificar, el protocolo de tratamiento en lo que respecta a la reconstrucción y cierre de la FNA. Por lo tanto, el presente estudio pretende aportar información estadísticamente significativa acerca del grado de integración ósea desarrollado en los pacientes sometidos a reconstrucción y cierre de las FNA y los factores que puedan modificarlos.
La problemática indicada, puede expresarse de la siguiente forma:
a) ¿Cuántos pacientes han desarrollado integración ósea a partir de INA secundarios de cresta iliaca, intervenidos por el Servicio de CMF del HIM de 1991 a 2001? ¿Y cuáles son los grados de integración ósea desarrollada en aquellos individuos que la presentaron?
b) ¿Qué factores como la edad (dentro del rango de injerto secundario), el sitio (lado) de la fisura y el sexo pueden estar asociados con el grado de integración ósea del INA?
OBJETIVOS
A) Objetivo general:
Conocer el grado de integración ósea en pacientes con SLPF, que hayan sido sometidos a INA secundarios de cresta iliaca, por el Servicio de CMF del HIM, en el periodo de 1991 al 2001.
B) Objetivos específicos:
1) Determinar la frecuencia de los injertos óseos nasoalveolares secundarios de cresta iliaca, practicados a pacientes del Servicio de CMF del HIM entre 1991 y 2001 y el número de éstos que desarrollaron algún grado de integración ósea.
2) Conocer si existe alguna relación entre los factores como: Edad, sexo y sitio de la fisura (lado) con respecto al grado de integración ósea.
HIPÓTESIS
1) El 80% de las reconstrucciones de FNA con injerto secundario de cresta iliaca realizadas por el Servicio de CMF en el HIM, desarrollaron algún grado de integración ósea.
2) El 70% de los pacientes que desarrollaron algún grado de integración ósea, están en el rango de injertos funcionales correspondiente a los grados I, II y III.
DISEÑO DE LA INVESTIGACIÓN
a) Tipo de investigación: El presente estudio se determina como documental , debido a que se basará en los registros escritos y radiográficos de los expedientes clínicos de los pacientes con SLPH intervenidos quirúrgicamente para reconstrucción de FNA por el Servicio de CMF del HIM. Retrospectivo porque se investigan procedimientos quirúrgicos ya realizados. Longitudinal porque se estudiarán aquellos pacientes intervenidos en el periodo de 1991 al 2001.
b) Consideración de variables: Las variables a aplicar en este estudio serán de tipo cuantitativo y cualitativo:
1) La variable independiente será el grado de integración ósea desarrollado en los pacientes injertados.
2) Las variables dependientes serán las siguientes:
i. Lado de la hendidura (izquierda o derecha)
ii. Edad de los pacientes intervenidos
iii. Sexo de los pacientes intervenidos
iv. Desarrollo de complicaciones.
1. Refistulización de la FNA postoperatoria
2. Desarrollo de proceso infeccioso rinosinusítico
c) Material: Expedientes clínicos del HIM y estudios de gabinete (radiografías oclusales) de los pacientes con SLPH unilateral, intervenidos por el Servicio de CMF del HIM.
d) Método: Se realizó una selección inicial de todos los expedientes de aquellos pacientes intervenidos de reconstrucción y cierre de FNA de 1991 al 2001, obteniéndose un total de 176 expedientes. Posteriormente una segunda selección en donde se consideraron sólo aquéllos con diagnóstico de SLPH unilateral, con reconstrucciones cuyo material fuese únicamente hueso autólogo obtenido de la cresta iliaca y cuyas edades correspondan a un injerto secundario. Finalmente, todos aquellos que carecieran de un expediente radiográfico suficiente que permitiera su evaluación o sin las características antes mencionadas se consideraron fuera del estudio, dejando así un universo muestra de 104 expedientes.
Se dio inicio a la valoración de los expedientes clínicos, determinando edad a la que fue injertado el paciente y subagrupando aquellos que se encuentran en la parte baja del rango de edad (7 a 10 años) y los de parte alta (11 a 14 años), así también el sexo, el lado de la FNA y la evolución postoperatoria en los primeros seis meses de la reconstrucción nasoalveolar. Los resultados fueron vaciados en una tabla resumen. Las características radiográficas del injerto permitirán clasificarlos inicialmente como:
1) Integrados
2) No Integrados
La primera clasificación se basa en la valoración radiográfica que manifieste la presencia o ausencia de tejido óseo integrado calcificado (radioopacidad) en la zona de la FNA, independientemente de la cantidad, densidad o en relación con otros sitios anatómicos. La segunda clasificación será considerada cuando la imagen radiográfica no muestre ningún indicio de material óseo calcificado (radiolucidez) presente en la FNA.
Una vez seleccionadas aquéllas con presencia de integración ósea, se debe discernir en el grado o cantidad de hueso presente en la FNA; esto se determinará con una segunda valoración radiográfica, determinando la cantidad de hueso presente con el área total de la FNA y se evaluará con respecto al criterio mencionado por Brusati y Garattini.
Esta valoración se llevó a cabo por tres miembros del Servicio de CMF del HIM dando valoraciones promedio entre ellos.
Finalmente los resultados son analizados aplicando las pruebas estadísticas de Chi cuadrada para evaluar las hipótesis con respecto a las variables, prueba exacta de Fisher para determinar la dependencia entre las variables analizadas en cada caso y prueba de Phi que determina si los casos son suficientes para el análisis. Estas tres pruebas se aplicaron mediante el software STATS v.2.
e) Criterios de inclusión:
1) Pacientes que hayan sido injertados en la edad correspondiente a injertos secundarios, con hueso autólogo de cresta iliaca, por el Servicio de CMF del HIM, entre 1991 y el 2001.
2) Pacientes con SLPH unilaterales.
3) Pacientes con expediente clínico y radiográfico completo.
b) Criterios de exclusión:
1) Pacientes con SLPH bilaterales.
2) Pacientes no intervenidos por el Servicio de CMF del HIM.
3) Pacientes cuyos INA sean considerados como primarios o secundarios tardíos.
4) Pacientes cuyos injertos no sean de tipo autólogo obtenidos de la cresta iliaca.
5) Pacientes sin un expediente radiográfico suficiente.
RESULTADOS
Se evaluaron 104 expedientes clínicos y radiográficos correspondientes al periodo de 1991 a 2001. El 44.26% (46) correspondieron a pacientes femeninos y el 55.76% (58) a pacientes masculinos. El promedio de edad fue de 11.52 años con una máxima de 15 una mínima de 8 años.
En lo que respecta a la localización anatómica de las fisuras, el 59.61% (62) fueron izquierdos y el restante 40.38% (42) derechos.
El total de injertos que presentaron un grado suficiente o funcional de integración ósea (grados I, II y III) corresponden al 98.07% (102) y el restante 1.98%(2) a aquellos injertos que no desarrollaron un grado suficiente de integración ósea (grado IV). Estos dos casos en donde el injerto se considera no suficiente, fueron consecuencia de la patología rinosinusal (rinosinusitis).
La correlación cuantitativa de la variable independiente con las dependientes arrojó los siguientes datos:
1) Total de injertos con integración grado I: 53.84% (56).
a) Sexo:
a. Mujeres: 57.14% (32)
b. Hombres: 42.85% (24)
b) Lado:
a. Izquierdos: 57.14% (32)
b. Derechos: 42.85% (24)
c) Promedio edad: 9.3 años (máx.: 15, min.: 8)
d) Complicaciones: Ninguna
2) Total de injertos con integración grado II: 30.76% (32)
a) Sexo:
a. Mujeres: 43.75% (14)
b. Hombres: 56.25% (18)
b) Lado:
a. Izquierdos: 68.75% (22)
b. Derechos: 31.25% (10)
c) Promedio edad: 10.8 años (máx.: 14, min.: 8)
d) Complicaciones: 7 (21.8%)
3) Total de injertos con integración grado III: 13.46% (14)
a) Sexo:
a. Mujeres: 42.85% (6)
b. Hombres: 57.14% (8)
b) Lado:
a. Izquierdos: 14.2% (4)
b. Derechos: 71.42% (10)
c) Promedio edad: 12 años (máx.: 14, min.: 11)
d) Complicaciones: 8 (57.14%)
4) Total de injertos con integración grado IV: 1.9% (2)
a) Sexo:
a. Mujeres 0%
b. Hombres 100% (2)
b) Lado:
a. Izquierdos 100% (2)
b. Derechos 0%
c) Promedio edad: 9 años (10 y 8)
d) Complicaciones 2 (100%)


DISCUSIÓN
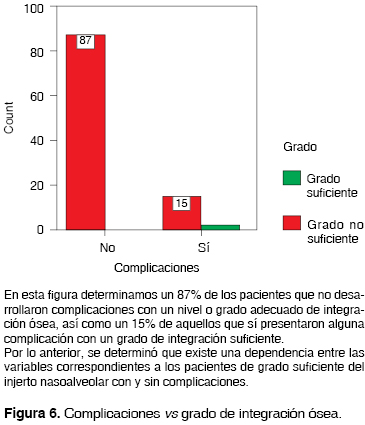
En la población estudiada, el 83.3% (87) no presentó complicaciones postoperatorias locales, desarrollándose en todos ellos un grado de integración ósea determinado como suficiente. De la misma forma, el 14.9% (15) de la población que sí presentó algún tipo de complicación, logró un grado satisfactorio de integración ósea. El restante 1.9% de la población que sí presentó complicaciones no logró un grado suficiente de integración ósea. Comparativamente con el estudio mostrado en el 2000 por Brusati y Garattini, se menciona el grado de integración ósea desarrollado en una población de 70 individuos, en donde el 100% presentó un grado de integración suficiente (58 de grado I y 12 grado II).
En aquellos individuos de la población con FNA izquierda, el 100% presentó un grado de integración suficiente y aquéllos con FNA derecha fue sólo el 95.5 % quienes lo desarrollaron.
En lo que respecta al presente estudio, el desarrollo de complicaciones en los INA se clasificaron en dos grupos: aquellos que a pesar de la complicación desarrollaron un grado suficiente o satisfactorio de integración ósea y los que no lo desarrollaron. Su diferencia fue estadísticamente significativa.
Los individuos en estudio en lo correlativo a la edad fueron divididos también en dos grupos. El primero correspondió a aquéllos entre los 7 y los 10 años y el segundo entre los 11 y los 14 años de edad. En el primero (37.3% de la muestra) se determinó que el 95% presenta un grado suficiente de integración ósea, el 5% restante no lo desarrolló. En el segundo grupo (62.7% de la muestra) el 100% presentaron un grado de integración suficiente.
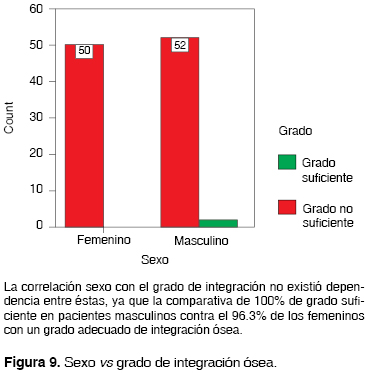
El género de la población estudiada fue determinante al arrojar un 100% de los pacientes femeninos (48.1% de la muestra) con un grado de integración suficiente, de los pacientes masculinos el 96.3% desarrolló y el 3.7% no desarrolló un nivel satisfactorio de integración (Figura 10).
La aplicación de la técnica descrita por el Dr. Phillipe J. Boyne en 1972, para la reconstrucción de la FNA como SLPF, mostró ser eficaz en pacientes con LPF unilateral ya que permite obtener grados de integración ósea señalados como suficientes para los objetivos a cumplir por el INA. Por otra parte el uso de hueso de la cresta iliaca como material para la reconstrucción mostró ser igualmente exitoso. Se demuestra que hay un grado de dependencia significativa entre los pacientes con un grado suficiente de integración ósea y el desarrollo de complicaciones, específicamente de tipo infeccioso.
Así mismo, queda sobre la mesa la idea de estudios comparativos entre las diversas técnicas para cierre de FNA con la aquí mostrada, del mismo modo estudios comparativos con los diferentes materiales de reconstrucción.
REFERENCIAS
1. Johnson DC. Cleft lip and palate. In: Behrman RE, Kliegman RM, Arvin AM, and editors. Textbook of pediatrics. 15th edition. Madrid (ES) McGraw-Hill. 1997; I: 1312. [ Links ]
2. Bloomquist DS, Turvey TA. Bone grafting in dentofacial deformities. In: Bell WH. Modern practice in orthognatic and reconstructive surgery . 2nd ed. Philadelphia: W.B. Saunders; 1992: 834-35, 839-841. [ Links ]
3. Bergland O, Semb G, Abyholm FE. Elimination of the residual alveolar cleft by secondary bone grafting and subsequent orthodontic treatment. Cleft Palate Craniofacial J 1986; 23: 175. [ Links ]
4. Kernahan DA, Rosenstein SW. Cleft lip and palate . Baltimore, Maryland Williams & Wilkins; 1990: 13-18, 115-118. [ Links ]
5. Brusati R, Garattini G. The early secondary gingivoperiostoplasty. Oral and Maxillofacial Surgery Clinics of North America 2000; 3: 443-453. [ Links ]
6. Cohen MM. Etiology and pathogenesis of orofacial clefting. Oral and Maxillofacial Surgery Clinics of North America 2000; 3: 361-376. [ Links ]
7. Bauer BS, Vicari FA. Cleft palate. In: Georgiade GS. Gregory NG, Riefkhol R, Barwick WJ. Textbook of plastic, maxillofacial and reconstructive surgery . 2nd ed. New York: Wiliams & Wilkins 1992: 299-306. [ Links ]
8. Boyne JP. The evolution of guided tissue regeneration, in: alveolar ridge reconstruction/guided tissue regeneration and bone grafting. Oral and Maxillofacial Surgery Clinics of North America 2001; 13: 3. [ Links ]
9. Marx RE. Philosophy and particulars of autogenous bone grafting. Oral and Maxillofacial Surgery Clinics of North America 1993; 4: 599-612. [ Links ]
10. Optiz, Meier, Stoll. Subklew radiographic evaluation of the transplant bone height in patients with clefts of the lip, alveolus palate, after secondary bone grafting. Journal of Orofacial Orthopedics 1999; 60 (6): 383-91. [ Links ]
11. Bardach J, Kenneth ES. Técnicas quirúrgicas en labio y paladar hendidos . Medilibros 1989, Madrid, España. [ Links ]
12. Turvey TA, Fonseca RJ. Facial clefts and craniosinostosis, principles of management . Edit. W.B. Saunders 1996. [ Links ]
13. Amin K, Jefrey WS, Raymod JF. Secondary grafting in the alveolar cleft patient. Oral And Maxillofacial Surgery Clinics of North America 2002; 4: 477-489. [ Links ]
14. Regezi JA, Sciubba JJ. Oral pathology, clinical pathologic correlations . 3a ed. México, D.F: McGraw-Hill; 2000. [ Links ]
15. Vig WL, Turvey TA, Fonseca RJ. Orthodontic and surgical considerations in bone grafting in the cleft maxilla and palate. In: Surgical management of craniofacial deformities . New York: WB Saunders 1998; 2. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Alejandro Montaño López
E-mail: amontano.lopez@universomedico.com.mx
Nota
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam











 texto en
texto en 


