Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista odontológica mexicana
versão impressa ISSN 1870-199X
Rev. Odont. Mex vol.15 no.4 Ciudad de México Out./Dez. 2011
Trabajo original
Influencia del hidróxido de calcio como medicación intraconducto en la microfiltración apical
Jeannette Sánchez Ortega,* Jorge Guerrero,§ Haroldo Elorza,II Raúl Luis García Aranda¶
* Egresada de la especialidad de Endodoncia, FO UNAM.
§ Profesor de postgrado. Laboratorio de Materiales dentales. FO UNAM.
II Profesor de postgrado. Estadística. FO UNAM.
¶ Profesor de postgrado de la especialidad de Endodoncia. FO UNAM.
Fecha de recepción: 24 de marzo de 2010.
Fecha de aceptación: 7 de abril de 2010.
RESUMEN
El objetivo de este estudio fue determinar la cantidad de Ca(OH)2 remanente en el conducto radicular después de aplicar 3 técnicas para su eliminación, así como determinar su relación con la microfiltración apical. Se aplicó Ca(OH)2 en 80 conductos preparados y se almacenaron a 37 °C y 100% de humedad por 7 días. Fueron divididos en 3 grupos según la técnica de remoción: NaClO 2.5% + EDTA 18% (G1); NaClO2.5% + EDTA18% y energización ultrasónica (G2); NaClO y energización ultrasónica (G3). Cuarenta especímenes fueron divididos longitudinalmente para la medición de Ca(OH)2 remanente. Los 40 especímenes restantes fueron obturados con compactación lateral modificada por ultrasonido y se realizó la prueba de microfiltración y posterior diafanización para su evaluación. El análisis estadístico mostró diferencia significativa (P < 0.03) entre los grupos en cuanto a remoción de Ca(OH)2, el grupo 2 fue el que mostró menos Ca(OH)2 remanente. En cuanto a microfiltración apical hubo diferencia estadísticamente significativa entre los grupos (P < 0.01), el grupo 2 fue el que presentó menor microfiltración apical. No hubo diferencia significativa entre los grupos 1 y 3. Conclusión: La irrigación con NaClO 2.5%, EDTA 18% y energización ultrasónica fue la más efectiva en remover Ca(OH)2 del conducto. La microfiltración apical es mayor en los conductos que presentan mayor porcentaje de Ca(OH)2.
Palabras clave: Microfiltración apical, hidróxido de calcio, medicación intraconducto, irrigación ultrasónica, hipoclorito de sodio, EDTA.
INTRODUCCIÓN
En la terapia endodóncica actual, el hidróxido de calcio (Ca(OH)2) es el medicamento intraconducto más utilizado. Su uso como agente antibacteriano y estimulador de tejido duro justifica su colocación intraconducto.1
Se ha reportado que, después del uso de algunos medicamentos intraconducto, es posible observar sus remanentes en 45% de las paredes del conducto, aún después de los intentos por eliminarlo.2,3
Previo a la obturación, la medicación intraconducto debe removerse con el objetivo de preparar la superficie dentinaria y propiciar condiciones físicas y químicas óptimas para lograr un sellado tridimensional, capaz de evitar la filtración de bacterias y sus toxinas.3
La remoción del Ca(OH)2 de las paredes del conducto pueden conllevar a un mayor reto en la actualidad ya que se han desarrollado métodos más eficientes en cuanto a su colocación para que la mezcla esté en contacto con las paredes de dentina en toda su longitud. Entre ellos encontramos la aplicación de Ca(OH)2 con léntulo, compactadores McSpadden, colocación con lima y puntas de papel y colocación con jeringa.4 Existen en la literatura numerosos estudios (Sigurdsson et al 1992, Cruz & Holland 2001) que atribuyen al uso de léntulo una mejor distribución del Ca(OH)2 dentro del conducto.5,6
El método más descrito para la remoción de Ca(OH)2 es la instrumentación con la última lima en combinación con irrigación copiosa de hipoclorito de sodio (NaClO) y EDTA.3 Sin embargo, se ha reportado que la irrigación e instrumentación por sí solas no limpian por completo los conductos.7 Algunos protocolos de irrigación han agregado el componente de irrigación ultrasónica pasiva (PUI) con el objetivo de retirar detritos de dentina. La irrigación ultrasónica está basada en la transmisión de energía desde un instrumento oscilante a la solución irrigante.8 Se ha evaluado su efecto al ser utilizado con el fin de aumentar la remoción de Ca(OH)2 por Kenee et al 2006, obteniendo mejores resultados en comparación con técnicas en donde no se aplicó ultrasonido.9
Los remanentes de Ca(OH)2 dentro de los conductos radiculares pueden dar como resultado una capa gruesa y no-homogénea de cemento sellador10 y también podrían propiciar una reacción química con el cemento sellador resultando en una reducción del tiempo de trabajo debido a la formación de eugenolato de calcio.11
Margelos & Eliades 1997, Calt & Serper 1999 y Kim & Kim 2002 demostraron que la presencia de hidróxido de calcio sobre las paredes del conducto puede afectar la penetración de los selladores en los túbulos dentinarios.10-12
Los objetivos de este estudio fueron determinar la cantidad de Ca(OH)2 después de aplicar varias técnicas de irrigación para su remoción y determinar la posible relación del Ca(OH)2 remanente con la microfiltración apical.
MATERIAL Y MÉTODOS
Ochenta premolares unirradiculares inferiores humanos fueron reunidos y decoronados con disco de diamante.
Se realizaron dos acanaladuras de 1 mm de profundidad con fresa de fisura en mesial y distal a lo largo de la raíz para la posterior división de 40 especímenes (aquéllos utilizados para prueba de remoción de Ca(OH)2).
Los 80 especímenes fueron preparados con sistema ProTaper universal (Dentsply Maillefer®) según las especificaciones del fabricante13 hasta la lima F4. Se determinó la longitud de trabajo a 1 mm de la salida del conducto.
Se realizó el protocolo de irrigación con NaClO al 2.5% y EDTA 18% (Ultradent®) por 3 minutos, se secaron los conductos con puntas de papel.
COLOCACIÓN DE HIDRÓXIDO DE CALCIO
Se realizó la mezcla de Ca(OH)2 con polvo y agua bidestilada hasta lograr una consistencia cremosa. Se depositó esta medicación a todos los especímenes con léntulo #35 (Dentsply Maillefer®). Se selló la cavidad de acceso con obturación temporal a base de sulfato de calcio Provisit®. Todos los dientes se almacenaron a una temperatura de 37 oC y 100% de humedad por un periodo de 7 días en atemperador (Felisa®).
La muestra se dividió aleatoriamente de la siguiente manera: 3 grupos experimentales de 24 dientes y 2 grupos controles de 4 dientes cada uno (control positivo y negativo). A cada uno se le aplicó una técnica de irrigación diferente para la remoción del hidróxido de calcio.
Grupo 1: 5 mL de NaClO 2.5%, EDTA 18% por 5 minutos, 5 mL de NaClO 2.5%.
Grupo 2: 5 mL de NaClO 2.5% y energización ultrasónica pasiva (PUI) a 1 mm de longitud de trabajo por 60 segundos (punta E5(NSK®), EDTA 18% por 5 minutos y 5 mL de NaClO 2.5% con PUI por 60 seg.
Grupo 3: 5 mL de NaClO 2.5% y energización ultrasónica pasiva por 60 segundos.
Control positivo: No se aplicó ninguna técnica de remoción.
Control negativo: No se colocó hidróxido de calcio.
A continuación se realizaron las siguientes pruebas:
PRUEBA 1: REMOCIÓN DE HIDRÓXIDO DE CALCIO
Se realizó esta prueba con la mitad de los especímenes experimentales (n = 36) y 2 grupos control (n = 4). Las raíces fueron divididas siguiendo la orientación de las hendiduras con un cortatubos manual, y se obtuvieron 2 fragmentos (vestibular y lingual). Se tomaron fotografías digitales del microscopio estereoscópido Lomo® a 20x y se midió el área ocupada por Ca(OH)2 remanente a través del programa AutoCad2009 (Autodesk®) en cada tercio.
PRUEBA 2: MICROFILTRACIÓN APICAL
Se realizó esta prueba con la otra mitad de los especímenes experimentales (n = 36) y 2 grupos control (n = 4). Nombramos a los grupos de la siguiente manera para que se distinguiera del experimento anterior: Grupo A, Grupo B, Grupo C; cada uno corresponde a la técnica de irrigación antes descrita de los grupos 1, 2 y 3, respectivamente. Después de la remoción de Ca(OH)2 de los conductos se secaron con puntas de papel y se obturaron con conos de gutapercha no estandarizados Hygenic® y cemento Roth 801 con técnica de compactación lateral modificada por ultrasonido (punta de obturación ultrasónica E5 NSK®).
Se selló el acceso coronal con ionómero de vidrio (Ketac Molar 3M ESPE®) y se realizó la prueba de microfiltración de la siguiente manera:
Los grupos A, B, C y control positivo, se cubrieron con cera parafina sobre su superficie radicular, excepto los 3 últimos milímetros alrededor del ápice.
Los especímenes en el grupo control negativo se cubrieron con cera parafina en su totalidad.
Todos los especímenes se colocaron en tinta china negra (Pelikan®) en una rejilla dentro de una campana de vacío a 10 libras de presión por pulgada cuadrada (psi). Fueron almacenados ahí por un periodo de 72 horas a 37oC. Posteriormente, las raíces fueron diafanizadas con la técnica de Robertson & Leeb14 y fueron observadas con microscopio estereoscópico Lomo® a 20x y se capturaron imágenes digitales para su medición con el software Transformer.
Se registró la superficie que obtuvo el mayor valor de microfiltración en milímetros lineales.
ANÁLISIS ESTADÍSTICO
Se aplicó el análisis de varianza paramétrico de Fisher y el no paramétrico de Kruskal-Wallis y la prueba Post-hoc de Tukey en los dos experimentos.
RESULTADOS
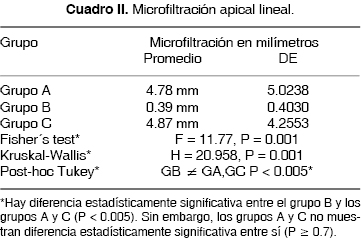
Los resultados promedio de remoción de Ca(OH)2 se muestran en el cuadro I y los de microfiltración apical se muestran en el cuadro II.
Existe diferencia estadísticamente significativa entre los 3 grupos en cuanto a la presencia de remanentes de Ca(OH)2 en cada tercio (P < 0.03). El grupo 2 presenta menor cantidad de Ca(OH)2 remanente de manera significativa en todos los tercios (P ≤ 0.05). En el tercio cervical de este grupo se observó un promedio de 5.87% de paredes con remanentes, en tercio medio 0.16% y en el tercio apical 2.03% (Figuras 1 y 2). No hubo diferencia estadísticamente significativa entre los grupos 1 y 3 en ninguno de los tercios (P ≥ 0.7).
El análisis estadístico de la prueba de microfiltración apical (Cuadro II, Figuras 3 y 4) muestra que hay diferencia estadísticamente significativa entre los grupos (P ≤ 0.05); el grupo B es el que presenta menor microfiltración promedio (0.39 mm) en comparación con los grupos A (4.78 mm) y grupo C (4.87 mm). Los grupos A y C a su vez no mostraron diferencia significativa entre sí (P ≥ 0.5).

Se puede observar en las figuras 3 y 5 que los especímenes de cada grupo se comportan de manera similar en los dos experimentos (remoción de Ca(OH)2 y microfiltración apical). A mayor cantidad de Ca(OH)2 remanente en las paredes del conducto se observa mayor microfiltración apical lineal.

DISCUSIÓN
La completa remoción de la pasta de Ca(OH)2 del sistema de conductos radiculares implica un reto y por ello existe la necesidad de determinar si el Ca(OH)2 remanente tiene un efecto benéfico o adverso sobre la obturación final. Estudios experimentales realizados en la década pasada reportaban que la microfiltración apical era menor en los grupos donde se había aplicado Ca(OH)2 en solución acuosa, en comparación con grupos en donde no se colocó medicación.15,16 Holland et al (1995) explicaban que esta reducción en la microfiltración se debía a que el Ca(OH)2 remanente era incorporado al cemento sellador durante la obturación, lo cual causaba una disminución en la permeabilidad del cemento o que el Ca(OH)2 era mecánicamente forzado dentro de los túbulos dentinarios, bloqueándolos y así logrando esta disminución de la permeabilidad.16 También se sugirió que este mejor sellado se debía a que se formaba un tapón de Ca(OH)2, lo cual se comportaba como una matriz contra la que se condensaría mejor el material de obturación.16
Sin embargo, en el presente estudio, se observan resultados contrarios, en donde los dientes con mayor remanente Ca(OH)2, mostraron mayor microfiltración. Esto puede deberse a que la presencia de Ca(OH)2 podría interferir en la adaptación de la obturación a las paredes dentinarias.
En los estudios mencionados anteriormente la tinción utilizada para la prueba de microfiltración fue azul de metileno. Se ha reportado que el Ca(OH)2 tiene un efecto decolorante sobre la tinción de azul de metileno.17 Wu y cols. estudiaron también este efecto en seis materiales de obturación utilizando azul de metileno al 1% y encontraron que el efecto decolorante alcanzó una media de 74%.7 Esto puede relacionarse con la alta alcalinidad que presenta el Ca(OH)2 y al tener este efecto modifica los resultados de microfiltración.
En este estudio utilizamos tinta china para la prueba de microfiltración. Las partículas de esta tinción tienen un tamaño mucho mayor al de las de azul de metileno, pero aún así son lo suficientemente pequeñas como para penetrar en la interfase de la obturación y las paredes dentinarias de manera comparable a las bacterias intraconducto.18
Investigaciones recientes muestran resultados comparables al presente estudio. Goldberg et al (2002)19 evaluaron la influencia que la medicación entre citas con Ca(OH)2 podría tener en la habilidad de obturar conductos laterales y accesorios. Los 20 dientes fueron instrumentados y luego se crearon conductos laterales simulados. A un grupo se le aplicó Ca(OH)2 por 7 días y al otro no se le aplicó ninguna medicación intraconducto. Se obturaron ambos grupos con Ultrafil®. El grupo al cual no se le aplicó hidróxido de calcio mostró mayor número de conductos laterales obturados de manera significativa.19
Con resultados similares, Kim en 200210 observa con estereomicroscopia que los dientes que no fueron medicados con Ca(OH)2 mostraban mejor sellado después de realizar pruebas de microfiltración con tinta china. El método de remoción de la medicación fue el limado con lima de mayor calibre a la última utilizada en la preparación e irrigación con hipoclorito de sodio al 2.5% y EDTA al 17%, la obturación fue realizada con técnica de condensación lateral convencional con gutapercha y cemento de óxido de zinc y eugenol.10
La asociación de NaClO y EDTA 17% por 3 minutos ha probado ser efectiva en la eliminación de barillo dentinario.20 Sin embargo, la importancia del EDTA en este estudio, no solamente radica en su capacidad de quelar iones calcio de las paredes dentinarias sino que ejerce el mismo efecto en la molécula de Ca(OH)2 facilitando el desprendimiento y desalojo del material por acción de la energización ultrasónica. También, el EDTA tiene la habilidad de neutralizar los residuos de Ca(OH)2 , lo cual podría prevenir una reacción química con el cemento sellador.20
En este estudio se observa que cuando el EDTA fue utilizado en conjunto con NaClO 2.5% e irrigación ultrasónica se incrementó el nivel de remoción de Ca (OH)2 en todos los tercios, encontrándose las paredes del conducto libres de remanente de Ca(OH)2 casi en su totalidad (2% en tercio apical). Estos resultados son comparables con los de un estudio reciente en donde la irrigación ultrasónica combinada con EDTA 17% permitió la remoción de Ca(OH)2 hasta en un 98%.21 Por el contrario, cuando no se utilizaron estos 3 elementos juntos en nuestro estudio, el nivel de remoción del material fue menor y dejó en algunos especímenes hasta 80% de paredes dentinarias cubiertas de Ca(OH)2.
Se ha demostrado que los métodos tradicionales (instrumentación manual e irrigación con NaClO y EDTA) no son eficientes para remover todo el material de las paredes de los conductos porque dejan hasta un 45% de superficie cubierta con remanentes.22 Salgado22 et al en 2009 obtuvieron resultados similares en un estudio realizado con microscopia electrónica de barrido, en donde el peor resultado se obtuvo al remover el Ca(OH)2 con irrigación de NaClO solamente. La mejor limpieza fue lograda en los grupos en donde se utilizó la recapitulación con la lima maestra e irrigación con NaClO al 0.5%, EDTA al 17% y Endo PTC®.23
El uso de ultrasonido en conjunto con el protocolo de irrigación final ha sido implementado desde hace algunos años con el objetivo de retirar detritos de dentina producto de la preparación mecánica de los conductos. Kenee9 et al (2006), evaluaron la cantidad de Ca(OH)2 remanente en los conductos luego de su remoción con varias técnicas, incluyendo combinaciones de NaClO con EDTA, instrumentación rotatoria o ultrasonido y encontraron que ninguna de las técnicas removía por completo el material. Sin embargo, la remoción con instrumentos rotatorios y la irrigación con ultrasonido, removieron significativamente más hidróxido de calcio en comparación con las otras técnicas.9
Un estudio realizado por Van der Sluis & Versluis (2007),8 mostró que el método de remoción de Ca(OH)2 más efectivo fue el realizado con irrigación ultrasónica e NaClO, el cual obtuvo un promedio de 63% de remoción; situación semejante a la presentada en el grupo experimental 3 en nuestro estudio, el cual utilizó esta misma irrigación y alcanzó resultados de 80% de remoción a nivel apical. Sin embargo, este porcentaje puede elevarse si le suma EDTA al protocolo de irrigación, como puede ser observado en los resultados del grupo 2 en nuestro estudio (Figura 1).
Durante el proceso experimental de microfiltración de este estudio se decidió colocar todos los especímenes bajo presión de 10 psi para simular las condiciones intraóseas, lo cual promovería la entrada de tinta china de manera activa hacia la interfase entre el material obturador y las paredes de dentina.
Los resultados obtenidos en este estudio demuestran que a mayor cantidad de Ca(OH)2 remanente en el conducto se observa mayor microfiltración apical (Figuras 3 y 5), lo cual sugiere que, a pesar de los efectos antibacterianos benéficos de esta medicación, si no es eliminado, su presencia puede influir en el sellado. Esto puede deberse al potencial del Ca(OH)2 de disociarse en presencia de agua en ión hidroxilo e iones de calcio.23
La microfiltración tan marcada en los grupos donde hubo mayor cantidad de remanente de Ca(OH)2 se puede deber a que estos remanentes (partículas de carbonato de calcio) pueden evitar la penetración del cemento sellador en los túbulos dentinarios y por consiguiente su capacidad de sellado, dando como resultado una reducción potencial de la adaptación de la obturación misma.12
Algunos estudios han observado fisuras en la capa del cemento de óxido de zinc y eugenol cuando se coloca en presencia de Ca(OH)2 remanente y se ha relacionado con la formación de eugenolato de calcio, lo cual aumenta la velocidad de endurecimiento del cemento sellador.10 A pesar de ello, en este estudio utilizamos cemento sellador a base de óxido de zinc y eugenol (Roth 801) ya que es el más utilizado en la práctica endodóncica.
Estudios futuros podrían estar encaminados a determinar si el sellado apical se ve afectado al utilizar un cemento sellador de otra naturaleza (resinosa o de Ca(OH)2) en presencia de medicación intraconducto remanente.
CONCLUSIÓN
La microfiltración apical es mayor en los conductos que presentan mayor porcentaje de hidróxido de calcio remanente.
La utilización de un protocolo de irrigación final que combine hipoclorito de sodio como solución irrigante, EDTA como quelante y energización ultrasónica es el método más eficaz para remover la pasta de Ca(OH)2 de las paredes del conducto. Esto influye favorablemente en el sellado apical ya que propicia condiciones adecuadas para lograr la adaptación de los materiales de obturación al sistema de conductos radiculares.
REFERENCIAS
1. Law A, Messer H. An evidence-based analysis of the antimicrobial effectiveness of intracanal medicaments. J Endod 2004; 30: 689-9. [ Links ]
2. Evans MD, Baumgartner JC, Khemaleelakul S, Xia T. Efficacy of calcium hydroxide: Clorhexidine paste as an intracanal medication in bovine dentin. J Endod 2003; 29, 338-9. [ Links ]
3. Lambrianidis T, Kosti E. Removal efficacy of various calcium hydroxide/cholorhexidine medicaments from the root canal. Int Endodon J 2006; 39:55-61. [ Links ]
4. Estrela C, Mamede-Neto I, Pécora JD. Root canal filling with calcium hydroxide using diferent techniques. Braz Dent J 2002; 13: 53-56. [ Links ]
5. Sigurdson A, Stancil R, Madison S. Intracanal placement of Ca(OH)2: A comparison of techniques. J Endod 1992; 18: 367-70. [ Links ]
6. Cruz GA, Holland R, Alfaro JF. Efecto de la colocación de pastas de hidróxido de calcio con diferentes vehículos, como medicación intraconducto, sobre el sellado apical de la obturación endodóncica. Braz Endod J 2001; 19: 284-92. [ Links ]
7. Wu M-K, Kontakiotis EG, Wesselink PR. Decoloration of 1% methylene blue solution in contact with dental filling materials. J Dentistry 1998; 26: 585-9. [ Links ]
8. LW M van der Sluis, Versluis M. Passive ultrasonic irrigation of the root canal: a review of the literature. Review. Int Endodon J 2007; 40 (6): 415-426. [ Links ]
9. Kenee DM, Allemang JD, Johnson JD, Hellstein J, Nichol BK. A quantitative assessment of efficacy of various calcium hydroxide removal techniques. J Endodon 2006; 32 (6): 563-5. [ Links ]
10. Kim S, Kim Y. Influence of calcium hydroxide intracanal medication on apical seal. Int Endodon J 2002; 35: 623-628. [ Links ]
11. Margelos J, Eliades G, Verdalis C, Palaghias G. Interaction of calcium hydroxide with zinc oxide eugenol type sealers: a potential clinical problema. J Endod 1997; 23: 43-8. [ Links ]
12. Calt S, Serper A. Dentinal tubule penetration of root canal sealers after root canal dressing with calcium hydroxide. J Endodon 1999; 25: 431-3. [ Links ]
13. Robertson D, Leeb I, McKee M, Brewer E. A clearing technique for the study of root canal systems. J Endod 1980; (6): 421-24. [ Links ]
14. Ruddle CJ. The ProTaper technique. Endodontic Topics 2005; 10(1): 187-90. [ Links ]
15. Porkaew P, Retief DH, Barfield RD, Lacefield WR, Soong S. Effects of calium hydroxide paste as an intracanal medicament on apical seal. J Endod 1990; (16): 369-374. [ Links ]
16. Holland R, Alexandre AC, Murata SS, Dos Santos CA, Dezan Jr. E. Apical leakeage following root canal dressing with calcium hydroxide. Endod Dent Traumatol 1995; 11: 261-263. [ Links ]
17. Kontakiotis EG, Wu M-K, Wesselink PR. Effect of calcium hydroxide dressing on seal of permanent root filling. Dental Traumatol 1997; 11: 261-4. [ Links ]
18. Yoshikawa M, Noguchi K, Toda T. Effect of particle sizes in India ink onits use in evaluation of apical seal. Journal of Osaka Dental University 1997; 31: 67-70. [ Links ]
19. Goldberg F, Artaza L. Inluence of calcium hydroxide dressing on the obturation of simulated lateral canals. J Endod 2002; 28 (2): 99-101. [ Links ]
20. Teixeira CS, Felippe MCS, Felippe WT. The effect of application time of EDTA and NaOCl on intracanal smear layer removal: an SEM analysis. Int Endodon J 2005; (38): 285-290. [ Links ]
21. Vehicle factor in calcium hydroxide removal. J Appl Oral Sci 2007; 52: 40-47. [ Links ]
22. Salgado R, Moura-Netto C. Comparison of different irrigants on calcium hydroxide medication removal: microscopic cleanliness evaluation. Oral Surg Oral Med Ora Pathol Oral Radiol Endodon 2009; 107 (4): 580-84. [ Links ]
23. Peters OA, Peters C. Limpieza y conformación del sistema de conductos radiculares. En: Cohen S, Hargreaves K. Vías de la Pulpa . Novena Edición. Elsevier España: 2008: 300-309,548. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Jeannette Sánchez Ortega
Filosofía y Letras 80,
Copilco Universidad.
Del. Coyoacán,
México D.F.
Teléfono: 5538473834
E-mail: janettsanchez@hotmail.com
Nota
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam











 texto em
texto em 


