La caries dental es una enfermedad multifactorial, por lo que no existe un método preventivo único que pueda constituirse como una panacea, por lo que no puede una sola modalidad preventiva por sí sola eliminar la enfermedad.1
Es el padecimiento de mayor prevalencia y costo en el mundo, ya que se calcula que es de un 70% en la población mundial. Sin embargo, esta prevalencia es mucho mayor en los países menos desarrollados y con mayor índice de pobreza. Aun cuando la manifestación de este padecimiento es la disolución de la estructura del diente, su naturaleza biológica es infecciosa.2
La importancia de la higiene bucal, con el uso de fluoruros en los dentífricos, en el agua potable y en otros vehículos como en la sal de mesa, disposición adoptada en nuestro país a principios de los años noventa, (NOM-040-SSA1) adicionada a medidas preventivas basadas en evidencia científica, han logrado disminuir significativamente los índices CPOD.
En México, este índice es de 1.91 a los 12 años, con una prevalencia del 58%, aunque cabe hacer notar que existen diferencias significativas en los diferentes estados; Yucatán reporta un CPOD de 0.77, mientras que en el Distrito Federal se reporta un promedio de 5.31, en escolares a los 15 años.3
Ancestralmente a la caries dental se le consideró, con la subsecuente pérdida de los dientes como algo inevitable. Tan es así, que Shakespeare al escribir sobre las edades del hombre, las refirió «...comenzando sin dientes y terminando sin ellos...».
Tradicionalmente el proceso carioso era tratado mediante la «excavación» del tejido desmineralizado, siguiendo los enunciados del Dr. VG. Black, que estipulaban entre otras cosas la «extensión por prevención» como si se tratase de un proceso maligno y con la posterior colocación de metales o restauraciones sintéticas.4
Sin embargo, un hallazgo muy importante que ha revolucionado estos conceptos clásicos, es el hecho de que lejos de ser el esmalte una estructura inerte e inactiva en la boca, su superficie está en un proceso constante, muy activo de desmineralización y remineralización (disolución y cicatrización). La caries en el esmalte y dentina es el resultado de una disgregación en el equilibrio entre la desmineralización y remineralización, con predominio de la desmineralización.5
El proceso carioso se inicia con la disolución de la estructura mineral del diente mediante la acción de ácidos orgánicos producidos por la presencia de los microorganismos de la biopelícula (placa dentobacteriana), alimentada principalmente por los carbohidratos en la dieta.
La acción ácida del metabolismo de las bacterias que colonizan la superficie, ataca especialmente los defectos de la estructura del esmalte, penetrando rápidamente a la unión amelodentinaria, propagándose en forma de triángulo invertido (Figura 1).
Cuando la desmineralización predomina, la lesión cariosa produce una cavidad, pero la remineralización continuamente estimulada puede detenerla, teniendo entonces lesiones activas versus inactivas. La remineralización convierte a estas últimas, en alteraciones que no requieren de tratamiento invasivo, ya que sólo necesitan de medidas que estimulen el proceso de remineralización, por lo que la meta terapéutica debería centrarse en prevenir las lesiones iniciales del esmalte que no requieren de excavación de la estructura dentaria, evitar la preparación de cavidades y la colocación de restauraciones (Figura 2).

Figura 2 Las flechas muestran caries de esmalte, que pueden cicatrizar y la estrella una lesión de caries que puede detenerse y tratarse con mínima intervención.
El gran avance en el estudio de este proceso ha logrado comprender mejor sus aspectos bioquímicos, microbiológicos, medioambientales y especialmente el papel que juega la saliva en este problema, lo que ha permitido diseñar medidas que disminuyen, detienen las lesiones y en la actualidad se pueden «cicatrizar» lesiones incipientes de caries en el esmalte.6
El concepto de la remineralización del esmalte y la dentina fue desarrollado en la década de los años 70, demostrándose que el tejido mineral del diente, si se encuentra en un ambiente en el que no hay ataque ácido y existiendo una sobresaturación de calcio en la saliva, las lesiones cariosas pueden cicatrizar.7
Se puede decir que la remineralización es la forma natural de reparación de las lesiones producidas por la caries dental. Aunque este hecho ya era conocido, es hasta las décadas recientes que se le ha dado la importancia tanto al proceso, como a su aplicación terapéutica.
Dada la alta prevalencia de caries que según la OMS es más del 70% en promedio mundial, existe una necesidad urgente de encontrar métodos más eficientes para impedir la desmineralización, inhibir la adherencia bacteriana y facilitar la remineralización.8
En la actualidad las medidas preventivas anticaries que agregadas al cepillado dental, consideradas como las más eficientes, son el uso de fluoruros y la estimulación del calcio en la saliva, a esto se agrega el xylitol y el Recaldent® en las gomas de mascar. Éstos son agentes preventivos científicamente comprobados que proporcionan mayor reducción en el índice de lesiones cariosas9),(10(Figura 3).
La remineralización activa está cambiando los conceptos clínicos proponiéndose la técnica de «mínima intervención» (o invasión). Aun cuando ésta no siempre sea aplicable, es una terapéutica que ha demostrado muchas posibilidades aceptándose actualmente como muy importante en el mantenimiento de la salud bucal, ya que es simple, económica y poco dolorosa. Un ejemplo es el tratamiento de restauración atraumático (TRA) implementado en México por la SSA desde 1990.11),(12
Para estudiar el binomio desmineralización-remineralización (D/R), se han utilizado métodos experimentales cuyos resultados son halagadores y aceptados, ya que la detención o inactivación del proceso carioso mediante la estimulación salival, puede durar desde periodos muy cortos hasta varias décadas, lográndose llegar hasta la «cicatrización» de la caries dental.13),(14
Una tecnología de la presente década, conocida como (Recaldent®), es la que utiliza una forma amorfa de fosfato de calcio, estabilizado con fosfopéptidos de una proteína derivada de la leche (caseína). Estos fosfopéptidos tienen una capacidad notable para estabilizar el fosfato de calcio en solución, como fosfato amorfo de calcio, formando así un complejo de fosfopéptidos-caseína y fosfato amorfo de calcio (CPP-ACP), que ha demostrado que remineraliza superficies de esmalte, in vitro e in vivo cuando es agregado a la goma de mascar sin azúcar. Como aditivo en ciertos alimentos y productos para la higiene bucal el CPP-ACP, tiene la capacidad de detener y/o cicatrizar la caries dental.15
El proceso bioquímico para el CCP-ACP consiste en la liberación de los iones fosfato y calcio en la superficie del diente, amortiguando el calcio y fosfato iónicos, ayudando a que exista una súper saturación de estos elementos en la superficie del esmalte, inhibiendo así la desmineralización, inactivación y estimulando entonces la remineralización (cicatrización) de la caries dental.16
Al adherirse la biopelícula a la superficie del diente, se desmineraliza la subsuperficie del esmalte, perdiéndose el calcio y el fosfato, dando por resultado una lesión inicial que puede ser reversible mediante un proceso de remineralización, involucrando una difusión de iones de calcio y fosfato hacia la subsuperficie, para reponer la estructura que se ha perdido.17
Considerando que varios estudios han demostrado que productos derivados de la leche tienen un efecto anticariogénico en modelos experimentales en animales, utilizando soluciones de péptidos de la caseína al reducir significativamente la desmineralización, estos péptidos se identificaron como el fosfato de calcio estabilizado (fosfopéptidos de la caseína). Un 0.5% en peso por volumen de CPP-ACP, demostró compararse con una solución de 500 ppm de solución de fluoruro, en la reducción de caries dental, observándose un sinergismo aditivo entre el CPP-ACP y el fluoruro.18-20),(19
El uso de goma de mascar sin azúcar con CPP-ACP, después de comer o ingerir refrigerios puede constituir un componente importante en un programa preventivo completo. La efectividad del CPP-ACP combinado con la capacidad de la goma de mascar sin azúcar para estimular el flujo salival, permite a los dos mecanismos: la remineralización y la estimulación salival, actuar simultáneamente en la boca, en los momentos de riesgo cariogénico. Se ha comprobado además que se efectúa una sinergia con el flúor formando una hidroxiapatita más estable. (21
Cabe señalar también que investigadores como Domenic Zero opinan que, actualmente la aplicación tópica de fluoruro continúa siendo la terapéutica anticaries «Standard» más efectiva, ya que la evidencia clínica no es todavía suficientemente amplia para implementar el uso de CCP-ACP como una estrategia alternativa para la remineralización. Los esfuerzos continúan a fin de lograr que el proceso carioso se detenga y se cuente con una hidroxiapatita más estable y menos soluble para lograr la detención del proceso carioso, la remineralización y la subsecuente reparación.22
Entre otras alternativas desarrolladas recientemente para terapias y cuidados bucales apareció en el mercado, el Novamin®, marca registrada de un fosfosilicato sódico de calcio diseñada originalmente en el tratamiento de la hipersensibilidad dentinaria, para lograr la obturación química de los túbulos dentinarios. Estudios recientes han demostrado el potencial de este material para prevenir la desmineralización y ayudar a la remineralización. El modo de acción de este material está basado en su actividad química, dado que en solución acuosa cuando entra en contacto con el medio ambiente bucal el material libera sodio, calcio y fosfato, interactuando entonces con los fluidos bucales, formando una capa de apatita hidroxicarbonatada que es estructural y químicamente similar al mineral natural del diente.23
Varios productos similares al Novamin® han sido aprobados por la FDA☆ como agentes desensibilizantes como son el Sootherx®, Oravive®, Nucare®, Renew®, Durashield® y Vitalmin®. La evidencia demostrada es un bloqueo rápido y completo de los túbulos dentinarios expuestos para ser aplicado también en los casos de erosión, ya que una precipitación de cristales en estas zonas es benéfica si se modifica también su causa. El calcio y fosfato adicionados son útiles en la remineralización si se cuenta con un sistema apropiado para proporcionarlo y precipitarlo, condicionado a una frecuencia adecuada, ya que un factor adverso como un exceso de calcio que bloquee la superficie del esmalte impedirá entonces la remineralización de la zona más profunda.24En lo que se refiere a la placa dentobacteriana, ahora reconocida como una biopelícula, hay también conocimientos innovadores. Mencionaremos que actualmente, ya no se estudian los microorganismos que la componen por separado, sino en su conjunto, entendiendo así mejor su formación, estructura y comportamiento (Figuras 4 y 5).
Después del advenimiento del microscopio electrónico, la biopelícula (BP) ha sido comprendida y estudiada en forma diferente. Lejos de considerarse un conglomerado de bacterias, hoy se sabe, tiene una organización «inteligente» donde existe comunicación entre los microorganismos que la componen y forman entre otras cosas canales para la circulación tanto de nutrientes como para sus desechos.25),(26
La formación de ésta se inicia cuando las bacterias se adhieren a una superficie en una solución acuosa, en casi cualquier material como tuberías, metal, plástico, piedras, implantes, prótesis y dientes. Esta biopelícula se compone de muchas especies de bacterias, hongos, algas, protozoarios, detritos y elementos de corrosión. Una vez adherida, los microorganismos causan diversas alteraciones, dependiendo del medio ambiente y la resistencia del huésped.
Dado que no es posible eliminar la biopelícula que se forma en los dientes, el reto es tener un control de ésta o tener una «buena» biopelícula.26
En esta idea cabe señalar que la primera observación de que el xylitol previene la caries inhibiendo la formación de la biopelícula se realizó en animales por Mühleman et al, en los años 60. Los primeros estudios clínicos los realizó Scheinin et al, en 1975, mostrando una reducción del 80% entre sujetos que masticaron goma conteniendo xylitol comparado con un grupo que recibió una con sucrosa.27),(28
La evidencia actual señala que el xylitol contenido en las gomas de mascar, al ser usado regularmente es un método preventivo, que tiene actividad microbicida contra el Estreptococo mutans (EsM), por lo que podría promoverse como una medida de salud pública, adicionado al fluoruro y a una higiene bucal adecuada. Aun cuando el xylitol no es todavía ampliamente accesible, parece ser la sinergia más efectiva en la prevención de caries, por sus efectos antimicrobianos.29
Como también otras enfermedades bucales tienen un origen bacteriano, es necesario comprender mejor la ecología oral y entender la naturaleza de la biopelícula de la placa bacteriana. Los investigadores deberán encaminarse hacia el desarrollo de agentes verdaderamente preventivos, usando un enfoque antimicrobiano, o prebiótico que no sólo sea efectivo en el laboratorio sino también en los pacientes.
Para que el xylitol sea efectivo algunos autores consideran una exposición de 4 a 10 veces al día, para controlar las bacterias que la conforman, la interacción entre ellas y su comunicación y para poder eliminar sobre todo a las patógenas dominantes.30),(31
En la actualidad los investigadores estudian cuáles son las posibilidades para disrupcionar la biopelícula, considerando que, una sola bacteria es capaz de adherirse a la superficie del esmalte y a través de la división celular más la expresión coordinada de sus productos genéticos, desarrollar una estructura compleja con una población de células adherentes (Figura 6).
El proceso antes descrito, se conoce como formación de la biopelícula, y requiere de señales intrínsecas y extrínsecas que son sensibles, contextualmente interpretadas y transducidas en un patrón genético con expresión proteica.
Utilizando análisis mutacionales y modelos experimentales, la complejidad de la maduración de la biopelícula y la persistencia de estreptococos patógenos, se tienen nuevas y originales posibilidades terapéuticas para su control, diseñándose y proporcionándose estrategias amplias y eficientes contra la caries dental.25
Considerando la compatibilidad de la biopelícula con los pocos patógenos que la forman (la mayoría de las bacterias no lo son), las estrategias principalmente van encaminadas a modular el pH y modificar los pasos de su formación, a fin de reducir la calcificación considerando que el flúor inhibe la adherencia en las biopelículas, reemplazando EsM por unos que genéticamente no produzcan ácido, así como modulando la producción de álcalis con ureasa y arginina con sustratos prebióticos.
Los microorganismos modificados genéticamente como el estreptococo mutans ureolítico recombinado previenen la glucolización in vitro y la caries dental en animales experimentales. El aumento del estrés ambiental es la clave para la patogenicidad, el incremento de microorganismos y la producción de ácidos. Si se eliminan ciertas enzimas de la estructura de la membrana del EsM para volverlo no patógeno, se aumenta el O2, y se modula el pH, se disminuye la biopelícula y las señales de comunicación entre las bacterias32(Figura 7).
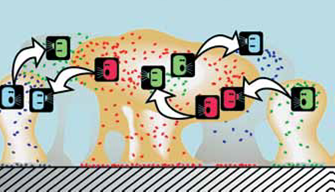
Figura 7 Diagrama propuesto de la organización y comunicación entre las bacterias de la biopelícula (cortesía de: The Center for Biofilm Engineering. 1997)
Estudios recientes están siendo encaminados para explorar las posibilidades y oportunidades biológicas para disrupcionar la biopelícula de la placa.
Otra estrategia dada a conocer recientemente por los investigadores, es el uso de péptidos antibacterianos, ya que la biopelícula es una comunidad mixta de especies de microorganismos. Estos péptidos muestran un amplio espectro de actividad microbicida, eliminando eficientemente cepas seleccionadas de patógenos bucales. Luego entonces, estos compuestos pueden potencialmente formularse para suministrar en la cavidad oral un ingrediente para eliminar la placa subgingival.33
Otro enfoque novedoso es determinar los efectos de un decapéptido (clorhidrato de cetilpiridina) KSL-W sobre biopelícula formada in vitro, por bacterias salivales humanas en una superficie similar al diente humano. El KSL-W, agregado a una goma de mascar fue probado para determinar las propiedades bactericidas, antibiopelícula. Los resultados demostraron que el KSL-W es estable en la saliva humana y despliega una actividad promisoria in vitro, de tal forma que un 90% del péptido se liberó en una forma sostenida durante 30 minutos. El KSL-W posee actividad bactericida en contra de cepas seleccionadas de estreptococos mutans. El péptido se absorbió fácilmente en las superficies de apatita. Un efecto significativo en la viabilidad de biopelículas maduras se observó in vitro cuando el KSL-W se utilizó en la presencia de sustancias activas. La conclusión indica que los péptidos antimicrobianos pueden ser un auxiliar útil adjunto a la higiene bucal convencional para prevenir enfermedades relacionadas a la biopelícula. En otras palabras, como ya se mencionó, intentar modificar la biopelícula nociva.34
En el campo de los compuestos antibiopelícula de origen natural, podemos anotar que existen enfoques originales de compuestos diferentes a los microbicidas, que afectan el desarrollo de la matriz de la biopelícula y su capacidad acidogénica, los cuales son también rutas promisorias para prevenir o reducir las enfermedades bucales relacionadas a la biopelícula. Recientemente se ha desarrollado una nueva estrategia para reducir la virulencia de la biopelícula al combinar un compuesto de origen natural con el flúor.
La idea es combinar terapias para aumentar la respuesta biológica a fin de disminuir la virulencia de las bacterias en lugar de eliminar la existencia de las mismas, lo cual da por resultado un debilitamiento en la cariogenicidad del estreptococo mutans en la biopelícula y una utilidad práctica como una alternativa en la quimioterapéutica anticariogénica. La meta principal que se busca, es inhibir los glucanos que son el factor adherente del EsM a través de su glucosiltransferasa, fungiendo como aditivos agregados a la clorohexidina y al flúor, el cual no es superado pero sí potencializado.35
A partir de estos avances de la ciencia surgen entonces las siguientes interrogantes:
¿Puede alterarse benéficamente la ecología de la biopelícula?
La flora bacteriana natural del niño alimentado con leche materna, ¿puede estar influenciada por la composición de los glucanos de la leche, el contenido de proteínas y bacterias incluidas durante el consumo diario?
Antes de la erupción de los dientes, los indicadores del riesgo de caries pueden evidenciarse en la boca y un medio ambiente propicio a la caries dental puede ser tipificado por la emergencia de una microbiota acidúrica y acidogénica.
La modificación benéfica de la biopelícula puede involucrar la remoción o sustitución de elementos conducentes a la caries dental, esto quiere decir carbohidratos de la dieta o el flujo salival estimulado, alternativamente, sin cambios en la dieta.
Se han efectuado intentos para desplazar a las bacterias asociadas con la caries dental, utilizando terapias enfocadas específicamente, versus terapias no específicas, como son los probióticos o biocidas, incluyendo a la clorohexidina o productos derivados de vegetales. Se ha estudiado, principalmente la relación entre los estreptococos mutans y sobrinus en humanos, observando que el conteo de cepas de EsM es realmente pequeño, y se considera no tan importante en cuanto a su capacidad para producción de ácido. Más importancia puede tener entonces, el sinergismo bacteriano y la producción de señales para la organización de la biopelícula. Dado que el pH de la caries en la raíz dental es de 6.2, mientras que en la caries del esmalte es de 5.2, lo que implica complicaciones y diferencias para la prevención.
Actualmente se recomienda NO «pulir» los dientes con pasta abrasiva después de una profilaxis, dado que una superficie pulida de esmalte facilita la adhesión de los EsM patógenos.36
En lo que se refiere al control de los ESM, el Dr. Svante Twetman, opina que no obstante las controversias actuales y que aun cuando existe clara evidencia de que el xylitol tiene una influencia benéfica en la ecología bucal, su posible uso como una medida de salud pública es discutible. La investigación actual sugiere una clara relación dosis-respuesta, ya que estudios clínicos recientes con consumos de menos de 5 g al día, de goma de mascar con xylitol, no han alcanzado las expectativas y un régimen de alta dosis puede tener un costo-beneficio inadecuado.37
Cabe mencionar también que se han realizado muy pocos estudios en grupos seleccionados de riesgo o en pacientes con caries activa, por lo que hasta no contar con mayores datos, el xylitol deberá considerarse como una medida anticaries para personas motivadas, considerándose entonces prioritario enfatizar en la necesidad de consolidar reportes estandarizados de investigaciones clínicas.38
Opinión contraria es la del Dr. Peter Milgrom, quien afirma que, el xylitol incorporado a la goma de mascar u otras confituras, es un agente preventivo seguro y eficiente si es utilizado habitualmente, pero su aplicación ha sido limitada por la ausencia de fórmulas que requieran de mínima adherencia y sean adaptables a situaciones donde la goma de mascar no es permitida.39
Algunos autores han señalado un mínimo de 5 a 6 gramos tres veces al día para la goma de mascar u otras confituras a fin de lograr un efecto terapéutico. Por otro lado, hay evidencia contraria proveniente de la pasta dental, sugiriendo que una menor dosis y a menor frecuencia es efectiva. El incremento en el uso del xylitol como edulcorante en alimentos y otros consumibles está aumentando la exposición total al xylitol y puede tener efectos benéficos adicionales, tales como la prevención de la otitis media, al disminuir la posibilidad de una sobredosis de antibióticos con la subsecuente resistencia y la pérdida o disminución de la capacidad auditiva.40 Para este importante padecimiento que es la causa principal de sordera en diversos grados en nuestro país, el xylitol podría ser un factor muy eficiente para su prevención, siendo aquí el factor costo-beneficio muy importante si se considera lo oneroso que resultan los aparatos para la sordera, que además requieren de mantenimiento frecuente.40
El efecto del xylitol en la prevención de la otitis media está probablemente basado en la reducción en el crecimiento de S. pneumoniae y H. influenzae.41
Parece ser que el objetivo del xylitol es inhibir el crecimiento y metabolismo de bacterias, especialmente el EsM. Existen más de 20 estudios a corto plazo en los cuales este compuesto produce una disminución en el número de colonias de EsM de la saliva y/o placa dentobacteriana; sin embargo, existen otros estudios que no han encontrado disminución en la saliva estimulada.
Por otro lado, el consumo durante periodos largos en mujeres embarazadas ha demostrado reducción en la transmisión de EsM a los recién nacidos, aun cuando no se demostró disminución en el conteo en la saliva estimulada de las madres.42
La explicación a este hecho en los consumidores habituales de xylitol parece ser que los EsM son fácilmente desalojados a la saliva, dicho de otra manera, el EsM salival aumenta, mientras que el EsM de la placa disminuye. Una interpretación a estos resultados, es que el xylitol disminuye la virulencia de los EsM y la placa dentobacteriana contiene menor cantidad de macromoléculas adhesivas comparado con la de los no consumidores.
Estudios clínicos realizados en México, en adultos sanos han demostrado una disminución en la cantidad de placa bacteriana y sangrado gingival, asociado al consumo regular de una goma de mascar con xylitol.43
Cualquier acción «anticaries» del xylitol parece ser debida a su actividad sobre la placa bacteriana y los organismos más que un efecto específico en la mineralización, aun cuando ésta se promueve al estimular saliva, y aún más, la prevención de la transmisión de EsM de madre a hijo ha sido comprobado que puede lograrse con este compuesto.44),(45
No existe sin embargo información en nuestro conocimiento que proporcione datos sobre los efectos del xylitol y su uso en la tercera edad, especialmente en caries de raíz.
Un factor de suma importancia es la caries secundaria o recurrente, que por definición es la que se desarrolla en los márgenes de una restauración, que es por mucho la complicación más frecuente observada en la clínica. La estadística señala que el 50% de todas las restauraciones colocadas, sean de amalgama o resina, presentarán caries recurrente y lo que es aún más grave es el hecho de que entre el 50 a 70% de las restauraciones que colocamos los dentistas son restauraciones de reemplazo de obturaciones previas.46
La caries secundaria diagnosticada en obturaciones de clase II y V, generalmente se localizan en los márgenes gingivales, esto es especialmente cierto en las restauraciones de amalgama de Clase II, donde el 94% de las lesiones se localizan gingivalmente. El diagnóstico es radiográfico o mediante el uso del explorador. No existe información sobre el curso progresivo de estas lesiones de caries secundaria, sin embargo si el comportamiento de estas lesiones es similar al de la caries primaria se esperaría un avance lento, no siendo necesaria la inmediata intervención con el reemplazo de la obturación, sobre todo porque no es posible saber si se trata de un defecto en la restauración o un borde en la superficie gingival, lo que justificaría una terapia remineralizante, (goma de mascar con xylitol y Recaldent®, p.ej.) y una supervisión periódica.47
De acuerdo con algunos autores, mientras que existe una clara diferenciación entre lesiones cariosas activas y detenidas en caries primarias, esta definición aún no existe para las lesiones de caries secundaria, los materiales de obturación que liberan flúor, parecen no tener efecto en las caries secundarias. La pregunta entonces que carece de respuesta es: ¿Las caries secundarias son realmente lesiones que necesitan tratamiento de reemplazo?48
La erosión dental es otro aspecto importante, que consiste en la disolución de la estructura dental sin bacterias. Ésta es multifactorial, principalmente química, con factores fisiológicos, hábitos y aspectos socio-culturales.
Existe evidencia en cuanto a que, la erosión cervical está aumentando consistentemente a nivel mundial, por lo que la erosión es un problema concurrente, si consideramos la salud de la dentición a largo plazo. El proceso erosivo desmineraliza la superficie y la región inmediatamente por debajo de la superficie, se pierde paulatinamente. Resulta entonces que un proceso reparativo natural y de mínima intervención debería ser posible. Varias estrategias se han utilizado para la prevención o reparación de la erosión tal como la aplicación tópica de flúor, o fórmulas a base de calcio y fosfato. El agregar calcio, fosfato, fierro, sulfato ferroso, hexametafosfato de sodio a los enjuagues, dentífricos, o pastas dentales son otras posibilidades. Añadir iones diversos a los agentes erosivos para convertirlos en supersaturados en relación al mineral del diente ha mostrado resultados promisorios.49
CONCLUSIONES
La caries dental es una enfermedad multifactorial, por lo que aún no existe un método preventivo único.
La aplicación tópica del fluoruro en varias formas y vehículos ha producido reducciones significativas en la prevalencia e incidencia del proceso carioso.
El uso de goma de mascar sin azúcar con CPP-ACP después de comer o ingerir refrigerios, puede constituir un componente complementario importante en un programa preventivo completo.
El xylitol inhibe el crecimiento y metabolismo de varias especies de bacterias, pero entre las bacterias bucales, especialmente el EsM parece ser el objetivo del xylitol.
Existen más de 20 estudios a corto plazo en el cual este compuesto induce cambios en la cuenta de colonias de EsM, en dosis y frecuencias adecuadas.
Durante los últimos años se ha incrementado un número de iniciativas, enfocadas a promover la remineralización y/o prevención de la caries dental, sin embargo, pocas tecnologías se llevan al mercado y al consumidor que tiene necesidades demandantes para la prevención de la caries dental y la disminución de la biopelícula, aun con estudios clínicos que han demostrado y establecido su efectividad; esto se debe a las regulaciones en materia de salud de los diferentes países.
Los estudios clínicos generalmente tienen su mayor reto durante el desarrollo y la consecuente introducción al mercado de consumo del producto comprobado como benéfico.
Otros retos son en cuanto al desarrollo de la formulación, comportamiento comparativo con tecnologías clínicamente acreditadas, análisis estadístico de los datos, reglamentación y requerimientos, así como hábitos y costumbres del paciente consumidor.
La saliva estimulada y el flúor son la mejor terapia natural con que contamos, debería considerarse a la goma de mascar, no como una golosina, sino como un agente terapéutico.
Finalmente existe un gran reto en la difusión de los hallazgos científicos y la información científica entre los educadores, el desafío es «educar al educador».











 nueva página del texto (beta)
nueva página del texto (beta)