Introducción
La neuralgia del trigémino es una entidad nosológica de difícil manejo, que puede llegar a considerarse refractaria a la terapéutica, la cual a su vez puede establecerse desde terapia psicológica, física, farmacológica, invasiva no quirúrgica e invasiva quirúrgica.1 Este comportamiento nos permite asegurar que el tratamiento óptimo no puede seguir una línea vertical para su manejo, ya que la etiología no está bien establecida y ocasionalmente se habla de un patrón multifactorial. A su vez, la participación del profesional encargado del manejo de la misma no corresponde a un área específica, podemos mencionar que entre esta gama de profesionales se encuentran los psicólogos, cirujano dentista, cirujano maxilofacial, otorrinolaringólogo, neurólogo, neurocirujano y por supuesto la participación de otros profesionales a las cuales se llega a obviar su trabajo, entre los que podemos mencionar a la trabajadora social y el médico familiar, personas de las que se pueden obtener datos fundamentales acerca del entorno del paciente afectado específicamente de las probables desarmonías emocionales, las cuales está comprobado que llegan a exacerbar o desencadenar el fenómeno doloroso, punto medular de la neuralgia.2
Es importante que todo profesional que participa en el manejo de esta entidad debe de reconocer las limitantes dentro de su área, de tal manera que en el momento y tiempo adecuado, pueda hacer partícipe a uno o más profesionales de áreas diferentes, para integrar un manejo multidisciplinario.2
La neuralgia del trigémino es descrita como una de las causas de dolor episódico y recurrente de dolor facial. Usualmente ocurre como resultado de una lesión desmielinizante del nervio trigémino en la zona de donde emerge. Aproximadamente 2% de los pacientes con neuralgia del trigémino cursan con esclerosis múltiple.3 En algunos casos la neuralgia del trigémino es secundaria a una enfermedad estructural, como los tumores, que causan neuralgia trigeminal sintomática, algunos pacientes tienen neuralgia del trigémino idiopática y usualmente tienen un examen neurológico normal.4 En éste no existen alteraciones estructurales, pero se ha sugerido una compresión vascular en la emergencia del nervio. La patogénesis de la neuralgia del trigémino es desconocida, así como los mecanismos por los cuales los tratamientos son efectivos.5
Historia: Fue descrita por primera vez en el siglo XVII por Fehr John Locke. En 1773, John Forthergill describió 16 pacientes con neuralgia trigeminal. En 1966, Jannetta y Rand propusieron que el origen de la neuralgia trigeminal era una compresión del nervio trigémino por pequeños vasos cerca del tallo cerebral.6
Incidencia: La neuralgia trigeminal tiene una prevalencia de 0.1-0.2 por mil y una incidencia que va de 4-5/100,000/año a 20/100,000/año después de los 60. La relación de mujer a hombre es aproximadamente 3:2. La revisión de una serie de casos muestra que el dolor es más predominante del lado derecho, pero la diferencia no es estadísticamente significativa. La neuralgia trigeminal está asociada significativamente con la hipertensión arterial.7
Cuadro clínico: Habitualmente es unilateral, se localiza en una de las ramas del trigémino. Cerca de la mitad de los casos (50%), el dolor se localiza en la zona del nervio maxilar, ala de la nariz y labio superior, alcanzando el párpado inferior.
En un cuarto de los casos (25%) se trata de una neuralgia en la región del nervio mandibular o en una de sus ramas, como el nervio mentoniano: barbilla y labio inferior, prolongándose habitualmente a la zona del nervio dentario inferior.8
Descripción del dolor. El dolor aparece en crisis espontáneas, caracterizadas por punzadas intensas que los pacientes comparan con una descarga eléctrica. Las crisis son cortas, de algunos segundos hasta un minuto, inmovilizando al paciente y acompañándose en el momento más fuerte del dolor de verdaderas gesticulaciones de la hemicara. Las crisis se repiten a intervalos variables, a veces muy próximos, de una a varias decenas por día.9
Las crisis pueden ser provocadas por el roce o la presión de algunas partes de la zona cutánea y mucosa de la hemicara: es la zona reflexógena que se sitúa a menudo en la región dolorosa: pliegue nasogeniano, labio superior y barbilla. Una excitación indirecta, como el habla, la risa o la alimentación provoca los accesos, de ahí la actitud inmóvil de estos pacientes que evitan el mínimo contacto a nivel de su cara, reducen su alimentación y articulan poco temiendo una nueva crisis. Las crisis son habitualmente seguidas de un periodo refractario de duración variable, aunque breve, durante el cual la excitación de la zona afectada es ineficaz.10
El examen neurológico es normal, no existe alteración de la sensibilidad en la región del trigémino, ni lesión de los músculos masticadores.11
Evolución.La evolución es discontinua y de gravedad variable. Los primeros periodos dolorosos son breves, entre algunos días y algunas semanas, las crisis son inrecuentes, con periodos de remisión, después los cuadros se vuelven frecuentes y difíciles de localizar, ya que la topografía del dolor tiende a extenderse.10
La presentación clínica es variable: Existen síntomas en los cuales los periodos dolorosos son espaciados y breves, la otra presentación es paroxística y existe un fondo doloroso continuo. Las formas con participación vasomotora pueden estar acompañadas y/o seguidas de signos vasomotores y secretorios como rubor de la hemicara, lagrimeo, rinorrea.12
Se ha observado una alta frecuencia de alteraciones vestibulo-oculomotoras, indicando que las alteraciones vasculares que comprimen el V y el V-II, también pueden comprimir al V-III y/o al tallo cerebral.13
El diagnóstico de la neuralgia trigeminal se basa en la topografía, las características del dolor y el examen clínico. Es raro en el adulto joven, es una afección de la edad media y de la senectud, un poco más frecuente en la mujer que en el hombre.14
Estudios de gabinete. En el pasado la evaluación de los pacientes con neuralgia trigeminal se basaba en la realización de una tomografía axial computada (TAC) y/o angiografía. Sin embargo, el trigémino normalmente no es visualizado en la TAC. La evaluación con TAC consiste en buscar anormalidades en el trayecto del nervio.15
El método de resonancia magnética (RM) proporciona una imagen precisa del curso del trigémino en su porción cisternal. Todas las porciones del nervio desde su origen son evaluadas fácilmente con las imágenes de resonancia magnética. Aunque la compresión vascular demostrada por resonancia magnética es un hallazgo radiológico hasta en el 30% de personas sintomáticas, una compresión del nervio en personas con neuralgia trigeminal puede implicar que ésta es la causa de la neuralgia e influenciar en el tratamiento.16
Tratamiento. La neuralgia trigeminal es de mecanismo aún desconocido, pero podía producirse tras una irritación crónica del nervio, por mecanismos periféricos y centrales. Se explicaría igualmente la actividad terapéutica de algunas sustancias, en general usada como antiepilépticos y que tienen la particularidad de facilitar los mecanismos inhibidores y disminuir los mecanismos excitadores en el núcleo del trigémino.17
Tratamiento farmacológico. La carbamazepina debe ser utilizada de primera intención y la posología debe aumentarse progresivamente para limitar los efectos secundarios: Náuseas, somnolencia, inestabilidad, confusión. La posología inicial es de 100 mg y se aumenta 100 mg cada 2 días hasta alcanzar 600 a 800 mg/día. Pocas veces se utilizan dosis más importantes, ya que los efectos secundarios en esos casos son considerables.18
La eficacia del producto es rápida, evidente desde los primeros días del tratamiento en aproximadamente el 60% de los casos, constituyendo una verdadera prueba diagnóstica. A largo plazo, a menudo es necesario aumentar temporalmente la posología durante las crisis evolutivas de la enfermedad, lo que a veces produce un agotamiento de la respuesta con la consecuente modificación del tratamiento farmacológico.19
En caso de fracaso de los tratamientos farmacológicos y según la edad del paciente, pueden proponese diferentes tipos de intervenciones.14
Tipos de intervenciones
Carbamazepina. Desde la década de 1960 se emplea para el tratamiento de la neuralgia del trigémino y como profiláctico para la migraña, se usa también en neuropatía diabética, dolor postinfarto, neuralgia post-herpética y dolor fantasma de extremidades.6
Química: La carbamazepina está relacionada químicamente con los antidepresivos tricíclicos. Es un derivado del iminoestilbeno, con un grupo carbamilo en la posición 5; esta fracción es esencial para la actividad antiepiléptica potente.26
Propiedades farmacocinéticas: son complejas; están influidas por su limitada solubilidad en agua y por la capacidad de muchos agentes antiepilépticos, incluyendo la propia carbamazepina, de incrementar su conversión en un metabolito activo por las enzimas oxidativas hepáticas.27
La carbamazepina es absorbida lentamente y en forma irregular, luego de su administración por vía oral. Las concentraciones plasmáticas máximas se observan de 4 a 8 horas después de la ingestión del fármaco, se distribuye rápidamente en otros tejidos. La fijación a las proteínas plasmáticas llega al 75%.28
La carbamazepina es inactivada por conjugación e hidroxilación. Menos del 3% del agente se recupera en la orina como compuesto original o epóxido. Durante la terapia prolongada, la vida media de la carbamazepina en el plasma es, en promedio, de 20 a 30 horas. Debido a la inducción de las enzimas metabolizadoras de fármacos, la vida media es mucho más larga en individuos que han recibido una sola dosis.29
Preparados y dosificación: La carbamazepina se presenta en tabletas de 100 y 200 mg y en suspensión de 20 mg/mL para administración oral, el tratamiento contra la epilepsia se inicia con una dosis de 200 mg, tomada dos veces por día para reducir los efectos secundarios. Luego se incrementa gradualmente hasta 600 a 1.200 mg/día en adultos y 20 a 30 mg/kg en niños. En general se recomienda administrar la dosis diaria dividida en tres o cuatro tomas para reducir las fluctuaciones en las concentraciones plasmáticas. El tratamiento para la neuralgia del trigémino se inicia con 200 mg/día; la dosis se incrementa en forma gradual, en caso necesario, hasta 1.200 mg/día si son bien tolerados.30
Concentraciones plasmáticas: No existe una relación simple entre la dosis de carbamazepina y las concentraciones de fármaco en el plasma. Las concentraciones terapéuticas oscilan entre 6 y 12 µ/mL, aunque existen variaciones considerables. Tomson y colaboradores reportaron que el efecto óptimo de la carbamazepina era con niveles entre 5.7 y 10.1 µ/mL; cuando los niveles superan los 9 µg/mL las alteraciones sobre el sistema nervioso central son frecuentes.27
La carbamazepina fue introducida por Blom a comienzos de la década de los 60 y actualmente es el agente principal para el tratamiento de las neuralgias del trigémino y glosofaríngeas. También es efectiva para eliminar el dolor tabético. La mayoría de los pacientes con neuralgia se benefician inicialmente, pero sólo en un 70% se obtiene un alivio continuado. Los efectos adversos requieren la suspensión de tratamiento en un 5.20% de los pacientes. El rango terapéutico de las concentraciones plasmáticas para la terapia antiepiléptica sirve como guía para su uso en las neuralgias. Cuando la carbamazepina sola no proporciona resultados satisfactorios, la medicación concurrente con fenitoína puede ser útil.28
Medición del dolor en clínica
La medición del dolor en clínica es muy distinta de lo que ocurre con el dolor experimental. En éste es posible cuantificar la calidad y magnitud del estímulo. En clínica, la mayoría de las veces tanto la naturaleza como la intensidad del estímulo son desconocidos, pudiendo variar ambas cualidades en el tiempo. A diferencia de otras variables fisiológicas (pulso, presión arterial, glicemia) no existe un método objetivo y directo que permita medir el dolor. Los métodos más utilizados son de tres categorías:
Informes subjetivos de dolor.
Mediciones y observaciones de conducta dolorosa.
Correlaciones fisiológicas.
Informes subjetivos de dolor. Son sin duda los métodos más usados en la evaluación clínica y en investigación. Se basan en el informe que el paciente realiza, generalmente de la intensidad del dolor y pueden ser de diferentes tipos:
a) Escala descriptiva simple: escalas verbales que clasifican al dolor en 4, 5 o más categorías, como por ejemplo intenso, moderado, leve o ausente, y que muchas veces se confrontan con otras escalas, también descriptivas, del alivio producido por el tratamiento ( Cuadro I). En ambos casos el paciente debe responder y ubicarse en categorías preestablecidas. Este es el método que más se acerca a lo cotidiano, cuando preguntamos a un paciente si tiene dolor. Son escalas fáciles de usar y de comprender por parte de los pacientes, pero tienen un uso limitado en investigación, debido a su baja sensibilidad, es decir al escaso rango de respuestas que ofrecen. En esas condiciones, el paso de una categoría a otra puede representar cosas diferentes y para el análisis estadístico deben utilizarse pruebas no paramétricas, ya que no existe una relación aritmética entre las categorías.
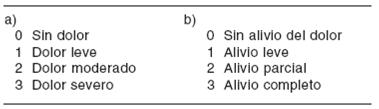
Cuadro I Diseño de una escala descriptiva simple de dolor (a) y de una escala de alivio de dolor (b), ambas limitadas a cuatro categorías.
Otra variante de este tipo de escalas categorizan el dolor de acuerdo a la necesidad de analgésicos (sin dolor, dolor que no requiere analgesia, y dolor que requiere analgesia), pero no presentan ventajas o limitaciones en relación a la escala verbal simple.
Objetivo
Determinar la relación de los niveles séricos de la carbamazepina con la presencia del dolor y los efectos colaterales en el tratamiento de la neuralgia trigeminal.
Material y métodos
Diseño: prospectivo, descriptivo, observacional, longitudinal, abierto, realizado en la Consulta Externa del Hospital de Especialidades del Centro Médico Nacional «La Raza», en el periodo de enero del 2003 a junio del 2004, se incluyeron pacientes entre 21 y 90 años de edad con diagnóstico de neuralgia trigeminal que tuvieran seguimiento mínimo de 9 meses y con 3 mediciones de niveles séricos de carbamazepina y tratados con carbamazepina. Se realizó una encuesta y una revisión de los expedientes clínicos, en busca de la dosis de carbamazepina, resultados de laboratorio de medición de niveles séricos y los efectos colaterales asociados, con el objetivo de establecer si existe una relación entre el dolor de la neuralgia, los efectos colaterales y los niveles séricos de la carbamazepina. Se utilizó la escala de medición de dolor visual análoga (EVA), consiste en una línea recta, habitualmente de 10 cm de longitud, se utiliza porque es una manera de entender fácil por el paciente y sencilla para expresar su grado de dolor con las leyendas «SIN DOLOR» y «DOLOR MÁXIMO» en cada extremo. El paciente anota en la línea el grado de dolor que siente de acuerdo a su percepción individual, midiendo el dolor en centímetros desde el punto cero (SIN DOLOR).
Tiene buena correlación con las escalas descriptivas, buena sensibilidad y confiabilidad, es decir, es fácilmente reproducible; mínimo dolor, de 1 al 4; dolor tolerable de 4-6 y el otro dolor severo de 7 a 10.
La medición del dolor se realizó según la manifestación de los pacientes hacia la presencia de dolor y se clasificó de la siguiente manera: a) leve (episodios cortos ocasionales) 1 a 4, b) moderado (episodios más prolongados y dolor más intenso pero soportable con mayor frecuencia) 5 a 7 y c) severo (episodios de dolor prolongados y severos) 8 a 10. La intensidad del dolor se midió según la referencia previa de dolor del paciente a la dosis, para poder indicar una dosis que pueda controlar el dolor sin causar efectos colaterales.
Los efectos colaterales y la sintomatología que presentaban al tomar la dosis de carbamazepina se obtuvieron interrogando al paciente. Los niveles séricos de los pacientes tratados crónicamente con carbamazepina se registraron cada 3 ó 4 meses con una solicitud de laboratorio. Para la medición de los niveles séricos en el laboratorio se utilizó la técnica de turbimetría, y no se realizaron exámenes de rutina.
Se recomendó a los pacientes no variar las dosis de carbamazepina sin conocimiento y autorización del médico tratante.
Resultados
En los expedientes revisados del Servicio de Cirugía Maxilofacial del HECMNR revisados en los periodos de enero del 2003 a junio del 2004 se encontraron 45 expedientes con diagnóstico de neuralgia trigeminal con controles periódicos de niveles séricos de carbamazepina. Se excluyeron 22 pacientes por expe diente clínico incompleto ( Cuadro II).
Por lo que se refiere a la edad, el rango fluctuó entre 21 y 87 años, el promedio fue de 54 años. De ellos, 17 (74%) fueron mujeres y 6 (26%) hombres ( Cuadro III).
El sitio anatómico que con mayor frecuencia se afectó, en 14 la neuralgia fue derecha y 9 izquierda. Ningún paciente presentó neuralgia de la rama orbitaria VI. 6 pacientes (4 lado derecho y 2 lado izquierdo) presentaron neuralgia de la rama maxilar VII; 9 pacientes (4 del lado derecho y 5 del lado izquierdo) presentaron neuralgia de la rama mandibular V-III; y 8 pacientes (6 de lado derecho y 2 del lado izquierdo) presentaron neuralgia trigeminal de V-II y V-III.
En 15 casos se encontró comorbilidad. El padecimiento más común fue la hipertensión arterial sistémica en 6 pacientes.
En 20 pacientes los efectos colaterales fueron:7 con mareos, 8 somnolencia, 5 náuseas.
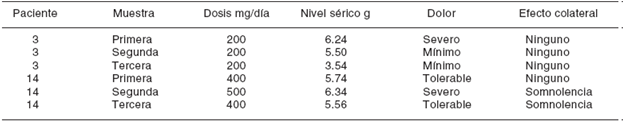
En la primera visita, la dosis promedio de consumo de carbamazepina fue de 468 mg, 452 en la segunda y 408 en la tercera visita, mientras que el promedio de niveles séricos fue de 5.6, 5.9 y 6.3 mg respectivamente (Kruskal-Wallis test p = 0.15) ( Figura 1 y Cuadro IV ).
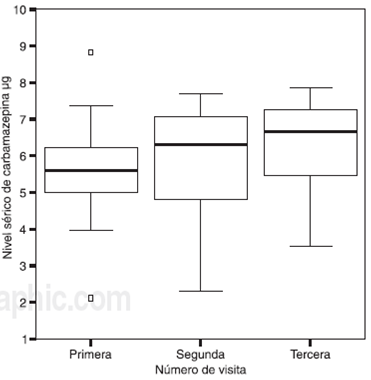
Figura 1 La figura muestra que los niveles séricos de carbamazepina fueron 5.6 μg en la primera visita, 6.3 μg en la segunda y 6.6 μg en la tercera. Kruskal-Wallis test (p = 0.15).
La correlación entre la dosis oral de carbamazepina en mg tuvo una correlación de 0.14 con los niveles séricos de carbamazepina (p = 0.25) ( Cuadro V). Probablemente esta baja correlación se debe a que no hubo ajuste por el peso del paciente.
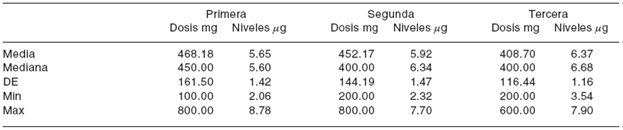
*Estadística descriptiva de las dosis de carbamazepina y los niveles séricos en las diferentes visitas de los pacientes.
Cuadro V Dosis de carbamazepina y niveles séricos en las visitas de los pacientes.*
De los pacientes que no presentaron dolor, 1 (20%) tuvo náuseas y 2 mareo (40%); los que presentaron mínimo dolor 3 (18.75%) presentaron somnolencia, 5 (31.25%) presentaron mareos y uno (6.25%) presentó náuseas y mareo, los que presentaron dolor tolerable 9 (34.62%) presentaron somnolencia, 4 (15.38%)presentaron náuseas, 6 (23.08) presentaron mareos, uno (3.85%) presentó náuseas y sueño y 2 (7.69%) presentó náuseas y mareo. De los pacientes que presentaron dolor severo 4 (18.18%) presentaron somnolencia, 3 (13.64%) presentaron náuseas, 6 (27.27%) presentaron mareos y uno (4.55%) presentó náuseas y sueño.
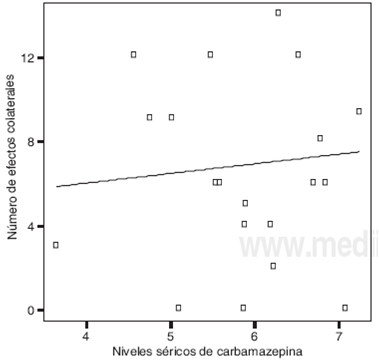
Se presentaron efectos colaterales en el 40% de los pacientes con niveles séricos de carbamazepina de menos de 4 µg, 64.3% en el paciente con 4 a 6 µg y 77.8% de los pacientes con niveles por arriba de 6 µg (p = 0.17) ( Figura 2 y Cuadro VI ).
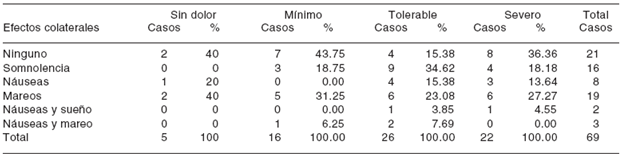
* Chi cuadrada (p = 0.6)
Cuadro VI Escala visual análoga del dolor y su relación con los efectos colaterales.
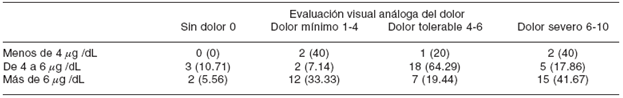
Al relacionar la escala visual análoga del dolor con los niveles séricos de carbamazepina se observa que a mayor concentración de carbamazepina, mayor calificación de la escala del dolor (p = 0.006). Probablemente se deba al requerimiento de carbamazepina que el paciente con dolor tiene ( Cuadro VII y Cuadro VIII ).
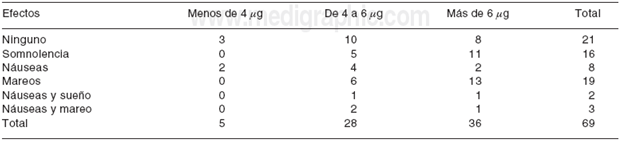
Cuadro VII Relación entre los niveles séricos de carbamazepina y la presentación de efectos colaterales.
Discusión
En nuestro estudio encontramos que el promedio de edad en la neuralgia trigeminal es de 54 años de edad, lo que difiere en comparación con la literatura médica mundial, en donde se ha comunicado que se presenta con mayor frecuencia entre la sexta y séptima década de la vida.7
Por lo que se refiere al sexo, en nuestro estudio predominó en las mujeres en el 74%, hecho similar a lo reportado por otros autores en proporción de 3:1 Pollock, Loi K, lo asocian con situaciones de tipo emocional.7
Anatómicamente, la rama de nervio trigémino que con mayor frecuencia se afectó en nuestra revisión fue la rama mandibular, lo que difiere de la literatura médica mundial, donde mencionan con mayor afección la rama maxilar en un 50% y la rama mandibular representa un 25%, coinciden en que siempre es unilateral.3
Se han utilizado muchos métodos para la medición del dolor y el efecto de los analgésicos. La escala descriptiva simple de leve moderado y severo se ha usado en la neuralgia del trigémino,31 así como la escala visual análoga (EVA), y en los efectos terapéuticos de la carbamazepina.32
Según Sharay y Benoliel en el artículo publicado en 1991 «Dolor trigeminal idiopático» se menciona que para evaluar el dolor y determinar el efecto de los analgésicos usan el marcador del dolor y la escala verbal descriptiva simple, son más apropiados que la escala visual análoga para determinar la magnitud del dolor en casos de dolor paroxístico y refractario.31
La escala visual análoga es una simple escala cuantitativa y es apropiada para determinar la intensidad del dolor. Se realizó la medición del dolor con este método, combinándola con el recuento de la frecuencia dolorosa ( Cuadro VI).32
Los efectos colaterales de la carbamazepina se relacionaron directamente con los niveles séricos y las dosis de carbamazepina; a mayor dosis mejor control del dolor.
Los niveles séricos que se encontraron en nuestro estudio oscilaron entre 2.06 µg, a 8.78 µg, los efectos óptimos de la carbamazepina en suero según Goodman y Gilman 2004 son de 6 µg a 12 µg, Tomson los describió entre 5.7 µg y 10.1 µg. En nuestra revisión encontramos algunos pacientes con niveles séricos elevados y presencia del dolor, así también observamos ocasionalmente control del dolor con niveles séricos de carbamazepina bajos.28
La presencia del dolor en nuestro estudio varía en todos los casos en donde se administran dosis similares; según la literatura, las variaciones de la presencia o ausencia del dolor varían de un periodo a otro. Taylor y Brauner comunicaron que la resistencia a la carbamazepina se induce por el tratamiento a largo plazo, así también cuando el dolor es nulo o está ausente aunque presente niveles séricos bajos las dosis son efectivas.26,28
En varios casos se usaron dosis elevadas de carbamazepina para controlar el dolor, a diferencia de otros casos que a bajas dosis el control del dolor era adecuado. Las diferencias individuales en respuesta a la carbamazepina pueden ser de acuerdo a la intensidad de la neuralgia, la farmacocinética y los métodos de registro del dolor.
Es difícil determinar la causa que ocasiona las diferencias en la respuesta a la carbamazepina, con frecuencia se observan en pacientes con neuralgia trigeminal, se asocian con situaciones emocionales y actividad.
Así como hay variación del dolor en la neuralgia trigeminal, su alivio se puede obtener temporalmente -aun cuando se restringe la dosis de carbamazepina-debido a la aparición de efectos colaterales. Es importante observar las variaciones en la intensidad del dolor y los efectos colaterales cuando se usa carbamazepina a largo plazo.
Taylor y Brauner en 1998 comunicaron que la resistencia a la carbamazepina se induce por el tratamiento a largo plazo, así mismo cuando el dolor es nulo o está ausente, aunque presente niveles séricos bajos las dosis son efectivas.20
Las dosis de carbamazepina para iniciar el tratamiento de neuralgia trigeminal, llegan a variar de acuerdo al criterio y experiencia de los autores, sin embargo en su mayoría proponen un inicio con 200 mg por dosis, y en base a la evolución del control del dolor, esta dosis puede incrementarse; así mismo los niveles séricos de carbamazepina establecidos como seguros pueden llegar hasta 12 µg/mL y específicamente en este estudio el laboratorio que estableció el control sérico manejó un nivel máximo de 10 µg.28
Por otra parte, la característica clínica en el momento de la aparición del dolor, es espontánea y repetitiva, a manera de descarga eléctrica, estas características también fueron reportadas por Trosseau en 1990 y otros autores, estos cendentales para el diagnóstico diferencial de otras neuropatías faciales.
El nivel más alto de carbamazepina en este estudio fue de 8.78 µg, con una dosis de 600 mg C/24 h, presentando aún dolor severo, y con manifestación de somnolencia y mareo, el nivel sérico mínimo fue de 2.06 µg con dosis de 600 mg C/24 h, presentando dolor intenso y sin datos de efecto colateral, y en otro caso de nivel sérico de 2.32 µg con misma dosis de 600 mg C/24h, dolor intenso, presentó efectos colaterales como náuseas, comparando con la literatura según Masahiro Umino y Tsuneto Owatari en 1993 refieren que no hay relación directa entre los niveles séricos y la intensidad del dolor, así mismo observamos que a misma dosis en estos casos los pacientes presentan dolor intenso y con presencia o no de efectos colaterales, así mismo se observa discrepancia extrema en los niveles séricos de carbamazepina a la misma dosis.
Es importante considerar que la respuesta individual de cada paciente es diversa, aun con las mismas dosis de carbamazepina, y el factor emocional que rodea a esta entidad nosológica es trascendental para su control.
Las alternativas terapéuticas anexas al manejo de carbamazepina, no están ausentes en este estudio, ya que 11 pacientes fueron sometidos a alcoholización en el tiempo del estudio, 3fueron arizotomía y 2 pasan a neurocirugía por descontrol del dolor. Siete pacientes continuaron control con carbamazepina, y en 3 casos fueron valorados por neurología para control del dolor con otros anticonvulsivantes, así como es establecido en el artículo de Fontanel JP. En 1997 en su artículo Algias craneofaciales.
Encontramos padecimientos de fondo asociados a la neuralgia trigeminal, entre los cuales el más representativo fue la hipertensión arterial sistémica en 6 pacientes, encontrando que de acuerdo al reporte de Masashi Yocota, Maseru Aoyagi, e Isao Kato en 1994, las situaciones vasculares contribuyen de forma importante a la aparición del dolor, requiriendo en ocasiones la descompresión del ganglio, sin embargo cuando no está bien determinada la HAS como tal funja como factor etiológico y 8 de los pacientes en este estudio no presentaron ningún padecimiento de fondo.
Conclusiones
Los niveles séricos de la carbamazepina no tienen relación directa con la presencia del dolor ni con los efectos colaterales. Se observó presencia del dolor aun a niveles séricos elevados, así también vemos en ocasiones control del dolor con niveles séricos de carbamazepina bajos.
Las respuestas individuales a la carbamazepina pueden ser multifactoriales, según la edad, actividades diarias, padecimientos de fondo, tratamientos conjuntos con otros medicamentos.
Es importante llevar un control estricto y periódico de la carbamazepina y de la biometría hemática para evitar la sobredosis y los efectos colaterales.
Se debe llevar un control adecuado del paciente y valorar la relación costo/beneficio del tratamiento, y valorar la posibilidad de tratamientos más radicales que puedan llevar a una estabilidad del paciente.
Se deben evaluar los niveles séricos de carbamazepina para evitar la sobredosis y realizar los ajustes necesarios de la dosis, y así decidir otros tratamientos neuroquirúrgicos o de bloqueos con anestésico y con alcohol.
Este estudio muestra la necesidad de establecer esquemas de control específicos, como puede ser la elaboración e integración al expediente clínico de una hoja de llenado rápido que incluya dosis de carbamazepina, hora de ingesta, cambios físicos abruptos y cambios emocionales que desde luego participan en la evolución de este padecimiento; esta hoja debe ser llenada y llevada por el mismo paciente.











 nueva página del texto (beta)
nueva página del texto (beta)