Introducción
Hoy día el conocimiento en la bioingeniería tisular para lograr regenerar un tejido después de una lesión o de un daño causado por un ataque bacteriano han llevado a la identificación y aislamiento de poblaciones de células progenitoras que bajo estímulos específicos pueden diferenciarse en una población específica, recibiendo el nombre de células madre (SC).1
Las células madre generalmente se definen como células clonogénicas capaces de autorrenovación; es decir son células no especializadas que se renuevan durante largos periodos de tiempo por división celular; y son capaces de diferenciación celular específica; esto hace referencia a que pueden ser inducidas por un estímulo adecuado a diferenciarse a células con funciones especiales como miocitos, osteoblastos, etc.2,3
Los reportes actuales sobre células madre reportan que se han aislado a partir de varios tejidos adultos, incluyendo médula ósea, tejido neural, músculo, piel, retina y folículos pilosos.4 Con referencia al área dental existen reportes incipientes donde las células madre aisladas son a partir de extractos de ligamento periodontal y de pulpas de órganos dentarios exfoliados (SHED).5,6
Los estudios con células madre enfocadas al área dental han reportado que estas células pueden formar estructuras que parecen complejos pulpa-dentina y ligamento periodontal-cemento radicular respectivamente al ser trasplantadas subcutáneamente en ratones inmunocomprometidos,7 o pueden participar en procesos de reparación periodontal en defectos creados en roedores.8 Asimismo, las células madre SHED son capaces de estimular la nueva formación de hueso, por lo que tienen posible aplicación en regeneración ósea craneofacial.9,10 Estos y otros datos experimentales, resaltan el potencial de las células madre para lograr la regeneración de tejidos dentarios humanos in vivo, sin embargo, no se conocen las señales necesarias para la diferenciación a un fenotipo celular específico, por lo que la investigación actual está encaminada a desentrañar cuáles son los mecanismos moleculares involucrados en el tránsito de una población celular progenitora con característica de célula madre a una población comprometida hacia un linaje dental o célula diferenciada.11
Por ello, el estudio de las células madre abre un panorama considerable desde su descubrimiento en el área biomédica y dental, aunado a su facilidad de obtención con la factibilidad de expandir el cultivo in vitro para su utilización terapéutica; convirtiendo a las células madre en candidatas ideales para la investigación en el área de regeneración tisular e ingeniería de tejidos.
Con la finalidad de contribuir al conocimiento de las células madre, el propósito de esta investigación se basó en llevar a cabo el aislamiento, caracterización y diferenciación celular de células madre derivadas de extractos de pulpa dental de premolares de pacientes jóvenes que fueron extraídos por cuestiones de tratamientos de ortodoncia.
Material y métodos
Selección de pacientes
Para realizar este estudio, se reclutaron 5 pacientes sanos de ambos sexos, adolescentes en un intervalo de 12 a 18 años de edad que acudían a la Clínica de Ortodoncia de la División de Estudios de Postgrado e Investigación de la Facultad de Odontología de la UNAM. Su tratamiento de base contempló extracciones de primeros premolares superiores e inferiores y ellos fueron informados del estudio para su consentimiento.
Extracción dental
La extracción de los premolares de los 5 pacientes se llevó a cabo en la Clínica de Odontopediatría de la División de Estudios de Postgrado e Investigación de la Facultad de Odontología de la UNAM. La extracción se realizó utilizando 1.8 mililitros de anestésico lidocaína con epinefrina (36 mg/0.025mg, Uniseal) luxando el órgano dentario con un elevador recto No. 301m y manipulando con fórceps No. 150. El órgano dentario extraído se colocó inmediatamente en medio Dulbelcos modified eagle medium (DMEM) frío para garantizar el estado celular del tejido pulpar.
Obtención de muestra pulpar
Posterior a la extracción del órgano dentario, se procedió a obtener pulpas dentales. El órgano dentario se fracturó por medio de utilizar pieza de alta velocidad para garantizar no dañar el tejido pulpar. La muestra pulpar se extrajo de la cavidad y se colocaron en medio DMEM frío estéril.
Aislamiento de células madre
Para llevar el aislamiento de las células madre, las pulpas dentales se colocaron en una solución de 3 mg/mL de colagenasa tipo I y 4 mg/mL de dispasa durante 10 minutos. Pasado el tiempo de digestión se lavaron con medio DMEM con suero fetal bovino al 10% por 3 minutos.
Los extractos digeridos de las pulpas dentales se dejaron crecer en cajas de cultivo de 6 pozos en presencia del medio de cultivo modificado Eagle's suple-mentado con 10% de suero fetal bovino (SFB), una solución de antibióticos (penicilina (100 UI/mL), estreptomicina (100 µ/mL) y fungisona (0.3 µ /mL), 100 mM de aminoácidos no esenciales y 100 mM de piruvato de sodio, hasta obtener colonias clonogénicas, aproximadamente de 2 a 5 semanas de cultivo. El medio de cultivo antes mencionado se cambió cada tercer día, para garantizar el crecimiento celular.
Inmunocitoquímica
Para detectar los marcadores específicos STROH-1 y CD-44 las clonas de células madre aisladas de los extractos pulpares, se crecieron en cajas de cultivo de Lab-Tek de 8 pozos durante 3 días. Pasado el tiempo las células se fijaron con paraformaldehído al 4% por 10 minutos, se lavaron con buffer de fosfatos (PBS) por 2 minutos repitiendo tres veces. Para detectar los marca dores específicos las células se permeabilizaron con metanol frío durante 10 minutos y se incubaron con los anticuerpos específicos que reconocen a los epítopes STROH-1 y CD-44 a una concentración de 1:100 incubados a 4°C durante 24 horas. Pasado el tiempo de reacción se lavaron 3 veces por 10 minutos con PBS-Tritón 100x para eliminar la señal inespecífica del anticuerpo. La señal se obtendrá por incubar con un segundo anticuerpo acoplado a isotiocianato de fluoresceína (FITC) a una concentración de 1:1000. Esta señal se observó bajo el microscopio de fluorescencia y se tomaron fotos de 5 campos al azar para fotodocumentar la señal positiva de los marcadores.
Ensayo de diferenciación celular
La determinación de la diferenciación celular se realizará por medio de utilizar un medio inductor de la biomineralización que contiene medio DMEM suplementado con 10% SFB, 50 µg/mL de ácido ascórbico, 10 mM de β-glicerofosfato, 10-7 M de dexametasona y una solución de antibióticos compuesta de penicilina (100 U/mL) y estreptomicina (100 µg/mL). El medio se cambiará cada 2 días. El control de los ensayos de diferenciación fueron las células madre cultivadas en ausencia del medio inductor de la mineralización. Para analizar la diferenciación celular de las células madre derivadas de la pulpa dental, se evaluaron los niveles de expresión del gen que codifica para dos de las proteínas más importantes involucradas en el proceso de biomineralización: Sialo-proteína ósea (BSP) y osteopontina (OPN) por medio de la reacción en cadena de la polimerasa reversa (RT-PCR), por inmunohistoquímica utilizándolos anticuerpos policlonales anti-BSP y anti OPN a concentraciones de 1.500 y por detectar la presencia de nódulos mineralizados por medio de la tinción con rojo de alizarina roja S.
Resultados y discusión
Los resultados obtenidos de este estudio muestran que a partir de tejido pulpar utilizando métodos de digestión enzimática es posible aislar células o colonias individuales, después de un periodo de cultivo de 14 a 20 días. Esto concuerda con los resultados de otros estudios donde obtienen colonias celulares desde 5 a 15 días de cultivo celular a partir de explantes de tejido pulpar.3 Las células que se obtuvieron de las digestiones pulpares después de 14 días de cultivo celular (Figura 1 A y Figura 1 B); muestran una morfología de tipo fibroblástica, alargada y aplanada que se pueden ubicar en colonias clonogénicas, característica esencial de las células madre post-natales. Por otro lado, los ensayos inmunocitoquímicos para detectar marcadores membranales específicos de células progenitoras mesenquimales, muestran que las células presentes en nuestros cultivos derivados de las digestiones de las pulpas dentales humanas son positivas a los marcadores CD-44 y STRO-1 ( Figura 1 C y Figura 1 E). Estos ensayos inmunocitoquímicos concuerdan con estudios previos donde aislaron y caracterizaron células madre a partir de dientes exfoliados deciduos y de células madre a partir del ligamento periodontal, siendo positivas las colonias celulares a los marcadores CD-44 y STRO-1.5 Asimismo, estos marcadores (CD-44 y STRO-1) en combinación con marcadores como CD-146 (MUC-18), VCAM-1, entre otros, han sido extensivamente utilizados para caracterizar colonias altamente puras de células madre mesenquimales aisladas a partir de médula ósea,12-14 lo cual nos ayuda a confirmar que las células aisladas en nuestro estudio son células progenitoras.

Figura 1 Fotografías donde se observa a las células madre migrando del tejido pulpar digerido después de 14 días de cultivo celular (A y B). Inmunofluorescencia de las células madre aisladas de los extractos pulpares contra epítopes superficiales de membrana CD-44 (C y D) y STRO-1 (E y F). El control son células en ausencia del primer anticuerpo. EP = extracto pulpar.
Las células madre se consideran células progenitoras capaces de responder a estímulos diferenciadores específicos. Para confirmar lo anterior expuesto, realizamos un estudio de diferenciación in vitro, donde utilizamos un estímulo que promovería la formación de nódulos mineralizados por medio de utilizar dexametasona en los medios de cultivo celular. Los resultados de los ensayos de diferenciación muestran que las células madre que recibieron dexametasona a una concentración de 10-7 M por 15 días de cultivo, son capaces de formar nódulos mineralizados (positivos a la tinción con alizarina roja S) cuando se comparan con las células madre cultivadas en ausencia del estímulo mineralizante ( Figura 2). Sin embargo, para evaluar la diferenciación celular de las células madre derivadas de la pulpa dental hacia un fenotipo mineralizante analizamos la expresión de dos de las proteínas más importantes involucradas en el proceso de biomineralización: sialoproteína ósea (BSP) y osteopontina (OPN) por medio de inmunocitoquímica ( Figura 3) y por medio de la técnica de RT-PCR ( Figura 4).

Tinción con alizarina roja S
Figura 2 Nódulos de fosfato de calcio depositados por células madre diferenciadas con dexametasona (B) y control (A) teñidos por alizarina roja S.
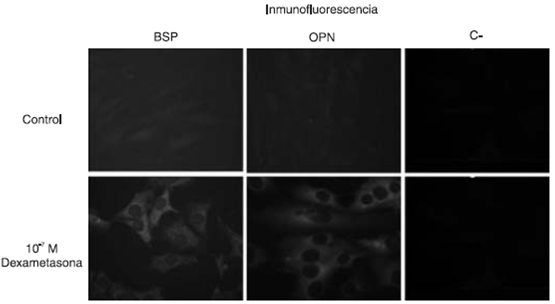
Figura 3 Inmunofluorescencia de proteínas involucradas en el proceso de mineralización BSP (A) y OPN (B) de células madre que fueron estimuladas a diferenciación celular. Control negativo ausencia del primer anticuerpo.
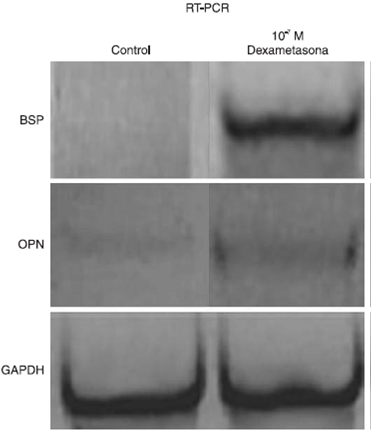
Figura 4 RT-PCR de los genes que codifican para las proteínas involucradas en el proceso de mineralización BSP y OPN de células madre que fueron estimuladas a diferenciación celular con dexametasona. El control interno fue el gen que codifica para la GAPDH.
Los resultados de los ensayos de inmunohistoquímica muestran que las células madre que recibieron dexametasona a una concentración de 10-7 M por 15 días de cultivo, son positivas a las proteínas BSP y OPN cuando se compararon con las células madre cultivadas en ausencia del estímulo mineralizante ( Figura 3).
Asimismo, en la Figura 4 se puede apreciar que existe una expresión diferencial de los genes que codifican para BSP y OPN. El gen que codifica para BSP se observa con mayor expresión con respecto al gen que codifica para OPN en las células madre que recibieron dexametasona a una concentración de 10-7 M por 15 días de cultivo.
Ambas proteínas están involucradas en el proceso de biomineralización. Sin embargo, el que exista una mayor expresión de BSP nos habla que la diferenciación de las células madre es completamente hacia un fenotipo mineralizante, ya que BSP es una proteína involucrada en la nucleación de cristales de hidroxiapatita y se presenta entre el 8 al 12% del total de proteínas no colágenas del hueso alveolar, cemento radicular, dentina y algunas subpoblaciones del ligamento periodontal. Esta expresión nos indica el papel tan importante que juega la BSP en el proceso de mineralización debido a que es una molécula que se propone puede estar involucrada en el reclutamiento de células progenitoras que darán origen a los linajes periodontales por medio de su secuencia RGD (Arg-Gly-Asp) involucrada en la adhesión celular por medio de receptores a integrinas.15-18
Así mismo durante este tiempo experimental puede estar jugando su papel más destacado, llevar a cabo la fijación de iones de Ca++ en la matriz extracelular permitiendo la nucleación de cristales. Esto nos indica el periodo en el que se encuentra el proceso de mineralización debido a que la BSP se expresa en los periodos iniciales de la mineralización. Una vez que la nucleación se lleva a cabo, la expresión de OPN es importante, porque se propone que juega un papel en regular el crecimiento adecuado de los cristales de hidroxiapatita.19 Estos resultados obtenidos concuerdan con lo reportado por la literatura, donde usando una metodología similar las células madre aisladas de dientes deciduos, células derivadas del ligamento periodontal y células madre mesenquimales de médula ósea han sido diferenciadas hacia células osteoblásticas y/o cementoblásticas, expresando marcadores como BSP, OPN, osteocalcina, fosfatasa alcalina, colágena tipo I entre otras y bajo otros estímulos diferenciadores a células adiposas, células neuronales, musculares, entre otras.19-21
Conclusión
Nuestros resultados indican que las células derivadas de las digestiones de pulpas dentales humanas contienen subpoblaciones celulares, entre las cuales existen células progenitoras que expresan marcadores que las identifican como células madre postnatales.
Estas células madre derivadas de las pulpas dentales humanas, presentan una característica esencial que son clonogénicas y que pueden ser catalogadas como multipotenciales, con capacidad de diferenciación hacia un fenotipo mineralizante.
Sin embargo, es necesario llevar más estudios para caracterizar el fenotipo al cual las células se han diferenciado con especial énfasis al fenotipo odonto-blasto/osteoblástico para pensar en un futuro en un uso potencialmente clínico en terapias de regeneración dental.











 nueva página del texto (beta)
nueva página del texto (beta)


