Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Tropical and subtropical agroecosystems
versão On-line ISSN 1870-0462
Trop. subtrop. agroecosyt vol.14 no.2 Mérida Mai./Ago. 2011
Artículos de investigación
Aislamiento y patogenicidad de un posible Pythium aphanidermatum en Jatropha Curcas L. no tóxica
Isolation and pathogenicity of a possible Pythium aphanidermatum in Jatropha Curcas L. non toxic
Ofelia Andrea Valdés Rodríguez*1, Roberto García Espinoza2, Odilón Sánchez Sánchez1, Arturo Pérez Vazquez2
1 Centro de Investigaciones Tropicales, Universidad Veracruzana, Xalapa, Ver. *Corresponding author Email: valdesandrea@yahoo.com.mx.
2 Colegio de Posgraduados, Campus Texcoco y Campus Veracruz.
Submitted April 13, 2010
Accepted November 02, 2010
Revised received February 20, 2011
Resumen
Un cromista, posible Pythium aphanidermatum, fue aislado de semillas y plántulas recién emergidas de semillas de Jatropha curcas L. no tóxica severamente dañadas sembradas en la región tropical de Veracruz, México. Para estudiar su efecto sobre las etapas de pre y post-emergencia, el patógeno aislado fue inoculado en semillas y plántulas de reciente emergencia. Se corroboró un cierto potencial patogénico en la etapa de pre-emergencia, que no fue estadísticamente significativo en la etapa post-emergente a mediano plazo.
Palabras clave: Pythium aphanidermatum; Jatropha curcas; plántulas; patogenicidad pre-emergente y post-emergente.
Abstract
A chromista, possible Pythium aphanidermatum, was isolated from severely damage seeds and seedlings recently started from Jatropha curcas L. non toxic seeds sown in the tropical area of Veracruz, Mexico. In order to study pathogenic Pythium aphanidermatum effects over pre-emergent and post-emergent stages, seeds and young seedlings were inoculated with the isolated pathogen, and the chromista showed possible pathogenic activity against pre-emergency and recently started post-emergency; however, statistically significant damaged was not found in older seedlings.
Keywords: Pythium aphanidermatum; Jatropha curcas; seedlings; pre-emergent patogenicity; post-emergent patogenicity.
INTRODUCCIÓN
Jatropha curcas L. (J. curcas) es una planta oleaginosa de la familia Euphorbiaceae (Heller, 1996). El cultivo de esta especie ha cobrado importancia en regiones tropicales y subtropicales debido a su capacidad para adaptarse a climas áridos y semi-áridos; sus usos en reforestación y retención de suelos, así como a las propiedades de sus semillas como fuente potencial de biocombustibles (Heller, 1996; Henning, 2007). En general, existen dos variantes de J. curcas, una tóxica, y otra no tóxica, o de muy baja toxicidad, proveniente de México (Hellen, 1996; Martínez, 2007; Becker y Makkar, 2008) y cuyas semillas son consumidas en algunas comunidades del sur del país (Schmook y Sanchez, 2000; Martínez et al., 2006). En México, el cultivo de ambas variantes se difunde por parte del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) (Zamarripa y Díaz, 2008), y la Comisión Nacional Forestal (CONAFOR) otorga apoyos para su siembra mediante el programa ProArbol (CONAFOR, 2010). Por lo que algunos productores han iniciado su cultivo en varias regiones del país (Gomez, 2010; FedeBiocombustibles, 2010). Sin embargo, la especie aun se considera como no domesticada (Achten et al., 2010), lo que implica que, las prácticas de reproducción, manejo y control de plagas, requieren desarrollarse. Ya que, aunque sus orígenes se ubican entre México y Centroamérica (Heller, 1996; Maes et al., 2009), existe poca información sobre los patógenos del suelo localmente importantes para la especie en el trópico mesoamericano. Esto se debe principalmente al reciente establecimiento de plantaciones comerciales en esta zona (Cifuentes y Fallot, 2009). Ante esta situación es imperativo contar con información relevante sobre las posibles amenazas para los cultivares que se establecen ahí. Para el genotipo tóxico de J. curcas, que es el más documentado, se reporta susceptibilidad de la planta en África y Nicaragua a los patógenos del suelo: Pythium spp, Phytophthora spp y Fusarium spp (Heller, 1996); así como problemas de pudrición de tallos en asociación con suelos mal drenados y condiciones de alta humedad, causados por Fusarium spp. (Padilla y Monterroso, 2007). En Guatemala, bajo condiciones de alta humedad (2000 mm anuales), se reporta a Fusarium spp y Erwinia spp como patógenos de elevada incidencia que atacan los tallos de la planta. (Biocombustibles de Guatemala, 2008). Para la variedad no tóxica, muy poco documentada, únicamente se ha identificado a Phymatotrichum omnivorum afectando siembras realizadas en suelos con poco drenaje (Félix, 2008). Por lo tanto, la documentación científica acerca del comportamiento de la forma no-tóxica en relación con sus posibles patógenos adquiere mayor relevancia, para los productores interesados en establecer plantaciones comerciales con esta variedad.
Por su parte, al género Pythium se le ha responsabilizado de la necesidad de abandonar la tierra en la agricultura trashumante (García, 2010), aunque su papel como limitante de la productividad suele confundirse con otros factores debido a la complejidad de la vida del suelo. Una especie adaptada al trópico es Pythium aphanidermatum (Edson) Fitz (P. aphanidermatum) un cromista del suelo de amplia distribución global; común en regiones cálidas, por que su crecimiento se favorece con temperaturas superiores a los 30º C (Rodríguez, 2001; Watanabe, 2002). P. aphanidermatum se caracteriza por dañar frutos, semillas, raíces y bases de tallos de plántulas juveniles (Parker, 2009). En México este patógeno se ha detectado atacando a más de 60 especies vegetales (Rodríguez, 2001). Entre otros, ataca diversos cultivos como solanáceas y cucurbitáceas en suelos de Sinaloa (Romero, 1988); así como frijol (Phaseolus vulgaris) en el valle de México (Rodríguez, 2001) y fresa (Fragaria x ananassa), en Michoacán (Ceja-Torres et al., 2008). Este cromista podría ser el Pythium spp. reportado por Heller, (1996) como causante de ahogamiento (damping off) y pudrición de tallos en plántulas de J. curcas; aunque no se encuentra especificada la especie, ni se reportan las pérdidas de manera cuantificada. Dado que las plantas son más vulnerables al ataque de Pythium durante la germinación o sus primeros estadíos y a que las suculentas (como J. curcas lo es en su etapa juvenil) son más susceptibles a su ataque (Paulus y Correl, 2001); es probable que este patógeno sea causante de una baja tasa de germinación y muerte prematura de las plántulas de esta especie cuando se registran condiciones de alta humedad, como ocurren generalmente en los trópicos.
En este contexto, el objetivo de este estudio fue definir la capacidad patogénica del aislamiento de un posible Pythium aphanidermatum durante las etapas de pre-emergencia y post-emergencia de la variedad de J. curcas no tóxica localizada en la región central de Veracruz, México.
MATERIALES Y MÉTODOS
Localización del área de estudio
La investigación de campo se llevó a cabo en la región central del estado de Veracruz (19°11'55.71"N, 96° 9'7.91"O y 11 msnm). El clima en esta región se considera cálido subhúmedo, con temperatura anual promedio de 23º C y máximas promedio de 32º C (INEGI, 2010).
Selección y preparación del material vegetativo
Las semillas de J. curcas utilizadas en los ensayos corresponden a genotipos considerados no tóxicos o de muy baja toxicidad procedentes de la región de Papantla, Veracruz (coordenadas: N 20° 15' 17'', O 97° 15' 32'' y 71 msnm), colecta Enero-Marzo 2009. Un análisis a una muestra de semillas escarificadas de la misma procedencia indicaron un nivel de forbolesteres de 0.11 mg/g (Schmook y Sanchez, 2000). Con la finalidad de eliminar presencia de patógenos en su superficie, las semillas fueron esterilizadas con peróxido de hidrógeno de 20 volúmenes durante 60 segundos antes de su siembra.
Detección y aislamiento del patógeno
Esta investigación se inició en abril del 2009, con la recolección de semillas y plántulas de reciente emergencia localizadas en la región y severamente afectadas por un patógeno. Las muestras fueron transportadas en bolsas de plástico al laboratorio, donde se procedió a lavarlas con agua corriente y detergente, y posteriormente se sometieron a 30 segundos de inmersión en peróxido de hidrógeno de 20 volúmenes para eliminar cualquier otro contaminante superficial. Las muestras fueron segmentadas y secadas sobre toallas estériles para posteriormente colocarlas en cajas de Petri conteniendo medio de cultivo harina de Maíz-agar adicionado con antibióticos que permiten el aislamiento selectivo de especies de Pythiaceos. Los antibióticos usados fueron: Rifamicina, Ampicilina, Pimaricina y PCNB, aplicados conforme al método desarrollado por Tsao y Ocana (1969). Las cajas de Petri se colocaron dentro de bolsas negras gruesas para evitar la luz y se introdujeron en una incubadora a temperatura constante de 35º C para favorecer las condiciones de desarrollo del cultivo. El desarrollo de un Pythiaceo se observó a las 48 horas después de la siembra.
Para identificar al patógeno cultivado se procedió a promover su esporulación, para lo cual se hirvieron hojas de pasto (Festuca arundinacea) durante 5 minutos. La solución se dejó enfriar a temperatura ambiente y posteriormente se vertió en cajas de Petri a las que se agregaron colonias tomadas de los márgenes de los discos que contenían al patógeno. Las cajas se colocaron dentro de una estufa germinadora a 35º C e iluminación constante de luz fría. Después de un tiempo aproximado de 48 horas se realizaron las observaciones de la esporulación obtenida con microscopio óptico de 20× y 40× de magnificación.
Las estructuras formadas se caracterizaron por la producción de oosporas, anteridios únicos e intercalares o terminales, formación de esporangios lobulados (hinchamientos hifales) con formación de vesículas cortas para la liberación de zoosporas, aspectos que definen la posible especie como Pythium aphanidermatum de acuerdo con las claves de Van Der Plaats-Niterink (1981).
Preparación e inoculación de los sustratos
Los sustratos utilizados se tomaron de la misma región y su determinación de texturas: franco, arenoso y arcilloso, se realizó mediante el método de Bouyoucos (1963). Posteriormente se tomaron muestras del suelo donde se colectaron los sustratos para determinar pH (mediante potenciómetro digital), materia orgánica (método de Walkley-Black (1937), P (método de Olsen-Kitson Mellon (NOM-021-SEMARNAT-2000)) y Ca y Mg (método de Diehl et al., 1950). Antes de la inoculación se esterilizaron los suelos (suelo colocado en jarras conserveras de 1 litro, sometido a 20 lb psi. en autoclave por cuatro horas durante dos días consecutivos). Posteriormente se adicionaron los aislamientos del Pythiaceo y se mezclaron uniformemente. Las jarras se cubrieron para protegerlas de la luz y los cultivos sembrados se mantuvieron en incubación durante 20 días a temperatura ambiente (25º C).
La cuantificación del número de unidades formadoras de colonias (ufc) se realizó después del periodo de almacenamiento de 20 días, mediante el método de dilución en placa empleando concentraciones: 1×10-2, 1×10-3 y 1×10-4 sembradas en cajas de Petri conteniendo el medio de cultivo para aislamiento selectivo de especies de Pythiaceos mencionado anteriormente. Se prepararon cinco cajas de Petri por cada dilución y se colocaron en el mismo ambiente controlado detallado anteriormente. Las ufc se contabilizaron 48 horas después de la siembra.
Patogenicidad en condición de pre-emergencia
La observación de la patogenecidad en pre-emergencia se realizó mediante dos ensayos con sustratos inoculados previamente con el patógeno.
Ensayo I: se implementó bajo condiciones ambientales naturales de la región. El diseño consistió en un bloque al azar de dos tratamientos (sustrato estéril y sustrato inoculado) con dos niveles (sustrato arenoso y sustrato arcilloso) y 100 individuos por tratamiento. Las semillas de J. curcas se sembraron de forma vertical quedando cubiertas completamente por el sustrato a una profundidad igual al largo de la semilla (2 cm aproximadamente). El sustrato fue hidratado diariamente, manteniéndose una humedad en suelo superior al 90% para sustrato arenoso y de 100% para sustrato arcilloso, según estimaciones realizadas con tensiometro Aquater Digital E300.
Ensayo II: se realizó en germinadora diseño propio. El diseño consistió en un bloque al azar con dos tratamientos (sustrato estéril y sustrato inoculado) y 40 individuos por tratamiento. Las semillas fueron colocadas en cajas de Petri con suelo franco estéril o inoculado, según correspondiera, a razón de cuatro semillas por caja. Posteriormente se introdujeron en la cámara germinadora con foto-periodos alternados de 12 horas y una temperatura constante de 30º C para los periodos de luz, y 24º C para los periodos de oscuridad. Las cajas de Petri se mantuvieron cerradas e hidratadas durante el periodo de observación.
En ambos ensayos durante un periodo de 14 días se registró el número de semillas germinadas y los efectos sobre las plántulas sobrevivientes. El Cuadro 1 resume los diseños y condiciones experimentales.
Patogenicidad en condición de post-emergencia
Para estudiar esta condición se implementaron dos ensayos, ambos con sustratos arenosos y plántulas emergidas de semillas con edad promedio de 15 días.
Ensayo I: se inició el 25 de junio. El diseño experimental consistió en un bloque completamente al azar con tres tratamientos (cero propágulos de P. aphanidermatum por gramo de suelo (ppgs), 160 ppgs y 400 ppgs) y 60 individuos trasplantados aleatoriamente a raíz desnuda a bolsas individuales de polietileno negro de 12 cm de diámetro × 16 cm de fondo conteniendo el tratamiento correspondiente y donde permanecieron por un periodo de 31 días.
Ensayo II: Se inició el seis de Octubre. El diseño consistió en un bloque experimental completamente al azar con tres tratamientos (cero ppgs, 160 ppgs y 400 ppgs) y 120 plántulas transplantadas a raíz desnuda en bolsas de polietileno de 8 cm × 16 cm conteniendo el tratamiento correspondiente, y donde permanecieron por un periodo de 64 días.
Posterior a su transplante, las plántulas fueron regadas diariamente, manteniéndose la humedad del suelo siempre por arriba del 90%, de acuerdo con estimaciones de Tensiometro Aquater Digital E300. Los registros diarios de temperatura ambiente se realizaron con Estación metereológica Skymaster. El resumen de los diseños se muestra en el Cuadro 2.
En ambos ensayos las plántulas se mantuvieron bajo condiciones ambientales naturales de la región, mismas que fueron registradas, y sin recibir fertilizantes ni soluciones nutrientes. Las variables registradas durante los ensayos fueron: diámetro basal del tallo al nivel del suelo usando vernier digital (0.001 mm de precisión); altura del tallo al inicio de la emergencia de las últimas hojas usando cinta métrica (1mm precisión); y número de hojas al momento del transplante. Parámetros que fueron medidos 31 días después del transplante, cuando se extrajeron para medidas de peso húmedo y seco. Durante el periodo de duración de este experimento, algunas plántulas fueron atacadas por insectos fitófagos, por lo que fueron eliminadas y sus medidas no se consideraron en los análisis. Las variables reportadas fueron analizadas por normalidad y homogeneidad de varianzas para determinar las pruebas ANOVAs de una vía correspondientes a distribuciones normales o anormales.
RESULTADOS
Patogenicidad en condición de pre-emergencia
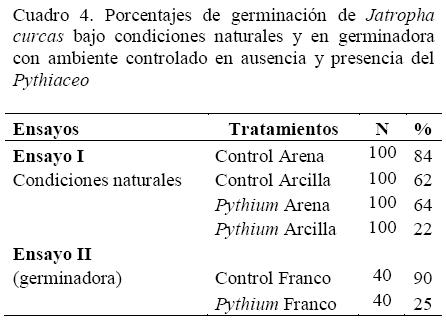
Para el ensayo I, realizado bajo condiciones ambientales naturales, se encontraron diferencias estadísticamente significativas entre porcentajes de germinación en semillas sembradas en sustratos arenosos y arcillosos inoculados con el patógeno (Tukey, P<0.05). Las semillas colocadas en sustrato arenoso tuvieron un porcentaje de muerte pre-emergente del 36%; mientras que las semillas colocadas en sustrato arcilloso tuvieron un porcentaje de muerte pre-emergente del 78%. Los síntomas observados en las semillas que no germinaron consistían en la aparición de estructuras con aspecto de hifas de hongos en el sustrato y sobre las propias semillas. Las estructuras amplificadas (oosporas, esporangios y tipo de micelio) del Pythiaceo se pueden apreciar en la Figura 1a y 1b.

En el ensayo II, la inoculación por P. aphanidermatum, realizada bajo condiciones controladas, sobre la condición pre-emergente de la germinación mostró un porcentaje de germinación de solo el 25% de las semillas sembradas. Lo que implicó un decremento de la tasa de germinación del 65% en presencia del patógeno, con relación a las semillas no infectadas, que obtuvieron un porcentaje de 90% de germinación. Estos resultados indicaron diferencias estadísticamente significativas entre el número de semillas infectadas por P. aphanidermatum (Tukey, P <0.001) con respecto a las que se encontraron libres del patógeno. Las semillas infestadas que no germinaron mostraron síntomas de pudrición con pérdida total de los embriones. El cuadro 4 muestra un resumen de los porcentajes de germinación obtenidos en ambos ensayos; mientras que la Figura 2 permite visualizar las curvas de germinación obtenidas.

Patogenicidad en condición de post-emergencia
Patogenicidad post-emergente en plántulas infestadas desde la semilla.
Los resultados aquí presentados se refieren a niveles de patogenicidad de P. aphanidermatum en plántulas germinadas de las semillas infestadas con el patógeno durante los experimentos de patogenicidad pre-emergente.
Para plántulas germinadas bajo condiciones naturales se observó muerte post-emergente del 8% para las plántulas localizadas en arena y un porcentaje de muerte post-emergente del 14% para las plántulas en suelo arcilloso (Cuadro 5). Los síntomas post-emergentes consistían en estructuras con aspecto de hifas de hongos en las bases de los tallos y puntas de las raíces de las plántulas germinadas, los cuales causaron la mortalidad en los dos tipos de sustrato. En las Figura 3a, 3b y 3c, se muestra el aspecto de las semillas y plántulas atacadas por el patógeno.

En las plántulas mantenidas en germinadora el efecto de P. aphanidermatum durante la etapa post-emergente a las plántulas de reciente germinación mostró severos daños a las raíces primarias de las plantas durante su desarrollo. En la Figura 4, se observan los daños causados en raíces de plántulas cuyas semillas sobrevivieron al ataque pre-emergente del patógeno. La severidad del ataque, que en algunos casos excede la capacidad de regeneración del sistema de raíces, resultó en una muerte post-emergente del 80%. Sin embargo, a pesar de lo dañino del ataque a todas las raíces, es importante destacar que el 100% de las plántulas que sobrevivieron al patógeno después del periodo de duración del experimento, no perecieron al ser transplantadas en el suelo de la región sin tratamiento alguno.
Patogenicidad post-emergente en plántulas de 15 días transplantadas a suelo infestado con P. aphanidermatum
Ensayo I. Al inocular P. aphanidermatum en la etapa post-emergente se observó amarillamiento en las hojas cotiledonares durante la primera semana después de transplantadas las plántulas, respuesta que no se observó en los individuos libres del patógeno. Sin embargo, al finalizar el periodo de experimentación de 31 días los resultados no indicaron diferencias estadísticamente significativas entre tratamientos en los crecimientos diferenciales del diámetro del tallo (H = 5.56; P = 0.07), la altura de la planta (H = 1.93; P = 0.38), ni el número de hojas generadas (H = 0.47; P = 0.8). Por otra parte el análisis de los pesos secos por partes: sistema de raíces (H = 1.01; P = 0.61); tallos (H = 0.024; P = 0.99); hojas (H = 0.12; P = 0.94) y pesos totales (H = 0.003; P = 0.998) de todas las muestras, al final del experimento tampoco proporcionó diferencias significativas entre tratamientos (Cuadros 6 y 7 y gráficas de Figura 5).
Ensayo II. El experimento de inoculación post-emergente para un periodo de dos meses no indicó diferencias significativas para el crecimiento diferencial del diámetro del tallo (H = 0.33; P = 0.85), ni tampoco para el número de hojas (H = 4.38; P = 0.11). En cambio, se encontraron diferencias significativas en relación con la altura de los tallos (H = 24.608; P <0.001), donde el mayor crecimiento en altura se registró en las plántulas inoculadas a 160 ppgs con respecto a las del grupo control y a las del grupo inoculadas a 400 ppgs. Sin embargo, esta diferencia no indica efectos patogénicos negativos sobre los grupos sometidos a las pruebas. Por otra parte, en los pesos secos finales sólo hubo diferencias significativas en el peso del follaje, ya que el grupo inoculado con 400 ppgs mostró un peso ligeramente mayor al grupo control (H = 7.4, P = 0.02). Situación que tampoco parece indicar efectos patogénicos negativos sobre el grupo sometido al mayor contenido de estos Pythiaceos. En los cuadros 8 y 9 y las gráficas de la Figura 6, se muestran promedios ± EE de las tallas y los pesos secos obtenidos en el experimento.
DISCUSIÓN
Condición de pre-emergencia
El deterioro de la capacidad de germinación de J. curcas en presencia del P. aphanidermatum coincide con lo reportado sobre sus efectos negativos durante las etapas de germinación y fases juveniles en otros cultivos (Martin, 1992; Bolton, 1980; Lumsdem et al., 1976). La condición de vulnerabilidad de las semillas de J. curcas reside en que la variedad no tóxica contiene niveles muy bajos de esteres de forbol (Harinder et al., 2008); mismos que han demostrado tener propiedades fungicidas (Suntornsuk, 2010), lo que aumenta probablemente su sensibilidad al ataque de este patógeno. Los efectos negativos fueron más evidentes cuando las semillas se sembraron en suelo tipo arcilloso bajo las condiciones naturales de la región, obteniéndose un 78% de muerte pre-emergente, y en suelo tipo franco bajo condiciones de temperatura controlada a 30 ºC se obtuvo un 75% de muerte en pre-emergencia. Sin embargo, el ataque del patógeno se atenúa significativamente bajo las mismas condiciones ambientales, pero en suelos arenosos, obteniéndose el 36% de muerte pre-emergente. Esto indica que el sustrato arenoso fue el más adecuado para obtener un mayor porcentaje de germinación de J. curcas. Este resultado coincide con lo reportado por Kahl et al. (2008), quienes al comparar la germinación en sustratos arenosos contra sustratos a base de composta con excreta de ganado vacuno, determinaron mayor germinación en sustratos arenosos. Lo cual coincide de igual manera con lo indicado por Ouwens et al. (2007) sobre la capacidad de J. curcas para sobrevivir mejor en suelos arenosos que arcillosos. Por otra parte, los análisis de contenido de materia orgánica y nutrimentos de las muestras de suelo indican que los sustratos franco y arcilloso contenían una cantidad mayor de materia orgánica y macronutrimentos (Cuadro 3) que el sustrato arenoso. Tal contenido de nutrimentos podría servir de alimento al patógeno favoreciendo su propagación en el sustrato, a diferencia de los suelos arenosos, donde no se detectó materia orgánica y el contenido de nutrimentos fue significativamente menor. Otro factor importante, es que la arena tiene una menor capacidad de retención de humedad (Aguilera y Martínez, 1996) y P. aphanidermatum requiere de condiciones de alta humedad para su desarrollo (Romero, 1988). Por tanto, es probable que el sustrato arenoso sea la mejor opción para disminuir la muerte pre-emergente en semillas de J. curcas, altamente susceptibles a este patógeno. Por tanto se sugiere usar suelo arenoso para germinar semillas de J. curcas y una vez obtenidas las plántulas, éstas pueden ser transplantadas a cualquier tipo de suelo donde se tengan condiciones adecuadas.
Condición de post-emergencia
La baja infección registrada por P. aphanidermatum al ser inoculado en plántulas de J. curcas de 15 días de edad evidencia la capacidad de la planta para tolerar al patógeno en sus etapas de mayor desarrollo. La menor capacidad del patógeno de infección a plántulas de mayor edad puede estar asociada con el incremento en la lignina de tallos y raíces, ya que se ha encontrado que ésta incrementa la resistencia a los patógenos fungales (Ogundana, 1971). Sin embargo, es importante considerar la disminución de la temperatura (por abajo de los 20 ºC para el periodo de 64 días) y el tipo de suelo utilizado (franco y arenoso), con menor contenido de nutrimentos y menor capacidad de retención de humedad que el suelo arcilloso, como atenuantes de la potencia de infección del patógeno. De hecho Michereff et al. (2005) indica que la temperatura puede determinar la frecuencia de las especies de hongos patogénos y suprimir diferencialmente sus poblaciones.
CONCLUSIONES
Con base en los resultados se concluye que la inoculación con P. aphanidermatum en etapas de pre y post germinación evidencian que, en la condición pre-emergente, el patógeno muestra un nivel más alto de infección, afectando drásticamente la germinación de J. curcas, especialmente si se encuentran en sustratos ricos en nutrimentos y con alta retención de humedad. El patógeno atacó severamente las raíces y la base de los tallos de las plántulas germinadas de semillas infectadas. Sin embargo, se encontró que J. curcas tienen una gran capacidad de regeneración en su sistema de raíces, ya que si los individuos logran superar esta fase, éstos pueden crecer satisfactoriamente, aunque con un desarrollo menor que plantas sanas. En la condición de inoculación post-emergente, se determinó que plántulas de 14 días o más son capaces de desarrollarse sin efectos significativos ante la presencia y ataque del patógeno. Cabe resaltar que los tipos de suelos utilizados (franco y arenoso) y el descenso de temperatura registrado durante el experimento de 64 días pudo haber tenido un efecto importante sobre la atenuación de la infección y el daño del patógeno. Por lo que, una segunda fase de estudio debe considerar realizar ensayos con diferentes niveles de inoculación, en diferentes épocas del año y con suelos arcillosos, que mantienen mayor humedad. Esto podría evidenciar posibles interacciones entre estos factores. Finalmente, la utilización de fungicidas para tratar a las semillas y la comparación con semillas de materiales tóxicos y no tóxicos podría demarcar el nivel de infección del patógeno y mejorar los métodos de propagación en esta especie.
REFERENCIAS
Achten, W. M. J., Nielsen, L. R., Aerts, R., Lengkeek, A. G., Kjær, E. D., Trabucco, A., Hanse, J. K. Maes, W.H., Graudal, L., Akinnifesi, F. K. Muys, B. 2010. Towards domestication of Jatropha curcas. Biofuels. 1: 91-107. [ Links ]
Aguilera, C. M. y Elizondo, M. R. 1996. Relaciones agua suelo. En: Relaciones agua suelo planta atmósfera. Universidad Autónoma de Chapingo, Edo. de México. Pp. 68-69. [ Links ]
Biocombustibles de Guatemala S. A. 2008. Creación de Vivero para la Producción de Plantas de Jatropha curcas a Nivel Regional. Informe Final. Guatemala, C.A. [ Links ]
Bolton, A. T. 1980. Effects of temperature and pH of soilless media on root rot of poinsettia caused by Pythium aphanidermatum. Canadian Journal of Plant Pathology 2: 83-85. [ Links ]
Bouyoucos, G. J. 1936. Directions for making mechanical analysis of soil by hidrometer method. Soil Science 42: 225–230. [ Links ]
Ceja-Torres, L. F. et al. 2008. Fungi prevalence and etiology of strawberry dry wilt under different crop management systems. Agrociencia 42:451-461. [ Links ]
Cifuentes, M. Fallot, A. 2009. Jatropha curcas como combustible: estado actual del cultivo en Mesoamérica. Recursos Naturales y Ambiente CATIE C.R. 56-57: 165-169. [ Links ]
CONAFOR, 2010. A3. Plantaciones Forestales Comerciales.- Municipios elegibles para las plantaciones de Jatropha curcas. En: Convocatoria de Reglas de Operación 2010: Términos de Referencia. < http://www.conafor.gob.mx/portal2/index.php?option=com_content&task=view&id=454&Itemid=527> [15 de noviembre del 2010] [ Links ]
Diehl, H., Goetz, C. A., Hach. C. C.1950. The Versenate titration for total hardness. American Water Works Association Journal 42: 40-48. [ Links ]
Federación Nacional de Biocombustibles (FedeBiocombustibles), 2010. Inician siembras de Jatropha. En: Notas de Interés <http://www.fedebiocombustibles.com/v2/interes-web-id-6.htm> [13 de abril del 2010] [ Links ].
Félix, M. J. G. 2008. Potencial de Producción de la Jatropha curcas en Sinaloa como una Alternativa más para la Generación de Biodiesel. Centro de Validación y Transferencia de Tecnología de Sinaloa A.C. (CVTTS) y Fundación Produce Sinaloa A. C. [ Links ]
García, E. R. 2010. Agroecología y enfermedades de la raíz en cultivos agrícolas. Editorial Colegio de Postgraduados, Serie Biblioteca Básica de Agricultura. 131 pp. [ Links ]
Gomez, G. 2010. Da inicio SEDARPA a plantaciones con JATROPHA CURCAS. Orizaba en Red. Nota No. 79147: Publicada 29/03/2010. <http://www.orizabaenred.com.mx/cgi-bin/web?b=VERNOTICIA&%7Bnum%7D=79147> [13 de abril del 2010] [ Links ].
Harinder, P. S.; Makkar, J.; Martínez-Herrera; Becker K. 2008. Variations in seed number per fruit, seed physical parameters and contents of oil, protein and phorbol ester in toxic an non-toxic genotypes of Jatropha curcas. Journal of Plant Sciences 3:260-265. [ Links ]
Heller, J. 1996. Physic nut. Jatropha curcas L. Promoting the conservation and use of underutilized and neglected crops. Institute of Plant Genetics and Crop Plant Research, Gatersleben/ International Plant Genetic Resources Institute, Rome. [ Links ]
Henning, R. K. 2007. Identification, selection and multiplication of high yielding Jatropha curcas L. plants and economic key points for a viable Jatropha oil production. The Jatropha Journal. <http://www.jatropha.de/> [22 de octubre del 2008] [ Links ].
INEGI, 2010. Veracruz Ignacio de la Llave: Carta de Climas 1:1 000 000. En: Página de inicio / Información por entidad / Veracruz de Ignacio De la Llave / Territorio . <http://cuentame.inegi.gob.mx/monografias/informacion/ver/territorio/clima.aspx?tema=me&e=30> [9 de marzo del 2010] [ Links ].
Kahl, J. J., Henning, R. K. y Nyathi, B. 2008. Generative propagation of Jatropha curcas L. on Kalahari sand. The Jatropha System. <http://www.jatropha.de/zimbabwe/ea/The%20generative%20propagation%20of%20JCL.htm> [26 de diciembre del 2009] [ Links ].
Lumsden, R. D., Ayers W. A., Adams, P. B., Dow, R. L., Lewis, J. A., Papavizas, G. C., Kantzes, J. G. 1976. Ecology and Epidemiology of Pythium Species in Field Soil. Phytopathology. The American Phytopathological Society, USA. 66:1203-1209. [ Links ]
Martin, F.M. 1992. Pythium, in Methods for Research on Soilborne Phytopathogenic Fungi. L.L Singleton, J.D. Mihail and C.M. Rush. APS Press. St. Paul, MN. pp. 39-49. [ Links ]
Martínez H. J, Siddhuraju P, Francis G, Davila Ortiz G, Becker K. 2006. Chemical composition, toxic/antimetabolic constituents, and effects of different treatments on their levels, in four provenances of Jatropha curcas L. from Mexico. Food Chemistry 96:80-89. [ Links ]
Martínez, H. J., Evangelista L. S., Martínez A.A. 2007. Perfil Nutricional de semillas de Jatropha curcas L. provenientes de Michoacán. Alimentos Ciencia e Ingeniería 16: 313-314. [ Links ]
Michereff, S. J., L. A. M. Peruch, e D. E. G. T. Andrade. 2005. Manejo integrado de doencas radiculares. In: Ecología e Manejo de Patógenos Radiculares em Solos Tropicais. Michereff, S. J., D. E. G. T. Andrade, e M. Menezes (eds). Universidade Federal Rural de Pernambuco. Brasil. pp: 367–388. [ Links ]
Ogundana S.K., 1971. Survey of basal rot of cowpeas in Nigeria. Annual Report, Federal Department Agricultural Research, Ibadan, Nigeria. [ Links ]
Ouwens K. D., Francis, G., Franken, Y. J., Rijssenbeek, W., Riedacker, A., Foidl, N., Jongschaap, R., Bindraban, P. 2007. Position Paper on Jatropha curcas. State of the Art, Small and Large Scale Project Development. Fuels from Agriculture in Communal Technology (FACT). <www.fact-fuels.org/media_en/Position_Paper_on_Jatropha_Curcas> [17 de septiembre del 2008] [ Links ]
Padilla, D y Monterroso, D. (2007). Diagnostico Preliminar de Enfermedades del Cultivo de Tempate (Jatropha curcas) en Nicaragua. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). <http://web.catie.ac.cr/informacion/rmip/rmip51/padilla-2.html> [18 de Noviembre del 2009] [ Links ]
Parker, K. C. 2009. Pythium aphanidermatum. En: Soilborne plant pathogens. N.C. State University. <http://www.cals.ncsu.edu/course/pp728/Pythium/Pythium_aphanidermatum.html> [20 de diciembre del 2009] [ Links ].
Paulus, A. O.; Correl J. C. 2001. Enfermedades causadas por Pythium spp. En: Plagas y enfermedades del tomate. The American Phytopathological Society. Mundi-Prensa. Madrid España. [ Links ]
Rodríguez, G. M. P. 2001. Biodiversidad de los hongos fitopatógenos del suelo de México. Acta Zoológica Mexicana (nueva serie). Instituto de Ecología A.C. Número ES1. Xalapa, México. [ Links ]
Romero, C. S. 1988. Hongos Fitopatogenos. Universidad Autónoma de Chapingo. Edo. de México. [ Links ]
Saetae D. y Suntornsuk W. 2010. Antifungal activities of ethanolic extract from Jatropha curcas seed cake. Journal of Microbiotechnology. 20: 319-324. [ Links ]
Schmook, B. y Sanchez-Sanchez O. 2000. Usos y potencial de Jatropha curcas L. en la península de Yucatán, México. Revista Foresta Veracruzana. 2: 7-11. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). Norma Oficial Mexicana NOM-021-SEMARNAT-2000. Diario Oficial (Segunda Sección), Dic. 21, 2002. México D.F. México. Pp. 11-36. [ Links ]
Tsao, P.H. and G. Ocana. 1969. Selective Isolation of Species of Phytophthora from Natural Soils on an Improved Antibiotic Medium. Nature 223: 636-638. [ Links ]
Van Der Plaats-Niterink, A. J. 1981. Monograph of the genus Pythium. Studies in Mycology. Centraalboreau voor Schimmelacultures, Baarn 242:1-24. [ Links ]
Walkley, A & I Black. 1934. Anexamination of the Degtjareff method and a proposed modification of thechromic matter and a proposed modification of thechromic acid titration method. Soil Science. 37: 29-38. [ Links ]
Watanabe, T. 2002. Pictorial Atlas of Soil and Seed Fungi – Morphologies of cultured fungi and key to species. Second Edition. CRC Press. USA. [ Links ]
Zamarripa, C. y Díaz, P. 2008. Áreas de potencial productivo de piñón Jatropha curcas L., como especie de interés bioenergético en México. Proyecto de Biocombustibles del INIFAP. INIFAP. <http://www.oleaginosas.org/art_211.shtml> [20 de diciembre del 2009] [ Links ].














