Introducción
El ibuprofeno es un fármaco analgésico anti-inflamatorio no esteroideo (AINE) utilizado para tratar dolor agudo y cuadros inflamatorios como los observados en diversos tipos de artritis. Debido a su uso común y amplio índice terapéutico, los medicamentos que contienen ibuprofeno se adquieren fácilmente sin receta médica. El efecto terapéutico del ibuprofeno radica principalmente en la inhibición no selectiva de las ciclooxigenasas COX-1 y COX-2, enzimas que participan en el proceso de inflamación. El ibuprofeno, al igual que la mayoría de los AINEs, presenta una reacción adversa irritante sobre el tracto gastrointestinal posiblemente por su baja solubilidad y prolongado contacto con la mucosa gástrica, relacionado con la dosis administrada y el uso prolongado.1 De acuerdo al Sistema de Clasificación Biofarmacéutico (SCB) el ibuprofeno es un fármaco de Clase 2.2 Los fármacos que pertenecen a esta clase son aquéllos que presentan baja solubilidad y alta permeabilidad.3 La absorción de esta clase de compuestos está limitada por la velocidad de disolución y tanto los excipientes como el proceso de manufactura juegan un papel importante en este proceso ya que deben permitir la liberación completa y oportuna del fármaco a partir de la forma farmacéutica que lo contiene. Para fármacos de Clase 2 es más factible establecer una correlación in vitro-in vivo (CIVIV) significativa.
Las Guías para la Industria de la FDA basadas en el enfoque del SCB indican los criterios con los cuales los estudios de bioequivalencia se pueden reemplazar por estudios de disolución in vitro. La bioexención se basa principalmente en el cumplimiento del criterio de similitud (f2) de los perfiles de disolución de los medicamentos de prueba y de referencia en medios de disolución con valores de pH de relevancia fisiológica así como otros criterios referentes al uso de ciertos excipientes utilizados en la formulación y para los cuales se ha documentado previamente que modifican la absorción del fármaco en cuestión.4 Por otra parte, se publicó una monografía que sugiere la exención de los estudios de bioequivalencia de los medicamentos orales de liberación inmediata que contienen ibuprofeno.5 El uso terapéutico de este fármaco, su amplio índice terapéutico y sus propiedades farmacocinéticas sin complicaciones justifican científicamente esta propuesta. La bioexención se lleva a cabo si se cumple con tres requisitos: que el medicamento de prueba se disuelva rápidamente en solución amortiguadora de pH 6.8 (85% en 30 min o menos) además, que demuestre un perfil de disolución similar al perfil del medicamento de referencia en soluciones amortiguadoras de pH 1.2, 4.5 y 6.8 y por último, que contenga solo aquellos excipientes reportados en la monografía de bioexención en las cantidades recomendadas y utilizadas comúnmente.
La prueba de disolución para formas sólidas orales de ibuprofeno, incluida en la monografía de la USP 37/NF 32,6 indica el uso del Aparato 2 USP (paletas) a 50 rpm y 900 mL de solución amortiguadora de fosfatos pH 7.2 a 37±0.5°C como medio de disolución. Bajo estas condiciones, se debe disolver no menos del 80% de fármaco en 60 min. Estudios previos muestran que algunos métodos de disolución farmacopeicos presenta baja capacidad discriminativa para detectar diferencias en la velocidad y grado de disolución de fármacos poco solubles a partir de formas farmacéuticas de liberación inmediata y que estas diferencias tienen alta probabilidad de reflejarse en una falta de bioequivalencia y por lo tanto, en una modificación del efecto terapéutico esperado.7-9
Con el fin de evaluar la capacidad de los estudios de disolución in vitro (realizados de acuerdo al enfoque del SCB) para predecir el desempeño in vivo de los medicamentos que contienen ibuprofeno, Álvarez et al.10 utilizaron el Aparato 2 USP a 50 ó 75 rpm y soluciones amortiguadoras de pH 1.2, 4.5 y 6.8 como medios de disolución. Medicamentos con perfiles de disolución similares (f2> 50) mostraron al menos en dos de tres formulaciones estudiadas bioinequivalencia al encontrar diferencia significativa en los valores de Cmax. Debido a que la velocidad de absorción de ibuprofeno (representada por el Cmax) es de relevancia clínica, los autores no recomiendan la exención de los estudios de bioequivalencia en humanos. Los estudios de disolución bajo las condiciones indicadas previamente no permiten predecir la velocidad de absorción de los medicamentos que contienen ibuprofeno. Lo anterior conduce a la búsqueda de mejores condiciones de disolución in vitro que permitan predecir con mayor precisión el comportamiento in vivo de este fármaco.
Una alternativa para evaluar la disolución de fármacos es el sistema de celda de flujo continuo (Aparato 4 USP). Sus ventajas sobre los métodos USP de canastillas y paletas están ampliamente demostradas, especialmente para fármacos poco solubles y formas farmacéuticas de liberación modificada. El Aparato 4 USP simula mejor las condiciones hidrodinámicas que se presentan en el tracto gastrointestinal por lo que es importante investigar la aplicabilidad del sistema de celda de flujo continuo en la evaluación de la disolución del ibuprofeno con el propósito de desarrollar métodos que permitan asegurar la evaluación apropiada de los medicamentos. A pesar de las ventajas del equipo de celda de flujo continuo la información sobre la velocidad y grado de disolución de ibuprofeno a partir de formas sólidas orales en este aparato es escasa.11-13
Algunos autores14 consideran que los medicamentos genéricos que no alcanzan el 85 % disuelto a los 60 min no cumplen con los lineamientos de las Guías para la Industria de la FDA y EMA. Información adicional acerca de la velocidad y el grado de liberación de diferentes dosis de un mismo medicamento de referencia también es escasa. Debido a que los medicamentos de referencia son una guía oficial para comparar la calidad biofarmacéutica de los medicamentos genéricos de venta en el mercado nacional es importante documentar el efecto que presenta la dosis y el aparato de disolución en la velocidad y grado de liberación de los fármacos.
Con los antecedentes previamente descritos, y a fin de documentar la influencia de la dosis y el aparato de disolución en el proceso de liberación in vitro de ibuprofeno, el objetivo del presente trabajo fue evaluar la disolución de ibuprofeno a partir del medicamento de referencia a dos dosis (400 y 600 mg, grageas), en medios de relevancia fisiológica: HCl 0.1 N (pH 1.2) y soluciones amortiguadoras de pH 4.5, 6.8 y 7.2 así como en los Aparatos 2 USP (50 rpm) y 4 USP (flujo laminar a 18 mL/min). Los resultados se analizaron de acuerdo a la información integrada en la monografía de bioexención de grageas de ibuprofeno.5
Material y métodos
Productos, sustancias y pruebas farmacopeicas
En el estudio se utilizaron grageas de ibuprofeno de 400 y 600 mg del producto comercial Motrin® indicado por la COFEPRIS como medicamento de referencia.15 Se utilizó ibuprofeno estándar de Sigma-Aldrich (St. Louis MO, EUA). Los ácidos clorhídrico y acético así como el acetato de sodio y las sales de fosfato se adquirieron de Merck-México. Las pruebas de uniformidad de dosis y valoración de principio activo se aplicaron a los medicamentos de acuerdo a las condiciones especificadas en la USP 37/NF 32.6
Validación del método de disolución a pH 1.2 y 4.5
Debido al carácter ácido de la molécula, el ibuprofeno presenta problemas de solubilidad a pH ácido (0.058 mg/mL a pH 1.51 y 0.166 mg/mL a pH 4.7716) razón por la cual la validación de los métodos de disolución a estos valores de pH no se llevó a cabo.
Validación del método de disolución a pH 6.8 y 7.2
Previo a los estudios de disolución, se llevó a cabo la validación del método analítico para cuantificar ibuprofeno en medios de disolución con pH 6.8 y 7.2. El método analítico se validó con el fármaco y con el medicamento a cada pH siguiendo los lineamientos de la norma oficial mexicana NOM-177-SSA1-2013.17
Parámetros de validación con el fármaco: Para evaluar la linealidad se preparó una curva de ibuprofeno estándar por duplicado (con cinco concentraciones en el intervalo de 1.875 a 30 μg/mL) y se determinó la absorbancia a 222 nm en celdas de cuarzo de 1 cm. Los resultados se ajustaron por mínimos cuadrados a una función lineal y se calculó el coeficiente de correlación (R) y el error relativo a la regresión. La precisión se demostró con el cálculo del coeficiente de variación (CV %) del factor respuesta de los datos de linealidad. Para evaluar la influencia del filtro se preparó una solución de ibuprofeno (30 μg/mL). Los filtros evaluados fueron: de nitrocelulosa (Millipore®) y de nylon (Sun Sri®) ambos de 0.45 μm. Se determinó la absorbancia promedio de la solución con por lo menos seis muestras filtradas y sin filtrar y se calculó la diferencia absoluta. La diferencia debe ser igual o menor al 2 %.
Parámetros de validación con el medicamento: La linealidad se determinó disolviendo cantidades de molido de grageas de ibuprofeno con el equivalente al 40, 60, 80, 100 y 120 % de la dosis en 900 mL de medio de disolución. Este procedimiento se realizó por triplicado con los medicamentos en estudio. Los resultados se ajustaron por mínimos cuadrados y se calculó el coeficiente de regresión y el error relativo a la regresión. La exactitud se evaluó calculando el promedio del porcentaje de la recuperación de los datos de linealidad, el cual no debe variar en más del 3 % con respecto a la cantidad nominal en cada punto. La precisión se determinó con el cálculo del CV % del porcentaje cuantificado de los datos de exactitud (repetibilidad) y con el análisis por triplicado de una muestra homogénea del molido de las grageas con el equivalente al 100 % de la dosis por dos analistas (reproducibilidad). Con estos resultados se calculó el CV % global del porcentaje de fármaco cuantificado. En ambos casos el valor debe ser menor o igual al 3 %.
Perfiles de disolución con el Aparato 2 USP
Los perfiles de disolución de ibuprofeno a partir de los medicamentos en estudio se determinaron de acuerdo a los lineamientos de la USP 37/NF 326 en un Aparato de disolución 2 USP (Hanson Research, modelo 72RL) con 12 grageas de cada medicamento. En cada uno de los vasos se transfirieron 900 mL de HCl 0.1 N y soluciones reguladoras a pH 4.5, 6.8 y 7.2±0.05. Los medios se desgasificaron previamente con vacío, y se trabajó a una temperatura de 37±0.5 °C. Las paletas se sumergieron en los medio de disolución y se accionaron a 50 rpm. Inmediatamente después se colocaron las grageas en los vasos. Se tomaron muestras filtradas de 3 mL a los 5, 10, 15, 20, 30 y 60 min reponiendo el volumen en cada ocasión. De las muestras se tomaron alícuotas de 1 mL, se colocaron en matraces de 25 mL y se aforaron con el medio de disolución correspondiente. La cantidad disuelta de ibuprofeno a cada tiempo se determinó en un espectrofotómetro UV/VIS (Perkin Elmer, modelo Lambda 2S) a 222 nm con referencia a una curva de calibración de ibuprofeno estándar preparada el mismo día del análisis.
Perfiles de disolución con el Aparato 4 USP
La disolución de ibuprofeno en el equipo de celda de flujo continuo se evaluó con un Aparato 4 USP automatizado (Sotax, modelo CE6) con 12 grageas de cada medicamento. Las grageas se colocaron en celdas de 22.6 mm (d.i.) y se utilizó flujo laminar (formado con una cama de 6 g de perlas de vidrio) a la velocidad de 18 mL/min. Se utilizó además un sistema abierto sin recircular el medio de disolución. Como medios de disolución se utilizaron HCl 0.1 N y soluciones amortiguadoras de pH 4.5, 6.8 y 7.2±0.05 a 37±0.5 °C. El equipo se programó para tomar alícuotas filtradas a través de membranas de nitrocelulosa cada cinco min durante 60 min. La cantidad disuelta de ibuprofeno se determinó en un espectrofotómetro UV/VIS (Perkin Elmer, modelo Lambda 10) a 222 nm comparando las absorbancias obtenidas con una curva de calibración.
Análisis de datos
Con los datos de disolución a pH 6.8 de los medicamentos en estudio se calcularon los parámetros modelo-independiente: tiempo medio de disolución (TMD)18 y eficiencia de la disolución (ED).19 Adicionalmente, para el análisis del proceso de liberación de ibuprofeno bajo los ambientes hidrodinámicos que generan los Aparatos 2 y 4 USP, los datos de disolución a pH 6.8 se ajustaron a los siguientes modelos cinéticos: primer-orden,20 Higuchi,21 Hixon-Crowell,22 Weibull23 y Logístico.24 El modelo cinético de mejor ajuste se seleccionó considerando el valor más alto de coeficiente de determinación (R2 ajustado) y el valor más bajo del criterio de información de Akaike (AIC).25 El ajuste de los datos se realizó con el programa DDSolver.26
Resultados y discusión
Pruebas farmacopeicas
Ambos medicamentos utilizados cumplieron las pruebas de uniformidad de dosis y valoración especificadas en la USP 37/ NF 3.26 Los resultados se presentan en la Tabla 1.
Validación a pH 6.8 y 7.2
Los resultados de la validación con el fármaco mostraron que el sistema analítico para cuantificar ibuprofeno es lineal en el intervalo de concentraciones indicado. La ecuación de regresión calculada con los datos promedio fue: y = 0.0484x + 0.0759 con un valor de R> 0.99 y un error relativo debido a la regresión de 1.8 % para la curva en solución amortiguadora de pH 6.8 y de y = 0.0417x + 0.0508 con un valor de R> 0.99 y un error relativo debido a la regresión de 2 % para la curva en solución amortiguadora de pH 7.2. La precisión presentó un CV % del factor respuesta menor de 2 %. La evaluación de la influencia del filtro permitió determinar que no existe adherencia del fármaco a cualquiera de los dos tipos de filtros utilizados ya que la diferencia absoluta en todos los casos fue menor al 2 %.
La ecuación de regresión para evaluar la linealidad con el medicamento a pH 6.8 fue y = 1.0025x + 0.502 con un valor de R> 0.99 y un error relativo debido a la regresión de 0.4 %. El promedio del porcentaje de la recuperación de los datos de linealidad se mantuvo ±3 % de la cantidad nominal en cada punto. El CV % del porcentaje cuantificado fue 1.25 % (repetibilidad) y el CV % global fue 0.77 % (reproducibilidad).
La ecuación de regresión para evaluar la linealidad con el medicamento a pH 7.2 fue y = 1.0042x - 1.579 con un valor de R> 0.99 y un error relativo debido a la regresión de 1.4 %. El promedio del porcentaje de la recuperación de los datos de linealidad se mantuvo ±3 % de la cantidad nominal en cada punto. El CV % del porcentaje cuantificado fue 1.41 % (repetibilidad) y el CV % global fue 1.91 % (reproducibilidad).
Liberación in vitro de ibuprofeno
En la Figura 1 se presentan los perfiles de disolución de ibuprofeno en medios de disolución HCl 0.1 N y soluciones reguladoras de pH 4.5, 6.8 y 7.2 obtenidos con los Aparatos 2 y 4 USP. En la figura se observa que con el uso de medios de disolución ácidos: HCl 0.1 N y pH 4.5 en ambos equipos, la velocidad y grado de liberación del ibuprofeno es limitada. Esto concuerda con lo reportado por otros autores donde, debido a la naturaleza del fármaco y al medio ácido que rodea la forma farmacéutica, la disolución del principio activo no es completa. Con estos resultados es importante cuestionar el sentido de sugerir la exención de los estudios de bioequivalencia de los medicamentos que contienen ibuprofeno, donde se incluye la comparación de los perfiles de disolución del medicamento de prueba vs. el medicamento de referencia a pH 1.2 y 4.5, si de antemano se conoce la baja solubilidad del fármaco a estos valores de acidez de relevancia fisiológica. Por lo tanto, la disolución de ibuprofeno en HCl 0.1 N y a pH 4.5 carece de significado para estimar los procesos de disolución y absorción.
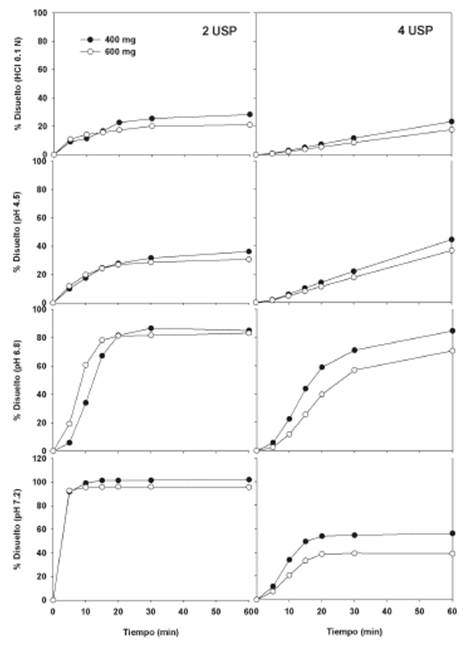
Figura 1 Perfiles de disolución de ibuprofeno en grageas del medicamento de referencia con los Aparatos 2 y 4 USP en medios de disolución HCl 0.1 N y pH 4.5, 6.8 y 7.2. Para mayor claridad se omiten las barras de error. Media, n=12.
Por otro lado, a menores valores de acidez se alcanza un mayor grado de disolución sin embargo, con el uso del equipo de celda de flujo continuo la velocidad de disolución es reducida respecto a la presentada con el uso del Aparato 2 USP. Esta reducción observada con el uso del Aparato 4 USP se puede explicar por las condiciones hidrodinámicas que se generan en el interior de la celda del equipo. Diversos autores coindicen en que estas condiciones, incorporadas con el uso de medios de disolución biorrelevantes, son más representativas del interior del tracto gastrointestinal y por lo tanto, los resultados obtenidos son más factibles de relacionar con datos plasmáticos y establecer una CIVIV significativa.12,27,28
En el Aparato 4 USP y con solución amortiguadora pH 6.8, los medicamentos de 400 y 600 mg no alcanzaron a liberar el 85 % disuelto de ibuprofeno a los 30 min. Además, el medicamento de 600 mg tampoco alcanzó este grado de disolución cuando se utilizó el Aparato 2 USP, lo que confirma el efecto de la dosis en el proceso de disolución del ibuprofeno bajo las mismas condiciones experimentales. Por otro lado, al utilizar las condiciones farmacopeicas con ambas dosis (Aparato 2 USP a 50 rpm y solución amortiguadora pH 7.2) la cantidad de fármaco disuelto superó el 80 % en 60 min. De acuerdo a lo reportado por Álvarez et al.10 a pH neutro o cercano (7.2) es imposible detectar productos que presentarán diferente velocidad de absorción a pesar de que estas condiciones son utilizadas convencionalmente para propósitos de control de calidad. Con base en estas condiciones cuando nuevos lotes de ibuprofeno son liberados, en el caso de un medicamento genérico no se asegura su bioequivalencia con el medicamento de referencia o en el caso del medicamento de referencia, con el lote que previamente demostró ser bioequivalente.
Monografía de bioexención
En la monografía de bioexención de medicamentos de liberación inmediata de ibuprofeno5 se recopila información que justifica la exención de los estudios de bioequivalencia para estos medicamentos cuando se cumplen tres requisitos: 1) la forma de dosificación se disuelve rápidamente en solución amortiguadora de pH 6.8 (85 % en 30 min o menos) 2) el medicamento de prueba muestra un perfil de disolución similar al perfil de disolución del medicamento de referencia en medios de disolución de pH 1.2, 4.5 y 6.8 y 3) si el medicamento de prueba contiene solo ciertos excipientes en cantidades que no exceden aquellas normalmente utilizadas para la preparación de medicamentos orales de liberación inmediata.
De acuerdo al primer requisito que contempla el grado de disolución a pH 6.8 en 30 min es importante analizar lo siguiente: en la Figura 2 se presentan los perfiles de disolución de ibuprofeno en los Aparatos 2 y 4 USP a pH 6.8. Al utilizar el Aparato 2 USP únicamente el medicamento de 400 mg cumple con el criterio de bioexención establecido (85 % en 30 min o menos). Con el mismo aparato, el medicamento de 600 mg no alcanza este porcentaje en el tiempo indicado y con el uso del Aparato 4 USP, ninguno de los dos medicamentos cumple con dicho criterio. Asimismo, se observa además una evidente reducción en la velocidad de disolución para ambos medicamentos en el Aparato 4 USP. La reducción en la velocidad de disolución del fármaco en el sistema de celda de flujo continuo se explica por las condiciones hidrodinámicas que caracterizan al Aparato 4 USP donde no existen mecanismos de agitación y el volumen del medio es mínimo aun cuando la forma de dosificación está expuesta continuamente a un flujo laminar uniforme lo que causa un patrón de disolución diferente al que genera el sistema convencional de vasos (canastillas o paletas).29

Figura 2 Perfiles de disolución de ibuprofeno en grageas del medicamento de referencia con los Aparatos 2 y 4 USP en solución amortiguadora de fosfatos pH 6.8. Dosis de 400 mg (A) y 600 mg (B). Media±DE, n=12.
Los resultados sugieren dos consideraciones importantes: la primera al cambiar las condiciones de disolución (equipos) las dos dosis utilizadas no cumplen los criterios mínimos de bioexención basados en el SCB, por lo que las repercusiones que llegaran a presentar los medicamentos de referencia al no cumplir con los requisitos suficientes para justificar la exención de los estudios de bioequivalencia de los medicamentos genéricos no deben ser subestimadas. La segunda radica en la necesidad de explorar otras alternativas o condiciones de disolución que manifiesten mejor el desempeño in vivo de este grupo de medicamentos ya que la velocidad y el grado de disolución que muestran los medicamentos de referencia en el Aparato 4 USP es muy bajo. Con algunos medicamentos que contienen fármacos de Clase 2, el sistema de celda de flujo continuo ha probado ser más discriminativo que los sistemas de vasos (Aparatos 1 ó 2 USP).7-9
Comparaciones modelo-independiente
Con el objetivo de analizar la información de la liberación in vitro de ibuprofeno a pH 6.8 se calcularon los parámetros modelo-independiente: TMD y ED. El TMD representa el tiempo al cual se disuelve el 63.2 % de la dosis y la ED está definida como el área bajo la curva de la disolución a cierto tiempo, expresada como el porcentaje del área del rectángulo describiendo el 100 % de la disolución al mismo tiempo. Ambos parámetros son utilizados en CIVIV nivel B y C, respectivamente.
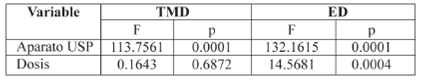
Los valores de la media±EE de los parámetros TMD y ED se presentan en la Tabla 2. Adicionalmente, con estos valores se realizó un ANDEVA de dos vías y se encontró diferencia significativa en los valores de ED, Tabla 3; lo que revela influencia de la dosis y el aparato de disolución en el grado de liberación in vitro del ibuprofeno a partir de los medicamentos de referencia utilizados.
Tabla 2 Tiempo medio de disolución (TMD) y eficiencia de disolución (ED) de los medicamentos de referencia de ibuprofeno a pH 6.8. Media±EE, n=12.

Tabla 3 ANDEVA para los valores de tiempo medio de disolución (TMD) y eficiencia de disolución (ED), comparando las dosis y los Aparatos USP, con datos de disolución a pH 6.8 (p< 0.05).
Comparaciones modelo-dependiente
El ajuste de los datos de disolución a los diferentes modelos cinéticos utilizados indicaron que el modelo que mejor representa la cinética de liberación in vitro de ibuprofeno a partir de los medicamentos de referencia es la ecuación de Weibull. Los valores de R2 ajustado así como los de AIC se presentan en la Tabla 4.
Tabla 4 Valores de coeficiente de determinación ajustado (R2 ajustado) y del criterio de información de Akaike (AIC) calculados con el ajuste de los datos de disolución (pH 6.8) a los diferentes modelos cinéticos.

Como los dos medicamentos, en ambos equipos, se ajustaron al mismo modelo cinético se calcularon los valores de los parámetros α, β, Ti, Fmax y Td derivados del ajuste de los datos al modelo de Weibull. El valor de Td es equivalente al valor de TMD calculado con la teoría de momentos estadísticos.23 Si por dosis se comparan los resultados generados en el Aparato 4 USP, respecto a los obtenidos con el Aparato 2 USP, se presenta diferencia significativa en los valores de Td (p< 0.05). Los valores de todos los parámetros se presentan en la Tabla 5.
Tabla 5 Parámetros de Weibull y valores de Td derivados del ajuste de los datos de disolución a este modelo cinético. Media, n=12.

En cuanto al segundo requisito que contempla la comparación de los perfiles de disolución en medios de disolución con pH de relevancia fisiológica se encontró lo siguiente: la Figura 3 presenta el porcentaje disuelto de ibuprofeno en función del pH y del tiempo, con el uso de los Aparatos 2 y 4 USP. Debido al evidente cambio en el grado de disolución de la misma dosis del fármaco en los dos Aparatos USP, se observa un efecto del aparato de disolución empleado. Esto como se explicó anteriormente, tiene un fundamento en las condiciones hidrodinámicas generadas por cada equipo de disolución sin embargo, lo observado en el Aparato 4 USP permite hacer un estimado de lo que sucedería en realidad al considerar al sistema de celda de flujo continuo como un símil del tracto gastrointestinal; es decir, se presentaría una baja disolución aún en el medio donde el fármaco es altamente soluble (27.5 mg/mL a pH 7.0216) o donde teóricamente el fármaco se absorbería en un mayor grado (pH 6.8).
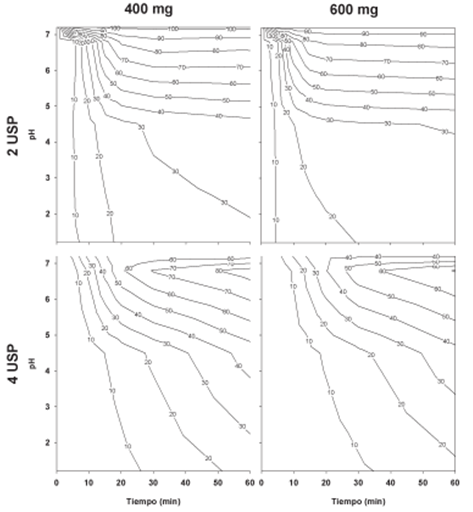
Figura 3 Porcentajes disueltos de ibuprofeno, a partir del medicamento de referencia con los Aparatos 2 y 4 USP, en función del tiempo y del grado de acidez. Media, n=12.
Por otro lado, al hacer una comparación entre dosis se puede inferir un efecto de la formulación al obtener diferentes porcentajes de disolución en el mismo equipo. Además como se indicó previamente, en ambos Aparatos USP y por la naturaleza ácida del fármaco, la disolución del ibuprofeno en medio ácido fue limitada. Esta condición está documentada y se contempla en la monografía que sugiere la exención de los estudios de bioequivalencia.
Contrario a lo sugerido en la monografía de bioexención de ibuprofeno5 los resultados reportados por Álvarez et al.10 indican que para productos de liberación inmediata de ibuprofeno las pruebas in vitro recomendadas a pH 1.2, 4.5 y 6.8 a 50 ó 75 rpm no son capaces de detectar diferencias en la velocidad de absorción y como este parámetro no puede pasar inadvertido la bioexención, basada en el enfoque del SCB, no debe ser recomendada para medicamentos que contienen ibuprofeno. Al parecer la aseveración resulta contradictoria a la información presentada en la monografía de ibuprofeno, sin embargo, por los resultados encontrados en el presente trabajo es importante hacer notar que el comportamiento de disolución del fármaco a partir del medicamento de referencia de 400 y 600 mg cambia de acuerdo a la dosis y al aparato de disolución empleado sugiriendo que los medicamentos genéricos de las mismas dosis presentarían variaciones similares o mayores. Por lo tanto, es necesario encontrar condiciones de disolución in vitro que resulten discriminativas o que permitan predecir el desempeño in vivo del ibuprofeno. El sistema de celda de flujo continuo es un equipo que refleja mejor el ambiente fisiológico del organismo y por las condiciones hidrodinámicas que genera resulta una opción adecuada para la búsqueda de CIVIV significativa.
Por otra parte, estudios de disolución in vitro para ibuprofeno y ketoprofeno desarrollados con medios de disolución biorrelevantes y simulaciones del desempeño in vivo apoyados con programas computacionales han sido reportados por Tsume et al.30 Las pruebas se llevaron a cabo con medicamentos de ibuprofeno de 400 mg y fluido intestinal simulado pH 6.0 ó 6.8 de diferente capacidad amortiguadora. En el estudio, los medicamentos no mostraron bioequivalencia en ninguna simulación a pH intestinal bajo, aún cuando las simulaciones se llevaron a cabo con la misma formulación. A pH alto y con el medio de baja capacidad amortiguadora la liberación completa del ibuprofeno se presentó hasta los 60 min. Los resultados corroboran la posibilidad de que una baja velocidad de disolución in vivo sea la causa de bioinequivalencia de ibuprofeno a pesar de que in vitro los medicamentos muestren un perfil de disolución similar. Perfiles de disolución similares y falta de bioequivalencia de tabletas de primidona (antiepiléptico de baja solubilidad31) de diferentes dosis (50 y 250 mg) ha sido reportada por otros autores.32 Por las ventajas del Aparato 4 USP mencionadas anteriormente sería importante documentar su aplicabilidad con metodologías in silico para estimar el desempeño de los medicamentos de Clase 2 ya que los estudios reportados por Tsume et al.30 se llevaron a cabo en el Aparato 2 USP.
Respecto al tercer y último requisito necesario para solicitar la exención de los estudios de bioequivalencia de medicamentos que contienen ibuprofeno, en el presente estudio se evaluaron productos comerciales de venta en farmacias públicas lo que no permite conocer la relación cuali-cuantitativa del tipo de excipientes utilizados. Se sabe que excipientes como surfactantes, sorbitol y manitol afectan la biodisponibilidad.10
La adecuada caracterización de la velocidad y grado de liberación in vitro de los fármacos a partir de los medicamentos de referencia tiene una repercusión en la evaluación de los medicamentos genéricos ya que son utilizados como entidad comparativa de calidad. La evaluación de la disolución de medicamentos genéricos ha llamado la atención de varios autores. Anand et al.33 resaltan la importancia de los estudios in vitro a lo largo de las diferentes etapas tanto del desarrollo del medicamento como de la post-producción y cambios en las formulaciones originales. Los autores resumen cómo las pruebas de disolución in vitro son utilizadas para probar la seguridad y eficacia de los medicamentos genéricos disponibles en Norteamérica. Al Almeri et al.14 evalúan la velocidad y grado de disolución de medicamentos genéricos respecto a los medicamentos de referencia indicando las ventajas de éstos productos a los diferentes grupos involucrados: pacientes, industria farmacéutica y entidades de salud como hospitales y organismos regulatorios. Los autores sugieren la necesidad de evaluar a los pacientes después de llevar a cabo la substitución del medicamento de referencia por uno genérico para asegurar la exitosa implementación de esta práctica. El ajuste y retroalimentación pertinente son necesarios. Hassalin et al.34 comparten la experiencia en la implementación de políticas que permiten el uso de medicamentos genéricos en diferentes lugares. En países de Norteamérica, Europa, Asia y Oceanía los pacientes y los sistemas de salud son los mayormente beneficiados sin embargo, hay retos para implementar una política única y completa de medicamentos a fin de conseguir los máximos beneficios. Como el reto en todos los países es garantizar la intercambiabilidad de los medicamentos con los beneficios económicos que el mercado de genéricos representa, es necesario el uso de programas bien diseñados a fin de que esta implementación sea efectiva. México no debe mantenerse al margen del desarrollo de programas y políticas que permitan una adecuada evaluación biofarmacéutica que asegure la calidad de los medicamentos que se expenden en el mercado nacional.
Conclusiones
Al evaluar la velocidad de liberación de ibuprofeno a pH 6.8 y 7.2 se encontraron efectos significativos debido al equipo utilizado y a la dosis del fármaco. A pH 7.2 el grado de liberación entre equipos mostró una notable diferencia. A pH 6.8 y únicamente con la dosis de 400 mg en el Aparato 2 USP, se alcanzó la especificación de 85% disuelto en 30 min. Con este pH se encontraron diferencias significativas en la eficiencia de disolución atribuibles a la dosis y al aparato de disolución empleado. Considerando las ventajas del equipo de celda de flujo continuo sobre los sistemas de vasos, es posible que este sistema refleje mejor los problemas de liberación del fármaco y constituye una alternativa para evaluar, en el caso de ibuprofeno, una propuesta de bioexención que de acuerdo a los resultados obtenidos en el presente trabajo no es posible sustentar.
Agradecimientos
Los autores agradecemos a los QFB Susana Arellano, Erik Espino, Zila Martínez y Ruth Valles su apoyo técnico.











 text new page (beta)
text new page (beta)



